用于单独或组合使用B7-H3抗体-药物缀合物的方法与流程
用于单独或组合使用b7-h3抗体-药物缀合物的方法
相关申请的交叉引用
1.本技术主张美国专利申请号63/023,495(在2020年5月12日提交;未决),和美国专利申请号63/180,795(在2021年4月28日提交;未决)的优先权,出于所有目的,其每一篇通过引用以其整体并入本文。序列表的引用
2.按照37c.f.r.1.821条款,本技术包括序列表,该序列表已经以ascii格式电子提交,并且出于所有目的,通过引用以其整体并入本文。序列表的ascii副本创建于2021年5月5日,命名为mac-0112-pc_sl.txt,并且大小为49,512字节。
技术领域
3.本发明部分涉及用于施用缀合倍癌霉素部分的人源化抗b7-h3抗体(“b7-h3-adc”)以治疗癌症,特别地与b7-h3表达相关的癌症的给药方案。本发明部分关注这种b7-h3-adc任选地与pd-1结合分子组合以治疗癌症的用途。本发明部分关注这种b7-h3-adc和抗pd-1抗体,或能够结合pd-1和lag-3的双特异性分子(“pd-1 x lag-3双特异性分子”)的用途。本发明部分涉及这种分子的使用,和含有这种分子且促进这种给药方案在治疗癌症中的用途的药物组合物和药物试剂盒的用途。发明背景i.b7超家族和b7-h3
4.b7-h3是b7-cd28超家族的成员并且在抗原呈递细胞上表达。b7-h3是独特的,因为主要的人形式含有两个细胞外串联igv-igc结构域(即,igv
–
igc
–
igv
–
igc)(collins,m.等(2005)“the b7 family of immune-regulatory ligands,”genome biol.6:223.1-223.7)。尽管最初认为仅包括2个ig结构域(igv
–
igc,参见,例如,ncbi sequence np_079516),但是已经鉴定出四个免疫球蛋白细胞外结构域变体(“4ig-b7-h3”)并且发现是更普通的人形式的蛋白质(sharpe,a.h.等(2002)“the b7-cd28 superfamily,”nature rev.immunol.2:116-126;还参见,例如,ncbi sequence np_001019907)。在心脏、肾、睾丸、肺、肝、胰腺、前列腺、结肠和成骨细胞的细胞中已经发现b7-h3mrna表达(collins,m.等(2005)“the b7 family of immune-regulatory ligands,”genome biol.6:223.1-223.7)。在蛋白质水平,在人肝、肺、膀胱、睾丸、前列腺、乳腺、胎盘和淋巴器官中发现b7-h3(hofmeyer,k.等(2008)“the contrasting role of b7-h3,”proc.natl.acad.sci.(u.s.a.)105(30):10277-10278)。
5.尽管b7-h3不在静息b或t细胞、单核细胞或树突细胞上表达,但其在树突细胞上被ifn-γ和在单核细胞上被gm-csf诱导(sharpe,a.h.等(2002)“the b7-cd28 superfamily,”nature rev.immunol.2:116-126)。b7-h3的作用方式是复杂的,并且蛋白质被报道介导t细胞共刺激和共抑制(hofmeyer,k.等(2008)“the contrasting role of b7-h3,”proc.natl.acad.sci.(u.s.a.)105(30):10277-10278;martin-orozco,n.等(2007)“inhibitory costimulation and anti-tumor immunity,”semin.cancer biol.17(4):
288-298.。b7-h3结合至未鉴定的受体以介导t细胞的共抑制。另外,通过与未知的受体相互作用,b7-h3是用于nk-细胞和成骨细胞的抑制剂(hofmeyer,k.等(2008)“the contrasting role of b7-h3,”proc.natl.acad.sci.(u.s.a.)105(30):10277-10278)。ii.b7-h3表达肿瘤
6.在各种癌细胞(例如,成神经细胞瘤、胃、卵巢、非小细胞肺癌等上表达b7-h3,参见,例如,modak,s.,等(2001)“monoclonal antibody 8h9 targets a novel cell surface antigen expressed by a wide spectrum of human solid tumors,”cancer res 61:4048-54)和在培养的癌症干细胞样细胞上表达。几个独立的研究已经显示人恶性肿瘤细胞展示出b7-h3蛋白质表达的显着增加并且该增加的表达与疾病严重程度的增加相关(tekle,c.,等(2012)“b7-h3 contributes to the metastatic capacity of melanoma cells by modulation of known metastasis-associated genes,”int.j.cancer 130:2282-90;wang,l.,等(2013)“b7-h3 mediated tumor immunology:friend or foe?,”int.j.cancer 134(12):2764-2771),表明b7-h3被肿瘤利用作为免疫逃避途径(hofmeyer,k.等(2008)“the contrasting role of b7-h3,”proc.natl.acad.sci.(u.s.a.)105(30):10277-10278)。
7.b7-h3在抑制免疫系统和b7-h3在人肿瘤上增加的表达中的作用已经表明,该分子可用作治疗癌症的治疗性靶标。已经提议使用抗b7-h3抗体和调节b7-h3表达的其他分子以治疗肿瘤和/或上调免疫应答(参见,loo,d.等(2012)“development of an fc-enhanced anti
–
b7-h3 monoclonal antibody with potent antitumor activity,”clin cancer res;18:3834-3845;ahmed,m.等(2015)“humanized affinity-matured monoclonal antibody 8h9 has potent anti-tumor activity and binds to fg loop of b7-h3,”j.biol.chem.290:30018-30029;nagase-zembutsu,a.等(2016)“development of ds-5573a:a novel afucosylated monoclonal antibody directed at b7-h3 with potent antitumor activity,”cancer sci.2016,doi:10.1111/cas.12915;还参见,美国专利号7,279,567、7,527,969、7,718,774、8,779,098、8,802,091,美国专利申请号2002/0168762、2008/0081346、2008/0116219、2013/0078234、2015/0274838,pct公开号wo 2009/073533、wo 2008/066691、wo 2006/016276、wo 2008/116219、wo 2001/094413、wo 2002/32375、wo 2004/093894、wo 2006/016276、wo 2008/116219和wo 2011/109400。iii.细胞-介导的免疫应答
8.免疫应答被通常称为“免疫检查点”的共刺激和共抑制配体和受体严格控制(chen等,(2013)“molecular mechanisms of tcell co-stimulation and co-inhibition,”nature rev.immunol.13:227-242;pardoll,d.m.,(2012)“the blockade of immune checkpoints in cancer immunotherapy,”nat.rev.cancer 12(4):252-264)。这些分子提供了调节免疫应答以提供防止感染和癌症的平衡的正负信号网络。一些癌细胞能够通过产生t细胞耗竭状态来逃避免疫系统,t细胞耗竭状态中t细胞暴露于持久性抗原和/或炎症信号(wherry e.j.(2010)“tcell exhaustion,”nat.immunol.12(6):492-499)。两个免疫检查点分子涉及t细胞耗竭、程序性死亡-1(“pd-1”)和淋巴细胞激活基因3(“lag-3”)(wherry,j.e.(2015)“molecular and cellular insights into t cell exhaustion,”nat.rev.immunol.15(8):486-499)。
9.程序性死亡-1(“pd-1”,也称为“cd279”)是t细胞调节剂的扩增cd28/ctla-4家族的近似31kd i型膜蛋白质成员,其广泛地负调节免疫应答(ishida,y.等(1992)“induced expression of pd-1,anovel member of the immunoglobulin gene superfamily,upon programmed cell death,”embo j.11:3887-3895。pd-1通过结合至跨膜蛋白质配体:程序性死亡-配体1(“pd-l1”,也称为“b7-h1”)和程序性死亡-配体2(“pd-l2”,也称为“b7-dc”)介导其免疫系统的抑制(flies,d.b.等(2007)“the new b7s:playing a pivotal role in tumor immunity,”j.immunother.30(3):251-260)。
10.pd-1配体相互作用在抑制t细胞激活和增殖中的作用已经表明,这些生物分子可用作治疗炎症和癌症的治疗性靶标。已经提议使用抗pd-1抗体以治疗肿瘤和上调适应性免疫应答,并且已经报道能够特异性结合至pd-1的抗体(参见,例如,patnaik a.等(2015)(2015)“phase i study of pembrolizumab(mk-3475;anti
–
pd-1 monoclonal antibody)in patients with advanced solid tumors,”clin cancer res;21(19):4286-4293;us专利号7,488,802、7,521,051、7,595,048、8,008,449、8,354,509、8,735,553、8,779,105、8,900,587、9,084,776、9,815,897和10,577,422;和pct专利公开号wo 2014/194302、和wo 2015/035606、wo 2004/056875、wo 2006/121168、wo 2008/156712、wo 2012/135408、wo 2012/145493、wo 2013/014668、wo 2014/179664、wo 2014/194302、wo 2015/112800和wo2019/246110)。
11.淋巴细胞激活基因3(“lag-3”,也称为“cd223”)是通过激活的cd4
+
和cd8
+
t细胞和nk细胞表达的细胞-表面受体蛋白,并且通过类浆细胞树突细胞构成性地表达;lag-3不通过b-细胞、单核细胞或任何其他测试的细胞类型表达(workman,c.j.等(2009)“lag-3regulates plasmacytoid dendritic cell homeostasis,”j.immunol.182(4):1885-1891)。
12.研究已经显示lag-3在负调节t细胞增殖、功能和体内平衡中和在t细胞耗竭中起到重要作用(参见,例如,workman,c.j.(2005)“negative regulation of t-cell homeostasis by lymphocyte activation gene-3(cd223),”j.immunol.174:688-695)并且已经表明,通过抗体阻断抑制lag-3功能可逆转lag-3-介导的免疫系统抑制和局部恢复效应子功能(grosso,j.f.等人.(2009)“functionally distinct lag-3and pd-1subsets on activated and chronically stimulated cd8 t-cells,”j.immunol.182(11):6659-6669)。已经报道抗体能够特异性结合至lag-3的抗体(参见,例如,pct公开号wo 2014/140180、wo 2015/138920、wo 2015/116539、wo 2016/028672、wo 2016/126858、wo 2016/200782和wo 2017/015560)。
13.结合至pd-1和lag-3二者的双特异性分子(“pd-1 x lag-3双特异性分子”)允许在各种应用中的设计和工程化中有很大的灵活性,提供增强的对多聚体抗原增强的亲合力、交联不同的抗原,并且依赖两种靶抗原存在的情况下直接靶向具体的细胞类型。用于治疗癌症的pd-1 x lag-3双特异性分子在pct公开号wo 2015/200119、wo 2017/025498、wo 2018/083087、wo 2018/185043、wo 2018/134279和wo 2018/217940中描述。特别地,具有新的pd-1和lag-3结合结构域和示例性活性的pd-1 x lag-3双特异性双抗体在wo 2017/019846中描述。
技术实现要素:
14.在某些方面中,本发明涉及施用b7-h3-adc以治疗癌症,特别地与b7-h3表达相关的癌症的给药方案。在某些方面中,本发明关注这种b7-h3-adc任选地与pd-1结合分子组合以治疗癌症的用途。某些b7-h3-adc和它们在治疗癌症中的用途,例如,在pct公开号wo 2017/180813中描述。在某些中,本发明关注这种b7-h3-adc和抗pd-1抗体,或pd-1 x lag-3双特异性结合分子的用途。施用b7-h3-adc以治疗癌症,或b7-h3-adc与pd-1结合分子组合以治疗癌症的给药方案可包括以规律给药间隔或间歇给药间隔施用。在给药方案中,其中b7-h3-adc与pd-1结合分子组合施用,它们可以同时或以任何顺序依次施用。在某些方面中,本发明涉及这种分子的用途,和含有这种分子且促进这种给药方案在治疗癌症中的用途的药物组合物和药物试剂盒的用途。
15.详细地,本发明提供了治疗癌症的方法,其包括向需要其的受试者施用b7-h3-adc,其中所述方法包括以约0.5mg/kg至约5mg/kg的剂量约每3周一次向受试者施用b7-h3-adc。
16.本发明进一步提供了治疗癌症的方法,包括向需要其的受试者施用b7-h3-adc,其中所述方法包括以约3mg/kg至约5mg/kg的剂量约每3周一次向受试者施用b7-h3-adc。
17.本发明进一步提供了治疗癌症的方法,其包括向需要其的受试者施用b7-h3-adc,其中所述方法包括以约3mg/kg至约4mg/kg的剂量约每3周一次向受试者施用b7-h3-adc。
18.本发明进一步提供了治疗癌症的方法,其包括向需要其的受试者施用b7-h3-adc的,其中所述方法包括以约4mg/kg至约5mg/kg的剂量约每3周一次向受试者施用b7-h3-adc。
19.本发明进一步提供了这种方法的实施方式(即,“这种方法的实施方式”意味着本文所述的应用的方法的实施方式),其包括向需要其的受试者施用b7-h3-adc,其中所述方法包括以约0.5mg/kg至约5mg/kg的剂量约每4周一次向受试者施用b7-h3-adc。
20.本发明进一步提供了治疗癌症的方法,其包括向需要其的受试者施用b7-h3-adc,其中所述方法包括以约3mg/kg至约5mg/kg的剂量约每4周一次向受试者施用b7-h3-adc。
21.本发明进一步提供了治疗癌症的方法,其包括向需要其的受试者施用b7-h3-adc,其中所述方法包括以约3mg/kg至约4mg/kg的剂量约每4周一次向受试者施用b7-h3-adc。
22.本发明进一步提供了治疗癌症的方法,其包括向需要其的受试者施用b7-h3-adc,其中所述方法包括以约4mg/kg至约5mg/kg的剂量约每4周一次向受试者施用b7-h3-adc。
23.本发明进一步提供了这种方法的实施方式,包括向需要其的受试者施用b7-h3-adc,其中所述方法包括以约0.5mg/kg、约1mg/kg、约1.5mg/kg、约2mg/kg、约2.25mg/kg、约2.5mg/kg、约2.75mg/kg、约3mg/kg、约3.25mg/kg、约3.5mg/kg、约3.75mg/kg、约4mg/kg、约4.25mg/kg、约4.5mg/kg、约4.75mg/kg或约5mg/kg向受试者施用b7-h3-adc。
24.本发明进一步提供了这种方法的实施方式,其包括向需要其的受试者施用:(a)b7-h3-adc;和(b)pd-1结合分子,其中方法包括以约0.5mg/kg至约5mg/kg的剂量每3周一次向受试者施用b7-h3-adc。
25.本发明进一步提供了这种方法的实施方式,其包括向需要其的受试者施用:
(a)b7-h3-adc;和(b)pd-1结合分子,其中方法包括以约0.5mg/kg至约5mg/kg的剂量每4周一次向受试者施用b7-h3-adc。
26.本发明进一步提供了这种方法的实施方式,其中b7-h3-adc由下式表示:ab-(lm)
m-(d)n,其中:ab是结合至b7-h3且包括以下的人源化b7-h3抗体或其b7-h3结合片段:(i)其可变轻链(vl)结构域中的cdrl1序列rasesiysyla(seq id no:39)、cdrl2序列ntktlpe(seq id no:40)和cdrl3序列qhhygtppwt(seq id no:41),和(ii)其可变重链(vh)结构域中的cdrh1序列sygms(seq id no:42)、cdrh2序列tinsggsntyypdslkg(seq id no:43)和cdrh3序列hdggamdy(seq id no:44);d是细胞毒素倍癌霉素部分;lm包括至少一个共价连接ab和d的键或连接体分子;m是0和n之间的整数并且表示b7-h3-adc的键或连接体分子的数量,除了当lm是键时,m不是0;和n是1和10之间的整数并且表示共价连接至b7-h3-adc的细胞毒素倍癌霉素部分的数量。
27.本发明进一步提供了这种b7-h3-adc,其中连接体分子不存在并且lm是至少一种键(即,m≥1);和拥有多于一个连接体分子lm的b7-h3-adc(即,m是从2到n的整数),其每个连接体分子lm将细胞毒素倍癌霉素药物部分d与这种b7-h3-adc的ab共价连接。本发明进一步提供这种b7-h3-adc,它的ab共价连接至多于一个连接体分子lm,其中所有这种连接体分子是相同的。共价连接至这种b7-h3-adc的ab的细胞毒素倍癌霉素药物部分d可以都是相同的或可以包括2、3、4或更多个不相同的细胞毒素倍癌霉素药物部分d。本发明进一步提供这种b7-h3-adc,它的ab共价连接至多于一个连接体分子lm,所有这种连接体分子是不相同的。共价连接至这种b7-h3-adc的ab的细胞毒素倍癌霉素药物部分d可以都是相同的或可以包括2、3、4或更多个不相同的细胞毒素倍癌霉素药物部分d。
28.本发明进一步提供了这种方法的实施方式,其中b7-h3-adc包括:(i)包括seq id no:17的氨基酸序列的人源化vl结构域,和(ii)包括seq id no:18的氨基酸序列的人源化vh结构域。
29.本发明进一步提供了这种方法的实施方式,其中ab是抗体。
30.本发明进一步提供了这种方法的实施方式,其中ab进一步包括人igg1的fc结构域。
31.本发明进一步提供了这种方法的实施方式,其中b7-h3-adc包括包含seq id no:19的氨基酸序列的轻链和包含seq id no:20的氨基酸序列的重链。
32.本发明进一步提供了这种方法的实施方式,其中至少一个lm是连接体分子,并且特别地其中lm连接体分子是肽连接体和/或可切割的连接体。
33.本发明进一步提供了这种方法的实施方式,其中肽连接体是缬氨酸-瓜氨酸二肽连接体。
34.本发明进一步提供了这种方法的实施方式,其中lm连接体分子进一步包括可切割的连接体和d之间的自消除间隔子。
35.本发明进一步提供了这种方法的实施方式,其中自消除间隔子包括对氨基苄氧基羰基部分。
36.本发明进一步提供了这种方法的实施方式,其中lm进一步包括可切割的连接体和ab之间的马来酰亚胺连接体部分。
37.本发明进一步提供了这种方法的实施方式,其中lm由下式表示:[v-(w)
k-(x)
1-a]由此b7-h3-adc由下式表示:ab
–
[v-(w)
k-(x)
1-a]
–
d其中:v是可切割的连接体,(w)
k-(x)
1-a是细长的、自消除间隔子系统,其经l,(4+2n)-消除自消除,w和x各自是l,(4+2n)电子级联间隔子,为相同的或不同的,a是式(y)m的间隔子基团,其中y是l,(4+2n)电子级联间隔子,或式u的基团,为环化消除间隔子,k、1和m独立地是0(被包括)至5(被包括)的整数,n是0(被包括)至10(被包括)的整数,条件是:当a是(y)m时:则k+l+m≥1,和如果k+l+m=l,则n》l;当a是u时:则k+1≥1。w、x和y独立地是选自具有以下式的化合物:式:或式:其中:q是-r5c=cr
6-、s、o、nr5、-r5c=n-或-n=cr
5-p是nr7、o或sa、b和c独立地是0(被包括)至5(被包括)的整数;i,f和g独立地的选自下式的化合物:其中r1、r2、r3、r4、r5、r6、r7、r8和r9独立地表示h、c
1-6
烷基、c
3-20
杂环基、c
5-20
芳基、c
1-6
烷氧基、羟基(oh)、氨基(nh2)、单取代的氨基(nr
x
h)、双取代的氨基(nr
x1rx2
)、硝基
(no2)、卤素、cf3、cn、conh2、so2me、conhme、环c
1-5
烷基氨基、咪唑基、c
1-6
烷基哌嗪基、吗啉基、巯基(sh)、硫醚基(sr
x
)、四唑、羧基(cooh)、羧酸基(coor
x
)、磺基(s(=o)2oh)、磺酸基(s(=o)2or
x
)、磺酰基(s(=o)2r
x
)、亚磺基(s(=o)oh)、亚磺酸基(s(=o)or
x
)、亚磺酰基(s(=o)r
x
)、膦酰氧基(op(=o)(oh)2)和磷酸基(op(=o)(or
x
)2),其中r
x
、r
x1
和r
x2
独立地选自c
1-6
烷基、c
3-20
杂环基或c
5-20
芳基,取代基r1、r2、r3、r4、r5、r6、r7、r8或r9的两个或更多个任选地彼此连接以形成一个或多个脂肪族或芳族环结构;u选自具有下式的化合物:其中:a、b和c独立地选择为0或1的整数;条件是a+b+c=2或3;r1和/或r2独立地表示h,c1-6烷基,任选地用以下基团的一个或多个取代的烷基:羟基(oh)、醚(or
x
)、氨基(nh2)、单取代的氨基(nr
x
h)、双取代的氨基(nr
x1rx2
)、硝基(no2)、卤素、cf3、cn、conh2、so2me、conhme、环c
1-5
烷基氨基、咪唑基、c
1-6
烷基哌嗪基、吗啉基、巯基(sh)、硫醚(sr
x
)、四唑、羧基(cooh)、羧酸基(coor
x
)、磺基(s(=o)2oh)、磺酸基(s(=o)2or
x
)、磺酰基(s(=o)2r
x
)、亚磺基(s(=o)oh)、亚磺酸基(s(=o)or
x
)、亚磺酰基(s(=o)r
x
)、膦酰氧基(op(=o)(oh)2)和磷酸基(op(=o)(or
x
)2),其中r
x
、r
x1
和r
x2
选自c
1-6
烷基、c
3-20
杂环基或c
5-20
芳基;和r3、r4、r5、r6、r7和r8独立地表示h、c
1-6
烷基、c
3-20
杂环基、c
5-20
芳基、c
1-6
烷氧基、羟基(oh)、氨基(nh2)、单取代的氨基(nr
x
h)、双取代的氨基(nr
x1rx2
)、硝基(no2)、卤素、cf3、cn、conh2、so2me、conhme、环c
1-5
烷基氨基、咪唑基、c
1-6
烷基哌嗪基、吗啉基、巯基(sh)、硫醚(sr
x
)、四唑、羧基(cooh)、羧酸基(coor
x
)、磺基(s(=o)2oh)、磺酸基(s(=o)2or
x
)、磺酰基(s(=o)2r
x
)、亚磺基(s(=o)oh)、亚磺酸基(s(=o)or
x
)、亚磺酰基(s(=o)r
x
)、膦酰氧基(op(=o)(oh)2)和磷酸基(op(=o)(or
x
)2),其中r
x
、r
x1
和r
x2
选自c
1-6
烷基、c
3-20
杂环基或c
5-20
芳基,并且取代基r1、r2、r3、r4、r5、r6、r7或r8的两个或更多个任选地彼此连接以形成一个或多个脂肪族或芳族环结构。
[0038]
本发明进一步提供了这种方法的实施方式,其中lm连接体分子包括:(1)对氨基苄氧基羰基-对氨基苄氧基羰基;(2)对氨基苄氧基羰基-对氨基苄氧基羰基-对氨基苄氧基羰基;(3)对氨基肉桂氧基羰基;(4)对氨基肉桂氧基羰基-对氨基苄氧基羰基;(5)对氨基-苄氧基羰基-对氨基肉桂氧基羰基;
(6)对氨基肉桂氧基羰基-对氨基肉桂氧基羰基;(7)对氨基苯基戊二烯氧基羰基;(8)对氨基苯基戊二烯氧基羰基-对氨基肉桂氧基羰基;(9)对氨基苯基戊二烯氧基羰基-对氨基苄氧基羰基;(10)对氨基苯基戊二烯氧基羰基-对氨基苯基戊二烯氧基羰基;(11)对氨基苄氧基羰基(甲氨基)乙基(甲氨基)羰基;(12)对氨基肉桂氧基羰基(甲氨基)乙基(甲氨基)羰基;(13)对氨基苄氧基羰基-对氨基苄氧基羰基(甲氨基)乙基(甲氨基)羰基;(14)对氨基肉桂氧基羰基-对氨基苄氧基羰基(甲氨基)乙基(甲氨基)羰基;(15)对氨基苄氧基羰基-对氨基肉桂氧基羰基(甲氨基)乙基(甲氨基)-羰基;(16)对氨基肉桂氧基羰基-对氨基肉桂氧基羰基(甲氨基)乙基(甲氨基)羰基;(17)对氨基苄氧基羰基-对氨基苄基;(18)对氨基苄氧基羰基-对氨基苄氧基羰基-对氨基苄基;(19)对氨基肉桂基;(20)对氨基肉桂氧基羰基-对氨基苄基;(21)对氨基苄氧基羰基-对氨基肉桂基;(22)对氨基-肉桂氧基羰基-对氨基肉桂基;(23)对氨基苯基戊二烯基;(24)对氨基苯基戊二烯氧基羰基-对氨基肉桂基;(25)对氨基苯基戊二烯氧基羰基-对氨基苄基;或(26)对氨基苯基戊二烯氧基羰基-对氨基苯基戊二烯基。
[0039]
本发明进一步提供了这种方法的实施方式,其中lm连接体分子缀合至ab的多肽链的氨基酸的侧链并且将ab结合至细胞毒素倍癌霉素部分d的分子。
[0040]
本发明进一步提供了这种方法的实施方式,其中细胞毒素倍癌霉素部分d包括倍癌霉素细胞毒素,其选自由下述组成的组中:倍癌霉素a、倍癌霉素b1、倍癌霉素b2、倍癌霉素c1、倍癌霉素c2、倍癌霉素d、倍癌霉素sa、cc-1065、阿多来新、比折来新、卡折来新(u-80244)和螺旋-倍癌霉(spiro-duocarmycin)素(duba)。
[0041]
本发明进一步提供了这种方法的实施方式,其中细胞毒素倍癌霉素部分d包括seco-倍癌霉素(seco-duocarmycin)。
[0042]
本发明进一步提供了这种方法的实施方式,其中lm连接体分子经还原的链间二硫化物共价连接至ab。
[0043]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约2mg/kg剂量施用。
[0044]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约2.25mg/kg剂量施用。
[0045]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约2.5mg/kg剂量施用。
[0046]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约2.75mg/kg剂量施用。
[0047]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约3mg/kg剂量施用。
[0048]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约3.25mg/kg剂量施用。
[0049]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约3.5mg/kg剂量施用。
[0050]
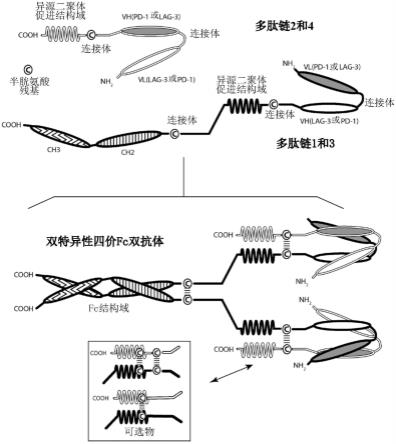
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约3.75mg/kg剂量施用。
[0051]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约4mg/kg剂量施用。
[0052]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约4.25mg/kg剂量施用。
[0053]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约4.5mg/kg剂量施用。
[0054]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约4.75mg/kg剂量施用。
[0055]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约5mg/kg剂量施用。
[0056]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc通过在约60分钟的一段时间内静脉内(iv)输注施用。
[0057]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc与治疗有效剂量的pd-1结合分子组合施用。
[0058]
本发明进一步提供了这种方法的实施方式,其中pd-1结合分子选自由下述组成的组中:抗体、单链抗体、fab片段、f(ab’)2片段、fab’片段、fsc片段、fv片段、scfv、sc(fv)2和双抗体。
[0059]
本发明进一步提供了这种方法的实施方式,其中pd-1结合分子选自由下述组成的组中:hpd-1 mab-a、派姆单抗(pembrolizumab)、尼伏鲁单抗和pd-1 x lag-3 bd。
[0060]
本发明进一步提供了这种方法的实施方式,其中pd-1结合分子是hpd-1 mab-a或pd-1x lag-3 bd。
[0061]
本发明进一步提供了这种方法的实施方式,其中pd-1结合分子包括包含vh互补决定区(cdr)1、vh cdr2和vh cdr3的可变重链(vh)结构域,其中vh cdr1包括氨基酸序列sywmn(seq id no:23);vh cdr2包括氨基酸序列vihpsdsetwldqkfkd(seq id no:24);vh cdr3包括氨基酸序列ehygtspfay(seq id no:25);和其中抗体包括轻链(vl)结构域,其包含vl cdr1、vl cdr2和vl cdr3,其中:vl cdr1包括氨基酸序列rasesvdnygmsfmnw(seq id no:26);vl cdr2包括氨基酸序列aasnqgs(seq id no:27);和vl cdr3包括氨基酸序列qqskevpyt(seq id no:28)。
[0062]
本发明进一步提供了这种方法的实施方式,其中pd-1结合分子的vh结构域包括seq id no:32中所示的氨基酸序列并且所述vl结构域包括seq id no:31中所示的氨基酸序列。
[0063]
本发明进一步提供了这种方法的实施方式,其中pd-1结合分子是hpd-1 mab-a。
[0064]
本发明进一步提供了这种方法的实施方式,其中方法包括以选自由约375mg、约500mg和约750mg组成的组中的固定剂量(flat dose)约每3周一次施用hpd-1 mab-a。
[0065]
本发明进一步提供了这种方法的实施方式,其中方法包括以选自由约375mg、约500mg和约750mg组成的组中的固定剂量约每4周一次施用hpd-1 mab-a。
[0066]
本发明进一步提供了这种方法的实施方式,其中hpd-1 mab-a以约375mg的固定剂量约每3周一次施用。
[0067]
本发明进一步提供了这种方法的实施方式,其中hpd-1 mab-a以约500mg的固定剂量约每3周一次施用。
[0068]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约3mg/kg剂量施用且hpd-1 mab-a以约375mg的固定剂量每3周一次施用。
[0069]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约3.25mg/kg剂量施用且hpd-1 mab-a以约375mg的固定剂量每3周一次施用。
[0070]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约3.5mg/kg剂量施用且hpd-1 mab a以约375mg的固定剂量每3周一次施用。
[0071]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约3.75mg/kg剂量施用且hpd-1 mab a以约375mg的固定剂量每3周一次施用。
[0072]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约4mg/kg剂量施用且hpd-1 mab-a以约375mg的固定剂量每3周一次施用。
[0073]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约4.25mg/kg剂量施用且hpd-1 mab-a以约375mg的固定剂量每3周一次施用。
[0074]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约4.5mg/kg剂量施用且hpd-1 mab-a以约375mg的固定剂量每3周一次施用。
[0075]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约4.75mg/kg剂量施用且hpd-1 mab-a以约375mg的固定剂量每3周一次施用。
[0076]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约5mg/kg剂量施用且hpd-1 mab-a以约375mg的固定剂量每3周一次施用。
[0077]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约3mg/kg剂量施用且hpd-1 mab-a以约375mg的固定剂量每4周一次施用。
[0078]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约3.25mg/kg剂量施用且hpd-1 mab-a以约375mg的固定剂量每4周一次施用。
[0079]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约3.5mg/kg剂量施用且hpd-1 mab-a以约375mg的固定剂量每4周一次施用。
[0080]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约3.75mg/kg剂量施用且hpd-1 mab-a以约375mg的固定剂量每4周一次施用。
[0081]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约4mg/kg剂量施用且hpd-1 mab-a以约375mg的固定剂量每4周一次施用。
[0082]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约4.25mg/kg剂量施用且hpd-1 mab-a以约375mg的固定剂量每4周一次施用。
[0083]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约4.5mg/kg剂量施
用且hpd-1 mab-a以约375mg的固定剂量每4周一次施用。
[0084]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约4.75mg/kg剂量施用且hpd-1 mab-a以约375mg的固定剂量每4周一次施用。
[0085]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc以约5mg/kg剂量施用且hpd-1 mab-a以约375mg的固定剂量每4周一次施用。
[0086]
本发明进一步提供了这种方法的实施方式,其中hpd-1 mab-a通过在约60分钟的一段时间内iv输注施用。
[0087]
本发明进一步提供了这种方法的实施方式,其中结合至人pd-1的抗体是派姆单抗。
[0088]
本发明进一步提供了这种方法的实施方式,其中派姆单抗以约200mg的固定剂量约每3周一次施用。
[0089]
本发明进一步提供了这种方法的实施方式,其中派姆单抗通过在约30分钟的一段时间内iv输注施用。
[0090]
本发明进一步提供了这种方法的实施方式,其中pd-1结合分子是尼伏鲁单抗。
[0091]
本发明进一步提供了这种方法的实施方式,其中尼伏鲁单抗以约240mg的固定剂量约每2周一次施用。
[0092]
本发明进一步提供了这种方法的实施方式,其中尼伏鲁单抗以约480mg的固定剂量约每4周一次施用。
[0093]
本发明进一步提供了这种方法的实施方式,其中尼伏鲁单抗通过在约30分钟的一段时间内iv输注施用。
[0094]
本发明进一步提供了这种方法的实施方式,其中pd-1结合分子是pd-1 x lag-3 bd。
[0095]
本发明进一步提供了这种方法的实施方式,其中pd-1 x lag-3 bd包括包含seq id no:37的氨基酸序列的两条多肽链和包含seq id no:38的氨基酸序列的两条多肽链。
[0096]
本发明进一步提供了这种方法的实施方式,其中pd-1 x lag-3 bd以约300mg的固定剂量每2周一次施用。
[0097]
本发明进一步提供了这种方法的实施方式,其中pd-1 x lag-3 bd以约300mg的固定剂量每3周一次施用。
[0098]
本发明进一步提供了这种方法的实施方式,其中pd-1 x lag-3 bd以约600mg的固定剂量每2周一次施用。
[0099]
本发明进一步提供了这种方法的实施方式,其中pd-1 x lag-3 bd以约600mg的固定剂量每3周一次施用。
[0100]
本发明进一步提供了这种方法的实施方式,其中pd-1 x lag-3 bd通过在30-240分钟的一段时间内iv输注施用。
[0101]
本发明进一步提供了这种方法的实施方式,其中pd-1 x lag-3 bd通过在约30-90分钟的一段时间内iv输注施用。
[0102]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc和hpd-1 mab-a以单独的药物组合物依次向受试者施用。
[0103]
本发明进一步提供了这种方法的实施方式,其中包括hpd-1 mab-a的药物组合物
在施用包括b7-h3-adc的药物组合物之前施用。
[0104]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc和派姆单抗以单独的药物组合物依次向受试者施用。
[0105]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc和尼伏鲁单抗以单独的药物组合物依次向受试者施用。
[0106]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc和pd-1 x lag-3 bd以单独的药物组合物依次向受试者施用。
[0107]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc被提供在药物试剂盒中,药物试剂盒包括:a.包括约0.5mg/ml至约5mg/ml的b7-h3-adc的药物组合物;和b.指导材料,其中指导材料指示包括b7-h3-adc的药物组合物任选地与包括pd-1结合分子的药物组合物组合施用。本发明进一步提供了这种方法的实施方式,其中pd-1结合分子是hpd-1 mab-a、派姆单抗、尼伏鲁单抗或pd-1 x lag-3 bd。
[0108]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc被提供在药物试剂盒中,其中b7-h3-adc包括:(i)包括seq id no:17的氨基酸序列的人源化vl结构域,和(ii)包括seq id no:18的氨基酸序列的人源化vh结构域。
[0109]
本发明进一步提供了这种方法的实施方式,其中这种药物试剂盒的指导手册指示b7-h3-adc以约0.5mg/kg、约1mg/kg、约1.5mg/kg、约2mg/kg、约2.25mg/kg、约2.5mg/kg、约2.75mg/kg、约3mg/kg、约3.25mg/kg、约3.5mg/kg、约3.75mg/kg、约4mg/kg、约4.25mg/kg、约4.5mg/kg、约4.75mg/kg或约5mg/kg的剂量施用。
[0110]
本发明进一步提供了这种方法的实施方式,其中这种药物试剂盒的指导手册指示hpd-1 mab-a以约375mg或约500mg的固定剂量每3周一次施用。
[0111]
本发明进一步提供了这种方法的实施方式,其中这种药物试剂盒的指导手册指示派姆单抗以约200mg的固定剂量每3周一次施用。
[0112]
本发明进一步提供了这种方法的实施方式,其中这种药物试剂盒的指导手册指示pd-1 x lag-3 bd以约300mg或约600mg的固定剂量每2周一次或每3周一次施用。
[0113]
本发明进一步提供了这种方法的实施方式,其中这种药物试剂盒的指导手册指示b7-h3-adc和hpd-1 mab-a通过在约60分钟的一段时间内iv输注施用。
[0114]
本发明进一步提供了这种方法的实施方式,其中这种药物试剂盒的指导手册指示b7-h3-adc通过在约60分钟的一段时间内iv输注施用且pd-1 x lag-3 bd通过在约30-90分钟的一段时间内iv输注施用。
[0115]
本发明进一步提供了这种方法的实施方式,其中这种药物试剂盒的指导手册指示b7-h3-adc通过在约60分钟的一段时间内iv输注施用和pd-1 x lag-3 bd通过在约30-240分钟的一段时间内iv输注施用。
[0116]
本发明进一步提供了这种方法的实施方式,其中b7-h3-adc与pd-1结合分子组合施用用于治疗其中表达b7-h3的癌症。
b7-h3-adc+20mg/kg抗pd-1抗体的组合或单独的媒介物腹膜内处理的小鼠呈现肿瘤生长曲线。
[0126]
图3显示了本发明的b7-h3-adc与抗pd-1抗体(rmp1-14)组合在balb/c同基因小鼠模型中介导针对皮下植入的ct26/hb7-h3(过表达人b7-h3的鼠结直肠癌肿瘤细胞)的体内细胞毒性的能力的研究结果。b7-h3-adc在第13天施用。抗pd-1抗体在第13、16、19、22、26、29、33和36天施用。媒介物在第13天施用。对于用10mg/kg单独的b7-h3-adc、20mg/kg单独的抗pd-1抗体、10mg/kg b7-h3-adc+20mg/kg抗pd-1抗体的组合或单独的媒介物腹膜内处理的小鼠呈现肿瘤生长曲线。
[0127]
图4显示通过肿瘤类型和通过剂量的可评估应答的队列递增(cohort escalation)和队列扩展(cohort expansion)患者之中靶病灶变化百分比的瀑布图(绘制为从基线的%改变)。患者以队列递增用0.5mg/kg、1mg/kg、2mg/kg、3mg/kg或4mg/kg b7-h3-adc或以队列扩展用3.0mg/kg b7-h3-adc治疗。虚线指示从基线20%或-30%的改变。缩写:crc=结直肠癌;nsclc=非小细胞肺癌;sclc=小细胞肺癌;mcrpc=转移性去势抵抗前列腺癌。
[0128]
图5a和5b呈现基线处(图5a)和在遵循2个q3w剂量的2mg/kg b7-h3-adc的6周处(图5b)一名非小细胞肺癌(nsclc)患者中的靶肺病灶的图像。由白色箭头在每个图像中标注病灶。
[0129]
图6显示通过剂量的可评估应答的队列递增和队列扩展mcrpc患者之中前列腺特异性抗原的变化百分比的瀑布图(psa;绘制为从基线的%改变)。患者以队列递增用2.0mg/kg、3.0mg/kg或4.0mg/kg b7-h3-adc或以队列扩展用3.0mg/kg b7-h3-adc治疗。虚线指示从基线25%或-50%的改变。发明详述
[0130]
本发明涉及施用b7-h3-adc以治疗癌症,特别地与b7-h3表达相关的癌症的给药方案。某些b7-h3-adc和它们在治疗癌症中的用途在,例如,pct公开号wo 2017/180813中描述,wo 2017/180813明确地通过引用并入本文。本发明特别地关注这种b7-h3-adc任选地与pd-1结合分子组合以治疗癌症的用途。本发明特别地关注b7-h3-adc和抗pd-1抗体,或pd-1 x lag-3双特异性分子的用途。施用b7-h3-adc以治疗癌症,或b7-h3-adc与pd-1结合分子组合以治疗癌症的给药方案可包括以定时给药间隔或间歇给药间隔施用。在其中b7-h3-adc与pd-1结合分子组合施用的给药方案中,他们可以同时或以任何顺序依次施用。本发明涉及这种分子的用途,和含有这种分子且促进这种给药方案在治疗癌症中的用途的药物组合物和药物试剂盒的用途。i.抗体和它们的结合结构域
[0131]
本发明的抗体是免疫球蛋白分子,其能够通过位于免疫球蛋白分子的可变结构域中的至少一个抗原识别位点特异性结合至靶,比如碳水化合物、多核苷酸、脂质、多肽等。本发明的b7-h3-adc因此包括结合b7-h3的抗体。如本文使用的,术语“抗体”指单克隆抗体、多特异性抗体、人抗体、人源化抗体、合成抗体、嵌合抗体、多克隆抗体,骆驼源化抗体(camelized antibodies)、单链fv(scfv)、单链抗体、fab片段、f(ab’)片段、二硫键连接的双特异性fv(sdfv)、胞内抗体和任何上述的表位-结合片段。特别地,术语“抗体”包括免疫球蛋白分子和免疫球蛋白分子(即含有表位-结合位点的分子)的免疫活性片段。免疫球蛋
白分子可以是任何类型(例如,igg、ige、igm、igd、iga和igy)、类别(例如,igg1、igg2、igg3、igg4、iga1和iga2)或亚类。由于在特定结构域或部分或构象(“表位”)的这种分子上的存在,抗体能够“免疫特异性结合”至多肽或蛋白质或非蛋白质分子(或能够以“免疫特异性方式”结合至这种分子)。含有表位的分子可具有免疫原性活性,使得其在动物中引起抗体产生应答;这种分子被称为“抗原”。
[0132]
如本文使用的,抗体、双抗体或其他表位-结合分子被称为“免疫特异性”结合另一分子的区域(即,表位),条件是其相对于可选的表位与该表位更频繁地、更快速地以更长持续时间和/或以更大亲和力反应或缔合。例如,免疫特异性结合病毒表位的抗体是与其免疫特异性结合至其他病毒表位或非病毒表位相比,以更大亲和力、亲合力、更快速和/或以更长持续时间结合该病毒表位的抗体。还可通过阅读该定义理解,例如,免疫特异性结合第一靶的抗体(或部分或表位)可以或不可以特异地或优先地结合第二靶。正因如此,“免疫特异性结合”不必须要求(尽管其可包括)排他的结合。一般而言,但不是必须的,提及结合意味着“免疫特异性”结合。两个分子被称为能够以“生理特异性”方式彼此结合,条件是这种结合展示出与其受体结合至它们各自配体的特异性。
[0133]
术语“单克隆抗体”指同源性抗体群,其中单克隆抗体包括涉及抗原的选择性结合的氨基酸(天然存在的或非天然存在)。单克隆抗体是高度特异性,针对单个表位(或抗原位点)。术语“单克隆抗体”不仅仅涵盖完整的单克隆抗体和全长单克隆抗体,而且也涵盖其片段(比如fab、fab'、f(ab')2、fv等)、单链(scfv)结合分子、其突变体、包括抗体部分的融合蛋白、人源化单克隆抗体、嵌合单克隆抗体和包括结合抗原所需特异性和能力的抗原识别位点的免疫球蛋白分子的任何其他修饰的构型。关于抗体的来源或其制备的方式(例如,通过杂交瘤、噬菌体选择、重组表达、转基因动物等)而言,不旨在是限制性的。该术语包括完整的免疫球蛋白以及上面根据“抗体”的定义描述的片段等。制备单克隆抗体的方法是本领域已知的。可采用的一种方法是kohler,g.等(1975)“continuous cultures of fused cells secreting antibody of predefined specificity,”nature 256:495-497的方法或其改进。典型地,单克隆抗体在小鼠、大鼠或兔子中开发。通过用免疫原性量的细胞、细胞提取物或含有期望表位的蛋白质制品免疫动物而产生抗体。免疫原可以是但不限于原代细胞、培养细胞系、癌细胞、蛋白质、肽、核酸或组织。可替选地,对于期望的致病表位是免疫特异性的现有单克隆抗体和任何其他等效抗体可被测序,并通过本领域中已知的任何手段重组产生。在一个实施方式中,对这种抗体测序,然后将多核苷酸序列克隆至载体中用于表达或增殖。编码感兴趣的抗体的序列可在宿主细胞内保持在载体中,然后可扩增和冷冻宿主细胞,用于将来的使用。这种抗体的多核苷酸序列可用于基因操纵,以产生本发明的单特异性或多特异性(例如,双特异性、三特异性和四特异性)分子以及亲和力优化的嵌合抗体、人源化抗体和/或犬源化(caninized)抗体,以改善抗体的亲和力或其他特征。使抗体人源化的一般原则涉及保留抗体的抗原-结合部分的基本序列,而用人抗体序列交换抗体的非人剩余部分。
[0134]
天然抗体(比如igg抗体)包括与两条“重链”复合的两条“轻链”。每条轻链含有可变结构域(“vl”)和恒定结构域(“cl”)。每条重链含有可变结构域(“vh”)、三个恒定结构域(“ch1”、“ch2”和“ch3”)和位于ch1和ch2结构域之间的“铰链”区(“h”)。天然存在的免疫球蛋白(例如,igg)的基本结构单元因此是具有两条轻链和两条重链的四聚物,通常表达为约
150,000da的糖蛋白。每条链的氨基末端(“n-末端”)部分包括约100至110或更多个主要负责抗原识别的氨基酸的可变结构域。每条链的羧基末端(“c-末端”)部分限定了恒定区,其中轻链具有单一恒定结构域和重链通常具备三个恒定结构域和铰链结构域。因此,igg分子的轻链的结构是n-vl-cl-c和igg重链的结构是n-vh-ch1-h-ch2-ch3-c(其中n和c分别表示多肽的n-末端和c-末端)。a.抗体可变结构域的特征
[0135]
igg分子的可变结构域由互补决定区(“cdr”)和称为框架区段(“fr”)的非cdr区段组成,cdr含有与表位接触的残基,fr大体上保持cdr环的结构和确定cdr环的定位以便允许这种接触(尽管某些框架残基也可接触抗原)。因此,vl和vh结构域具有结构n-fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4-c。cdr的氨基酸序列确定抗体是否将能够结合特定的表位。抗体轻链与抗体重链的相互作用,并且具体地,它们的vl和vh结构域的相互作用形成抗体的表位-结合位点。
[0136]
来自免疫球蛋白的成熟的重链和轻链的可变结构域的氨基酸是通过链中氨基酸的位置命名。kabat(sequences of proteins of immunological interest,5th ed.public health service,nh1,md(1991))描述了抗体的许多氨基酸序列、鉴定了每个亚组的氨基酸共有序列并且为每个氨基酸指定了残基编号,并且鉴定cdr和fr,如通过kabat定义(应当理解,通过chothia,c.&lesk,a.m.((1987)“canonical structures for the hypervariable regions of immunoglobulins,”j.mol.biol.196:901-917)定义的cdrh1提前五个残基开始)。kabat的编号方案通过参考保守氨基酸将考虑的抗体与kabat中的共有序列之一比对而可扩增至不包括在其纲要中的抗体。用于指定残基编号的该方法在本领域中已经变成了标准,并且易于鉴定在不同抗体(包括嵌合或人源化变体)中在等同位置处的氨基酸。例如,在人抗体轻链的位置50处的氨基酸占据与小鼠抗体轻链的位置50处的氨基酸等同的位置。它们的cdr开始和结束处的vl和vh结构域内的位置因此很好定义,并且可通过检查vl和vh结构域的序列确定(参见,例如,martin,c.r.(2010)“protein sequence and structure analysis of antibody variable domains,”in:antibody engineering vol.2(kontermann,r.and d
ü
bel,s.(eds.),springer-verlag berlin heidelberg,chapter 3(pages 33-51))。
[0137]
是(或可用作)抗体轻链的第一cdr、第二cdr和第三cdr的多肽在本文中分别命名为:cdr
l
1结构域、cdr
l
2结构域和cdr
l
3结构域。类似地,是(或可用作)抗体重链的第一cdr、第二cdr和第三cdr的多肽在本文中分别命名为:cdrh1结构域、cdrh2结构域和cdrh3结构域。因此,术语cdr
l
1结构域、cdr
l
2结构域、cdr
l
3结构域、cdrh1结构域、cdrh2结构域和cdrh3结构域涉及这种多肽:当其并入蛋白质中时,引起该蛋白质能够结合特定表位,而无论这种蛋白质是具有轻链和重链的抗体或是双抗体或单链结合分子(例如,scfv、bite等),或是另一类型蛋白质。相应地,如本文使用的,术语“表位-结合片段”表示能够免疫特异性结合表位的分子片段。表位-结合片段可含有抗体的任意1、2、3、4或5个cdr结构域,或可含有抗体的全部6个cdr结构域,并且,尽管能够免疫特异性结合这种表位,但对不同于这种抗体的表位的这种表位可展示出免疫特异性、亲和力或选择性。然而,优选地,表位-结合片段将含有这种抗体的全部6个cdr结构域。抗体的表位-结合片段可以是单个多肽链(例如,scfv),或可包括两条或更多条多肽链,每条具有氨基末端和羧基末端(例如,双抗体、fab片段、fab2片段
等)。除非具体地指示,本文所述的蛋白质分子的结构域的顺序是以“n-末端至c-末端”方向。
[0138]
本发明特别地涵盖包括本发明的人源化抗b7-h3-vl和/或vh结构域的单链可变结构域片段(“scfv”)。单链可变结构域片段包括使用短的“连接体”肽连接在一起的vl和vh结构域。这种连接体可被修饰以提供另外功能,比如允许药物附着或允许固体载体的附着。单链变体可以重组或合成产生。对于scfv的合成产生,可使用自动合成仪。对于scfv的重组产生,编码scfv的含有多核苷酸的合适质粒可引入合适的宿主细胞,真核宿主细胞比如酵母、植物、昆虫或哺乳动物细胞,或原核宿主细胞比如大肠杆菌。编码感兴趣的scfv的多核苷酸可通过常规操作比如多核苷酸的连接来制备。所得的scfv可使用本领域已知的标准蛋白质纯化技术分离。
[0139]
本发明特别地涵盖包括人源化抗体的vl和/或vh结构域的结合分子(包括抗体和双抗体)。术语“人源化”抗体指嵌合分子,通常使用重组体技术制备,其具有来自非人物种的免疫球蛋白的表位-结合位点和基于人免疫球蛋白的结构和/或序列的分子的剩余免疫球蛋白结构。这种抗体的可变结构域的多核苷酸序列可用于基因操纵以产生这种衍生物并且改善这种抗体的亲和力或其他特征。已知,重链和轻链二者的可变结构域含有三个互补决定区(cdr),其响应于考虑的抗原变化并且确定结合能力,侧面是四个框架区域(fr),其在给定物种中是相对保守的,并且其公认为cdr提供了支架。当相对于特定的抗原制备非人抗体时,可变结构域可以是“重塑的”或“人源化的”。使抗体人源化的一般原则涉及保留抗体的表位-结合部分的基本序列,同时用人抗体序列交换抗体的非人剩余部分。使单克隆抗体人源化有四个一般步骤。这些步骤是:(1)确定起始抗体轻链可变结构域和重链可变结构域的核苷酸和预测的氨基酸序列;(2)设计人源化抗体或犬源化抗体,即决定在人源化或犬源化过程期间使用哪个抗体框架区;(3)实际的人源化或犬源化方法/技术;和(4)人源化抗体的转染和表达。参见,例如美国专利号4,816,567、5,807,715、5,866,692和6,331,415。
[0140]
已经描述了包括源自非人免疫球蛋白的表位-结合位点的许多人源化抗体分子,包括具有啮齿动物或修饰的啮齿动物可变结构域和与人恒定结构域融合的它们的缔合的互补决定区(cdr)的嵌合抗体(参见,例如,(1989)“mouse/human chimeric monoclonal antibody in man:kinetics and immune response,”proc.natl.acad.sci.(u.s.a.)86:4220-4224(1989))。其他参考文献描述了在与适当的人抗体恒定结构域融合之前移植到人支撑框架区(fr)中的啮齿动物cdr(参见,例如,riechmann,l.等(1988)“reshaping human antibodies for therapy,”nature 332:323-327和jones等(1986)“replacing the complementarity-determining regions in a human antibody with those from a mouse,”nature 321:522-525)。另一参考文献描述了通过重组修饰的啮齿动物框架区支撑的啮齿动物cdr。参见,例如欧洲专利公开号519,596。这些“人源化”分子被设计为使得对啮齿动物抗人抗体分子的不期望的免疫应答最小化,该不期望的免疫应答限制了那些部分在人接受者中治疗应用的持续时间和功效。也可使用的使抗体人源化的其他方法公开在下面文献中:daugherty等人(1991)“polymerase chain reaction facilitates the cloning,cdr-grafting,and rapid expression of a murine monoclonal antibody directed against the cd18component of leukocyte integrins,”nucl.acids res.19:2471-2476和美国专利号6,180,377、6,054,297、5,997,867和5,866,692。在一些实施方式中,人源化
抗体保留全部cdr序列(例如,人源化小鼠抗体含有来自小鼠抗体的全部六个cdr)。在其他实施方式中,人源化抗体具有一个或多个cdr(一、两、三、四、五或六个),其相对于原始抗体在序列上不同。b.抗体恒定结构域的特征1.轻链的恒定结构域
[0141]
如以上指示的,抗体的每条轻链含有可变结构域(“vl”)和恒定结构域(“cl”)。
[0142]
如本文使用的术语“示例性”意味着“非限制性示例”。示例性cl结构域是人igg clκ结构域。示例性人clκ结构域的氨基酸序列是(seq id no:1):
[0143]
可替选地,示例性cl结构域是人igg clλ结构域。示例性人clλ结构域的氨基酸序列是(seq id no:2):2.重链的恒定结构域
[0144]
如以上指示的,抗体的重链可包括ch1、铰链结构域、ch2和ch3恒定结构域。抗体的两条重链的ch1结构域与抗体的轻链的cl恒定区复合,并且通过间插铰链结构域附着至重链ch2结构域。
[0145]
示例性ch1结构域是人igg1 ch1结构域。示例性人igg1 ch1结构域的氨基酸序列是(seq id no:3):
[0146]
示例性ch1结构域是人igg4 ch1结构域。示例性人igg4 ch1结构域的氨基酸序列是(seq id no:4):
[0147]
示例性铰链结构域是人igg1铰链结构域。示例性人igg1铰链结构域的氨基酸序列是(seq id no:5):epkscdkthtcppcp。
[0148]
另一示例性铰链结构域是人igg4铰链结构域。示例性人igg4铰链结构域的氨基酸序列是(seq id no:6):eskygppcpscp。igg4铰链结构域可包括稳定化突变比如s228p置换。示例性s228p-稳定化的人igg4铰链结构域的氨基酸序列是(seq id no:7):eskygppcppcp。
[0149]
抗体的两条重链的ch2和ch3结构域相互作用以形成“fc结构域”,其是被细胞fc受体识别的结构域,fc受体包括但不限于fcγ受体(fcγr)。如本文使用的,术语“fc结构域”用于限定igg重链的c-末端区。如果fc区的氨基酸序列相对于其他igg同种型与该同种型最同源,则认为fc结构域是特定的igg同种型、类别或亚类。除它们已知的在诊断中的用途外,
抗体已经显示可用作治疗剂。
[0150]
示例性人igg1的ch2-ch3结构域的氨基酸序列是(seq id no:8):如通过kabat中所示的eu索引所编号,其中x是赖氨酸(k)或不存在。
[0151]
示例性人igg4的ch2-ch3结构域的氨基酸序列是(seq id no:9):如通过kabat中所示的eu索引所编号,其中x是赖氨酸(k)或不存在。
[0152]
遍及本技术说明书,igg重链的恒定区中的残基的编号是按照kabat等的sequences o
f proteins of immunological interest,5
th ed.public health service,nh1,md(1991)中eu索引的编号,其通过引用明确地并入本文。术语“如kabat中的eu索引”指人igg1 eu抗体的恒定结构域的编号。
[0153]
在抗体恒定区内在许多不同位置(例如,fc位置,包括但不限于通过kabat中所示的eu索引所编号的位置270、272、312、315、356和358)已经观察到多态性,并且因此在所展示出的序列和现有技术中的序列之间可存在轻微差异。已经很好地表征了人免疫球蛋白的多态形式。目前,18gm同种异型是已知的:g1m(1、2、3、17)或g1m(a、x、f、z)、g2m(23)或g2m(n)、g3m(5、6、10、11、13、14、15、16、21、24、26、27、28)或g3m(b1、c3、b3、b0、b3、b4、s、t、g1、c5、u、v、g5)(lefranc等“the human igg subclasses:molecular analysis of structure,function and regulation.”pergamon,oxford,pp.43-78(1990);lefranc,g.
等1979,hum.genet.:50,199-211)。具体地考虑本发明的抗体可并入任何免疫球蛋白基因的任何同种异型(allotype)、异种型(isoallotype)或单体型(haplotype),并且不限于本文提供的序列的同种异型、异种型或单体型。而且,在一些表达系统中,ch3结构域的c-末端氨基酸残基(上文粗体)可在翻译后去除。相应地,ch3结构域的c-末端残基是任选的氨基酸残基。具体地,本发明涵盖的是缺少ch3结构域的c-末端残基的b7-h3-adc。同样具体地,本发明涵盖的是包括ch3结构域的c-末端赖氨酸残基的这种构建体。
[0154]
本发明特别地涵盖包括免疫特异性结合人b7-h3多肽的表位的抗b7-h3可变结构域(即,vl和/或vh结构域)的b7-h3-adc。这种b7-h3-adc能够免疫特异性结合人b7-h3。如本文使用的,这种b7-h3可变结构域分别称为“抗b7-h3-vl”和“抗b7-h3-vh”。ii.抗b7-h3抗体mab-a
[0155]
示例性抗b7-h3抗体,称为“mab-a”从通过用表达人b7-h3的细胞、用b7-h3多肽或其肽表位免疫一产生的杂交瘤细胞分离。抗体mab-a是人源化的。
[0156]
发现抗体mab-a与食蟹猴的b7-h3交叉反应。以下提供了mab-a的vl和vh结构域的氨基酸序列。本发明的优选的b7-h3-adc具有vh结构域的全部3个cdrh、vl结构域的全部3个cdr
l
和任选地人源化的单克隆抗体mab-a(“hmab-a”)的整个vh和vl结构域。a.鼠抗b7-h3抗体mab-a
[0157]
以下显示了鼠抗b7-h3抗体mab-a的vl结构域的氨基酸序列(seq id no:15)(cdr
l
残基加下划线显示):
[0158]
以下显示了抗b7-h3 mab-a的vh结构域的氨基酸序列(seq id no:16)(cdrh残基加下划线显示)。b.人源化的抗b7-h3抗体hmab-a
[0159]
抗b7-h3抗体mab-a的可变结构域是人源化的,以产生人源化mab-a(“hmab-a”)。在一些情况下,产生可替选的人源化可变结构域以优化结合活性和/或去除抗原表位和/或去除潜在地不稳定的氨基酸残基。
[0160]
以下显示了hmab-a的vl结构域的氨基酸序列(seq id no:17)(cdr
l
残基加下划线显示):
[0161]
以下显示了包括hmab-a的vl结构域和clκ结构域的hmab-a的轻链的氨基酸序列(seq id no:19):
[0162]
在seq id no:19中,氨基酸残基1-108对应于hmab-a的vl结构域(seq id no:17),和氨基酸残基109-215对应于轻链κ恒定区(seq id no:1)。
[0163]
以下显示了hmab-a的vh结构域的氨基酸序列(seq id no:18)(cdrh残基加下划线显示)。
[0164]
以下显示了包括hmab-a的vh结构域和igg1 ch1-h-ch2-ch3结构域的重链的氨基酸序列(seq id no:20):no:20):
[0165]
在seq id no:20中,氨基酸1-117对应于hmab-a的vh结构域(seq id no:18),氨基酸残基118-215对应于igg1 ch1结构域(seq id no:3),氨基酸残基216
–
230对应于igg1铰链结构域(seq id no:5),和氨基酸残基231
–
447对应于igg1 ch2-ch3结构域(seq id no:8)。n-连接糖基化位点在kabat位置296处存在(加下划线显示)。iii.fc结构域的修饰
[0166]
本发明的含有fc结构域的分子(例如,抗体和双抗体)的fc结构域可以是完整的fc结构域(例如,完整的igg fc结构域)或仅是fc结构域的片段。任选地,本发明的含有fc结构域的分子的fc结构域缺少c-末端赖氨酸氨基酸残基。
[0167]
在传统的免疫功能中,抗体-抗原复合物与免疫系统细胞的相互作用导致各种各样的响应,范围从效应子功能比如抗体依赖性细胞毒性、肥大细胞脱粒和吞噬作用至免疫调节信号比如调节淋巴细胞增殖和抗体分泌。所有这些相互作用都是通过抗体或免疫复合物的fc结构域与多种类型的免疫系统细胞(例如,b淋巴细胞、滤泡树突状细胞、天然杀伤细
胞、巨噬细胞、中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞和肥大细胞)的表面上发现的专用的细胞表面受体(特别称为“fcγ受体”、“fcγr”并且统称为“fcγr”)的结合来启动。由抗体和免疫复合物触发的细胞反应的多样性源于三种fc受体的结构异质性:fcγri(cd64)、fcγrii(cd32)和fcγriii(cd16)。fcγri(cd64)、fcγriia(cd32a)和fcγriii(cd16)是激活(即,使免疫系统增强)受体;fcγriib(cd32b)是抑制(即,使免疫系统抑制)受体。此外,与新生fc受体(fcrn)相互作用介导igg分子从内涵体再循环到细胞表面且释放到血液中。以上呈现了示例性野生型igg1(seq id no:8)和igg4(seq id no:9)的氨基酸序列。
[0168]
fc结构域的修饰可导致改变的表型,例如改变的血清半衰期、改变的稳定性、改变的对细胞酶的敏感性或改变的效应子功能。相应地,在某些实施方式中,本发明的含有fc结构域的分子的fc结构域可以是工程化的变体fc结构域。尽管本发明的含有fc结构域的分子的fc结构域可具有对一种或多种fc受体(例如,fcγr)结合的能力,特别是这种变体fc结构域将具有改变的对fcγria(cd64)、fcγriia(cd32a)、fcγriib(cd32b)、fcγriiia(cd16a)或fcγriiib(cd16b)的结合(相对于野生型fc结构域展示出的结合),例如,将具有增强的对激活受体的结合和/或将具有基本上降低的或没有对抑制受体的结合的能力。因此,本发明的含有fc结构域的分子的fc结构域可包括完整的fc结构域的一些或全部ch2结构域和/或一些或全部ch3结构域,或可包括变体ch2和/或变体ch3序列(其可包括,例如,相对于完整的fc结构域的ch2或ch3结构域的一个或多个插入和/或一个或多个删除)。这种fc结构域可包括非fc多肽部分,或可包括非天然完整的fc结构域的部分,或可包括包括ch2和/或ch3结构域的非天然存在的方向(比如,例如,两个ch2结构域或两个ch3结构域,或在n-末端至c-末端方向上,ch3结构域连接至ch2结构域等)。
[0169]
在某些实施方式中,本发明的结合分子的fc结构域展示出减少的(或基本没有的)对fcγria(cd64)、fcγriia(cd32a)、fcγriib(cd32b)、fcγriiia(cd16a)或fcγriiib(cd16b)的结合(相对于由野生型igg1 fc结构域(seq id no:8)展示出的结合)。在某些实施方式中,本发明的结合分子包括展示出降低的adcc效应子功能的igg fc结构域。在这种实施方式中,结合分子的ch2-ch3结构域包括任何1、2、3或4个置换:l234a、l235a、d265a、n297q和n297g。在另一个实施方式中,ch2-ch3结构域含有n297q置换;n297g置换;l234a和l235a置换;或d265a置换,因为这些突变消除了fcr结合。可替选地,利用固有地展示出减少的(或基本上没有的对fcγriiia(cd16a)的结合和/或降低的效应子功能(相对于由野生型igg1 fc结构域(seq id no:8)展示出的结合和效应子功能)的天然存在的fc结构域的ch2-ch3结构域。在一个具体实施方式中,本发明的结合分子包括igg4 fc结构域(seq id:no:9)。当利用igg4 fc结构域时,本发明还涵盖引入稳定化突变,比如本文所述的铰链结构域s228p置换(参见,例如,seq id no:7)。
[0170]
包括fc结构域的蛋白质的血清半衰期可通过增加fc结构域对fcrn的结合亲和力来增加。如本文使用的术语“半衰期”意味着分子的药物代谢动力学性质,其是分子在它们施用后平均存活时间的量度。半衰期可以表示为从受试者的身体(例如,人患者或其他哺乳动物)或其特定隔室中消除百分之五十(50%)已知量的分子所需的时间,例如,如在血清中测量的,即循环半衰期,或在其他组织中。一般而言,半衰期的增加导致施用的分子在循环中的平均停留时间(mrt)增加。能够增加含有fc结构域的分子的半衰期的修饰是本领域已知的,并且包括例如m252y、s254t、t256e及其组合。例如,参见美国专利号6,277,375、7,
083,784、7,217,797和8,088,376;美国公开号2002/0147311、2007/0148164和2011/0081347中描述的修饰。
[0171]
在一个实施方式中,本发明的pd-1 x lag-3结合分子包括变体fc区,其中这种变体fc区包括在位置252处用酪氨酸、在位置254处用苏氨酸和在位置256处用谷氨酸置换(252y、254t和256e),其中这种编号是如kabat中的eu索引的编号。在具体的实施方式中,本发明的pd-1 x lag-3结合分子包括变体igg4 fc区,其中这种变体igg4 fc区包括在位置252处用酪氨酸、在位置254处用苏氨酸和在位置256处用谷氨酸置换(252y、254t和256e),其中这种编号是如kabat中的eu索引的编号。
[0172]
包括m252y/s254t/t256e置换的ch2和ch3结构域的示例性变体igg4序列是(seq id no:14):其中,x为赖氨酸(k)或不存在。iv.b7-h3-adc
[0173]
本发明涉及以上描述的缀合至细胞毒素药物的抗b7-h3抗体hmab-a,b7-h3-adc。这种b7-h3-adc提高了抗b7-h3疗法,特别地在治疗癌症中的细胞毒性。如以上指示的,本发明的b7-h3-adc由下式表示:ab-(lm)
m-(d)n,其中:ab是结合至包括人源化可变重链(vh)结构域和人源化可变轻链(vl)结构域的b7-h3的抗体,或其b7-h3-结合片段,和;d是细胞毒素倍癌霉素部分;lm是共价连接ab和d键或连接体分子;m是0和n之间的整数并且表示b7-h3-adc的键或连接体分子的数量,除了当lm是键时,m不是0;和n是1和10之间的整数并且表示共价连接至b7-h3-adc的细胞毒素倍癌霉素部分的数量。
[0174]
在某些实施方式中,本发明的b7-h3-adc包括igg1同种型的天然存在的fc结构域。这种fc结构域缺少ch3结构域的c-末端赖氨酸残基。在具体的实施方式中,b7-h3-adc将结合至表达b7-h3的肿瘤细胞,然后将通过受体-介导的内吞作用内化入这种细胞。一旦在溶酶体内部,b7-h3-adc将优选地被劣化以便从而导致细胞内部的细胞毒素倍癌霉素部分的释放,导致细胞死亡。如将理解的,细胞死亡的作用机制可基于使用的细胞毒素药物的类别改变(例如,由微管蛋白聚合抑制剂比如美登素(maytansine)和奥利斯达汀(auristatin)破坏胞质分裂,通过dna相互作用试剂比如加利车霉素(calicheamicin)和倍癌霉素的dna
损伤)等。当通过垂死的细胞在称为旁侧效应的过程中将游离药物释放入肿瘤环境中时,邻近的癌细胞也可被杀死(panowski,s.等(2014)“site-specific antibody drug conjugates for cancer therapy,”mabs 6(1):34-45;kovtun,y.v.等(2006)“antibody-drug conjugates designed to eradicate tumors with homogeneous and heterogeneous expression of the target antigen,”cancer res.66:3214-3221)。a.本发明的示例性连接体分子
[0175]
本发明特别地考虑这种b7-h3-adc,其中lm是连接体分子并且不存在(即,m=0),和b7-h3-adc拥有大于一个连接体分子lm(即,m是2至n的整数,其中n是2至10的整数),连接体分子lm的每一个将细胞毒素倍癌霉素部分d共价连接至这种b7-h3-adc的ab。
[0176]
本发明进一步提供了b7-h3-adc,它的ab共价连接至大于一个连接体分子lm,其中所有这种连接体分子是相同的。共价连接至这种b7-h3-adc的ab的细胞毒素倍癌霉素部分d可都是是相同的或可包括2、3、4或更多个独立地不同的细胞毒素倍癌霉素部分d。
[0177]
本发明进一步提供了这种b7-h3-adc,它的ab共价连接至大于一个连接体分子lm,其中所有这种连接体分子不是相同的并且可独立地不同。共价连接至这种b7-h3-adc的ab的细胞毒素倍癌霉素部分d可都是相同的或可包括2、3、4、或更多个独立地不同的细胞毒素倍癌霉素部分d。
[0178]
以上提供了结合人b7-h3的抗体的示例性人源化vh和vl结构域,和可包括在b7-h3-adc中的示例性人抗体恒定结构域。如以上叙述的,b7-h3-adc另外包括至少一个细胞毒素倍癌霉素部分,其直接或经侧链原子和倍癌霉素部分之间嵌入的连接体分子共价连接至这种vh结构域或vl结构域和/或恒定结构域的氨基酸残基的侧链的原子。连接体分子可以是非肽分子,或包括非肽部分和肽部分的分子,或其可以是仅包括氨基酸残基的分子。任何这种连接体分子的氨基酸残基可含有天然存在或非天然存在的氨基酸残基,包括天然存在的氨基酸残基的d-版本、对乙酰苯丙氨酸、硒代半胱氨酸等。任选地,或另外地,具有期望的侧链(例如,-ch
2-sh侧链、-ch
2-oh侧链、-ch(ch2)-sh侧链、-ch
2-ch
2-s-ch3侧链、-ch
2-c(o)-nh2侧链、-ch
2-ch
2-c(o)-nh2侧链、-ch
2-c(o)oh-侧链、ch
2-ch
2-c(o)oh-侧链、-ch
2-ch
2-ch
2-ch
2-nh2侧链、-ch
2-ch
2-ch
2-nh-c(nh2)2侧链、咪唑侧链、苄基侧链、酚侧链、吲哚侧链等)的特定残基可被工程化为b7-h3-adc。
[0179]
连接体分子lm在生理条件下可以是不可切割的,例如包括水解的稳定部分,例如,硫醚连接体或受阻的二硫键连接体(disulfide linker)。水解的稳定连接体在水中基本上稳定并且在有益的ph值下不与水反应,包括但不限于在生理条件下延长的一段时间。相反地,水解的不稳定或可降解的连接体在水中或在水溶液,包括例如血液中可降解。
[0180]
可替选地,连接体分子lm可以是可切割的,或可含有可切割的部分。这种可切割的部分的示例包括酸不稳定的连接体(例如,形成肼键的4-(4
’‑
乙酰苯氧基)丁酸连接体)、可切割的二硫键连接体(其在还原的细胞内环境中被切割),和蛋白酶可切割的连接体。酸不稳定的连接体被设计为在血液中遇到的ph水平下是稳定的,但当遇到溶酶体的低ph环境时变成不稳定的且降解。蛋白酶-可切割的连接体也被设计为在血液/血浆中是稳定的,但被溶酶体酶切割时在癌细胞中溶酶体内部快速释放游离药物(panowski,s.等(2014)“site-specific antibody drug conjugates for cancer therapy,”mabs 6(1):34-45)。可替选地,连接体分子可以是酶-可切割的-底物或含有酶-可切割的-底物,比如可切割的肽,(例
如,可切割的二肽比如缬氨酸-瓜氨酸二肽对氨基苯甲醇连接体(cac10-mc-vc-paba),其被溶酶体酶选择性切割)。合适的可切割的连接体是本领域已知的,参见,例如,de groot,franciscus m.h.等“design,synthesis,and biological evaluation of a dual tumor-specific motive containing integrin-targeted plasmin-cleavable doxorubicin prodrug,”molecular cancer therapeutics,1:901-911;dubowchik等(2002)“doxorubicin immunoconjugates containing bivalent,lysosomally-cleavable dipeptide linkages.”bioorganic&medicinal chemistry letters12:1529-1532;us专利号5547667、6,214,345、7,585,491、7,754,681、8,080,250、8,461,117和wo 02/083180。
[0181]
可采用酶不稳定的或可降解的连接体。这种连接体被一种或多种酶降解。仅通过示例,peg和相关聚合物可包括在聚合物骨架中以及在聚合物分子的聚合物骨架和一个或多个末端官能团之间的连接体基团中的可降解的连接体分子。这种可降解的连接体分子包括但不限于由peg羧酸或激活的peg羧酸与生物活性剂上的醇基团反应形成的酯链接,其中这种酯基团在生理条件下通常水解以释放生物活性剂。其他水解可降解的连接体分子包括但不限于碳酸基链接(linkage)、由胺和醛反应获得的亚胺链接、由醇与磷酸根基团反应形成的磷酸酯链接、是酰肼和醛的反应产物的腙链接、是醛和醇的反应产物的缩醛链接、是甲酸盐和醇反应产物的原酸酯链接、由包括但不限于聚合物比如peg的末端处的胺基团和肽的羧基形成的肽链接和由包括但不限于聚合物的末端处的亚磷酰胺基团和寡核苷酸的5'羟基形成的寡核苷酸链接。
[0182]
在一个实施方式中,本发明的连接体分子可以是,或可包括,可切割的连接体分子,v-(w)
k-(x)
1-a,如pct公布wo02/083180中公开的,产生具有下式的b7-h3-adc:ab
–
[v-(w)
k-(x)
1-a]
–
d其中:v是任选的可切割的部分,(w)
k-(x)
1-a是伸长的、自消除间隔子系统,其经l,(4+2n)-消除自消除,w和x各自是l,(4+2n)电子级联间隔子,是相同的或不同的,a是式(y)m的间隔子基团,其中y是l,(4+2n)电子级联间隔子,或式u的基团,为环化消除间隔子,k、1和m独立地为0(被包括)至5(被包括)的整数,n为0(被包括)至10(被包括)的整数,条件是:当a是(y)m时:则k+l+m≥1,和如果k+l+m=l,则n》l;当a是u时:t则k+1≥1。w、x和y独立地选自具有下式的化合物:
其中:q是-r5c=cr
6-、s、o、nr5、-r5c=n-或-n=cr
5-p是nr7、o或sa、b和c独立地是0(被包括)至5(被包括)的整数;i、f和g独立地是选自具有下式的化合物:其中r1、r2、r3、r4、r5、r6、r7、r8、和r9独立地表示h、c
1-6
烷基、c
3-20
杂环基、c
5-20
芳基、c
1-6
烷氧基、羟基(oh)、氨基(nh2)、单取代的氨基(nr
x
h)、双取代的氨基(nr
x1rx2
)、硝基(no2)、卤素、cf3、cn、conh2、so2me、conhme、环c
1-5
烷基氨基、咪唑基、c
1-6
烷基哌嗪基、吗啉基、巯基(sh)、硫醚基(sr
x
)、四唑、羧基(cooh)、羧酸基(coor
x
)、磺基(s(=o)2oh)、磺酸基(s(=o)2or
x
)、磺酰基(s(=o)2r
x
)、亚磺基(s(=o)oh)、亚磺酸基(s(=o)or
x
)、亚磺酰基(s(=o)r
x
)、膦酰氧基(op(=o)(oh)2)和磷酸基(op(=o)(or
x
)2),其中r
x
、r
x1
和r
x2
独立地选自c
1-6
烷基、c
3-20
杂环或c
5-20
芳基,取代基r1、r2、r3、r4、r5、r6、r7、r8、或r9的两个或更多个任选地彼此连接以形成一个或多个脂肪族或芳族环结构;u选自具有下式的化合物:其中:a、b和c独立地被选择为0或1的整数;条件是a+b+c=2或3;r1和/或r2独立地表示h、c1-6烷基,所述烷基任选地用以下基团的一个或多个取代:羟基(oh)、醚(or
x
)、氨基(nh2)、单取代的氨基(nr
x
h)、双取代的氨基(nr
x1rx2
)、硝基(no2)、卤素、cf3、cn、conh2、so2me、conhme、环c
1-5
烷基氨基、咪唑基、c
1-6
烷基哌嗪基、吗啉
基、巯基(sh)、硫醚基(sr
x
)、四唑、羧基(cooh)、羧酸基(coor
x
)、磺基(s(=o)2oh)、磺酸基(s(=o)2or
x
)、磺酰基(s(=o)2r
x
)、亚磺基(s(=o)oh)、亚磺酸基(s(=o)orx)、亚磺酰基(s(=o)rx)、膦酰氧基(op(=o)(oh)2)和磷酸基(op(=o)(or
x
)2),其中r
x
、r
x1
和r
x2
选自c
1-6
烷基、c
3-20
杂环基或c
5-20
芳基;和r3、r4、r5、r6、r7和r8独立地表示h、c
1-6
烷基、c
3-20
杂环基、c
5-20
芳基、c
1-6
烷氧基、羟基(oh)、氨基(nh2)、单取代的氨基(nr
x
h)、双取代的氨基(nr
x1rx2
)、硝基(no2)、卤素、cf3、cn、conh2、so2me、conhme、环c
1-5
烷基氨基、咪唑基、c
1-6
烷基哌嗪基、吗啉基、巯基(sh)、硫醚基(sr
x
)、四唑、羧基(cooh)、羧酸基(coor
x
)、磺基(s(=o)2oh)、磺酸基(s(=o)2or
x
)、磺酰基(s(=o)2r
x
)、亚磺基(s(=o)oh)、亚磺酸基(s(=o)or
x
)、亚磺酰基(s(=o)r
x
)、膦酰氧基(op(=o)(oh)2)和磷酸基(op(=o)(or
x
)2),其中r
x
、r
x1
和r
x2
选自c
1-6
烷基、c
3-20
杂环基或c
5-20
芳基,和取代基r1、r2、r3、r4、r5、r6、r7或r8的两个或更多个任选地彼此连接以形成一个或多个脂肪族或芳族环结构。
[0183]
示例性分子包括:对氨基苄氧基羰基-对氨基苄氧基羰基;对氨基苄氧基羰基-对氨基苄氧基羰基-对氨基苄氧基羰基;对氨基肉桂氧基羰基;对氨基肉桂氧基羰基-对氨基苄氧基羰基;对氨基-苄氧基羰基-对氨基肉桂氧基羰基;对氨基肉桂氧基羰基-对氨基肉桂氧基羰基;对氨基苯基戊二烯氧基羰基;对氨基苯基戊二烯氧基羰基-对氨基肉桂氧基羰基;对氨基苯基戊二烯氧基羰基-对氨基苄氧基羰基;对氨基苯基戊二烯氧基羰基-对氨基苯基戊二烯氧基羰基;对氨基苄氧基羰基(甲氨基)乙基(甲氨基)羰基;对氨基肉桂氧基羰基(甲氨基)乙基(甲氨基)羰基;对氨基苄氧基羰基-对氨基苄氧基羰基(甲氨基)乙基(甲氨基)羰基;对氨基肉桂氧基羰基-对氨基苄氧基羰基(甲氨基)乙基(甲氨基)羰基;对氨基苄氧基羰基-对氨基肉桂氧基羰基(甲氨基)乙基(甲氨基)-羰基;对氨基肉桂氧基羰基-对氨基肉桂氧基羰基(甲氨基)乙基(甲氨基)羰基;对氨基苄氧基羰基-对氨基苄基;对氨基苄氧基羰基-对氨基苄氧基羰基-对氨基苄基;对氨基肉桂基;对氨基肉桂氧基羰基-对氨基苄基;对氨基苄氧基羰基-对氨基肉桂基;对氨基-肉桂氧基羰基-对氨基肉桂基;对氨基苯基戊二烯基;对氨基苯基戊二烯氧基羰基-对氨基肉桂基;对氨基苯基戊二烯氧基羰基-对氨基苄基;和
cancer therapy,”mabs 6(1):34-45评论。b.本发明的示例性倍癌霉素部分
[0187]
倍癌霉素是首先从链霉菌属细菌中分离的一系列相关天然产物的成员并且他们是有效的抗肿瘤抗生素(参见dokter,w.等(2014)“preclinical profile of the her2-targeting adc syd983/syd985:introduction of a new duocarmycin-based linker-drug platform,”mol.cancer ther.13(11):2618-2629;boger,d.l.等(1991).“duocarmycins-a new class of sequence selective dna minor groove alkylating agents,”chemtracts:organic chemistry 4(5):329-349(1991);tercel等(2013)“the cytotoxicity of duocarmycin analogues is mediated through alkylation of dna,not aldehyde dehydrogenase 1:acomment,”chem.int.ed.engl.52(21):5442-5446;boger,d.l.等(1995)“cc-1065and the duocarmycins:unraveling the keys to a new class of naturally derived dna alkylating agents,”proc.natl.acad.sci.(u.s.a.)92(9):3642-3649;cacciari,b.等(2000)“cc-1065and the duocarmycins:recent developments,”expert opinion on therapeutic patents 10(12):1853-1871)。
[0188]
天然倍癌霉素包括倍癌霉素a、倍癌霉素b1、倍癌霉素b2、倍癌霉素c1、倍癌霉素c2、倍癌霉素d、倍癌霉素sa和cc-1065(pct公开号wo 2010/062171;martin,d.g.等(1980)(1980)“structure of cc-1065(nsc 298223),a new antitumor antibiotic,”j.antibiotics33:902-903;boger,d.l.等(1995)“cc-1065and the duocarmycins:unraveling the keys to a new class of naturally derived dna alkylating agents,”proc.natl.acad.sci.(u.s.a.)92:3642-3649)。
[0189]
合适的合成倍癌霉素类似物包括阿多来新、比折来新、卡折来新(u-80244)和螺旋-倍癌霉素(duba)(dokter,w。等(2014)“preclinical profile of the her2-targeting adc syd983/syd985:introduction of a new duocarmycin-based linker-drug platform,”mol.cancer ther.13(11):2618-2629;elgersma,r.c.等(2014)“design,synthesis,and evaluation of linker-duocarmycin payloads:toward selection of her2-targeting antibody-drug conjugate syd985,”mol.pharmaceut.12:1813-1835):
[0190]
另外合成的倍癌霉素类似物包括pct公开号wo2010/062171中公开的那些,并且特别地这种具有下式的类似物:
或其药学上可接受的盐、水合物或溶剂化物,其中db是dna-结合部分并且选自由下述组成的组中:其中:r是离去基团;r2、r
2'
、r3、r
3'
、r4、r
4'
、r
12
、和r
19
独立地选自h、oh、sh、nh2、n3、no2、no、cf3、cn、c(o)nh2、c(o)h、c(o)oh、卤素、ra、sra、s(o)ra、s(o)2ra、s(o)ora、s(o)2ora、os(o)ra、os(o)2ra、os(o)ora、os(o)2ora、ora、nhra、n(ra)rb、+n(ra)(rb)rc、p(o)(ora)(orb)、op(o)(ora)(orb)、sirarbrc、c(o)ra、c(o)ora、c(o)n(ra)rb、oc(o)ra、oc(o)ora、oc(o)n(ra)rb、n(ra)c(o)rb、n(ra)c(o)orb和n(ra)c(o)n(rb)rc,其中ra、rb和rc独立地选自h和任选地取代的c
1-3
烷基或c
1-3
杂烷基,或r3+r
3'
和/或r4+r
4'
独立地选自=o、=s、=nor
18
、=c(r
18
)r
18'
和=nr
18
,r
18
和r
18'
独立地选自h和任选地取代的c
1-3
烷基,r2、r
2'
、r3、r
3'
、r4、r
4'
和r
12
的两个或更多个任选地被一个或多个键连接以形成一个或多个任选地取代的碳环和/或杂环;x2选自o、c(r
14
)(r
14'
)和nr
14'
,其中r
14
和r
14'
具有与r7的定义相同的含义并且是独立地选择的,或r
14'
和r
7'
不存在,导致指定携带r
7'
和r
14'
的原子之间是双键;r5、r
5'
、r6、r
6'
、r7、和r
7'
独立地选自h、oh、sh、nh2、n3、no2、no、cf3、cn、c(o)nh2、c(o)h、c(o)oh、卤素、re、sre、s(o)re、s(o)2re、s(o)ore、s(o)2ore、os(o)re、os(o)2re、os(o)ore、os(o)2ore、ore、nhre、n(re)rf、
+
n(re)(rf)rg、p(o)(ore)(orf)、op(o)(ore)(orf)、sirerfrg、c(o)re、c(o)ore、c(o)n(re)rf、oc(o)re、oc(o)ore、oc(o)n(re)rf、n(re)c(o)rf、n(re)c(o)orf、n(re)c(o)n(rf)rg和水溶性基团,
其中re、rf和rg独立地选自h和任选地取代的(ch2ch2o)
ee
ch2ch2x
13re1
、c
1-15
烷基、c
1-15
杂烷基、c
3-15
环烷基、c
1-15
杂环烷基、c
5-15
芳基或c
1-15
杂芳基,其中ee选自1至1000,x
13
选自o、s和nr
f1
,和r
f1
和r
e1
独立地选自h和c
1-3
烷基,re、rf和/或rg中的一个或多个任选的取代基任选地为水溶性基团,re、rf和rg的两个或更多个任选地被一个或多个键连接以形成一个或多个任选地取代的碳环和/或杂环,或r5+r
5'
和/或r6+r
6'
和/或r7+r
7'
独立地选自=o、=s、=nor
e3
、=c(r
e3
)r
e4
和=nr
e3
,r
e3
和r
e4
独立地选自h和任选地取代c
1-3
烷基,或r
5'
+r
6'
和/或r
6'
+r
7'
和/或r
7'
+r
14
不存在,导致指定分别携带r
5'
+r
6'
和/或r
6'
+r
7'
和/或r
7'
+r
14'
的原子之间是双键,r5、r
5'
、r6、r
6'
、r7、r
7'
、r
14
和r
14'
的两个或更多个任选地被一个或多个键连接以形成一个或多个任选地取代的碳环和/或杂环;x1选自o、s和nr,其中r选自h和任选地取代的c
1-8
烷基或c
1-8
杂烷基并且不与任何其他取代基连接;x3选自o、s、c(r
15
)r
15'
、-c(r
15
)(r
15'
)-c(r
15”)(r
15”')-、-n(r
15
)-n(r
15'
)-、-c(r
15
)(r
15'
)-n(r
15"
)-、-n(r
15"
)-c(r
15
)(r
15'
)-、-c(r
15
)(r
15'
)-o-、-o-c(r
15
)(r
15'
)-、-c(r
15
)(r
15'
)-s-、-s-c(r
15
)(r
15'
)-、-c(r
15
)=c(r
15'
)-、=c(r
15
)-c(r
15'
)=、-n=c(r
15'
)-、=n-c(r
15'
)=、-c(r
15
)=n-、=c(r
15
)-n=、-n=n-、=n-n=、cr
15
、n、nr
15
,或在db1和db2-x3-中表示-x
3a
和x
3b-,其中x
3a
连接至x
34
,双键在x
34
和x4之间存在,和x
3b
连接至x
11
,其中x
3a
独立地选自h和任选地取代的(ch2ch2o)
ee
ch2ch2x
13re1
、c
1-8
烷基或c
1-8
杂烷基并且不与任何其他取代基连接;x4选自o、s、c(r
16
)r
16'
、nr
16
、n和cr
16
;x5选自o、s、c(r
17
)r
17'
、nor
17
和nr
17
,其中r
17
和r
17'
独立地选自h和任选地取代的c
1-8
烷基或c
1-8
杂烷基并且不与任何其他取代基连接;x6选自cr
11
、cr
11
(r
11'
)、n、nr
11
、o和s;x7选自cr8、cr8(r
8'
)、n、nr8、o和s;x8选自cr9、cr9(r
9'
)、n、nr9、o和s;x9选自cr
10
、cr
10
(r
10'
)、n、nr
10
、o和s;x
10
选自cr
20
、cr
20
(r
20'
)、n、nr
20
、o和s;x
11
选自c、cr
21
和n,或x
11-x
3b
选自cr
21
、cr
21
(r
21'
)、n、nr
21
、o和s;x
12
选自c、cr
22
和n;x
6*
、x
7*
、x
8*
、x
9*
、x
10*
和x
11*
具有分别与x6、x7、x8、x9、x
10
和x
11
定义的相同含义,并且是独立地选择的;x
34
选自c、cr
23
和n;db6和db7中x
11*
的环b原子连接至环a的环原子,使得db6和db7中的环a和环b经单键直接连接;虚线双键意味着指定的键可以是单键或非累积的、任选地离域的双键;r8、r
8'
、r9、r
9'
、r
10
、r
10'
、r
11
、r
11'
、r
15
、r
15'
、r
15"
、r
15"
、r
16
、r
16'
、r
20
、r
20'
、r
21
、r
21'
、r
22
、和r
23
各自独立地选自h、oh、sh、nh2、n3、no2、no、cf3、cn、c(o)nh2、c(o)h、c(o)oh、卤素、rh、srh、s(o)rh、s(o)2rh、s(o)orh、s(o)2orh、os(o)rh、os(o)2rh、os(o)orh、os(o)2orh、orh、nhrh、n(rh)ri、
+
n(rh)(ri)rj、p(o)(orh)(ori)、op(o)(orh)(ori)、sirhr
irj
、c(o)rh、c(o)orh、c(o)n(rh)ri、oc(o)rh、oc(o)
orh、oc(o)n(rh)ri、n(rh)c(o)ri、n(rh)c(o)ori、n(rh)c(o)n(ri)rj和水溶性基团,其中rh、ri和rj独立地选自h和任选地取代的(ch2ch2o)
ee
ch2ch2x
13re1
、c
1-15
烷基、c
1-15
杂烷基、c
3-15
环烷基、c
1-15
杂环烷基、c
5-15
芳基或c
1-15
杂芳基,rh、ri和/或rj中的一个或多个任选的取代基任选地为水溶性基团,rh、ri和rj的两个或更多个任选地被一个或多个键连接以形成一个或多个任选地取代的碳环和/或杂环,或r8+r
8'
和/或r9+r
9'
和/或r
10
+r
10'
和/或r
11
+r
11'
和/或r
15
+r
15'
和/或r
15"
+r
15'"
和/或r
16
+r
16'
和/或r
20
+r
20'
和/或r
21
+r
21'
独立地选自=o、=s、=nor
h1
、=c(r
hl
)r
h2
和=nr
hl
,r
hl
和r
h2
独立地选自h和任选地取代的c
1-3
烷基,r8、r
8'
、r9、r
9'
、r
10
、r
10'
、r
11
、r
11'
、r
15
、r
15'
、r
15"
、r
15'"
、r
16
、r
20
、r
20'
、r
21
、r
21'
、r
22
和r
23
的两个或更多个任选地被一个或多个键连接以形成一个或多个任选地取代的碳环和/或杂环;r
8b
和r
9b
是独立地选择的并且具有与r8相同的含义,除了它们不可与任何其他取代基连接;r4和r
4'
之一和r
16
和r
16'
之一可任选地被一个或多个键连接以形成一个或多个任选地取代的碳环和/或杂环;r2、r
2'
、r3和r
3'
之一和r5和r
5'
之一可任选地被一个或多个键连接以形成一个或多个任选地取代的碳环和/或杂环;a和b独立地选自0和1;db部分不包括dai、da2、dai
'
或da2
'
部分;db1中的环b是杂环;如果db1中的x3表示-x
3a
和x
3b-并且环b是芳族,则连接所述环b上两个邻近取代基以形成融合至所述环b的任选地取代的碳环或杂环;如果db2中的x3表示-x
3a
和x
3b-并且环b是芳族,则连接所述环b上两个邻近取代基以形成融合至所述环b的任选地取代的杂环、融合至所述环b的任选地取代的非芳族碳环或融合至所述环b的取代的芳族碳环,并且其所连接的至少一个取代基含有羟基、伯氨基或仲氨基,伯或仲胺既不是芳族环系统中的环原子,也不是酰胺的部分;如果db2中的环a是6元芳族环,则环b上的取代基不连接以形成融合至环b的环;db8中环a上的两个邻近取代基连接以形成融合至所述环a的任选地取代的碳环或杂环,以形成没有进一步环融合的双环部分;和db9中的环a与融合至所述环a的任何环一起含有至少两个环杂原子。
[0191]
可使用巯基-马来酰亚胺化学将以上描述的连接体分子缀合至半胱氨酸巯基,如以上显示的。在一些实施方式中,细胞毒素倍癌霉素部分是前药。例如,前药,vc-seco-duba经可切割的肽部分可缀合至连接至马来酰亚胺连接体部分的自消除部分:
[0192]
分子的马来酰亚胺连接体部分可缀合至b7-h3-adc的ab部分的vl结构域和/或vh结构域和/或恒定结构域的半胱氨酸残基的巯基。随后蛋白水解切割的可切割的肽部分跟随自消除部分的自发消除,导致自发重排以形成活性药物,duba的seco-duba的释放:(参见,dokter,w.等(2014)“preclinical profile of the her2-targeting adc syd983/syd985:introduction of a new duocarmycin-based linker-drug platform,”mol.cancer ther.13(11):2618-2629)。
[0193]
用于产生b7-h3-倍癌霉素药物部分缀合物的示例性方法中,将采用elgersma,r.c.等(2014)“design,synthesis,and evaluation of linker-duocarmycin payloads:toward selection of her2-targeting antibody-drug conjugate syd985,”mol.pharmaceut.12:1813-1835的方法或wo 2011/133039的方法。因此,抗b7-h3抗体或抗体片段的vl或vh链的含有巯基的基团通过马来酰亚胺连接体部分-可切割的肽部分-自消除部分缀合至seco-duba或其他前药(方案3a):
[0194]
尽管本发明关于duba前药进行说明,其他前药,例如cc-1065可以可替选地被采用,如方案3b中显示的:
[0195]
可切割的肽部分的切割和自消除部分的消除后,前药部分被认为经历winstein螺环化产生活性药物(例如,如方案3c中显示的来自seco-duba的duba)。
[0196]
seco-duba是从相应的dna-烷基化和dna-结合部分(例如,如由elgersma,r.c.(2014)“design,synthesis,and evaluation of linker-duocarmycin payloads:toward selection of her2-targeting antibody-drug conjugate syd985,”mol.pharmaceut.12:1813-1835描述的1,2,9,9a-四氢环丙烷-[c]苯并[e]吲哚-4-酮框架)制备的(参见,boger,d.l.(1989)“total synthesis and evaluation of(
±
)-n-(tert-butoxycarbonyl)-cbi,(
±
)-cbi-cdpi1,and(
±
)-cbi-cdpi2:cc-1065functional agents incorporating the equivalent 1,2,9,9a-tetrahydrocyclopropa[1,2-c]benz[1,2-e]indol-4-one(cbi)left-hand subunit,”j.am.chem.soc.111:6461-6463;boger,d.l.等(1992)“dna alkylation properties of enhanced functional analogs of cc-1065 incorporating the 1,2,9,9a-tetrahydrocyclopropa[1,2-c]benz[1,2-e]indol-4-one(cbi)alkylation subunit,”j.am.chem.soc.114:5487-5496)。
[0197]
方案3d通过显示用于duba的dna-烷基化部分的合成阐释了发明。因此,邻甲苯甲醛(1)和二甲基琥珀酸酯(2)通过stobbe缩合反应以产生酸的混合物(3a/3b)。酸的混合物的闭环可用三氟乙酸酐完成并且得到醇(4),其然后用苄基氯化物保护以提供苄醚(5)。接着发生的甲基酯基团的水解产生羧酸(6),其随后为甲苯和叔丁基醇的混合物中的curtius重排以提供氨基甲酸酯(7)。用n-溴代琥珀酰亚胺溴化得到溴化物(8)。在叔丁醇钾存在的情况下,溴化物(8)用(s)-间硝基苯磺酸缩水甘油酯烷基化以得到环氧化物(9)。与正丁基锂反应提供期望的化合物(10)的混合物并且脱溴,重排衍生物(11)。当四氢呋喃用作溶剂和反应温度保持在-25和-20℃之间时,期望的化合物(10)的产率更高。在这些条件下,期望的化合物(10)和脱溴、重排衍生物(11)是以近似1:1比例获得的。用对甲苯磺酸检查(workup)导致脱溴、重排衍生物(11)转化为至(7),从而有助于期望的化合物(10)的恢复。(10)中羟基的甲磺酰化随后使用氯化锂通过氯化物置换得到关键的中间体(12)。
[0198]
方案3e通过显示用于duba的dna-结合部分的合成阐释了本发明。因此,允许chichibabin环化反应在溴丙酮酸乙酯(13)和5-硝基吡啶-2-胺(14)之间进行,从而获得硝基化合物(15)。在酸性条件下,用锌还原硝基得到胺(16)。用甲氧甲基(mom)-保护的4-羟基苯甲酸(17)(其通过与氯甲基甲醚反应,随后酯水解从甲基4-羟基苯甲酸酯制备的(参见,wo 2004/080979))偶联,得到乙基酯(18),其可在水性1,4-二恶烷中用氢氧化钠水解以提供酸(19)。
[0199]
然后seco-duba从dna-烷基化单元(12)和dna-结合部分(19)合成。在酸性条件下从(12)去除叔丁氧基羰基(boc)保护基团以形成胺(20)。edc-介导的胺(20)和化合物(19)的偶联产生保护的化合物(21),然后其在两个连续的步骤中完全脱保护(用pd/c、nh4hco2、meoh/thf、3小时、90%以产生(22),并且然后用hcl、1,4-二恶烷/水、1h、95%以提供seco-duba(23)作为其hcl盐(方案3f)。
[0200]
其他药物的前药,例如cc-1065,可如例如wo2010/062171中描述的合成。
[0201]
根据方案3g,前药部分可连接至adc的其他部分。马来酰亚胺连接体基础部分通过以(24)和2-(2-氨基乙氧基)乙醇(25)之间的缩合反应开始来合成以得到醇(26),其然后通过与4-硝基苯基氯甲酸酯反应转化为为反应性碳酸酯(27)。(27)与h-缬氨酸-瓜氨酸-paba(28)(根据dubowchik,g.m.等“cathepsin b-labile dipeptide linkers for lysosomal release of doxorubicin from internalizing immunoconjugates:model studies of enzymatic drug release and antigen-specific in vitro anticancer activity,”bioconjugate chem.13:855-869)制备的)的偶联导致连接体(29)的形成,连接体(29)用双(4-硝基苯基)碳酸酯处理以得到激活的连接体(30)。
如方案3h中显示的,seco-duba-mom(22)被修饰用于在两个步骤中缀合。(22)与4-硝基苯基氯甲酸酯和叔丁基甲基(2-(甲氨基)乙基)氨基甲酸酯(31)的连续处理得到化合物(32)。用三氟乙酸(tfa)去除(32)中的boc和mom保护基团提供(33)作为其tfa盐。
[0202]
在稍微碱性的条件下,adc通过激活的连接体(30)与环化间隔子-倍癌霉素构建体(33)的反应合成。在这些条件下,环化间隔子的自消除和3a的所得形成被抑制(方案3i)。
[0203]
工艺生成每个mab平均两个游离巯基,导致b7-h3-adc的统计分布,其中约二的平均药物与抗体比例(dar),和少量的高分子量物种和残留的未缀合的倍癌霉素部分。
[0204]
合成步骤的顺序可如期望的改变。特别地考虑使用的方法将是方案3a-3i的方法,如以上描述的。v.示例性pd-1结合分子
[0205]
本发明的pd-1结合分子包括双特异性分子(例如,双特异性抗体、双特异性双抗体等),嵌合或人源化抗体和具有变体fc区的这种结合分子。这种pd-1结合分子能够结合至人pd-1(cd279)的连续的或不连续的(例如,构象)部分(表位)。本发明的pd-1结合分子还将优选地展示出结合一种或多种非人物种,特别地灵长类物种(和尤其是灵长类物种比如食蟹猴)的pd-1分子的能力。包括20种氨基酸残基信号序列和268种氨基酸残基成熟蛋白质的代表性人pd-1多肽由ncbi序列np_005009.2(seq id no:22)提供。
[0206]
对pd-1特异性的抗体是已知的(参见,例如,美国专利号7,488,802、7,521,051、7,595,048、8,008,449、8,354,509、8,735,553、8,779,105、8,900,587、9,084,776、10,577,422;pct专利公布wo 2004/056875、wo 2006/121168、wo 2008/156712、wo 2012/135408、wo 2012/145493、wo 2013/014668、wo 2014/179664、wo 2014/194302、wo 2015/112800和wo2019/246110)。另外期望的抗体可通过将使用pd-1或其肽片段引起的抗体-分泌杂交瘤分离来制造。合适的抗体包括尼伏鲁单抗((cas登记号:946414-94-4,也称为5c4、bms-936558、ono-4538、mdx1106并且由bristol-myers squibb作为销售);(尼伏鲁单抗的氨基酸序列在who药物信息,2013,推荐的inn:列表69,27(1):68-69)中提供)和派姆单抗((之前称为帕博利珠抗体(lambrolizumab)),cas登记号:1374853-91-4,也称为mk-3475、sch-900475并且由merck作为销售);(派姆单抗的氨基酸序列在who药物信息,2014,推荐的inn:列表75,28(3):407)中提供)。以下提供了这些抗体的vh和vl结构域的氨基酸序列。
[0207]
本发明的pd-1结合分子可包括igg4重链恒定区,或含有减少adcc效应子功能的一个或多个置换(例如,含有任何1、2、3或4个置换:l234a、l235a、d265a、n297q和n297g,如以上描述的)的变体igg1重链恒定区,代替野生型igg1重链恒定区。这种变体重链恒定区用于减少或消除抗体的fc结构域结合至fcγriiia(cd16a)细胞受体的能力。因此,使用igg4重链恒定区或这种变体igg1重链恒定区减少或消除与使用具有野生型igg1 fc结构域的抗体相关的抗体-依赖性细胞-介导的细胞毒性(adcc)效应子功能。以上提供了示例性人igg4的ch2-ch3结构域的氨基酸序列(seq id no:9)。
[0208]
当本发明的pd-1结合分子包括igg4重链恒定区时,优选也采用igg4 ch1结构域(seq id no:6)和igg4铰链结构域,特别地包括kabat s228p置换的修饰的igg4铰链结构域((seq id no:7),因为该修饰使igg4铰链结构域稳定。a.尼伏鲁单抗
[0209]
尼伏鲁单抗的vh结构域的氨基酸序列具有氨基酸序列(seq id no:36)(cdrh残基加下划线显示):
[0210]
尼伏鲁单抗的vl结构域的氨基酸序列具有氨基酸序列(seq id no:35)(cdr
l
残基加下划线显示):b.派姆单抗
[0211]
派姆单抗的vh结构域的氨基酸序列具有氨基酸序列(seq id no:34)(cdrh残基加下划线显示):
[0212]
派姆单抗的vl结构域的氨基酸序列具有氨基酸序列(seq id no:33)(cdr
l
残基加下划线显示):c.hpd-1 mab-a
[0213]
在某些实施方式中,pd-1结合分子包括hpd-1 mab-a的vh和vl结构域。以下提供了hpd-1 mab-a的氨基酸序列,并且还在美国专利号10,577,422中和pct公布wo 2017/062619、wo2017/019846和wo2019/246110中公开。hpd-1 mab-a也称为瑞弗利单抗(retifanlimab),mga012和incmga-00012(cas登记号:2079108-44-2,其是由incyte和macrogenics,inc.共同开发的)。以下显示了hpd-1 mab-a的氨基酸序列并且在who药物信息2019,推荐的inn:列表82,33(1):611-612中提供。
[0214]
以下显示了hpd-1 mab-a的vh结构域的氨基酸序列(seq id no:32)(cdrh残基加下划线显示):
[0215]
以下显示了包括hpd-1 mab-a的vl结构域和igg4ch1-稳定的h-ch2-ch3结构域的人源化抗体hpd-1 mab-a的重链的氨基酸序列(seq id no:30):
[0216]
在seq id no:30中,氨基酸残基1-119对应于hpd-1 mab-a的vh结构域(seq id no:32),氨基酸残基120-217对应于igg4 ch1结构域(seq id no:4),氨基酸残基218-229对应于包括kabat s228p置换(加下划线的)的稳定化的igg4铰链结构域(seq id no:7)和氨基酸残基230-445对应于igg4 ch2-ch3结构域(seq id no:9),但缺少c-末端赖氨酸残基。
重链的n末端谷氨酰胺可被环化以形成焦谷氨酸。n-连接的糖基化位点在kabat位置296处存在(加双下划线)。
[0217]
以下显示了hpd-1 mab-a的vl结构域的氨基酸序列(seq id no:31)(cdrh残基加下划线显示):
[0218]
以下显示了包括hpd-1 mab-a的vl结构域和clκ结构域的人源化抗体hpd-1 mab-a的轻链的氨基酸序列(seq id no:29):
[0219]
在seq id no:29中,氨基酸残基1-111对应于hpd-1 mab-a的vl结构域(seq id no:31),和氨基酸残基112-218对应于轻链κ恒定区(seq id no:1)。d.pd-1 x lag-3双特异性分子
[0220]
在某些实施方式中,pd-1结合分子是结合至pd-1和lag-3的双特异性分子。用于治疗癌症和/或与病原体相关的疾病的pd-1 x lag-3双特异性分子在pct公开号wo 2015/200119、wo 2017/025498、wo 2018/083087、wo 2018/185043、wo 2018/134279和wo 2018/217940中描述。在具体的实施方式中,双特异性分子是pd-1 x lag-3双特异性双抗体。pd-1 x lag-3双特异性双抗体具有新的pd-1和lag-3结合结构域并且示例性活性在wo 2017/019846中描述。在具体的实施方式中,双抗体是“pd-1 x lag-3 bd”。pd-1 x lag-3 bd是四条链、含有fc区的双抗体,其具有对pd-1特异性的两个结合位点、对lag-3特异性的两个结合位点、fc区和含有半胱氨酸的e/k-螺旋异源二聚体促进结构域。pd-1 x lag-3 bd的一般结构在图1中提供。pd-1 x lag-3 bd包括结合至pd-1的人源化抗体的vl和vh结构域和还包括结合至lag-3的人源化抗体的vl和vh结构域。因此,pd-1 x lag-3 bd能够特异性结合至pd-1的表位和lag-3的表位。
[0221]
pd-1 x lag-3 bd包括四条多肽链。pd-1 x lag-3 bd的第一和第三多肽链包括,在n-末端至c-末端方向上:n-末端、能够结合至lag-3的单克隆抗体的vl结构域(seq id no:45;以下seq id no:37中加粗和加下划线)、间插连接体肽(连接体1:gggsgggg(seq id no:10))、能够结合至pd-1的单克隆抗体的vh结构域(seq id no:32;以下seq id no:37中加粗和加双下划线)、含有半胱氨酸的间插连接体肽(连接体2:ggcggg(seq idno:11))、含有半胱氨酸的异源二聚体促进(e-螺旋)结构域(evaacek-evaalek-evaalek-evaalek(seq id no:12))、包括稳定化的igg4铰链区的间插连接体肽(连接体3)(seq id no:7)、包括置换m252y/s254t/t256e且缺少c-末端残基的变体igg4 ch2-ch3结构域(seq id no:14)和c-末端。
[0222]
pd-1 x lag-3 bd的第一和第三多肽链的氨基酸序列是(seq id no:37):
[0223]
pd-1 x lag-3 bd的第二和第四多肽链包括,在n-末端至c-末端方向上:n-末端、能够结合至pd-1的单克隆抗体的vl结构域(seq id no:31;以下seq id no:38中加粗和加下划线)、间插连接体肽(连接体1:gggsgggg(seq id no:10))、能够结合至lag-3的单克隆抗体的vh结构域(seq id no:46;以下seq id no:38中加粗和加双下划线)、含有半胱氨酸的间插连接体肽(连接体2:ggcggg(seq id no:11))、含有半胱氨酸的异源二聚体促进(k-螺旋)结构域(kvaacke-kvaalke-kvaalke-kvaalke(seq id no:13)和c-末端。
[0224]
pd-1 x lag-3 bd的第二和第四多肽链的氨基酸序列是(seq id no:38):vi.生产方法
[0225]
本发明的结合分子(例如,b7-h3-adc、hpd-1 mab a和pd-1 x lag-3 bd)可使用本领域已知的用于产生重组蛋白质的任何方法重组制备和表达。例如,编码这种结合分子的多肽链的核酸可被构建,引入至表达载体,并且在合适的宿主细胞中表达。结合分子可在细菌细胞(例如,大肠杆菌细胞),或真核细胞(例如,cho、293e、cos、ns0细胞)中重组产生。另外,结合分子可在酵母细胞比如毕赤酵母属或酵母菌属中表达。
[0226]
为了产生结合分子(例如,b7-h3-adc、hpd-1 mab a和pd-1 x lag-3 bd),编码分子的一个或多个多核苷酸可被构建,引入至表达载体,并且然后在合适的宿主细胞中表达。使用标准分子生物学技术以制备重组表达载体、转染宿主细胞、对转化株进行选择、培养宿主细胞和恢复分子(参见,例如,green,m.r.等(2012),molecular cloning,a laboratory manual,4th ed.,cold spring harbor laboratory,cold spring harbor,ny和ausubel等eds.,1998,current protocols in molecular biology,john wiley&sons,ny中描述的技
术)。表达载体应具有允许载体在宿主细胞中复制的特征。载体还应具有对在宿主细胞中的表达必要的启动子和信号序列。这种序列是本领域众所周知的。除了编码这种结合分子的核酸序列,重组表达载体可携带另外序列,比如调节载体在宿主细胞中的复制(例如,复制的起始)和可选择的标志物基因的序列。可采用的另一方法是在植物(例如,烟草)或转基因动物中表达基因序列。已经公开了用于在植物或牛奶中重组地表达这种结合分子的合适的方法(参见,例如,peeters等(2001)“production of antibodies and antibody fragments in plants,”vaccine 19:2756;美国专利号5,849,992;和pollock等(1999)“transgenic milk as a method for the production of recombinant antibodies,”j.immunol methods 231:147-157)。
[0227]
在结合分子被重组表达后,其可通过本领域已知的用于纯化多肽或多蛋白的任何方法从宿主细胞的内部或外部(比如从培养基)纯化。通常用于抗体纯化的分离和纯化方法(例如,基于抗原选择性的抗体纯化方案)可用于这种分子的分离和纯化并且不限于任何特定方法。例如,通过例如柱层析、过滤、超滤、盐析、溶剂沉淀、溶剂提取、蒸馏、免疫沉淀、sds-聚丙烯酰胺凝胶电泳、等电聚焦、透析和重结晶。层析包括例如离子交换、亲和力,特别是通过对特定抗原的亲和性(任选地在protein a选择后,其中pd-1 x lag-3 bd包括fc区)、尺寸柱色谱法(sizing column chromatography)、疏水性、凝胶过滤、逆相和吸附(marshak等(1996)strategies for protein purification and characterization:a laboratory course manual.(eds.),cold spring harbor laboratory press,cold spring harbor,ny)。vii.药物组合物
[0228]
本发明的b7-h3-adc和pd-1结合分子(例如,hpd-1 mab-a和/或pd-1 x lag-3 bd)可被配制为组合物。本发明的组合物包括可用于制造药物组合物的原料药组合物(例如,不纯的或非灭菌的组合物)和可用于制备单位剂型的药物组合物(即,适合于施用至受试者或患者的组合物)。这种组合物包括预防或治疗有效量的本发明的b7-h3-adc、一种或多种pd-1结合分子或其组合,和一种或多种药学上可接受的载体和可任选地另外包括一种或多种另外的治疗剂。药物组合物可以例如,作为水溶液或特别地适合于用这种药学上可接受的载体重配(reconstitution)或用这种载体重构(reconstituted)的干燥冻干粉或无水浓缩物供应。
[0229]
如本文使用的,术语“药学上可接受的载体”意味着被联邦政府或州政府管理机构批准的或列于美国药典或其他通常认可的药典的适于施用至动物,更特别是用于人的稀释剂、溶剂、分散介质、抗细菌剂和抗真菌剂、赋形剂或媒介物。这种药学载体可以是无菌液体,比如水和油,包括石油、动物、植物或合成来源的那些。也可采用生理盐水(saline)溶液和葡聚糖水溶液和甘油溶液作为液体载体,特别地用于可注射的溶液。组合物,如果期望,也可含有少量的湿润剂或乳化剂,或ph缓冲剂。这些组合物可采用溶液、悬浮液、乳液、片剂、丸剂、胶囊、粉末、缓释制剂等的形式。
[0230]
一般而言,组合物的成分被单独供应或以剂量形式混合在一起,例如作为干燥冻干粉或无水浓缩物,或作为在标明活性剂的量的气密密封容器比如小瓶、安瓿或小袋(sachet)中的水溶液。当通过输注施用组合物时,其可以用含有无菌药物级水或生理盐水的输注瓶分配。当通过注射施用组合物时,则可提供注射用无菌水、生理盐水或其他稀释剂
的安瓿,以便可以在施用前混合成分。viii.药物试剂盒
[0231]
本发明还提供包括一个或多个含有药物组合物(一种或多种)和指导材料(例如,通知、包装插页、说明书等)的容器的药物包装或试剂盒。另外地,用于疾病治疗的一种或多种其他预防或治疗剂也可以包括在药物试剂盒中。这种药物试剂盒的容器可,例如,包括一个或多个气密密封小瓶、安瓿、小袋等,其标明其中含有的活性剂的量。当通过输注施用组合物时,容器可以是输注瓶子、袋等,其含有无菌药学级溶液(例如,水、生理盐水、缓冲液等)。当通过注射施用组合物时,药物试剂盒可含有注射用无菌水、生理盐水或其他稀释剂的安瓿,以便促进向受试者(例如,人患者或其他哺乳动物)施用的药物试剂盒的组分混合。在某些实施方式中,药物包装或试剂盒包括b7-h3-adc药物组合物和指导材料。在其他实施方式中,药物包装或试剂盒包括b7-h3-adc药物组合物和pd-1结合分子组合物以及指导材料。
[0232]
在一个实施方式中,这种试剂盒的b7-h3-adc和/或pd-1结合分子(例如,hpd-1 mab-a和/或pd-1 x lag-3 bd)在气密密封容器中作为干燥灭菌冻干粉或无水浓缩物供应并且可以,例如,用水、生理盐水或其他稀释剂重构至用于施用给受试者的合适的浓度。在另一实施方式中,这种试剂盒的b7-h3-adc和/或pd-1结合分子(例如,hpd-1 mab-a和/或pd-1 x lag-3 bd)在气密密封容器中以水溶液供应并且可以,例如,用水、生理盐水或其他稀释剂稀释至施用给受试者的合适的浓度。试剂盒可进一步在一个或多个容器中包括对治疗癌症有用的一种或多种其他预防剂和/或治疗剂;和/或试剂盒可进一步包括结合一种或多种与癌症相关的癌症抗原的一种或多种细胞毒素抗体。在某些实施方式中,其他预防剂或治疗剂是化疗剂。在其他实施方式中,预防剂或治疗剂是生物或激素治疗剂。
[0233]
药物试剂盒包括的指导材料可以是,例如,由管理药物或生物产品的制造、使用或销售的政府机关规定的内容和格式,并且可指示由用于人施用和/或用于人疗法的药物组合物的制造、销售或使用的机关的批准。指导材料可,例如提供关于药物组合物的所含有的剂量、如何施用其的方式等的信息。这种指导可进一步提供关于试剂盒中未提供的一种或多种药物组合物的剂量和施用的信息。
[0234]
因此,例如,药物试剂盒包括的指导材料可指导所提供的药物组合物与在相同的药物试剂盒中或在分开的药物试剂盒中可提供的另外试剂组合施用。这种指导材料可指导所提供的b7-h3-adc药物组合物包括,或被重构以施用约0.5mg/kg至约2mg/kg、约2mg/kg至约3mg/kg、约2mg/kg至约2.25mg/kg、约2.25mg/kg至约2.5mg/kg、约2.5mg/kg至约2.75mg/kg、约2.75mg/kg至约3mg/kg、约3mg/kg至约4mg/kg、约3mg/kg至约3.25mg/kg、约3.25mg/kg至约3.5mg/kg、约3.5mg/kg至约3.75mg/kg、约3.75mg/kg至约4mg/kg、约4mg/kg至约5mg/kg、约4mg/kg至约4.25mg/kg、约4.25mg/kg至约4.5mg/kg、约4.5mg/kg至约4.75mg/kg或约5mg/kg的剂量。这种指导材料可指导所提供的b7-h3-adc药物组合物包括,或被重构以施用约0.5mg/kg、约1mg/kg、约1.5mg/kg、约2mg/kg、约2.25mg/kg、约2.5mg/kg、约2.75mg/kg、约3mg/kg、约3.25mg/kg、约3.5mg/kg、约3.75mg/kg、约4mg/kg、约4.25mg/kg、约4.5mg/kg、约4.75mg/kg或约5mg/kg的剂量。这种指导材料可指导约每2周一次、约每3周一次、约每4周一次或通常更多或更少(more or less)施用所提供的b7-h3-adc药物组合物。这种指导材料可指导还施用pd-1结合分子药物组合物。这种指导材料可指导pd-1结合分子药物组合物包
括,或被重构以施用约120mg至约800mg的固定剂量。这种指导材料可指导pd-1结合分子药物组合物包括,或被重构以施用约120mg、约200mg、约240mg、约300mg、约375mg、约400mg、约480mg、约500mg、约600mg或约800mg的固定剂量。这种指导材料可指导pd-1结合分子药物组合物包括,或被重构以施用约1mg/kg至约10mg/kg、约1mg/kg至约5mg/kg或约5mg/kg至约10mg/kg的剂量。这种指导材料可指导pd-1结合分子药物组合物包括,或被重构以施用约1mg/kg、约2mg/kg、约3mg/kg、约4mg/kg、约5mg/kg、约6mg/kg、约7mg/kg、约8mg/kg、约9mg/kg或约10mg/kg的剂量。这种指导材料可指导所提供的药物组合物包括,或被重构以包括,单剂量,或大于一个剂量(例如,2个剂量、4个剂量、6个剂量、12个剂量、24个剂量等)。这种指导材料可指导约每2周一次、约每3周一次、约每4周一次或通常更多或更少施用pd-1结合分子药物组合物。药物试剂盒包括的指导材料可组合任何一组这种信息(例如,其可指导所提供的含有b7-h3-adc的药物组合物包括,或被重构以包括,约3mg/ml的剂量,且约每3周一次施用这种剂量;其可指导所提供的药物组合物包括,或被重构以包括,约3.5mg/kg的剂量,且约每3周一次施用这种剂量等,和/或其可指导含有hpd-1 mab-a的药物组合物包括,或被重构以包括,约375mg的固定剂量,且约每3周一次施用这种剂量等),和/或其可指导含有pd-1 x lag-3 bd的药物组合物包括,或被重构以包括,约300mg或约600mg的固定剂量,且约每2周一次或约每3周一次施用这种剂量等)。这种指导材料可指导关于包括的药物组合物的施用模式,例如其通过静脉内(iv)输注施用。药物试剂盒包括的指导材料可指导关于这种施用的持续时间或时机,例如包括的药物组合物是在约60分钟的一段时间,约30-240分钟、约30-90分钟的一段时间等内通过静脉内(iv)输注被施用。
[0235]
药物试剂盒包括的指导材料可指导关于所包括药物组合物的合适的或期望的使用,例如指导施用这种药物组合物用于治疗其中表达b7-h3的癌症。这种癌症可以是肾上腺癌、aids相关的癌、肺泡状软组织肉瘤、星形细胞肿瘤、肛门癌(例如scac)、膀胱癌、骨癌、脑和脊髓癌、转移性脑瘤、b-细胞癌、乳腺癌(例如her2+乳腺癌或tnbc)、颈动脉体瘤、子宫颈癌、软骨肉瘤、脊索瘤、嫌色性肾细胞癌、透明细胞癌、结肠癌、结直肠癌、皮肤良性纤维组织细胞瘤、促结缔组织增生性小圆细胞肿瘤、室管膜细胞瘤、尤因氏肿瘤、骨骼外粘液样软骨肉瘤、骨纤维发育不全、骨骼的纤维发育异常、胆囊或胆管癌、胃癌、妊娠滋养细胞疾病、生殖细胞瘤、头颈癌、胶质母细胞瘤、血液系统恶性肿瘤、肝细胞癌、胰岛细胞肿瘤、卡波西氏肉瘤、肾癌、白血病(例如急性髓样白血病)、脂肪肉瘤/恶性脂肪瘤、肝癌、淋巴瘤、肺癌(例如nsclc)、成神经管细胞瘤、黑素瘤、脑膜瘤、间皮咽癌、多发性内分泌瘤、多发性骨髓瘤、骨髓发育不良综合征、成神经细胞瘤、神经内分泌肿瘤、卵巢癌、胰腺癌、乳头状甲状腺癌、甲状旁腺肿瘤、儿科癌症、周围神经鞘肿瘤、嗜铬细胞瘤、垂体肿瘤、前列腺癌(例如mcrpc)、后部葡萄膜黑素瘤、肾转移癌、横纹肌样瘤、横纹肌肉瘤、肉瘤、皮肤癌、童年期的小圆形蓝细胞瘤(包括成神经细胞瘤和横纹肌肉瘤)、软组织肉瘤、鳞状细胞癌(例如scchn)、胃癌、滑膜肉瘤、睾丸癌、胸腺癌、胸腺瘤、甲状腺癌(例如甲状腺转移癌症)和子宫癌。ix.本发明的b7-h3-adc的用途
[0236]
本发明b7-h3-adc可任选地与本发明的pd-1结合分子组合使用以治疗或预防各种紊乱,包括癌症,特别地其中表达b7-h3的癌症。相应地,本发明提供了治疗癌症的方法,这种方法包括向需要其的受试者施用任选地与本发明的pd-1结合分子组合的本发明的b7-h3-adc。如本文使用的,术语“受试者”指人(即,人患者)或其他哺乳动物。本文提供了用于
向需要其的受试者施用这种疗法的示例性给药方案。
[0237]
可用单独的b7-h3-adc或通过本发明的b7-h3-adc和pd-1结合分子的组合治疗的癌症包括:肾上腺癌、aids相关的癌、肺泡状软组织肉瘤、星形细胞肿瘤、肛门癌(例如scac)、膀胱癌、骨癌、脑和脊髓癌、转移性脑瘤、b-细胞癌、乳腺癌(例如her2+乳腺癌或tnbc)、颈动脉体瘤、子宫颈癌、软骨肉瘤、脊索瘤、嫌色性肾细胞癌、透明细胞癌、结肠癌、结直肠癌、皮肤良性纤维组织细胞瘤、促结缔组织增生性小圆细胞肿瘤、室管膜细胞瘤、尤因氏肿瘤、骨骼外粘液样软骨肉瘤、骨纤维发育不全、骨骼的纤维发育异常、胆囊或胆管癌、胃癌、妊娠滋养细胞疾病、生殖细胞瘤、头颈癌、胶质母细胞瘤、血液系统恶性肿瘤、肝细胞癌、胰岛细胞肿瘤、卡波西氏肉瘤、肾癌、白血病(例如急性髓样白血病)、脂肪肉瘤/恶性脂肪瘤、肝癌、淋巴瘤、肺癌(例如nsclc)、成神经管细胞瘤、黑素瘤、脑膜瘤、间皮咽癌、多发性内分泌瘤、多发性骨髓瘤、骨髓发育不良综合征、成神经细胞瘤、神经内分泌肿瘤、卵巢癌、胰腺癌、乳头状甲状腺癌、甲状旁腺肿瘤、儿科癌症、周围神经鞘肿瘤、嗜铬细胞瘤、垂体肿瘤、前列腺癌(例如mcrpc)、后部葡萄膜黑素瘤、肾转移癌、横纹肌样瘤、横纹肌肉瘤、肉瘤、皮肤癌、童年期的小圆形蓝细胞瘤(包括成神经细胞瘤和横纹肌肉瘤)、软组织肉瘤、鳞状细胞癌(例如scchn)、胃癌、滑膜肉瘤、睾丸癌、胸腺癌、胸腺瘤、甲状腺癌(例如甲状腺转移癌症)和子宫癌。
[0238]
特别地,本发明的b7-h3-adc可在以下的治疗中任选地与本发明的pd-1结合分子组合使用:前列腺癌(包括mcrpc)、肛门癌(包括scac)、乳腺癌(包括her2+乳腺癌和/或tnbc)、头颈癌(包括scchn)和肺癌(包括nsclc)。
[0239]
在某些实施方式中,本发明的b7-h3-adc任选地与本发明的pd-1结合分子组合施用作为治疗癌症的一线疗法(first-line therapy)。在其他实施方式中,本发明的b7-h3-adc在一种或多种先前的疗法方式之后任选地与本发明的pd-1结合分子组合施用。在仍其他实施方式中,在外科去除肿瘤时或之后本发明的b7-h3-adc可任选地与本发明的pd-1结合分子组合采用作为辅助疗法,以便延迟、抑制或预防转移的发展。在外科手术之前,本发明的b7-h3-adc也可任选地与本发明的pd-1结合分子组合施用(例如,作为新辅助疗法),以便减少肿瘤的大小,因此能够进行或简化这种外科手术,在这种外科手术期间使组织不受伤害,和/或减少任何所得外形毁损(disfigurement)。
[0240]
本发明具体地涵盖施用b7-h3-adc,任选地与pd-1结合分子组合,进一步与对本领域技术人员已知的用于治疗或预防癌症的一种或多种其他疗法组合,所述其他疗法包括但不限于当前标准和实验化学疗法、激素疗法、生物疗法、免疫疗法、辐射疗法或外科手术。在一些实施方式中,b7-h3-adc,任选地与pd-1结合分子组合,可进一步与对本领域技术人员已知的用于治疗和/或预防癌症,尤其是表达b7-h3的癌症的治疗或预防有效量的一种或多种治疗剂或化疗剂组合施用。治疗表达b7-h3的癌症中通常使用的治疗剂和化疗剂包括,但不限于基于铂的化疗(特别地,卡铂、奥沙利铂和卡铂)、紫杉烷(特别地,多西他赛和紫杉醇)、激素疗法(特别地,阿比特龙和恩杂鲁胺)、蒽环类(特别地,柔红霉素、多柔比星和表柔比星)、卡培他滨、环磷酰胺、亚叶酸、甲氨蝶呤、镭223、sipuleucel-t和5-氟尿嘧啶(5-fu)。
[0241]
如本文使用的,术语“组合”指使用大于一种治疗剂。术语“组合”的使用不限制向具有紊乱的受试者(例如,人患者或其他哺乳动物)施用治疗剂的顺序,也不意味着在完全相同的时间施用试剂。术语组合意味着b7-h3-adc、本发明的pd-1结合分子和任何其他试剂
向人患者或其他哺乳动物依次和在一定时间间隔内施用,使得b7-h3-adc、pd-1结合分子和其他试剂的组合比如果它们以其他方式施用提供增加的益处。例如,每种治疗剂(例如,化疗、辐射疗法、激素疗法或生物疗法)可以在同时或在时间的不同点以任何顺序依次施用;然而,如果不是同时施用,它们应在足够近的时间施用,以便提供期望的治疗或预防效果。每种治疗剂可以任何合适的形式且通过任何合适的途径,例如,一种通过口服途径和一种通过肠胃外等分开施用。本文提供了向需要其的受试者施用与pd-1结合分子组合的b7-h3-adc的示例性给药方案。x.施用的方法和剂量
[0242]
本发明的分子(例如,b7-h3-adc和/或pd-1结合分子)可通过各种方法向受试者,例如,需要其的受试者,例如人患者施用。对于许多应用,施用的途径是以下之一:静脉内注射或输注(iv)、皮下注射(sc)、腹膜内注射(ip)或肌内注射。也可能使用关节内递送。也可使用肠胃外施用的其他模式。这种模式的示例包括:动脉内、鞘内、囊内、眶内、心内、皮内、经气管的、表皮下、关节内、囊下,蛛网膜下、脊柱内和硬膜外和胸骨内注射。
[0243]
分子(例如,b7-h3-adc和/或pd-1结合分子)可作为固定剂量(例如,375mg)或作为基于体重的剂量(例如,3.5mg/kg)施用。还可选择剂量以减少或避免针对施用分子的抗体的产生。调整用药方案以提供期望的应答,例如,治疗应答或组合治疗效果。一般而言,可使用b7-h3-adc和pd-1结合分子(和任选地其他试剂)的剂量,以便提供受试者以生物利用量的试剂。如本文使用的,术语“剂量”(“dose”)指一次采用指定量的药物。术语“用药”(“dosage”)指在指定时间段内剂量的具体量、数量和频率的施用;因此,术语用药包括时序特征(chronological feature),比如持续时间和周期性(periodicity)。
[0244]
如本文使用的术语“固定剂量(flat dose)”指不依赖患者体重的剂量,并且包括适合作为待治疗的受试者的单一剂量的分子(例如,b7-h3-adc或pd-1结合分子)的物理离散单位;其中每个单位含有与药学载体结合,并且任选地与其他试剂结合的预定量的b7-h3-adc和/或pd-1结合分子(计算以产生期望的治疗效果)。可给予单个或多个固定剂量。如本文使用的术语“基于体重的剂量”指每单位患者体重施用的分子的离散量,例如每千克受试者的体重的毫克药物(mg/kg体重,本文缩写为“mg/kg”)。计算的剂量将基于基线处受试者的体重施用。典型地,从基线或确定的稳定状态(plateau)重量的体重的显着性(≥10%)变化将通常促进重新计算剂量。可以以给单个或多个剂量。包括b7-h3-adc和/或pd-1结合分子的组合物可经输注向需要其的受试者施用。
[0245]
在某些实施方式中,b7-h3-adc以约0.5mg/kg至约2mg/kg、约2mg/kg至约3mg/kg、约2mg/kg至约2.25mg/kg、约2.25mg/kg至约2.5mg/kg、约2.5mg/kg至约2.75mg/kg、约2.75mg/kg至约3mg/kg、约3mg/kg至约4mg/kg、约3mg/kg至约3.25mg/kg、约3.25mg/kg至约3.5mg/kg、约3.5mg/kg至约3.75mg/kg、约3.75mg/kg至约4mg/kg、约4mg/kg至约5mg/kg、约4mg/kg至约4.25mg/kg、约4.25mg/kg至约4.5mg/kg、约4.5mg/kg至约4.75mg/kg或约5mg/kg的基于体重的剂量向需要其的受试者施用。在特别的实施方式中,b7-h3-adc以约0.5mg/kg、约1mg/kg、约1.5mg/kg、约2mg/kg、约2.25mg/kg、约2.5mg/kg、约2.75mg/kg、约3mg/kg、约3.25mg/kg、约3.5mg/kg、约3.75mg/kg、约4mg/kg、约4.25mg/kg、约4.5mg/kg、约4.75mg/kg或约5mg/kg的基于体重的剂量向需要其的受试者施用。在某些实施方式中,b7-h3-adc约每2周一次、约每3周一次、约每4周一次或通常更多或更少施用。
[0246]
在某些实施方式中,pd-1结合分子是hpd-1 mab-a并且以约200mg至约800mg的固定剂量向需要其的受试者施用。在特别的实施方式中,hpd-1 mab-a以约200mg、约200mg、约275mg、约300mg、约350mg、约375mg、约400mg、约450mg、约475mg、约500mg、约550mg、约575mg、约600mg、约650mg、约675mg、约700mg、约750mg、约775mg或约800mg的固定剂量向需要其的受试者施用。在特别的实施方式中,hpd-1 mab-a以约1mg/kg至约10mg/kg的基于体重的剂量向需要其的受试者施用。在特别的实施方式中,hpd-1 mab-a以约1mg/kg、约2mg/kg、约3mg/kg、约4mg/kg、约5mg/kg、约6mg/kg、约7mg/kg、约8mg/kg、约9mg/kg或约10mg/kg的基于体重的剂量向需要其的受试者施用。在某些实施方式中,hpd-1 mab-a以约每2周一次、约每3周一次、约每4周一次或通常更多或更少施用。
[0247]
在某些实施方式中,pd-1结合分子是派姆单抗并且以约200mg的固定剂量向需要其的受试者施用。在某些实施方式中,尼伏鲁单抗以约240mg或约480mg的固定剂量向需要其的受试者施用。在某些实施方式中,尼伏鲁单抗以约3mg/kg的基于体重的剂量向需要其的受试者施用。在某些实施方式中,派姆单抗或尼伏鲁单抗以约每2周一次、约每3周一次、约每4周一次或通常更多或更少施用。
[0248]
在特别的实施方式中,pd-1结合分子是pd-1 x lag-3 bd并且以约120mg至约800mg的固定剂量向需要其的受试者施用。在某些实施方式中,pd-1 x lag-3 bd以约120mg、约300mg、约400mg、约600mg或约800mg的固定剂量向需要其的受试者施用。在特别的实施方式中,pd-1 x lag-3 bd以约300mg的固定剂量向需要其的受试者施用。在另一特别的实施方式中,pd-1 x lag-3 bd以约600mg的固定剂量向需要其的受试者施用。在另一特别的实施方式中,pd-1 x lag-3 bd以约800mg的固定剂量向需要其的受试者施用。在某些实施方式中,pd-1 x lag-3 bd以约每2周一次、约每3周一次、约每4周一次或通常更多或更少施用。
[0249]
关于固定剂量或固定用药,术语“约”旨在表示所述剂量的
±
10%的范围,使得例如,约600mg的剂量将在540mg和660mg之间。关于基于体重的剂量,术语“约”旨在表示所述剂量的
±
10%的范围,使得例如,约10mg/kg的剂量将在0.9mg/kg和10.1mg/kg之间。
[0250]
如本文使用的术语“给药间隔(dosing interval)”指可以是规则的或间歇的剂量之间的时间间隔。分子的用药(例如,b7-h3-adc的剂量和/或pd-1结合分子的剂量)可以在足以涵盖至少2个剂量,至少4个剂量,至少6个剂量,至少12个剂量或至少24个剂量(治疗的过程)的一段时间内以周期的给药间隔施用。例如,用药可以以例如,每天一次或两次或每周约一次至四次,或特别地每周一次(“q1w”)、每两周一次(“q2w”)、每三周一次(“q3w”)、每四周一次(“q4w”)等施用。这种周期施用可继续例如,约1至52周之间或大于52周的一段时间。这种治疗过程可分为数个增量(increment),每个本文称为“周期”,例如,2至8周之间、约3至7周之间、特别地约4周、或约6周、或约8周,在此期间施用固定数量的剂量。在每个周期期间,施用的剂量和/或频率可相同或不同。可影响有效治疗受试者所需的用药和时机的因素包括,例如,疾病或紊乱的严重程度、配方、递送的途径、先前的治疗、受试者的总体健康和/或年龄和受试者其他疾病的存在。而且,用治疗有效量化合物治疗受试者可包括单个治疗或可包括一系列治疗。
[0251]“给药方案”是用药施用,其中以预定的频率(或一组这种频率)向患者施用预定的剂量(或一组这种预定的剂量)预定的周期数(或多个周期数)。示例性给药方案包括施用以
约0.5mg/kg至约5mg/kg的基于体重的剂量每3周一次施用本发明的b7-h3-adc。另一示例性给药方案包括以约3mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc。另一示例性给药方案包括以约3mg/kg至约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc。另一示例性给药方案包括以约4mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc。另一示例性给药方案包括以约1mg/kg的基于体重的剂量每3周一次施用b7-h3-adc。另一示例性给药方案包括以约2mg/kg的基于体重的剂量每3周一次施用b7-h3-adc。另一示例性给药方案包括以约3mg/kg的基于体重的剂量每3周一次施用b7-h3-adc。另一示例性给药方案包括以约3.25mg/kg的基于体重的剂量每3周一次施用b7-h3-adc。另一示例性给药方案包括以约3.5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc。另一示例性给药方案包括以约3.75mg/kg的基于体重的剂量每3周一次施用b7-h3-adc。另一示例性给药方案包括以约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc。另一示例性给药方案包括以约4.25mg/kg的基于体重的剂量每3周一次施用b7-h3-adc。另一示例性给药方案包括以约4.5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc。另一示例性给药方案包括以约4.75mg/kg的基于体重的剂量每3周一次施用b7-h3-adc。另一示例性给药方案包括以约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc。
[0252]
另一示例性给药方案包括以约0.5mg/kg至约5mg/kg的基于体重的剂量每4周一次施用本发明的b7-h3-adc。另一示例性给药方案包括以约3mg/kg至约5mg/kg的基于体重的剂量每4周一次施用b7-h3-adc。另一示例性给药方案包括以约3mg/kg至约4mg/kg的基于体重的剂量每4周一次施用b7-h3-adc。另一示例性给药方案包括以约4mg/kg至约5mg/kg的基于体重的剂量每4周一次施用b7-h3-adc。另一示例性给药方案包括以约1mg/kg的基于体重的剂量每4周一次施用b7-h3-adc。另一示例性给药方案包括以约2mg/kg的基于体重的剂量每4周一次施用b7-h3-adc。另一示例性给药方案包括以约3mg/kg的基于体重的剂量每4周一次施用b7-h3-adc。另一示例性给药方案包括以约3.25mg/kg的基于体重的剂量每4周一次施用b7-h3-adc。另一示例性给药方案包括以约3.5mg/kg的基于体重的剂量每4周一次施用b7-h3-adc。另一示例性给药方案包括以约3.75mg/kg的基于体重的剂量每4周一次施用b7-h3-adc。另一示例性给药方案包括以约4mg/kg的基于体重的剂量每4周一次施用b7-h3-adc。另一示例性给药方案包括以约4.25mg/kg的基于体重的剂量每4周一次施用b7-h3-adc。另一示例性给药方案包括以约4.5mg/kg的基于体重的剂量每4周一次施用b7-h3-adc。另一示例性给药方案包括以约4.75mg/kg的基于体重的剂量每4周一次施用b7-h3-adc。另一示例性给药方案包括以约5mg/kg的基于体重的剂量每4周一次施用b7-h3-adc。
[0253]
另一示例性给药方案包括以约0.5mg/kg至约5mg/kg的基于体重的剂量每3周一次施用本发明的b7-h3-adc和每2周一次、每3周一次或每4周一次以约120mg至约800mg的固定剂量施用本发明的pd-1结合分子。另一示例性给药方案包括以约0.5mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg至约500mg的固定剂量每3周一次施用hpd-1 mab-a。另一示例性给药方案包括以约3mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg至约500mg的固定剂量每3周一次施用hpd-1 mab-a。另一示例性给药方案包括以约3mg/kg至约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg至约500mg的固定剂量每3周一次施用hpd-1 mab-a。另一示例性给药方案包括以约4mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg至约500mg
的固定剂量每3周一次施用hpd-1 mab-a。
[0254]
另一示例性给药方案包括以约3mg/kg至约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg的固定剂量每3周一次施用hpd-1 mab-a。另一示例性给药方案包括以约4mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg的固定剂量每3周一次施用hpd-1 mab-a。另一示例性给药方案包括以约2mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约3mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约3.25mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约3.5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约3.75mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约4.25mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约4.5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约4.75mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg的固定剂量每3周施用hpd-1 mab-a。
[0255]
另一示例性给药方案包括以约3mg/kg至约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约500mg的固定剂量每3周一次施用hpd-1 mab-a。另一示例性给药方案包括以约4mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约500mg的固定剂量每3周一次施用hpd-1 mab-a。另一示例性给药方案包括以约2mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约500mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约3mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约500mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约3.25mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约500mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约3.5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约500mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约3.75mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约500mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约500mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约4.25mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约500mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约4.5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约500mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约4.75mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约500mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约500mg的固定剂量每3周施用hpd-1 mab-a。
[0256]
另一示例性给药方案包括以约0.5mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg至约500mg的固定剂量每4周一次施用hpd-1 mab-a。另一示例性给药方案包括以约3mg/kg至约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg至约500mg的固定剂量每4周一次施用hpd-1 mab-a。另一示例性给药方案包括以约4mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg至约500mg的固定剂量每4周一次施用hpd-1 mab-a。
[0257]
另一示例性给药方案包括以约3mg/kg至约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg的固定剂量每4周一次施用hpd-1 mab-a。另一示例性给药方案包括以约4mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg的固定剂量每4周一次施用hpd-1 mab-a。另一示例性给药方案包括以约2mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg的固定剂量每4周施用hpd-1 mab-a。另一示例性给药方案包括以约3mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg的固定剂量每4周施用hpd-1 mab-a。另一示例性给药方案包括以约3.25mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg的固定剂量每4周施用hpd-1 mab-a。另一示例性给药方案包括以约3.5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg的固定剂量每4周施用hpd-1 mab-a。另一示例性给药方案包括以约3.75mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg的固定剂量每4周施用hpd-1 mab-a。另一示例性给药方案包括以约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg的固定剂量每4周施用hpd-1 mab-a。另一示例性给药方案包括以约4.25mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg的固定剂量每4周施用hpd-1 mab-a。另一示例性给药方案包括施用以约4.5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg的固定剂量每4周施用hpd-1 mab-a。另一示例性给药方案包括以约4.75mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg的固定剂量每4周施用hpd-1 mab-a。另一示例性给药方案包括以约5mg/kg的基于体重的剂量每3周一次的b7-h3-adc和以约375mg的固定剂量每4周施用hpd-1 mab-a。
[0258]
另一示例性给药方案包括以约3mg/kg至约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约500mg的固定剂量每4周一次施用hpd-1 mab-a。另一示例性给药方案包括以约4mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约500mg的固定剂量每4周一次施用hpd-1 mab-a。另一示例性给药方案包括以约2mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约500mg的固定剂量每4周施用hpd-1 mab-a。另一示例性给药方案包括以约3mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约500mg的固定剂量每4周施用hpd-1 mab-a。另一示例性给药方案包括以约3.25mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约500mg的固定剂量每4周施用hpd-1 mab-a。另一示例性给药方案包括以约3.5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约500mg的固定剂量每4周施用hpd-1 mab-a。另一示例性给药方案包括以约3.75mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约500mg的固定剂量每4周施用hpd-1 mab-a。另一示例性给药方案包括以约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约500mg的固定剂量每4周施用hpd-1 mab-a。另一示例性给药方案包括以约4.25mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约500mg的固定剂量每4周施用hpd-1 mab-a。另一示例性给药方案包
括以约4.5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约500mg的固定剂量每4周施用hpd-1 mab-a。另一示例性给药方案包括以约4.75mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约500mg的固定剂量每4周施用hpd-1 mab-a。另一示例性给药方案包括以约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约500mg的固定剂量每4周施用hpd-1 mab-a。
[0259]
另一示例性给药方案包括以约0.5mg/kg至约5mg/kg的基于体重的剂量每4周一次施用b7-h3-adc和以约375mg至约500mg的固定剂量每3周一次施用hpd-1 mab-a。另一示例性给药方案包括以约3mg/kg至约5mg/kg的基于体重的剂量每4周一次施用b7-h3-adc和以约375mg至约500mg的固定剂量每3周一次施用hpd-1 mab-a。另一示例性给药方案包括以约3mg/kg至约4mg/kg的基于体重的剂量每4周一次施用b7-h3-adc和以约375mg至约500mg的固定剂量每3周一次施用hpd-1 mab-a。另一示例性给药方案包括以约4mg/kg至约5mg/kg的基于体重的剂量每4周一次施用b7-h3-adc和以约375mg至约500mg的固定剂量每3周一次施用hpd-1 mab-a。
[0260]
另一示例性给药方案包括以约3mg/kg至约4mg/kg的基于体重的剂量每4周一次施用b7-h3-adc和以约375mg的固定剂量每3周一次施用hpd-1 mab-a。另一示例性给药方案包括以约4mg/kg至约5mg/kg的基于体重的剂量每4周一次施用b7-h3-adc和以约375mg的固定剂量每3周一次施用hpd-1 mab-a。另一示例性给药方案包括以约2mg/kg的基于体重的剂量每4周一次施用b7-h3-adc和以约375mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约3mg/kg的基于体重的剂量每4周一次施用b7-h3-adc和以约375mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括施用以约3.25mg/kg的基于体重的剂量每4周一次施用b7-h3-adc和以约375mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约3.5mg/kg的基于体重的剂量每4周一次施用b7-h3-adc和以约375mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约3.75mg/kg的基于体重的剂量每4周一次施用b7-h3-adc和以约375mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约375mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约4.25mg/kg的基于体重的剂量每4周一次施用b7-h3-adc和以约375mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约4.5mg/kg的基于体重的剂量每4周一次施用b7-h3-adc和以约375mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约4.75mg/kg的基于体重的剂量每4周一次施用b7-h3-adc和以约375mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约5mg/kg的基于体重的剂量每4周一次施用b7-h3-adc和以约375mg的固定剂量每3周施用hpd-1 mab-a。
[0261]
另一示例性给药方案包括以约3mg/kg至约4mg/kg的基于体重的剂量每4周一次施用b7-h3-adc和以约500mg的固定剂量每3周一次施用hpd-1 mab-a。另一示例性给药方案包括以约4mg/kg至约5mg/kg的基于体重的剂量每4周一次施用b7-h3-adc和以约500mg的固定剂量每3周一次施用hpd-1 mab-a。另一示例性给药方案包括以约2mg/kg的基于体重的剂量每4周一次施用b7-h3-adc和以约500mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约3mg/kg的基于体重的剂量每4周一次施用b7-h3-adc和以约500mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约3.25mg/kg的基于体重的剂量每4
周一次施用b7-h3-adc和以约500mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约3.5mg/kg的基于体重的剂量每4周一次施用b7-h3-adc和以约500mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约3.75mg/kg的基于体重的剂量每4周一次施用b7-h3-adc和以约500mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约4mg/kg的基于体重的剂量每4周一次施用b7-h3-adc和以约500mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约4.25mg/kg的基于体重的剂量每4周一次施用b7-h3-adc和以约500mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约4.5mg/kg的基于体重的剂量每4周一次施用b7-h3-adc和以约500mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约4.75mg/kg的基于体重的剂量每4周一次施用b7-h3-adc和以约500mg的固定剂量每3周施用hpd-1 mab-a。另一示例性给药方案包括以约5mg/kg的基于体重的剂量每4周一次施用b7-h3-adc和以约500mg的固定剂量每3周施用hpd-1 mab-a。
[0262]
另一示例性给药方案包括以约0.5mg/kg至约5mg/kg的基于体重的剂量每3周一次施用本发明的b7-h3-adc和以约1mg/kg至约10mg/kg的基于体重的剂量每2周一次、每3周一次或每4周一次施用本发明的hpd-1 mab-a。另一示例性给药方案包括以约0.5mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约1mg/kg至约10mg/kg的基于体重的剂量每2周一次施用hpd-1 mab-a。另一示例性给药方案包括以约3mg/kg至约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约1mg/kg至约10mg/kg的基于体重的剂量每2周一次施用hpd-1 mab-a。另一示例性给药方案包括以约4mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约1mg/kg至约10mg/kg的基于体重的剂量每2周一次施用hpd-1mab-a。另一示例性给药方案包括以约0.5mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约1mg/kg的剂量每2周一次施用hpd-1 mab-a。另一示例性给药方案包括以约0.5mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约3mg/kg的剂量每2周一次施用hpd-1 mab-a。另一示例性给药方案包括以约0.5mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约10mg/kg的基于体重的剂量每2周一次施用hpd-1 mab-a。另一示例性给药方案包括以约3mg/kg至约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约1mg/kg的剂量每2周一次施用hpd-1mab-a。另一示例性给药方案包括以约3mg/kg至约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约3mg/kg的剂量每2周一次施用hpd-1 mab-a。另一示例性给药方案包括施用以约3mg/kg至约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约10mg/kg的剂量每2周一次施用hpd-1 mab-a。另一示例性给药方案包括以约4mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约1mg/kg的剂量每2周一次施用hpd-1 mab-a。另一示例性给药方案包括以约4mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约3mg/kg的剂量每2周一次施用hpd-1 mab-a。另一示例性给药方案包括以约4mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约10mg/kg的剂量每2周一次施用hpd-1mab-a。
[0263]
另一示例性给药方案包括以约0.5mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约1mg/kg至约10mg/kg的基于体重的剂量每3周一次施用hpd-1 mab-a。另一示例性给药方案包括以约3mg/kg至约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约1mg/kg至约10mg/kg的基于体重的剂量每3周一次施用hpd-1 mab-a。另一示例性
h3-adc和以约200mg的固定剂量每3周一次施用派姆单抗。另一示例性给药方案包括以约4.25mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约200mg的固定剂量每3周一次施用派姆单抗。另一示例性给药方案包括以约4.5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约200mg的固定剂量每3周一次施用派姆单抗。另一示例性给药方案包括以约4.75mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约200mg的固定剂量每3周一次施用派姆单抗。另一示例性给药方案包括以约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约200mg的固定剂量每3周一次施用派姆单抗。
[0266]
示例性给药方案包括以约0.5mg/kg至约5mg/kg的基于体重的剂量每3周一次施用本发明的b7-h3-adc和以约240mg的固定剂量每2周一次施用尼伏鲁单抗。另一示例性给药方案包括以约3mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约240mg的固定剂量每2周一次施用尼伏鲁单抗。另一示例性给药方案包括以约3mg/kg至约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约240mg的固定剂量每2周一次施用尼伏鲁单抗。另一示例性给药方案包括以约4mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约240mg的固定剂量每2周一次施用尼伏鲁单抗。另一示例性给药方案包括以约2mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约240mg的固定剂量每2周一次施用尼伏鲁单抗。另一示例性给药方案包括以约3mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约240mg的固定剂量每2周一次施用尼伏鲁单抗。另一示例性给药方案包括以约3.25mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约240mg的固定剂量每2周一次施用尼伏鲁单抗。另一示例性给药方案包括以约3.5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约240mg的固定剂量每2周一次施用尼伏鲁单抗。另一示例性给药方案包括以约3.75mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约240mg的固定剂量每2周一次施用尼伏鲁单抗。另一示例性给药方案包括以约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约240mg的固定剂量每2周一次施用尼伏鲁单抗。另一示例性给药方案包括以约4.25mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约240mg的固定剂量每2周一次施用尼伏鲁单抗。另一示例性给药方案包括以约4.5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约240mg的固定剂量每2周一次施用尼伏鲁单抗。另一示例性给药方案包括以约4.75mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约240mg的固定剂量每2周一次施用尼伏鲁单抗。另一示例性给药方案包括以约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约240mg的固定剂量每2周一次施用尼伏鲁单抗。
[0267]
另一示例性给药方案包括以约0.5mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约480mg的固定剂量每4周一次施用尼伏鲁单抗。另一示例性给药方案包括以约3mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约480mg的固定剂量每4周一次施用尼伏鲁单抗。另一示例性给药方案包括以约3mg/kg至约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约480mg的固定剂量每4周一次施用尼伏鲁单抗。另一示例性给药方案包括以约4mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约480mg的固定剂量每4周一次施用尼伏鲁单抗。另一示例性给药方案包括以约2mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约480mg的固定剂量每4周一次施用尼伏鲁单抗。另一示例性给药方案包括以约3mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约480mg的固定剂量每4周一次施用尼伏鲁单抗。另一示例性给药方案包括以约
adc和以约120mg至约800mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约3mg/kg至约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约120mg至约800mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约4mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约120mg至约800mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约2mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约120mg至约800mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约3mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约120mg至约800mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约3.25mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约120mg至约800mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约3.5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约120mg至约800mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约3.75mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约120mg至约800mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约120mg至约800mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约4.25mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约120mg至约800mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约4.5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约120mg至约800mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约4.75mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约120mg至约800mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约120mg至约800mg的固定剂量每2周一次施用pd-1 x lag-3 bd。
[0270]
另一示例性给药方案包括以约3mg/kg至约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约300mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约4mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约300mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约2mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约300mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约3mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约300mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约3.25mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约300mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约3.5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约300mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约3.75mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约300mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约4mg/kg的基于体重的剂量每3周一次的b7-h3-adc和以约300mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约4.25mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约300mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约4.5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约300mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约4.75mg/kg的基于体重的剂量每3周
一次施用b7-h3-adc和以约300mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约300mg的固定剂量每2周一次施用pd-1 x lag-3 bd。
[0271]
另一示例性给药方案包括以约3mg/kg至约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约600mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约4mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约600mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约2mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约600mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约3mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约600mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约3.25mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约600mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约3.75mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约600mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约600mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约4.25mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约600mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约4.5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约600mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约4.75mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约600mg的固定剂量每2周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约600mg的固定剂量每2周一次施用pd-1 x lag-3 bd。
[0272]
另一示例性给药方案包括以约0.5mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约120mg至约800mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约3mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约120mg至约800mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约3mg/kg至约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约120mg至约800mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约4mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约120mg至约800mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约2mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约120mg至约800mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约3mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约120mg至约800mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约3.25mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约120mg至约800mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约3.5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约120mg至约800mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约3.75mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约120mg至约800mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约120mg至约800mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括
以约4.25mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约120mg至约800mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约4.5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约120mg至约800mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约4.75mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约120mg至约800mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约120mg至约800mg的固定剂量每3周一次施用pd-1 x lag-3 bd。
[0273]
另一示例性给药方案包括以约3mg/kg至约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约300mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约4mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约300mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约2mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约300mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约3mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约300mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约3.25mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约300mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约3.5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约300mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约3.75mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约300mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约300mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约4.25mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约300mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约4.5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约300mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约4.75mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约300mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约300mg的固定剂量每3周一次施用pd-1 x lag-3 bd。
[0274]
另一示例性给药方案包括以约3mg/kg至约4mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约600mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约4mg/kg至约5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约600mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约2mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约600mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约3mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约600mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约3.25mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约600mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约3.5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约600mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约3.75mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约600mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约4mg/kg的基于体重
的剂量每3周一次施用b7-h3-adc和以约600mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约4.25mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约600mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约4.5mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约600mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约4.75mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约600mg的固定剂量每3周一次施用pd-1 x lag-3 bd。另一示例性给药方案包括以约3.25mg/kg的基于体重的剂量每3周一次施用b7-h3-adc和以约600mg的固定剂量每3周一次施用pd-1 x lag-3 bd。
[0275]
特别地考虑了,在以上实施方式中,以预定的频率或周期数,或这种计划的给药间隔的1-3天内进行施用,使得施用发生在计划的给药的那天之前的1-3天、之后的1-3天或当天,例如,每3周(
±
3天)一次。具体地考虑了,在以上实施方式中,b7-h3-adc和pd-1结合分子在24-小时周期内通过iv输注施用。在某些实施方式中,b7-h3-adc和pd-1结合分子根据至少1个月或更多、至少3个月或更多、或至少6个月或更多或至少12个月或更多的持续时间(即,治疗的过程)的任何以上给药方案通过iv输注施用。特别地考虑了至少6月或更多、或至少12月或更多或直到观察到疾病或难以管理的毒性缓解的治疗持续时间。在某些实施方式中,在疾病缓解后治疗持续一段时间。
[0276]
在某些实施方式中,b7-h3-adc和pd-1结合分子通过iv输注施用。分子因此在包括合适的稀释剂,例如,0.9%氯化钠的输注袋内被稀释(分开或一起)。因为可能发生输注或过敏反应,预防这种输注反应的术前用药是推荐的并且在抗体施用期间应观察过敏性反应的预防措施。在某些实施方式中,iv输注可在约30分钟和约24小时之间的周期内向受试者施用。在某些实施方式中,iv输注在约30-240分钟、约30-180分钟、约30-120分钟或约30-90分钟的周期内,或约60-90分钟的周期内,或约60-75分钟的周期内,或更小周期内递送,如果受试者不展示出不利的输注反应的迹象或症状。在一个实施方式中,b7-h3-adc通过在约60分钟的一段时间内iv输注施用。在另一实施方式中,hpd-1 mab-a通过在约60分钟的一段时间内iv输注施用。在进一步的实施方式中,派姆单抗通过在约30分钟的一段时间内iv输注施用。在进一步的实施方式中,尼伏鲁单抗通过在约30分钟的一段时间内iv输注施用。在进一步的实施方式中,pd-1 x lag-3 bd通过在约30-240分钟或约30-90分钟的一段时间内iv输注施用。
[0277]
尽管,如上所讨论,可采用各种给药和施用途径以便按照本发明提供单独的b7-h3-adc或b7-h3-adc和pd-1结合分子的组合给需要其的接受受试者,特别地以下提供某些组合、给药和施用途径在这种治疗中使用。
[0278]
相应地,某些给药方案包括以约0.5mg/kg至约5mg/kg的基于体重的剂量施用b7-h3-adc并且任选地以约300-700mg的固定剂量或以约1mg/kg至约10mg/kg的基于体重的剂量与pd-1结合分子组合施用,其中这种分子每3周一次(
±
3天)施用。在某些实施方式中,b7-h3-adc以约0.5mg/kg、约1mg/kg、约2mg/kg、约2.25mg/kg、约2.5mg/kg、约2.75mg/kg、约3mg/kg、约3.25mg/kg约3.5mg/kg、约3.75mg/kg、约4mg/kg、约4.25mg/kg、约4.5mg/kg、约4.75mg/kg或约5mg/kg的基于体重的剂量施用和pd-1结合分子以约300mg、约375mg、约400mg、约500mg、约600mg或约700mg的固定剂量或以约1mg/kg、约3mg/kg、约5mg/kg或约10mg/kg的基于体重的剂量施用。
(a)在某些实施方式中,b7-h3-adc以约3mg/kg的基于体重的剂量施用。在这种实施方式中,如果待施用的pd-1结合分子是hpd-1 mab-a,这种hpd-1 mab-a以约375mg或约500mg的固定剂量施用。可替选地,如果在这种实施方式种,施用的pd-1结合分子是派姆单抗,所述派姆单抗以约200mg的固定剂量施用。可替选地,如果在这种实施方式中,施用的pd-1结合分子是尼伏鲁单抗,所述尼伏鲁单抗以240mg或480mg的固定剂量或以3mg/kg的基于体重的剂量施用。可替选地,如果在这种实施方式中,施用的pd-1结合分子是pd-1 x lag-3 bd,所述pd-1 x lag-3 bd以300mg或约600mg的剂量施用。(b)在某些实施方式中,b7-h3-adc以约3.25mg/kg的基于体重的剂量施用。在这种实施方式中,如果待施用的pd-1结合分子是hpd-1 mab-a,这种hpd-1 mab-a以约375mg或约500mg的固定剂量施用。可替选地,如果在这种实施方式中,施用的pd-1结合分子是派姆单抗,所述派姆单抗以约200mg的固定剂量施用。可替选地,如果在这种实施方式中,施用的pd-1结合分子是尼伏鲁单抗,所述尼伏鲁单抗以240mg或480mg的固定剂量或以3mg/kg的基于体重的剂量施用。可替选地,如果在这种实施方式中,施用的pd-1结合分子是pd-1 x lag-3 bd,所述pd-1 x lag-3 bd以300mg或约600mg的剂量施用。(c)在某些实施方式中,b7-h3-adc以约3.5mg/kg的基于体重的剂量施用。在这种实施方式中,如果待施用的pd-1结合分子是hpd-1 mab-a,这种hpd-1 mab-a以约375mg或约500mg的固定剂量施用。可替选地,如果在这种实施方式中,施用的pd-1结合分子是派姆单抗,所述派姆单抗以约200mg的固定剂量施用。可替选地,如果在这种实施方式中,施用的pd-1结合分子是尼伏鲁单抗,所述尼伏鲁单抗以240mg或480mg的固定剂量或以3mg/kg的基于体重的剂量施用。可替选地,如果在这种实施方式中,施用的pd-1结合分子是pd-1 x lag-3 bd,所述pd-1 x lag-3 bd以300mg或约600mg的剂量施用。(d)在某些实施方式中,b7-h3-adc以约3.75mg/kg的基于体重的剂量施用。在这种实施方式中,如果待施用的pd-1结合分子是hpd-1 mab-a,这种hpd-1 mab-a以约375mg或约500mg的固定剂量施用。可替选地,如果在这种实施方式中,施用的pd-1结合分子是派姆单抗,所述派姆单抗以约200mg的固定剂量施用。可替选地,如果在这种实施方式中,施用的pd-1结合分子是尼伏鲁单抗,所述尼伏鲁单抗以240mg或480mg的固定剂量或以3mg/kg的基于体重的剂量施用。可替选地,如果在这种实施方式中,施用的pd-1结合分子是pd-1 x lag-3 bd,所述pd-1 x lag-3 bd以300mg或约600mg的剂量施用。(e)在某些实施方式中,b7-h3-adc以约4mg/kg的基于体重的剂量施用。在这种实施方式中,如果待施用的pd-1结合分子是hpd-1 mab-a,这种hpd-1 mab-a以约375mg或约500mg的固定剂量施用。可替选地,如果在这种实施方式中,施用的pd-1结合分子是派姆单抗,所述派姆单抗以约200mg的固定剂量施用。可替选地,如果在这种实施方式中,施用的pd-1结合分子是尼伏鲁单抗,所述尼伏鲁单抗以240mg或480mg的固定剂量或以3mg/kg的基于体重的剂量施用。可替选地,如果在这种实施方式中,施用的pd-1结合分子是pd-1 x lag-3 bd,所述pd-1 x lag-3 bd以300mg或约600mg的剂量施用。(f)在某些实施方式中,b7-h3-adc以约5mg/kg的基于体重的剂量施用。在这种实施方式中,如果待施用的pd-1结合分子是hpd-1 mab-a,这种hpd-1 mab-a以约375mg或约500mg的固定剂量施用。可替选地,如果在这种实施方式中,施用的pd-1结合分子是派姆单抗,所述派姆单抗以约200mg的固定剂量施用。可替选地,如果在这种实施方式中,施用的
pd-1结合分子是尼伏鲁单抗,所述尼伏鲁单抗以240mg或480mg的固定剂量或以3mg/kg的基于体重的剂量施用。可替选地,如果在这种实施方式中,施用的pd-1结合分子是pd-1 x lag-3 bd,所述pd-1 x lag-3 bd以300mg或约600mg的剂量施用。在任何以上实施方式中,b7-h3-adc和pd-1结合分子同时、依次、以交替方式或在不同的时间,在24小时内通过iv输注施用。在任何以上实施方式中,pd-1结合分子是hpd-1 mab-a或pd-1 x lag-3bd。xi.本发明的实施方式
[0279]
本发明部分涉及以下非限制性实施方式(e1-e119):e1.一种治疗癌症的方法,其包括向需要其的受试者施用b7-h3-adc,其中所述方法包括以约0.5mg/kg至约5mg/kg的剂量约每3周一次向所述受试者施用所述b7-h3-adc。e2.根据e1所述的方法,其中所述方法包括以约3mg/kg至约5mg/kg的剂量约每3周一次向所述受试者施用所述b7-h3-adc。e3.根据e1-e2的任一项所述的方法,其中所述方法包括以约3mg/kg至约4mg/kg的剂量约每3周一次向所述受试者施用所述b7-h3-adc。e4.根据e1-e2的任一项所述的方法,其中所述方法包括以约4mg/kg至约5mg/kg的剂量约每3周一次向所述受试者施用所述b7-h3-adc。e5.一种治疗癌症的方法,其包括向需要其的受试者施用b7-h3-adc,其中所述方法包括以约0.5mg/kg至约5mg/kg的剂量约每4周一次向所述受试者施用所述b7-h3-adc。e6.根据e5所述的方法,其中所述方法包括以约3mg/kg至约5mg/kg的剂量约每4周一次向所述受试者施用所述b7-h3-adc。e7.根据e5-e6的任一项所述的方法,其中所述方法包括以约3mg/kg至约4mg/kg的剂量约每4周一次向所述受试者施用所述b7-h3-adc。e8.根据e5-e6的任一项所述的方法,其中所述方法包括以约4mg/kg至约5mg/kg的剂量约每4周一次向所述受试者施用所述b7-h3-adc。e9.根据e1-e8的任一项所述的方法,其中所述方法包括以约0.5mg/kg、约1mg/kg、约1.5mg/kg、约2mg/kg、约2.25mg/kg、约2.5mg/kg、约2.75mg/kg、约3mg/kg、约3.25mg/kg、约3.5mg/kg、约3.75mg/kg、约4mg/kg、约4.25mg/kg、约4.5mg/kg、约4.75mg/kg或约5mg/kg的剂量向所述受试者施用所述b7-h3-adc。e10.一种治疗癌症的方法,其包括向需要其的受试者施用:(a)b7-h3-adc;和(b)pd-1结合分子,其中所述方法包括以约0.5mg/kg至约5mg/kg的剂量每3周一次向受试者施用所述b7-h3-adc。e11.一种治疗癌症的方法,其包括向需要其的受试者施用:(a)b7-h3-adc;和(b)pd-1结合分子,其中方法包括以约0.5mg/kg至约5mg/kg的剂量每4周一次向受试者施用所述b7-h3-adc。e12.根据e1-e11的任一项所述的方法,其中所述b7-h3-adc由下式表示:
ab-(lm)
m-(d)n,其中:ab是结合至b7-h3且包括以下的人源化b7-h3抗体或其b7-h3结合片段:(i)其可变轻链(vl)结构域中的cdrl1序列rasesiysyla(seq id no:39)、cdrl2序列ntktlpe(seq id no:40)和cdrl3序列qhhygtppwt(seq id no:41),和(ii)其可变重链(vh)结构域中的cdrh1序列sygms(seq id no:42)、cdrh2序列tinsggsntyy pdslkg(seq id no:43)和cdrh3序列hdggamdy(seq id no:44);lm包括至少一个共价连接ab和d的键或连接体分子;m是0和n之间的整数并且表示所述b7-h3-adc的键或连接体分子的数量,除了当lm是键时,m不是0;和n是1和10之间的整数并且表示共价连接至所述b7-h3-adc的细胞毒素倍癌霉素部分的数量。e13.根据e1-e12的任一项所述的方法,其中所述b7-h3-adc包括:(i)包括seq id no:17的氨基酸序列的人源化vl结构域,和(ii)包括seq id no:18的氨基酸序列的人源化vh结构域。e14.根据e12或e13所述的方法,其中ab是抗体。e15.根据e12-e14的任一项所述的方法,其中ab进一步包括人igg1的fc结构域。e15.1.根据e12-e15的任一项所述的方法,其中ab包括包含seq id no:19的氨基酸序列的轻链和包含seq id no:20的氨基酸序列的重链。e16.根据e12-e15.1的任一项所述的方法,其中至少一个lm是连接体分子,和特别地其中lm连接体分子是肽连接体和/或可切割的连接体。e17.根据e16所述的方法,其中肽连接体是缬氨酸-瓜氨酸二肽连接体。e18.根据e12-e17的任一项所述的方法,其中lm连接体分子进一步包括可切割的连接体和d之间的自消除间隔子。e19.根据e12-e17的任一项所述的方法,其中自消除间隔子包括对氨基苄氧基羰基部分。e20.根据e12-e19的任一项所述的方法,其中lm进一步包括可切割的连接体和ab之间的马来酰亚胺连接体部分。e21.根据e12-e20的任一项所述的方法,其中lm由下式表示:[v-(w)
k-(x)
1-a]由此b7-h3-adc由下式表示:ab
–
[v-(w)
k-(x)
1-a]
–
d其中:v是可切割的连接体,(w)
k-(x)
1-a是经l,(4+2n)-消除自消除的细长的、自消除间隔子系统,w和x各自是l,(4+2n)电子级联间隔子,是相同的或不同的,a是式(y)m的间隔子基团,其中y是l,(4+2n)电子级联间隔子,或式u的基团,为环
化消除间隔子,k、1和m独立地是0(被包括)至5(被包括)的整数,n是0(被包括)至10(被包括)的整数,条件是:当a是(y)m时:则k+l+m≥1,和如果k+l+m=l,则n》l;当a是u时:则k+1≥1。w、x和y独立地选自这样的化合物,其具有下式:或下式:其中:q是-r5c=cr
6-、s、o、nr5、-r5c=n-或-n=cr
5-p是nr7、o或sa、b和c独立地是0(被包括)至5(被包括)的整数;i、f和g独立地选自具有下式的化合物:其中r1、r2、r3、r4、r5、r6、r7、r8和r9独立地表示h、c
1-6
烷基、c
3-20
杂环基、c
5-20
芳基、c
1-6
烷氧基、羟基(oh)、氨基(nh2)、单取代的氨基(nr
x
h)、双取代的氨基(nr
x1rx2
)、硝基(no2)、卤素、cf3、cn、conh2、so2me、conhme、环c
1-5
烷基氨基、咪唑基、c
1-6
烷基哌嗪基、吗啉基、巯基(sh)、硫醚基(sr
x
)、四唑、羧基(cooh)、羧酸基(coor
x
)、磺基(s(=o)2oh)、磺酸基(s(=o)2or
x
)、磺酰基(s(=o)2r
x
)、亚磺基(s(=o)oh)、亚磺酸基(s(=o)or
x
)、亚磺酰基(s(=o)r
x
)、膦酰氧基(op(=o)(oh)2)和磷酸基(op(=o)(or
x
)2),其中r
x
、r
x1
和r
x2
独立地选自c
1-6
烷基、c
3-20
杂环基或c
5-20
芳基,取代基r1、r2、r3、r4、r5、r6、r7、r8或r9的两个或更多个任选地彼此连接以形成一个或多个脂肪族或芳族环结构;u选自具有下式的化合物:其中:
a、b和c独立地被选择为0或1的整数;条件是a+b+c=2或3;r1和/或r2独立地表示h、c1-6烷基、任选地用以下基团的一个或多个取代的烷基:羟基(oh)、醚(or
x
)、氨基(nh2)、单取代的氨基(nr
x
h)、双取代的氨基(nr
x1rx2
)、硝基(no2)、卤素、cf3、cn、conh2、so2me、conhme、环c
1-5
烷基氨基、咪唑基、c
1-6
烷基哌嗪基、吗啉基、巯基(sh)、硫醚基(sr
x
)、四唑、羧基(cooh)、羧酸基(coor
x
)、磺基(s(=o)2oh)、磺酸基(s(=o)2or
x
)、磺酰基(s(=o)2r
x
)、亚磺基(s(=o)oh)、亚磺酸基(s(=o)orx)、亚磺酰基(s(=o)rx)、膦酰氧基(op(=o)(oh)2)和磷酸基(op(=o)(or
x
)2),其中r
x
、r
x1
和r
x2
选自c
1-6
烷基、c
3-20
杂环基或c
5-20
芳基;和r3、r4、r5、r6、r7和r8独立地表示h、c
1-6
烷基、c
3-20
杂环基、c
5-20
芳基、c
1-6
烷氧基、羟基(oh)、氨基(nh2)、单取代的氨基(nr
x
h)、双取代的氨基(nr
x1rx2
)、硝基(no2)、卤素、cf3、cn、conh2、so2me、conhme、环c
1-5
烷基氨基、咪唑基、c
1-6
烷基哌嗪基、吗啉基、巯基(sh)、硫醚基(sr
x
)、四唑、羧基(cooh)、羧酸基(coor
x
)、磺基(s(=o)2oh)、磺酸基(s(=o)2or
x
)、磺酰基(s(=o)2r
x
)、亚磺基(s(=o)oh)、亚磺酸基(s(=o)or
x
)、亚磺酰基(s(=o)r
x
)、膦酰氧基(op(=o)(oh)2)和磷酸基(op(=o)(or
x
)2),其中r
x
、r
x1
和r
x2
选自c
1-6
烷基、c
3-20
杂环基或c
5-20
芳基,和取代基r1、r2、r3、r4、r5、r6、r7或r8的两个或更多个任选地彼此连接以形成一个或多个脂肪族或芳族环结构。e22.根据e12-e21的任一项所述的方法,其中lm连接体分子包括:(1)对氨基苄氧基羰基-对氨基苄氧基羰基;(2)对氨基苄氧基羰基-对氨基苄氧基羰基-对氨基苄氧基羰基;(3)对氨基肉桂氧基羰基;(4)对氨基肉桂氧基羰基-对氨基苄氧基羰基;(5)对氨基-苄氧基羰基-对氨基肉桂氧基羰基;(6)对氨基肉桂氧基羰基-对氨基肉桂氧基羰基;(7)对氨基苯基戊二烯氧基羰基;(8)对氨基苯基戊二烯氧基羰基-对氨基肉桂氧基羰基;(9)对氨基苯基戊二烯氧基羰基-pamino苄氧基羰基;(10)对氨基苯基戊二烯氧基羰基-对氨基苯基戊二烯氧基羰基;(11)对氨基苄氧基羰基(甲氨基)乙基(甲氨基)羰基;(12)对氨基肉桂氧基羰基(甲氨基)乙基(甲氨基)羰基;(13)对氨基苄氧基羰基-对氨基苄氧基羰基(甲氨基)乙基(甲氨基)羰基;(14)对氨基肉桂氧基羰基-对氨基苄氧基羰基(甲氨基)乙基(甲氨基)羰基;(15)对氨基苄氧基羰基-对氨基肉桂氧基羰基(甲氨基)乙基(甲氨基)-羰基;(16)对氨基肉桂氧基羰基-对氨基肉桂氧基羰基(甲氨基)乙基(甲氨基)羰基;(17)对氨基苄氧基羰基-对氨基苄基;(18)对氨基苄氧基羰基-对氨基苄氧基羰基-对氨基苄基;(19)对氨基肉桂基;(20)对氨基肉桂氧基羰基-对氨基苄基;(21)对氨基苄氧基羰基-对氨基肉桂基;
(22)对氨基-肉桂氧基羰基-对氨基肉桂基;(23)对氨基苯基戊二烯基;(24)对氨基苯基戊二烯氧基羰基-对氨基肉桂基;(25)对氨基苯基戊二烯氧基羰基-对氨基苄基;或(26)对氨基苯基戊二烯氧基羰基-对氨基苯基戊二烯基。e23.根据e12-e22的任一项所述的方法,其中lm连接体分子缀合至ab多肽链的氨基酸的侧链并且将ab结合至细胞毒素倍癌霉素部分d的分子。e24.根据e12-e23的任一项所述的方法,其中细胞毒素倍癌霉素部分d包括选自由下述组成的组中的倍癌霉素细胞毒素:倍癌霉素a、倍癌霉素b1、倍癌霉素b2、倍癌霉素c1、倍癌霉素c2、倍癌霉素d、倍癌霉素sa、cc-1065、阿多来新、比折来新、卡折来新(u-80244)和螺旋-倍癌霉素(duba)。e25.根据e12-e24的任一项所述的方法,其中细胞毒素倍癌霉素部分d包括seco-倍癌霉素。e26.根据e12-e25的任一项所述的方法,其中lm连接体分子经还原的链间二硫化物共价连接至ab。e27.根据e1、e5或e9-e26的任一项所述的方法,其中所述b7-h3-adc以约2mg/kg剂量施用。e28.根据e1、e5或e9-e26的任一项所述的方法,其中所述b7-h3-adc以约2.25mg/kg剂量施用。e29.根据e1、e5或e9-e26的任一项所述的方法,其中所述b7-h3-adc以约2.5mg/kg剂量施用。e30.根据e1、e5或e9-e26的任一项所述的方法,其中所述b7-h3-adc以约2.75mg/kg剂量施用。e31.根据e1-e3、e5-e7或e9-e26的任一项所述的方法,其中所述b7-h3-adc以约3mg/kg剂量施用。e32.根据e1-e3、e5-e7或e9-e26的任一项所述的方法,其中所述b7-h3-adc以约3.25mg/kg剂量施用。e33.根据e1-e3、e5-e7或e9-e26的任一项所述的方法,其中所述b7-h3-adc以约3.5mg/kg剂量施用。e34.根据e1-e3、e5-e7或e9-e26的任一项所述的方法,其中所述b7-h3-adc以约3.75mg/kg剂量施用。e35.根据e1-e26的任一项所述的方法,其中所述b7-h3-adc以约4mg/kg剂量施用。e36.根据e1-e26的任一项所述的方法,其中所述b7-h3-adc以约4.25mg/kg剂量施用。e37.根据e1-e26的任一项所述的方法,其中所述b7-h3-adc以约4.5mg/kg剂量施用。e38.根据e1-e26的任一项所述的方法,其中所述b7-h3-adc以约4.75mg/kg剂量施用。
e39.根据e1、e2、e4-e6或e8-e26的任一项所述的方法,其中所述b7-h3-adc以约5mg/kg剂量施用。e40.根据e1-e39的任一项所述的方法,其中所述b7-h3-adc在约60分钟的一段时间内通过静脉内(iv)输注施用。e41.根据e1-e39的任一项所述的方法,其中所述b7-h3-adc与治疗有效剂量的pd-1结合分子组合施用。e42.根据e10、e11或e41的任一项所述的方法,其中所述pd-1结合分子选自由下述组成的组中:抗体、单链抗体、fab片段、f(ab’)2片段、fab’片段、fsc片段、fv片段、scfv、sc(fv)2和双抗体。e43.根据e10、e11、e41或e42的任一项所述的方法,其中所述pd-1结合分子选自由下述组成的组中:hpd-1 mab-a、派姆单抗、尼伏鲁单抗和pd-1 x lag-3 bd。e44.根据e10、e11或e41-e43任一项所述的方法,其中所述pd-1结合分子是hpd-1 mab-a或pd-1x lag-3 bd。e45.根据e10、e11或e41-e44的任一项所述的方法,其中所述pd-1结合分子包括包含vh互补决定区(cdr)1、vhcdr2和vh cdr3的可变重链(vh)结构域,其中vh cdr1包括氨基酸序列sywmn(seq id no:23);vh cdr2包括氨基酸序列vihpsdsetwldqkfkd(seq id no:24);vh cdr3包括氨基酸序列ehygtspfay(seq id no:25);和其中抗体包括包含vl cdr1、vl cdr2和vl cdr3的可变轻链(vl)结构域,其中:vl cdr1包括氨基酸序列rasesvdnygmsfmnw(seq id no:26);vl cdr2包括氨基酸序列aasnqgs(seq id no:27);和vl cdr3包括氨基酸序列qqskevpyt(seq id no:28)。e46.根据e45所述的方法,其中所述pd-1结合分子的vh结构域包括seq id no:32中所示的氨基酸序列和所述vl结构域包括seq id no:31中所示的氨基酸序列。e47.根据e10、e11或e41-e46的任一项所述的方法,其中所述pd-1结合分子是hpd-1 mab-a。e48.根据e10、e11或e41-e47的任一项所述的方法,其中方法包括以选自由约375mg、约500mg和约750mg组成的组中的固定剂量约每3周一次施用hpd-1 mab-a。e49.根据e10、e11或e41-e47的任一项所述的方法,其中所述方法包括以选自由约375mg、约500mg和约750mg组成的组中的固定剂量约每4周一次施用hpd-1 mab-a。e50.根据e10、e11或e41-e47的任一项所述的方法,其中所述hpd-1 mab-a以约375mg的固定剂量约每3周一次施用。e51.根据e10、e11或e41-e47的任一项所述的方法,其中所述hpd-1 mab-a以约500mg的固定剂量约每3周一次施用。e52.根据e10、e11、e41、e47、e48或e50的任一项所述的方法,其中所述b7-h3-adc以约3mg/kg剂量施用和所述hpd-1 mab-a以约375mg的固定剂量每3周一次施用。e53.根据e10、e11、e41、e47、e48或e50的任一项所述的方法,其中所述b7-h3-adc
以约3.25mg/kg剂量施用和所述hpd-1 mab-a以约375mg的固定剂量每3周一次施用。e54.根据e10、e11、e41、e47、e48或e50的任一项所述的方法,其中所述b7-h3-adc以约3.5mg/kg剂量施用和所述hpd-1 mab a以约375mg的固定剂量每3周一次施用。e55.根据e10、e11、e41、e47、e48或e50的任一项所述的方法,其中所述b7-h3-adc以约3.75mg/kg剂量施用和所述hpd-1 mab a以约375mg的固定剂量每3周一次施用。e56.根据e10、e11、e41、e47、e48或e50的任一项所述的方法,其中所述b7-h3-adc以约4mg/kg剂量施用和所述hpd-1 mab-a以约375mg的固定剂量每3周一次施用。e57.根据e10、e11、e41、e47、e48或e50的任一项所述的方法,其中所述b7-h3-adc以约4.25mg/kg剂量施用和所述hpd-1 mab-a以约375mg的固定剂量每3周一次施用。e58.根据e10、e11、e41、e47、e48或e50的任一项所述的方法,其中所述b7-h3-adc以约4.5mg/kg剂量施用和所述hpd-1 mab-a以约375mg的固定剂量每3周一次施用。e59.根据e10、e11、e41、e47、e48或e50的任一项所述的方法,其中所述b7-h3-adc以约4.75mg/kg剂量施用和所述hpd-1 mab a以约375mg的固定剂量每3周一次施用。e60.根据e10、e11、e41、e47、e48或e50的任一项所述的方法,其中所述b7-h3-adc以约5mg/kg剂量施用和所述hpd-1 mab-a以约375mg的固定剂量每3周一次施用。e61.根据e10、e11、e41、e47或e49的任一项所述的方法,其中所述b7-h3-adc以约3mg/kg剂量施用和所述hpd-1mab-a以约375mg的固定剂量每4周一次施用。e62.根据e10、e11、e41、e47或e49的任一项所述的方法,其中所述b7-h3-adc以约3.25mg/kg剂量施用和所述hpd-1 mab-a以约375mg的固定剂量每4周一次施用。e63.根据e10、e11、e41、e47或e49的任一项所述的方法,其中所述b7-h3-adc以约3.5mg/kg剂量施用和所述hpd-1 mab-a以约375mg的固定剂量每4周一次施用。e64.根据e10、e11、e41、e47或e49的任一项所述的方法,其中所述b7-h3-adc以约3.75mg/kg剂量施用和所述hpd-1 mab-a以约375mg的固定剂量每4周一次施用。e65.根据e10、e11、e41、e47或e49的任一项所述的方法,其中所述b7-h3-adc以约4mg/kg剂量施用和所述hpd-1mab-a以约375mg的固定剂量每4周一次施用。e66.根据e10、e11、e41、e47或e49的任一项所述的方法,其中所述b7-h3-adc以约4.25mg/kg剂量施用和所述hpd-1 mab-a以约375mg的固定剂量每4周一次施用。e67.根据e10、e11、e41、e47或e49的任一项所述的方法,其中所述b7-h3-adc以约4.5mg/kg剂量施用和所述hpd-1 mab-a以约375mg的固定剂量每4周一次施用。e68.根据e10、e11、e41、e47或e49的任一项所述的方法,其中所述b7-h3-adc以约4.75mg/kg剂量施用和所述hpd-1 mab-a以约375mg的固定剂量每4周一次施用。e69.根据e10、e11、e41、e47或e49的任一项所述的方法,其中所述b7-h3-adc以约5mg/kg剂量施用和所述hpd-1mab-a以约375mg的固定剂量每4周一次施用。e70.根据e10、e11、e41-e69的任一项所述的方法,其中所述hpd-1 mab-a在约60分钟的一段时间内通过iv输注施用。e71.根据e10、e11或e41-e43的任一项所述的方法,其中结合至人pd-1的所述抗体是派姆单抗。e72.根据e41-e43或e71的任一项所述的方法,其中所述派姆单抗以约200mg的固定剂量约每3周一次施用。
bd以单独的药物组合物依次向受试者施用。e91.根据e1-e90的任一项所述的方法,其中所述b7-h3-adc被提供在药物试剂盒中,所述药物试剂盒包括:(a)包括约0.5mg/ml至约5mg/ml的所述b7-h3-adc的药物组合物;和(b)指导材料,其中指导材料指示包括所述b7-h3-adc的药物组合物任选地与包括pd-1结合分子的药物组合物组合施用。e92.根据e91所述的方法,其中所述pd-1结合分子是hpd-1mab-a、派姆单抗、尼伏鲁单抗或pd-1 x lag-3 bd。e93.根据e91或e92的任一项所述的方法,其中在所述药物试剂盒中,所述b7-h3-adc包括:(i)包括seq id no:17的氨基酸序列的人源化vl结构域,和(ii)包括seq id no:18的氨基酸序列的人源化vh结构域。e94.根据e91-e93的任一项所述的方法,其中所述药物试剂盒的所述指导手册指示所述b7-h3-adc以约0.5mg/kg、约1mg/kg、约1.5mg/kg、约2mg/kg、约2.25mg/kg、约2.5mg/kg、约2.75mg/kg、约3mg/kg、约3.25mg/kg、约3.5mg/kg、约3.75mg/kg、约4mg/kg、约4.25mg/kg、约4.5mg/kg、约4.75mg/kg或约5mg/kg的剂量施用。e95.根据e91-e94的任一项所述的方法,其中所述药物试剂盒的所述指导手册指示所述hpd-1 mab-a以约375mg或约500mg的固定剂量每3周一次施用。e96.根据e91-e94的任一项所述的方法,其中所述药物试剂盒的所述指导手册指示所述派姆单抗用约200mg的固定剂量每3周一次施用。e97.根据e91-e94的任一项所述的方法,其中所述药物试剂盒的所述指导手册指示所述pd-1 x lag-3 bd以约300mg或约600mg的固定剂量每2周一次或每3周一次施用。e98.根据e91-e95的任一项所述的方法,其中所述药物试剂盒的所述指导手册指示所述b7-h3-adc和所述hpd-1 mab-a在约60分钟的一段时间内通过iv输注施用。e99.根据e91-e94或e97的任一项所述的方法,其中所述药物试剂盒的所述指导手册指示所述b7-h3-adc在约60分钟的一段时间内通过iv输注施用和所述pd-1 x lag-3 bd在约30-90分钟的一段时间内通过iv输注施用。e100.根据e91-e94或e97的任一项所述的方法,其中所述药物试剂盒的所述指导手册指示所述b7-h3-adc在约60分钟的一段时间内通过iv输注施用和所述pd-1 x lag-3 bd在约30-240分钟的一段时间内通过iv输注施用。e101.根据e1-e100的任一项所述的方法,其中所述b7-h3-adc任选地与所述pd-1结合分子组合施用用于治疗其中表达b7-h3的癌症。e102.根据e1-e101的任一项所述的方法,其中所述癌症选自由下述组成的组中:肾上腺癌、aids相关的癌、肺泡状软组织肉瘤、星形细胞肿瘤、肛门癌((例如肛管鳞状细胞癌(scac))、膀胱癌、骨癌、脑和脊髓癌、转移性脑瘤、b-细胞癌、乳腺癌(例如her2+乳腺癌或三阴性乳腺癌(tnbc))、颈动脉体瘤、子宫颈癌、软骨肉瘤、脊索瘤、嫌色性肾细胞癌、透明细胞癌、结肠癌、结直肠癌、皮肤良性纤维组织细胞瘤、促结缔组织增生性小圆细胞肿瘤、室管膜细胞瘤、尤因氏肿瘤、骨骼外粘液样软骨肉瘤、骨纤维发育不全、骨骼的纤维发育异常、胆
囊或胆管癌、胃癌、妊娠滋养细胞疾病、生殖细胞瘤、头颈癌、胶质母细胞瘤、血液系统恶性肿瘤、肝细胞癌、胰岛细胞肿瘤、卡波西氏肉瘤、肾癌、白血病(例如、急性髓样白血病)、脂肪肉瘤/恶性脂肪瘤、肝癌、淋巴瘤、肺癌(例如非小细胞肺癌(nsclc))、成神经管细胞瘤、黑素瘤、脑膜瘤、间皮咽癌、多发性内分泌瘤、多发性骨髓瘤、骨髓发育不良综合征、成神经细胞瘤、神经内分泌肿瘤、卵巢癌、胰腺癌、乳头状甲状腺癌、甲状旁腺肿瘤、儿科癌症、周围神经鞘肿瘤、嗜铬细胞瘤、垂体肿瘤、前列腺癌(例如转移性去势抵抗前列腺癌(mcrpc))、后部葡萄膜黑素瘤、肾转移癌、横纹肌样瘤、横纹肌肉瘤、肉瘤、皮肤癌、童年期的小圆形蓝细胞瘤(例如成神经细胞瘤或横纹肌肉瘤)、软组织肉瘤、鳞状细胞癌(例如头颈部鳞状细胞癌(scchn)、胃癌、滑膜肉瘤、睾丸癌、胸腺癌、胸腺瘤、甲状腺癌(例如甲状腺转移癌症)和子宫癌。e103.根据e102所述的方法,其中所述癌症是前列腺癌、肛门癌、鳞状细胞癌、乳腺癌、黑素瘤或肺癌。e104.根据e102或e103的任一项所述的方法,其中所述癌症是前列腺癌。e105.根据e102-e104的任一项所述的方法,其中所述前列腺癌是mcrpc。e106.根据e102或e103的任一项所述的方法,其中所述癌症是肛门癌。e107.根据e102或e106所述的方法,其中所述肛门癌是scac。e108.根据e102或e103的任一项所述的方法,其中所述癌症是鳞状细胞癌。e109.根据e102、e103或e108的任一项所述的方法,其中所述鳞状细胞癌症是scchn。e110.根据e102或e103的任一项所述的方法,其中所述癌症是乳腺癌。e111.根据e102、e103或e110的任一项所述的方法,其中所述乳腺癌是tnbc。e112.根据e102或e103的任一项所述的方法,其中所述癌症是黑素瘤。e113.根据e102、e103或e112的任一项所述的方法,其中所述黑素瘤是葡萄膜黑素瘤。e114.根据e102或e103的任一项所述的方法,其中所述癌症是肺癌。e115.根据e102、e103或e114的任一项所述的方法,其中所述肺癌是nsclc。e116.根据e1-e115的任一项所述的方法,进一步包括施用治疗或预防有效量的一种或多种另外治疗剂或化疗剂。e117.根据e116所述的方法,其中所述化疗剂是基于铂的化疗剂。e118.根据e116所述的方法,其中所述化疗剂是紫杉烷。e119.根据e1-e119的任一项所述的方法,其中所述需要其的受试者是人。
实施例
[0280]
现在已经大致地描述了本发明,本发明通过参考以下实施例将更容易理解。以下实施例阐释了在本发明的诊断中或治疗方法中组合物的各种方法。实施例旨在阐释,但不是限制,本发明的范围。实施例1b7-h3-adc与pd-1结合分子组合展示出c57bl/6小鼠中有效的体内抗肿瘤活性
[0281]
为了进一步表明本发明的b7-h3-adc与pd-1结合分子组合的抗肿瘤活性,使用用
阳性肿瘤的剂量依赖性体内抗肿瘤活性。用5mg/kg b7-h3-adc治疗的0/6动物中看见了完全应答,而用10mg/kg b7-h3-adc治疗的2/6动物中看见了完全应答。b7-h3-adc与抗pd-1抗体的组合增强了b7-h3-adc的抗肿瘤活性。用5mg/kg b7-h3-adc+20mg/kg抗pd-1抗体治疗的3/6动物中和用10mg/kg b7-h3-adc+20mg/kg抗pd-1抗体治疗的5/6动物中看见了完全应答。实施例2b7-h3-adc与pd-1结合分子组合展示出balb/c小鼠中有效的体内抗肿瘤活性
[0284]
为了进一步表明本发明的b7-h3-adc与pd-1结合分子组合的抗肿瘤活性,使用用人b7-h3转染的鼠ct26结直肠肿瘤细胞系(“ct26/hb7-h3”)评估b7-h3-adc任选地与抗pd-1抗体(rmp1-14;bioxcell,lebanon,nh,usa)组合对balb/c同基因的小鼠模型中体内毒性。简言之,将~5x105肿瘤细胞(1:1培养基和中悬浮)皮下植入致balb/c小鼠(charles river laboratories)的侧面。当在第13天肿瘤已经达到约40-100mm3的体积,随机分配小鼠并且腹膜内施用b7-h3-adc、抗pd-1抗体或对照媒介物。在这些研究中,在第13天施用一剂量的b7-h3-adc(10mg/kg)或对照媒介物。在第13天、第16天、第19天、第22天、第26天、第29天、第33天和第36天以20mg/kg施用抗pd-1抗体。用电子测径器通过垂直测量每周两次测量肿瘤,肿瘤体积计算为:(长度x宽度x高度)/2。确定了肿瘤体积(相对于对照)(“t/c”)。认为在研究阶段期间发现治疗动物的肿瘤体积已经减少至≤5mm3,以表示完全应答(“cr”)并且当肿瘤在研究期间在任何点从给药的那天开始减少50%或更多时定义为部分应答(“pr”)。抗肿瘤活性根据国家癌症研究所(nci)标准评估;t/c≤42%是抗肿瘤活性的最低水平,而》42%的t/c值是不活跃的。t/c《10%被认为高度活跃。针对ct26/hb7-h3肿瘤细胞的体内活性
[0285]
在表2和图3中呈现了关于皮下植入的ct26/hb7-h3结直肠癌肿瘤细胞该研究的结果。
evaluation criteria in solid tumours:revised recist guideline(version1.1)”eur.j.cancer.45(2):228-247);实体肿瘤的免疫相关的反应评估标准(irrecist)(wolchok,j.d.等,(2009)“guidelines for the evaluation of immune therapy activity in solid tumors:immune-related response criteria.”clin.cancer res,15:7412-7420)或改进的国际工作组标准(即,the lugano classification;cheson,b.d.等,(2014)“recommendations for initial evaluation,staging,and response assessment of hodgkin and non-hodgkin lymphoma:the lugano classification.”j.clin.oncol,32:3059-3068),用于应答评估,如果适用的话。
[0293]
在剂量递增阶段中,将0.3mg/kg至多达5mg/kg的依次递增剂量遵循常规的3+3+3设计q3w施用:评估每个3至9名患者的连续队列(表3)。在各种剂量水平,评估为对剂量递增目的不可评估的患者将被替换。还将在多个感兴趣的剂量水平加入另外的患者,以获得另外的临床经验。在剂量递增阶段中,将加入具有任何组织学的不可切除、复发或难治、局部晚期和或转移性实体肿瘤的患者。
[0294]
基于包括但不限于观察的临床活性、外周受体占有率和药物动力学(pk)的来自单疗法(单独的b7-h3-adc)剂量递增阶段的全部临床数据,将选择q3w施用的最大耐受剂量(mtd)作为待在单疗法队列扩展阶段中并且也在b7-h3-adc和hpd-1 mab-a的组合剂量递增研究中被评估的给药方案。
[0295]
在b7-h3-adc和hpd-1 mab-a的组合研究的剂量递增阶段中,375mg固定剂量的hpd-1 mab-a将遵循常规的3+3+3设计q3w施用:如表4中列出了用b7-h3-adc的剂量的3至9名患者的连续队列。在各种剂量水平,评估为剂量递增目的不可评估的患者将被替换。还将在多个感兴趣的剂量水平加入另外的患者,以获得另外的临床经验。在剂量递增阶段中,将加入具有任何组织学的不可切除、复发或难治、局部晚期或转移性实体肿瘤的患者。取决于任何观察到的毒性的性质和时机,b7-h3-adc的剂量可逐步降低至mtd-3并且hpd-1 mab-a可减少至250mg的固定剂量,或两种药物可被调整至研究人员认为合适的队列1剂量水平或以下的其他水平。
[0296]
在队列扩展阶段,具有复发/难治、不可切除的局部晚期或转移性scchn、mcrpc,tnbc和葡萄膜黑素瘤的患者将接受以mtd的单独的b7-h3-adc。类似地,具有不可切除、局部晚期或转移性scchn或mcrpc的患者队列,基于组合剂量递增研究,将用与hpd-1 mab-a组合的b7-h3-adc以mtd剂量治疗,这基于来自研究的剂量递增阶段的安全性、pk和抗肿瘤活性。治疗相关的不良事件
[0297]
提供了在23名患者以q3w剂量递增的治疗后的发现。如表6中显示的,22/23名(91.7%)患者中发生的治疗相关的不良事件(trae),最常见的嗜中性细胞减少症(n=6)、淋巴球减少症(n=3)、掌跖红斑感觉不良综合征(n=5)和斑丘疹(n=3)。≥3级的trae的比率是58.3%。3名患者中发生的三种治疗相关的严重不良事件:1)具有并发细菌肺炎的患者中的肺炎;2)非感染胃肠炎;和3)具有慢性静脉功能不全的患者的瘀滞性皮炎。报道了一种变成至基线的4级嗜中性细胞减少症的一种剂量-限制的毒性(“dlt”)。没有观察到热病嗜中性细胞减少症。
[0298]
基于来自剂量递增阶段的结果,选择3mg/kg的剂量作为扩展队列的治疗剂量。
[0299]
七十二名患者已经用3mg/kg b7-h3-adc治疗(包括剂量递增和剂量扩展队列)。≥3级trae发生45.8%的患者,并且包括嗜中性细胞减少症(16.7%)、淋巴球减少症(6.9%)、
贫血(4.2%)和掌跖红斑感觉不良综合征(4.2%)。靶病灶减少
[0300]
图4呈现了瀑布图,展示了在接受以q3w0.5 mg/kg、1mg/kg、2mg/kg、3mg/kg或4mg/kg的b7-h3-adc单疗法的26名应答-可评估的剂量递增和队列扩展患者之中靶病灶的减少百分比。在剂量递增的治疗后每6周和在队列扩展的治疗后每9周对患者进行成像。显示了来自接受至少一个剂量的b7-h3-adc且具有至少一次基线后肿瘤评估的患者的数据。剂量递增队列中的患者包括具有非小细胞肺癌(nsclc)、葡萄膜黑素瘤、黑素瘤、前列腺癌、转移性去势抵抗前列腺癌(mcrpc)、小细胞肺癌(sclc)、结直肠癌(crc)、卵巢癌、肾细胞癌症(rcc)、胰腺癌、肉瘤和食管癌的那些。一名转移性去势抵抗前列腺癌(mcrpc)患者接受了5剂量b7-h3-adc;前4剂量以2mg/kg给予,并且第五剂量以1mg/kg给予。与基线相比,该mcrpc患者的靶病灶减少了约30%。一名nsclc患者接受了6剂量2mg/kg的b7-h3-adc,并且与基线相比,靶病灶减少了24%。图5显示了该患者在2剂量2mg/kg b7-h3-adc q3w后的计算机断层扫描(ct)肺成像扫描。如临床研究人员所指出的,前-后切片中的肺病灶(由箭头所示),证实减少了约24%。图4还显示了接受3mg/kg b7-h3-adc的7名应答-可评估的队列扩展患者中靶病灶的减少百分比。两名患者具有nsclc和4名患者具有mcrpc。患者接受了至少一个剂量的b7-h3-adc并且具有至少一次基线后肿瘤评估。该研究正在进行中,并且数据仍在完善中。前列腺特异性抗原(psa)评估
[0301]
九名具有mcrpc的患者已以剂量递增用1mg/kg、2mg/kg、3mg/kg或4mg/kg的b7-h3-adc q3w治疗。在基线和第6周、第12周和第19周时从患者获得血液样品以测试psa水平。使用常规测试在临床位点测量psa水平。五名患者(71%)具有范围为50%-95%的psa水平从基线的显着下降,包括一名具有骨疾病显着消退的患者。mcrpc患者、临床应答和psa结果的总结在表7中显示。
[0302]
九名具有mcrpc的患者已经以剂量递增用2mg/kg、3.0mg/kg或4mg/kg b7-h3-adc q3w治疗,并且16名具有mcrpc的患者已经以队列扩增用3.0mg/kg b7-h3-adc q3w治疗。十一名患者(46%)具有范围为50%-95%的从基线≥50%的psa水平下降,如图6中显示的。这项研究正在进行中,数据仍在完善中。
[0303]
这些数据指示,本发明的b7-h3-adc展示出可接受的安全性,并在多种肿瘤类型中展示出令人鼓舞的抗肿瘤活性的证据。这些数据还指示,用b7-h3-adc治疗的mcrpc患者的psa水平显着降低,使mcrpc成为用于研究的队列扩展阶段中进一步分析的可行的癌症指示。b7-h3表达的免疫组织化学(ihc)分析
[0304]
使用免疫组织化学(ihc)在来自患者的前列腺和其他实体肿瘤的活检组织中分析b7-h3的表达。十八名患者具有对b7-h3表达可评估的组织样品。所使用的特定测定是来自ventana medical systems,inc.(“ventana”;tuscon,az)的b7-h3(sp206)ihc测定。b7-h3在肿瘤内细胞的细胞膜中和脉管系统中的表达由0-3+强度的h评分表示。计算每个染色强度水平的细胞百分比,最后,使用下式分配h评分:h评分=[1
×
(%细胞1+)+2
×
(%细胞2+)+3
×
(%细胞3+)]b7-h3表达的h评分范围是82-279,肿瘤中200的中位评分。脉管系统中b7-h3表达的范围是0至2+,并且中位评分是2+。
[0305]
本说明书中所提及的所有出版物和专利以相同的程度通过引用并入本文,如同每个单独的出版物或专利申请被明确且单独地指出以其全部内容通过引用并入一样。尽管本发明已经结合其具体实施方式进行了描述,但是应当理解它能进一步改变,并且本技术意欲涵盖本发明的任何变化、用途或调整,其总体上遵循本发明的原理并且包括落入本发明所属领域内的已知或惯用实践内的并且可适用于前文所提出的实质特征的这种偏离。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1