用于预防和/或治疗血小板减少症的具有APAC活性的抗血栓分子的制作方法
用于预防和/或治疗血小板减少症的具有apac活性的抗血栓分子
技术领域
1.本发明涉及具有抗血小板和抗凝血(apac)活性的抗血栓分子,特别是其作为药物预防和/或治疗肝素诱导的血小板减少症(hit)i型或ii型;和/或肝素诱导的血小板减少症伴血栓形成(hitt);和/或不依赖于肝素的自身免疫性血小板减少症hit(ahit);和/或疫苗诱导的血小板减少症伴血栓形成(vitt)的用途。本发明可用于医疗和兽医行业。
背景技术:
2.血小板减少症可能由导致血小板破坏增加或血小板产生减少的情况引起。肝素可通过免疫和非免疫介导的机制引起血小板减少症。这两种类型的肝素诱导的血小板减少症(hit)可由肝素施用引起:i型,非免疫介导的;和ii型,免疫介导的。术语“非免疫性肝素相关性的血小板减少症”用于表示i型,一种不存在肝素依赖性抗体的良性病症。术语“免疫介导的肝素诱导的血小板减少症”(hit)用于表示可检测到致病性肝素依赖性抗体的血小板减少症,该术语是hit ii型最广泛接受的名称。
3.人们还认识到,一些患者尽管在最近或根本没有接受过肝素,但却出现hit的临床症状和实验室特征(自发性hit综合征)。这些患者的血清含有即使在没有肝素的情况下也能强烈激活血小板的抗体。然而,这种“不依赖于肝素”的血小板活化特性并不是自发性hit综合征所独有的,而且在少数(肝素依赖性)典型hit患者的血清中也有发现。此外,表现出这种体外反应性特征的患者更有可能出现不寻常的hit综合征,例如迟发性hit、持续性hit、磺达肝素相关hit和因暴露于肝素“冲洗(flushes)”而诱发的hit。这种形式的hit称为ahit。最近,在疫苗诱导的血小板减少症伴血栓形成(vitt)中也发现了ahit样的以pf4为主的抗体。
4.此外,任何类型的血小板减少症(hit i、hit ii、ahit或vitt)都可能导致血栓形成,因此患者可能会出现血小板减少症伴血栓形成(hitt)。值得注意的是,hitt可导致动脉或静脉血栓形成并发生在多个部位。
5.总之,hit i是肝素相关的和短暂的,而hit ii是免疫性的、长期存在的和更易于发病,因为进一步的hit ii抗体可以诱发hitt。
6.肝素诱导的血小板减少症(hit ii型)是一种危险的、可能致命的,对普通肝素(unfractionated heparin,ufh)或较少见的低分子量肝素(lmwh)的免疫反应。
7.hit ii的发病率在接受肝素的患者中为0.1-5%,其中35-50%的患者出现血栓并因此表现为hitt。发生hitt的风险随着肝素治疗的持续时间(》5天)、肝素的类型(ufh/lmwh)和剂量、治疗指征(手术和创伤风险较高、组织暴露于血小板和凝血活性)和患者的性别(女性风险更大)而增加。因此,hitt是肝素治疗的潜在的致命的免疫并发症。主要临床表现是血小板计数下降,在接近肝素暴露情况下血栓栓塞倾向增加,或其他一些不良反应。
8.hit ii的诊断包括实验室和临床检查。临床4t评分评估血小板减少的程度、肝素施用后血小板下降的时序、血栓的存在和其他血小板减少原因的可能性。该评分系统具有
较高的阴性预测值,有助于排除hitt。此外,这种4t评分作为指导实验室检查的先决条件很重要,因为对于一个无症状患者,如果4t评分显示为hit ii,那么超声检查可能会发现血栓形成,一旦确定,则患者需要治疗而不是预防的方法。
9.在诊断或怀疑hit ii或hitt后,必须停用所有肝素类药物,并需要逆转华法林治疗以预防静脉性肢体坏疽。所有hit ii患者都需要4周的抗凝治疗,如果并发血栓形成hitt,抗凝治疗可延长至3个月。在一些情况下,可以使用静脉内免疫球蛋白。
10.因此,hit ii是一种强烈的促血栓形成疾病,不幸的悖论是,血栓预防和/或血栓形成治疗转而成为新血栓形成的诱导剂。它是由超大型免疫复合物(ulic)引起的,其大小可达微米。ulic由聚阴离子组成,如普通肝素(ufh)或其他糖胺聚糖(gag)或多磷酸盐或与血小板因子4(pf4)结合的dna,当血小板被激活时,例如在心肺分流或其他形式的接触激活凝血后会释放出来。pf4四聚体沿着ufh主链寡聚化,加入另外的ufh分子、另外的pf4分子等。这种结构修饰产生了一个大型抗原阵列,稳定了一些hitt抗体所识别的pf4上的表位。
11.这些抗原复合物能够结合多种抗pf4/ufh的抗体,其中一些反过来又促进了寡聚化。
12.pf4与造血细胞和血管细胞表达的糖胺聚糖之间也形成抗原复合物,在肝素消散和代谢之后的很长一段时间内,这些抗原复合物继续成为hitt抗体的靶标。
13.ulic还通过igg受体fcγriia激活血小板,释放pf4,从而使新抗原的形成持续并导致不受控制的凝血酶形成。pf4与肝素和其他gag结合时会中和它们,因此阻碍了抗凝作用。
14.ulic还激活中性粒细胞以产生dna网,激活单核细胞以表达组织因子,激活补体诱导内皮表达组织因子和释放von willebrand因子等。组织因子的表达导致凝血酶的产生,从而放大这些细胞类型的激活,加剧血栓形成的风险。
15.现代疗法包括施用最大耐受剂量的凝血酶抑制剂或因子xa抑制剂或达那肝素(danaparoid)疗法。然而,相当一部分患者出现新的血栓栓塞并发症,据报道,大出血的风险高达40%。因此,有必要采取合理的、针对疾病的干预措施,作用于致病过程中与凝血酶形成接近的步骤,这将使较低剂量的抗血栓剂安全有效。具体而言,预防或破坏抗原形成或预防或破坏免疫复合物形成的药物,最好是全部,将作用于致病过程的最接近步骤,并且不仅会减弱凝血酶的产生,还会阻断激活igg-fc受体或激活补体的其他有害作用。
16.因此,我们在本文中描述了基于肝素的组合物的用途,其在预防或破坏pf4/ufh复合物和/或预防或破坏ulic的形成方面有出人意料的效果。
技术实现要素:
17.根据本发明的第一方面,提供了一种同时具有抗血小板和抗凝血(apac)活性的抗血栓分子,其包含通过多个接头分子连接有选自包括4、5、6、7、8、9、10、11、12、13、14、15和16条链的组的多条肝素链的人血浆蛋白,每条链的mw在10-21kda之间,用于预防和/或治疗血小板减少症。
18.在本发明的优选实施方案中,所述血小板减少症选自包括以下的组:肝素诱导的血小板减少症(hit)i型;肝素诱导的血小板减少症(hit)ii型;血小板减少症伴血栓形成(hitt);不依赖于肝素的血小板减少症ahit;和疫苗诱导的血小板减少症伴血栓形成
(vitt)。
19.最理想地,所述血小板减少症选自包括以下的组:肝素诱导的血小板减少症(hit)ii型;和血小板减少症伴血栓形成(hitt)。
20.仍然最理想地,所述血小板减少症是基于免疫的并且选自包括以下的组:肝素诱导的血小板减少症(hit)ii型;血小板减少症伴血栓形成(hitt);不依赖于肝素的血小板减少症ahit;和疫苗诱导的血小板减少症伴血栓形成(vitt)。
21.仍然更理想地,所述血小板减少症是非基于免疫的并且选自包括以下的组:肝素诱导的血小板减少症(hit)i型;血小板减少症伴血栓形成(hitt);和疫苗诱导的血小板减少症伴血栓形成(vitt)。
22.仍然更理想地,所述血小板减少症由肝素引起并且选自包括以下的组:肝素诱导的血小板减少症(hit)i型;肝素诱导的血小板减少症(hit)ii型;血小板减少症伴血栓形成(hitt);和疫苗诱导的血小板减少症伴血栓形成(vitt)。
23.不希望受理论束缚,我们认为,apac具有使其有效用于治疗血小板减少症的特性。apac不仅具有理想的双重抗血小板/抗凝活性,而且是一种相对较小的阴离子分子,与ufh竞争hit抗原和/或ulic的形成/稳定性,使其成为hit ii型或hitt和/或ahit和/或vitt的合理干预措施。
24.此外,我们认为令人惊讶的是,基于肝素的组合物,即apac,可用于预防或治疗hit i型、hit ii型或hitt;和/或vitt,即由肝素(通常为ufh/lmwh)的存在引起的疾病。
25.在pct/ep2015/069327(wo/2016/030316)中描述了apac的制造和使用以治疗由肝素施用以外的因素引起的血栓形成以及针对其的免疫反应。
26.值得注意的是,hit ii型或hitt可能导致动脉和静脉血栓形成,因此本文通篇提及的血栓形成的预防或治疗是指动脉和静脉血栓形成的治疗。
27.在本发明的又一方面,提供了具有抗血小板和抗凝血(apac)活性的抗血栓分子在制备治疗肝素诱导的血小板减少症的药物中的用途,所述抗血栓分子包含通过多个接头分子连接有选自包括4、5、6、7、8、9、10、11、12、13、14、15和16条链的组的多条肝素链的人血浆蛋白,每条链的mw在10-21kda之间。
28.在本发明的优选实施方案中,所述apac分子具有6条或更少,例如在4、5或6条之间的连接至所述血浆蛋白的肝素链,理想地为5条肝素链。仍然更优选地,所述apac分子具有1.1mg/ml的肝素浓度,并且所述人血浆蛋白,理想地是血清白蛋白(hsa),具有0.87mg/ml的浓度。
29.在本发明的优选实施方案中,所述apac配制成以包括和在0.15μg/ml-10μg/ml之间的剂量施用,其中在该范围的较高端,对hit i型或hitt ii型的抑制几乎是完全的。更优选地,hitt在0.3μg/ml时被抑制,在1μg/ml及以上时观察到主要抑制作用。因此,本发明包括被配制成用于施用的apac,其在血液或血浆中的剂量范围包括和在0.15μg/ml-3μg/ml之间,包括该范围间的所有0.1μg/ml。包含1-3μg/ml的制剂是特别优选的。此外,可供选择地,制剂优选在0.1-0.3mg/kg的范围。
30.在本发明的优选实施方案中,所述肝素缀合的人血浆蛋白是白蛋白、球蛋白或纤维蛋白原,理想地是血清白蛋白或α2-巨球蛋白,更理想地是人血清白蛋白(hsa)或人α2-巨球蛋白。众所周知,血清白蛋白由肝脏产生,溶解在血浆中,是哺乳动物中最丰富的血液蛋
白。血清白蛋白是一种球状水溶性蛋白质,分子量约为66000道尔顿。还众所周知的是,α2-巨球蛋白(α2m和a2m)是一种大的血浆蛋白,实际上它是血浆中最大的主要非免疫球蛋白,主要由肝脏产生。α2-巨球蛋白作为一种抗蛋白酶,能够使多种蛋白酶失活。
31.在本发明的又一个优选实施方案中,所述血浆蛋白是重组的。
32.在本发明的又一个优选实施方案中,所述肝素是普通肝素(unfractionated heparin)。仍然更理想的是,所述肝素是哺乳动物来源的,理想地是人或猪的。在血浆蛋白是人血浆蛋白并且肝素是猪肝素或牛肝素的情况下,所述apac分子代表嵌合分子。
33.优选地,肝素的mw选自包括以下的组:10、11、12、13、14、15、16、17、18、19、20或21kda,理想地为15或16或17kda。
34.在本发明的又一个优选实施方案中,所述肝素是重组的。
35.在本发明的又一个更优选的实施方案中,所述接头分子,至少在所述肝素与所述血浆蛋白的连接完成时,是结合一个肝素分子的单个接头分子,因此一个接头分子与所述血浆蛋白的连接导致一个肝素分子与所述血浆蛋白的连接。因此,所述接头与所述肝素的化学计量比为1:1。优选地,所述接头是胺接头,因此与所述肝素和血浆蛋白上的氨基连接,理想地但不排他地,所述接头与肝素链上的丝氨酸(理想地位于所述链的末端或靠近末端)缀合,并且理想地但不排他地,与血浆蛋白上的赖氨酸缀合。还更理想地,所述接头通过使用二硫键缀合所述肝素和血浆蛋白。还更优选地,所述接头是异双功能交联剂,例如3-(2-吡啶基二硫代)丙酸n-羟基琥珀酰亚胺酯(spdp)接头,或同双功能交联剂,例如3,3
’‑
二硫代二丙酸二(n-羟基琥珀酰亚胺(nhs)酯(dtsp)接头。
36.spdp(可从例如sigma-aldrich或thermo scientific pierce商购)是一种短链交联剂,用于通过n-羟基琥珀酰亚胺(nhs)酯和吡啶基二硫醇反应基团进行胺与巯基的缀合,并与半胱氨酸巯基形成可裂解的(可还原的)二硫键。它有短链和长链版本。长链版本可以磺化形式提供,并且是水溶性的。我们更喜欢使用3-(2-吡啶基二硫代)丙酸n-羟基琥珀酰亚胺酯。尽管所有spdp都含有胺反应性n-羟基琥珀酰亚胺(nhs)酯,该酯将与赖氨酸残基反应形成稳定的酰胺键,并且在接头的另一端,有一个将与巯基反应形成可逆的二硫键的吡啶基二硫基团。
37.dtsp(3,3
’‑
二硫代二丙酸二(n-羟基琥珀酰亚胺(nhs)酯),可从例如sigma-aldrich或thermo scientific pierce商购)是短链交联剂,用于通过n-羟基琥珀酰亚胺(nhs)酯基团进行胺与胺的缀合。它有短链和长链版本。长链版本可以磺化形式(n-羟基磺基琥珀酰亚胺(磺基-nhs)酯)提供并且是水溶性的。dtsp含有两个胺反应性n-羟基琥珀酰亚胺(nhs)酯基团和间隔臂中的二硫桥。n-羟基琥珀酰亚胺酯与含有伯胺的残基反应形成稳定的酰胺键,并在接头分子中具有可裂解的二硫键。
38.在优选的实施方案中,所述apac具有5个肝素/人血清白蛋白(hsa)的偶联水平(cl),并且用于偶联的接头是spdp。
39.鉴于当所述apac分子具有6个或更少(例如4-6个)连接到所述血浆蛋白的肝素链时,抗血栓分子/apac具有抗血小板和抗凝血(apac)活性,所述分子主要或在较大程度上作为抗凝剂发挥作用。
40.鉴于当所述apac分子具有8-16个连接到所述血浆蛋白的肝素链时,抗血栓分子/apac具有抗血小板和抗凝(apac)活性,所述分子主要或在更大程度上作为抗血小板剂/血
小板抑制剂发挥作用。
41.根据本发明的另一方面,提供了一种预防和/或治疗血小板减少症的方法;其中向待治疗的个体施用有效量的抗血栓分子,所述抗血栓分子同时具有抗血小板和抗凝血(apac)活性,其包含通过多个接头分子连接有多条肝素链的血浆蛋白,所述肝素链各自具有10-21kda之间的mw,并且进一步地,其中连接至所述血浆蛋白的所述肝素链的数目选自包括4、5、6、7、8、9、10、11、12、13、14、15和16的组。
42.在本发明的另一个优选方法中,所述apac代替肝素,即lmw肝素或普通ufh(unfractionated ufh)。
43.在本发明的又一个优选实施方案中,所述apac以包括和在0.15μg/ml-10μg/ml之间的剂量在血液或血浆中施用,其中在所述范围的较高端,hit或hitt的抑制几乎是完全的。更优选地,hitt在0.3μg/ml时被抑制,在1μg/ml及以上时观察到主要抑制作用。因此,本发明包括配制成以包括和在0.15μg/ml-3μg/ml之间的剂量施用的apac,包括该范围间的所有0.1μg/ml。此外,可供选择地,制剂优选在0.1-3mg/kg的范围。
44.在所附的权利要求和前面对本发明的描述中,除非上下文因明确的语言或必要的暗示而另有要求,否则“包括”一词或诸如“包“包含”的变形形式用于表示包括在内的意义,即指明所述特征的存在,但不排除在本发明的各种实施方案中存在或添加进一步的特征。
45.本说明书中引用的所有参考文献,包括任何专利或专利申请,均通过引用并入本文。不承认任何参考文献构成现有技术。此外,不承认任何现有技术构成本领域公知常识的一部分。
46.本发明的每个方面的优选特征可以用于描述任何其他方面。
47.本发明的其他特征将从以下实施例中变得显而易见。一般而言,本发明扩展到本说明书(包括所附权利要求和附图)中公开的特征中的任何一个新颖的特征或任何新颖的组合。因此,结合本发明的特定方面、实施方案或实施例描述的特征、整数、特性、化合物或化学部分应理解为适用于本文所述的任何其他方面、实施方案或实施例,除非与之不相容。
48.此外,除非另有说明,否则本文公开的任何特征都可以由用于相同或相似目的的替代特征代替。
附图说明
49.现在将仅通过示例的方式描述本发明,并特别参考以下附图,其中:
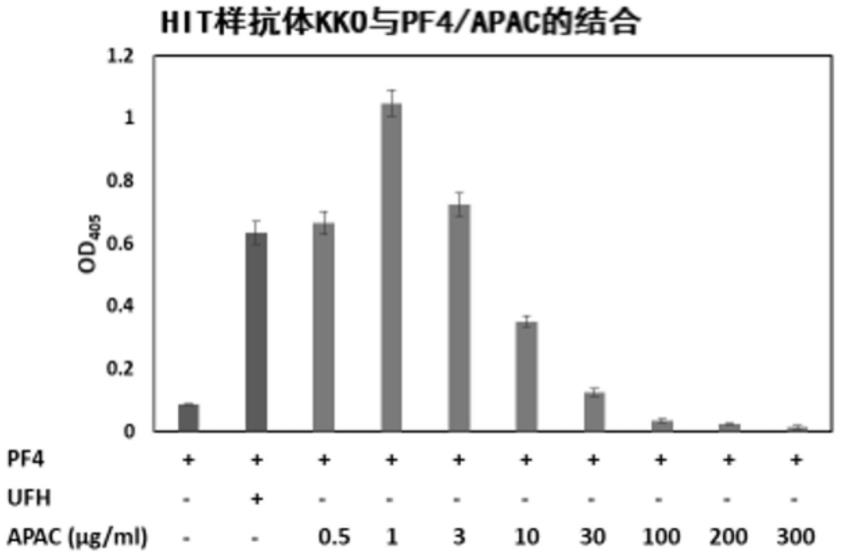
50.图1.显示了hit样单克隆抗体kko(arepally等人,blood.2000;95:1533-1540https://www.ncbi.nlm.nih.gov/pubmed/10688805)与pf4在存在和不存在ufh和apac的情况下的结合。a,显示了hit样单克隆抗体kko(针对人pf4和肝素的复合物的小鼠单克隆igg[2bκ]抗体)与以下的结合:1)固定化的pf4(每孔50μl 5μg/ml=0.25μg),2)在ufh(0.1iu/ml)存在下的固定化的pf4,和3)在apac(0.5、1、3、10、30、100、200和300μg/ml;在肝素等效浓度下)存在下的固定化的pf4。b,显示了抗体kko与以下的结合:1)固定化的pf4(0.25μg),2)在ufh(0.1iu/ml)存在下的固定化的pf4,3)在ufh(0.1iu/ml)和apac(3、10、30和100μg/ml)存在下的固定化的pf4,和4)在apac(3、10、30和100μg/ml)存在下的固定化的pf4。结果显示为3次独立实验的平均值(sem)的平均值
±
标准误差。
[0051]
图2.显示了apac对大的抗原性pf4/ufh复合物形成的抑制作用。在存在和不存在
apac(0.15、0.3、1、2、3、5或10μg/ml;显示为肝素当量浓度)的情况下,pf4(10μg/ml)和ufh(0.1iu/ml)之间形成的颗粒大小在0、1、2、3、4、5、6和24小时的孵育时间后显示。通过动态光散射(dls)检测颗粒形成。结果显示为3次独立实验的平均值
±
标准偏差(sd)。
[0052]
图3.显示了apac对预先形成的大的抗原性pf4/ufh复合物的解离作用。pf4/ufh复合物首先在10μg/ml的pf4和0.2iu/ml的ufh之间形成。在存在和不存在apac(0.15、0.3、1、2、3、5或10μg/ml;为肝素当量浓度下)的情况下,这种预先形成的pf4/ufh复合物的颗粒大小在0、1、2、3、4、5、6和24小时的孵育时间时显示。通过dls检测颗粒形成。结果显示为3次独立实验的平均值
±
sd。
[0053]
图4.显示了apac对kko/pf4/ufh超大免疫复合物(ulic)形成的竞争作用。在存在和不存在apac(0.15、0.3、1、2、3、5或10μg/ml;显示为肝素当量浓度)的情况下,pf4(10μg/ml)、ufh(0.2iu/ml)和hit样单克隆抗体kko(30μg)之间形成的ulic颗粒大小在0、1、2、3、4、5、6和24小时的孵育时间时显示。通过dls检测颗粒形成。结果显示为3次独立实验的平均值
±
sd。
[0054]
图5.显示了apac对kko/pf4/ufh的预先形成的超大免疫复合物(ulic)的解离作用。首先使用pf4(10μg/ml)、ufh(0.2iu/ml)和hit样单克隆抗体kko(30μg)形成ulic。在存在和不存在apac(0.15、0.3、1、2、3或5μg/ml;为肝素当量浓度下)的情况下,预先形成的kko/pf4/ufh复合物的颗粒大小在0、1、2、3、4、5、6和24小时的孵育时间时显示。通过dls检测颗粒形成。结果显示为3次独立实验的平均值
±
sd。
[0055]
图6.显示了apac对诱导人单核细胞样细胞系(thp-1)上的组织因子(tf)活性的作用。thp-1细胞首先与pf4(10μg/ml)一起孵育,然后补充apac(10、50或100μg/ml;为肝素当量浓度下)。对照thp-1细胞未用apac处理。将hit样单克隆抗体kko(50μg/ml)包括在内以诱导免疫复合物(ic)的形成。fxa活性的产生反映了细胞悬浮液中活跃的tf表达。数据被描述为相对于单独的thp-1细胞产生fxa的初始速率的平均倍数增加。结果显示为4次实验的平均值
±
sem。
具体实施方式
[0056]
方法
[0057]
缀合
[0058]
通过由两种可供选择的交联剂产生的二硫桥使普通肝素hep(ufh链与人血清白蛋白(hsa)缀合,反应路线如下:
[0059]
i)异双功能交联剂3-(2-吡啶基二硫代)丙酸n-羟基琥珀酰亚胺酯(spdp)。利用hep接头区域的ser上的游离胺和hsa上的lys进行缀合。hep和hsa在单独的反应中分别被修饰为巯基(-sh)和吡啶基二硫醇(-pdp)衍生物。在最终的缀合反应中,hsa的吡啶基二硫醇基团与hep的巯基基团反应,形成二硫键复合物并释放吡啶2-硫酮。
[0060]
ii)同双功能交联剂3,3
’‑
二硫代二丙酸二(n-羟基琥珀酰亚胺(nhs)酯)(dtsp)。利用hep接头区域的ser上的游离胺和hsa上的lys进行缀合。hep首先被修饰为n-羟基琥珀酰亚胺(nhs)酯衍生物,释放出第一个nhs基团。在最终的缀合反应中,hsa的lys与衍生的hep的n-羟基琥珀酰亚胺(nhs)酯基团反应,形成在接头区域具有可裂解二硫键的复合物并释放第二个n-羟基琥珀酰亚胺基团。
[0061]
上述定义的hsa和hep中间体衍生物在最终缀合反应中产生hep-hsa复合物的比率被选择为在最终纯化的hep-hsa复合物中产生指定的平均缀合水平(cl)。
[0062]
hep-hsa复合物通过超滤/渗滤和阴离子交换色谱法进行纯化,使用q sepharose介质(ge healthcare,usa)或超滤/渗滤。最后,将hep-hsa复合物洗脱到ph为7.4-7.5的磷酸盐缓冲盐水(pbs)中。复合物被命名为apac-,后缀指定hep链与hsa的平均缀合水平。因此,本文所提及的选自包括4、5、6、7、8、9、10、11、12、13、14、15和16条链的组的与人血浆蛋白缀合的多条肝素链,是指平均缀合水平。
[0063]
举例说明本发明的apac复合物的通式是(hep-nh-co-ch
2-ch
2-s-s-ch
2-ch
2-co-nh)
n-hsa,其中与hsa偶联的普通肝素链的平均数目被定义为n。
[0064]
使用hep和hsa的浓度及其平均分子量通过以下等式确定hep与hsa的平均缀合水平(cl):
[0065]
hep的摩尔数=hep[c]/平均hep mw
[0066]
hsa的摩尔数=hsa[c]/hsa mw
[0067]
cl=hep的摩尔数/hsa的摩尔数
[0068]
hep mw=15800或17000
[0069]
hsa mw=66472
[0070]
在存在和不存在ufh和apac的情况下,hit样单克隆抗体kko与pf4的结合
[0071]
首先用pf4(50μl,5μg/ml在磷酸盐缓冲盐水[pbs]中)涂覆immulon 4hbx板(thermo scientific,waltham,ma,usa)。在实验a中,孔中补充有终浓度为0.5、1、3、10、30、100、200和300μg/ml的apac。在实验b)中,apac以3、10、30、100、200和300μg/ml的终浓度单独或与恒定浓度的ufh(0.1iu/ml)一起补充。使用单独的pf4和补充有ufh(0.1iu/ml)的pf4作为对照。将板在室温(rt)下孵育过夜。第二天,用180μl pbs洗涤孔4次,并在室温下用pbs中的1%牛血清白蛋白(bsa)封闭非特异性结合1小时。接下来,孔中补充有100μg/ml(在1% bsa/pbs中)的hit样单克隆抗体kko,在37℃下保持30分钟,然后用180μl pbs/0.1%tween-20洗涤孔4次。使用在1% bsa/pbs中的与辣根过氧化物酶(hrp)缀合的山羊抗小鼠igg(fc)1:3000作为二抗(bethyl laboratories,montgomery,tx,us)孵育孔30分钟。用180μl pbs/0.1% tween-20进一步洗涤孔4次,在室温下加入100μl/孔的hrp底物2,2
’‑
连氮基-二(3-乙基苯并二氢噻唑-6-磺酸)二铵盐(roche diagnostics,mannheim,德国),在biotek synergy 2读板器(biotek instruments inc.,winooski,vt,usa)上在405nm和490nm检测二抗。结果计算为3次独立实验的平均值
±
sem。
[0072]
apac对大的抗原性pf4/ufh复合物形成的影响
[0073]
给pf4(10μg/ml)单独补充ufh(hep;0.2iu/ml),或同时补充ufh(hep;0.2iu/ml)和apac,浓度逐渐增加(0.15、0.3、1、2、3、5或10μg/ml)。在加入ufh和/或apac后立即以及在孵育1、2、3、4、6和24小时后,通过动态光散射(dls)测量颗粒大小。结果计算为3次独立实验的平均值
±
sd。
[0074]
apac对预先形成的大的抗原复合物的解离的影响
[0075]
给pf4(10μg/ml)补充ufh(0.2iu/ml)并在室温下预孵育30分钟,然后以0.15、0.3、0.5、1、2、3和5μg/ml的递增浓度加入apac。立即以及在孵育1、2、3、4、6和24小时后,通过dls测量形成的颗粒的大小。结果计算为3次独立实验的平均值
±
sd。
[0076]
apac对超大免疫复合物形成的影响
[0077]
apac(0.15、0.3、1、2、3或5μg/ml)、pf4(10μg/ml)、ufh(0.2iu/ml)和hitt样单克隆抗体kko(30μg)一起孵育,立即以及在孵育1、2、3、4、6和24小时后,通过dls测量形成的超大免疫复合物(ulic)的大小。结果计算为3次独立实验的平均值
±
sd。
[0078]
apac对预先形成的超大免疫复合物的破坏的影响
[0079]
pf4(10μg/ml)首先与hit样单克隆抗体kko在室温下孵育5分钟,然后加入ufh(0.2iu/ml)再保持5分钟,以形成pf4/kko/ufh复合物。然后向这些预先形成的pf4/kko/ufh复合物补充0.15、0.3、1、2、3或5μg/ml的apac。立即以及在孵育1、2、3、4、6和24小时后,通过dls测量形成的颗粒的大小。结果计算为3次独立实验的平均值
±
sd。
[0080]
apac对单核细胞系诱导fxa活性的影响
[0081]
thp-1细胞产生的组织因子tf与pf4/kko
±
apac一起孵育。该实验旨在确定apac是否会防止pf4和hit样单克隆抗体kko对人类单核细胞样细胞产生组织因子(tf)活性。
[0082]
thp-1细胞(人类急性白血病单核细胞系)在补充有10%胎牛血清(fbs)、4.5mg/ml葡萄糖、1mm丙酮酸钠、2mm l-谷氨酰胺、100u/ml青霉素、100μg/ml链霉素和0.25μg/ml两性霉素b的roswell park memorial institute(rpmi)1640培养基中在37℃和5% co2下培养。将thp-1细胞以每孔105个细胞接种在96孔板上,每孔含有100μl补充有5% fbs的rpmi-1640。thp-1细胞首先在37℃下与pf4(10μg/ml)一起孵育5分钟,然后与终浓度为10、50或100μg/ml的apac再孵育30分钟。对照thp-1细胞不含apac。第三步,向所有细胞补充hit样单克隆抗体kko(50μg/ml)并进一步孵育过夜。kko与细胞相关糖胺聚糖的结合取代了外源ufh。第二天洗涤细胞以去除未结合的配体。在平底96孔板中使用显色测定法测量fxa活性,其中将细胞悬浮液的等分试样(10μl)加入到含有100mm nacl和10mm cacl2的20mm tris缓冲液(ph 7.4)中的因子viia(0.5nm)和因子x(160nm)的混合物中,在37℃和5%co2下保持30分钟。加入活化的凝血因子fxa显色底物(0.4mm),并在37℃下以动力学模式读取405nm处的光密度(每分钟读取一次)30分钟。相对于使用纯化试剂的标准曲线,计算前10分钟内产生的fxa的量。
[0083]
hep聚合物的平均mw基于从肝素制造商获得的信息。hsa mw基于来自uniprotkb/swiss-prot的albu_human、p02768,分别为无信号肽和无前肽的同种型1。
[0084]
统计学。所有数据均为平均值
±
sd或sem,并通过用于windows的spss(版本15.0)(spss inc,chicago,il)进行分析。对于两组比较,采用非参数mann-whitney u检验和参数学生t检验。对于多组比较,采用非参数kruskal-wallis检验和dunn事后检验以及具有dunnett校正的参数化anova。p《0.05被认为具有统计显著性。
[0085]
实验程序
[0086]
我们的第一个目标是确定apac是否与pf4形成抗原性复合物和/或它是否降低了pf4/ufh复合物的抗原性,这由hit样抗体的结合确定。一旦我们确定了干扰抗原性的apac浓度,我们的第二个目标是检查对导致hit或hitt的大的致病复合物的大小的影响。因为我们已经发现ulic的稳定性超过24小时,所以我们假设抗原性复合物和免疫复合物随着时间的推移会发生一系列变化,这使得其越来越难以产生变化。因此,我们的目标是通过提出以下4个问题,进行一系列实验以解决hit发病机制中假定的事件顺序,每个问题依次解决:
[0087]
1)apac能否防止形成pf4/ufh复合物?
[0088]
2)apac能否破坏pf4/ufh复合物?
[0089]
3)apac能否防止形成ulic?和
[0090]
4)apac能否破坏预先形成的ulic?
[0091]
为此,我们使用了一种描述良好的鼠单克隆抗pf4/ufh抗体,称为kko,并且我们使用动态光散射(dls)来测量溶液中复合物的大小。
[0092]
最后,我们探讨了apac是否会抑制ulic在单核细胞系上产生活性凝血因子fxa活性的能力。
[0093]
结果
[0094]
注意:在所有实验中,数据以至少3次独立实验(图2-5)的平均值
±
sd或3次(图1)或4次实验(图6)的平均值
±
sem表示。
[0095]
a.apac对hit样单克隆抗体kko结合的影响。
[0096]
图1a中显示的数据来自elisa,用于测量鼠单克隆hit样抗体与pf4/apac的结合。结果表明,kko从测试的最低浓度(0.5μg/ml)开始与pf4/apac结合(参见图1a)。然而,根据随后的结果,在较高的、可能是apac的治疗浓度下,kko的结合以剂量依赖的方式降低。这与在肝素的超最佳浓度下观察到的模式相同,这是因为与pf4形成了较小的复合物。
[0097]
apac加入到pf4/ufh的效果如图1b所示,左侧。
[0098]
在apac浓度为1μg/ml时,kko与pf4/ufh的结合略有增加,这相当于单独与pf4/apac结合,即在不存在ufh的情况下(数据未显示)。然而,最重要的影响是在所有较高浓度的apac下,kko的结合呈剂量依赖性降低。对比图1b中右边和左边的幻灯片,很可能apac解离了大的pf4/ufh复合物,而结合的是我们将要提出的小的pf4/apac复合物。这些结果导致对pf4与apac的结合是否会产生大的“致病”复合物的探讨。我们认为apac的小尺寸使其不太可能以ufh所呈现的方式促进pf4的寡聚化,这一假设在下面描述的实验中得到证实。
[0099]
b.apac对大的抗原性pf4/ufh复合物形成的影响。
[0100]
在这些和随后的dls实验中,pf4(10μg/ml)与指定浓度的apac和ufh(0.2iu/ml)作为标准起始条件一起孵育。立即以及在1、2、3、4、6和24小时后(横坐标),通过dls测量颗粒大小(纵坐标)。图2中的红线显示不存在apac,即这是pf4和ufh之间形成的复合物的大小,在24小时的孵育过程中随着时间的推移继续增加。一般而言,apac浓度与颗粒大小之间存在反向剂量依赖性关系。1μg/ml apac时的看似异常的早期结果与elisa的结果相吻合,可能代表pf4/apac和pf4/ufh复合物的组合或apac掺入pf4/ufh复合物中。结果表明,apac在浓度低至0.15μg/ml时可抑制24小时孵育期间复合物的生长,而在3μg/ml时抑制几乎是完全的。
[0101]
c.apac对预先形成的大的抗原复合物的解离的影响。
[0102]
在图3所示的一组实验中,pf4与普通肝素(ufh)在室温下预孵育30分钟。然后以指定浓度加入apac。结果表明,在apac的最低浓度下,对抗原复合物的大小没有影响。在0.3μg/ml时,尺寸开始减小,在较高浓度下没有明显的尺寸大于20nm的复合物。在1μg/ml时可见主要抑制作用。
[0103]
d.apac对ulic形成的影响。
[0104]
在图4所示的实验中,apac与pf4(10μg/ml)、ufh(0.2iu/ml)和kko(30μg)一起加入,并且测量随时间推移(横坐标)的复合物的大小(纵坐标)。数据显示,在低剂量的apac
下,免疫复合物的形成增强。这与先前模式中的数据一致,显示在这些浓度下形成ufh-pf4抗原复合物时抗体结合增强。在较高浓度下,apac完全防止了超大免疫复合物(ulic)的形成,这再次与其预防和破坏抗原形成的能力一致。在3μg/ml时可见主要抑制作用。
[0105]
e.预先形成的ulic的破坏。
[0106]
这是最严格的测试,即破坏大而稳定的预先形成的pf4/kko/肝素复合物。在这里,pf4(10μg/ml)与kko在室温下孵育5分钟。在室温下加入ufh(0.2iu/ml),保持5分钟。然后以逐渐增加的浓度(0至5μg/ml)加入apac。结果如图5所示。正如我们在之前的所有实验构造中观察到的,低剂量的apac增加了复合物的大小。然而,在较高浓度的apac下,预先形成的复合物完全被破坏。在3μg/ml时可见主要抑制作用。
[0107]
f.apac对单核细胞系诱导fxa活性的影响。
[0108]
该实验旨在确定apac是否会防止pf4和kko对thp-1单核细胞的组织因子活性的诱导。thp-1细胞与pf4在有/没有apac的情况下孵育,如下所述。加入顺序是pf4(10μg/ml,5分钟孵育),然后是apac(30分钟),然后是kko(50μg/ml),均在37℃下进行。kko与细胞相关糖胺聚糖的结合代替了外源ufh。进一步孵育后,洗涤细胞以去除未结合的配体。作为tf表达的量度,检测细胞悬浮液的等分试样中产生的fxa的量。图6中显示的结果是4次实验的平均值
±
sem,每个实验在一式四份的孔中进行。结果表明,较高浓度的apac抑制了由hitt免疫复合物刺激的单核细胞系产生的fxa。这些结果与之前关于pf4/ufh和pf4/ufh/kko复合物的形成/溶解的所有实验组一致。
[0109]
结论
[0110]
这些实验支持这样的观念,即apac为治疗hit ii型和/或hitt提供了一种新方法,它将抗血栓活性与干扰ulic形成和稳定性的能力相结合,而ulic形成是致病过程中最接近的步骤之一。
[0111]
防止抗原形成《解离抗原《防止=解离免疫复合物所需的apac浓度依次增加。实际上,从理论上讲,施用apac代替ufh可以防止hit的发展,而更高的浓度可用于中断ulic形成、细胞活化、pf4和凝血酶释放的循环以及这些患者中形成的前馈血栓形成循环。
[0112]
换句话说,应该在以下情况使用apac而不是肝素:
[0113]
1)预防性地,当高度怀疑发生hit时,例如有既往史,或当hit风险增加时,例如与创伤或手术(例如心血管、介入)有关;和/或
[0114]
2)当已经发生hit ii型或hitt时,需要停用肝素时,以apac替代肝素。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1