胰腺功能的诊断剂的制作方法
1.本发明涉及胰腺功能的诊断剂。
背景技术:
2.胰腺具有分泌糖质的淀粉酶、分解蛋白质的胰蛋白酶、以及分泌含有分解脂肪的脂肪酶的消化液(胰液)的外分泌功能、分泌糖的代谢所需要的胰岛素和胰高血糖素这样的激素的内分泌功能。因此,若产生胰腺的功能障碍,则无法从食物产生或吸收生存所需的能量,由于对细胞的营养的供给不足,导致各种脏器的功能降低。另外,即使现在癌的早期发现和早期治疗很普遍,由于胰腺癌经常发现延误,因此,5年存活率还在10%以下,占据了难治性的癌的上位。
3.以往,在急性胰腺炎、慢性胰腺炎、初期胰腺癌等胰腺疾病的诊断中,例如使用基于x射线-ct和mri的图像诊断、以及基于超声波内窥镜的诊断(例如,非专利文献1和非专利文献2)。另一方面,非专利文献3中公开了在ii型糖尿病患者中,pet探针([
18
f]fdg)向胰腺的导入增加。
[0004]
现有技术文献
[0005]
非专利文献
[0006]
非专利文献1:日本腹部急救医学会杂志,2008年,28卷,561-571页
[0007]
非专利文献2:journal of the pancreas,2009年,10卷,280-283页非专利文献3:plos one,2019年,14卷,e0213202
技术实现要素:
[0008]
[发明所要解决的课题]
[0009]
以往的基于x射线-ct或mri的图像诊断是利用基于胰腺的萎缩或钙化这样的脏器的结构变化的信息的诊断,因此无法检测结构变化之前的生物学功能变化。这在基于超声波内窥镜的诊断中也是同样的。而且,基于超声波内窥镜的诊断也是侵袭性更高的检查法。另外,非专利文献3所公开的方法是进行将[
18
f]fdg作为探针的pet检查的方法,只能评价反映脏器的炎症的蓄积的增加。
[0010]
因此,本发明的目的在于提供一种能够早期诊断胰腺的功能变化的胰腺功能的诊断剂。
[0011]
[用于解决课题的手段]
[0012]
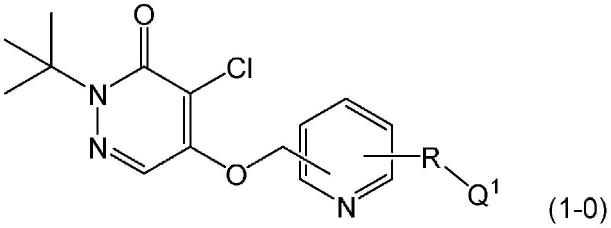
本发明涉及以通式(1-0)表示的化合物(以下也称为“化合物(1-0)”)为有效成分的胰腺功能的诊断剂。
[0013][0014]
通式(1-0)中,r表示-o(ch2)
n-、-o(ch2)noc2h
4-、-ch2o(ch2)
n-或-ch2o(ch2)noc2h
4-,n表示1~5的整数,q1表示f或-och3。
[0015]
已知化合物(1-0)能够用于线粒体复合物-i(以下,也称为“mc-i”)的检测。本发明的胰腺功能的诊断剂在胰腺中蓄积,进而成为与胰腺的mc-i活性成比例的蓄积量,因此适合用于胰腺功能的诊断用途。另外,如后述的实施例所示,胰腺的mc-i活性的降低先于生化指标(例如血中葡萄糖浓度的上升)的恶化而产生。因此,本发明的诊断剂能够早期诊断胰腺的功能变化。
[0016]
上述诊断剂的q1可以为
18
f或-o
11
ch3。由此,上述化合物能够释放正电子。从上述化合物放出的正电子立即与电子结合而放出γ射线(湮灭放射线)。通过利用阳电子(正电子)发射型断层摄影法(pet法)中所使用的装置测定该γ射线,能够定量且经时地对蓄积在胰腺中的上述化合物进行图像化。即,也可以用作pet法的标记化合物。
[0017]
另外,本发明还可以理解为包含以下工序的胰腺功能的诊断方法:将上述诊断剂向对象进行给药的工序;检测蓄积于胰腺的化合物(1-0)的工序;以及对胰腺中的化合物(1-0)的蓄积量进行定量分析的工序。
[0018]
本发明还可以理解为用于胰腺功能的诊断中使用的通式(1-0)所示的化合物。另外,本发明还可以理解为通式(1-0)所示的化合物在胰腺功能的诊断剂的制造中的用途。
[0019]
[发明效果]
[0020]
根据本发明,能够提供一种能够早期诊断胰腺的功能变化的胰腺功能的诊断剂。
附图说明
[0021]
图1是关于[
18
f]bcpp-bf向胰腺的蓄积,绘制通过pet测量法测定的放射能蓄积量(suv)相对于通过解剖法测量的放射能蓄积量(suv)的曲线图。
[0022]
图2是表示用各周龄的健康(lean)大鼠及肥胖(fatty)大鼠测定的向胰腺的[
18
f]bcpp-bf的导入(suv)(图2(a))、胰腺重量(图2(b))及血中葡萄糖浓度(图2(c))的结果的曲线图。
[0023]
图3是表示向胰腺的[
18
f]bcpp-bf的导入(suv)与血中葡萄糖浓度或血中中性脂肪浓度的关系的曲线图。
[0024]
图4(a)是表示5周龄和16周龄的大鼠的胰腺的每单位面积的胰岛素阳性细胞数的曲线图。图4(b)是表示16周龄的大鼠(健康(lean)大鼠和肥胖(fatty)大鼠)的向胰腺的[
18
f]bcpp-bf的导入(suv)与每单位面积的胰岛素阳性细胞数的关系的曲线图。
具体实施方式
[0025]
以下,对用于实施本发明的方式进行详细说明。但是,本发明并不限定于以下的实
施方式。
[0026]
本实施方式的胰腺功能的诊断剂将通式(1-0)所示的化合物作为有效成分。
[0027][0028]
化合物(1-0)中,r为-o(ch2)
n-、-o(ch2)noc2h
4-、-ch2o(ch2)
n-或-ch2o(ch2)noc2h
4-。r优选为-o(ch2)
n-或-o(ch2)noc2h
4-,更优选为-o(ch2)
n-。
[0029]
化合物(1-0)中,n为1~5的整数,优选为2~5的整数,更优选为3~5的整数,进一步优选为4。
[0030]
化合物(1-0)中,q1为f或-och3,优选为
18
f或-o
11
ch3。q1为
18
f或-o
11
ch3的化合物(1-0)可以释放正电子,因此适合作为用于pet法中使用的标记化合物(pet探针)。另外,在q1为-o
11
ch3的情况下,半衰期为20分钟这么短,因此对于同一被试验者也可以在1天进行多次测量。在q1为
18
f的情况下,半衰期为110分钟比-o
11
ch3长,因此能够延长1次测量时间。
[0031]
吡啶环的与哒嗪环结合的-och
2-的键合位置和r的键合位置没有特别限制,优选与哒嗪环结合的-och
2-的键合位置为吡啶环的5位,r的键合位置为吡啶环的2位。以下所示的通式(1-0
′
)表示的化合物(以下,也称为“化合物(1-0
′
)”)是与哒嗪环结合的-och
2-的键合位置为吡啶环的5位、r的键合位置为吡啶环的2位时的结构式。
[0032][0033]
通式(1-0
′
)中,r、n及q1与通式(1-0)中的r、n及q1含义相同。
[0034]
由于更适合于胰腺功能的诊断用途,因此化合物(1-0)优选为通式(1-0
″
)所示的化合物(以下,也称为“化合物(1-0
″
)”),更优选为式(1)所示的化合物(以下,也称为“化合物(1)”)。
[0035][0036]
通式(1-0
″
)中,n及q1与通式(1-0)中的n及q1含义相同。
[0037][0038]
式(1)中,q1与通式(1-0)中的q1含义相同。
[0039]
化合物(1-0)例如可以由对应的前体合成。化合物(1-0
′
)、化合物(1-0
″
)和化合物(1)也相同。
[0040]
作为化合物(1-0)的对应的前体,例如可以举出下述通式(2-0)所示的化合物(以下,也称为“化合物(2-0)”。作为化合物(1-0
′
)、化合物(1-0
″
)和化合物(1)的对应的前体,例如可以举出在化合物(2-0)中,r和吡啶环的与哒嗪环结合的-och
2-的键合位置和r的键合位置与化合物(1-0
′
)、化合物(1-0
″
)和化合物(1)相同的化合物。
[0041][0042]
通式(2-0)中,r与通式(1-0)中的r含义相同。q2表示可脱离的取代基(取代磺酰基氧基、卤素原子或羟基等)。
[0043]
作为取代磺酰基氧基,例如可以举出甲苯磺酰基氧基(-ots)、甲烷磺酰基氧基(-oms)、三氟甲烷磺酰基氧基(-otf)、硝基苯磺酰基氧基(-ons),优选使用-ots。
[0044]
作为卤素原子,可以举出氟、氯、溴、碘。
[0045]
前体例如可以通过国际公开第2014/30709号中记载的方法来合成。
[0046]
化合物(1-0)由于以mc-i特异性蓄积在胰腺中,因此与胰腺功能的程度相关地蓄积量变化。即,如果胰腺的功能降低,则化合物(1-0)的蓄积量减少,如果胰腺的功能亢进,则化合物(1-0)的蓄积量增加。因此,本实施方式所涉及的诊断剂能够经由化合物(1-0)的蓄积量的测定而适合用于胰腺功能的诊断。
[0047]
化合物(1-0)的蓄积量的测定并不限定于此,例如,可以通过在化合物(1-0)上结合荧光色素等、或通过单光子核素(
123
i、
99m
tc等)或正电子核素进行标记而制成标记化合物,通过检测该标记来实施。正电子标识例如可以通过将化合物(1-0)的q1设为-o
11
ch3或
18
f来进行。在进行正电子标记的情况下,通过用pet法中使用的装置测定湮灭放射线,能够定量且经时地对化合物(1-0)的体内分布进行图像化。
[0048]
本实施方式的诊断剂例如可以通过将化合物(1-0)溶解于任意的缓冲液中来制造。在该情况下,本实施方式的诊断剂作为溶液提供,除了缓冲成分以外,还可以含有表面
活性剂、防腐剂、稳定剂等其它成分。
[0049]
本实施方式涉及的胰腺功能的诊断方法包括:将本发明的诊断剂向对象进行给药的工序;检测蓄积于胰腺的化合物(1-0)的工序;以及对胰腺中的化合物(1-0)的蓄积量进行定量分析的工序。
[0050]
作为对象,例如可以举出人、小鼠和大鼠,但不限于此。
[0051]
将诊断剂向对象进行给药的方法只要化合物(1-0)到达胰腺,就没有特别限制,通常为静脉内给药。
[0052]
作为诊断剂的给药量,只要是足以在胰腺中检测化合物(1-0)的给药量,就没有特别限制,可以根据检测给药的对象和化合物(1-0)的方法适当设定。例如,在使用包含q1为
18
f或-o
11
ch3的化合物(1-0)的诊断剂,在pet法中使用的装置中检测化合物(1-0)的情况下,诊断剂的给药量(以下,也称为“给药放射能量”)可以为1mbq/kg体重~1000mbq/kg体重。化合物(1-0)的比放射能为10~10,000gbq/μmol。另外,诊断剂的给药放射能量依赖于所使用的pet照相机的灵敏度和对象个体的体积,但在啮齿类(小鼠、大鼠)中,对大约200~500mbq/kg体重以0.1~0.5ml的生理盐水进行给药。在人以外的灵长类(猿类)的情况下,对40~200mbq/kg体重以0.5~2ml的生理盐水进行给药,在人的情况下,对2~10mbq/kg体重以1~5ml的生理盐水进行给药。
[0053]
作为检测蓄积在胰腺中的化合物(1-0)的方法,没有特别限制,可以按照公知的方法实施。例如,在使用含有q1为
18
f或-o
11
ch3的化合物(1-0)的诊断剂时,可以通过pet法检测化合物(1-0)。pet法中的测定方法没有特别限制,可以按照公知的方法实施。另外,例如,作为利用pet法进行测量的方法,可以从诊断剂的刚给药后起进行60分钟的动态测量,也可以将诊断剂给药后等待30~40分钟,使化合物(1-0)充分蓄积于胰腺,然后进行10~20分钟的pet测量。
[0054]
作为对胰腺中的化合物(1-0)的蓄积量进行定量分析的方法,没有特别限制,可以按照公知的方法实施。例如,可以举出以下的方法。首先,将通过pet法得到的化合物(1-0)的蓄积图像与通过ct测量等得到的胰腺的形态图像重叠,鉴定胰腺的pet图像。接着,在胰腺的pet图像上设定关注区域,将以成为对象的个体的体重和给药放射能量标准化的值作为向胰腺的化合物(1-0)的蓄积量。另外,也可以代替胰腺的形态图像,而用使用了能够检测胰腺的探针的pet法的图像。
[0055]
本实施方式所涉及的诊断方法也可以还包括将定量分析过的化合物(1-0)的蓄积量与基准值进行比较来诊断胰腺功能的工序。
[0056]
基准值可以根据诊断目的适当设定。例如,在集团健康诊断中实施本实施方式的诊断方法的情况下,基准值也可以是根据多个同种对象中的化合物(1-0)的蓄积量的分布而预先决定的正常范围。在该情况下,能够根据特定的对象中的蓄积量的定量分析值是否落入该正常范围,来诊断该特定的对象中的胰腺功能是否正常。
[0057]
另外,例如,在患有引起胰腺的功能障碍的症状(例如,糖尿病、脂质代谢异常症、慢性胰腺炎、急性胰腺炎、胰腺癌等)的对象中,为了进行该症状的经过观察、治疗效果的确认、或预后预测等而实施本实施方式的诊断方法的情况下,基准值也可以是该对象的某个时间点(例如,健康时、初诊断时、治疗开始时、治疗结束等)中的化合物(1-0)的蓄积量的测定结果。
[0058]
上述的本发明也可以理解为用于胰腺功能的诊断中使用的通式(1-0)所示的化合物。胰腺功能的诊断例如可以通过上述胰腺功能的诊断方法中例示的方法来实施。
[0059]
[实施例]
[0060]
以下,基于实施例更具体地说明本发明。但是,本发明并不限定于这些。
[0061]
[试验例1:pet探针的合成]
[0062]
下述式所示的[
18
f]bcpp-bf通过非专利文献(j.labelled comp.radiopharm.,2013年,56卷11号,pp.553-561)中记载的方法来合成。得到的最终生成物的放射化学纯度为100.0%,比放射能为74.5gbq/μmol。
[0063][0064]
另外,为了确定胰腺的位置,准备了对在小动物的胰腺中高表达的氨基酸转运蛋白(lat-1)进行识别的探针(d-[
11
c]mt)。通过国际公开第2005/115971号的实施例1中记载的方法来合成d-[
11
c]mt。得到的最终生成物的放射化学纯度为100.0%,比放射能为56.4gbq/μmol。
[0065]
[试验例2:ii型糖尿病模型大鼠的胰腺功能的评价]
[0066]
(ii型糖尿病模型大鼠)
[0067]
将与人成人的ii型糖尿病类似的病态发病的雄性的zucker leprfa/leprfa大鼠(以下,也称为“肥胖(fatty)大鼠”)、作为其对照的雄性的zucker leprfa/+大鼠(以下也称为“健康(lean)大鼠”),分别在5周龄、8周龄、16周龄及26周龄的时间点供于pet测量。
[0068]
(pet测量)
[0069]
用异氟烷麻醉大鼠,固定在动物用pet照相机(shr-38000,hamamatsu photonics k.k.公司制)的机架内。为了吸收校正而实施了15分钟的透射测量后,从大鼠的尾静脉给药约20mbq/0.5ml的d-[
11
c]mt,实施60分钟的发射测量。接着,从大鼠的尾静脉给药约20mbq/0.5ml的[
18
f]bcpp-bf,实施60分钟的发射测量。pet测量结束后,对从d-[
11
c]mt的给药40-60分钟后的pet蓄积图像鉴定出的胰腺设定关注区域,算出[
18
f]bcpp-bf向关注区域的蓄积量。接着,将计算出的蓄积量以各个体的体重和给药放射能量进行标准化,作为向胰腺的[
18
f]bcpp-bf的蓄积量(放射能蓄积量(suv))。
[0070]
(解剖法的放射能蓄积量(suv)的测定)
[0071]
pet测量结束后立即从大鼠摘出胰腺,测定摘出的胰腺的重量。接着,使用伽马计数器(perkin elmer公司制造,1480wizard)测量摘出的胰腺的放射能。将测量出的放射能以大鼠的体重和胰腺的重量和给药放射能量进行标准化,算出基于解剖法的放射能蓄积量(suv)。
[0072]
(血中葡萄糖浓度和血中中性脂肪浓度的测定)
[0073]
在pet测量后立即从大鼠采血,测定血中葡萄糖浓度和血中中性脂肪浓度。血中葡萄糖浓度及血中中性脂肪浓度使用生化自动分析装置(hitachi high-tech corporation
制7180)进行测定。
[0074]
(胰岛素阳性细胞数的测定)
[0075]
使用测量重量和放射能后的摘出的胰腺,通过免疫染色测定胰岛素阳性细胞数(个/μm2)。具体而言,使用作为一次抗体的抗胰岛素单克隆抗体(nichirei biosciences公司制,k36ac10)、作为二次抗体的(nichirei biosciences公司制,max-po(m))、作为显色剂的dab(dojindo公司制,d006)对胰腺组织切片进行染色,从组织切片上随机地选择5个胰岛,利用光学显微镜(olympus公司制,bx41)和显微镜相机(olympus公司制,dp22)以100倍拍摄胰岛,使用专用图像软件(olympus公司制,cell sensv1.15)测定胰岛素阳性细胞数(个/μm2)。
[0076]
(结果)
[0077]
图1是对向胰腺的[
18
f]bcpp-bf的蓄积,对通过解剖法测量的放射能蓄积量(suv)绘制用pet测量法测定的放射能蓄积量(suv)的曲线图。如图1所示,用pet测量法测定的suv与用解剖法测定的suv表示良好的相关性(r2=0.777,p<0.001)。可知可以使用[
18
f]bcpp-bf非侵入性地实施胰腺的mc-i测量。以下,图2~4所示的向胰腺的[
18
f]bcpp-bf的导入(suv)为用pet测量法测定的放射能蓄积量(suv)。
[0078]
图2是表示用各周龄的健康(lean)大鼠及肥胖(fatty)大鼠测定向胰腺的[
18
f]bcpp-bf的导入(suv)(图2(a))、胰腺重量(图2(b))及血中葡萄糖浓度(图2(c))的结果的曲线图。在图2中,
“★”
表示肥胖(fatty)大鼠的数据与健康(lean)大鼠的数据之差在统计学上显著(p<0.05)。
[0079]
如图2(b)所示,在肥胖(fatty)大鼠中,在8周龄的时刻确认到胰腺的肥大化,其后确认到胰腺的萎缩。另外,如图2(c)所示,在肥胖(fatty)大鼠中,在16周龄以后,检测出血中葡萄糖浓度的异常。另一方面,如图2(a)所示,在肥胖(fatty)大鼠中,5周龄以后,向胰腺的[
18
f]bcpp-bf的导入(suv)降低。向胰腺的[
18
f]bcpp-bf的导入(suv)的降低意味着胰腺的mc-i活性的降低。由这些结果可知,通过使用[
18
f]bcpp-bf的pet测量法,在检测出血中葡萄糖浓度的异常之前(在此为5周龄和8周龄),能够检测胰腺功能的降低。
[0080]
图3是表示向胰腺的[
18
f]bcpp-bf的导入(suv)与血中葡萄糖浓度或血中中性脂肪浓度的关系的曲线图。图3(a)是绘制5周龄的大鼠(健康(lean)大鼠和肥胖(fatty)大鼠)中的血中葡萄糖浓度和向胰腺的[
18
f]bcpp-bf的导入(suv)的曲线图。图3(b)是描绘了5周龄的大鼠(健康(lean)大鼠和肥胖(fatty)大鼠)中的血中中性脂肪浓度和向胰腺的[
18
f]bcpp-bf的导入(suv)的曲线图。图3(c)是绘制16周龄的大鼠(健康(lean)大鼠和肥胖(fatty)大鼠)中的血中葡萄糖浓度和向胰腺的[
18
f]bcpp-bf的导入(suv)的曲线图。图3(d)是绘制16周龄的大鼠(健康(lean)大鼠和肥胖(fatty)大鼠)中的血中中性脂肪浓度和向胰腺的[
18
f]bcpp-bf的导入(suv)的曲线图。
[0081]
据报道,血中葡萄糖浓度高或血中中性脂肪浓度高会诱发胰腺功能障碍(例如,febs j.,2013年,280卷,1039-1050页;endocr rev.,2008年,29卷,351-366页;kidney int.,2006年,70卷,1560-1566页)。如图3所示,可以使用[
18
f]bcpp-bf将该现象检测为mc-i活性的障碍。
[0082]
图4(a)是表示5周龄和16周龄的大鼠的胰腺的每单位面积的胰岛素阳性细胞数的曲线图。图4(a)中,白棒表示健康(lean)大鼠的结果,黑棒表示肥胖(fatty)大鼠的结果。图
4(b)是表示16周龄的大鼠(健康(lean)大鼠和肥胖(fatty)大鼠)向胰腺的[
18
f]bcpp-bf的导入(suv)与每单位面积的胰岛素阳性细胞数的关系的曲线图。
[0083]
如图4(a)所示,通过免疫染色法对作为现有的胰腺功能的指标的胰岛素阳性细胞数进行计数,结果在5周龄中在健康(lean)大鼠和肥胖(fatty)大鼠之间没有发现显著差异,在16周龄检测到肥胖(fatty)大鼠的显著降低。需要说明的是,如图2(a)所示,在使用[
18
f]bcpp-bf的pet测量法中,在5周龄的时刻,能够检测出肥胖(fatty)大鼠中的胰腺的mc-i活性的降低。
[0084]
如图4(b)所示,在16周龄的大鼠(健康(lean)大鼠和肥胖(fatty)大鼠)中,使用[
18
f]bcpp-bf的pet测量法测定的胰腺的mc-i活性(向胰腺的[
18
f]bcpp-bf的导入(suv))表示与每单位面积的胰岛素阳性细胞数显著的正相关(r2=0.649,p=0.001)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1