用于癌症疗法的LFA-1信号传导介体
用于癌症疗法的lfa-1信号传导介体
1.本发明涉及一种用于癌症免疫疗法的具有中等lfa-1稳定化性质的lfa-1信号传导介体或一种用于癌症免疫疗法的组合物,所述组合物包含免疫系统调节剂,其中所述免疫系统调节剂增强针对癌症的免疫响应;以及具有中等lfa-1稳定化性质的lfa-1信号传导介体,其中所述lfa-1信号传导介体选择性地并显著增强抗癌免疫响应。所述组合物可包含用于所述组合物的靶向递送的载体。
2.手术、放疗和化疗是用于治疗包括白血病、实体瘤和转移瘤在内的癌症的标准公认方法。已经研究将免疫疗法(有时被称为生物疗法、生物治疗或生物反应调节剂疗法)作为常规癌症疗法的辅助手段多年,该免疫疗法直接或间接地使用身体的免疫系统来缩小或根除癌症。据信人体免疫系统是用于癌症疗法的未开发的资源,并且一旦正确利用免疫系统的各组分,就可以开发出有效的治疗。由于关键的免疫调节分子和免疫信号被鉴定并制备为治疗试剂,因此可以使用众所周知的癌症模型来测试此类试剂的临床有效性。免疫治疗策略包括施用疫苗、活化细胞、抗体、细胞因子、趋化因子以及小分子抑制剂、反义寡核苷酸和基因疗法(mocellin等人,cancer immunol.&immunother.(2002)51:583-595;dy等人,j.clin.oncol.(2002)20:2881-2894,2002)。
3.癌症和肿瘤的生长和转移在很大程度上取决于其逃避宿主免疫监督和克服宿主防御的能力。大多数癌症和肿瘤表达的抗原可以在不同程度上被宿主免疫系统识别,但在许多情况下,免疫响应是不充分的。未能引起效应t细胞的强活化可能是由于肿瘤抗原的弱免疫原性或癌症和肿瘤细胞不适当地表达或不表达共刺激分子(epstein,a.,&hu,p.(2012).美国专利号8,268,788。washington,dc:美国专利商标局)。
4.白细胞功能相关抗原(lfa-1、αlβ2、cd11a/cd18)是一种整合素型细胞粘附分子,去主要参与白细胞运输和外渗。lfa-1在白细胞上表达并与配体icam-1、icam2和icam-3相互作用以促进免疫系统功能所需的各种同型和异型细胞粘附事件,例如细胞-细胞、细胞-基质和细胞-病原体相互作用(arnaout ma.integrin structure:new twists and turns in dynamic cell adhesion.immunol rev.2002;186:125-40;askari ja,buckley pa,mould ap,humphries mj.linking integrin conformation to function.j cell sci.2009;122:165-70;caswell pt,norman jc.integrin trafficking and the control of cell migration.traffic.2006;7:14-21;huttenlocher a,sandborg rr,horwitz af.adhesion in cell migration.curr opin cell biol.1995;7:697-706;huttenlocher a,ginsberg mh,horwitz af.modulation of cell migration by integrinmediated cytoskeletal linkages and ligand-binding affinity.j cell biol.1996;134:1551-62)。lfa-1往往以无活性状态在细胞表面表达并介导低基底粘附性(zhang k,chen j.the regulation of integrin function by divalent cations.cell adh migr.2012;6(1):20-29)。
5.lfa-1介导的粘附和信号传导事件在包括免疫响应在内的正常生理反应中很重要(springer ta,wang j-h.the three-dimensional structure of integrins and their ligands and conformational regulation of cell adhesion.adv protein chem.2004;
68:29-63;bon g,folgiero v,di carlo s,sacchi a,falcioni r.involvement ofα6β4integrin in the mechanisms that regulate breast cancer progression.breast cancer res.2007;9:203;di sabatino a,rovedatti l,rosado mm,carsetti r,corazza gr,macdonald tt.increased expression of mucosal addressin cell adhesion molecule 1in the duodenum of patients with active celiac disease is associated with depletion of integrinα4β7-positive t cells in blood.hum pathol.2009;40:699-704;varner ja,cheresh da.tumor angiogenesis and the role of vascular cell integrinαvβ3.important adv oncol.1996:69-87)。先前已经描述了lfa-1介体的解剖结构和结合位点(mikaela等人,"lfa-1integrin antibodies inhibit leukocyteα4β1
–
mediated adhesion by intracellular signalling."blood 128.9(2016):1270-1281;zecchinon,laurent等人,"anatomy of the lymphocyte function-associated antigen-1."clinical and applied immunology reviews 6.3-4(2006):149-172.)。lfa-1的三种构象状态是已知的:具有封闭头段的弯曲构象、具有封闭头段的延伸构象和开放头段的延伸构象,所述三种构象分别对应于低、中和高亲和力状态(takagi j,petre bm,walz t,springer ta.global conformational rearrangements in integrin extracellular domains in outside-in and inside-out signaling.cell.2002;110:599
–
611;zhang k,chen j.the regulation of integrin function by divalent cations.cell adh migr.2012;6(1):20-29)。lfa-1活化被描述为伴随着头段尾段界面的弹簧刀样开口,所述弹簧刀样开口将整合素异二聚体的配体结合头段延伸远离质膜(takagi j,petre bm,walz t,springer ta.global conformational rearrangements in integrin extracellular domains in outside-in and inside-out signaling.cell.2002;110:599-611;zhang k,chen j.the regulation of integrin function by divalent cations.cell adh migr.2012;6(1):20-29)。细胞表面上的lfa-1处于这些构象状态之间的平衡下,并且可以通过具有lfa-1稳定化性质的lfa-1信号传导介体以活性形式稳定化(takagi j,petre bm,walz t,springer ta.global conformational rearrangements in integrin extracellular domains in outside-in and inside-out signaling.cell.2002;110:599-611;zhang k,chen j.the regulation of integrin function by divalent cations.cell adh migr.2012;6(1):20-29)。
6.lfa-1也可以由抗体、肽、小分子、二价阳离子(例如mg
2+
或mn
2+
)或其他刺激物活化(zhang m.,march m.e.,lane w.s.,long e.o.a signaling network stimulated byβ2integrin promotes the polarization of lytic granules in cytotoxic cells.sci.signal.2014;7:ra96;traunecker e.,gardner r.,fonseca j.e.,polido-pereira j.,seitz m.,villiger p.m.,iezzi g.,padovan e.blocking oflfa-1enhances expansion of th17 cells induced by human cd14(+)cd16(+)nonclassical monocytes.eur.j.immunol.2015;45:1414-1425;verma n.k.,fazil m.h.,ong s.t.,chalasani m.l.s.,low j.h.,kottaiswamy a.,praseetha p.,kizhakeyil a.,kumar s.,panda a.k.等人,lfa-1/icam-1ligation in human t cells promotes th1 polarization through a gsk3βsignaling
–
dependent notch pathway.j.immunol.2016;197:108-118;meli a.p.,font
é
s g.,avery d.t.,leddon s.a.,tam m.,elliot m.,
ballesteros-tato a.,miller j.,stevenson m.m.,fowell d.j.等人,the integrin lfa-1controls t follicular helper cell generation and maintenance.immunity.2016;45:831-846;gahmberg c.g.,fagerholm s.c.,nurmi s.m.,chavakis t.,marchesan s.,m.regulation of integrin activity and signaling.biochim.biophys.acta.2009;1790:431-444;m
ó
csai a.,walzog b.,lowell c.a.intracellular signalling during neutrophil recruitment.cardiovasc.res.2015;107:373-385)。
7.二价阳离子对lfa-1的亲和力以以下次序逐渐降低:mn
2+
》mg
2+
》ca
2+
(vorup-jensen t,waldron tt,astrof n,shimaoka m,springer ta.the connection between metal ion affinity and ligand affinity in integrin i domains.biochim biophys acta.2007;1774(9):1148-1155)。抗体的lfa-1稳定化性质可能强于二价阳离子的lfa-1稳定化性质(sch
ü
rpf,thomas,and timothy a springer.“regulation of integrin affinity on cell surfaces.”the embo journal,第30卷,23 4712-27.2011年9月23日)。
8.癌症免疫疗法中整合素(例如lfa-1)的调节仍然很复杂。先前的研究表明阻断lfa-1具有有益效应,但在功能上拮抗人类肿瘤中的整合素的尝试已经普遍失败(goodman,simon l,and martin picard.“integrins as therapeutic targets.”trends in pharmacological sciences第33卷,7(2012):405-12.)。在癌症免疫疗法的情境下,结合rgd的整合素被用作抗体fc效应子功能的靶标(kwan,byron h等人,“integrin-targeted cancer immunotherapy elicits protective adaptive immune responses.”the journal of experimental medicine第214卷,6(2017):1679-1690)。当例如使用抗体非适度地靶向整合素lfa-1时,在靶向lfa-1时不可预见的效应并不少见(reina,manuel,and enric espel.“role of lfa-1and icam-1in cancer.”cancers,第9卷,11 153.2017年11月3日;m,jahan f,bryushkova ea等人,lfa-1 integrin antibodies inhibit leukocyte α4β1-mediated adhesion by intracellular signaling.blood.2016;128(9):1270-1281)。
9.综上所述,迫切需要选择性地增强癌症免疫疗法。
10.上述技术问题通过本文所提供的实施方式得以解决并且如权利要求书中所表征。
11.因此,本发明涉及以下实施方式。
12.1.一种用于癌症免疫疗法的组合物,所述组合物包含
13.(a)免疫系统调节剂,其中所述免疫系统调节剂增强针对癌症的免疫响应,以及
14.(b)具有中等lfa-1稳定化性质的lfa-1信号传导介体
15.其中所述lfa-1信号传导介体显著增强所述抗癌免疫响应。
16.2.一种用于癌症免疫疗法的具有中等lfa-1稳定化性质的lfa-1信号传导介体,其中所述lfa-1信号传导介体增强抗癌免疫响应。
17.3.根据实施方式1所述的组合物或根据实施方式2所述的lfa-1信号传导介体,其中所述lfa-1信号传导介体诱导选择性t细胞介导的对呈递肿瘤相关抗原的细胞的杀伤。
18.4.根据实施方式1、3所述的组合物或根据实施方式2、3所述的lfa-1信号传导介体,其中与具有强lfa-1稳定化性质的信号传导介体相比,具有中等lfa-1稳定化性质的lfa-1信号传导介体诱导更少的t细胞介导的对不呈递肿瘤相关抗原的细胞的杀伤。
19.5.根据实施方式4所述的组合物,或根据实施方式4所述的lfa-1信号传导介体,其中具有强lfa-1稳定化性质的所述lfa-1信号传导介体是cbrlfa-1/2。
20.6.根据实施方式1、3-5所述的组合物或根据实施方式2-5所述的lfa-1信号传导介体,其中所述lfa-1信号传导介体结合金属离子依赖性粘附位点。
21.7.根据实施方式1、3-6所述的组合物或根据实施方式2-6所述的lfa-1信号传导介体,其中所述lfa-1信号传导介体是二价阳离子。
22.8.根据实施方式7所述的组合物,或根据实施方式7所述的lfa-1信号传导介体,其中所述二价阳离子是mg
2+
。
23.9.根据实施方式1、3-8中任一项所述的组合物,其中所述免疫系统调节剂是单克隆抗体、经修饰的免疫细胞或检查点抑制剂(cpi)。
24.10.根据实施方式9所述的组合物,其中所述检查点抑制剂是pd-1/pd-l1抑制剂。
25.11.根据实施方式10所述的组合物,其中所述pd-1/pd-l1抑制剂选自由以下组成的组:纳武单抗、派姆单抗、西米普利单抗、斯巴达珠单抗、阿特珠单抗、度伐利尤单抗和阿维鲁单抗。
26.12.根据实施方式1、3-11中任一项所述的组合物,或根据实施方式2-8、11所述的lfa-1信号传导介体,所述组合物或lfa-1信号传导介体另外包含用于靶向递送所述lfa-1信号传导介体的载体。
27.13.根据实施方式12所述的组合物或根据实施方式12所述的lfa-1信号传导介体,其中所述载体是成膜分子。
28.14.根据实施方式13所述的组合物或根据实施方式13所述的lfa-1信号传导介体,其中所述成膜分子是成囊脂质。
29.15.根据实施方式1、3-14中任一项所述的组合物,其中所述免疫系统调节剂和所述lfa-1信号传导介体同时或顺序地施用。
30.16.根据实施方式15所述的组合物,其中所述免疫系统调节剂和所述lfa-1信号传导介体顺序地施用。
31.17.根据实施方式16所述的组合物,其中首先施用所述免疫系统调节剂,然后在5年的时段内重复施用所述lfa-1信号传导介体。
32.18.根据实施方式17所述的组合物,其中第一施用之后是每2-7天重复施用。
33.19.根据实施方式1、3-18中任一项所述的组合物,或根据实施方式2-8、12-14所述的lfa-1信号传导介体,其中所述癌症选自由以下组成的组:乳腺癌、脑癌、造血器官癌(例如急性髓性白血病)、免疫系统癌(例如霍奇金淋巴瘤)、前列腺癌、肺癌、结肠癌、头颈癌、皮肤癌、卵巢癌、子宫内膜癌、宫颈癌、肾癌、肺癌、胃癌、小肠癌、肝癌、胰腺癌、睾丸癌、垂体癌、血癌、脾癌、胆囊癌、胆管癌、食道癌、唾液腺癌和甲状腺癌。
34.20.根据实施方式1、3-19中任一项所述的组合物或根据实施方式2-8、12-14或19所述的lfa-1信号传导介体,其中所述癌症是实体瘤并且其中所述lfa-1信号传导介体是经由肿瘤内注射施用的。
35.在第一实施方式中,本发明涉及一种用于癌症免疫疗法的组合物,所述组合物包含免疫系统调节剂,其中所述免疫系统调节剂增强对癌症的免疫响应;以及具有中等lfa稳定化性质的lfa-1信号传导介体,其中所述lfa-1信号传导介体显著增强所述抗癌免疫响
应。
36.在另一实施方式中,本发明涉及一种具有中等lfa-1稳定化性质的lfa-1信号传导介体,其中所述lfa-1信号传导介体显著增强所述抗癌免疫响应。
37.如本文所用,术语“癌症”是指涉及细胞增殖的疾病,所述疾病的独特性状—失去正常控制—导致不受控制的生长、缺乏分化、局部组织侵袭和转移。示例包括但不限于癌性疾病和癌前病变,包括肿瘤性疾病,包括乳腺癌、脑癌、造血器官癌(例如急性髓性白血病)、免疫系统癌(例如霍奇金淋巴瘤)、前列腺癌、肺癌、结肠癌、头颈癌、皮肤癌、卵巢癌、子宫内膜癌、宫颈癌、肾癌、肺癌、胃癌、小肠癌、肝癌、胰腺癌、睾丸癌、脑垂体癌、血液癌、脾癌、胆囊癌、胆管癌、食道癌、唾液腺癌和甲状腺癌。
38.如本文所用,术语“免疫疗法”是指通过包括诱导、增强、抑制或以其他方式改变免疫响应的方法来治疗或预防疾病,特别是癌症。
39.如本文所用,术语“免疫系统调节剂”是指可以诱导、增强、抑制或以其他方式改变免疫响应,特别是作为免疫疗法的一部分的试剂、药物、组合物和/或细胞。在一些实施方式中,免疫系统调节剂是选自单克隆抗体、经修饰的免疫细胞、检查点抑制剂、小分子、细胞因子、免疫佐剂和imid的组中的至少一者。在一些实施方式中,免疫系统调节剂是选自单克隆抗体、经修饰的免疫细胞和检查点抑制剂的组的至少一者。在本发明的优选实施方式中,免疫系统调节剂是单克隆抗体、经修饰的免疫细胞或检查点抑制剂。在一些实施方式中,本文所述的单克隆抗体选自裸单克隆抗体、缀合的单克隆抗体和双特异性抗体的组。在一些实施方式中,本文所述的双特异性抗体是双特异性t细胞衔接体。在一些实施方式中,本文所述的经修饰的免疫细胞是选自肿瘤浸润淋巴细胞、具有工程化t细胞受体的细胞、car t细胞和自然杀伤细胞的组的至少一种细胞。
40.如本文所用,术语“免疫响应”是指受试者的免疫系统的反应。例如,免疫响应包括但不限于toll受体活化、淋巴因子(例如,细胞因子或趋化因子)表达和/或分泌、巨噬细胞活化、树突细胞活化、t细胞活化(例如,cd4
+
或cd8
+
t细胞)、nk细胞活化和/或b细胞活化(例如,抗体产生和/或分泌)的可检测改变(例如,增加)。免疫响应的附加示例包括免疫原(例如,抗原(例如,免疫原性多肽))与mhc分子的结合和诱导细胞毒性t淋巴细胞(“ctl”)反应、诱导b细胞反应(例如,抗体产生)、和/或t-辅助淋巴细胞反应、和/或针对免疫原性多肽所衍生自的抗原的迟发型超敏(delayed type hypersensitivity,dth)反应、免疫系统的细胞(例如,t细胞、b细胞(例如,任何发育阶段的细胞(例如,浆细胞))的扩增(例如,细胞群的生长),以及抗原呈递细胞对抗原的加工和呈递增加。免疫响应可以是针对受试者的免疫系统识别为外来物的免疫原(例如,来自微生物(例如,病原体)的非自身抗原,或被识别为外来物的自身抗原)。因此,应当理解的是,如本文所用,“免疫响应”是指任何类型的免疫响应,包括但不限于先天免疫响应(例如,toll受体信号传导级联的活化)、细胞介导的免疫响应(例如,由t细胞(例如,抗原特异性t细胞)和免疫系统的非特异性细胞介导的应答)和体液免疫响应(例如,由b细胞介导的应答(例如,经由产生抗体并使抗体分泌进入血浆、淋巴液和/或组织液)。术语“免疫响应”意在涵盖受试者的免疫系统响应于抗原(例如,肿瘤相关抗原)和/或免疫原(例如,对免疫原的初始反应以及作为适应性免疫响应的结果的获得性(例如,记忆)反应)的的能力的所有方面。
41.如本文所用,术语“lfa-1信号传导介体”是指可以诱导、增强、促进、抑制或以其他
方式修饰lfa-1信号传导的试剂。
42.如本文所用,术语“lfa-1稳定化性质”是指lfa1信号传导介体降低lfa-1处于其低亲和力状态的可能性的性质。具有强lfa-1稳定化性质的lfa-1信号传导介体,例如cbr lfa-1/2,是一种在“regulation of integrin affinity on cell surfaces”(sch
ü
rpf,thomas和timothy a springer.the embo journal,第30卷,23 4712-27.2011年9月23日)中所述的测定中诱导kd≤10.2μm的lfa-1介导的淋巴细胞与icam-1底物的粘附的lfa-1信号传导介体。根据本发明的具有中等lfa-1稳定化性质的lfa-1信号传导介体是一种在“regulation of integrin affinity on cell surfaces”(sch
ü
rpf,thomas和timothy a springer.the embo journal,第30卷,23 4712-27.2011年9月23日)中所述的测定中诱导kd》10.2μm的lfa-1介导的淋巴细胞与icam-1底物的粘附并显著增强抗癌免疫响应的lfa-1信号传导介体。在一些实施方式中,根据本发明的具有中等lfa-1稳定化性质的lfa-1信号传导介体是主要通过增强与开放式头段构象的结合来介导lfa-1信号传导的lfa-1信号传导介体。因此,在这些实施方式中,具有中等lfa-1稳定化性质的lfa-1信号传导介体在开放式头段构象中增强的lfa-1结合大于在装配的cd11a/cd18异二聚体和弯曲lfa-1构象中增强的lfa-1结合。开放式头段构象中的结合可以使用m24(m24克隆,biolegend,类别号363402)通过流式细胞术测定(参见例如图2i)。装配的cd11a/cd18异二聚体中的结合可以使用ts2/4抗体(ts2/4克隆,biolegend,类别号350602)通过流式细胞术测定(参见例如图2f)。弯曲构象中的结合可以使用hi111抗体(hi111克隆,biolegend,类别号301202)通过流式细胞术测定(参见例如图2g)。在一些实施方式中,优选在分别如图2h或图2i中所述的测定中,本文所述的具有中等lfa-1稳定化性质的lfa-1信号传导介体可以增强cd3刺激的m24和/或kim127结合达至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约100%。在一些实施方式中,优选地如图2f、图2g、图2h、图2i的对应测定中所述,本文所述的具有中等lfa-1稳定化性质的lfa-1信号传导介体可以增强cd3刺激的m24和/或kim127结合达比cd3刺激的hi111和/或ts2/4结合大至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约100%。在一些实施方式中,本文所述的具有中等lfa-1稳定化性质的lfa-1信号传导介体诱导至少一种lfa-1信号传导标志物的至少约10%、至少约20%或至少约30%的增加,优选地其中所述lfa-1信号传导标志物是cd3/28介导的%磷酸-fak
397
阳性和/或%tnf阳性,更优选如分别在图2j或图2k中所述的测定中所检测到的。在一些实施方式中,具有中等lfa-1稳定化性质的lfa-1信号传导介体不会增强或不会显著地增强与装配的cd11a/cd18异二聚体的结合,并且不会增强或不会显著地增强弯曲的lfa-1构象。在本发明的上下文中,“不会增强或不会显著地增强lfa-1结合”是指增强lfa-1结合小于10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或没有增强。在一些实施方式中,描述具有中等lfa-1稳定化性质的lfa-1信号传导介体的阈值和范围是在至少约0.012mm、至少约0.06mm、至少约0.12mm、至少约0.6mm、或至少约1.2mm的浓度下在测定中实现的。在一些实施方式中,描述具有中等lfa-1稳定化性质的lfa-1信号传导介体的阈值和范围是至少在约0.012mm至约1.2mm、约0.06mm至约1.2mm、约0.12mm至约1.2mm、约0.6mm或约1.2mm的浓度范围下在测定中实现的。在一些实施方式中,描述具有中等lfa-1稳定化性质的lfa-1信号传导介体的阈值和范围是至少在最有效浓度下在测定中实现的。
3.1.3、ny-eso-i、和scp家族。mage家族的成员包括但不限于mage-1、mage-2、mage-3、mage-4、mage-6、mage-11和mage-12。gage家族的成员包括但不限于gage-i、gage-6。参见例如,van den eynde和van der bruggen的评论,(1997)curr.opin.immunol.9:684-693;和sahin等人,(1997)curr.opin.immunol.9:709-716。
49.肿瘤相关抗原还可以是但不限于人上皮细胞粘蛋白(muc-1;muc-1糖蛋白的20个氨基酸的核心重复序列,存在于乳腺癌细胞和胰腺癌细胞上)、muc-2、muc-3、muc-18、癌胚抗原(cea)、raf致癌基因产物、ca-125、gd2、gd3、gm2、tf、stn、gp75、ebv-lmp 1和2、前列腺特异性抗原(psa)、前列腺特异性膜抗原(psma)、gnt-v内含子v序列(n-乙酰基葡糖胺转移酶v内含子v序列)、前列腺ca psm、mum-i-b(黑色素瘤遍在性突变基因产物)、甲胎蛋白(afp)、col 7-1a、ga733、gp72、β-hcg、gp43、hsp-70、π7mel、hsp-70、gp43、hmw、hoj-i、黑素瘤神经节苷脂、tag-72、突变的原癌基因如p21ras、突变的肿瘤抑制基因如p53、雌激素受体、乳脂球蛋白、端粒酶、核基质蛋白、前列腺酸性磷酸酶、蛋白mz2-e、多态性上皮粘蛋白(pem)、叶酸结合蛋白lk26、截短的表皮生长因子受体(egfr)、汤-弗氏(thomsen-friedenreich)(t)抗原、gm-2和gd-2神经节苷脂、多态性上皮粘蛋白、叶酸结合蛋白lk26、人绒毛膜促性腺激素(hcg)、胰腺癌胚抗原、癌抗原15-3、19-9、549、195、鳞状细胞癌抗原(scca),卵巢癌抗原(oca)、胰腺癌相关抗原(paa)、ebna(艾普斯登-巴尔病毒核抗原)1-6、gp75、嵌合蛋白p210bcr-abl、肺耐药蛋白(lrp)bcl-2和ki-67。参见例如,美国专利号6,537,552;还参见美国专利号6,815,531;6,773,707;6,682,928;和6,623,739。
50.肿瘤相关抗原也可以是由b细胞肿瘤(例如,b细胞淋巴瘤;b细胞白血病;骨髓瘤;毛细胞白血病)产生的抗体;此类抗体的片段,所述片段包含所述抗体的独特型的表位、恶性b细胞抗原受体、恶性b细胞免疫球蛋白独特型、免疫球蛋白可变区、免疫球蛋白的可变区的高变区或互补决定区(cdr)、恶性t细胞受体(tcr)、tcr的可变区和/或tcr的高变区。在一个实施方式中,本发明的肿瘤相关抗原可以是包含连接的vh结构域和vl结构域的单链抗体(scfv),所述scfv保留抗体的天然独特型的构象和特异性结合活性。
51.如本文提供的具有中等lfa-1稳定化性质的lfa-1信号传导介体可以支持免疫细胞的免疫响应,例如t细胞功能(图2c)、细胞毒性(图3d、图3k、图3l、图3o、图4c、图4d)、去颗粒作用(图3c和图3j)和/或细胞因子释放(图2d和图3p)。t细胞介导的靶细胞杀伤在具有中等lfa-1稳定化性质的lfa-1信号传导介体的存在下是选择性的,而在具有强lfa-1稳定化性质的lfa-1信号传导介体的存在下是非选择性的(图4e)。
52.因此,本文所提供的发明基于以下令人惊讶的发现:与具有强lfa稳定化性质的lfa-1信号传导介体相比,具有中等lfa-1稳定化性质的lfa-1信号传导介体诱导更少的非希望的效应,例如杀伤非靶细胞。
53.因此,在本发明的某些实施方式中,与具有强lfa-1稳定化性质的信号传导介体相比,具有中等lfa-1稳定化性质的所述lfa-1信号传导介体诱导更少的t细胞介导的对不呈递肿瘤相关抗原的细胞的杀伤。因此,强lfa-1稳定化更可能通过诱导对非靶细胞的杀伤来诱导不希望的副作用。
54.因此,本文所提供的发明基于以下令人惊讶的发现:lfa-1信号传导介体的中等而非强lfa-1稳定化性质介导对靶细胞的选择性杀伤。
55.在本发明的某些实施方式中,具有强lfa-1稳定化性质的lfa-1信号传导介体是与
quantification and screening technology platform for the interactions of leukocyte function-associated antigen-1(lfa-1)with intercellular adhesion molecule-1(icam-1).plos one.2014;9(7):e102572发表于2014年7月17日)、共焦珠粒上筛选(hintersteiner、martin等人"identification and x-ray co-crystal structure of a small-molecule activator of lfa-1-icam-1binding."angewandte chemie international edition 53.17(2014):4322-4326)、负染色电子显微镜(takagi,j.、petre,b.m.、walz,t.、和springer,t.a.(2002).global conformational rearrangements in integrin extracellular domains in outside-in and inside-out signaling.cell 110,599-611.)、结晶学(xiong,j.p.、stehle,t.、zhang,r.、joachimiak,a.、frech,m.、goodman,s.l.和arnaout,m.a.(2002).crystal structure of the extracellular segment of integrinαvβ3in complex with an arg-gly-asp ligand.science 296,151-155.)、nmr(beglova,n.、blacklow,s.c.、takagi,j.和springer,t.a.(2002).cysteine-rich module structure reveals a fulcrum for integrin rearrangement upon activation.nat.struct.biol.9,282-287)、表位作图(lu,c.、ferzly,m.、takagi,j.和springer,t.a.(2001).epitope mapping of antibodies to the c-terminal region of the integrinβ2subunit reveals regions that become exposed upon receptor activation.j.immunol.166,5629-5637,以及lu,c.、shimaoka,m.、zang,q.、takagi,j.和springer,t.a.(2001).locking in alternate conformations of the integrinαlβ2i domain with disulfide bonds reveals functional relationships among integrin domains.proc.natl.acad.sci.usa 98,2393-2398)和/或快速流式细胞术方法(crucian,brian,mayra nelman-gonzalez和clarence sams."rapid flow cytometry method for quantitation of lfa-1-adhesive t cells."clinical and vaccine immunology 13.3(2006):403-408.)。
64.在本发明中,可以在使用一种或多种测定(例如以上提供的测定中的一种测定)筛选时选择具有中等lfa-1稳定化性质的lfa-1信号传导介体。因此,可以基于测试对免疫系统的功能的影响的测定来选择如本文所用的具有中等lfa-1稳定化性质的lfa-1信号传导介体,所述免疫系统的功能为例如代谢重编程(例如图2a和图3a)、增强的和选择性的免疫细胞介导的杀伤(例如图3d、图3k和图3o)和/或如由somersalo k等人(cytotoxic t lymphocytes form an antigen-independent ring junction.j clin invest.2004;113(1):49-57)或franciszkiewicz k等人(cd103 or lfa-1engagement at the immune synapse between cytotoxic t cells and tumor cells promotes maturation and regulates t-cell effector functions.cancer res.2013;73(2):617-628)所述的免疫突触形成。如本文所用的具有中等lfa-1稳定化性质的lfa-1信号传导介体优选诱导显著的ecar增加(例如图2a和图3a)、显著增加的对肿瘤细胞和/或呈递肿瘤相关抗原的细胞的杀伤(例如图3k、图3o),与此同时具有选择性t细胞介导的杀伤性质(例如图4e)。
65.如本文所用的具有中等lfa-1稳定化性质的优选lfa-1信号传导介体可在上述测定中的一种或多种测定中具有与所述一种或多种测定中的mg
2+
的性质相似的性质,优选地与所述一种或多种测定中的mg
2+
的性质相似的性质。
66.在一个示例中,本领域技术人员通过使用两步筛选鉴定了根据本发明的具有中等
lfa-1稳定化性质的lfa-1信号传导介体。在第一步骤中,使用测定,例如上述免疫突触形成测定来鉴定至少一种lfa-1信号传导介体候选物,所述候选物诱导kd》10.2μm的lfa-1介导的淋巴细胞与icam-1底物的粘附。在第二步骤中,如果候选物显著增强抗癌免疫响应,则来自第一步骤的候选物被鉴定为具有中等lfa-1稳定化性质的lfa-1信号传导介体。如果候选者增强t细胞介导的杀伤,更优选地,如果候选者在筛选的第二步骤中在图3k中所述的测定中诱导选择性t细胞介导的对呈递肿瘤相关抗原的细胞的杀伤,则优选地选择候选者。图4e中所述的测定中lfa-1信号传导介体的浓度是根据本领域技术人员估计的适合于介导lfa-1信号传导的浓度。在本发明的实施方式中,其中lfa-1信号传导介质是cbr-lfa1/2,基于先前研究中在这些浓度下观察到的lfa-1活性,合适的cbr-lfa1/2浓度为约10-1
(petruzzelli l、maduzia l、springer ta.activation of lymphocyte function-associated molecule-1(cd11a/cd18)and mac-1(cd11b/cd18)mimicked by an antibody directed against cd18.j immunol.1995;155(2):854-866;m、jahan f、bryushkova ea等人,lfa-1integrin antibodies inhibit leukocyteα4β1-mediated adhesion by intracellular signaling.blood.2016;128(9):1270-1281)。
67.因此,本发明的lfa-1信号传导介体显著增强抗癌免疫响应,是惊人地选择性的,并且可用于癌症免疫疗法。
68.因此,本发明的组合物包含增强针对癌症的免疫响应的免疫系统调节剂和具有中等lfa-1稳定化性质的lfa-1信号传导介体,其中所述lfa-1信号传导介体显著增强抗癌免疫响应,是令人惊讶地选择性的并且可用于癌症免疫疗法。
69.lfa-1参与细胞间接触介导的杀伤过程以及抗体介导的杀伤过程(oxford dictionary of biochemistry and molecular biology.编辑cammack,richard,teresa atwood,peter campbell,howard parish,anthony smith,frank vella和john stirling.:oxford university press,2008)。
70.在本发明的某些实施方式中,免疫系统调节剂是单克隆抗体、经修饰的免疫细胞或检查点抑制剂(cpi)。
71.如本文所用,术语“抗体”是指免疫球蛋白家族的蛋白质或包含能够特异性结合对应抗原的免疫球蛋白片段的多肽。一般而言,术语“抗体”在本文中在最广泛的意义上使用并涵盖各种抗体结构,包括但不限于单克隆抗体、多克隆抗体、多特异性抗体(例如,双特异性抗体)、嵌合抗体、全人抗体和抗体片段,只要它们表现出所需的抗原结合活性即可。本发明内的抗体还可以是嵌合抗体、重组抗体、重组抗体的抗原结合片段、人源化抗体或展示在噬菌体表面上或展示在嵌合抗原受体(car)t细胞表面上的抗体。用于产生抗体的方法是本领域中众所周知的(参见,例如,harlow和lane(1988)antibodies:a laboratory manual,cold spring harbor laboratory,cold spring harbor,n.y.;和美国专利号4,196,265)。
72.如本文所用,术语“单克隆抗体”是指从基本上均质的抗体群体获得的抗体,即除了可能以少量存在的可能天然存在的突变之外,构成该群体的单独抗体是相同的。单克隆抗体具有高度特异性,针对单个抗原位点。单克隆抗体的优势在于它们可以通过基本上未被其他免疫球蛋白污染的杂交瘤培养物合成。经修饰的“单克隆”指示抗体的特性是在基本上同质的抗体群体中,并且不应解释为需要通过任何特定方法产生抗体。如上所述,要根据本发明使用的单克隆抗体可以通过由kohler,nature 256(1975),495所述的杂交瘤方法制
备。
73.如本文所用,术语“经修饰的”免疫细胞是指这样的细胞,所述细胞在体外以某种方式操纵,使得在将细胞施用于受试者后所述细胞赋予针对癌症的增强的免疫响应。在本发明的一些实施方式中,经修饰的免疫细胞源自受试者并且在操纵之后被重新施用于同一受试者。在本发明的一些实施方式中,经修饰的免疫细胞源自一个受试者并施用于第二受试者。经修饰的免疫细胞包括但不限于工程化的免疫细胞和/或通过活化方案活化的和/或通过扩增方案扩增的细胞。如本文所用,术语“工程化的”免疫细胞是指这样的免疫细胞,在所述免疫细胞中已引入外源核酸序列,例如载体,并且所述免疫细胞增强针对癌症的免疫响应。因此,工程化的免疫细胞是与不包含重组引入的核酸的天然存在的免疫细胞可区分的。尽管免疫细胞天然地可能具有用于靶向抗原、接收细胞因子信号等的受体,但是本公开的免疫细胞是非天然的并且由人工直接或间接地工程化,以使得它们表达期望的二分体(bipartite)或三分体(tripartite)信号传导分子。可以通过重组工程来操纵工程化的免疫细胞以表达所述信号传导分子中的一种、两种或三种信号传导分子。工程化细胞以表达一种或多种信号传导分子可以单个步骤或多个步骤进行,并且操纵可以发生在单个时间点或连续的时间点处。在特定方面中,细胞用于过继转移。所述细胞可以被包含在药物组合物中。可以用如本文所述的一种或多种载体转化或转染细胞。可通过引入本文所述的载体中的至少一种载体来产生重组细胞。载体在细胞中的存在介导适当受体的表达,并且在一些实施方式中,一种或多种构建体被整合到细胞的基因组中。也就是说,引入宿主中的核酸分子或载体可以整合到宿主的基因组中或者它们可以维持在染色体外。工程化的免疫细胞包括但不限于car t细胞、工程化的细胞毒性t细胞、工程化的b细胞、工程化的粒细胞和/或工程化的单核细胞,例如工程化的巨噬细胞、工程化的树突细胞。在一些实施方式中,本文所述的工程化的免疫细胞是选自cart细胞、细胞毒性t细胞、b细胞、粒细胞、nk细胞和单核细胞的组的至少一种细胞。
74.如本文所用,术语“cpi”或“检查点抑制剂”是指完全或部分地减少、抑制、干扰或调节一种或多种检查点蛋白的分子。检查点蛋白调节t细胞活化或功能。
75.不受理论的束缚,lfa-1介体可以经由lfa-1稳定化来增强细胞粘附、细胞迁移和/或细胞分化(oxford dictionary of biochemistry and molecular biology.编辑cammack,richard,teresa atwood,peter campbell,howard parish,anthony smith,frank vella和john stirling.:oxford university press,2008;verma,navin kumar和dermot kelleher."not just an adhesion molecule:lfa-1contact tunes the tlymphocyte program."the journal of immunology 199.4(2017):1213-1221.)。lfa-1介体可能能够增强先天免疫细胞的免疫响应和/或适应性免疫细胞的免疫响应。例如,具有中等lfa-1稳定化性质的lfa-1介体可以增强t细胞、b细胞、粒细胞和/或单核细胞的免疫响应(oxford dictionary of biochemistry and molecular biology.编辑cammack,richard,teresa atwood,peter campbell,howard parish,anthony smith,frank vella和john stirling.:oxford university press,2008;carrasco yr,fleire sj,cameron t,dustin ml,batista fd.lfa1/icam-1interaction lowers the threshold of b cell activation by facilitating b cell adhesion and synapse formation.immunity.2004;20(5):589-599)。因此,通过包含t细胞、b细胞、粒细胞和单核
细胞,本发明的组合物可特别地可用于癌症免疫疗法。lfa-1介体可以特别地增强经修饰的免疫细胞的免疫响应(参见例如图3o、图4c)。某些经修饰的免疫细胞,例如记忆t细胞、pha诱导的t母细胞以及rep t细胞,比原初cd8
+
细胞具有更高的lfa-1表达(图2e和图3e)并且因此特别适用于发明。这一观察结果进一步得到了以下的支持:在原初cd8
+
细胞中缺乏lfa-1介体诱导的代谢变化(图2b)并且缺乏lfa-1头段开口(图2l),而在lfa-1介体作用(图2a和图2m)后,非原初cd8
+
细胞(例如em cd8
+
细胞、pha母细胞和rep t)中细胞因子释放(图2d)、活化标志物(图2c)和ecar增加。
76.除了经修饰的免疫细胞外,单克隆抗体和/或检查点抑制剂也可用于诱导可通过lfa-1介体增强的免疫响应(图1h)。检查点蛋白调节t细胞活化或功能。对免疫检查点过程尤其重要的是细胞毒性t淋巴细胞相关抗原4(ctla-4)和程序性死亡1(pd-1)免疫检查点通路。ctla-4和pd-1通路被认为在免疫响应的不同阶段起作用。ctla-4被认为是免疫检查点抑制剂的“领导者”,因为它在原初t细胞活化的初始阶段,通常在淋巴结中阻止潜在的自体反应性t细胞。pd-1通路在免疫响应的后期阶段,主要是在外周组织中调节先前活化的t细胞。进展中的患者已被证明缺乏肿瘤细胞或肿瘤浸润免疫细胞对pd-l1的上调(romano e,romero p.the therapeutic promise of disrupting the pd-1/pd-l1 immune checkpoint in cancer:unleashing the cd8 t cell-mediated antitumor activity results in significant,unprecedented clinical efficacy in various solid tumors.j immunother cancer.2015;3:15)。因此,靶向pd-l1/pd-1通路的免疫疗法可能在这种免疫抑制轴起作用的肿瘤中特别有效,并且逆转平衡朝向免疫保护环境将重新点燃并加强预先存在的抗癌免疫响应。单克隆抗体可以阻断负面调节t细胞免疫响应的细胞相互作用,例如cd80/ctla-4和pd-1/pd-1l,放大预先存在的免疫力并由此引发抗癌免疫响应(sagiv-barfi i,kohrt he,czerwinski dk,ng pp,chang by,levy r.therapeutic antitumor immunity by checkpoint blockade is enhanced by ibrutinib,an inhibitor of both btk and itk.proc natl acad sci u s a.2015;112(9):e966-e972.)。因此,pd-1在有对感染的炎症反应时限制外周组织中的t细胞的活性,并且为了限制自身免疫,pd-1体外阻断响应于特定抗原靶标的攻击或通过混合淋巴细胞反应中的同种异体细胞而增强t细胞增殖和细胞因子产生。pd-1阻断可以通过多种机制实现,包括与pd-1或其配体pd-l1结合的抗体。免疫检查点通路的抑制已导致了以下几种新药的批准:易普利姆玛单抗(ipilimumab)(抗ctla-4;)、帕博利珠单抗(pembrolizumab)(抗pd-1;)、西米普利单抗(cemiplimab)(抗pd-1;)、斯巴达珠单抗(spartalizumab)(抗pd-1;)和纳武单抗(nivolumab)(抗pd-1;)。pd-l1抑制剂,例如阿特朱单抗(atezolizumab)(mpdl3280)、阿维鲁单抗(avelumab)(msb0010718c)和度伐利尤单抗(durvalumab)(medi4736)、曲美木单抗(tremelimumab)(靶向pd-l1的单克隆抗体)也是可用的。这些拮抗性抗体已经与癌症患者中的客观临床反应相关联。靶向ctla-4的抗体已经上市(例如易普利姆玛单抗、yervoy、bristol-myers squibb、bms)用于转移性黑素瘤。其他抗体疗法是抗pd-l1(例如,mpdl3280a,roche)或抗pd-1(例如,纳武单抗,bms)。
77.其他免疫检查点抑制剂包括但不限于淋巴细胞活化基因3(lag-3)抑制剂,例如
imp321,一种可溶性ig融合蛋白。其他免疫检查点抑制剂包括b7抑制剂,例如b7-h3和b7-h4抑制剂。特别是抗b7-h3抗体mga271。还包括tim3(t细胞免疫球蛋白结构域和粘蛋白结构域3)抑制剂。在某些实施方式中,pd-1抑制剂包括抗pd-l1抗体。在某些其他实施方式中,pd-1抑制剂包括抗pd-1抗体和类似的结合蛋白,例如纳武单抗(mdx1106、bms-936558、ono-4538),一种通过pd-1的配体pdl1和pdl2结合并阻断pd-1活化的全人igg4抗体;ct-011,一种结合pd-1的人源化抗体;amp-224是b7-dc的融合蛋白;抗体fc部分;用于pd-l1(b7-h1)阻断的bms-936559(mdx-1105-01)。可在某些实施方式中使用的pd-l1抑制剂的其他示例是阿特朱单抗(mpdl3280)、度伐利尤单抗(medi4736)和阿维鲁单抗(msb0010718c)。因此,本发明的优选的检查点抑制剂是针对pd-1和pd-l1的那些。在本发明的某些实施方式中,所述pd-1/pd-l1抑制剂选自由以下组成的组:纳武单抗、派姆单抗、西米普利单抗、斯巴达珠单抗、阿特珠单抗、度伐利尤单抗和阿维鲁单抗。lfa-1介体可以增强针对mc38-ova的抗体的抗癌免疫响应(图1b)和/或抗pd1抗体的免疫响应(图1h和图1i)。因此,本发明的组合物包含单克隆抗体、经修饰的免疫细胞和/或增强针对癌症的免疫响应的检查点抑制剂以及具有中等lfa-1稳定化性质的lfa-1信号传导介体,其中所述lfa-1信号传导介体显著增强抗癌免疫响应,是令人惊讶地选择性的并且可用于癌症免疫疗法。
78.在靶部位处高浓度的本发明的lfa-1信号传导介体、本发明的组合物或本发明的组合物的一种或多种成分可能有利于抗癌免疫响应,而在非靶部位处高浓度的本发明的lfa-1信号传导介体、本发明的组合物或本发明的组合物的一种或多种成分可能引起不希望的效应。靶部位处高浓度的本发明的lfa-1信号传导介体、本发明的组合物或本发明的组合物的一种或多种成分可以通过施用途径和/或通过载体的支持来实现。
79.本发明的lfa-1信号传导介体、本发明的组合物或本发明的组合物的一种或多种成分(以及任何附加的治疗剂)可以通过任何合适的手段施用,包括胃肠外、肺内和鼻内,以及如果需要的话(例如,用于局部治疗)则肿瘤内、病灶内、鞘内、子宫内或膀胱内施用。肠胃外输注包括皮下、肌内、静脉内、动脉内、腹膜内或皮下施用。在本发明的某些实施方式中,本发明的lfa-1信号传导介体、本发明的组合物或本发明的组合物的一种或多种成分可具有适当的性质以便皮内地、阴道内地、口服地、局部地、吸入地、鼻内地、透皮地、经直肠地施用(和吸收)以便局部和/或全身地作用。可以与本文所述的试剂和方法一起使用的施用技术可见于例如goodman和gilman,the pharmacological basis of therapeutics,current ed.;pergamon;and remington's,pharmaceutical sciences(现行版),mack publishing co.,easton,pa.中,该文献以引用方式并入本文。
80.在某些实施方式中,本发明涉及本发明的lfa-1信号传导介体或本发明的组合物用于实体瘤的癌症免疫疗法中的用途,其中所述lfa-1信号传导介体是经由瘤内注射施用的。
81.如本文所用,术语“实体瘤”是指形成离散肿瘤块的肿瘤。这种方法的范围内的实体瘤的示例包括结肠、直肠、肾、膀胱、前列腺、脑、乳腺、肝、肺、皮肤(例如,黑素瘤)和头颈肿瘤。
82.如本文所用,术语“施用(administer/administering/administration)”等是指可用于使组合物能够递送至期望的生物作用位点的方法。
83.如本文所用,术语“瘤内注射”是指机械装置介导的施用到肿瘤内、肿瘤环境内和/
或包含一种或多种肿瘤的组织内。
84.通过瘤内注射,可以在肿瘤环境中达到高局部浓度的本发明的lfa-1信号传导介体或本发明的组合物,而不会显著增加全身浓度。某些lfa-1信号传导介体,例如mg
2+
,迅速从所需的生物作用部位清除,或在最有利于增强靶部位的免疫响应的浓度下可能表现出不希望的效应(例如,在非靶部位处)。lfa-1信号传导介体的瘤内注射已被证明令人惊讶地可用于将lfa-1信号传导介体在靶部位处维持在治疗范围内(图1c、图1d、图1h和图1i)。
85.在本发明的某些实施方式中,本发明的lfa-1信号传导介体、本发明的组合物另外包含用于靶向递送lfa-1信号传导介体的载体。
86.如本文所用,术语“载体”是指允许靶向递送的任何药学上可接受的溶剂、助悬剂、媒介物剂、药物、组合物、装置、工具或它们的组合。
87.如本文所用,术语“靶向递送”是指允许在至少一个靶部位中比在至少一个非靶部位中更多地增加活性剂的浓度和/或效应的特定递送方式。
88.载体的使用可以增加本发明的lfa-1信号传导介体或本发明的组合物在靶部位处(例如在肿瘤环境中)的局部作用。在本发明的某些实施方式中,载体通过在到达靶部位之前延迟lfa-1信号传导介体或成分的释放(例如,通过脂质体封装),通过减少靶部位处成分的清除和/或代谢和/或通过限制靶部位处干扰剂(例如,钙螯合剂)的影响,来实现lfa-1信号传导介体或本发明的组合物的至少一种成分的靶向递送。
89.用于癌症免疫疗法的本发明的lfa-1信号传导介体或本发明的组合物的成分在到达靶部位之前的靶向递送和/或延迟释放可以通过本领域技术人员已知的任何方法实现。在本发明的某些实施方式中,载体经由多个成膜分子实现靶向递送和/或延迟释放。
90.如本文所用,术语“成膜分子”是指允许形成生物膜或能够整合到生物膜中的分子。膜可以形成单层片、双层片或胶囊,例如脂质体或胶束。在某些实施方式中,胶囊包含用于癌症的组合物的至少一种成分并且可以进一步携带药剂、诊断剂、营养剂、放射增敏剂、造影剂、酶、核酸、抗体、生长因子、蛋白质、肽、碳水化合物、靶向基团或这些的组合。
91.在本发明的某些实施方式中,成膜分子是成囊脂质。特别地,延迟释放可以通过载体结合和/或封装lfa-1信号传导介体或本发明的组合物的至少一种成分来实现。在本发明的某些实施方式中,载体包含可聚合的脂质两亲物以产生具有更高稳定性的交联脂质体(o'brien等人,1998,acc.chem.res.31:861-868;moon,j.j.,yuchen,f.a.n.,sahdev,p.,&bazzill,j.(2019).美国专利号10,307,491.washington,dc:美国专利商标局)。示例包括但不限于dotap、dope、dobaq或dopc。在本发明的一些实施方式中,载体包含官能化脂质(例如,具有马来酰亚胺或二苯并环辛炔(dbco))。
92.在本发明的某些实施方式中,免疫细胞连接的(例如t细胞连接的)合成纳米粒子被用作到靶部位(例如,进入免疫突触)的载体,以用于治疗性调节免疫信号传导事件。在某些实施方式中,载体形成马来酰亚胺官能化纳米粒子与t细胞膜蛋白上的游离硫醇基团的共价偶联,以用于将lfa-1信号传导介体或本发明的组合物的至少一种成分递送至t细胞突触。载体可以支持lfa-1信号传导介体或本发明的组合物的至少一种成分的递送,如由stephan,matthias t.等人所述。("synapse-directed delivery of immunomodulators using t-cell-conjugated nanoparticles."biomaterials 33.23(2012):57765787)。
93.在本发明的一些实施方式中,载体形成用于药物递送的刺激反应性脂质体,如在"
stimuli-responsive liposomes for drug delivery"(lee,y.,和d.h.thompson.wiley interdisciplinary reviews:nanomedicine and nanobiotechnology 9.5(2017):e1450.)中所述。
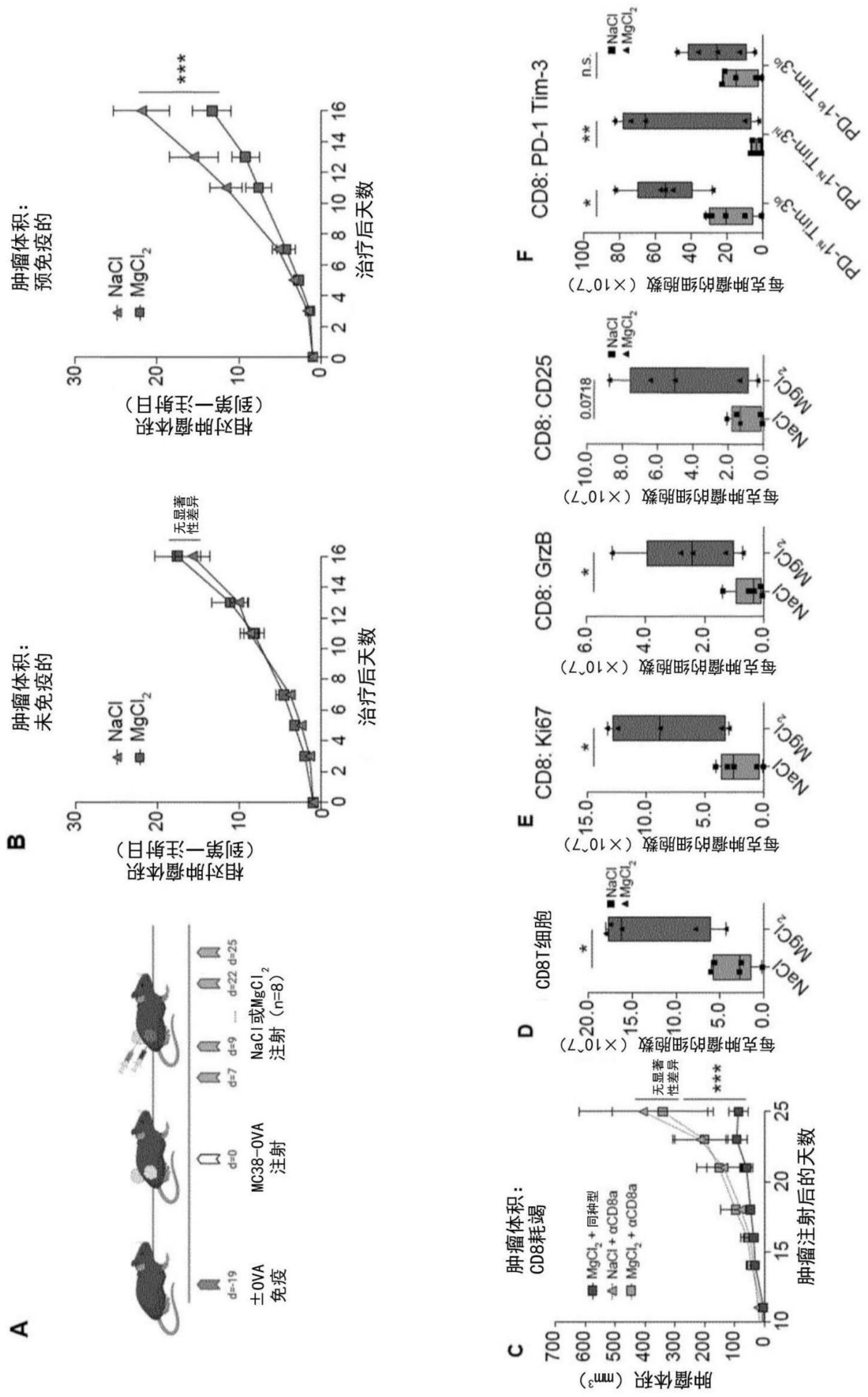
94.在本发明的一些实施方式中,载体是与本发明的lfa-1信号传导介体或本发明的组合物的至少一种成分缀合的载体-抗体。抗体可以在靶部位中(例如,在肿瘤环境中)或在肿瘤细胞上结合,以递送本发明的lfa-1信号传导介体或本发明的组合物的成分中的至少一种成分到靶区域。在本发明的一些实施方式中,载体-抗体在靶区域中结合时从本发明的lfa-1信号传导介体或本发明的组合物的至少一种成分脱离。在本发明的一些实施方式中,免疫系统调节剂还履行lfa-1信号传导介体的载体的功能。
95.减少本发明的lfa-1信号传导介体或用于癌症免疫疗法的组合物的至少一种成分的清除和/或代谢可通过药物诱导的代谢改变来实现。在一个示例中,甲状旁腺提取物降低了lfa1信号传导介体(例如,镁)的清除率(gill jr,john r.,norman h.bell和frederic c.bartter."effect of parathyroid extract on magnesium excretion in man."journal of applied physiology 22.1(1967):136-138)。在本发明的一些实施方式中,载体是增加本发明的lfa-1信号传导介体或用于癌症免疫疗法的组合物的成分中的至少一种成分的浓度的机械装置。在一个示例中,载体是用于通过溶血增加lfa-1信号传导介体(例如镁)的血浆浓度的装置。
96.限制干扰剂在靶部位的影响以增强本发明的lfa-1信号传导介体或用于癌症免疫疗法的组合物的至少一种成分的作用可以例如通过使用螯合物来实现。在一个示例中,载体包括钙螯合剂egta以增强lfa-1信号传导介体的作用(lomakina,elena b.和richard e.waugh."micromechanical tests of adhesion dynamics between neutrophils and immobilized icam-1."biophysical journal 86.2(2004):12231233)。
97.因此,本文所提供的发明是基于以下发现:局部增加本发明的lfa-1信号传导介体或本发明的组合物的至少一种成分的浓度(例如,通过瘤内注射或通过载体)可在癌症疗法期间赋予令人惊讶的增强的免疫响应。
98.可以通过任何合适的途径投配,例如通过注射,例如静脉内、皮下或瘤内注射,部分地取决于施用是短暂的还是长期的。本文考虑了各种投配方案,包括但不限于在不同时间点内单次或多次施用、推注施用和脉冲输注。
99.本发明的lfa-1信号传导介体、本发明的组合物或本发明的组合物的成分将以符合良好医疗实践的方式配制、投配和施用。在本文上下文中要考虑的因素包括正在治疗的特定类型的癌症、正在治疗的特定受试者、受试者的临床病症、癌症的进展、药剂的递送部位、施用方法、施用时间安排以及执业医师已知的其他因素。
100.载体的有效量取决于本发明的lfa-1信号传导介体、本发明的组合物的量或制剂中存在的本发明的组合物的至少一种成分的量、癌症或治疗的类型和进展等因素。
101.在本发明的实施方式中,其中载体直接与本发明的lfa-1信号传导介体或本发明的组合物的至少一种成分结合,所述载体通常在相同的剂量范围内和用如本文所述的施用途径使用,或者为本文所述剂量的约1%至99%,或为凭经验/在临床上确定为合适的任何剂量并通过凭经验/在临床上确定为合适的任何途径。
102.在本发明的实施方式中,其中载体形成膜,载体的量可高于本发明的lfa-1信号传
导介体或本发明的组合物的至少一种其他成分的量,例如为同时施用的本发明的lfa-1信号传导介体或本发明的组合物的至少一种其他成分的量的2倍、3倍、5倍、10倍、50倍、100倍或大于100倍高,具体取决于上述因素。
103.在本发明的某些实施方式中,免疫系统调节剂是抗体或检查点抑制剂,并且剂量为约1μg/kg至15mg/kg(例如0.1mg/kg-10mg/kg),具体取决于上述因素。
104.在本发明的某些实施方式中,免疫系统调节剂是经修饰的免疫细胞,并且一个疗法周期的免疫系统调节剂的总剂量通常为约1
×
104/kg至1
×
10
10
/kg经修饰的免疫细胞或更多,具体取决于上述因素。
105.在本发明的某些实施方式中,免疫系统调节剂充当具有中等lfa-1稳定化性质的lfa-1信号传导介体的载体,并且免疫系统调节剂以类似的剂量范围投配,优选地以与具有中等lfa-1稳定化性质的lfa-1信号传导介体约等摩尔的剂量范围投配。
106.在本发明的某些实施方式中,具有中等lfa-1稳定化性质的lfa-1信号传导介体是二价阳离子,并以0.5-15mm,优选地0.9-10mm,更优选地1.5-5mm,特别是约3mm的浓度范围在溶液中施用(图1b、图1c、图1d、图1h和图1i)。
107.在本发明的某些实施方式中,具有中等lfa-1稳定化性质的lfa-1信号传导介体是抗体,并且剂量为约1μg/kg至15mg/kg(例如,0.1mg/kg-10mg/kg),具体取决于上述因素。
108.在本发明的某些实施方式中,具有中等lfa-1稳定化性质的lfa-1信号传导介体是肽,并且剂量为约1μg/kg至15mg/kg(例如,0.1mg/kg-10mg/kg),具体取决于上述因素。
109.在本发明的某些实施方式中,具有中等lfa-1稳定化性质的lfa-1信号传导介体是小分子,并且剂量为约1μg/kg至15mg/kg(例如,0.1mg/kg-10mg/kg),具体取决于上述因素。
110.本发明的lfa-1信号传导介体、本发明的组合物或本发明的组合物的至少一种成分的剂量可以是用于施用于患者的初始候选剂量,而无论是例如通过一次或多次单独施用还是通过连续输注。
111.在本发明的一些实施方式中,免疫系统调节剂和lfa-1信号传导介体是同时或顺序地施用的。
112.如本文所用,术语“同时”是指同时施用多于一种药物,但不一定经由相同的施用途径或以一种组合制剂的形式。例如,本发明的组合物的一种成分可以口服提供,而本发明的组合物的另一种成分可以在患者就诊期间静脉内提供。
113.在本发明的某些实施方式中,本发明的组合物或本发明的组合物的成分适当地一次施用于患者。
114.如本文所用,术语“顺序地”是指在施用本发明的组合物的第一成分之后立即或及时施用本发明的组合物的第二成分。
115.在本发明的某些实施方式中,免疫系统调节剂或lfa-1信号传导介体可对免疫系统产生影响(例如引发和/或活化)。取决于相关施用时间安排的因素,例如这种对免疫系统的影响的开始和持续时间,同时或顺序地施用免疫系统调节剂和lfa-1信号传导介体是有益的。
116.免疫系统调节剂和lfa-1信号传导介体可能在用于施用时间安排的更多因素方面不同,例如在药代动力学和药效学性质方面和/或在影响彼此的药代动力学和药效学性质方面。
117.用于施用时间安排的其他因素包括正在治疗的特定类型的癌症、正在治疗的特定受试者、受试者的临床病症、癌症的进展、药剂的递送部位、施用方法,以及执业医师已知的其他因素。
118.在本发明的某些实施方式中,在同时施用于受试者之前,将免疫系统调节剂(例如,经修饰的t细胞)在含有高浓度lfa-1信号传导介体(例如,mg
2+
)的培养基中预孵育,以避免高lfa-1信号传导介体浓度的毒性效应。
119.在本发明的某些实施方式中,将免疫系统调节剂和具有中等lfa-1稳定化性质的lfa-1信号传导介体同时施用以使免疫系统调节剂能够充当具有中等lfa-1稳定化性质的lfa-1信号传导介体的载体。
120.在本发明的某些实施方式中,将免疫系统调节剂和具有中等lfa-1稳定化性质的lfa-1信号传导介体同时施用以使载体能够支持本发明的组合物的几种成分的靶向递送。
121.在本发明的一些实施方式中,免疫系统调节剂和lfa-1信号传导介体是顺序地施用的。
122.在本发明的某些实施方式中,免疫系统调节剂和lfa-1信号传导介体以1分钟、5分钟、10分钟、15分钟、20分钟、30分钟、45分钟、1小时、2小时、3小时、4小时、6小时、8小时、12小时、16小时、1天、1.5天、2天、2.5天、3天、4天、5天、7天、10天、12天、14天、16天、24天(例如,图1b、图1c、图1d、图1e、图1h和图1i))的时间差顺序地施用,部分取决于上述用于施用时间安排的因素。
123.在本发明的一些实施方式中,首先施用免疫系统调节剂,之后在少于5年的时段内重复施用lfa-1信号传导介体。
124.在本发明的某些实施方式中,将本发明的lfa-1信号传导介体、本发明的组合物和/或本发明的组合物的至少一种成分在一系列治疗和/或治疗循环中适当地施用于患者。通常,lfa-1信号传导介体在数周至数月的时段内施用。在lfa-1信号传导介体显示出一种或多种预期效应并且被可接受地耐受的情况下,lfa-1信号传导介体也可以施用多年。
125.在本发明的某些实施方式中,重复施用lfa-1信号传导介体(例如,mg
2+
)以维持受试者中的lfa-1信号传导介体浓度(图1a和图1h)。在本发明的实施方式中,这种重复施用可能特别有益,其中lfa-1信号传导介体的半衰期比免疫系统调节剂的半衰期短。在本发明的此类实施方式中,lfa-1信号传导介体可以在例如1周、2周、3周或4周的时段内重复施用(例如,每隔0.5天、1天、1.5天、2天、2.5天或3天),部分取决于上述用于施用时间安排的因素。
126.在其他实施方式中,免疫系统调节剂(例如,经修饰的免疫细胞的施加)的效应不主要依赖于半衰期,并且可以表现出可以通过本发明的lfa-1信号传导介体增强的延长的效应。在这些实施方式中,lfa-1信号传导介体的重复施用的时段也可以更长,例如5周、6周、2个月或更长,部分取决于上述用于施用时间安排的因素。
127.在本发明的一些实施方式中,第一次施用后每隔2-7天重复施用一次。
128.为了在靶部位维持高浓度的本发明的组合物,至少每隔7天,优选地每隔6天,优选地每隔5天,优选地每隔4天,优选地每隔3天,优选地每隔2.5天,优选地每隔2天一次重复施用本发明的组合物(图1a和图1g)。
129.对于数天或更长时间的重复施用,取决于癌症的类型和靶部位,治疗通常会持续直到出现所需的疾病症状抑制。本发明的组合物或本发明的组合物的成分的一个示例性剂
量将在约0.05mg/kg至约10mg/kg的范围内。因此,可以向患者施用约0.5mg/kg、2.0mg/kg、4.0mg/kg或10mg/kg(或它们的任何组合)的一个或多个剂量。此类剂量可以间歇地施用,例如,每周或每隔三周(例如,使得患者接受约二个至约二十个,或例如约六个剂量的抗体)。可以施用初始较高负荷剂量,然后施用一个或多个较低剂量。然而,其他剂量方案可为可用的。这种疗法的进展很容易通过常规技术和测定进行监测。
130.在本发明的某些实施方式中,免疫系统调节剂是经修饰的免疫细胞,并且通过根据第一天10%,第二天30%,第三天60%的模式在几个疗程(例如三个疗程)内注射细胞总数来研究患者的耐受性。
131.因此,本文提供的发明基于以下发现:本发明的组合物的优选施用模式能够令人惊讶地增强免疫系统调节剂在癌症疗法期间的免疫响应。
132.在本发明的一些实施方式中,癌症选自由以下组成的组:乳腺癌、脑癌、造血器官癌(例如急性髓性白血病)、免疫系统癌(例如霍奇金淋巴瘤)、前列腺癌、肺癌、结肠癌、头颈癌、皮肤癌、卵巢癌、子宫内膜癌、宫颈癌、肾癌、肺癌、胃癌、小肠癌、肝癌、胰腺癌、睾丸癌、脑垂体癌、血液癌、脾癌、胆囊癌、胆管癌、食道癌、唾液腺癌和甲状腺癌。
133.本发明的lfa-1信号传导介体和本发明的组合物特别可用于免疫细胞可接近的器官或组织中的癌症。
134.因此,本文所提供的发明基于以下发现:本发明的组合物令人惊讶地可用于选自由以下组成的组的癌症的免疫疗法:乳腺癌、脑癌、造血器官癌(例如急性髓性白血病)、免疫系统癌症(例如霍奇金淋巴瘤)、前列腺癌、肺癌、结肠癌、头颈癌、皮肤癌、卵巢癌、子宫内膜癌、宫颈癌、肾癌、肺癌、胃癌、小肠癌、肝癌、胰腺癌、睾丸癌、脑垂体癌、血癌、脾癌、胆囊癌、胆管癌、食道癌、唾液腺癌和/或甲状腺癌。
135.在本发明的一些实施方式中,癌症选自由以下组成的组:免疫系统、胸腺、脾脏、骨髓的癌症。
136.本发明的lfa-1信号传导介体和本发明的组合物特别可用于治疗t细胞可接近的癌症。
137.因此,本文所提供的发明基于以下发现:本发明的lfa-1信号传导介体和本发明的组合物令人惊讶地可用于选自由以下组成的组的癌症的免疫疗法:黑素瘤、肺癌、肾癌、膀胱癌、头颈癌、霍奇金淋巴瘤、膀胱癌、默克尔细胞癌和/或尿路上皮癌。
138.除非另有定义,否则本文所使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同含义。尽管与本文所述的那些相似或等同的方法和材料都可以用于本发明的实践或测试,但是下文描述了合适的方法和材料。在冲突的情况下,以本说明书,包括定义为准。此外,材料、方法和实施例仅是说明性的而非旨在为限制性的。
139.除非另有说明,否则本文所述的一般方法和技术可根据本领域中众所周知的常规方法执行,并且如在整个本说明书中引用和讨论的各种一般和更具体的参考文献中所描述的。
140.虽然在附图和前面的描述中详细说明和描述了本发明的各方面,但是此类说明和描述被认为是说明性或示例性的而不是限制性的。应当理解的是,普通技术人员可以在所附权利要求书的范围和精神内进行改变和修改。特别地,本发明涵盖具有来自上文和下文所述的不同实施方式的特征的任意组合的更多实施方式。
141.此外,权利要求书中的“包括”一词不排除其他元件或步骤,并且不定冠词“一”或“一个(种)”不排除复数个(种)。单个单位可以实现权利要求书中列举的几个特征的功能。与属性或值相关的术语“基本上”、“约”、“大约”等特别地也分别定义了准确的属性或准确的值。权利要求书中的任何参考标记不应被解释为限制范围。
附图说明
142.图1:瘤内镁施用提高了适应性抗肿瘤免疫力。(a)实验设计示意图。向经ova免疫或未处理的bl/6小鼠的胁腹双侧皮下接种mc38-ova肿瘤细胞。从第7天起,在左胁腹肿瘤中施加3mm nacl溶液的注射,而在对侧肿瘤中注射3mm mgcl2溶液。这个方案每隔三天重复一次,达总共8个循环。(b)未免疫小鼠(n=20)(左小图)和免疫小鼠(n=19)(右小图)的肿瘤生长曲线。(c)
±
cd8耗竭小鼠(n=6-17)中的肿瘤生长曲线。结果汇集自2个独立实验,每个实验n=6-12只小鼠。(d)肿瘤浸润性cd8
+
t细胞的绝对数量。(e)ki67(左小图)、颗粒酶b(中间小图)和cd25(右小图)阳性的肿瘤浸润性cd8
+
t细胞的数量。(f)表达pd-1和tim3的肿瘤浸润性cd8
+
t细胞的细胞数。(g)实验设计示意图。向经ova免疫的bl/6小鼠的胁腹单侧皮下接种mc38-ova肿瘤细胞。从第5天起,开始瘤内注射3mm nacl或3mm mgcl2,并且每隔三天重复一次,持续8个循环。在第9天、第12天和第15天额外向鼠腹腔注射200μg的同种型对照(igg2a)或抗pd-1抗体。(h)肿瘤生长曲线(n=13-14)和(i)宿主存活率(n=13-14)。结果汇集自2个独立实验(b、h、i)。
143.数据表示为平均值
±
sem(b、c、h)、中值
±
iqr,其中每个符号代表一只小鼠(d、e、f),并且通过双因素方差分析(anova)和邦费罗尼校正(b、c和h)、非配对双尾学生t检验(d、e)、双因素方差分析和sidak校正多重比较检验(f)和对数秩mantel-cox检验(i)评估统计显著性。*p《0.05,**p《0.01,***p《0.001,****p《0.0001。i.p.表示腹膜内;ab表示抗体
144.图2:细胞外镁经由lfa-1促进记忆特异性活化。通过在含有1.2mm mg
2+
、0mm mg
2+
的培养基或在活化前立即从0mm至1.2mm mg
2+
重构的培养基(0
→
1.2mm mg
2+
)中进行代谢通量分析来评定仅注射抗cd3抗体、或注射抗cd3抗体和抗cd28抗体时,人em cd8 t细胞(a)和原初cd8 t细胞(b)亚群的糖酵解切换。(a)人效应记忆(em)的结果和(b)人原初cd8 t细胞的结果。通过从基线ecar测量值中减去最大ecar来量化糖酵解切换。(c)分别在1.2mm和0mm mg
2+
培养基中通过板结合的抗cd3抗体和可溶性抗cd28抗体活化后24小时,对人em cd8 t细胞上的表面活化标志物的流式细胞术分析。(d)通过cba确定的对应em cd8 t细胞培养上清液中炎性细胞因子的丰度。(e)人原初和em cd8 t细胞以及pha t母细胞上的cd11a(lfa-1)表面表达。通过mab ts2/4评定的基于流式细胞术的总lfa-1表达的评定(f),通过mab hi111获得的αl的闭合构象(g)、通过mab kim127获得的lfa-1的扩展构象(h),通过mab m24获得的lfa-1的开放头段构象(i),粘着斑激酶(fak)的磷酸化(h),以及tnf表达(k)
±
tcr诱导的不同细胞外mg
2+
浓度的活化。(l)使用开放头段报告mab m24对人em和原初cd8 t细胞上具有开放头段构象的lfa-1的基于流式细胞术的评定。(m)对em cd8 t细胞的糖酵解切换的评定。(n)对原初cd8 t细胞的糖酵解切换的评定。对
±
用birt377(50μm)处理的人pha t细胞母细胞上的tcr刺激诱导的具有开放头段构象的lfa-1活化(o)以及糖酵解切换(p)和去颗粒作用(q)的评定。
145.每个符号代表单独的健康人类供体,图表显示了来自2-4次独立实验的汇总结果,
条形指示平均值
±
sd(a-c、e-q)并且条形指示中值
±
四分位差(d)。通过重复量度单因素方差分析和sidak多重比较检验(a、b、e、l-q)、未配对的双尾学生和holm-sidak校正多重比较(c)、mann-whitney检验(d)评定统计显著性。*p《0.05,**p《0.01,***p《0.001,****p《0.0001。mab表示单克隆抗体;mg
2+
表示镁;tnf表示肿瘤坏死因子;gmfi表示几何平均荧光强度
146.图3:镁调节lfa-1介导的t细胞活化和细胞毒性以及bite和car t细胞功能性。(a)在含有1.2mm mg
2+
和0mm mg
2+
的培养基中注射抗cd3/28ab后鼠wt和lfa-1-/-ctl的糖酵解切换,呈现为n=4只小鼠的汇总数据的量化。(b)分别在1.2mm和0mm mg
2+
培养基中用抗cd3 ab刺激的wt和lfa-1-/-jurkat t细胞中的钙通量。细胞负载有fluo4,并且将酶标仪记录的信号强度归一化为未刺激的基线值。数据表示为一式两份的3次独立实验的曲线下面积的量化,(c)在与板结合的抗cd3 ab和可溶性抗cd28 ab在含有1.2mm mg
2+
、0mm mg
2+
或1.2mm mg
2+
±
birt377(50μm)的培养基中一起孵育8小时后,鼠wt和lfa-1-/-ctl上的去颗粒作用标志物cd107a的表达。n=3只小鼠的量化结果,每只小鼠有3个技术重复。(d)在(c)中的条件下在10μg/ml pha存在下与鼠wt和lfa-1-/-ctl共培养4小时后,el4靶细胞中的半胱天冬酶-3活性。效应物与靶细胞的比率为3:1。结果是针对n=3只小鼠量化的,每只小鼠有3个技术重复。(e)通过流式细胞术评定的在人原初和em cd8 t细胞、pha t母细胞和rep t细胞上的代表性cd11a(lfa-1)表面表达。对在与(c)中相同的条件下与t2靶细胞(经10-8
m 9c肽脉冲的)共孵育后的rep t细胞上的具有弯曲构象的失活lfa-1(f)、具有β2腿部延伸的延伸构象(g)、具有开放头段的lfa-1(h)、fak磷酸化、去颗粒作用标志物cd107a的表达(j)的的基于流式细胞术的评定。效应物与靶细胞的比率为1:1。数据呈现为n=5个健康供体(f、g、h);n=3个健康供体,每个健康供体有2个技术重复;或n=1个健康供体,有4个技术重复(j)的量化结果。(k)在使用(c)中的条件与rep t细胞共培养后45分钟,经9c肽脉冲的(10-8
m)t2靶细胞中的半胱天冬酶-3活性。效应物与靶细胞的比率为1:1。数据呈现为n=1个健康供体,有4个技术重复的量化结果。(l)表示在所示的mg
2+
和博纳吐单抗(blinatumomab)浓度下与n=5个健康供体的pha母细胞共培养3.5h后ramos靶细胞中半胱天冬酶-3活性的流式细胞术评定的箱线图。(m)在300pg ml-1
的博纳吐单抗浓度下与ramos细胞共培养30min后,pha母细胞上活化诱导的lfa-1头段开放的基于流式细胞术的评定,n=5个健康供体。(n)pha母细胞、未转导的t细胞以及表达抗cd19的car t细胞上的cd11a表达的代表性直方图。(o)在含有0.6mm或0mm mg
2+
的培养基中与psma+pc3-pip细胞系共培养的抗psma car t细胞和utd t细胞的细胞毒性测定。细胞毒性被报告为通过在死靶细胞中掺入细胞毒性绿色试剂驱动的荧光曲线下的总面积(每μm2的绿色面积)。效应物与靶细胞的比率为2:1。示出了来自2个独立实验的n=6的汇集结果。(p)通过elisa确定24小时处与(o)中所描述的条件对应的细胞培养上清液中ifnγ的丰度(n=8,3个独立实验)。(q)置于mg
2+
耗竭饮食或相应的对照饮食上并用抗psma car t细胞、未转导的t细胞或盐水溶液处理的小鼠的肿瘤生长曲线。n=2个独立实验的代表,其中每组n=6只小鼠。
147.数据表示为平均值
±
sd(a-d、f-k、m、p)、
±
iqr(l)、
±
sem(o、q)。通过普通单因素方差分析和sidak多重比较检验(a-d、i-k、l)、rm单因素方差分析和sidak多重比较(f、g、h)、双因素方差分析和事后tukey检验(o、q)和未配对的双尾学生t检验(m、p)评定统计显著性。ab表示抗体;em表示效应记忆;mg
2+
表示镁;ctl表示细胞毒性t淋巴细胞;psma表示前列
腺特异性膜抗原;car表示嵌合抗原受体;utd表示未转导的;pha表示植物血凝素、rep t细胞表示快速扩增方案t细胞。
148.图4:镁在生理范围内调节lfa-1介导的t细胞活化和细胞毒性
149.(a)对在用抗cd3 ab和抗cd28 ab进行超生理活化,并在含有1.2mm mg
2+
、0mm mg
2+
的培养基或在活化前立即重构为1.2mm mg
2+
的培养基(0
→
1.2mm mg
2+
)中额外注射交联抗cd3/28二抗后的人em cd8 t细胞的代谢流分析。来自3个独立实验的n=6个健康供体的汇总结果。(b)在含有
±
mg
2+
的培养基中用指定浓度的板结合抗cd3 mab活化后,pha t细母细胞的cd69表达。(c)在所指示浓度的pha存在下在含有1.2mm mg
2+
或0mm mg
2+
的培养基中与鼠wt和lfa-1-/-ctl共培养4小时后,el4靶细胞中的半胱天冬酶-3活性。效应物与靶细胞的比率为3:1。汇集结果,n=3-4,来自2个独立实验。(d)使用在含有1.2mm mg
2+
或0mm mg
2+
的培养基中与表达荧光素酶的el4靶细胞(经10^-6m的改变的ova肽脉冲的)共培养4小时的wt和lfa-1-/-ot1 ctl的细胞毒性测定。细胞毒性在向培养基中加入荧光素并测量发光信号强度后量化。效应物与靶细胞的比率为3:1(n=4只小鼠)。(e)与表达荧光素酶的t2靶细胞(
±
用10-8
m的9c肽脉冲的)在含有活化抗lfa-1ab cbr-lfa1/2(10μg/ml)或同种型对照ab(10μg/ml)和1.2mm或0mm mg
2+
的培养基中共培养4小时的人rep t细胞的细胞毒性。细胞毒性在向培养基中加入荧光素并测量发光信号强度后量化。效应物与靶细胞的比率为2:1。具有n=1个健康供体和3-6个技术重复的代表性实验。
150.数据表示为平均值
±
标准偏差。通过普通单因素方差分析和sidak多重比较检验(a、d、e)评定统计显著性
具体实施方式
151.如本文所用,冠词“一”和“一个(种)”是指一个(种)或多于一个(种)(即,至少一个(种))该冠词的语法对象。举例来说,“一个(种)要素”意指一个(种)要素或多于一个(种)要素。如本文所用,术语“约”是指大约、在区域内、粗略地或左右。当术语“约”与数值范围结合使用时,它通过将边界延伸到所叙述的数值之上和之下来修饰该范围。一般而言,术语“约”在本文中用于修饰数值比指定值高和低
±
20%或
±
10%,在一些情况下
±
5%,在一些情况下
±
1%,并且在一些情况下
±
0.1%的变化量,因为这些变化量适于执行所公开的方法。如本文所用,术语“治疗(treatment)”(及其语法变体,例如“治疗(treat/treating)”)是指试图改变被治疗的个体的自然病程并且可以执行以用于预防或在至少一种病理过程期间执行的至少一种干预。治疗的所需效应包括但不限于预防疾病的发生或复发、减轻症状、减轻疾病的任何直接或间接病理后果、预防转移、降低疾病进展速率、改善或减轻疾病状态、和缓解或改善预后。治疗包括对疾病或病理状态的症状或病理的任何有益或期望的效应,并且可以包括甚至最小程度地减少所治疗的疾病或病症(例如,癌症)的一种或多种可测量标志物。“治疗”不一定表示疾病或病症或其相关症状的完全根除或治愈。术语“患者”、“受试者”、“个体”等在本文中可互换使用,并且是指无论是在体外还是在原位的适用于本文所述的方法的任何动物或其细胞。在某些非限制性实施方式中,患者、受试者或个体是人。如本文所用,术语“嵌合抗原受体(car)”是指融合蛋白,所述融合蛋白包含能够与预定抗原结合的细胞外结构域、包含源自不同于细胞外结构域所来源于的多肽的信号转导蛋白的一个或多个细胞质结构域的细胞内区段,以及跨膜结构域。如本文所用,术语“有效量”是指活性剂
basel-stadt and geneva))批准。所有笼子都提供自由采食和水。在实验期间,至少每隔一天监测一次所有动物的不适迹象,并且如果需要的话,则每周测量体重3次。在终点通过过量二氧化碳杀死小鼠。
159.人原初和记忆t细胞分离
160.经书面知情同意后,从健康的男性和女性供体(18-65岁)获得血样作为血沉棕黄层(巴塞尔大学医院的血液供体中心(blood donor center,university hospital basel))。
161.通过标准密度梯度离心方案(lymphoprep;fresenis kabi)分离外周血单核细胞(peripheral blood mononuclear cell,pbmc)。使用macs珠粒和ls柱(均购自milteny biotec)来分选cd8阳性t细胞。将经阳性选择的cd8 t细胞与apc抗cd62l mab(immunotools)和太平洋蓝抗cd45ra(beckman coulter)一起孵育。原初和em cd8
+
t细胞分别被鉴定为cd62l
+
cd45ra
+
和cd62l
–
cd45ra
–
群体。使用bd facsaria iii或bd流入细胞分选仪(bd bioscience)执行细胞分选。在进一步实验之前,将细胞于37℃静置24h。
162.人t母细胞(pha母细胞)的产生
163.用10μg ml-1
植物血凝素(pha,thermo fisher)和300u ml-1
人重组il-2(proleukin,novartis)活化pbmc。通过每隔3-4天添加新鲜il-2来扩增pha母细胞。
164.体外活化人t细胞
165.除非另有说明,否则人em cd8 t细胞和pha母细胞在1μgml-1
的板结合抗cd3 ab(hit3a,biolegend)和5μg ml-1
的可溶性抗cd28 ab存在下被活化。用经自制产生的抗cd3/抗cd28包被的微珠活化原初cd8 t细胞。将polybead微球(4.5mm,polyscience eppenheim)与1μg抗cd3 ab和10μg抗cd28 ab一起孵育。将t细胞以2
×
105个细胞/孔接种在平底96孔板(greiner bio one)中的补充有10%dfcs并按指示补充有mg
2+
或lfa-1抑制剂的自制培养基中。将原代人t细胞活化24h,并将pha母细胞活化4h。
166.ny-eso多肽
167.ny-eso-9c肽(sllmwitqc)购自ez biolabs,纯度》95%。将冻干的肽以10mm的浓度重悬于无菌二甲基亚砜(dmso)中,并存储在-20℃直至进一步使用。
168.用于rep t细胞的t细胞受体构建体
169.由洛桑大学的michael hebeisen博士和natalie rufer博士善意地提供了在hpgk启动子下编码由ires结构域分隔的密码子优化的wt lau155 ny-eso-1t细胞受体α链和β链的慢病毒构建体(hebeisen等人,2013;schmid等人,2010)。这种tcr对其内源性ny-eso-1sllmwitqc肽的kd=21.4μm。
170.为rep t细胞生成慢病毒
171.为了产生慢病毒,将2.5
×
106个低传代hek293t细胞在dmem培养基(thermo fisher)中培养并接种到15cm经组织培养处理的培养皿中。在3天后,将第2代含有ltr的供体质粒、包装质粒pcmv-δ8.9和包膜质粒vsv-g在未补充的opti-mem(thermo fisher)中以4:2:1的比率混合并无菌过滤。然后将这种溶液与同样在opti-mem中以1:3的dna:pei比率稀释的聚乙烯亚胺25kda(polysciences inc.)混合。每15cm培养皿转染28μg的dna。在2天后,从细胞(交换介质)中收集上清液并滤过0.45μm的pes过滤器。将上清液于4℃存储1天,直到24小时后收集第二批上清液。通过于4℃以40,000x g超速离心2h来浓缩含有慢病毒粒
子的上清液,重悬于0.1% bsa的pbs溶液中,并冷冻至-80℃。
172.用于rep t细胞生产的人t细胞的转导
173.为了产生ny-eso-1tcr特异性t细胞,将人类健康供体pbmc解冻并在pbs中洗涤。然后根据制造商的使用说明在automacs(myltenyi)上使用cd8微珠(miltenyi)来分离cd8 t细胞。将分离的细胞洗涤并重悬于补充有150u ml-1
il-2的培养基中并以1.5mio ml-1
接种。然后根据制造商的施用说明,用来自t细胞活化和扩增试剂盒(miltenyi)的活化珠粒以1:1的比率活化cd8t细胞。24小时后,以为2的感染复数(moi)添加如上所述产生的ny-eso-1tcr慢病毒粒子。然后每隔2天用新鲜培养基扩增细胞并补充50uml-1 il-2达5天。将ny-eso-1tcr阳性t细胞用facsaria iii或facs sorparia(bd)分选,并用ny-eso-9c肽重刺激。维持0.5-2
×
106个细胞ml-1
的细胞密度用于扩增,并且每隔三天更换3,000u ml-1
的il-2。在扩增1周后,将细胞存储在液氮中或进一步扩增,随后用于如下所述的功能读出。
174.rep t细胞的活化和细胞毒性
175.如果没有另外说明的话,则将rep t细胞与t2靶细胞一起在平底96孔板中以1:1的比率(各自4-6
×
104个)一起孵育。预先针对每个供体滴定最佳比率。为了区分不同的细胞群体,将rep t细胞用celltrace violet(ctv,invitrogen)标记,并将t2靶细胞用羧基荧光素二乙酸琥珀酰亚胺酯(cfse,invitrogen)标记。在共孵育之前,将经cfse标记的t2靶细胞用10-8
m的ny eso肽在无镁培养基中脉冲30min,并洗涤三次,然后与rep t细胞一起在补充有10%dfcs的无镁培养基中以指定的阳离子或lfa-1抑制剂浓度重悬。对于所有共孵育实验,使细胞在不离心的情况下沉降。对于去颗粒作用测定,在整个共孵育过程中将抗cd107a-af647 ab直接添加到培养基中。在4小时后,收获细胞,在冷facs缓冲液中洗涤,并在室温下用2%的pfa轻轻固定15min。用nucview 488荧光半胱天冬酶-3底物(biotium)检查细胞毒性。在共孵育开始时,以1μm的最终浓度将荧光半胱天冬酶底物添加到孔中。45min后,将细胞在facs缓冲液中洗涤,并在室温下用2%的pfa轻轻固定15min。对于蛋白质磷酸化分析,在25min后终止共孵育,如以下流式细胞术小节中所述。或者,使用表达荧光素酶的t2靶细胞(图4e)。对于这个特定的实验,rep t细胞与t2靶标的比率为2:1。在共培养开始时加入cbr-lfa1/2(biolegend)或同种型对照(biolegend),最终浓度为10μg ml-1
。向培养基中加入0.15mg ml-1
的荧光素(perkinelmer)并通过酶标仪(synergy h1,biotek)测量发光信号强度后,对细胞毒性进行量化。
176.用于car t细胞的重组慢病毒生产
177.产生高滴度复制缺陷型慢病毒并通过超速离心浓缩以用于原代t细胞转导。简而言之,在转染前24h,将hek293细胞以10
×
106接种在t-150组织培养瓶中的30ml培养基中。使用无内毒素的maxiprep试剂盒(invitrogen,life technologies)纯化所有质粒dna。使用turbofect(thermo fisher)和optimem培养基(invitrogen,life technologies,180μl的turbo fect用于3ml的optimem)的混合物,用7μg pvsv-g(vsv糖蛋白表达质粒)、18μg的r874(rev和gag/pol表达质粒)和15μg的pelns转基因质粒转染hek-293t细胞。转染后48小时收集病毒上清液。将病毒粒子通过以24,000g超速离心2h浓缩,并重悬于400μl培养基中,之后立即在干冰上快速冷冻。
178.用于car t细胞生成的原代人t细胞转导
179.原代人t细胞是从健康供体的外周血单核细胞中分离出的(hd;制备为血沉棕黄层
或单采术过滤器)。所有血样均在hd的知情同意下收集,并在获得沃州(canton of vaud)伦理批准的情况下进行遗传工程化。使用标准离心方案,经由lymphoprep(axonlab)分离溶液获得总外周血单核细胞。按照制造商的建议(easysep,stem cell technology),使用基于磁性珠粒的阴性选择试剂盒分离cd4和cd8 t细胞。将纯化的cd4和cd8 t细胞以1:1的比率培养,并用1:2的t细胞与珠粒比率的抗cd3和抗cd28 ab包被的珠粒(invitrogen,life technologies)刺激。将t细胞在活化后18-22h用慢病毒粒子转导。人重组il-2(hil-2;glaxo)每隔一天补足至50iu ml-1
的浓度,直到刺激后5天(第+5天)。在第+5天,去除磁性珠粒,并向培养物中添加10ng ml-1
的h-il-7和h-il-15(miltenyi biotec)以代替h-il-2。维持0.5-1
×
106个细胞ml-1
的细胞密度以用于扩增。在所有功能测定之前,调整静息工程化t细胞以实现等效转基因表达。
180.用car t细胞进行细胞毒性测定
181.使用incucyte仪器(essen bioscience)执行细胞毒性测定。简而言之,将1.25
×
104个pc3-pip靶细胞接种在平底96孔板(costar,vitaris)中。4小时后,将静息t细胞(48h内不添加细胞因子)洗涤,并以2.5
×
104/孔、以2:1的效应物与靶标比率接种于补充有10%dfcs和0.6mm mgcl2或不补充mg
2+
的自制培养基中。在测定的共培养时段期间不添加外源细胞因子。以在200μl总体积中5μm的终浓度添加incucyte半胱天冬酶-3/7(essen bioscience)。
182.将内部实验性阴性对照包含在所有测定中,包括在incucyte半胱天冬酶-3/7试剂存在下共孵育未转导的(utd)-t细胞和肿瘤细胞,以监测随时间推移的自发性细胞死亡。作为阳性对照,用1%triton溶液处理单独的肿瘤细胞,以评估测定中的最大杀伤力。每共培养2h收集每孔的总绿色面积的图像。通过在由essen bioscience提供的incucyte zoom软件上使用相同的分析方案获得每孔的总绿色面积。通过从所有其他时间点减去在时间0(在car-t细胞杀伤任何细胞之前)观察到的背景荧光,对所有数据进行归一化。
183.car t细胞的细胞因子释放测定
184.通过在96孔圆底平板中一式两份地在终体积为200μl的补充有10%dfcs和0.6mm mgcl2或不补充mg
2+
的自制培养基中进行每孔5
×
104个t细胞与5
×
104个靶细胞的共培养来进行细胞因子释放测定。24h后,收集共培养上清液,并根据制造商的方案(biolegend)通过商业酶联免疫吸附测定试剂盒测试ifnγ的存在。
185.小鼠mc38-ova肿瘤模型—建立
186.除非另有说明,否则使用6至12周龄的雌性小鼠进行实验。在用预免疫小鼠进行的测定中,将小鼠在肿瘤植入前19天通过皮下注射重悬于100μl pbs中的100μg的ova蛋白(invivogen)和50μg的cpg-b odn 1826(eurogentec)进行免疫。对于肿瘤植入,将重悬于100μl pbs中的0.5
×
106个mc38-ova细胞皮下接种到小鼠的胁腹上。在双侧肿瘤实验中,小鼠接受50μl瘤内注射的3mm nacl或3mm mgcl2(均在ddh2o中稀释)。左胁腹肿瘤中施加nacl溶液的注射,而对侧肿瘤中注射mgcl2溶液。一旦肿瘤可感知,通常在肿瘤注射后第5天与第10天之间,就开始鞘内注射。每隔三天重复注射一次。使用卡尺量化肿瘤大小,并使用有理椭圆公式(α2
×
β
×
π/6,α为较短轴并且β为较长轴)计算肿瘤体积。在所有存活率实验中,在任何肿瘤尺寸已达到大于15mm的长度后,使小鼠退出研究。
187.小鼠mc38-ova肿瘤模型—体内cd8
+
t细胞耗竭
188.对于cd8耗竭实验,将小鼠如上所述用ova进行免疫,并在胁腹上单侧接种0.5
×
106个mc38-ova细胞。开始瘤内注射3mm nacl或3mm mgcl2,并在肿瘤变得可感知时每隔三天重复一次瘤内注射。通过施用每周腹腔注射一次的10mg kg-1
抗cd8a ab(53-6.72,bioxcell)来耗竭cd8 t细胞。
189.小鼠mc38-ova肿瘤模型—体内pd-1阻断
190.对于pd-1阻断实验,将小鼠如上所述用ova进行免疫,并在胁腹上单侧接种0.5
×
106个mc38-ova细胞。随着肿瘤变得可感知—在第5天—开始瘤内注射3mm nacl或3mm mgcl2,并且每隔三天重复一次,持续8个循环。在肿瘤植入后第9天、第12天和第15天,以在100μl ph匹配的pbs中稀释(根据制造商的建议)的每只小鼠200μg的剂量另外向小鼠腹腔注射同种型对照(igg2a)或抗pd-1抗体。所使用的抗体是:抗pd-1igg2a ab(克隆rmp1-14)或igg2a同种型对照ab(克隆2a3,均购自bioxcell)。
191.小鼠mc38-ova肿瘤模型—肿瘤浸润免疫细胞的流式细胞术分析
192.从小鼠分离出肿瘤组织,称重并使用剃刀片切碎。然后使用细胞消化液(paa)、胶原酶iv(worthington)、透明质酸酶(sigma)和dna酶iv型(sigma)于37℃在持续振荡下消化组织60min。使用细胞过滤器(70μm)过滤细胞悬液。在染色前添加精密计数珠粒(biolegend)以量化每克肿瘤的细胞数。将单细胞悬浮液用大鼠抗小鼠fcγiii/ii受体(cd16/cd32)阻断抗体(
‘
fc-block’)阻断,并用活/死细胞排斥染料染色。然后将细胞与针对细胞表面抗原的荧光团缀合的抗体一起孵育,洗涤并重悬于facs缓冲液(pbs+2% fbs)中。对于细胞内/核内抗原,在与针对细胞内抗原的抗体一起孵育之前,使用foxp3/转录因子染色缓冲液(ebioscience)固定和透化用细胞表面抗体染色的细胞。
193.限制镁饮食
194.基于纯化成分啮齿动物饮食ain-76a的限制镁饮食和匹配对照饮食购自research diets inc.(usa)。
195.小鼠ctl分化和培养
196.从自c57bl/6和lfa-1ko小鼠(雄性和雌性,6-10周,性别和年龄分布均等)收获的淋巴结和脾脏制备单细胞悬浮液。按照制造商的建议(easysep,stem cell technology),使用基于磁性珠粒的阴性选择试剂盒分离原初cd8 t细胞。在100u ml-1
的il-2(普留净)存在下。将原初t细胞(2
×
105个/孔)在5μg抗cd3 ab(板结合的)和1μg抗cd28 ab(可溶性;均来自biolegend)存在下接种2天。将细胞洗涤并以106ml-1
接种在具有500u ml-1
的il-2的圆底96孔板中的新鲜培养基中。维持0.5
‑×
106个细胞ml-1
的细胞密度以用于扩增,并且每天更换il-2。在初始活化后7-19天并且在没有il-2的情况下进行功能读出。
197.鼠ot-1细胞和人jurkat t细胞的crispr-cas9编辑
198.crrna选自来自idt的预先设计的crispr-cas9指导rna工具。产品id和序列列于补充表i中。将crrna(idt)或阴性对照crrna编号1(idt)和trrna(idt)以1:1的比率在无核酸酶双链缓冲液(idt)中以50μm的终浓度混合,于95℃退火5min并添加到40μm的cas9(qb3 macrolab,uc berkeley)中,之后在室温下孵育至少10min。根据制造商的使用说明,使用2b核转染剂(nucleofector),用小鼠t细胞核转染(nucleofector)试剂盒(lonza)转染鼠ot-1细胞。简而言之,从自ot-i小鼠(雄性和雌性,6-10周,性别和年龄分布均等)收获的淋巴结和脾脏制备单细胞悬浮液。将2
×
106个ot-i淋巴细胞重悬于100μl的核转染溶液中并与20μ
m rnp组合。应用了适当的核转染程序。将细胞在小鼠t细胞核转染培养基(lonza)中静息24h,然后在100u ml-1
的il-2(普留净)存在下,用ova
257
–
264
肽脉冲(10-9
m)的c57/bl6脾细胞活化3天。将细胞洗涤并以106ml-1
接种在具有500u ml-1
的il-2的圆底96孔板中的新鲜培养基中。通过流式细胞术验证并通过细胞分选纯化敲除效率。
199.使用amaxa细胞系v核转染试剂盒(lonza)如上所述转染jurkat t细胞。通过流式细胞术验证并通过细胞分选纯化敲除效率。将jurkat t细胞最初扩增1周,然后存储在液氮中。
200.体外活化鼠ctl
201.除非另有说明,否则在0.05μg ml-1
的平板结合的抗cd3 ab(145-2c11,biolegend)和1μg ml-1
的可溶性抗cd28 ab(37.51,biolegend)存在下在平底96孔板中以2
×
105个细胞/孔活化wt或lfa-1ko c57/bl6的ctl达8h。表面活化标志物的染色如下所述。使用nucview 488荧光半胱天冬酶-3底物评估细胞毒性。将ctv标记的ctl和cfse标记的el4靶细胞在平底96孔板中在指定浓度的pha存在下孵育4小时。在孵育的最后45min添加半胱天冬酶-3底物。收获细胞,在facs缓冲液中洗涤,并在室温下用2%的pfa轻轻固定15min。
202.用10μm的ova
257
–
264
肽(siinfekl,eurogentec)或改变的肽配体r7(siiqferl,eurogentec)、h7(siiqfehl,eurogentec)或g4(siigfekl,eurogentec)下刺激ot-i衍生的ctl达4h。
203.收获细胞并进行表面活化标志物染色。对于细胞毒性测定,在共孵育前将el4靶细胞用1μm的不同ova肽脉冲30min。用荧光半胱天冬酶-3底物(如上所述)或表达荧光素酶的el4靶细胞评估细胞毒性。向培养基中加入0.15mg ml-1
的荧光素(perkinelmer)并通过酶标仪(synergy h1,biotek)测量发光信号强度后,对细胞毒性进行量化。
204.细胞计数珠粒阵列(cba)
205.根据制造商的使用说明,使用legendplex细胞计数珠粒阵列人th1-pannel(biolegend)确定细胞培养上清液中的细胞因子浓度。
206.代谢测定
207.使用seahorse xf-96e细胞外通量分析仪(seahorse bioscience,agilent)确定细胞的代谢概况。将t细胞(2
×
105个细胞/孔)接种到celltak(corning,usa)包被的细胞板上。在无缓冲、无血清和无mg
2+
的自制培养基中进行实验。将培养基用
±
1.2mm的mgcl2重构。mg
2+
的重构从实验开始就存在,或者是经由仪器的多注入端口施加到接种细胞上的。所有以下浓度代表所指示物质的最终孔浓度。通过注射抗cd3 ab(1μg ml-1
)或抗cd3 ab(1μg ml-1
)和抗cd28 ab(10μg ml-1
)来活化人t细胞。在某些实验(如所示)中,抗cd3/cd28抗体与附加注射的山羊抗小鼠二抗(5μg ml-1
,thermo fisher)交联。通过注射抗cd3 ab(5μg ml-1
)和抗cd28ab(2.5μg ml-1
)来活化小鼠t细胞。
208.钙通量测定
209.使jurkat t细胞于37℃在不含mg
2+
的自制培养基中加载终浓度为2μm的fluo4(invitrogen)达30min。将细胞洗涤两次并以2
×
105个/孔接种在黑色平底96孔板(greiner bio one)中,该96孔板已用胶原蛋白(thermo fisher)预包被以增强细胞附着。于37℃附加孵育15min使细胞粘附并使fluo4探针完全去酯化。用10μgml-1
的抗cd3刺激jurkat t细胞。使用tecan spark m10酶标仪测量随时间推移的荧光强度。将样品以技术重复运行,并将荧
光信号强度的平均值归一化为未刺激的基线值。
210.与博纳吐单抗的共培养测定
211.博纳吐单抗(amgen)来源于输注的剩余物。人pha母细胞与ramos靶细胞一起在平底96孔板中以0.5:1的比率(6.5
×
104个pha母细胞和1.3
×
105个ramos细胞)在指定博纳吐单抗浓度下孵育。为了区分不同的细胞群体,将pha母细胞49用ctv标记,并将t2靶细胞用cftr invitrogen标记。对于所有共孵育实验,使细胞在不离心的情况下沉降。为了量化lfa-1构象,将m24直接添加到细胞培养基中并孵育10min,之后在冰上孵育30min,然后洗涤并随后用2% pfa固定。在3.5h后如上所述用cellevent半胱天冬酶-3/7绿色检测试剂(invitrogen,thermo fisher)量化细胞毒性。在孵育的最后45min以2μm的终浓度添加半胱天冬酶底物。收获细胞,在facs缓冲液中洗涤,并在facs分析前用2%的pfa在室温下固定15min。
212.抗cd19 car t细胞的重组慢病毒生产
213.在转染前24h,接种hek-293t细胞(3.8
×
106个细胞10ml-1
培养基)。使用无内毒素的质粒maxiprep试剂盒(sigma)纯化所有质粒dna。使用脂质转染胺2000(invitrogen)和optimem培养基(invitrogen、life technologies),用1.3pmol的pspax2(慢病毒包装质粒)、0.72pmol的pmd2g(vsv-g包膜表达质粒)和1.64pmol的pcar-cd19car-p2a-egfp(creative biogene)转染hek-293t细胞。在转导后48h收集病毒上清液。使用peg沉淀浓缩病毒粒子,并在-80℃存储。
214.用于抗cd19 car t细胞生成的原代人t细胞转导
215.血液样品(塞尔大学医院的血液供体中心)是在书面知情同意后从健康供体获得的。通过标准密度梯度离心方案(lymphoprep;fresenius kabi)分离pbmc。使用磁性cd4
+
和cd8
+
珠粒(miltenyi biotec)阳性选择cd4
+
和cd8
+
t细胞。将纯化的cd4
+
和cd8
+
t细胞在r10ab中培养。将cd4
+
和cd8
+
t细胞接种到24孔细胞培养板中,并用抗cd3和抗cd28单克隆抗体包被的珠粒(miltenyj,t细胞活化和扩增试剂盒)以1:1的比率在含有il-2(150u ml-1
)的培养基中进行刺激。在含有聚凝胺(6μg ml-1
,millipore)的培养基中活化后18-22h,用慢病毒粒子转导t细胞。每隔一天用新鲜的il-2(150u ml-1
)更换培养基。在转导后五天,对gfp
+
细胞进行分选以富集cd19-car
+
细胞,并从未转导的细胞中去除磁性珠粒。在靶细胞杀伤测定之前,将细胞在含有il-2(150u ml-1
)的培养基中进一步扩增3天。
216.使用抗cd19 car t细胞进行细胞毒性测定
217.将cd8
+
抗cd19 car t细胞与ramos靶细胞一起以0.1-0.33:1的比率(0.5-1.5
×
104个car t细胞和5
×
104个ramos靶细胞)孵育。ramos细胞在共孵育前已用cftr标记。使细胞在平底96孔板中在没有离心的情况下沉降,并孵育3h。使用biotracker nucview 405蓝色半胱天冬酶-3染料(sigma-aldrich)通过流式细胞术量化细胞毒性。
218.用于抗psma car t细胞的重组慢病毒生产
219.产生高滴度复制缺陷型慢病毒并通过超速离心浓缩以用于原代t细胞转导。简而言之,在转染前24h,将hek-293细胞以10
×
106接种在t-150组织培养瓶中的30ml培养基中。使用无内毒素的maxiprep试剂盒(invitrogen,life technologies)纯化所有质粒dna。使用turbofect(thermo fisher)和optimem培养基(invitrogen,life technologies,180μl的turbo fect用于3ml的optimem)的混合物,用7μg pvsv-g(vsv糖蛋白表达质粒)、18μg的
r874(rev和gag/pol表达质粒)和15μg的pelns转基因质粒转染hek-293t细胞。转染后48小时收集病毒上清液。将病毒粒子通过以24,000x g超速离心2h浓缩,并重悬于400μl培养基中,之后立即在干冰上快速冷冻。
220.用于抗psma car t细胞生成的原代人t细胞转导
221.原代人t细胞是从健康供体的外周血单核细胞中分离出的(hd;制备为血沉棕黄层或单采术过滤器)。所有血样均在健康供体的知情同意下收集,并在获得瑞士沃州(canton of vaud,switzerland)伦理批准的情况下进行遗传工程化。使用标准离心方案,经由lymphoprep(axonlab)分离溶液获得pbmc。按照制造商的建议(easysep,stem cell technology),使用基于磁性珠粒的阴性选择试剂盒分离cd4和cd8
+
t细胞。将纯化的cd4和cd8
+
t细胞以1:1的比率培养,并用1:2的t细胞与珠粒比率的抗cd3和抗cd28ab包被的珠粒(invitrogen,life technologies)刺激。将t细胞在活化后18-22h用慢病毒粒子转导。人重组il-2(h-il-2;glaxo)每隔一天补足至50iu ml-1
的浓度,直到刺激后5天(第+5天)。在第+5天,去除磁性珠粒,并向培养物中添加10ng ml-1
的h-il-7和h-il-15(miltenyi biotec)以代替h-il-2。维持0.5-1
×
106个细胞ml-1
的细胞密度以用于扩增。在所有功能测定之前,调整静息工程化t细胞以实现等效转基因表达。
222.用抗psma car t细胞进行细胞毒性测定
223.使用incucyte仪器(essen bioscience)执行细胞毒性测定。简而言之,将1.25
×
104个pc3-pip靶细胞接种在平底96孔板(costar,vitaris)中。4小时后,将静息t细胞(48h内不添加细胞因子)洗涤,并以2.5
×
104/孔、以2:1的效应物与靶标比率接种于补充有10%dfcs和
±
0.6mm mgcl2的自制培养基中。在共培养时段期间不添加外源细胞因子。以在200μl总体积中5μm的终浓度添加incucyte半胱天冬酶-3/7(essen bioscience)。将内部实验性阴性对照包含在所有测定中,包括在incucyte半胱天冬酶-3/7试剂存在下共孵育未转导的(utd)-t细胞和肿瘤细胞,以监测随时间推移的自发性细胞死亡。作为阳性对照,用1%triton溶液处理单独的肿瘤细胞,以评估测定中的最大杀伤力。每共培养2h收集每孔的总绿色面积的图像。通过在由essen bioscience提供的incucyte zoom软件上使用相同的分析方案获得每孔的总绿色面积。细胞毒性被报告为通过在死靶细胞中掺入细胞毒性绿色试剂驱动的荧光曲线下的总面积(每μm2的绿色面积)。通过从所有其他时间点减去在时间零(在car t细胞杀伤任何细胞之前)观察到的背景荧光,对所有数据进行归一化。
224.抗psma car t细胞的细胞因子释放测定
225.通过在96孔圆底平板中一式两份地在终体积为200μl的补充有10%dfcs和0.6mm mgcl2或不补充mg
2+
的自制培养基中进行每孔5
×
104个t细胞与5
×
104个靶细胞的共培养来进行细胞因子释放测定。24h后,收集共培养上清液,并根据制造商的方案(biolegend)通过商业酶联免疫吸附测定试剂盒测试ifn-γ的存在。
226.抗psma car t细胞体内实验
227.10-12周的雄性nsg小鼠在肿瘤注射前5天接受mg
2+
限制或匹配对照饮食,并在整个实验过程中保持相应的饮食。皮下注射5
×
106个pc3-pip肿瘤细胞。在5天后,静脉过继转移生理盐水或2
×
106个t细胞的静脉注射(utd或car t细胞)。每周两次监测肿瘤体积。每天监测动物并且每隔一天用卡尺测量肿瘤。使用公式v=1/2(长度
×
宽度2)计算肿瘤体积,其中长度是最大纵向直径,并且宽度是经由卡尺测量确定的最大横向直径。
228.流式细胞术
229.为了分析表面标志物,在指定时间点收获t细胞,在冷pbs中洗涤一次,并且如果需要的话于4℃用可固定活力染料染色15min。将表面标志物于4℃用适当的抗体染色20min。
230.为了评估活化诱导的lfa-1头段打开,将t细胞活化45min,并将抗人cd11a/cd18(克隆m24)直接添加到培养基中并在冰上孵育20min。然后将细胞在facs缓冲液中洗涤两次并在2% pfa中固定,在室温下孵育20min并在采集前用facs缓冲液洗涤。
231.对于lfa-1构象的附加量化,还将m24、kim127或ts2/4mab直接添加到细胞培养基中于37℃达10min,然后在冰上30min,然后洗涤并随后用2% pfa固定。对于用hi111染色,将细胞活化45min,用2% pfa固定,随后用hi111染色,并在采集前用facs缓冲液洗涤。
232.对于细胞内tnf染色,如所示将细胞活化4h。在活化的最后2h期间,用布雷菲德菌素a溶液(biolegend)处理细胞以阻断细胞因子分泌。然后降细胞在室温下洗涤并固定20min(固定/透化溶液,bd biosciences),并在染色前用透化缓冲液(bd biosciences)洗涤45min,并在采集前进一步洗涤。为了分析蛋白质磷酸化,将t细胞按指示进行刺激,并通过将8%多聚甲醛(pfa)(thermo fisher)直接添加到培养基中以获得4% pfa的终浓度来固定。将细胞在室温下孵育15min,用facs缓冲液洗涤,之后用4℃的冰冷甲醇透化5min。在用facs缓冲液洗涤后,将细胞在室温下染色30min,洗涤并采集。
233.使用bd fortessa lsr ii(bd bioscience)或cytoflex s(beckmann)流式细胞仪进行流式细胞术
234.使用以下抗体进行染色:
235.mc38-ova肿瘤模型:
236.cd3(buv805,bd biosciences)、cd4(buv496,bd biosciences)、cd8(efluor450,ebiosciences)、cd11b(apc-cy7,biolegend)、cd11c(fitc,biolegend)、cd19(bb515,bd biosciences)、cd25(pe-cy5.5,ebioscience)、cd45(buv385,bd biosciences)、cd80(bv605,biolegend)、cd103(bv650,bd biosciences)、cd206(bv711,biolegend)、cxcr3(buv737,bd biosciences)、f4/80(af647,biolegend)、foxp3(apc,ebioscience)、gzmb(pe-efluor610,inivtrogen)、ki67(af532,ebioscience)、lfa-1(sb436,thermofisher)、ly-6g(buv563,bd biosciences)、ly-6c(percp,biolegend)、mhcii(bv510,biolegend)、nkp46(buv563,bd biosciences)、pd-1(bv785,biolegend)、pd-l1(bv421,biolegend)、tcf-7(af700,r&d systems)、tim-3(bb700,bd biosciences)、zombie uv可固定活力试剂盒(biolegend)鼠腹膜炎模型:cd8(fitc,biolegend)、cd11b(pe-cy5,biolegend)、cd11c(pe-cy5,biolegend)、cd69(apc,biolegend)、cd107a(pe/cy7,biolegend)、b220(pe-cy5,biolegend)、f4/80(pe-cy5,biolegend)、tetramer h-2kb ova(pe,tetramers core facility,university of lausanne)、活力染料(zombie red,biolegend,)
237.小鼠体外活化:
238.cd11a(fitc和bv421,biolegend)、lfa-1(bv421,biolegend)、cd8(fitc,biolegend)、cd69(apc,biolegend)、cd107a(pe-cy7,biolegend)、活力染料(aqua zombie,biolegend)
239.人t细胞体外活化
240.cd11a(fitc或未标记的,biolegend)、cd18(pe或未标记的,biolegend)、cd18(未
标记的,invivo biotech services gmbh)、cd25(apc,bd)、cd45ra(太平洋蓝,beckmann)、cd62l(apc,immuno tools)、cd69(percp,biolegend)、cd71(pe,biolegend)、cd107a(af647 bd和pe-cy7 biolegend)、cd98(fitc,bd bioscience)、m24表位lfa-1(pe biolegend)、tcr vbeta13.1(fitc和pe-cy7,biolegend)、tnf(pe,biolegend)、磷酸-fak(tyr397,未标记的,thermo fisher)、活性染料(aqua zombie,biolegend;zombie green,biolegend)、二级山羊抗小鼠af488(thermofisher)
241.化学品
242.使用50μm的birt377(tocris)执行lfa-1抑制剂研究。所有化学品均在dmso中等分并于-20℃存储。
243.统计分析
244.使用prism 8.0(graphpad软件,usa)分析统计显著性。小于0.05的p值被认为是统计学上显著的。
245.crrna序列
246.设计id物种位置链序列pam
247.hs.cas9.itgal.1.aa人30475350-tgcccgactggcactgatagaggmm.cas9.itgal.1.ab小鼠127302137-cacatagttgatggcacgaaagg
248.实施例1:瘤内镁注射改善记忆cd8 t细胞介导的抗肿瘤免疫
249.cd8 t细胞对于抗肿瘤免疫至关重要。为了探索mg
2+
在肿瘤微环境中的作用,特别是其对t细胞免疫的功能影响,我们检查了瘤内(鞘内注射)mg
2+
施用在mc38-ova肿瘤模型中的效应。具体地,在胁腹双侧皮下植入表达ova的mc38结直肠癌细胞之前,将小鼠针对卵清蛋白(ova)进行免疫,或者不进行处理。从第7天开始,将右侧肿瘤反复注射3mm mgcl2,并且左侧对照肿瘤接受3mm nacl溶液(图1a,实验方案)。虽然在未免疫的小鼠中mgcl2和nacl处理之间的肿瘤生长相当,但是瘤内mgcl2施用显著减少了预免疫的小鼠中的肿瘤生长,表明增加瘤内mg
2+
浓度增强了特异性记忆t细胞介导的抗肿瘤免疫(图1b)。ova免疫诱导ova特异性记忆t细胞,包括在肿瘤排斥中起关键作用的记忆cd8
+
t细胞。并且cd8耗竭实验证实mg
2+
经由cd8
+
t细胞发挥其效应(图1c)。因此,我们试图进一步定义鞘内注射mg
2+
是如何影响记忆cd8
+
t细胞隔室的。使用流式细胞术,我们对肿瘤浸润性免疫细胞进行了计数和分型。需注意,在经mg
2+
处理的组中肿瘤浸润性cd8
+
t细胞的数量增加(图1d)。与其增加的数量一致,更多经mg
2+
处理的cd8
+
t细胞表达ki67(图1e,左小图)。此外,更多暴露于mg
2+
的cd8
+
t细胞含有颗粒酶b并表达活化标志物cd25(图1e,中间小图和右小图)。进一步反映增加的活化,pd-1和tim3在经mg
2+
处理的cd8+t细胞上也显著更经常(共)表达(图1f)。
250.接下来,我们检查了mgcl2处理与pd1阻断的组合是否可以协同地提高记忆cd8
+
t细胞的肿瘤抑制能力(图1g,实验方案)。与其他治疗方案相比,接受瘤内mgcl2与pd-1阻断的组合的小鼠在控制肿瘤生长方面明显更优,其中单独的mgcl2显著改善免疫控制(图1h)。虽然与经nacl处理的对照组相比,单独的瘤内mgcl2施加导致了显著提高的动物存活率,但将mgcl2与pd1阻断组合导致了附加的存活率益处(图1i)。
251.综上所述,我们的数据表明,瘤内mg
2+
施加增强了记忆cd8 t细胞的抗肿瘤活性,并
且增加瘤内mg
2+
浓度与pd-1阻断协同作用,导致了改善的肿瘤抑制。所有这些实验都将mg
2+
鉴定为记忆cd8
+
t细胞依赖性肿瘤控制的重要调节剂
252.实施例2:细胞外镁经由lfa-1稳定化使得能够进行lfa-1
高
t细胞的t细胞活化
253.为了确定在mg
2+
限制条件下观察到的记忆细胞特异性活化缺陷是否可以在体外重现,我们用原代人效应记忆(em)和原初cd8 t细胞执行了代谢通量分析。这种方法允许实时监测t细胞活化,因为t细胞在活化时表现出需氧糖酵解的立即上调—被称为
‘
糖酵解切换’—使t细胞能够获得效应物能力,例如快速产生ifnγ(gubser pm,bantug gr,razik l等人,rapid effector function of memory cd8
+
t cells requires an immediate-early glycolytic switch.nat immunol.2013;14(10):1064-1072.doi:10.1038/ni.2687)。糖酵解通量曲线分析表明,在没有mg
2+
的情况下,em cd8 t细胞的糖酵解切换会被钝化。值得注意的是,活化缺陷与通过cd28进行共刺激无关,并且在活化前立即反加mg
2+
后可完全恢复(图2a)。相比之下,在没有mg
2+
的情况下,原初cd8 t细胞没有显示出受损的活化诱导的糖酵解上调(图2b)。这些数据表明:(i)在mg
2+
限制条件下的记忆t细胞特异性损伤—如在先前的体内实验中发现的—可以在体外再现;(ii)细胞外mg
2+
的缺乏影响em cd8 t细胞中的近端tcr信号传导,这继而阻碍糖酵解切换;和(iii)em cd8 t细胞的钝化的糖酵解切换可以在活化前不久通过mg
2+
反加完全逆转,这反抗了由于mg
2+
缺乏条件导致的不可逆细胞损伤。接下来,我们评定了在中等tcr刺激(板结合的抗cd3和可溶性抗cd28 ab)24h后em cd8 t细胞上的表面活化的表达。在没有mg
2+
的情况下,em cd8t细胞无法上调t细胞活化标志物,例如早期和晚期活化(分别为cd69和cd25);代谢重编程(cd71、cd98)和去颗粒作用(cd107a)的指标(图2c)。对来自这些相同测定孔的细胞因子分泌的测量揭示了在mg
2+
限制条件下ifnγ、tnf和il-2的产生减少(图2d)。对人原初和em cd8 t细胞以及pha母细胞的cd11a表面表达的分析表明,与em cd8 t细胞或pha母细胞相比,原初cd8 t细胞的cd11a表面表达显著降低。另一方面,pha母细胞表现出最高的cd11a表达水平(图2e)。已知lfa-1具有3种构象状态:具有封闭头段的弯曲构象、具有封闭头段的延伸构象和具有开放头段的延伸构象,所述构象分别对应于低、中和高亲和力状态(zhang k,chen j.the regulation of integrin function by divalent cations.cell adh migr.2012;6(1):20-29)。在静息t细胞上,lfa-1主要处于其非活性/弯曲构象,并且响应于tcr刺激,lfa-1从低亲和力状态转换为高亲和力状态。这种转化由金属离子依赖性粘附位点(metal-ion dependent adhesion site,midas)协调,该midas以高亲和力结合mg
2+
。因此,记忆cd8 t细胞是mg
2+
依赖性的,而原初cd8 t细胞的活化似乎与mg
2+
无关的观察结果,与给出的t细胞亚群上的差异lfa-1表达模式一致,使lfa-1
高
更mg
2+
依赖性。mab ts2/4绘制了cd11a上的表位,该表位仅存在于装配的cd11a/cd18异二聚体中。ts2/4表位的丰度不依赖于细胞外mg
2+
浓度以及t细胞活化状态(图2f)。mab hi111报告了非活性/弯曲的lfa-1构象(图2g)。在不断降低的细胞外mg
2+
浓度下,pha t母细胞在tcr刺激时表现出更高水平的非活性lfa-1。kim127与cd18上的表位结合,该表位隐藏在弯曲的、非活性的整合素中并在整合素延伸时暴露。我们观察到随着细胞外mg
2+
浓度的不断增加,在t细胞活化时剂量依赖性kim127信号增加(图2h)。lfa-1的延伸/开放高亲和力构象可以通过使用m24抗体进行量化,例如通过流式细胞术。与由kim127报告的lfa-1延伸一致,头段开放也强烈依赖于细胞外mg
2+
浓度(图2i)。lfa-1活化和随后的由外向内信号传导导致粘着斑激酶(fak)磷酸化。为了探索与mg
2+
可用性有关的这种
早期lfa-1下游信号,我们评定了活化t母细胞中的fak磷酸化。与mg
2+
限制条件下的lfa-1延伸减少以及头段开放一致,fak磷酸化也减少(图2j)。此外,对活化诱导的细胞因子产生的评定显示了类似的对细胞外mg
2+
浓度的剂量依赖性模式(图2k)。在mg
2+
限制条件下em cd8 t细胞表现出减少的活化诱导的lfa-1头段开放,而在任何一种条件下,中等的tcr刺激都不诱导原初cd8 t细胞上的lfa-1头段开放(图2l)。此外,使用变构lfa-1抑制剂birt377,将lfa-1稳定化在其肥活性的封闭构象中,防止了在mg
2+
存在下活化诱导的lfa-1头段开放(图2o)。值得注意的是,在未刺激的t细胞中,lfa-1活化在
±
mg
2+
之间没有差异(数据未显示)。在t细胞活化过程中抑制lfa-1延伸和头段开放导致糖酵解切换受损(图2p)以及去颗粒作用减少(图2q)。
254.总的来说,这些数据表明,由mg
2+
与midas的结合介导的弯曲lfa-1和随后的延伸以及头段开放的丰度的降低,对于lfa-1
高
细胞的活化是至关重要的。细胞外环境中mg
2+
的缺乏,或lfa-1在弯曲/低亲和力构象中的药理学强制稳定化导致了钝化的t细胞活化。因此,我们得出的结论是lfa-1
高
t细胞的活化需要具有中等lfa-1稳定性质的介体。
255.实施例3:镁经由适度调节lfa-1稳定化来调节细胞毒性t细胞活性—强lfa-1稳定化会超驰控制镁-lfa-1轴
256.为了阐明细胞外mg
2+
是否经由lfa-1介导其t细胞调节活性,我们通过使用lfa-1-缺陷型(lfa-1-/-)t细胞进行实验来进行我们的假设遗传验证。根据我们之前的发现,lfa-1-/-t细胞的活化预计不会因细胞外mg
2+
浓度而不变。在第一次尝试中,我们通过代谢通量分析监测活化诱导的糖酵解切换。虽然野生型(wt)细胞毒性淋巴细胞(ctl)在mg
2+
耗竭条件下表现出减少的糖酵解切换,但是lfa-1-/-ctl的活化导致需氧糖酵解的上调减少,这实际上不依赖于细胞外mg
2+
浓度(图3a)。除了需氧糖酵解的上调外,tcr刺激还会导致细胞外钙(ca
2+
)快速流入。细胞溶质ca
2+
是关键的第二信使,并且是完全t细胞活化所必需的。与代谢通量分析一致,细胞外mg
2+
浓度的耗竭导致wt jurkat t细胞中ca
2+
流入减少,与此同时lfa-1-/-jurkat t的ca
2+
流入减少。同样,这种减少与细胞外mg
2+
浓度无关(图3b)。由于细胞外mg
2+
耗竭或基因缺失导致的lfa-1功能性的缺乏,减少了即时ca
2+
流入,但更明显地导致了延长、持续的ca
2+
流入的缺乏。持续的ca
2+
流入是完全t细胞活化所必需的,并且据报道由线粒体向免疫突触的转位介导,在免疫突触中所述线粒体局部缓冲高ca
2+
浓度并由此延长膜ca
2+
通道的打开(quintana,a.,schwindling,c.,wenning,a.s.,becherer,u.,rettig,j.,schwarz,e.c.,&hoth,m.(2007).t cell activation requires mitochondrial translocation to the immunological synapse.proceedings of the national academy of sciences,104(36),14418-14423)。因此,我们得出的结论是,细胞外mg
2+
—作为具有中等lfa-1稳定化性质的lfa-1介质—在免疫突触处策划多分子信号传导复合物的装配并由此对t细胞活化进行塑形。我们接下来评定中等lfa-1稳定化对细胞毒性t细胞活性的重要性。因此,我们活化wt和lfa-1-/-ctl,并通过流式细胞术评估去颗粒作用。通过mg
2+
限制或用birt377进行药物抑制来抑制wt ctl中的lfa-1功能性导致ctl去颗粒作用减少。另一方面,lfa-1-/-ctl中的细胞毒性颗粒释放不受此类lfa-1调节的影响(图3c)。此外,当lfa-1功能性被阻断时,如通过凋亡靶细胞的频率评定的wt ctl的细胞毒性降低(图3d)。lfa-1-/-ctl不仅表现出与wt ctl相比显著降低的细胞毒性潜力,而且它们对lfa-1调节也没有反应。
257.为了产生足够数量的肿瘤特异性t细胞供患者施用,可以使用快速扩增方案(rapid expansion protocol,rep)。rep t细胞表现出高lfa-1表面表达(图3e)。我们将rep t细胞与同源肽脉冲的肿瘤靶细胞共培养并评估lfa-1构象。我们观察到在细胞外mg
2+
存在下非活性的弯曲构象的丰度降低(图3f),这表明lfa-1在活化时更有活性。与这一发现一致,具有开放头段(图3h)的延伸lfa-1(图3g)显著增加。此外,在细胞外mg
2+
和随后的去颗粒作用(图3f)和细胞毒性(图3g)存在下,fak磷酸化显著增加。通过mg
2+
限制或birt377施加进行的lfa-1抑制导致去颗粒作用或靶细胞杀伤减少(图3fk)。cd3/cd19双特异性抗体博纳吐单抗接合t细胞以结合并消除cd19阳性细胞的使用,已改善了b细胞恶性肿瘤的临床结局。鉴于其作用方式,我们旨在测试mg
2+
对博纳吐单抗功效的影响。博纳吐单抗介导的细胞毒性,在其报道的治疗范围(230-620pg ml-1
)中,强烈依赖于mg
2+
的可用性(图3l),而lfa-1头段开放也是mg
2+
依赖性的。
258.作者发现嵌合抗原受体(car)t细胞(另一种基于细胞的过继免疫疗法)的细胞毒活性也表现出lfa-1的高表面表达(图3n)并且也依赖于细胞外mg
2+
。延时杀伤测定揭露,mg
2+
限制在体外损害car t细胞对肿瘤靶细胞的溶胞活性(图3o,并且同时减少了炎症ifnγ释放(图3p)。为了探究经由饮食限制减少全身mg
2+
是否会影响体内car t细胞介导的细胞毒性,执行肿瘤排斥实验。事实上,饮食mg
2+
限制足以在体内对car t细胞介导的肿瘤排斥产生负面影响(图3q)。这些实验强调了新颖的基于细胞的过继免疫疗法的功效依赖于中等lfa-1稳定化—如由细胞外mg
2+
介导的—并强调了mg
2+
状态评定对接受此类疗法的患者的重要性。
259.值得注意的是,在通过注射与靶向cd3/28的mab交联的二抗抗体实现的超生理活化的情况下,em cd8
+
t细胞对mg
2+
的敏感性丧失(图4a)。与此一致,通过增加抗cd3抗体的浓度来增加tcr刺激的强度导致pha t母细胞对细胞外mg
2+
的依赖性更不明显(图4b),表明mg
2+
在中等/生理刺激的情况下微调lfa-1
高
t细胞的活化。使用ova变体肽(对ot-i的亲和力:g4《h7《r7),mg
2+
—lfa-1系统在调节特异性靶细胞裂解中的重要性跨一系列tcr亲和力得到了证实(图4c)。这些数据进一步证实细胞裂解需要mg 2+
—lfa-1调节功能。通过使用多克隆wt和lfa-1-/-ctl进行体外细胞毒性测定进一步证实了这一点:虽然低pha浓度(1μgml-1
)在任何一种情况下均未导致细胞毒活性,但是中等pha浓度(10μg ml-1
)在wt ctl中表现出mg
2+
依赖性效应,而lfa-1-/-ctl表现出与wt ctl相比受损的细胞毒性能力。有趣的是,高pha浓度(100μg ml-1
)平衡了
±
细胞外mg
2+
与lfa-1基因型之间的差异,导致整体高细胞溶解效应物功能(图4d)。此外,使用lfa-1活化单克隆抗体使rep t细胞独立于细胞外mg
2+
浓度,但代价是非特异性细胞毒性(图4e)。
260.这些结果表明(i)细胞外mg
2+
经由其中等lfa-1稳定化性质放大了对lfa-1
高
t细胞的低到中等tcr刺激,导致与lfa-1-/-t细胞相比更好的t细胞活化和随后的细胞毒性效应物功能;(ii)使用强lfa-1稳定剂,例如抗体,导致了非特异性靶细胞杀伤。因此,中等lfa-1稳定化—由例如mg
2+
介导—对于生理性t细胞活化是必不可少的,并且可以直接为新颖的治疗策略提供信息。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1