一种酶制剂及其制备方法和用途
1.本发明涉及一种酶制剂包埋材料,更具体地说涉及一种新型双层微胶囊形式的酶制剂及其制备方法和用途。
背景技术:
2.酶制剂是一类无毒、绿色的生物活性物质,具有催化分解、改善肠道环境、促进营养物质消化吸收、清除自由基和保护肠道上皮细胞等功能,然而,酶易受到重金属离子、ph、表面活性剂和温度等因素影响而活性降低甚至失活。如何防止酶在食品或饲料加工中失活具有重要的意义。
3.壳聚糖是几丁质经脱乙酰后得到的生物聚合物,具有无毒、生物相容性、生物降解性、丰富的羟基和氨基和来源广泛等优点,已在酶制剂包埋领域得到广泛应用。经专利局查询中国专利公开号:cn101664111b公开一种用于饲料中的以壳聚糖和三聚磷酸钠(tpp)为原料形成的壳聚糖纳米粒子包埋α
‑ꢀ
半乳糖苷酶的制备方法;cn113388169a公开一种用壳聚糖、甘油、蒙脱石、 tween-80、耐高温溶菌酶和铜陵白姜精油制备食品用耐高温复合保鲜膜的方法;cn113061595a公开一种以环氧基修饰的磁性壳聚糖纳米粒子为载体的固定化磷脂酶c的方法;cn113652415a公开一种将壳聚糖附着在鸡蛋壳膜的表面并通过共沉淀的方式将磁性fe3o4均匀沉淀分布在蛋壳膜上,制备出磁性 fe3o4/cs/esmp作为固定化β-葡萄糖苷酶的酶载体;cn107699558b公开一种以壳聚糖和海藻酸钠为基材的双层固定化酶的方法。然而,现有技术公开的以壳聚糖为壁材包埋酶制剂的方法大部分为单层包埋,释放速度快,在胃肠道中不能实现持续释放,如壳聚糖纳米粒子包埋酶制剂产量低不利于工业化生产。
4.纳晶纤维素(cnc)是经硫酸水解或酶水解纤维素得到的一种刚性棒状粒子,具有来源广泛、尺寸小、比表面积大、成本低、无毒、生物可降解和生物相容性等优点,cnc已经被广泛应用生物医药、农业、食品、化妆品等方面。经国家知识产权局查询所公开的以cnc为壁材包埋酶制剂的专利较少,但是有cnc稳定酶制剂的文章,如deng(food research international,2020, 137,109380)等报道了一种cnc与壳聚糖纳米粒子结合包埋β-半乳糖苷酶以提高该种酶的稳定性以及延长体外释放时间;zhang(international journal ofbiological macromolecules,2021,191,71-78)等以cnc为功能交联剂,以 pickering乳化剂,通过离子凝胶法稳定季铵盐壳聚糖纳米颗粒包埋的溶菌酶。 zhang(carbohydrate polymers,2020,236,115974)等报道了一种将cnc添加到溶菌酶装载的β-壳聚糖纳米粒子中,以增强其抗菌稳定性的制备方法。现有技术的缺点是:(1)cnc是在溶液中稳定酶装载的壳聚糖纳米粒子,难以量化生产;(2)cnc稳定的纳米粒子溶液贮藏时间短(低于2个月)。
技术实现要素:
5.针对现有技术中存在的上述缺陷,本发明一方面的目的是提供一种双层微胶囊包埋酶制剂,为实现本发明的目的,本发明的采用以下技术方案:
6.一种酶制剂,其包括:
7.芯材,其包括壳聚糖纳米粒子和酶,
8.第一层壁材,其包括海藻酸钠和海藻糖,
9.第二层壁材,其包括纳晶纤维素,
10.其中第一层壁材包覆在芯材表面上,第二层壁材包覆在第一层壁材表面上。
11.优选地,上述酶选自葡萄糖氧化酶、木聚糖酶、植酸酶、蛋白酶、脂肪酶和淀粉酶中的一种或多种。
12.更优选地,上述酶选自葡萄糖氧化酶和/或木聚糖酶和/植酸酶。
13.优选地,所述壳聚糖与所述酶与的质量比为1~5:0.2~0.5。
14.优选地,海藻酸钠和海藻糖的质量比为10~20:0.1~1。
15.更优选地,海藻酸钠和海藻糖的质量比为10~20:1。
16.更优选地,海藻酸钠和海藻糖的质量比为15:1。
17.优选地,上述纳晶纤维素的制备方法包括以下步骤:
18.(1)将微晶纤维素分散于质量分数为50~75%硫酸中,40~60℃强烈机械搅拌8~12h,用4~12倍水稀释反应混合物,使水解反应淬灭;
19.(2)向步骤(1)中的淬灭的反应混合物,加入质量分数为20~40%的 h2o2水溶液反应20~40min后,通过离心分离结晶物;
20.(3)将结晶物加入水中,用超声波洗涤,离心,以去除多余的酸,然后进行透析(截留分子量14000kda),冻干,制备得到纳晶纤维素。
21.优选地,纳晶纤维素的制备方法中步骤(1)中,硫酸的用量为1g微晶纤维素利用1~12ml硫酸分散。
22.优选地,纳晶纤维素的制备方法中步骤(2)中,h2o2水溶液的用量为 1g微晶纤维素利用0.3~2mlh2o2水溶液氧化。
23.本发明另一方面的目的是提供上述酶制剂的制备方法,该制备方法包括以下步骤:
24.(1)芯材的制备:将酶加入到壳聚糖溶液中,加入三聚磷酸钠,壳聚糖和三聚磷酸根离子之间通过离子交联形成载酶的壳聚糖纳米粒子;
25.(2)第一层壁材的包覆:将cacl2溶液加入到步骤(1)的最终溶液中,混匀,再加入海藻酸钠和海藻糖的混合溶液,海藻酸钠和海藻糖吸附在壳聚糖纳米粒子表面并固化形成第一层壁材,过滤得到单层微胶囊形式的酶制剂;
26.(3)第二层壁材的包覆:将单层微胶囊形式的酶制剂加入到纳晶纤维素溶液中,纳晶纤维素吸附在第一层壁材表面形成第二层壁材,过滤得到双层微胶囊形式的酶制剂。
27.优选地,上述步骤(1)芯材的制备包括:将壳聚糖溶解于质量浓度为 0.5~4%的乙酸溶液中,充分溶解后,得到质量浓度为1~10mg/ml的壳聚糖的溶液,用naoh溶液调整ph到5.0~6.0后,向其中加入酶,充分溶解后,离心,取上清液,将浓度为0.10~0.50mg/ml的三聚磷酸钠溶液与上清液按照体积比为2~8:1混合,100~200rpm搅拌获得装载酶的壳聚糖纳米粒子的溶液。更优选地,所用乙酸的质量浓度为1~3%,最优选2%。更优选地,壳聚糖的溶液的质量浓度为2~3mg/ml,最优选2.5mg/ml。优选地,壳聚糖充分溶解于乙酸溶液所用的方法为:先将加入壳聚糖的乙酸溶液搅拌10~30h,然后超声2~40min。
28.优选地,步骤(2)第一层壁材的包覆包括:将cacl2溶液加入到所述装载酶的壳聚糖纳米粒子的溶液中,混匀后,ca
2+
的最终摩尔浓度为0.5~2mol/l,向其中滴加海藻酸钠和海藻糖的混合溶液,其中固化20~40min,过滤得到单层微胶囊形式的酶制剂,其中海藻酸钠和海藻糖的混合溶液中,海藻酸钠与海藻糖的质量比为10~20:0.1~1,海藻酸钠的质量浓度为5%~30%,海藻糖的质量浓度为0.5%~4%,并且其中海藻酸钠和海藻糖的混合溶液与含ca
2+
的溶液的体积比为1~5:1。
29.优选地,步骤(3)第二层壁材的包覆包括将所述单层微胶囊形式的酶制剂加入到质量浓度为0.05~5%的纳晶纤维素溶液中,轻轻搅拌0.5~2h,过滤得到双层微胶囊形式的酶制剂。更优选地,纳晶纤维素溶液的浓度为 0.1%~1%。优选地,纳晶纤维素溶液的用量为1g步骤(2)制得的包覆第一层壁的微胶囊加入到20~100ml的纳晶纤维素溶液中。
30.紫外可见光光谱图表明酶(木聚糖酶和葡萄糖氧化酶1:1混合)成功地被包埋到本发明的微胶囊形式的酶制剂中。酶的浓度为35mg/ml时,仅仅用海藻酸钠和海藻糖包覆芯材形成的单层微胶囊形式的酶制剂中,木聚糖酶和葡萄糖氧化酶的包埋率分别为83.34%和87.16%,继续分别使用质量浓度为 0.1%、0.5%和1%的cnc包覆,形成的双层微胶囊形式的酶制剂中,木聚糖酶的包埋率分别为85.92%、88.75%和82.83%,葡萄糖氧化酶的包埋率分别为 86.42%、88.34%和86.10%。模拟胃肠道消化实验表明,经cnc包覆形成的双层微胶囊形式的酶制剂能够提高酶在胃肠道内的活性,远高于游离酶的活性。在整个消化过程中,游离酶的累积释放率是先升高后降低的趋势,木聚糖酶在胃期的累积释放率为49.06%~51.11%,在小肠期的释放率为 45%~30.72%,葡萄糖氧化酶在两个阶段的累积释放率分别为47.61%~58.67%, 47.66%~32.99%。而单层微胶囊形式的酶制剂和双层微胶囊形式的酶制剂在模拟胃肠道消化过程中两种酶的释放率始终处于上升趋势,在胃期双层微胶囊的释放率略小于单层微胶囊形式的酶制剂,小肠期则相反。
31.本发明再一方面提供了上述酶制剂在制备药物、食品和饲料中的用途,该酶制剂可提高酶在动物胃肠道内的活性。
32.本发明的酶制剂为双层微胶囊形式的结构,芯材包括壳聚糖纳米粒子和酶,第一层壁材包括海藻酸钠、海藻糖,最外层壁材(第二层壁材)包括cnc。其中壳聚糖含有丰富的氨基和羟基,氨基能够和三聚磷酸钠所带的聚阴离子通过静电吸引发生离子交联形成壳聚糖纳米粒子,海藻酸钠所带的coo-可与少量壳聚糖的-nh
4+
进行静电吸引,在cacl2的存在下固化形成第一层微胶囊, cnc表面的-oso
3-和ca
2+
之间的静电吸引作用能够使得cnc包覆在整个微球表面。海藻糖在上述结果中作为冻干保护剂。
33.本发明利用cnc的强的耐酸性和稳定性能,将cnc设计成微胶囊的第二层壁材,用于制备双层包埋酶制剂微胶囊,可有效保护酶免受胃酸的破坏和降解,在食品、畜牧和农业等领域具有重要的应用价值。
34.与现有技术相比,本发明的方法具有如下有益效果:
35.(1)壳聚糖和cnc均为高分子聚合物,均具有来源广泛、生物降解性、生物相容等优点。
36.(2)本发明的双层微胶囊形式的酶制剂使得酶能够在胃肠道中实现持续释放,提高了酶在胃肠道中的活性,具有实际应用的价值。
37.(3)三次离子交联制备双层微胶囊,第一次:壳聚糖和tpp;第二次:海藻酸钠和
cacl2;第三次:cnc和cacl2,三次离子交联的微胶囊,结构更紧密,能有效在小肠内靶向释放包埋的酶。
附图说明
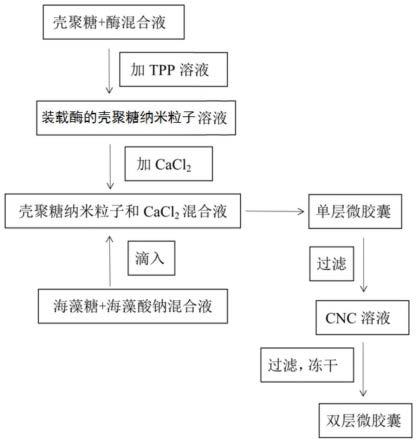
38.图1是本发明的酶制剂的制备方法的流程图。
39.图2是不同酶浓度的单层微胶囊形式的酶制剂的紫外可见光谱图。其中 a1、a2、a3、a4、a5分别是含有20、25、30、35和40mg/ml的酶浓度的酶制剂的紫外可见光谱图。右上角的图是200-220nm下含有上述酶浓度的酶制剂的紫外可见光谱图。
40.图3是不用微胶囊形式的酶制剂的实际照片图,其中a图显示了实施例4制备的单层微胶囊形式的酶制剂的照片;b图显示了实施例1制备的利用质量浓度0.1%cnc包覆的双层微胶囊形式的酶制剂的照片;c图显示了实施例 2制备的利用质量浓度0.5%cnc包覆的双层微胶囊形式的酶制剂的照片;d 图显示了实施例3制备的利用质量浓度1%cnc包覆的双层微胶囊形式的酶制剂的照片。
41.图4是木聚糖酶和葡萄糖氧化酶的包埋效率及产率,其中(a)图显示了单层微胶囊形式的酶制剂的包埋效率,其中a1、a2、a3、a4、a5分别表示含有20、25、30、35和40mg/ml的酶浓度的酶制剂;(b)图显示了双层微胶囊式的酶制剂的包埋效率及产率,其中a4、cnc
0.1
/a4、cnc
0.5
/a4、 cnc1/a4分别表示35mg/ml的酶包埋浓度,利用质量浓度0.1、0.5和1%的 cnc包覆的酶制剂。
42.图5是微胶囊形式的酶制剂在ph=4.5的pbs缓冲液中酶的释放效果图,其中(a)图和(b)图分别为木聚糖酶和葡萄糖氧化酶的释放效果,其中a4、 cnc
0.1
/a4、cnc
0.5
/a4、cnc1/a4分别表示35mg/ml的酶包埋浓度,利用质量浓度0.1、0.5和1%的cnc包覆的酶制剂。
43.图6是微胶囊在ph=7.4的pbs缓冲液中酶的释放效果图,其中(a)图和(b)图分别为木聚糖酶和葡萄糖氧化酶的释放效果,其中a4、cnc
0.1
/a4、 cnc
0.5
/a4、cnc1/a4分别表示35mg/ml的酶包埋浓度,利用质量浓度0.1、 0.5和1%的cnc包覆的酶制剂。
44.图7是微胶囊在模拟胃肠道消化液中酶的释放效果图,其中(a)图和 (b)图分别为木聚糖酶和葡萄糖氧化酶在模拟胃肠道消化液中的释放效果,其中a4、cnc
0.1
/a4、cnc
0.5
/a4、cnc1/a4分别表示35mg/ml的酶包埋浓度、利用质量浓度0.1、0.5和1%的cnc包覆的酶制剂。
具体实施方式
45.针对现有技术的状况,本技术发明人经过深入研究首次发明以壳聚糖和 cnc为壁材,以装载酶的壳聚糖纳米粒子为芯材制备的双层微胶囊形式的酶制剂能够实现酶在胃肠道中的持续释放从而提高酶活。该酶制剂的制备方法包括(1)芯材的制备:将酶加入到壳聚糖溶液中,加入三聚磷酸钠,壳聚糖与三聚磷酸根离子之间通过离子交联形成附载酶的壳聚糖纳米粒子,(2)第一层壁材的包覆:将cacl2溶液加入到步骤(1)的最终溶液中,混匀,再加入海藻酸钠和海藻糖的混合溶液,海藻酸钠和海藻糖吸附在壳聚糖纳米粒子表面并固化形成第一层壁材,过滤得到单层微胶囊形式的酶制剂;(3)第二层壁材的包覆:将单层微胶囊形式的酶制剂加入到纳晶纤维素溶液中,纳晶纤维素吸附在第一层壁材表面形成第二层壁材,过滤得到双层微胶囊形式的酶制剂。在此基础上完成了本发明。
46.本发明的制备方法的具体流程图参见图1。
47.本发明的描述中,酶包括但不局限于葡萄糖氧化酶、木聚糖酶、植酸酶、蛋白酶、脂肪酶和淀粉酶。在本发明的一个具体实施方式中,本发明的酶为木聚糖酶和葡萄糖氧化酶,两者的质量比为1:1。
48.本发明的描述中,纳晶纤维素可市售可得,也可以按照本发明的描述制备。
49.在本发明的一个具体实施例中,纳晶纤维素的制备方法为将1g微晶纤维素(mcc)分散于3~10ml质量分数为50~75%硫酸中,50℃强烈机械搅拌 10h,用5~10倍水稀释反应混合物,使水解反应淬灭;然后加入0.5~1.6ml 30wt%的h2o2水溶液,氧化纤维素纳米晶体悬浮液;反应30min后,用8000rpm 离心10min分离结晶,再用超声波洗涤,离心多次以去除多余的酸;最后进行透析,冻干,制备纳晶纤维素。该方法中,优选硫酸的质量分数为75%,优选淬灭水解反应中用9倍水稀释反应混合物。
50.在本发明的一个具体实施方式中,本发明酶制剂的制备方法包括以下步骤:(1)芯材的制备:将壳聚糖溶解于2%的乙酸溶液中,得到的壳聚糖浓度为2.5mg/ml,过夜搅拌24h然后超声30min使其充分溶解,用naoh溶液将其ph调整到5.5,然后将酶加入到上述溶液中,离心,取上清液,将浓度为0.25mg/ml的tpp溶液与上清液按照一定的比例(1:5)混合,低速搅拌 (150rpm)获得装载酶的壳聚糖纳米粒子的溶液;(2)第一层壁材的制备:将浓度cacl2溶液加入到上述壳聚糖纳米粒子溶液中,混匀,ca
2+
最终摩尔浓度为1mol/l,向其中滴加质量浓度为1%的海藻酸钠和质量浓度为15%的海藻糖的混合溶液,其固化30min,过滤得到单层微胶囊形式的酶制剂,其中海藻酸钠和海藻糖的混合溶液与含ca
2+
的溶液的体积比为1:1;(3)第二层壁材的制备:将单层微胶囊形式的酶制剂加入到质量浓度为0.1%~1%的cnc 溶液中并且轻轻搅拌,反应1h,过滤获得cnc包覆的双层微胶囊形式的酶制剂,冻干。
51.本发明的描述中,“溶液”没有特殊说明的话,一般指水溶液。
52.本发明的描述中,“多种”指两种或两种以上。
53.下面结合具体实施例,进一步阐述本发明。具体实施例是在以本发明技术方案为前提下进行实施的,给出了详细的实施方式和操作过程。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件进行。除非另有说明,比例和百分数按重量计。应理解本发明可添加的辅料并不仅仅局限于实施例提到的几种,本领域技术人员可根据需要选择不同的辅料进行添加。
54.下列实施例中,所用壳聚糖的分子量为1400kda,按照常规方法在实验室制备。
55.下列实施例中,所用海藻酸钠的cas编号为9005-38-3,购于阿拉丁。
56.下列实施例中,所用海藻糖的cas编号99-20-7,分子量342.3,购于阿拉丁。
57.下列实施例中,所用微晶纤维素,编号a600279,尺寸100μm,购于生工生物工程(上海)股份有限公司。下列实施例中,纳晶纤维素是通过以下方法制备的:
58.将9g mcc分散于50ml质量分数为70%的硫酸中,50℃强烈机械搅拌 10h,用8倍水稀释反应混合物,使水解反应淬灭。然后加入8ml 30wt%的 h2o2溶液,氧化纳晶纤维素悬浮液。反应30min后,用8000rpm离心10min 分离结晶,再用超声波洗涤,离心多次以去除多余的酸。最后进行透析(截留分子量)14000kda、冻干,制备纳晶纤维素。
59.实施例1
60.第一步 装载酶的壳聚糖纳米粒子(芯材)制备
61.将壳聚糖溶解于2%的乙酸溶液中,壳聚糖的浓度为2.5mg/ml,过夜搅拌,使壳聚糖充分溶解。随后用5m的naoh溶液将ph调整为5.5,并且将总量为葡萄糖氧化酶和木聚糖酶以1:1的质量比加入到壳聚糖溶液中,浓度为35mg/ml。待其充分溶解后置于离心机中离心,速度为3500rpm。取其上清液,将浓度为0.25mg/ml的tpp溶液以为1:5(v:v)滴入到上清液中, 150rpm搅拌30min,形成装载酶的壳聚糖纳米粒子的溶液。
62.第二步 第一层壁材的制备
63.将cacl2溶液加入到壳聚糖纳米粒子溶液中,ca
2+
最终摩尔浓度为1 mol/l。随后将海藻酸钠(1%)和海藻糖(15%)的混合液溶液用注射器(针头直径为0.45mm)按照1:1(v:v)滴入到上述壳聚糖纳米粒子和cacl2的混合溶液中,固化30min,形成单层微胶囊形式的酶制剂。
64.第三步 第二层壁材的制备
65.将步骤二中获得的单层微胶囊形式的酶制剂过滤后(不冲洗)置入质量浓度为0.1%的cnc溶液中(1g滤渣加入约5~10mlcnc溶液中),使其充分反应1h后过滤得到包覆cnc的双层微胶囊形式的酶制剂,冻干。
66.效果评价
67.(1)双层微胶囊形式的酶制剂在ph=4.5的pbs中的释放
68.将0.1g冻干的双层微胶囊形式的酶制剂置入10ml ph=4.5的pbs中,随后放入摇床中进行实验。摇床需要预热。整个释放时间为12h,在释放实验的前1h内,每隔15min取2份0.1ml样液,在随后的时间里,每隔30min 取一次,取完后要加入同样体积的pbs。将0.1ml的样液分别与0.5ml的木聚糖溶液(1%)和葡萄糖溶液(0.2m)在37℃水浴反应30min,随后分别加入0.5ml dns试剂和靛蓝胭脂红溶液,沸水浴分别加热5min和13min,在540nm和615nm处分别测其吸光度。结果表明,cnc质量浓度为0.1%时,木聚糖酶在6h时达到最大释放率90.87%,葡萄糖氧化酶在6.5h时达到最大释放率90.84%。
69.(2)双层微胶囊形式的酶制剂在ph=7.4的pbs中的释放
70.将0.1g冻干的双层微胶囊形式的酶制剂置入10ml ph=7.4的pbs缓冲液中,随后放入摇床中进行实验。摇床需要预热。整个释放时间为12h,在释放实验的前1h内,每隔15min取2份0.1ml样液,在随后的时间里,每隔30min取一次,取完后要加入同样体积的pbs。将0.1ml的样液分别与 0.5ml的木聚糖溶液(1%)和葡萄糖溶液(0.2m)在37℃水浴反应30min,随后分别加入0.5ml dns试剂和靛蓝胭脂红溶液,沸水浴分别加热5min和 13min,在540nm和615nm处分别测其吸光度。结果表明,cnc质量浓度为 0.1%时,木聚糖酶在5.5h时达到最大释放率91.42%,葡萄糖氧化酶在6.5h 时达到最大释放率91.11%。
71.(3)模拟双层微胶囊形式的酶制剂的胃肠道释放
72.将0.1g冻干的双层微胶囊形式的酶制剂置入10ml pbs中(ph=7),随后与等体积模拟胃液(2g nacl,3.2g胃蛋白酶,7ml hcl,用naoh溶液将ph调整到2.5,最后定容到1000ml)混合,在摇床中(摇床需预热到37℃) 进行孵育。整个胃期为2h。每隔30min取2份0.1ml样液,测定吸光度。取完样液后需加入等量的模拟胃液。胃期结束后用naoh溶液溶液将ph调整为6.8。然后加入20ml模拟肠液(6.8g kh2po4溶解于250ml水中,77ml 0.2m naoh溶液溶液,500ml水,10g胰蛋白酶,用naoh溶液溶液或者 hcl将ph调整到6.8),每隔30min取样,测其吸光度。结果表明,木聚糖酶在胃期结束时的累积释放率为53.13%,葡萄糖氧化酶
为47.62%,而小肠期结束时,木聚糖酶和葡萄糖氧化酶的累积释放率分别为73.64%和68.95%。
73.实施例2
74.第一步 装载酶的壳聚糖纳米粒子(芯材)的制备
75.将壳聚糖溶解于2%的乙酸溶液中,壳聚糖浓度为2.5mg/ml,过夜搅拌,使壳聚糖充分溶解。随后用5m的naoh溶液将ph调整为5.5,并且将葡萄糖氧化酶和木聚糖酶以1:1的质量比加入到壳聚糖溶液中,浓度为35mg/ml。待其充分溶解后置于离心机中离心,速度为3500rpm。取其上清液,将浓度为0.25mg/ml的tpp溶液以为1:5(v:v)滴入到上清液中,150rpm搅拌30min,形成装载酶的壳聚糖纳米粒子的溶液。
76.第二步 第一层壁材的制备
77.将cacl2溶液加入到壳聚糖纳米粒子溶液中,ca
2+
最终摩尔浓度为1 mol/l。随后将海藻酸钠(1%)和海藻糖(15%)的混合液溶液用注射器(针头直径为0.45mm)按照1:1(v:v)滴入到上述壳聚糖纳米粒子和cacl2的混合溶液中,固化30min,形成单层微胶囊形式的酶制剂。
78.第三步 第二层壁材的的制备
79.将步骤二中获得的微胶囊过滤后(不冲洗)置入质量浓度为0.5%的cnc 溶液中,使其充分反应1h后过滤得到包覆cnc的双层微胶囊形式的酶制剂,冻干。
80.效果评价
81.(1)双层微胶囊形式的酶制剂在ph=4.5的pbs中的释放
82.将0.1g冻干的双层微胶囊形式的酶制剂置入10ml ph=4.5的pbs中,随后放入摇床中进行实验。摇床需要预热。整个释放时间为12h,在释放实验的前1h内,每隔15min取2份0.1ml样液,在随后的时间里,每隔30min 取一次,取完后要加入同样体积的pbs。将0.1ml的样液分别与0.5ml的木聚糖溶液(1%)和葡萄糖溶液(0.2m)在37℃水浴反应30min,随后分别加入0.5ml dns试剂和靛蓝胭脂红溶液,沸水浴分别加热5min和13min,在540nm和615nm处分别测其吸光度。结果表明,cnc质量浓度为0.5%时,木聚糖酶在7.5h时达到最大释放率91.95%,葡萄糖氧化酶在8.5h时达到最大释放率92.55%。
83.(2)双层微胶囊形式的酶制剂在ph=7.4的pbs中的释放
84.将0.1g冻干的双层微胶囊形式的酶制剂置入10ml ph=7.4的pbs缓冲液中,随后放入摇床中进行实验。摇床需要预热。整个释放时间为12h,在释放实验的前1h内,每隔15min取2份0.1ml样液,在随后的时间里,每隔30min取一次,取完后要加入同样体积的pbs。将0.1ml的样液分别与 0.5ml的木聚糖溶液(1%)和葡萄糖溶液(0.2m)在37℃水浴反应30min,随后分别加入0.5ml dns试剂和靛蓝胭脂红溶液,沸水浴分别加热5min和 13min,在540nm和615nm处分别测其吸光度。结果表明,cnc质量浓度为 0.5%时,木聚糖酶在6.5h时达到最大释放率91.42%,葡萄糖氧化酶在7h时达到最大释放率92%。
85.(3)模拟双层微胶囊形式的酶制剂的胃肠道释放
86.将0.1g冻干的双层微胶囊形式的酶制剂置入10ml pbs中(ph=7),随后与等体积模拟胃液(2g nacl,3.2g胃蛋白酶,7ml hcl,用naoh溶液将ph调整到2.5,最后定容到1000ml)混合,在摇床中(摇床需预热到37℃) 进行孵育。整个胃期为2h。每隔30min取2份0.1ml样液,测定吸光度。取完样液后需加入等量的模拟胃液。胃期结束后用naoh溶液溶液
将ph调整为6.8。然后加入20ml模拟肠液(6.8g kh2po4溶解于250ml水中,77ml 0.2m naoh溶液溶液,500ml水,10g胰蛋白酶,用naoh溶液溶液或者 hcl将ph调整到6.8),每隔30min取样,测其吸光度。结果表明,木聚糖酶在胃期结束时的累积释放率为41.62%,葡萄糖氧化酶为42.63%,而小肠期结束时,木聚糖酶和葡萄糖氧化酶的累积释放率分别为77.13%和72.11%。
87.实施例3
88.第一步 装载酶的壳聚糖纳米粒子(芯材)制备
89.将壳聚糖溶解于2%的乙酸溶液中,壳聚糖浓度为2.5mg/ml,过夜搅拌,使壳聚糖充分溶解。随后用5m的naoh溶液将ph调整为5.5,并且将葡萄糖氧化酶和木聚糖酶以1:1的质量比加入到壳聚糖溶液中,浓度为35mg/ml。待其充分溶解后置于离心机中离心,速度为3500rpm。取其上清液,将浓度为0.25mg/ml的tpp溶液以为1:5(v:v)滴入到上清液中,150rpm搅拌 30min,形成载酶的壳聚糖纳米粒子的溶液。
90.第二步 第一层壁材的制备
91.将cacl2溶液加入到壳聚糖纳米粒子溶液中,ca
2+
最终摩尔浓度为1 mol/l。随后将海藻酸钠(1%)和海藻糖(15%)的混合液溶液用注射器(针头直径为0.45mm)按照1:1(v:v)滴入到上述壳聚糖纳米粒子和cacl2的混合溶液中,固化30min,形成单层微胶囊形式的酶制剂。
92.第三步 第二层壁材的制备
93.将步骤二中获得的微胶囊过滤后(不冲洗)置入质量浓度为1%的cnc 溶液中,使其充分反应1h后过滤得到包覆cnc的双层微胶囊形式的酶制剂,冻干。
94.效果评价
95.(1)双层微胶囊形式的酶制剂在ph=4.5的pbs中的释放
96.将0.1g冻干的双层微胶囊形式的酶制剂置入10ml ph=4.5的pbs中,随后放入摇床中进行实验。摇床需要预热。整个释放时间为12h,在释放实验的前1h内,每隔15min取2份0.1ml样液,在随后的时间里,每隔30min 取一次,取完后要加入同样体积的pbs。将0.1ml的样液分别与0.5ml的木聚糖溶液(1%)和葡萄糖溶液(0.2m)在37℃水浴反应30min,随后分别加入0.5ml dns试剂和靛蓝胭脂红溶液,沸水浴分别加热5min和13min,在540nm和615nm处分别测其吸光度。结果表明,cnc质量浓度为1%时,木聚糖酶在10h时达到最大释放率90.61%,葡萄糖氧化酶在10h时达到最大释放率91.19%。
97.(2)双层微胶囊形式的酶制剂在ph=7.4的pbs中的释放
98.将0.1g冻干的双层微胶囊形式的酶制剂置入10ml ph=7.4的pbs缓冲液中,随后放入摇床中进行实验。摇床需要预热。整个释放时间为12h,在释放实验的前1h内,每隔15min取2份0.1ml样液,在随后的时间里,每隔30min取一次,取完后要加入同样体积的pbs。将0.1ml的样液分别与 0.5ml的木聚糖溶液(1%)和葡萄糖溶液(0.2m)在37℃水浴反应30min,随后分别加入0.5ml dns试剂和靛蓝胭脂红溶液,沸水浴分别加热5min和 13min,在540nm和615nm处分别测其吸光度。结果表明,cnc质量浓度为 1%时,木聚糖酶在7.5h时达到最大释放率94.42%,葡萄糖氧化酶在9h时达到最大释放率91.75%。
99.(3)模拟双层微胶囊形式的酶制剂的胃肠道释放
100.将0.1g冻干的双层微胶囊形式的酶制剂置入10ml pbs中(ph=7),随后与等体积
模拟胃液(2g nacl,3.2g胃蛋白酶,7ml hcl,用naoh溶液将ph调整到2.5,最后定容到1000ml)混合,在摇床中(摇床需预热到37℃) 进行孵育。整个胃期为2h。每隔30min取2份0.1ml样液,测定吸光度。取完样液后需加入等量的模拟胃液。胃期结束后用naoh溶液溶液将ph调整为6.8。然后加入20ml模拟肠液(6.8g kh2po4溶解于250ml水中,77ml 0.2m naoh溶液溶液,500ml水,10g胰蛋白酶,用naoh溶液溶液或者 hcl将ph调整到6.8),每隔30min取样,测其吸光度。结果表明,木聚糖酶在胃期结束时的累积释放率为32.63%,葡萄糖氧化酶为44.25%,而小肠期结束时,木聚糖酶和葡萄糖氧化酶的累积释放率分别为64.77%和61.37%。
101.对比实施例1
102.第一步 装载酶的壳聚糖纳米粒子(芯材)制备
103.将壳聚糖溶解于2%的乙酸溶液中,浓度为2.5mg/ml,过夜搅拌,使壳聚糖充分溶解。随后用5m的naoh溶液将ph调整为5.5,并且将葡萄糖氧化酶和木聚糖酶以1:1的质量比加入到壳聚糖溶液中,浓度为35mg/ml。待其充分溶解后置于离心机中离心,速度为3500rpm。取其上清液,将浓度为0.25mg/ml的tpp溶液以为1:5(v:v)滴入到上清液中,150rpm搅拌 30min,形成载酶的壳聚糖纳米粒子的溶液。
104.第二步 第一层壁材的制备
105.将cacl2溶液加入到壳聚糖纳米粒子溶液中,ca
2+
最终摩尔浓度为1 mol/l。随后将海藻酸钠(1%)和海藻糖(15%)的混合液溶液用注射器(针头直径为0.45mm)按照1:1(v:v)滴入到上述壳聚糖纳米粒子和cacl2的混合溶液中,固化30min,形成单层微胶囊形式的酶制剂。随后将单层微胶囊形式的酶制剂用ph=5.5的醋酸-醋酸钠缓冲液冲洗三次,使得微胶囊表面不再附着酶,随后冻干。
106.效果评价
107.(1)单层微胶囊形式的酶制剂在ph=4.5的pbs中的释放
108.将0.1g冻干的单层微胶囊形式的酶制剂置入10ml ph=4.5的pbs中,随后放入摇床中进行实验。摇床需要预热。整个释放时间为12h,在释放实验的前1h内,每隔15min取2份0.1ml样液,在随后的时间里,每隔30min 取一次,取完后要加入同样体积的pbs。将0.1ml的样液分别与0.5ml的木聚糖溶液(1%)和葡萄糖溶液(0.2mol/l)在37℃水浴反应30min,随后分别加入0.5ml dns试剂和靛蓝胭脂红溶液,沸水浴分别加热5min和13min,在540nm和615nm处分别测其吸光度。结果表明,木聚糖酶在6h时达到最大释放率92.07%,葡萄糖氧化酶在7h时达到最大释放率92.88%。
109.(2)单层微胶囊形式的酶制剂在ph=7.4的pbs中的释放
110.将0.1g冻干的cnc包覆壳聚糖的微胶囊珠置入10ml ph=7.4的pbs缓冲液中,随后放入摇床中进行实验。摇床需要预热。整个释放时间为12h,在释放实验的前1h内,每隔15min取2份0.1ml样液,在随后的时间里,每隔30min取一次,取完后要加入同样体积的pbs。将0.1ml的样液分别与 0.5ml的木聚糖溶液(1%)和葡萄糖溶液(0.2mol/l)在37℃水浴反应30min,随后分别加入0.5ml dns试剂和靛蓝胭脂红溶液,沸水浴分别加热5min和 13min,在540nm和615nm处分别测其吸光度。结果表明,木聚糖酶在5h 时达到最大释放率92.52%,葡萄糖氧化酶在6h时达到最大释放率90.09%。
111.(3)模拟单层微胶囊形式的酶制剂的胃肠道释放
112.将0.1g冻干的双层微胶囊形式的酶制剂置入10ml pbs中(ph=7),随后与等体积模拟胃液(2g nacl,3.2g胃蛋白酶,7ml hcl,用naoh溶液将ph调整到2.5,最后定容到1000ml)混合,在摇床中(摇床需预热到37℃) 进行孵育。整个胃期为2h。每隔30min取2份0.1ml样液,测定吸光度。取完样液后需加入等量的模拟胃液。胃期结束后用naoh溶液溶液将ph调整为6.8。然后加入20ml模拟肠液(6.8g kh2po4溶解于250ml水中,77ml 0.2m naoh溶液溶液,500ml水,10g胰蛋白酶,用naoh溶液溶液或者 hcl将ph调整到6.8),每隔30min取样,测其吸光度。结果表明,木聚糖酶在胃期结束时的累积释放率为58.39%,葡萄糖氧化酶为52.93%,而小肠期结束时,木聚糖酶和葡萄糖氧化酶的累积释放率分别为68.08%和61.66%。
113.对比实施例2
114.游离酶的效果评价
115.(1)游离酶在ph=4.5的pbs中的释放
116.分别准确称取0.05g木聚糖酶和葡萄糖氧化酶置入10ml ph=4.5的pbs 中,随后放入摇床中进行实验。摇床需要预热。整个释放时间为12h,在释放实验的前1h内,每隔15min取2份0.1ml样液,在随后的时间里,每隔 30min取一次,取完后要加入同样体积的pbs。将0.1ml的样液分别与0.5ml 的木聚糖溶液(1%)和葡萄糖溶液(0.2m)在37℃水浴反应30min,随后分别加入0.5ml dns试剂和靛蓝胭脂红溶液,沸水浴分别加热5min和13 min,在540nm和615nm处分别测其吸光度。结果表明,游离木聚糖酶在3.5h 时达到最大释放率92.03%,游离葡萄糖氧化酶在3.5h时达到最大释放率 90.97%。
117.(2)游离酶在ph=7.4的pbs中的释放
118.分别准确称取0.05g木聚糖酶和葡萄糖氧化酶置入10ml ph=7.4的pbs 缓冲液中,随后放入摇床中进行实验。摇床需要预热。整个释放时间为12h,在释放实验的前1h内,每隔15min取2份0.1ml样液,在随后的时间里,每隔30min取一次,取完后要加入同样体积的pbs。将0.1ml的样液分别与 0.5ml的木聚糖溶液(1%)和葡萄糖溶液(0.2m)在37℃水浴反应30min,随后分别加入0.5ml dns试剂和靛蓝胭脂红溶液,沸水浴分别加热5min和 13min,在540nm和615nm处分别测其吸光度。结果表明,游离木聚糖酶在 4h时达到最大释放率91.42%,游离葡萄糖氧化酶在4h时达到最大释放率 93.7%。
119.(3)游离酶模拟体外释放
120.分别准确称取0.05g木聚糖酶和葡萄糖氧化酶置入10ml pbs中 (ph=7),随后与等体积模拟胃液(2g nacl,3.2g胃蛋白酶,7ml hcl,用 naoh溶液将ph调整到2.5,最后定容到1000ml)混合,在摇床中(摇床需预热到37℃)进行孵育。整个胃期为2h。每隔30min取2份0.1ml样液,测定吸光度。取完样液后需加入等量的模拟胃液。胃期结束后用naoh溶液溶液将ph调整为6.8。然后加入20ml模拟肠液(6.8g kh2po4溶解于250ml 水中,77ml 0.2m naoh溶液溶液,500ml水,10g胰蛋白酶,用naoh溶液溶液或者hcl将ph调整到6.8),每隔30min取样,测其吸光度。结果表明,游离木聚糖酶在胃期结束时的累积释放率为59.11%,葡萄糖氧化酶为 52.93%,而小肠期结束时,游离木聚糖酶和葡萄糖氧化酶的累积释放率分别为58.65%和32.99%。
121.将实施例1-3与对比实施例1和对比实施例2的对比可以看出(1)双层微胶囊酶制剂的包埋率、体外释放和胃肠道释放比单层微胶囊的效果好,双层和单层包埋酶制剂的微
胶囊的包埋率、体外释放和胃肠道释放比游离酶的效果好。
122.以上显示和描述了本发明的基本原理和主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1