一种橙皮苷脂质体凝胶剂及其制备方法和用途
1.本发明属于医药技术领域,涉及一种橙皮苷脂质体凝胶剂及其制备方法和用途。
背景技术:
2.橙皮苷(hesperidin,hdn)别名川陈皮素、橘皮苷、柚皮苷,是中药陈皮(citri reticulatae pericarpium)的主要活性成分之一,主要存在于芸香科柑橘属植物的果实中,是橙皮素(hesperitin,hst)与芸香糖脱水形成的二氢黄酮类化合物。hdn具有抗氧化、抗炎、抗肿瘤、抗过敏、防辐射等药理活性。研究表明hdn水溶性较差,其在水中饱和溶解度约为5~50μg/ml(guo j,lu s,liu z,et al.solubilization of hesperidin with octenyl succinic anhydride modified sweet potato starch[j].food chem,2019,285:180-185)。正因为橙皮苷水溶性差,难以达到有效治疗浓度,同时油水分配系数低,难以透过皮肤角质层,因此极大限制了其在局部外用给药方面的临床应用。
[0003]
因此,目前对橙皮苷外用制剂的药物,仍有待进一步研究。
技术实现要素:
[0004]
本发明旨在至少在一定程度上解决上述技术问题之一或至少提供一种有用的商业选择。为此,本发明的目的在于提供一种橙皮苷脂质体凝胶剂及其制备方法和用途。该橙皮苷脂质体凝胶剂的处方及配比科学合理,制备工艺简单、质量可控,临床疗效好,其可广泛应用于局部外用给药。
[0005]
由此,在本发明的第一个方面,本发明提出了一种橙皮苷脂质体凝胶剂,其包含:橙皮苷、磷脂、胆固醇、凝胶基质、保湿剂、ph调节剂、以及磷酸盐缓冲溶液(pbs)。本发明所述的橙皮苷脂质体凝胶剂,其将橙皮苷制备成可以供外用的脂质体凝胶剂,其可在提高橙皮苷脂质体立体稳定性、减少橙皮苷脂质体聚集的同时,延长橙皮苷脂质体在皮肤上的作用时间,并在皮肤内形成药物储库,从而持续有效释放橙皮苷,表现出对皮肤有良好的靶向性能,且大大改善了橙皮苷的透皮能力,保障了橙皮苷脂质体凝胶剂临床应用的安全有效、质量可控性,提高了橙皮苷作为局部外用制剂药物的疗效。
[0006]
根据本发明的实施例,本发明所述的橙皮苷脂质体凝胶剂中所述的磷脂采用豆磷脂、天然磷脂、半合成磷脂、全合成磷脂、天然磷脂与半合成磷脂的混合物、或者天然磷脂与全合成磷脂的混合物,并且磷脂酰胆碱的含量在50%~99.9%。
[0007]
根据本发明的实施例,优选本发明所述的橙皮苷脂质体凝胶剂中所述的磷脂采用豆磷脂,并且其磷脂酰胆碱的含量在97%以上。
[0008]
根据本发明的实施例,在本发明的橙皮苷脂质体凝胶剂中,ph调节剂可以选自为:三乙醇胺、氢氧化钠、氢氧化钾的至少一种,优选三乙醇胺。
[0009]
根据本发明的一些具体示例,应用ph调节剂调节橙皮苷脂质体凝胶ph值为6.0~7.5。
[0010]
根据本发明的一些具体示例,优选本发明应用ph调节剂调节橙皮苷脂质体凝胶ph
值为6.5~7.0,此时得到的凝胶剂具有最优的粘度和稠度。
[0011]
本发明的发明人通过响应面优化设计,优选本发明处方中所述的磷脂与胆固醇的质量比为(1~5):1,磷脂与橙皮苷的质量比为(5~9):1,磷酸盐缓冲液的ph值为6.0~7.0。
[0012]
根据本发明的实施例,优选本发明处方中所述的磷脂与胆固醇的质量比为2.35:1,磷脂与橙皮苷的质量比为7.43:1,磷酸盐缓冲液的ph值为ph6.54。
[0013]
根据本发明的实施例,本发明所述ph6.54磷酸盐缓冲溶液的处方及配制方法为:精密称取在110℃~120℃干燥2~3小时的无水磷酸氢二钠3.55g与磷酸二氢钾3.40g,加水使溶解,加入0.1mol/l的氢氧化钠,用ph计精密测定后微调至ph6.54,并稀释至1000ml即可。
[0014]
由此,本发明提出了一种橙皮苷脂质体凝胶剂,其包含:橙皮苷、磷脂、胆固醇、凝胶基质、保湿剂、ph调节剂、以及磷酸盐缓冲溶液。
[0015]
根据本发明的实施例,本发明所述的橙皮苷脂质体凝胶剂的凝胶基质为选自:卡波姆。
[0016]
根据本发明的实施例,本发明所述的橙皮苷脂质体凝胶剂的凝胶基质优选为选自:卡波姆940、卡波姆941、卡波姆934的至少一种。
[0017]
根据本发明的实施例,本发明所述的橙皮苷脂质体凝胶剂的凝胶基质更优选为:卡波姆940。
[0018]
发明人惊奇地发现,采用卡波姆940作为本发明凝胶剂的凝胶基质,制备得到的橙皮苷脂质体凝胶剂乳白色,质地细腻,易于涂布,无油腻性,对皮肤和黏膜无刺激性。
[0019]
根据本发明的实施例,在本发明的橙皮苷脂质体凝胶剂的保湿剂可以选自为:甘油、1,2-戊二醇、透明质酸、透明质酸季铵盐、葫芦巴多糖、香菇多糖、木糖醇、羧甲基海藻糖、银耳多糖、β-葡聚糖的至少一种,优选保湿剂选自为:β-葡聚糖、香菇多糖、甘油、1,2-戊二醇、葫芦巴多糖、银耳多糖、羧甲基海藻糖的至少一种,进一步优选保湿剂选自为:β-葡聚糖与香菇多糖的组合、或β-葡聚糖与甘油的组合、或1,2-戊二醇与甘油的组合。
[0020]
根据本发明的具体实施例,优选保湿剂选自为:β-葡聚糖与香菇多糖以重量比为1:1的组合;
[0021]
根据本发明的具体实施例,优选保湿剂选自为:β-葡聚糖与香菇多糖以重量比为4:1的组合;
[0022]
根据本发明的具体实施例,优选保湿剂选自为:1,2-戊二醇与甘油以重量比为1:1的组合。
[0023]
根据本发明的实施例,按照重量份数,本发明的橙皮苷脂质体凝胶剂包括:所述橙皮苷0.05~0.3重量份、所述磷脂0.373~2.229重量份、所述胆固醇0.158~0.948重量份、所述凝胶基质25~150重量份、所述保湿剂125~750重量份、所述适量的ph调节剂、以及所述磷酸盐缓冲溶液,加至共5000重量份。
[0024]
本发明的发明人惊奇的发现,本发明的橙皮苷脂质体凝胶剂,表现出对皮肤有良好的靶向性能,且大大改善了橙皮苷的透皮能力,保障了橙皮苷脂质体凝胶剂临床应用的安全有效、质量可控性,提高了橙皮苷作为局部外用制剂药物的疗效。
[0025]
本发明的发明人意外的发现,本发明所述的hdn-ls-gel的保湿剂中,β-葡聚糖与香菇多糖按特定比例的组合相对于单一的β-葡聚糖、或单一的香菇多糖,β-葡聚糖与甘油
按特定比例的组合相对于单一的β-葡聚糖、或单一的甘油,1,2-戊二醇与甘油按特定比例的组合相对于单一的1,2-戊二醇、或单一的甘油,其保湿性能均是能得到明显的提升。
[0026]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.1重量份橙皮苷、0.743重量份磷脂、0.316重量份胆固醇、50重量份卡波姆940、250重量份甘油、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0027]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.1重量份橙皮苷、0.743重量份磷脂、0.316重量份胆固醇、50重量份卡波姆940、250重量份β-葡聚糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0028]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.1重量份橙皮苷、0.743重量份磷脂、0.316重量份胆固醇、50重量份卡波姆941、250重量份木糖醇、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0029]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.1重量份橙皮苷、0.743重量份磷脂、0.316重量份胆固醇、50重量份卡波姆934、250重量份葫芦巴多糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0030]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.1重量份橙皮苷、0.743重量份磷脂、0.316重量份胆固醇、50重量份卡波姆940、250重量份香菇多糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0031]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.1重量份橙皮苷、0.743重量份磷脂、0.316重量份胆固醇、50重量份卡波姆940、125重量份β-葡聚糖、125重量份香菇多糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0032]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.1重量份橙皮苷、0.743重量份磷脂、0.316重量份胆固醇、50重量份卡波姆940、200重量份β-葡聚糖、50重量份香菇多糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0033]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.1重量份橙皮苷、0.743重量份磷脂、0.316重量份胆固醇、50重量份卡波姆940、50重量份β-葡聚糖、200重量份香菇多糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0034]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.1重量份橙皮苷、0.743重量份磷脂、0.316重量份胆固醇、50重量份卡波姆940、125重量份β-葡聚糖、125重量甘油、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0035]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.1重量份橙皮苷、0.743重量份磷脂、0.316重量份胆固醇、50重量份卡波姆940、125重量份1,2-戊二醇、125重量份甘油、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0036]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.1重量份橙皮苷、0.743重量份磷脂、0.316重量份胆固醇、50重量份卡波姆940、125重量份透明质酸、125重量份木糖醇、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0037]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.1重量份橙皮苷、0.743重量份磷脂、0.316重量份胆固醇、50重量份卡波姆940、250重量份
银耳多糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0038]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.1重量份橙皮苷、0.743重量份磷脂、0.316重量份胆固醇、50重量份卡波姆940、250重量份羧甲基海藻糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0039]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.1重量份橙皮苷、0.743重量份磷脂、0.316重量份胆固醇、50重量份卡波姆940、250重量份1,2-戊二醇、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0040]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.05重量份橙皮苷、0.372重量份磷脂、0.158重量份胆固醇、25重量份卡波姆940、125重量份甘油、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0041]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.05重量份橙皮苷、0.372重量份磷脂、0.158重量份胆固醇、25重量份卡波姆940、125重量份β-葡聚糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0042]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.05重量份橙皮苷、0.372重量份磷脂、0.158重量份胆固醇、25重量份卡波姆941、125重量份木糖醇、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0043]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.05重量份橙皮苷、0.372重量份磷脂、0.158重量份胆固醇、25重量份卡波姆934、125重量份葫芦巴多糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0044]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.05重量份橙皮苷、0.372重量份磷脂、0.158重量份胆固醇、25重量份卡波姆940、125重量份香菇多糖、适量的氢氧化钠、以及磷酸盐缓冲溶液,加至共5000重量份。
[0045]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.05重量份橙皮苷、0.372重量份磷脂、0.158重量份胆固醇、25重量份卡波姆940、75重量份β-葡聚糖、50重量份香菇多糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0046]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.05重量份橙皮苷、0.372重量份磷脂、0.158重量份胆固醇、25重量份卡波姆940、75重量份β-葡聚糖、50重量份甘油、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0047]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.05重量份橙皮苷、0.372重量份磷脂、0.158重量份胆固醇、25重量份卡波姆940、100重量份1,2-戊二醇、25重量份甘油、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0048]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.05重量份橙皮苷、0.372重量份磷脂、0.158重量份胆固醇、25重量份卡波姆940、100重量份透明质酸、25重量份木糖醇、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0049]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.05重量份橙皮苷、0.372重量份磷脂、0.158重量份胆固醇、25重量份卡波姆940、125重量份银耳多糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0050]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.05重量份橙皮苷、0.372重量份磷脂、0.158重量份胆固醇、25重量份卡波姆940、125重量
份羧甲基海藻糖、适量的氢氧化钠、以及磷酸盐缓冲溶液,加至共5000重量份。
[0051]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.05重量份橙皮苷、0.372重量份磷脂、0.158重量份胆固醇、25重量份卡波姆940、125重量份1,2-戊二醇、适量的氢氧化钠、以及磷酸盐缓冲溶液,加至共5000重量份。
[0052]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.3重量份橙皮苷、2.229重量份磷脂、0.948重量份胆固醇、150重量份卡波姆940、750重量份甘油、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0053]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.3重量份橙皮苷、2.229重量份磷脂、0.948重量份胆固醇、150重量份卡波姆940、750重量份β-葡聚糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0054]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.3重量份橙皮苷、2.229重量份磷脂、0.948重量份胆固醇、150重量份卡波姆941、750重量份木糖醇、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0055]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.3重量份橙皮苷、2.229重量份磷脂、0.948重量份胆固醇、150重量份卡波姆934、750重量份葫芦巴多糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0056]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.3重量份橙皮苷、2.229重量份磷脂、0.948重量份胆固醇、150重量份卡波姆940、750重量份香菇多糖、适量的氢氧化钠、以及磷酸盐缓冲溶液,加至共5000重量份。
[0057]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.3重量份橙皮苷、2.229重量份磷脂、0.948重量份胆固醇、150重量份卡波姆940、600重量份β-葡聚糖、150重量份香菇多糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0058]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.3重量份橙皮苷、2.229重量份磷脂、0.948重量份胆固醇、150重量份卡波姆940、500重量份β-葡聚糖、250重量份甘油、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0059]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.3重量份橙皮苷、2.229重量份磷脂、0.948重量份胆固醇、150重量份卡波姆940、250重量份1,2-戊二醇、500重量份甘油、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0060]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.3重量份橙皮苷、2.229重量份磷脂、0.948重量份胆固醇、150重量份卡波姆940、250重量份透明质酸、500重量份木糖醇、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0061]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.3重量份橙皮苷、2.229重量份磷脂、0.948重量份胆固醇、150重量份卡波姆940、750重量份银耳多糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000重量份。
[0062]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.3重量份橙皮苷、2.229重量份磷脂、0.948重量份胆固醇、150重量份卡波姆940、750重量
份羧甲基海藻糖、适量的氢氧化钠、以及磷酸盐缓冲溶液,加至共5000重量份。
[0063]
根据本发明的实施例,按照重量份数,本发明所述的橙皮苷脂质体凝胶剂包括:0.3重量份橙皮苷、2.229重量份磷脂、0.948重量份胆固醇、150重量份卡波姆940、750重量份1,2-戊二醇、适量的氢氧化钠、以及磷酸盐缓冲溶液,加至共5000重量份。
[0064]
在本发明的第二个方面,本发明提供了一种橙皮苷脂质体凝胶剂的制备方法。
[0065]
根据本发明的实施例,为促进橙皮苷在局部外用给药方面的研究,保障本发明所述橙皮苷脂质体凝胶剂临床应用的安全有效、质量可控,本发明采用薄膜超声法制备橙皮苷脂质体,以包封率(ee)为主要评价指标对脂质体处方进行优化,并对最优处方制备橙皮苷脂质体和橙皮苷脂质体凝胶剂的外观、微观形态、平均粒径(size)、多分散指数(pdi)、zeta电位、ee%、ph、粘度等理化指标进行考察。采用franz扩散池法对橙皮苷脂质体和橙皮苷脂质体凝胶剂体外释放模型和透皮吸收进行考察,得到了本发明所述的安全有效、质量可控的橙皮苷脂质体凝胶剂。
[0066]
根据本发明的实施例,本发明所述橙皮苷脂质体凝胶剂的制备方法包含如下步骤:
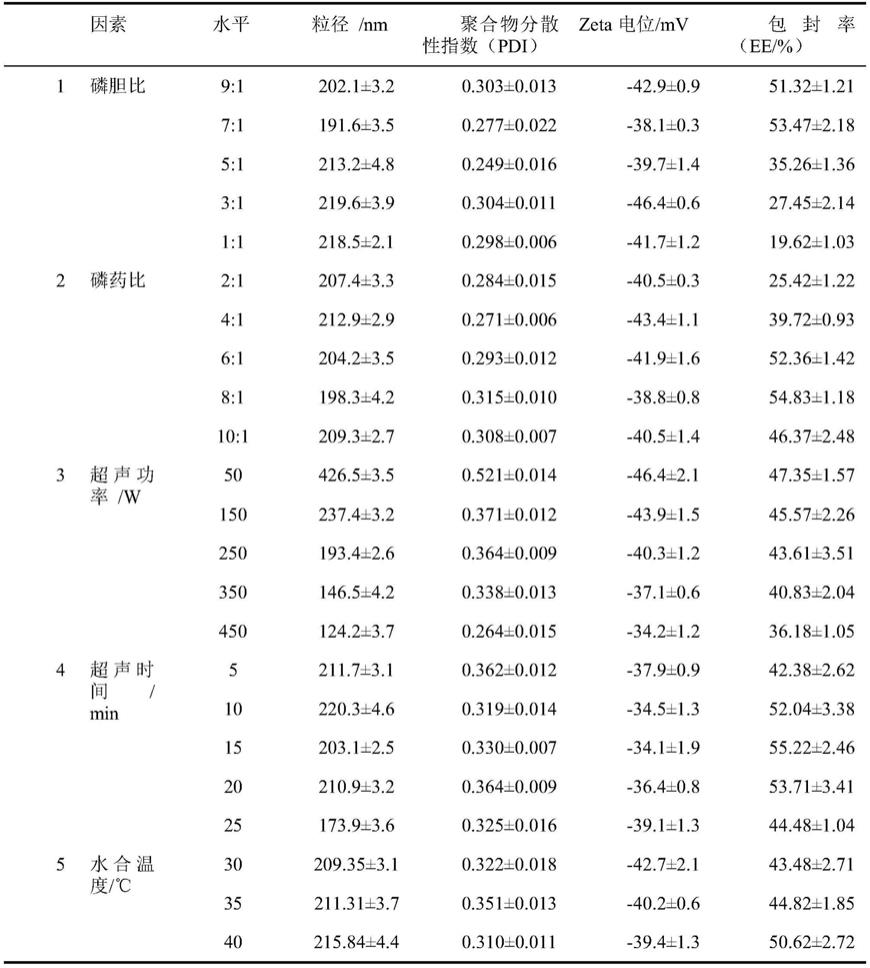
[0067]
步骤(1):分别称取磷脂和胆固醇溶解于氯仿溶液中,称取橙皮苷溶解于甲醇溶液中,将上述两种溶液混合均匀,减压浓缩去除溶剂,得到第一混合物;
[0068]
步骤(2):在步骤(1)得到的第一混合物中加入适量磷酸盐缓冲溶液水化,短时水浴超声至脂质膜脱落完全后将其置于超声波细胞粉碎仪中冰浴超声,每超声1秒间隔2秒,超声功率150w,超声时间共15min,超声毕,再用适量磷酸盐缓冲溶液定容,得橙皮苷脂质体(hdn-ls);
[0069]
步骤(3):称取凝胶基质加入步骤(2)得到的橙皮苷脂质体中,于4℃冰箱中冷藏过夜,使其充分溶胀后,再加入保湿剂,用适量的ph调节剂调ph至6.5~7.0,加适量磷酸盐缓冲溶液,加至共500g,灌装,即得本发明所述的橙皮苷脂质体凝胶剂(hdn-ls-gel)100支。
[0070]
根据本发明的实施例,本发明所述橙皮苷脂质体凝胶剂的制备方法包含如下步骤:
[0071]
步骤(1):分别称取磷脂和胆固醇溶解于氯仿溶液中,称取橙皮苷溶解于甲醇溶液中,将上述两种溶液混合均匀,减压浓缩去除溶剂,得到第一混合物;
[0072]
步骤(2):在步骤(1)得到的第一混合物中加入适量磷酸盐缓冲溶液水化,短时水浴超声至脂质膜脱落完全后将其置于高压均质机中,100~200bar,循环5~8次,再用适量磷酸盐缓冲溶液定容,得橙皮苷脂质体(hdn-ls);
[0073]
步骤(3):称取凝胶基质加入步骤(2)得到的橙皮苷脂质体中,于4℃冰箱中冷藏过夜,使其充分溶胀后,再加入保湿剂,用适量的ph调节剂调ph至6.5~7.0,加适量磷酸盐缓冲溶液,加至共5000g,灌装,即得本发明所述的橙皮苷脂质体凝胶剂(hdn-ls-gel)1000支。
[0074]
根据本发明的实施例,本发明所述的橙皮苷脂质体凝胶剂,其特征在于,所述橙皮苷脂质体凝胶剂是由本发明所述的方法制备得到的。
[0075]
根据本发明的具体实施例,优选本发明所述hdn-ls-gel的处方为:0.1g橙皮苷、0.743g磷脂、0.316g胆固醇、50g卡波姆940、200gβ-葡聚糖、50g香菇多糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000g,制备成1000支hdn-ls-gel。
[0076]
根据本发明的具体实施例,优选本发明所述hdn-ls-gel的制备方法包含的步骤如
下:
[0077]
步骤(1):分别称取0.743g磷脂、0.316g胆固醇溶解于1000ml氯仿溶液中,称取0.1g橙皮苷溶解于1000ml甲醇溶液中,将上述两种溶液混合均匀,减压浓缩去除溶剂,得到第一混合物;
[0078]
步骤(2):在步骤(1)得到的第一混合物中加入2500g磷酸盐缓冲溶液水化,短时水浴超声至脂质膜脱落完全后将其置于高压均质机中,150bar,循环6次,再用适量磷酸盐缓冲溶液定容至4000g,得橙皮苷脂质体(hdn-ls);
[0079]
步骤(3):称取50g卡波姆940加入步骤(2)得到的橙皮苷脂质体中,于4℃冰箱中冷藏过夜,使其充分溶胀后,再加入200gβ-葡聚糖、50g香菇多糖,用适量的三乙醇胺调ph至6.5,加适量磷酸盐缓冲溶液,加至共5000g,灌装制备成1000支本发明所述的橙皮苷脂质体凝胶剂(hdn-ls-gel)。
[0080]
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。本发明所用试剂和原料均市售可得。
[0081]
根据本发明的具体实施例,本发明所述的重量份,其重量单位可为吨。
[0082]
根据本发明的具体实施例,本发明所述的重量份,其重量单位可为公斤或千克。
[0083]
根据本发明的具体实施例,本发明所述的重量份,其重量单位可为克。
[0084]
根据本发明的具体实施例,本发明所述的重量份,其重量单位可为毫克。
[0085]
根据本发明的具体实施例,本发明所述的重量份,其重量单位可为微克。
[0086]
对本发明所述的制备方法的步骤(2)制备成的橙皮苷脂质体,在透射电镜下形态观察结果显示,其多为球形或类球形,外观圆整,粒径较小,分布较均匀。
[0087]
对本发明所述的制备方法的步骤(3)制备成的橙皮苷脂质体凝胶剂进行质量评价,经外观检测显示本发明所述的橙皮苷脂质体凝胶剂为乳白色、表面光滑、有光泽、半透明、质地细腻,易于涂布的半固体制剂。
[0088]
根据本发明的实施例,本发明所述的橙皮苷脂质体凝胶制剂,其中所述橙皮苷脂质体的微粒粒径为124.2至426.5nm。
[0089]
根据本发明的具体实施例,本发明所述的橙皮苷脂质体凝胶制剂,优选所述橙皮苷脂质体的微粒平均粒径207.87
±
13.27nm。
[0090]
在本发明的第三个方面,本发明提供了一种橙皮苷脂质体凝胶剂的用途,该橙皮苷脂质体凝胶剂用于制备成延缓皮肤衰老、美白抗皱的药物或者化妆品。
[0091]
根据本发明的实施例制备得到的橙皮苷脂质体凝胶剂,其对皮肤无刺激性作用。
[0092]
利用本发明所述的橙皮苷脂质体凝胶剂用于半乳糖致衰老的小鼠模型药效学评价实验,其结果表明:与空白对照组相比,本发明所述的橙皮苷脂质体凝胶剂使得动物皮肤皱纹产生更少,皮肤光滑度更少,生化指标结果更优,本发明所述的橙皮苷脂质体凝胶剂外用于皮肤,能起到很好的保湿效果、以及延缓衰老的作用。
[0093]
本发明的积极进步效果在于:
[0094]
(1)本发明采用薄膜超声法成功制备较高包封率的橙皮苷脂质体凝胶剂,工艺简单,质量可控,具有良好的应用和开发前景;同时在体外释药和透皮实验中,本发明所述的橙皮苷脂质体凝胶剂较普通橙皮苷凝胶具有较高的累计透过量和皮肤滞留量,本发明所述的橙皮苷脂质体凝胶剂具有明显的缓释效果。
[0095]
(2)本发明所述的橙皮苷脂质体凝胶剂,其将橙皮苷制备成可以供外用的脂质体凝胶剂,其在提高橙皮苷脂质体立体稳定性、减少橙皮苷脂质体聚集的同时,延长了橙皮苷脂质体在皮肤上的作用时间,并在皮肤内形成药物储库,从而持续有效释放橙皮苷,表现出对皮肤有良好的靶向性能,且大大改善了橙皮苷的透皮能力,保障了橙皮苷脂质体凝胶剂临床应用的安全有效、质量可控性,提高了橙皮苷作为局部外用药物的疗效。
[0096]
(3)用于半乳糖致衰老的小鼠模型药效学实验结果表明:与空白对照组相比,本发明所述的橙皮苷脂质体凝胶剂使得动物皮肤皱纹产生更少,皮肤光滑度更少,生化指标结果更优,本发明所述的橙皮苷脂质体凝胶剂可以起到延缓衰老、美白抗皱的作用。
[0097]
(4)本发明的发明人意外的发现,本发明所述的hdn-ls-gel的保湿剂中,β-葡聚糖与香菇多糖按特定比例的组合相对于单一的β-葡聚糖、或单一的香菇多糖,β-葡聚糖与甘油按特定比例的组合相对于单一的β-葡聚糖、或单一的甘油,1,2-戊二醇与甘油按特定比例的组合相对于单一的1,2-戊二醇、或单一的甘油,其保湿性能均是能得到明显的提升。当β-葡聚糖与香菇多糖以重量比为4:1的组合时,保湿效果达到最佳。
附图说明
[0098]
图1为本发明实施例2的hdn-ls高效液相色谱图,其中图ⅰ为空白ls,图ⅱ为hdn标准品,图ⅲ为hdn-ls;
[0099]
图2为本发明实施例24的hdn-ls-gel体外释药及透皮吸收实验(透皮吸收单位面积累计透过量);
[0100]
图3为本发明实施例25的hdn-ls-gel的外观及性状图;
[0101]
图4为本发明实施例25的hdn-ls的透射电镜图;
[0102]
图5为本发明实施例25的hdn-ls粒径分布图;
[0103]
图6为本发明实施例25的hdn-ls电位分布图;
[0104]
图7为本发明实施例26所述对hdn-ls-gel的药效学评价中,he染色结果;
[0105]
图8为本发明实施例26所述对hdn-ls-gel的药效学评价中,间苯二酚碱性品红染色结果;
[0106]
图9为本发明实施例26所述对hdn-ls-gel的药效学评价中,天狼星红染色结果;
[0107]
图10为本发明实施例26所述对氧化物歧化酶(sod)的值测定。
具体实施方式
[0108]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0109]
仪器:za305as电子分析天平(上海赞维衡器有限公司);re-6000型旋转蒸发仪(上海亚荣生化仪器厂);scientz
‑ⅱ
d新芝超声波细胞粉碎机(宁波新芝生物科技股份有限公司);rannie 15/gaulin15高压均质机(汉默泰克流体技术有限公司);1580r多用途高速冷冻离心机(基因有限公司);lc-20at高效液相色谱仪(日本岛津公司);df-101s集热式恒温加热磁力搅拌器(郑州长城科工贸有限公司);ndj-5s旋转式粘度计(上海右一仪器有限公司);zetasizerzs90型激光粒径仪(英国马尔文公司);jem-2100型透射电镜(日本jeol公
司)。
[0110]
药品与试剂:橙皮苷(上海源叶生物科技有限公司,纯度≥98.0%);豆磷脂(北京源华美磷脂科技有限公司,批号:201910130);胆固醇(北京百灵威科技有限公司,批号:lg70s131);卡波姆940(上海麦克林生化科技有限公司,批号:c12058025);甘油(国药集团化学试剂有限公司,20200709);三乙醇胺(天津市博迪化工有限公司,批号20190306);纯净水(杭州娃哈哈集团有限公司),甲醇、乙腈为色谱纯,其他试剂为分析纯。
[0111]
实施例1、橙皮苷脂质体(hdn-ls)的制备
[0112]
1.1橙皮苷脂质体的制备:
[0113]
采用薄膜超声法制备橙皮苷脂质体,其制备方法如下:
[0114]
步骤(1):分别称取7.4mg磷脂、3.2mg胆固醇溶解于10ml氯仿溶液中,称取1mg橙皮苷溶解于10ml甲醇溶液中,将上述两种溶液混合均匀,减压浓缩去除溶剂,得到第一混合物。
[0115]
步骤(2):在步骤(1)得到的第一混合物中加入适量ph=6.5的磷酸盐缓冲溶液水化,短时水浴超声至脂质膜脱落完全后将其置于超声波细胞粉碎仪中冰浴超声,每超声1秒间隔2秒,超声功率150w,超声时间共15min,超声毕,再用适量ph=6.5的磷酸盐缓冲溶液定容至50ml,即得橙皮苷脂质体(hdn-ls)。
[0116]
1.2空白脂质体(ls)的制备:
[0117]
空白脂质体中不加入主药橙皮苷,其制备方法如下:
[0118]
步骤(1):分别称取7.4mg磷脂、3.2mg胆固醇溶解于10ml氯仿溶液中,混合均匀,减压浓缩去除溶剂,得到第一混合物。
[0119]
步骤(2):在步骤(1)得到的第一混合物中加入适量ph=6.5的磷酸盐缓冲溶液水化,短时水浴超声至脂质膜脱落完全后将其置于超声波细胞粉碎仪中冰浴超声,每超声1秒间隔2秒,超声功率150w,超声时间共15min,超声毕,再用适量ph=6.5的磷酸盐缓冲溶液定容至50ml,即得空白脂质体(空白ls)。
[0120]
实施例2、对测定橙皮苷含量的hplc测定方法的研究
[0121]
2.1色谱条件
[0122]
色谱柱:fortis xi c18(250mm
×
4.6mm,5μm);流动相:甲醇-乙腈-4%冰醋酸(16:16:68);柱温:30℃;流速:0.8ml
·
min-1
;检测波长:279.9nm;进样量:10μl。
[0123]
2.2专属性
[0124]
分别取上述实施例1中按第1.1所述制备方法得到的hdn-ls、实施例1中按第1.2所述制备方法得到的空白ls、以及10μg
·
ml-1
的hdn标准品溶液,经0.45μm微孔滤膜过滤后按上述2.1所述的色谱条件进行测定,结果见图1。空白ls中辅料对hdn的含量测定无干扰,说明本方法专属性好。
[0125]
2.3线性关系考察
[0126]
精密称取hdn对照品3.00mg置于100ml棕色容量瓶中,加入适量甲醇溶解后定容至刻度线,摇匀后即得30μg
·
ml-1
对照品贮备液。分别精密吸取贮备液适量,制备浓度为0.1,1,3,5,10,20,30μg
·
ml-1
的系列标准溶液。经0.45μm微孔滤膜过滤后按上述2.1所述的色谱条件进样,各浓度溶液重复进样3次并记录峰面积。以峰面积平均值(a)对浓度(c)进行线性回归,得hdn回归方程为:a=20753561.6c-4283(r=0.9995),结果表明hdn在0.1~30μg
·
ml-1
范围内,其峰面积与浓度呈良好线性关系。
[0127]
2.4精密度
[0128]
精密移取30μg
·
ml-1
hdn标准贮备液,按上述2.1所述的色谱条件连续进样6次测定峰面积,rsd为1.22%,说明仪器精密度良好。
[0129]
2.5回收率
[0130]
精密移取一定量上述2.3的hdn标准贮备液,分别配制低、中、高(1μg
·
ml-1
、10μg
·
ml-1
、20μg
·
ml-1
)浓度的hdn溶液,每个浓度平行配制3份,再精密吸取1ml空白ls分别加入上述溶液中,经0.45μm微孔滤膜过滤后,按上述2.1所述的色谱条件测定各自峰面积。结果低、中、高3种浓度的平均加样回收率分别为99.31%、101.03%、99.51%,rsd分别为1.21%、0.66%、1.15%(n=3),表明实验准确度良好。
[0131]
2.6稳定性
[0132]
精密移取30μg
·
ml-1
的hdn标准贮备液,在室温条件下分别放置0、2、4、8、12h后按上述2.1所述的色谱条件进行含量测定,rsd为1.62%(n=3),说明样品稳定性良好。
[0133]
实施例3、对hdn-ls包封率的测定
[0134]
测定hdn-ls包封率的方法主要有低温超高速离心法、透析法、葡聚糖凝胶柱层析法等。本发明的发明人,在前期开展的实验发现:低温超高速离心法所测hdn-ls的包封率与另外两种方法透析法、葡聚糖凝胶柱层析法所得结果相近,但由于后两者耗时费力,故本发明选择低温超高速离心法进行hdn-ls的分离以测定包封率。
[0135]
采用低温超高速离心法测定hdn-ls的包封率。精密吸取2ml hdn-ls于离心管中,4℃下10000r
·
min-1
离心15min,上清液经0.45μm微孔滤膜过滤后,按上述2.1所述的色谱条件进行含量测定,记为hdn-ls中游离药物含量c
游
。另取1ml hdn-ls用适量甲醇破乳后定容到5ml,按上述2.1所述的色谱条件进行含量测定,记为hdn-ls中药物总量c
总
,按以下公式计算hdn-ls包封率,ee%=(1-c
游
/(c
总
×
5))
×
100%。
[0136]
实施例4、对hdn-ls处方研究
[0137]
4.1单因素考察及相关性分析
[0138]
本实验以平均粒径(size)、pdi、zeta电位、ee%为评价指标,对影响hdn-ls处方中的磷脂与胆固醇质量比(简称磷胆比)、磷脂与hdn质量比(简称磷药比)、探头超声时间、探头超声功率、水合温度、水合时间、水合介质(本发明所述的水合介质具体是指磷酸盐缓冲液)ph值这7种因素分别进行考察;采用spss26.0统计学软件对ee%结果进行双变量pearson相关性分析,为后续响应面实验中因素及水平的选择提供依据。实验设计、结果和相关性分析分别见表1、2、3。
[0139]
表1、单因素实验的因素及水平表
[0140]
[0141][0142]
表2、单因素实验结果
[0143][0144]
表3、hdn-ls包封率及其影响因素的相关性分析
[0145]
[0146][0147]
注:
**.
p《0.01,相关性极显著
[0148]
双变量pearson相关性分析检验结果表明,磷胆比对hdn-ls包封率影响最为显著(r=0.549,p=0.0003《0.01),其余因素对hdn-ls包封率影响不大,各因素对hdn-ls包封率影响的重要程度依次为:磷胆比》磷药比》水合介质ph》探头超声时间》探头超声功率》水合时间》水合温度。因此,确定磷胆比、磷药比、水合介质ph为box-behnken响应面实验考察的三个因素。
[0149]
4.2box-behnkendesign(bbd)响应面法优化及结果
[0150]
4.2.1bbd优化实验设计
[0151]
根据单因素考察实验结果,选择对hdn-ls包封率影响较为显著的磷胆比(x1)、磷药比(x2)、水合介质ph(x3)3个因素为自变量,以包封率(y)为评价指标,根据bbd试验设计原理,采用3因素3水平(-1、0、+1)的响应面分析方法进行分析,bbd实验设计因素及水平见表4,实验设计方案及ee值结果见表5-1,涉及17个处方中磷脂、胆固醇、hdn的具体组成、以及调节水合介质的ph值见表5-2。
[0152]
表4、bbd设计因素及水平表
[0153][0154]
表5-1、涉及17个处方的bbd实验方案及结果
[0155]
[0156][0157]
表5-2、涉及17个处方中磷脂、胆固醇、hdn的具体组成、以及调节水合介质的ph值
[0158]
[0159][0160]
4.2.2模型拟合
[0161]
采用design-expert.v8.0.6.1软件对表5中各因素水平进行多元线性回归和二项式拟合,得到多元二次回归模型为y=0.061096
×
a+0.28655
×
b+4.32222
×
c-0.00729375
×
ab+0.013600
×
ac+0.012150
×
bc-0.020399
×a2-0.023474
×b2-0.033969
×c2-14.68419。对模型采用f检验进行方差分析及模型系数显著性检查,结果见表6及表7。
[0162]
表6、方差分析表
[0163][0164]
表7、误差分析表
[0165][0166]
4.2.3效应面分析
[0167]
方差分析模型的p值《0.05,相关系数显著,表明该模型具有统计学意义;失拟项p值》0.05表明不显著,说明该模型在整个回归区域内拟合良好,可用于后续优化及分析;多元相关系数r2较大,说明相关性好;精密度(adeqprecision)》4,cv《10%,表明该实验的可信度和精确度较高,模型可用于分析。
[0168]
4.2.4效应面优化和预测
[0169]
通过响应面优化设计,优选本发明处方中所述的磷脂与胆固醇的质量比为(1~5):1,磷脂与橙皮苷的质量比为(5~9):1,磷酸盐缓冲液的ph值范围为6.0~7.0。
[0170]
在各因素范围内,以hdn-ls包封率的最大值为目标得到最优处方:磷胆比2.35:1、磷药比7.43:1、水合介质ph6.54,预测最大包封率59.02%。
[0171]
4.2.5验证试验
[0172]
按磷胆比2.35:1、磷药比7.43:1、水合介质ph6.54的最佳处方及按本发明实施例1所述hdn-ls的制备工艺,分别制备3批hdn-ls,测定包封率分别为57.89%、57.63%和59.11%(rsd=1.36%),平均包封率为58.21%与预测值59.02%的偏差为-1.37%,低于5%,说明所建立的bbd效应面模型可靠,具有较好的预测性,最优处方工艺准确可靠。
[0173]
实施例5、本发明所述橙皮苷脂质体凝胶剂(hdn-ls-gel)的制备
[0174]
处方:0.1g橙皮苷、0.743g磷脂、0.316g胆固醇、50g卡波姆940、250g甘油、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000g,制备成1000支hdn-ls-gel。
[0175]
制备方法包含的步骤如下:
[0176]
步骤(1):分别称取0.743g磷脂、0.316g胆固醇溶解于1000ml氯仿溶液中,称取0.1g橙皮苷溶解于1000ml甲醇溶液中,将上述两种溶液混合均匀,减压浓缩去除溶剂,得到第一混合物;
[0177]
步骤(2):在步骤(1)得到的第一混合物中加入2500g磷酸盐缓冲溶液水化,短时水浴超声至脂质膜脱落完全后将其置于高压均质机中,150bar,循环6次,再用适量磷酸盐缓冲溶液定容至4000g,得橙皮苷脂质体(hdn-ls);
[0178]
步骤(3):称取50g卡波姆940加入步骤(2)得到的橙皮苷脂质体中,于4℃冰箱中冷藏过夜,使其充分溶胀后,再加入250g甘油,用适量的三乙醇胺调ph至6.5,加适量磷酸盐缓冲溶液,加至共5000g,灌装制备成1000支本发明所述的橙皮苷脂质体凝胶剂(hdn-ls-gel)。
[0179]
实施例6、hdn-ls-gel的制备
[0180]
处方:0.1g橙皮苷、0.743g磷脂、0.316g胆固醇、50g卡波姆940、250gβ-葡聚糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000g,制备成1000支hdn-ls-gel。
[0181]
制备方法包含的步骤如下:
[0182]
步骤(1):操作同实施例5的步骤(1);
[0183]
步骤(2):操作同实施例5的步骤(2);
[0184]
步骤(3):称取50g卡波姆940加入步骤(2)得到的橙皮苷脂质体中,于4℃冰箱中冷藏过夜,使其充分溶胀后,再加入250gβ-葡聚糖,用适量的三乙醇胺调ph至6.5,加适量磷酸盐缓冲溶液,加至共5000g,灌装制备成1000支本发明所述的橙皮苷脂质体凝胶剂(hdn-ls-gel)。
[0185]
实施例7、hdn-ls-gel的制备
[0186]
处方:0.1g橙皮苷、0.743g磷脂、0.316g胆固醇、50g卡波姆934、250g葫芦巴多糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000g,制备成1000支hdn-ls-gel。
[0187]
制备方法包含的步骤如下:
[0188]
步骤(1):操作同实施例5的步骤(1);
[0189]
步骤(2):在步骤(1)得到的第一混合物中加入2500g磷酸盐缓冲溶液水化,短时水浴超声至脂质膜脱落完全后将其置于高压均质机中,100bar,循环8次,再用适量磷酸盐缓冲溶液定容至4000g,得橙皮苷脂质体(hdn-ls);
[0190]
步骤(3):称取50g卡波姆934加入步骤(2)得到的橙皮苷脂质体中,于4℃冰箱中冷藏过夜,使其充分溶胀后,再加入250g葫芦巴多糖,用适量的三乙醇胺调ph至6.0,加适量磷酸盐缓冲溶液,加至共5000g,灌装制备成1000支本发明所述的橙皮苷脂质体凝胶剂(hdn-ls-gel)。
[0191]
实施例8、hdn-ls-gel的制备
[0192]
处方:0.1g橙皮苷、0.743g磷脂、0.316g胆固醇、50g卡波姆940、250g香菇多糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000g,制备成1000支hdn-ls-gel。
[0193]
制备方法包含的步骤如下:
[0194]
步骤(1):操作同实施例5的步骤(1);
[0195]
步骤(2):操作同实施例5的步骤(2);
[0196]
步骤(3):称取50g卡波姆940加入步骤(2)得到的橙皮苷脂质体中,于4℃冰箱中冷藏过夜,使其充分溶胀后,再加入250g香菇多糖,用适量的三乙醇胺调ph至6.6,加适量磷酸盐缓冲溶液,加至共5000g,灌装制备成1000支本发明所述的橙皮苷脂质体凝胶剂(hdn-ls-gel)。
[0197]
实施例9、hdn-ls-gel的制备
[0198]
处方:0.1g橙皮苷、0.743g磷脂、0.316g胆固醇、50g卡波姆940、125gβ-葡聚糖、125g香菇多糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000g,制备成1000支hdn-ls-gel。
[0199]
制备方法包含的步骤如下:
[0200]
步骤(1):操作同实施例5的步骤(1);
[0201]
步骤(2):操作同实施例5的步骤(2);
[0202]
步骤(3):称取50g卡波姆940加入步骤(2)得到的橙皮苷脂质体中,于4℃冰箱中冷藏过夜,使其充分溶胀后,再加入125gβ-葡聚糖、125g香菇多糖,用适量的三乙醇胺调ph至6.8,加适量磷酸盐缓冲溶液,加至共5000g,灌装制备成1000支本发明所述的橙皮苷脂质体凝胶剂(hdn-ls-gel)。
[0203]
实施例10、hdn-ls-gel的制备
[0204]
处方:0.1g橙皮苷、0.743g磷脂、0.316g胆固醇、50g卡波姆940、200gβ-葡聚糖、50g香菇多糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000g,制备成1000支hdn-ls-gel。
[0205]
制备方法包含的步骤如下:
[0206]
步骤(1):操作同实施例5的步骤(1);
[0207]
步骤(2):操作同实施例5的步骤(2);
[0208]
步骤(3):称取50g卡波姆940加入步骤(2)得到的橙皮苷脂质体中,于4℃冰箱中冷藏过夜,使其充分溶胀后,再加入200gβ-葡聚糖、50g香菇多糖,用适量的三乙醇胺调ph至6.5,加适量磷酸盐缓冲溶液,加至共5000g,灌装制备成1000支本发明所述的橙皮苷脂质体凝胶剂(hdn-ls-gel)。
[0209]
实施例11、hdn-ls-gel的制备
[0210]
处方:0.1g橙皮苷、0.743g磷脂、0.316g胆固醇、50g卡波姆940、50gβ-葡聚糖、200g香菇多糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000g,制备成1000支hdn-ls-gel。
[0211]
制备方法包含的步骤如下:
[0212]
步骤(1):操作同实施例5的步骤(1);
[0213]
步骤(2):操作同实施例5的步骤(2);
[0214]
步骤(3):称取50g卡波姆940加入步骤(2)得到的橙皮苷脂质体中,于4℃冰箱中冷藏过夜,使其充分溶胀后,再加入50gβ-葡聚糖、200g香菇多糖,用适量的三乙醇胺调ph至6.8,加适量磷酸盐缓冲溶液,加至共5000g,灌装制备成1000支本发明所述的橙皮苷脂质体凝胶剂(hdn-ls-gel)。
[0215]
实施例12、hdn-ls-gel的制备
[0216]
处方:0.1g橙皮苷、0.743g磷脂、0.316g胆固醇、50g卡波姆940、125gβ-葡聚糖、125g甘油、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000g,制备成1000支hdn-ls-gel。
[0217]
制备方法包含的步骤如下:
[0218]
步骤(1):操作同实施例5的步骤(1);
[0219]
步骤(2):操作同实施例5的步骤(2);
[0220]
步骤(3):称取50g卡波姆940加入步骤(2)得到的橙皮苷脂质体中,于4℃冰箱中冷藏过夜,使其充分溶胀后,再加入125gβ-葡聚糖、125g甘油,用适量的三乙醇胺调ph至6.7,加适量磷酸盐缓冲溶液,加至共5000g,灌装制备成1000支本发明所述的橙皮苷脂质体凝胶剂(hdn-ls-gel)。
[0221]
实施例13、hdn-ls-gel的制备
[0222]
处方:0.1g橙皮苷、0.743g磷脂、0.316g胆固醇、50g卡波姆940、125g1,2-戊二醇、
125g甘油、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000g,制备成1000支hdn-ls-gel。
[0223]
制备方法包含的步骤如下:
[0224]
步骤(1):操作同实施例5的步骤(1);
[0225]
步骤(2):操作同实施例5的步骤(2);
[0226]
步骤(3):称取50g卡波姆940加入步骤(2)得到的橙皮苷脂质体中,于4℃冰箱中冷藏过夜,使其充分溶胀后,再加入125g1,2-戊二醇、125g甘油,用适量的三乙醇胺调ph至7.0,加适量磷酸盐缓冲溶液,加至共5000g,灌装制备成1000支本发明所述的橙皮苷脂质体凝胶剂(hdn-ls-gel)。
[0227]
实施例14、hdn-ls-gel的制备
[0228]
处方:0.1g橙皮苷、0.743g磷脂、0.316g胆固醇、50g卡波姆940、250g1,2-戊二醇、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000g,制备成1000支hdn-ls-gel。
[0229]
制备方法包含的步骤如下:
[0230]
步骤(1):操作同实施例5的步骤(1);
[0231]
步骤(2):操作同实施例5的步骤(2);
[0232]
步骤(3):称取50g卡波姆940加入步骤(2)得到的橙皮苷脂质体中,于4℃冰箱中冷藏过夜,使其充分溶胀后,再加入250g1,2-戊二醇,用适量的三乙醇胺调ph至7.0,加适量磷酸盐缓冲溶液,加至共5000g,灌装制备成1000支本发明所述的橙皮苷脂质体凝胶剂(hdn-ls-gel)。
[0233]
实施例15、hdn-ls-gel的制备
[0234]
处方:0.1g橙皮苷、0.743g磷脂、0.316g胆固醇、50g卡波姆940、250g银耳多糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000g,制备成1000支hdn-ls-gel。
[0235]
制备方法包含的步骤如下:
[0236]
步骤(1):操作同实施例5的步骤(1);
[0237]
步骤(2):在步骤(1)得到的第一混合物中加入2500g磷酸盐缓冲溶液水化,短时水浴超声至脂质膜脱落完全后将其置于高压均质机中,200bar,循环5次,再用适量磷酸盐缓冲溶液定容至4000g,得橙皮苷脂质体(hdn-ls);
[0238]
步骤(3):称取50g卡波姆940加入步骤(2)得到的橙皮苷脂质体中,于4℃冰箱中冷藏过夜,使其充分溶胀后,再加入250g银耳多糖,用适量的三乙醇胺调ph至7.5,加适量磷酸盐缓冲溶液,加至共5000g,灌装制备成1000支本发明所述的橙皮苷脂质体凝胶剂(hdn-ls-gel)。
[0239]
实施例16、hdn-ls-gel的制备
[0240]
处方:0.1g橙皮苷、0.743g磷脂、0.316g胆固醇、50g卡波姆940、250g羧甲基海藻糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000g,制备成1000支hdn-ls-gel。
[0241]
制备方法包含的步骤如下:
[0242]
步骤(1):操作同实施例5的步骤(1);
[0243]
步骤(2):操作同实施例5的步骤(2);
[0244]
步骤(3):称取50g卡波姆940加入步骤(2)得到的橙皮苷脂质体中,于4℃冰箱中冷藏过夜,使其充分溶胀后,再加入250g羧甲基海藻糖,用适量的三乙醇胺调ph至6.2,加适量
磷酸盐缓冲溶液,加至共5000g,灌装制备成1000支本发明所述的橙皮苷脂质体凝胶剂(hdn-ls-gel)。
[0245]
实施例17、hdn-ls-gel的制备
[0246]
处方:0.01g橙皮苷、0.0743g磷脂、0.0316g胆固醇、5g卡波姆940、20gβ-葡聚糖、5g香菇多糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共500g,制备成100支hdn-ls-gel。
[0247]
制备方法包含的步骤如下:
[0248]
步骤(1):分别称取0.0743g磷脂、0.0316g胆固醇溶解于100ml氯仿溶液中,称取0.01g橙皮苷溶解于100ml甲醇溶液中,将上述两种溶液混合均匀,减压浓缩去除溶剂,得到第一混合物;
[0249]
步骤(2):在步骤(1)得到的第一混合物中加入250g磷酸盐缓冲溶液水化,短时水浴超声至脂质膜脱落完全后将其置于超声波细胞粉碎仪中冰浴超声,每超声1秒间隔2秒,超声功率150w,超声时间共15min,超声毕,再用适量磷酸盐缓冲溶液定容至400g,得橙皮苷脂质体(hdn-ls);
[0250]
步骤(3):称取5g卡波姆940加入步骤(2)得到的橙皮苷脂质体中,于4℃冰箱中冷藏过夜,使其充分溶胀后,再加入20gβ-葡聚糖、5g香菇多糖,用适量的三乙醇胺调ph至6.5,加适量磷酸盐缓冲溶液,加至共500g,灌装制备成100支本发明所述的橙皮苷脂质体凝胶剂(hdn-ls-gel)。
[0251]
实施例18、hdn-ls-gel的制备
[0252]
处方:0.01g橙皮苷、0.0743g磷脂、0.0316g胆固醇、5g卡波姆940、12.5gβ-葡聚糖、12.5g甘油、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共500g,制备成100支hdn-ls-gel。
[0253]
制备方法包含的步骤如下:
[0254]
步骤(1):操作同实施例17的步骤(1);
[0255]
步骤(2):操作同实施例17的步骤(2);
[0256]
步骤(3):称取5g卡波姆940加入步骤(2)得到的橙皮苷脂质体中,于4℃冰箱中冷藏过夜,使其充分溶胀后,再加入12.5gβ-葡聚糖、12.5g甘油,用适量的三乙醇胺调ph至6.5,加适量磷酸盐缓冲溶液,加至共500g,灌装制备成100支本发明所述的橙皮苷脂质体凝胶剂(hdn-ls-gel)。
[0257]
实施例19、hdn-ls-gel的制备
[0258]
处方:0.05g橙皮苷、0.372g磷脂、0.158g胆固醇、25g卡波姆940、125gβ-葡聚糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000g,制备成1000支hdn-ls-gel。
[0259]
制备方法包含的步骤如下:
[0260]
步骤(1):分别称取0.372g磷脂、0.158g胆固醇溶解于500ml氯仿溶液中,称取0.05g橙皮苷溶解于500ml甲醇溶液中,将上述两种溶液混合均匀,减压浓缩去除溶剂,得到第一混合物;
[0261]
步骤(2):在步骤(1)得到的第一混合物中加入2500g磷酸盐缓冲溶液水化,短时水浴超声至脂质膜脱落完全后将其置于高压均质机中,150bar,循环6次,再用适量磷酸盐缓冲溶液定容至4000g,得橙皮苷脂质体(hdn-ls);
[0262]
步骤(3):称取25g卡波姆940加入步骤(2)得到的橙皮苷脂质体中,于4℃冰箱中冷藏过夜,使其充分溶胀后,再加入125gβ-葡聚糖,用适量的三乙醇胺调ph至6.5,加适量磷酸
盐缓冲溶液,加至共5000g,灌装制备成1000支本发明所述的橙皮苷脂质体凝胶剂(hdn-ls-gel)。
[0263]
实施例20、hdn-ls-gel的制备
[0264]
处方:0.05g橙皮苷、0.372g磷脂、0.158g胆固醇、25g卡波姆940、75gβ-葡聚糖、50g香菇多糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000g,制备成1000支hdn-ls-gel。
[0265]
制备方法包含的步骤如下:
[0266]
步骤(1):操作同实施例19的步骤(1);
[0267]
步骤(2):操作同实施例19的步骤(2);
[0268]
步骤(3):称取25g卡波姆940加入步骤(2)得到的橙皮苷脂质体中,于4℃冰箱中冷藏过夜,使其充分溶胀后,再加入75gβ-葡聚糖、50g香菇多糖,用适量的三乙醇胺调ph至6.5,加适量磷酸盐缓冲溶液,加至共5000g,灌装制备成1000支本发明所述的橙皮苷脂质体凝胶剂(hdn-ls-gel)。
[0269]
实施例21、hdn-ls-gel的制备
[0270]
处方:0.3g橙皮苷、2.229g磷脂、0.948g胆固醇、150g卡波姆940、750gβ-葡聚糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000g,制备成1000支hdn-ls-gel。
[0271]
制备方法包含的步骤如下:
[0272]
步骤(1):分别称取2.229g磷脂、0.948g胆固醇溶解于3000ml氯仿溶液中,称取0.3g橙皮苷溶解于3000ml甲醇溶液中,将上述两种溶液混合均匀,减压浓缩去除溶剂,得到第一混合物;
[0273]
步骤(2):在步骤(1)得到的第一混合物中加入2500g磷酸盐缓冲溶液水化,短时水浴超声至脂质膜脱落完全后将其置于高压均质机中,150bar,循环7次,再用适量磷酸盐缓冲溶液定容至4000g,得橙皮苷脂质体(hdn-ls);
[0274]
步骤(3):称取150g卡波姆940加入步骤(2)得到的橙皮苷脂质体中,于4℃冰箱中冷藏过夜,使其充分溶胀后,再加入750gβ-葡聚糖,用适量的三乙醇胺调ph至6.5,加适量磷酸盐缓冲溶液,加至共5000g,灌装制备成1000支本发明所述的橙皮苷脂质体凝胶剂(hdn-ls-gel)。
[0275]
实施例22、hdn-ls-gel的制备
[0276]
处方:0.3g橙皮苷、2.229g磷脂、0.948g胆固醇、150g卡波姆940、600gβ-葡聚糖、150g香菇多糖、适量的三乙醇胺、以及磷酸盐缓冲溶液,加至共5000g,制备成1000支hdn-ls-gel。
[0277]
制备方法包含的步骤如下:
[0278]
步骤(1):操作同实施例21的步骤(1);
[0279]
步骤(2):操作同实施例21的步骤(2);
[0280]
步骤(3):称取25g卡波姆940加入步骤(2)得到的橙皮苷脂质体中,于4℃冰箱中冷藏过夜,使其充分溶胀后,再加入600gβ-葡聚糖、150g香菇多糖,用适量的三乙醇胺调ph至6.5,加适量磷酸盐缓冲溶液,加至共5000g,灌装制备成1000支本发明所述的橙皮苷脂质体凝胶剂(hdn-ls-gel)。
[0281]
实施例23、皮肤水分含量(含水量)测定
[0282]
使用电动剃毛器在小鼠背部中心位置处脱毛3cm
×
5cm,模型对照组(衰老模型组)每天颈背部皮下注射同等剂量500mg/(kg
·
d)的d-半乳糖溶液,其余小组注射同等剂量等浓度的d-半乳糖溶液,给药组分别涂抹含有不同保湿剂的hdn-ls-gel(根据本发明实施例5~实施例17所述的hdn-ls-gel组)。连续涂抹42天,每三天使用剃毛器在原部位进行脱毛。观察皮肤状况,并于第42天将小鼠眼眶取血后处死,将给药处皮肤剥离,取小鼠颈背部脱毛区皮肤组织约0.1g,除去皮下组织精密称量湿重,于80℃烘箱烘烤24h后称量干重,计算各组皮肤含水量。计算公式如下:皮肤含水量(%)=(皮肤湿重-皮肤干重)/皮肤湿重
×
100%。测定结果见表8。
[0283]
表8、皮肤含水量(%)测定结果
[0284]
[0285][0286][0287]
由上述表8结果可以看出,衰老模型组小鼠的皮肤含水量(百分比)均低于本发明实施例5~实施例17所述hdn-ls-gel的给药组,本发明所述的实施例5~实施例17所述hdn-ls-gel给药组的皮肤含水量状态比衰老模型组均有不同程度的改善。
[0288]
本发明的发明人意外的发现,本发明所述的hdn-ls-gel的保湿剂中,β-葡聚糖与香菇多糖按特定比例的组合相对于单一的β-葡聚糖、或单一的香菇多糖,β-葡聚糖与甘油按特定比例的组合相对于单一的β-葡聚糖、或单一的甘油,1,2-戊二醇与甘油按特定比例的组合相对于单一的1,2-戊二醇、或单一的甘油作为保湿剂,其保湿性均是能得到了明显提升。根据皮肤含水量的结果,本发明的保湿剂为选自:β-葡聚糖、香菇多糖、甘油、1,2-戊二醇、葫芦巴多糖、银耳多糖、羧甲基海藻糖、β-葡聚糖与香菇多糖的组合、或β-葡聚糖与甘油的组合、或1,2-戊二醇与甘油的组合,优选保湿剂的组合为:β-葡聚糖与香菇多糖的组合、或β-葡聚糖与甘油的组合、或1,2-戊二醇与甘油的组合,优选保湿剂选自为:β-葡聚糖与香菇多糖以重量比为1:1的组合;或选自为:β-葡聚糖与香菇多糖以重量比为4:1的组合;或选自为:1,2-戊二醇与甘油以重量比为1:1的组合。
[0289]
实施例24、对hdn-ls-gel的离体皮肤透皮实验
[0290]
spf级昆明小鼠(6~8周),雄性,体质量(20
±
2)g,合格证号:42010200005587,由湖北省试验动物研究中心提供,生产许可证号:scxk(鄂)2017-0012。
[0291]
取健康昆明种雄性小鼠,刮去腹毛后处死并立即剥离腹部皮肤,小心去除皮下脂肪和结缔组织,用生理盐水洗净后剪成大小均匀的方块(4cm
×
4cm)备用。采用直立式franz扩散池,用弹簧夹将处理好的小鼠皮肤固定在franz扩散池的接收池与供给池之间,角质层面向供给池朝上放置,接收池中加入转子及生理盐水,注意排尽皮肤下面气泡。将组装好的扩散池放入磁力搅拌器中,分别取hdn-ls和hdn溶液各5ml,hdn-ls-gel和hdn-gel各5.3g,将各组样品分别置于供给池中,并用扎若干个通气小孔的保鲜膜封口。32℃水浴恒温,300r/min电磁恒速搅拌,分别于1,2,3,5,7,9,12,24h从接收池中取样1ml同时补加同温等量释放介质。经0.45μm微孔滤膜过滤后按上述实施例2第2.1项下的色谱条件进行含量测定,计算单位面积累计透过量qn,结果见图2。
[0292]
24h后取下皮肤并将其表面用脱脂棉擦拭干净,生理盐水洗净残留样品,常温晾干后剪去未与样品接触的多余鼠皮。将剩余鼠皮用剪刀充分剪碎后放入10ml玻璃匀浆器,并加入适量甲醇萃取,将皮肤组织研碎后定容至5ml,提取液经0.45μm微孔滤膜过滤后按上述实施例2第2.1项下的色谱条件进行含量测定,计算单位面积皮肤滞留量。结果见表9。图2和表9结果表明,与hdn-gel和hdn溶液相比,hdn-ls-gel能显著提高hdn的皮肤透过量和滞留量,有利于hdn在皮肤发挥局部治疗作用。
[0293]
表9、hdn-ls-gel单位面积皮肤滞留量(24h)
[0294][0295]
本发明的实验中,hdn-ls-gel透皮效果强于hdn-gel,且整个过程基本呈线性。表明脂质体对hdn原料药起到了明显的增溶作用。
[0296]
实施例25、对hdn-ls-gel的质量评价
[0297]
25.1外观及性状
[0298]
取按照上述实施例10制备的hdn-ls-gel适量,置于黑色背景下观察,结果hdn-ls-gel为乳白色,表面光滑,有光泽,半透明,质地细腻,易于涂布的半固体制剂,详见图3。
sod)比色法测试盒(wst-1法)(elabscience biotechnology公司)操作,测sod值。
[0314]
测定结果见表10、以及图10。
[0315]
表10
[0316][0317]
由表10可以看出,衰老模型组小鼠皮肤sod含量低于空白对照组,给药组(根据本发明实施例10制备得到的hdn-ls-gel)则比衰老模型组有不同程度的改善。
[0318]
同样的,利用本发明实施例5~实施例9、实施例11~实施例23制备得到的hdn-ls-gel,也起到了与本发明实施例10制备得到的hdn-ls-gel相似的保湿效果、以及延缓衰老的作用。
[0319]
综上,本发明通过动物模型实验,对hdn-ls-gel的药效学评价进行了非常好的证明,本发明所述的橙皮苷脂质体凝胶剂,其外用于皮肤,能起到很好的保湿效果、以及延缓衰老的作用,其可用于制备成延缓衰老、美白抗皱的药物或化妆品。
[0320]
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
[0321]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1