对香豆酸修饰延伸因子在抑制细菌生长中的应用
1.本发明属于医药领域,尤其是涉及对香豆酸修饰延伸因子在抑制细菌生长中的应用。
背景技术:
2.目前日益增加的细菌耐药性是一个严重的全球健康问题,人类急切需要新型的抗生素来应对耐药性的细菌感染,比如阪崎肠杆菌。阪崎肠杆菌是最常见的可导致新生儿坏死性小肠结肠炎的病原体之一。许多国家分离出耐药性阪崎肠杆菌,包括环境和临床分离株,对万古霉素、青霉素、苯唑西林、林可酰胺等具有耐药性。例如,在印度,从新生儿中分离的阪崎肠杆菌对头孢菌素、氟喹诺酮和氨基糖苷类药物具有耐药性。从美国田纳西州的厨房样本中分离出对青霉素、四环素、环丙沙星和萘啶酸具有耐药性的菌株,中国报告了多种耐药菌株,导致一名新生儿出现严重脑膜炎病例。多重耐药菌株的出现促使研究人员将注意力转向传统医学,寻找替代品。据报道,叶和花的挥发油对阪崎肠杆菌具有抗菌活性。水溶性麝香碱的种子提取物对阪崎肠杆菌有效。肉桂中的一种成分反式肉桂醛(tc)可以控制阪崎镰刀菌。tc还抑制生物膜合成,因此可用于防止婴儿配方奶粉喂养设备上的阪崎肠杆菌生物膜。某些其他天然产品,如诃子和甘草,对各种微生物有效。越来越多的体外研究和流行病学研究强烈表明,酚类化合物具有抗菌、抗突变和抗炎活性,食用各种酚类化合物可显著降低严重健康疾病的风险。
3.虽然越来越多的抑菌物质被发现,但是,其抑菌的作用机理仍然缺乏了解。现在,蛋白质组技术越来越多的应用于研究抑菌物质对于细菌代谢的影响,然而,抑菌化合物对细菌的具体作用靶点仍不清楚。这限制了对抑菌化合物的进一步结构的优化。
技术实现要素:
4.有鉴于此,本发明旨在克服现有技术中的缺陷,提出对香豆酸修饰延伸因子在抑制细菌生长中的应用。
5.为达到上述目的,本发明的技术方案是这样实现的:
6.一种对香豆酸修饰延伸因子在抑制细菌生长中的应用,对香豆酸通过对细菌的延伸因子进行修饰从而抑制细菌的生长。
7.进一步,所述的延伸因子为阪崎肠杆菌的a7mki5蛋白质;所述的延伸因子为肺炎克雷伯菌的a6tex7蛋白质。
8.进一步,所述的修饰步骤为脱酰胺。
9.进一步,所述的细菌为革兰氏阴性杆菌;优选的,所述的细菌为阪崎肠杆菌、大肠杆菌、铜绿假单胞菌、肺炎链球菌、金黄色葡萄球菌或肺炎克雷伯菌中的一种。
10.一种确定抑菌化合物结合蛋白和作用氨基酸位点的方法,包括如下步骤:
11.(1)制备蛋白质样品:将抑菌化合物作用于细菌,然后裂解细菌,收集分解后的蛋白质;
12.(2)蛋白质预处理:对收集到的蛋白质进行变性、水解、纯化后得到多肽样品;
13.(3)多肽分析:对得到的多肽样品的分子量和丰度进行定量分析;
14.(4)蛋白质组分析:对所述的步骤(3)中得到的数据进行蛋白修饰分析,得到发生修饰的蛋白质和作用位点;
15.(5)分子对接:将所述的步骤(4)中得到的蛋白质与抑菌化合物进行分子对接,确认蛋白质和抑菌化合物的相互作用位点。
16.进一步,所述的步骤(1)中的抑菌化合物为对香豆酸。
17.进一步,所述的步骤(1)中的细菌为革兰氏阴性杆菌;优选的,所述的细菌为阪崎肠杆菌、大肠杆菌、铜绿假单胞菌、肺炎链球菌、金黄色葡萄球菌或肺炎克雷伯菌中的一种。
18.进一步,所述的步骤(4)中的修饰为脱酰胺;所述的步骤(5)中得到的蛋白质为延伸因子。
19.所述的方法用途,所述的方法在制备抑菌药物和/或杀菌剂中的应用。
20.进一步,所述的方法在确定抑菌药物或杀菌剂的结合蛋白与作用位点中的应用。
21.相对于现有技术,本发明具有以下优势:
22.本发明所述的对香豆酸影响细菌的延伸因子的脱酰胺,从而导致细菌的生长抑制,提供了一个新的抑菌物质和/或杀菌剂的作用机理研究的技术路线,并且鉴定出的延伸因子的酰胺基团可以作为未来新型药物开发研究的作用靶点。
附图说明
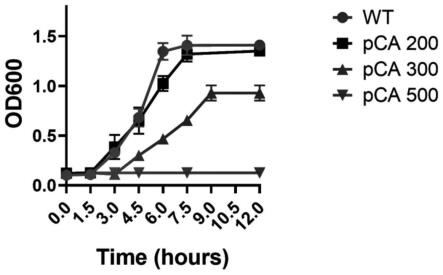
23.图1为本发明实施例1所述的抑菌化合物对细菌在体外和体内的影响:1-a为三种不同浓度(mg/l)的阪崎肠杆菌的生长曲线(n=3)图,1-b为感染大鼠的存活率(n=12),1-c为感染后一天大鼠血液的阪崎肠杆菌的细菌量(n=4),1-d为感染后一天大鼠肾脏的阪崎肠杆菌的细菌量(n=4),1-e为感染后一天大鼠脾脏的阪崎肠杆菌的细菌量(n=4)。
24.图2为本发明实施例2所述的蛋白质组学分析细菌阪崎肠杆菌暴露于抑菌物质pca的影响:2-a为火山图(2分钟),2-b为火山图(30分钟),2-c为火山图(1小时),2-d为火山图(2小时),2-e为火山图(2小时没有暴露于pca),2-f为丰度变化;
25.图3为本发明实施例3所述的使用模糊c-means(fcm)算法对不同阶段的蛋白质表达谱进行聚类:3-a为上调趋势蛋白,3-b为下调趋势蛋白;
26.图4为本发明实施例3所述的对上调和下调的蛋白质进行go分析;
27.图5为本发明实施例4所述的对上调和下调蛋白的kegg通路分析;
28.图6为本发明实施例6所述的蛋白质和pca复合物的分子对接的示意图:其中,6-a为a7mgu5/pca复合物,6-b为a7mki5/pca复合物,6-c为a7mkm7/pca复合物;
29.图7为本发明实施例7所述的肺炎克雷伯菌的蛋白质a6tex7和pca复合物的分子对接的示意图。
具体实施方式
30.除有定义外,以下实施例中所用的技术术语具有与本发明所属领域技术人员普遍理解的相同含义。以下实施例中所用的试验试剂,如无特殊说明,均为常规生化试剂;所述实验方法,如无特殊说明,均为常规方法。
31.下面结合实施例来详细说明本发明。
32.实施例1确定pca的抑菌作用
33.本发明中使用了国际标准菌株cronobacter sakazakii baa-894(atcc,美国)。细菌被储存在含有15%甘油的lb培养基(oxoid,英国)中,温度为-80℃。为了启动所有的实验,将菌株在lb中培养过夜。然后将细菌在含有不同浓度的对香豆素的lb培养基中稀释到106cfu/ml;通过连续稀释细菌并在lb琼脂上电镀来监测细菌的生长或失活。将平板在37℃下培养24-48小时,然后对菌落总数(cfu)进行编号。
34.图1-a显示了pca对阪崎肠杆菌生长的影响。对照组的细菌在20分钟后开始指数式增长,并在6小时后达到拐点。阪崎肠杆菌在浓度为300μg/ml pca时受到抑制,9小时后达到稳定期。当pca的浓度达到500μg/ml时,细菌的生长被完全抑制了。结果表明,pca可以抑制阪崎肠杆菌的体外生长。我们还研究了pca在体内的效果,结果如图1-b所示。我们用大鼠作为感染模型。细菌细胞被清洗并重新悬浮于pbs(vazyme,中国)。将5
×
109个菌落形成单位(cfu)灌胃给3日龄雌性sprague dawley大鼠(6只/组)。在适当的情况下,在换菌2小时后,以1毫克/克体重的剂量给予对香豆酸,同时给予同等体积的生理盐水作为对照。为了分析细菌在血液和器官中的定植情况,感染24小时后处死大鼠;将器官在冰冷的pbs中均质化并连续稀释。通过在lb琼脂上涂布稀释液来确定细菌数量。在pca治疗组中,小狗在细菌感染2小时后接受pca(1毫克/克重)的灌胃治疗,同时给予同等体积的生理盐水作为对照。结果显示,pca可以明显提高感染大鼠的存活率。此外,pca处理明显降低了感染后一天牺牲的大鼠血液、肝脏和脾脏中的阪崎肠杆菌的细菌密度,如图1-c、1-d与1-e所示。总之,这些结果表明,pca可以有效地抑制细菌在体内和体外的生长。
35.实施例2阪崎肠杆菌暴露于pca的蛋白质组学分析
36.细菌悬浮液在4℃下以12,000g离心2分钟,用pbs洗涤两次。加入蛋白酶抑制剂鸡尾酒(beyong,中国),用超声波(200w,工作3秒,停顿3秒)裂解细菌10分钟。将提取的蛋白质离心,得到上清液(21,000g,4℃下15分钟)。用微孔过滤器(0.22μm)清理蛋白质,并将提取的蛋白质储存在-80℃以备随后的ms分析。
37.在微量离心管中的蛋白质溶液中加入四分之一的8m尿素(aladdin,中国),使蛋白质样品(100μg)变性。加入50mm碳酸氢铵(aladdin,中国),使总体积达到100μl。将该混合物在37℃下孵育30分钟。随后,用1μl的200mm dtt(aladdin,中国)还原蛋白样品,并在60℃孵育30分钟。冷却到室温5分钟。加入1ul500mm碘乙酰胺(aladdin,中国)对蛋白质进行烷基化。烷基化反应在室温下无光摇动30分钟。然后加入dtt(1μl,200mm),并通过涡旋10分钟来淬灭该反应。随后用胰蛋白酶(thermo,美国)消化蛋白质(4μl,0.25μg/μl)。样品在12,000g下离心1分钟,反应液在37℃下孵化过夜。加入10%的三氟乙酸(aladdin,中国)至最终浓度为0.4%,终止消化。最后,消化后的样品用c18固相萃取柱(millipore,美国)进行脱盐,并在真空下干燥。真空干燥后的样品被提交给ms分析。
38.消化后的多肽样品用q exactive plus质谱仪(thermo,美国)和带有easy纳米电喷雾接口的easy液相色谱仪(easy nlc 1200,thermo scientific)进行分析。液相色谱系统配备了一个thermo scientific acclaim pepmap纳米捕获柱(c18,5微米,100埃,100微米
×
2厘米)和一个thermo scientific easy-spray柱(pepmap rslc,c18,2微米,100埃,50微米
×
15厘米)。纳米液相色谱法使用溶剂a(0.1%甲酸)和溶剂b(80%ch3cn/0.1%甲酸),
其梯度如下。0-8%b 3分钟,8-28%b 42分钟,28-38%b 5分钟,38-100%b 10分钟。质谱对照uniprot数据库进行检索,每个样品的质谱原始数据用maxquant(2.0.3.1版)进行检索。相关参数和说明如下:样品中半胱氨酸的碳酰胺甲基化被设定为固定修饰。氧化(m)被设定为可变修饰。搜索以胰蛋白酶裂解特异性进行,允许有两个误裂事件。前体质量公差被设定为10ppm,片段质量公差为0.02da。蛋白质和多肽鉴定的最大错误发现率(fdr)被设定为1.0%。蛋白质鉴定是基于至少一个独特的肽鉴定。蛋白质的定量是以蛋白质独特肽的中位数计算的。
39.使用无标签相对定量质谱法,我们系统地监测了阪崎肠杆菌在接触pca后2分钟、30分钟、1小时和2小时的蛋白质表达情况,如图2所示。在初始阶段和正常生长2小时后没有暴露于pca的阪崎肠杆菌被设定为对照。我们得到了15621个独特的肽,与1553个蛋白质相匹配。其中,905个蛋白质符合定量要求。根据差异表达蛋白的折叠变化超过2倍的标准,采用t检验(p<0.05)来确定上调和下调的肽段,如图2所示。与对照组相比,2分钟的pca暴露可以明显改变39种蛋白质丰度,而且丰度变化随着pca暴露时间的延长而增加,如图2-f所示。pca处理2小时后,有90个上调的蛋白质和113个下调的蛋白质。然而,令人惊讶的是,在标准生长控制2小时后,细菌蛋白质组显示出更多的变化。这表明,延长时间和药物处理可以引起蛋白质组的变化。
40.实施例3模糊聚类和go分析
41.为了区分pca诱导的蛋白质组变化和时间诱导的蛋白质组变化,我们使用模糊c-均值(fcm)算法对不同时间阶段的蛋白质表达谱进行聚类,如图3所示。一般来说,我们观察到不同的时间模式聚类,代表不同的调节蛋白,表明不同的表达动态。聚类2和4代表下调的蛋白,聚类6和7代表上调的蛋白,聚类1、3和5代表显示双峰表达模式的蛋白,而聚类8代表表达变化不大的蛋白。当通过叠加正常生长2小时后的蛋白质表达量排除时间干扰后,一些蛋白质连续上调或下调,分别聚类于第7和第8群。上调和下调的蛋白分别占到905个蛋白总数的11%和17%。在核心改变的蛋白质中(成员资格>0.58),40%被下调,是上调的3.3倍。总的来说,我们发现pca引起了蛋白质表达的变化,下调的蛋白质多于上调的蛋白质,这与观察到的暴露在pca下的细菌生长受到的抑制相一致。
42.实施例4 kegg路径分析
43.通过进行kegg途径富集分析,下调的蛋白在7条途径中明显富集(p<0.05),上调的蛋白仅在一条途径中富集,如图5所示。pca扭曲了l-苯丙氨酸、酪氨酸和色氨酸的生物合成。在下调的七条途径中,"新陈代谢"是最常见的,包括几个子类。"糖醛酸和二羧酸代谢"、"果糖和甘露糖代谢"、"精氨酸和脯氨酸代谢"、"甘氨酸、丝氨酸和苏氨酸的代谢"。此外,一些重要的类别也明显富集(例如,"磷酸转移酶系统"、"氧化磷酸化")。这些结果说明,pca可能会抑制细胞的能量代谢,而氨基酸代谢的平衡可能会被扰乱。
44.实施例5修饰蛋白组分析
45.除了对生物代谢途径的调节外,化学品对蛋白质的翻译后修饰也很重要,但往往被忽视。我们表征了pca的翻译后效应,包括乙酰化、磷酸化、甲基化和脱酰胺化。然而,除了脱酰胺化的变化,我们没有发现任何其他类型的重要修饰变化。我们发现有三个蛋白质受到pca的影响,明显增加了脱酰胺作用。这些包括a7mki5:64位氨基酸的l-天冬酰胺化、a7mgu5:43位氨基酸的l-天冬酰胺化、a7mkm7:379位氨基酸的l-天冬酰胺化。值得注意的
2.5对所有受体蛋白进行处理,包括去除水分子,盐离子以及小分子。随后设置对接盒子,使用pymol插件center_of_mass.py定义活性位点残基的质心为对接盒子的中心,盒子边长设定为22.5埃。此外,使用adfrsuite 1.0将所有处理好后的小分子以及受体蛋白转换为autodock vina 1.1.2对接必须的pdbqt格式。对接时,全局搜索的详尽度设为20,其余参数保持默认设置。输出的打分最高的对接构象被我们认为是结合构象,最后使用pymol 2.5对接结果进行可视化分析,如图7所示。
54.我们发现pca与肺炎克雷伯菌的延伸因子asn-136具有氢键相互作用,而氢键相互作用可以导致asn、gln氨基酸的脱酰胺。这些结果说明pca与延伸因子氨基酸的酰胺基团的相互作用是普遍存在的。
55.以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1