一种快速降解乙醇的仿生MOF纳米胶囊的制备及其在酒精中毒治疗中的应用
一种快速降解乙醇的仿生mof纳米胶囊的制备及其在酒精中毒治疗中的应用
技术领域
1.本发明属于仿生纳米胶囊领域,主要涉及一种快速降解乙醇的仿生mof纳米胶囊的制备及其在酒精中毒治疗中的应用。
背景技术:
2.公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
3.酒是人类日常生活中常见的饮品,但是过量饮酒则会导致一系列疾病的产生,例如急性酒精中毒(aai),酒精性肝损伤(ald)以及胃肠道疾病等。根据世界卫生组织统计,因酒精而死亡的男性占6.2%,女性占1.1%。此外,酒精也是人类另一大疾病,癌症的诱因之一,并且已经被世界卫生组织列为一级致癌物。针对目前成年人群中饮酒者的现状,以及过量饮酒对身体造成的危害,寻找一种可以快速解酒的方法是势在必行的。
4.饮酒者最容易出现的疾病是急性酒精中毒和慢性酒精性肝损伤。前者主要是由于一次性摄入过量的酒精,导致肝脏代谢速度远远低于肠胃摄取酒精的速度,而过量的酒精则会进入血液循环影响中枢神经系统造成醉酒,并且乙醇代谢过程中会产生对人体有害的乙醛和自由基等,进一步损伤人体器官,严重时可导致死亡。后者主要是由于长期摄入酒精而对肝脏产生的累积性伤害,可进一步发展成为肝硬化、肝癌等。因此,乙醇、乙醛的大量累积是导致酒精性疾病的主要原因。
5.目前临床上使用的药物,例如:美他多辛片和姜黄素等,都是用来对肝脏进行保护却没有从根本上解决乙醇和乙醛的累积。2018年,卢云峰与其同事以聚乙二醇作为壳,将酶包裹在其中,可以实现稳定且快速的运输到肝脏细胞中,以此增强肝脏解酒的能力,并且效果显著。但是其所用的乙醇氧化酶和乙醛脱氢酶并没有包裹在同一个纳米颗粒中,无法实现双酶之间最快速的级联,导致仍有部分乙醛分子扩散,对人体造成损伤。
技术实现要素:
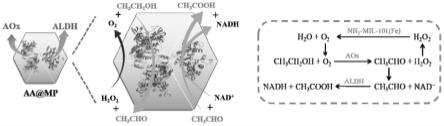
6.对于上述问题,本发明开发了一种介孔型mof材料nh
2-mil-101(fe)-m,用其包裹可以降解乙醇的乙醇氧化酶(aox)和乙醛脱氢酶(aldh),并在其外层偶联上聚乙二醇(peg)外壳,制备得到仿生纳米胶囊aa@mp。乙醇氧化酶和乙醛脱氢酶的负载可以使aa@mp纳米胶囊快速完成对酒精的降解,从根本上解决酒精中毒的问题。降解乙醇过程中产生的过氧化氢会被具有类过氧化氢酶活性的nh
2-mil-101(fe)-m分解产生水和氧气,氧气会进一步促进乙醇氧化酶的反应效率,形成级联。因为两种酶都是偶联在了nh
2-mil-101(fe)-m上,所以乙醇氧化酶分解乙醇产生的乙醛分子可以很快速的被乙醛脱氢酶分解,减少了有害物质的扩散。peg外壳可以提高纳米胶囊的水溶性,促进其在体内运输。此纳米胶囊可以完成对乙醇的快速降解并且最大限度的减少了有害物质的扩散,相信会为酒精中毒的治疗提供新
的策略。
7.为实现上述技术目的,本发明采用如下技术方案:
8.本发明的第一个方面,提供了一种快速降解乙醇的仿生mof纳米胶囊的制备方法,包括:
9.将nh
2-mil-101(fe)粉末分散在含有盐酸的dmf溶液中,加热进行反应,固液分离,收集固体,洗涤、干燥,得到mof-m;
10.将所述mof-m分散在pbs中,加入戊二醛溶液,进行反应,得到ga-mof-m悬浮液;
11.将乙醇氧化酶、乙醛脱氢酶溶解于所述ga-mof-m悬浮液中,在冰浴的条件下搅拌过夜,固液分离,收集沉淀并将沉淀分散在pbs中,得到aa@mof-m悬浮液;
12.将thiol peg carboxyl加入到aa@mof-m悬浮液中,冰浴条件下过夜搅拌,离心收集固体,即得。
13.本发明找到一种可以快速降解乙醇且最大化减少乙醇降解过程中有毒物质的扩散的策略,对解决酒精中毒问题有十分重要的意义。
14.本发明的第二个方面,提供了上述的方法制备的仿生mof纳米胶囊。
15.本发明的第三个方面,提供了上述的仿生mof纳米胶囊在制备治疗酒精中毒的药物中的应用。
16.本发明的有益效果在于:
17.(1)仿生纳米胶囊的形貌表征:如图2中a)所示成功合成了直径在200nm左右的mof-m纳米颗粒。aa@mp仿生纳米胶囊的形貌如图2中b)所示,可以观察到其表面由一层peg外壳所包裹,证明纳米胶囊成功制备。该纳米胶囊形态稳定且分散性较好,尺寸相较mof-m纳米颗粒有所增大,约为210nm左右。
18.(2)双荧光标记的仿生纳米胶囊的荧光共振能量迁移:如图3所示,酶混合溶液被波长为450nm的激光激发后只产生fitc的发射峰,而双荧光标记的仿生纳米胶囊被波长为450nm的激光激发后,会产生fitc和rbitc两者的发射峰,说明fitc的发射能量被rbitc所捕获,证明两种蛋白近距离(≤10nm)偶联到了mof-m纳米颗粒上。
19.(3)aa@mp纳米胶囊的细胞毒性:如图6所示,aa@mp纳米胶囊的浓度高达250μg/ml时,与纳米胶囊孵育的aml12细胞、ea.hy926细胞、j774细胞依然表现出良好的细胞活性,存活率>80%,证明aa@mp纳米胶囊有着良好的体外生物相容性。
20.(4)仿生纳米胶囊降解乙醇和乙醛的能力:aa@mp纳米颗粒上负载了乙醇氧化酶和乙醛脱氢酶,两种酶可以将乙醇逐步降解为对人体无害的乙酸。pbs作为对照组,将mof-m纳米颗粒、aa@mp纳米颗粒、aa@mp和nad+的混合物与乙醇溶液混合后,观察溶液中乙醇和乙醛浓度变化。如图4所示,mof-m组中乙醇和乙醛浓度无明显变化,证明其对乙醇没有降解能力。aa@mp组中乙醇浓度随时间逐渐降低而乙醛浓度随时间逐渐升高,证明纳米胶囊中乙醇氧化酶成功将乙醇分解为乙醛,但由于缺少nad+,乙醛脱氢酶无法降解乙醛。在aa@mp+nad+组中,乙醇浓度逐渐降低的同时乙醛浓度也没有太高的升高,证明在nad+存在的条件下,aa@mp纳米胶囊可以成功将乙醇逐步降解为乙酸,且不会累积过量乙醛。
21.(5)aa@mp纳米胶囊对过氧化氢的清除能力:aa@mp纳米胶囊以金属中心为铁元素的mof-m为双酶偶联的基底,由于铁元素具有类过氧化氢酶活性,所以可以清除乙醇氧化酶降解乙醇过程中产生的过氧化氢。如图5所示,aa@mp纳米胶囊组在降解乙醇过程中累积的
过氧化氢含量与乙醇氧化酶、乙醛脱氢酶和mof-m的混合物组相比含量较低,约为其1/4,证明纳米胶囊在降解乙醇过程中不会产生大量对身体有害的过氧化氢。
22.(6)aa@mp纳米胶囊对酒精环境中细胞的保护能力评估:酒精会损伤细胞活性,aa@mp纳米胶囊快速清除酒精的能力可以对细胞的活性进行一定的保护。如图7所示,三种细胞与各种不同的材料孵育后,aa@mp+nad+组处理的细胞活性最高,分别为50.6%(ea.hy926)、48.3%(j774)、86.5%(aml12),表明aa@mp纳米胶囊可以清除环境中的酒精来达到保护细胞的目的。
23.(7)aa@mp纳米胶囊对急性酒精中毒小鼠的治疗能力评估:将建模成功的急性酒精中毒模型小鼠分为3组,每组数量均为4只。分别用pbs(阳性对照),aa@mp,aa@mp+nad+进行治疗,同时健康小鼠作为阴性对照。如图8所示,pbs组小鼠平均醉酒睡眠时间为143分钟,而aa@mp和aa@mp+nad+组治疗后的小鼠平均醉酒睡眠时间明显低于pbs组且大致相等,约为81分钟。表明aa@mp纳米胶囊可以有效缓解小鼠急性酒精中毒症状。此外,如图9所示,aa@mp+nad+组治疗的小鼠,其血液中乙醇和乙醛含量以及alt和ast水平明显低于其他两组。表明在添加外源性nad+的条件下,aa@mp纳米胶囊可以有效降解小鼠体内的乙醇和乙醛,并且对肝脏具有一定的保护作用。
24.(8)aa@mp纳米胶囊对慢性酒精性肝损伤小鼠的保护能力评估:如图10所示,相较于健康小鼠而言,no binge组的小鼠血液中alt和ast水平和肝脏中tg含量、mda含量均有所升高,而肝脏中gsh含量、sod活性有所降低,表明小鼠经过酒精液体饮食喂养后的小鼠肝功能收到了一定程度的损伤。而在pbs组中,各项指标变化程度更加明显,证明酒精性肝损伤模型的成功构建。经aa@mp,aa@mp+nad+治疗后的小鼠其血液中alt和ast水平和肝脏中tg含量、mda含量均有所下降,肝脏中gsh含量、sod活性有所升高,且aa@mp+nad+组小鼠的变化更为明显。虽然治疗后小鼠的各项指标没有恢复到健康小鼠的状态,但可以证明在添加外源性nad+的条件下,aa@mp纳米胶囊可以对慢性酒精性肝损伤起到一定的保护作用。
25.(9)本技术的操作方法简单、成本低、具有普适性,易于规模化生产。
附图说明
26.构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
27.图1是仿生纳米胶囊的原理机制图;
28.图2是a)mof-m纳米颗代表性tem图片b)仿生纳米胶囊代表性tem图片;
29.图3是aox-fitc/aldh-rbitc@mp的荧光共振能量迁移图片;
30.图4是不同浓度下aa@mp纳米颗粒的细胞毒性;
31.图5是aa@mp纳米胶囊对乙醇和乙醛的降解;
32.图6是aa@mp纳米胶囊对过氧化氢的清除;
33.图7是不同材料对酒精环境中细胞的保护作用;
34.图8是醉酒小鼠睡眠时间对比图;
35.图9是急性酒精中毒模型中各组小鼠血液中乙醇浓度a)、乙醛浓度b)、谷氨酸转氨酶浓度c)、谷草转氨酶浓度d);
36.图10是慢性酒精性肝损伤模型中各组小鼠血液中谷氨酸转氨酶浓度a)、谷草转氨
酶浓度b)、肝脏中甘油三酯含量c)、还原型谷胱甘肽含量d)、超氧化物歧化酶浓度e)、丙二醛含量f)。
具体实施方式
37.应该指出,以下详细说明都是示例性的,旨在对本发明提供进一步的说明。除非另有指明,本发明使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
38.一种快速降解乙醇的仿生mof纳米胶囊的制备方法,包括:
39.将nh
2-mil-101(fe)粉末分散在含有盐酸的dmf溶液中,加热进行反应,固液分离,收集固体,洗涤、干燥,得到mof-m;
40.将所述mof-m分散在pbs中,加入戊二醛溶液,进行反应,得到ga-mof-m悬浮液;
41.将乙醇氧化酶、乙醛脱氢酶溶解于所述ga-mof-m悬浮液中,在冰浴的条件下搅拌过夜,固液分离,收集沉淀并将沉淀分散在pbs中,得到aa@mof-m悬浮液;
42.将thiol peg carboxyl加入到aa@mof-m悬浮液中,冰浴条件下过夜搅拌,离心收集固体,即得。
43.在一些实施例中,nh
2-mil-101(fe)粉末与dmf溶液的用量比为30~40mg:10~15ml。
44.在一些实施例中,加热进行反应的具体条件为70~80℃的条件下反应30~40分钟。
45.在一些实施例中,mof-m与戊二醛溶液的用量比为2~3毫克:100~150mm。
46.在一些实施例中,所述乙醇氧化酶与乙醛脱氢酶的质量比为1:2~2.5。
47.在一些实施例中,所述thiol peg carboxyl与aa@mof-m的质量比为0.35~0.5:1。
48.下面结合具体的实施例,对本发明做进一步的详细说明,应该指出,所述具体实施例是对本发明的解释而不是限定。
49.实施例1
50.材料:六水合氯化铁(fecl3·
6h2o)、2-氨基对苯二甲酸(nh
2-h2bdc)、乙醇氧化酶(aox)、乙醛脱氢酶(aldh)、巯基-peg-羧基(μw=3500da)、罗丹明b异硫氰酸酯(rbitc)、异硫氰酸荧光素(fitc)、烟酰胺腺嘌呤二核苷酸(nad
+
)、3-甲基-2-苯并噻唑啉酮肼(mbth)、cell counting kit-8(cck-8)细胞计数试剂购自sigma-aldrich。二甲基亚砜(dmso)、盐酸(hcl)、乙酸、戊二醛(ga)、n,n-二甲基甲酰胺(dmf)、无水乙醇均购自国药集团药业股份有限公司。乙醇检测试剂盒购自苏州科明生物科技有限公司,过氧化氢(h2o2)检测试剂盒、丙二醛(mda)检测试剂盒购自南京建成生物工程研究所。bicinchoninic acid(bca)蛋白检测试剂盒、甘油三酯(tg)检测试剂盒、超氧化物歧化酶(sod)检测试剂盒、还原型谷胱甘肽(gsh)检测试剂盒购自南京建成生物工程研究所。其他化学品均来自上海源叶生物科技有限公司,无需进一步纯化即可使用。所有实验均使用去离子(di)水(millipore milli-q级,18.2mω)。
51.1、nh
2-mil-101(fe)的合成:采用水热法合成nh
2-mil-101(fe)。将2-氨基对苯二甲酸(0.2g,1.1mmol)和六水合氯化铁(0.297g,1.1mmol)分散在20ml dmf中,然后向溶液中加入5.5mmol的乙酸,超声处理15分钟。将溶液转移到内衬为聚四氟乙烯的高压釜中,在150℃
下反应2小时,将混合物以8000转/分钟的转速离心并收集固体。将收集到的固体在dmf、乙醇和水中离心多次以去处多余的反应物,最后在80℃的真空条件干燥过夜。
52.2、mof-m的合成:将合成的nh
2-mil-101(fe)粉末(30mg)分散在含有浓度为100μmol/l盐酸的10ml dmf溶液中,将溶液转移到内衬为聚四氟乙烯的高压釜中,70℃的条件下反应30分钟,然后以8000转/分钟的转速离心并收集固体。将收集到的固体在dmf、乙醇中各洗涤三次,最后在80℃的真空条件下干燥过夜。
53.3、aa@mof-m的合成:将4毫克mof-m分散在2毫升pbs中,加入174μl质量分数为25%的戊二醛溶液,使其最终浓度为200mm,室温下搅拌6h。将悬浮液以8000转/分钟的转速离心并收集沉淀,用pbs洗涤三次,得到浓度为1毫克/毫升的ga-mof-m悬浮液。将aox(300μg)和aldh(600μg)溶解于1毫升上述悬浮液中,在冰浴的条件下搅拌过夜,离心收集沉淀并将沉淀分散在pbs中,制成1mg/ml的aa@mof-m悬浮液。
54.4、aa@mp纳米胶囊的合成:将0.35mg(0.1mmol)thiol peg carboxyl(μw=3500da)加入到1毫升浓度为1mg/ml的aa@mof-m悬浮液中,冰浴条件下过夜搅拌,离心收集固体。aa@mp纳米胶囊以最终浓度为1毫克/毫升保存在pbs中进行进一步表征。
55.5、双荧光标记的aox-fitc/aldh-rbitc@mp的合成:根据文献所报道的实验方法合成异硫氰酸荧光素标记的乙醇氧化酶(aox-fitc)和罗丹明b异硫氰酸酯标记的乙醛脱氢酶(aldh-rbitc)。首先,将异硫氰酸荧光素和异硫氰酸罗丹明b溶解在无水dmso中,分别得到浓度为10mg/ml的储备溶液。将乙醇氧化酶和乙醛脱氢酶溶解在ph值为8.2的碳酸钠缓冲溶液中,分别得到浓度为10mg/ml的蛋白溶液。然后将50μl的fitc溶液和rbitc溶液分别逐滴加入到2ml的乙醇氧化酶和乙醛脱氢酶溶液(蛋白浓度为10mg/ml,ph值为8.2的碳酸钠缓冲溶液)中。在4℃的条件下过夜反应。将标记好的蛋白质在磷酸盐缓冲液(20mm,ph=7)中进行透析。然后通过超滤离心管(mwco=10kda)进行浓缩并储存在4℃磷酸盐缓冲液中进行荧光表征。
56.6、aa@mp的荧光共振能量迁移实验:用波长为450nm的激光激发aox-fitc/aldh-rbitc@mp溶液和与其具有相同蛋白含量的aox-fitc/aldh-ritc混合溶液,且aox-fitc和aldh-rbitc的比例为1:2。
57.7、乙醇和乙醛的降解实验:在含有酒精(0.4%,w/v)的溶液中分别加入浓度相同的不同材料(mof-m,aa@mp,aa@mp+nad
+
或者pbs,mof和nad
+
浓度分别为250μg/ml和100μg/ml,各组中mof浓度相同)。反应在室温下进行,每隔半小时取样品检测溶液中乙醇和乙醛的浓度,反应共进行两小时。乙醇浓度采用乙醇检测试剂盒进行测定,乙醛浓度利用乙醛和mbth的显色反应来检测。实验重复三次,记录并分析数据。
58.8、过氧化氢生成动力学:用过氧化氢检测试剂盒测定过氧化氢生成量。将aa@mp或者乙醇氧化酶、乙醛脱氢酶和mof-m的混合物添加到乙醇溶液(0.1%,w/v)中进行反应,每隔半小时测量溶液中过氧化氢的含量。实验重复三次,记录并分析数据。
59.9、aa@mp纳米胶囊的细胞毒性实验:aa@mp纳米胶囊的细胞毒性是通过cck-8法使用人脐静脉细胞融合细胞(ea.hy926)、小鼠单核巨噬细胞(j774)、小鼠正常肝细胞(aml12)测定的。简言之,将细胞接种到96孔板(8000-10000个细胞/孔)中并培养过夜。然后用不同浓度(0、50、100、150、200、250、和300微克/毫升的mof)的aa@mp纳米胶囊处理细胞。培养24小时后,加入cck-8试剂,继续培养2小时,用酶标仪检测细胞活力。实验重复三次,记录并分
析数据。
60.10、aa@mp纳米胶囊对细胞酒精性损伤的保护作用:将ea.hy926细胞、aml12细胞、j774细胞接种在96孔板(8000-10000个细胞/孔)中并培养细胞至贴壁。然后用乙醇浓度为50mm且添加了不同材料(aox,aox和aldh的混合物,aox、aldh、nad
+
的混合物,aox、aldh、nad
+
和mof-m的混合物,aa@mp和nad
+
的混合物,各实验组mof和酶的浓度分别对应相等)的培养基处理细胞24小时。孵育结束后用cck-8法检测各孔中细胞活力。其相对活性与正常组相比较而得到。实验重复三次,记录并分析数据。
61.11、急性酒精中毒小鼠模型的构建:7周龄雌性balb/c小鼠购自济南朋悦实验动物繁育有限公司,在实验室适应一周。所有动物实验均按照山东大学实验动物中心批准的程序进行。为构建小鼠急性酒精中毒模型,首先需要将小鼠禁食12小时,然后用酒精含量为50%的pbs溶液(6mg酒精/g体重)再分组进行治疗。
62.12、aa@mp纳米胶囊对急性酒精中毒小鼠的治疗能力:将构建模型成功的实验小鼠分成3组。灌胃15分钟后,通过尾静脉给小鼠注射250微克aa@mp、aa@mp和nad
+
的混合物或者pbs,以健康小鼠作为对照。然后在不同时间点取小鼠血液,以2000rpm的转速离心10分钟,离心后取上清来检测乙醇和乙醛的浓度。八小时后处死小鼠,取其血液检测alt和ast水平。各组小鼠数量均≥4只,实验均重复三次以上。
63.13、翻正反射实验:在小鼠急性酒精中毒模型中,静脉给药后,每隔30秒将小鼠身体翻转,直至小鼠无法自主恢复正常体位时,判定其丧失翻正反射。从小鼠无法恢复正常体位开始直至小鼠可以自主恢复正常体位时记为小鼠睡眠时间。小鼠数量≥4只,实验均重复三次以上。
64.14、慢性酒精性肝损伤小鼠模型的建立:采用液体饮食法建立小鼠慢性酒精性肝损伤模。首先让小鼠适应5天的液体饮食(无酒精液体饮食),然后对小鼠进行10天的酒精液体饮食喂养(5%酒精液体饮食)或同等热量的麦芽糖溶液喂养(健康小鼠组)。酒精液体饮食结束后的第二天早上七点到九点之间对小鼠进行酒精(6mg酒精/g体重)或同等热量的麦芽糖溶液(no binge组)灌胃,成功构建小鼠慢性酒精性肝损伤模型。
65.15、aa@mp纳米胶囊对慢性酒精性肝损伤小鼠的保护能力:将构建模型成功的实验小鼠分成3组。15分钟后通过尾静脉给实验组小鼠注射250微克aa@mp、aa@mp和nad+的混合物,以pbs组作为阳性对照,以no binge组作为阴性对照。九小时后,处死小鼠,取其肝脏检测肝脏中gsh含量、mda含量、tg含量和超氧化物歧化酶活性;取其血液检测alt和ast水平。各组小鼠数量均≥4只,实验均重复三次以上。
66.实验结果表明:
67.1、仿生纳米胶囊的形貌表征:如图2a)所示成功合成了直径在200nm左右的mof-m纳米颗粒。aa@mp仿生纳米胶囊的形貌如图2b)所示,可以观察到其表面由一层peg外壳所包裹,证明纳米胶囊成功制备。该纳米胶囊形态稳定且分散性较好,尺寸相较mof-m纳米颗粒有所增大,约为210nm左右。
68.2、双荧光标记的仿生纳米胶囊的荧光共振能量迁移:如图3所示,酶混合溶液被波长为450nm的激光激发后只产生fitc的发射峰,而双荧光标记的仿生纳米胶囊被波长为450nm的激光激发后,会产生fitc和rbitc两者的发射峰,说明fitc的发射能量被rbitc所捕获,证明两种蛋白近距离(≤10nm)偶联到了mof-m纳米颗粒上。
69.3、aa@mp纳米胶囊的细胞毒性:如图6所示,aa@mp纳米胶囊的浓度高达250μg/ml时,与纳米胶囊孵育的aml12细胞、ea.hy926细胞、j774细胞依然表现出良好的细胞活性,存活率>80%,证明aa@mp纳米胶囊有着良好的体外生物相容性。
70.4、仿生纳米胶囊降解乙醇和乙醛的能力:aa@mp纳米颗粒上负载了乙醇氧化酶和乙醛脱氢酶,两种酶可以将乙醇逐步降解为对人体无害的乙酸。pbs作为对照组,将mof-m纳米颗粒、aa@mp纳米颗粒、aa@mp和nad
+
的混合物与乙醇溶液混合后,观察溶液中乙醇和乙醛浓度变化。如图4所示,mof-m组中乙醇和乙醛浓度无明显变化,证明其对乙醇没有降解能力。aa@mp组中乙醇浓度随时间逐渐降低而乙醛浓度随时间逐渐升高,证明纳米胶囊中乙醇氧化酶成功将乙醇分解为乙醛,但由于缺少nad
+
,乙醛脱氢酶无法降解乙醛。在aa@mp+nad
+
组中,乙醇浓度逐渐降低的同时乙醛浓度也没有太高的升高,证明在nad
+
存在的条件下,aa@mp纳米胶囊可以成功将乙醇逐步降解为乙酸,且不会累积过量乙醛。
71.5、aa@mp纳米胶囊对过氧化氢的清除能力:aa@mp纳米胶囊以金属中心为铁元素的mof-m为双酶偶联的基底,由于铁元素具有类过氧化氢酶活性,所以可以清除乙醇氧化酶降解乙醇过程中产生的过氧化氢。如图5所示,aa@mp纳米胶囊组在降解乙醇过程中累积的过氧化氢含量与乙醇氧化酶、乙醛脱氢酶和mof-m的混合物组相比含量较低,约为其1/4,证明纳米胶囊在降解乙醇过程中不会产生大量对身体有害的过氧化氢。
72.6、aa@mp纳米胶囊对酒精环境中细胞的保护能力评估:酒精会损伤细胞活性,aa@mp纳米胶囊快速清除酒精的能力可以对细胞的活性进行一定的保护。如图7所示,三种细胞与各种不同的材料孵育后,aa@mp+nad
+
组处理的细胞活性最高,分别为50.6%(ea.hy926)、48.3%(j774)、86.5%(aml12),表明aa@mp纳米胶囊可以清除环境中的酒精来达到保护细胞的目的。
73.7、aa@mp纳米胶囊对急性酒精中毒小鼠的治疗能力评估:将建模成功的急性酒精中毒模型小鼠分为3组,每组数量均为4只。分别用pbs(阳性对照),aa@mp,aa@mp+nad
+
进行治疗,同时健康小鼠作为阴性对照。如图8所示,pbs组小鼠平均醉酒睡眠时间为143分钟,而aa@mp和aa@mp+nad
+
组治疗后的小鼠平均醉酒睡眠时间明显低于pbs组且大致相等,约为81分钟。表明aa@mp纳米胶囊可以有效缓解小鼠急性酒精中毒症状。此外,如图9所示,aa@mp+nad
+
组治疗的小鼠,其血液中乙醇和乙醛含量以及alt和ast水平明显低于其他两组。表明在添加外源性nad
+
的条件下,aa@mp纳米胶囊可以有效降解小鼠体内的乙醇和乙醛,并且对肝脏具有一定的保护作用。
74.8、aa@mp纳米胶囊对慢性酒精性肝损伤小鼠的保护能力评估:如图10所示,相较于健康小鼠而言,no binge组的小鼠血液中alt和ast水平和肝脏中tg含量、mda含量均有所升高,而肝脏中gsh含量、sod活性有所降低,表明小鼠经过酒精液体饮食喂养后的小鼠肝功能收到了一定程度的损伤。而在pbs组中,各项指标变化程度更加明显,证明酒精性肝损伤模型的成功构建。经aa@mp,aa@mp+nad
+
治疗后的小鼠其血液中alt和ast水平和肝脏中tg含量、mda含量均有所下降,肝脏中gsh含量、sod活性有所升高,且aa@mp+nad
+
组小鼠的变化更为明显。虽然治疗后小鼠的各项指标没有恢复到健康小鼠的状态,但可以证明在添加外源性nad
+
的条件下,aa@mp纳米胶囊可以对慢性酒精性肝损伤起到一定的保护作用。
75.最后应该说明的是,以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然
可以对前述实施例所记载的技术方案进行修改,或者对其中部分进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1