石蒜碱在制备治疗和/或预防败血症及其诱发的心肌损伤的药物中的用途
1.本发明属于药物研究技术领域,具体公开了石蒜碱在制备治疗和/或预防败血症及其诱发的心肌损伤的药物中的用途。
背景技术:
2.石蒜碱(lycorine,lyc)是存在于石蒜科植物石蒜鳞茎中的生物碱。lyc的结构式如式ⅰ所示,其具有多种药理活性,包括抗氧化、抗菌、抗炎、抗病毒和抗肿瘤等作用。现代药理研究证明,石蒜碱还有强力的催吐作用,可作为吐根代用品,其效力比吐根碱强,且毒性较小;石蒜碱还具有祛痰作用。
3.败血症是指宿主对感染的反应失调导致的危及生命的器官功能障碍。败血症加重可引起感染性休克、弥散性血管内凝血和器官功能受损,严重威胁患者生命。心脏是败血症损伤最为严重的器官之一。败血症诱发的心肌损伤属于感染性心肌损伤的一种。感染性心肌损伤指微生物(细菌、病毒等)感染过程中或恢复期中出现的如心脏扩大、心力衰竭、心源性休克或心律异常等反应,典型的症状为疲乏无力、食欲不振、恶心、呕吐、呼吸困难、面色苍白以及发热等。临床研究表明,伴有严重心肌损伤的败血症患者死亡率高达50%。在败血症早期,心肌损伤可加速败血症病情恶化。因此,对败血症及其诱发的心肌损伤进行早期干预和治疗具有关键研究意义。
4.目前,石蒜碱在败血症及败血症诱发的心肌损伤中的治疗作用尚未见报道。
5.
技术实现要素:
6.鉴于以上技术问题,本发明提供以下技术方案:
7.本发明提供了石蒜碱在制备治疗和/或预防败血症的药物中的用途。
8.本发明还提供了石蒜碱在制备治疗和/或预防所述败血症引发的心肌损伤的药物中的用途。
9.优选地,所述石蒜碱用于升高白细胞、淋巴细胞及中性粒细胞的数量。
10.优选地,所述石蒜碱用于降低乳酸脱氢酶、肌酸激酶、谷草转氨酶及尿素氮的水平,并升高白蛋白的水平。
11.优选地,所述石蒜碱用于改善败血症引发的心功能障碍。
12.优选地,所述石蒜碱用于改善败血症引起的心肌组织形态紊乱。
13.优选地,所述石蒜碱用于制备炎症相关分子tnf-α、il-1β、il-6的mrna水平下调剂。
14.优选地,所述石蒜碱用于减少败血症引起的超氧化物阴离子累积。
15.本发明还提供一种用于治疗和/或预防败血症的药物,其包括所述石蒜碱,以及药学上可接受的辅料或载体。
16.本发明还提供一种用于治疗和/或预防败血症引发的心肌损伤的药物,其包括所述石蒜碱,以及药学上可接受的辅料或载体。
17.对比现有技术,本发明的有益效果为:
18.本发明提供了石蒜碱在制备治疗和/或预防败血症及其诱发的心肌损伤的药物中的用途。经动物实验证明,石蒜碱可提高败血症损伤后的生存率,改善败血症评分及肛温,升高白细胞、淋巴细胞、中性粒细胞的数量,降低乳酸脱氢酶、肌酸激酶、谷草转氨酶、尿素氮的水平和升高白蛋白的水平;还能改善由败血症引起的心脏功能障碍及心肌组织形态紊乱,并降低败血症诱发的心肌组织损伤后tnf-α、il-1β、il-6的mrna水平及减少由败血症引起的超氧化物阴离子累积。
附图说明
19.图1为小鼠生存率造模图片;a、盲肠结扎图片;b、盲肠穿孔图片;
20.图2为小鼠生存率曲线;
*
p《0.05;
21.图3为小鼠功能学检测造模图片;a、盲肠结扎图片;b、盲肠穿孔图片;
22.图4为小鼠损伤后败血症相关指标评分统计分析图;a、败血症评分统计分析图;b、小鼠肛温统计分析图;
*
p《0.05,
***
p《0.001,
****
p《0.0001;
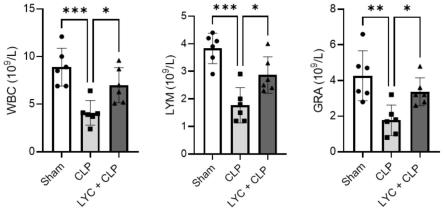
23.图5为lyc对clp损伤后8h小鼠血常规各项指标的影响;wbc,白细胞;lym,淋巴细胞;gra,中性粒细胞;
*
p《0.05,
**
p《0.01,
***
p《0.001;
24.图6为lyc对clp损伤8h后小鼠血生化ldh、ck及ast指标的影响;ldh,乳酸脱氢酶;ck,肌酸激酶;ast,谷草转氨酶;
**
p《0.01,
***
p《0.001,
****
p《0.0001;
25.图7为lyc对clp损伤8h后小鼠血生化bun及alb指标的影响;bun,尿素氮;alb,白蛋白;
*
p《0.05,
***
p《0.001,
****
p《0.0001;
26.图8为lyc对clp损伤8h后左室超声心动图长轴切面、m模典型图片;
27.图9为lyc对clp损伤8h后各项心功能指标的统计分析图;sv,每搏输出量;co,心输出量;lvesv,左心室收缩末期容积;lvedv,左心室舒张末期容积;
*
p《0.05,
**
p《0.01,
***
p《0.001,
****
p《0.0001;
28.图10为lyc对clp损伤8h后左室超声心动图短轴切面及m模典型图片;
29.图11为lyc对clp损伤8h后各项心功能指标的统计分析图;sv,每搏输出量;co,心输出量;lvesv,左心室收缩末期容积;lvedv,左心室舒张末期容积;
*
p《0.05,
**
p《0.01,
***
p《
0.001,
****
p《0.0001;
30.图12为lyc对clp损伤8h后各组心肌组织切片he染色结果;
31.图13为lyc对clp损伤8h后心肌组织炎症相关典型指标tnf-α的免疫组织化学染色结果;
32.图14为炎症相关分子tnf-α、il-1β、il-6的mrna表达水平的统计分析图;
**
p《0.01,
***
p《0.001;
33.图15为lyc对clp损伤8h后心肌组织切片dhe染色结果。
具体实施方式
34.下面通过结合具体实施案例进一步对本发明进行进一步详细说明。各实施例及试验例中所用的设备和试剂如无特殊说明,均可从商业途径得到。这些实施案例所描述的具体实施例仅用以解释本发明而用于限定本发明。
35.为了更好地理解本发明而不是限制本发明的范围,在本发明中所用的表示用量、时间、百分比的所有数字、以及其他数值,在所有情况下都应理解为以词语“大约”所修饰。因此,除非特别说明,否则在说明书和所附权利要求书中所列出的数字参数都是近似值,其可能会根据试图获得的理想效果的不同而加以改变。
36.本发明提供了lyc用于制备治疗和/或预防败血症的药物的用途,以及lyc用于制备治疗和/或预防败血症诱发的心肌损伤药物的用途。
37.经动物实验研究证明:lyc可提高败血症损伤后的生存率、改善败血症评分及肛温、升高白细胞(white blood cell,wbc)、淋巴细胞(lymphocyte,lym)、中性粒细胞(granulocyte,gra)的数量,降低乳酸脱氢酶(lactate dehydrogenase,ldh)、肌酸激酶(creatine kinase,ck)、谷草转氨酶(aspartate aminotransferase,ast)、尿素氮(bloodureanitrogen,bun)的水平和升高白蛋白(albumin,alb)的水平;
38.lyc能改善由败血症引起的心脏功能障碍,表现为提高每搏输出量(stroke volume,sv)、心输出量(cardiac output,co)、左心室收缩末期容积(left ventricularend systolic volume,lvesv)、左心室舒张末期容积(leftventricular end diastolicvolume,lvedv);同时,lyc可改善由败血症引起的心肌组织形态紊乱,发挥减轻心肌损伤的作用。
39.lyc能降低败血症诱发的心肌组织损伤后tnf-α的表达,降低tnf-α、il-1β、il-6的mrna水平,并减少由败血症引起的超氧化物阴离子累积,从而发挥抗炎和抗氧化应激的作用。
40.本发明还提供一种用于治疗和/或预防败血症的药物,以及用于治疗和/或预防败血症引发的心肌损伤的药物,所述药物由lyc和药物辅料制备而成,所述药物为静脉注射或口服给药制剂,所述药物的给药剂量为每千克体重5mg-20mg lyc。
41.盲肠结扎穿孔(cecal ligation andpuncture,clp)动物模型是经典的败血症动物模型,本发明采用clp动物模型为研究对象,根据现有技术研究,该动物模型可造成急性心肌损伤,即败血症诱发的心肌损伤。
42.本发明所述的心肌损伤,特别是指细菌性心内膜炎、系统性或者其他脏器感染所致菌血症导致的心肌炎性病变和系统性或者其他脏器感染所致脓毒血症导致的心肌炎性
病变,临床上多用肾上腺皮质激素和广谱抗生素,防止菌群失调。在应用过程中应严加观察,特别注意有无消化道、泌尿道和呼吸道的真菌感染。
43.需要说明的是,以下实施例所用的lyc纯度为hplc≥98%。所用动物购自空军军医大学实验动物中心,所用试剂为市场采购。如无特殊说明,以下实施例中所采用的实验方法或相关检测方法采用本领域已知方法。
44.以下通过具体实施例对本发明做进一步的阐述。实施例是对本发明进行详细说明,但本发明并不受这些的任何限定。
45.实施例1
46.lyc能够提高败血症损伤后的小鼠生存率
47.方案:
48.采用clp手术,于在体水平上构建败血症模型,给予lyc预保护处理。
49.步骤:
50.使用balb/c小鼠作为研究对象,按照研究设计,用随机数字表法进行分组,小鼠感染性心肌损伤模型按照rittirsch d等发表的clp实验方法,复制重度感染性心肌损伤模型。具体实验步骤如下:
51.(1)分组:将balb/c小鼠分为sham组、clp组、lyc+clp低、中、高剂量组(给药剂量分别为5、10、20mg/kg),共5组,每组10只;
52.(2)制药:使用dmso(二甲基亚砜)溶解lyc,制成剂量分别为5mg/kg、10mg/kg、20mg/kg的lyc溶液;
53.(3)给药:clp造模前6天对各组小鼠进行预保护处理(腹腔注射),按照1ml/kg(体重)的浓度给sham组、clp组dmso(腹腔注射),lyc+clp组:使用dmso溶解lyc,制成剂量分别为5mg/kg、10mg/kg、20mg/kg的lyc溶液,腹腔注射,每2天给药1次,共3次,确保每次给药的时间段和手术时间相同;
54.(4)clp造模:
①
第7天造模,采用小动物吸入麻醉系统对小鼠进行麻醉:小鼠吸入浓度为3%的异氟烷(空气流量为1l/min),造模过程中持续麻醉的异氟烷浓度为1.5%(空气流量为1l/min),麻醉程度监测标准为肢体的撤回反射消失;
②
小鼠腹正中区域备皮,用75%乙醇消毒皮肤两次,沿中下腹部正中行纵切口1cm,逐层切开分离皮肤、皮下组织,见腹白线,沿腹白线切开腹直肌及腹膜,切口两侧用0.9%生理盐水湿润,用弯镊进腹,找到盲肠后轻柔牵出,将靠近回盲瓣处的粪便轻柔挤向盲肠末端(避免空气残留),在盲肠末端至回盲瓣连线上2/3处(生存率实验为clp损伤加重模型,功能学检测采用盲肠末端至回盲瓣连线上1/3处结扎模型,其余步骤与加重模型相同)用4-0号无菌手术缝线结扎盲肠,在结扎线与盲肠末端中点处用25g注射器针头对穿已结扎盲肠(避开血管),穿孔后轻轻挤压盲肠,可见结扎段盲肠内容物质顺穿刺孔流出,将盲肠连同周围所有肠管还纳入腹腔,用4-0号无菌手术缝线逐层间断缝合腹膜及皮肤,造模过程如图1;
③
术毕,所有实验小鼠均于术后立即背部皮下注射37℃生理盐水(10ml/kg体重)进行液体复苏,妥善标记后放回鼠笼,等待苏醒。sham组除不进行盲肠结扎穿孔外,其余步骤与clp组造模相同。
55.(5)clp手术后开始计时,每1h观察一次,记录72h内各个分组小鼠死亡数量,统计并分析生存率;
56.(6)根据各组生存率结果,进行功能学实验,所取得的标本进行后续检测。
57.结果:
58.小鼠生存率曲线如图2所示,与sham组相比,clp处理后,小鼠72h内生存率为40%,lyc(5mg/kg)处理后小鼠生存率约为90%(与clp组相比,p《0.05),lyc(10mg/kg)处理后小鼠生存率约为30%,lyc(20mg/kg)处理后,小鼠生存率约为60%,提示lyc可以提高小鼠clp后的生存率,并选取5mg/kg为lyc最佳保护浓度(后续功能学检测将采用此浓度)。
59.实施例2
60.lyc能改善败血症评分及肛温
61.方案:
62.采用clp手术,于在体水平上构建败血症及其诱发的心肌损伤模型(后续所有功能学检测采用盲肠末端至回盲瓣连线上1/3处结扎,其余步骤与加重模型相同,如图3),给予lyc预保护处理。
63.步骤:
64.(1)分组:功能学检测:将balb/c小鼠分为sham组、clp组、lyc+clp组(5mg/kg剂量,腹腔注射),每组6只,给药方式同实施例1。
65.(2)clp造模:结扎位置采用盲肠末端至回盲瓣连线上1/3处结扎,其余步骤同实施例1。
66.(3)根据败血症评分表对clp手术后8h的小鼠进行评分。
67.(4)检测clp手术8h后小鼠肛温的变化:损伤8h后,固定住小鼠,用棉球将小鼠的肛门清理干净,随后将温度检测探针轻轻插入小鼠肛门,待数据稳定后记录温度。
68.结果:
69.于小鼠clp处理8h后进行败血症评分,结果如图4a所示,与sham组相比,clp组败血症评分显著升高(p《0.0001),给予lyc保护后,与clp组相比,败血症评分显著降低(p《0.05);
70.于小鼠clp处理8h后进行肛温检测,结果如图4b所示,与sham组相比,clp组肛温显著降低(p《0.0001),给予lyc保护后,与clp组相比,肛温显著升高(p《0.001)。
71.实施例3
72.lyc能改善败血症引起的血常规变化
73.方案:
74.采用clp手术,于在体水平上构建败血症及其诱发的心肌损伤模型,给予lyc预保护处理,具体步骤同实施例2。
75.步骤:
76.检测clp手术8h后小鼠血常规各项指标的变化:损伤8h后,采用摘眼球取血法取血,采用全自动血常规仪进行血常规检测。
77.结果:
78.于小鼠clp处理8h后检测血常规相关指标的变化,结果如图5所示,与sham组相比,clp损伤后wbc、lym、gra均显著降低(p《0.001,p《0.001,p《0.01),而lyc处理后,与clp组相比,wbc、lym、gra均显著升高(p《0.05)。
79.实施例4
80.lyc能改善败血症引起的血生化变化
81.方案:
82.采用clp手术,于在体水平上构建败血症及其诱发的心肌损伤模型,给予lyc预保护处理,具体步骤同实施例2。
83.步骤:
84.检测clp手术8h后小鼠血生化各项指标的变化:损伤8h后,采用摘眼球取血法取血,收集每组全血,3000rpm/min,离心10min,吸取血清,随后使用全自动血生化分析仪进行检测。
85.结果:
86.于小鼠clp处理8h后检测了血生化相关指标的变化,结果如图6-7所示,与sham组相比较,clp损伤8h后,血清中ldh、ck、ast、bun均显著上升(p《0.0001,p《0.001,p《0.001,p《0.001),alb显著下降(p《0.0001),给予lyc处理后,与clp组相比,ldh、ck、ast、bun显著下降(p《0.001,p《0.001,p《0.01,p《0.0001),alb显著上升(p《0.05)。
87.实施例5
88.lyc可以改善败血症引发的心功能障碍
89.方案:
90.采用clp手术,于在体水平上构建败血症及其诱发的心肌损伤模型,给予lyc预保护处理,具体步骤同实施例2。
91.步骤:
92.小动物超声检测clp手术8h后小鼠心脏功能:各组动物于超声检测前一天脱去小鼠左胸区域被毛,小鼠经3%异氟烷麻醉,麻醉气体流量为1l/min,异氟烷吸入麻醉后固定于37℃恒温板上,充分暴露左侧胸廓,采用30mhz探头,选取标准胸骨旁左室长轴切面及标准左心室乳头肌短轴切面,记录m模心脏超声切面图像,测量指标包括:sv、co、lvesv、lvedv。
93.在检测过程中应该注意以下几点可能影响检测结果的细节:第一,麻醉状态不可以过深,否则会影响小鼠的心率和收缩功能;第二,小鼠的体位要摆好,四肢不可固定地过伸过紧,否则会压迫小鼠心脏,最终影响心功能检测的准确性;第三,小鼠靠近心脏部分至少提前一天进行脱毛处理,脱毛太早会导致检测时生出新毛发,成像时生成伪影,影响超声结果,太晚则使小鼠处于应激状态干扰心功能结果。
94.结果:
95.使用小动物超声检测clp手术8h后小鼠心脏功能,结果如图8-9(左室长轴超声结果)、图10-11(左室短轴超声结果)所示,与sham组相比,clp损伤后,小鼠心脏的sv、co、lvesv、lvedv显著下降(p《0.0001或p《0.01,p《0.01或p《0.05,p《0.0001,p《0.0001);给予lyc保护后,与clp组相比,小鼠心脏的sv、co、lvedv显著升高(p《0.01,p《0.01,p《0.001),而lvesv无显著变化(p》0.05),小鼠心脏功能得到明显改善。
96.实施例6
97.lyc能改善败血症引起的心肌组织结构紊乱
98.方案:
99.采用clp手术,于在体水平上构建败血症及其诱发的心肌损伤模型,给予lyc预保护处理,具体步骤同实施例2。
100.步骤:
101.心肌组织he染色:
102.(1)心肌组织he染色:
103.①
石蜡包埋:心尖部缓慢注入含肝素生理盐水,右心耳流出的液体变为透明时,将灌注液体替换为4%多聚甲醛固定液;多聚甲醛组织固定成功后,沿心脏根部剪断各血管,完整取下心脏;心脏取出后,切下心脏左半边(左心房及左心室)放入4%多聚甲醛中,进行后固定至少24h;按照顺序依次在80%、95%、95%、100%乙醇中浸泡40min,再按照100%乙醇、100%乙醇∶二甲苯=1∶1混合液、二甲苯浓度梯度浸泡30min进行组织脱水透明;然后于包埋机中浸蜡3h,最后进行滴蜡包埋。
104.②
切片:设置切片厚度为5μm,使用捞片法将切片贴于多聚赖氨酸覆膜载玻片上,70℃烤片1h后,60℃烤片5h。
105.③
染色:将切片置于二甲苯中浸泡10min,更换二甲苯再次浸泡10min,按照100%、100%、95%、95%、80%乙醇、去离子水的顺序依次浸泡2min脱蜡至水,以备染色;将切片浸入苏木素染液染色3min,使用自来水轻柔冲洗5min;浸入1%盐酸乙醇30s,1%氨水3min脱色,使用自来水轻柔冲洗3min;浸入伊红染液染色3min,使用自来水轻柔冲洗3min;按照70%、80%浓度乙醇30s,95%、95%、95%、100%、100%浓度梯度乙醇、二甲苯、二甲苯的顺序分别浸泡2min进行脱水透明处理;中性树胶封片。
106.结果:
107.小鼠心肌组织he染色结果如图12所示,与sham组相比,clp损伤后心肌组织纤维断裂,间质水肿增加,细胞完整性破坏;给予lyc后,clp引起的心肌组织结构损伤得到明显改善。
108.实施例7
109.lyc能减轻由败血症引起的炎症反应
110.方案:
111.采用clp手术,于在体水平上构建败血症及其诱发的心肌损伤模型,给予lyc预保护处理,具体步骤同实施例2。
112.步骤:
113.(1)免疫组织化学检测:
114.①
石蜡包埋、切片步骤同实施例5;
115.②
染色:切片常规脱蜡至水:分别取各组小鼠心脏组织石蜡切片,依次经二甲苯2次,每次10min,100%乙醇2次、每次10min;95%、90%、80%、70%乙醇各1次,每次5min,最后浸入蒸馏水中5min;抗原修复:柠檬酸钠缓冲液微波抗原修复20min,流水冲洗10min;阻断内源性过氧化物酶:3%双氧水,室温20min。pbs洗3次,每次5min;封闭:滴加5%正常山羊血清封闭液,室温孵育30min;滴加一抗:擦去多余血清,加一抗,4℃孵育过夜。pbs洗3次,每次5min;滴加二抗:滴加辣根过氧化物酶hrp标记的二抗(1∶5000,pbs配制),37℃温箱内孵育1h,pbs洗3次,每次5min;dab显色:滴加dab 0.5-3min,镜下控制显色程度,流水冲洗10min,苏木素复染,1%盐酸酒精分化,1%氨水脱色,脱水,经二甲苯透明后用中性树胶封片。
116.③
显微镜下观察并拍照:显微镜下观察并拍照,每张切片随机找出20-30个不重叠
视野,光镜下组织切片呈棕黄色颗粒性沉积区域为阳性染色部位。
117.(2)实时定量荧光pcr
118.①
样品总rna提取:将装有小鼠心脏样本的离心管从液氮中取出后,加入1ml trizol和2个研磨小珠,置于组织破碎仪上于60hz破碎1min,轻轻摇晃使trizol与样品混匀,置于冰上裂解5min;加入200μl氯仿,手动剧烈震荡管体15s,室温孵育15min后,置于4℃高速离心机离心15min,转速为12000rpm/min;此时rna全部位于上层水相中,用移液器吸取400μl水相转移至干净的无rna酶的离心管中,加入等体积的异丙醇进行混合,手动摇晃15s,室温孵育10min后,置于4℃高速离心机离心15min,转速为12000rpm/min;弃上清,加入75%乙醇(用depc水配制),手动摇晃使rna沉淀悬浮,室温孵育5min后,4℃,8000rpm/min离心5min,重复该操作一次;弃去乙醇溶液,留下rna沉淀,室温干燥5-10min;采用20μl depc水溶解rna沉淀,打开dna/rna浓度测定仪,测定样品的浓度,放于-80℃冰箱进行保存。
119.②
反转录:将提取的总rna从-80℃冰箱中取出,加入反转录试剂后置于pcr仪器中进行反转录,反转录程序为:37℃15min;85℃5s;反转后的cdna放于-20℃保存,反转录体系如表1所示:
120.表1反转录体系
121.成分体积(μl)反转录酶4total rna1μgdepc水加至20μl总体积20
122.③
qrt-pcr:将cdna、试剂盒(购自湖南艾科瑞生物工程有限公司;货号:ag11409-s)及所需引物(购自苏州金唯智生物科技有限公司;tnf-α:正向引物5'-actgaacttcggggtgatcg-3’;反向引物5'-tggtggtttgctacgacgtg-3’;il-1β:正向引物5
’‑
ccttgtgcaagtgtctgaagc-3’;反向引物5
’‑
aagggcttggaagcaatcct-3’;il-6:正向引物5
’‑
tccggagaggagacttcaca-3’;反向引物5
’‑
tgccattgcacaactcttttct-3’);从-20℃冰箱中取出,准备好实验所需的器材;待样品和试剂盒融化后,按照以下比例配制溶液后,使用qrt-pcr仪器设置好的程序进行实验。反应条件为:95℃预变性10min;95℃变性15s;58℃退火延伸20s;72℃终末延伸30s,共40个循环,反应体系如表2所示:
123.表2 qrt-pcr反应体系
124.成分体积(μl)sybr premix ex taq
ꢀⅱ
5ddh2o(灭菌双蒸水)3.5正向引物f(10μm)0.25反向引物r(10μm)0.25cdna1总体积10
125.结果:
126.小鼠心肌组织ihc染色结果,如图13所示,与sham组相比较,clp损伤后tnf-α表达显著升高;与clp组相比,给予lyc处理后其表达量显著降低;
127.小鼠心肌组织qrt-pcr结果,如图14所示,与sham组相比,clp损伤后炎症相关分子tnf-α、il-1β、il-6的mrna水平均显著升高(p《0.01,p《0.001,p《0.01);给予lyc处理后,与clp组相比,其表达水平显著降低(p《0.01,p《0.001,p《0.01),clp引起的小鼠心肌组织炎症得到明显改善。
128.实施例8
129.lyc能减少由败血症引起的超氧化物阴离子累积
130.方案:
131.采用clp手术,于在体水平上构建败血症及其诱发的心肌损伤模型,给予lyc预保护处理,具体步骤同实施例2。
132.步骤:
133.dhe染色:
134.①
石蜡包埋、切片步骤实施案例5。
135.②
dhe染色:将切片置于二甲苯中浸泡10min,更换二甲苯再次浸泡10min,按照100%、100%、95%、95%、80%乙醇、去离子水的顺序浸泡2min脱蜡至水,以备染色;脱蜡结束后,使用dhe染色液于37℃下孵育30min,经过适当洗涤后,荧光显微镜下观察并拍照,荧光显微镜下组织切片呈红色荧光阳性染色部位,每张切片随机找出20-30个不重叠视野,光镜下组织切片呈红色荧光区域为阳性染色部位。
136.结果:
137.小鼠心肌组织dhe染色结果,如图15所示,与sham组相比,clp损伤后红色荧光部位显著增多,且红色荧光强度显著增强,lyc处理后其荧光部位显著减少,荧光强度明显下降,clp引起的小鼠心肌组织氧化应激得到明显改善。
138.以上公开的仅为本发明的具体实施例,但是,本发明实施例并非局限于此,任何本领域的技术人员能思之的变化都应落入本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1