包含颗粒的乳液的制作方法
包含颗粒的乳液
1.(201780014816.1分案)
技术领域
2.本发明涉及治疗性栓塞领域,并且具体涉及用于进行经导管动脉化疗 性栓塞(tace)的材料和方法。
背景技术:
3.治疗性栓塞是一种微创技术,其中通过阻塞供应组织的血管来限制对 组织的血液流动,导致局部坏死;已使用了液体和固体栓塞剂两者。在一 种方法中,通过油性乳液的经导管递送来实现该效应,所述油性乳液可另 外包含抗肿瘤药物。油组分通常是罂粟籽油的脂肪酸的碘化乙酯的组合物 (ultra fluide-guerbet s.a.,法国)。含水组分通常包含碘化造 影剂,以改善在递送期间的显现。例如,这种方法已用于治疗肝细胞癌 (hcc),并且称为常规tace(ctace)。
4.将乳液引入供给癌的肝动脉分支内,并且通常通过横穿供给肿瘤的两 个系统之间的胆管周围丛或穿过血窦,不仅栓塞肿瘤供给的肝小动脉还栓 塞门静脉小静脉。然而,乳液是弱栓塞剂并且被迅速洗掉,将细胞毒性药 物释放到全身循环内。在递送后使用微粒“塞子”(例如蛋白质泡沫颗粒、 或永久性微球栓塞-参见例如geschwind等人cardiovasc.intervent.radiol. (2003)26:111-117)有助于延长栓塞效应,但最终无法阻止乳液的分散。 此外,在ctace之后,油和药物不共定位(gaba r.等人j.v.i.r.2012; 23(2);265-273)。
5.乳液必须足够稳定用于方便制备和递送。它还应该在通过手术所需的 小导管递送期间保持稳定,并且当它沿着血管行进时保持内聚性。此外, 如果需要再乳化,则重新制备的乳液应该具有与原始乳液相似的性质。然 而,制备和材料的变化可导致广泛变化的性质,例如稳定性。
6.各种材料的栓塞颗粒是可用的;通常直径在40
–
1200um范围内的聚 合物微球是一种这样的材料。在一些情况下,通过掺入化学治疗剂,它们 可适合tace,所述化学治疗剂经过数小时或数天的时期释放。该方法也 已用于治疗hcc,尽管由于其大小,栓塞颗粒通常不进入肝门小静脉内, 并且因此肿瘤循环的一部分是无法接近的。wo2004/071495公开了由聚乙 烯醇共聚物制备的一种此类试剂。
7.尽管其缺点,ctace的乳液制剂仍然很受欢迎。然而,仍然需要用于 在ctace中使用的制剂,其提供可预测的药代动力学,具有降低的全身 暴露,提供良好程度的栓塞,经过延长时期将药物递送至组织,在使用时 制备简单且快速,需要最少数目的组分,提供门静脉栓塞的潜力,提供射 线照相反馈,并且在递送之前和在递送期间两者可靠地稳定足够的时间。
8.wo2015/036626提供了包含亲水性颗粒和的乳液制剂,然而, 这些可遭受稳定性问题并且再乳化导致逐渐缩短的稳定性时间。
9.本发明人已鉴定,通过将栓塞颗粒掺入组合物内,可在递送之前容易 地制备具有用于tace中的改善特性的乳液制剂。特别地,本发明人已鉴 定,通过掺入包含碘化聚合物的颗粒,可改变乳液的特性以增加稳定性和 可用性。该制剂可在使用时容易地制备,不需要另外的专门设备来制备, 并且具有超过先前公开的乳液制剂的改善稳定性。该制剂具有提供对肿瘤 的动脉和门静脉供应两者的栓塞的潜力,并且减少全身循环对掺入药物的 暴露,并且提供更可预测的药代动力学和改善的局部递送。通过将疏水部 分掺入聚合物内来增加颗粒疏水性,特别有用的是碘化芳族物种,其不仅 增加疏水性,特别是表面疏水性,而且还对颗粒赋予固有的射线不透性。
技术实现要素:
10.相应地,本发明提供乳液组合物,其包含连续相、不连续相和多个颗 粒,所述不连续相为水性,并且所述连续相包含油;其中所述颗粒包含与 颗粒共价结合的碘。
11.颗粒特性
12.形状
13.虽然在本发明中可使用不规则形状的微粒材料,但一般优选球形颗粒, 因为它们的球形形式导致良好的流动性质,用于更远端的分布和易于处理。 本领域已知的颗粒类型为微粒,或优选地微球是特别优选的。
14.尺寸
15.可使用适合于栓塞疗法的任何尺寸的颗粒或微球,但是一般它们的直 径不超过2000um。因为优选颗粒不通过毛细血管床到达肿瘤之外的静脉 系统,所以至少15um的颗粒是优选的。颗粒一般以一系列尺寸提供,例 如可使用15至1200微米的颗粒;制剂通常提供以尺寸子范围的颗粒以适 合计划的治疗,例如100-300、300-500、500-700或700-900um。较小的 颗粒趋于更深地进入血管床内,并且因此对于某些目的,例如在15-35、 30-60、40-90或70-150微米范围内的颗粒是优选的。当颗粒通过尺寸范围 提及时,这意指该范围涵盖制剂中至少80%的颗粒,优选90%,除非另有 说明。尺寸指在生理盐水(1mm磷酸钠ph7.2-7.4,0.9%nacl)中完全水 合的颗粒。
16.孔隙度
17.还考虑了具有内部空间如孔或空隙的颗粒。孔可相互连接或不相互连 接,但可对颗粒的外部开放。空隙是与外部不连接的内部空间。
18.干燥的
19.颗粒可以干燥形式或水合形式提供。干燥的颗粒通常冻干提供且在真 空下(即在小于0.01巴的压力下)贮存。当本文提及水合颗粒时,这指在 生理盐水(1mm磷酸钠ph7.2-7.4,0.9%nacl)中完全水合的颗粒,除非 另有说明。所有测量都在实验室温度下,在18至22℃之间,除非另有说 明。在一个优选实施例中,在一种或多种冻干保护剂的存在下干燥颗粒。 这有助于在干燥时保持颗粒的结构。合适的冻干保护剂包括药学可接受的 水溶性多羟基化合物,例如多元醇以及单糖、二糖和多糖。例如,可使用 蔗糖、葡萄糖、右旋糖和海藻糖;甘露醇已提供良好的结果。在其中去除 结构水可损害颗粒结构的情况下,例如在由水凝胶制备的颗粒的情况下, 冻干保护剂是特别有用的。以这种方式处理的颗粒具有改善的药物负载特 性。
20.聚合物
21.本发明的颗粒包含聚合物。许多类型的聚合物可用于制备颗粒,并且 它们可为可生物降解的或不可生物降解的。在一个优选实施例中,聚合物 是亲水的;水可溶胀但不溶于水的聚合物是优选的,交联聚合物是特别优 选的。聚合物包括天然聚合物,例如多糖(例如壳聚糖或海藻酸盐)或蛋 白质(例如白蛋白或明胶)或合成聚合物。
22.合成聚合物包括聚酯,例如聚交酯、聚乙交酯及其共聚物,例如聚丙 交酯-共聚-乙交酯和聚(d,l-丙交酯-共聚-peg)、聚原酸酯和聚(酯酰胺); 丙烯酸酯(例如甲基丙烯酸酯)、丙烯酰胺(例如甲基丙烯酰胺)、聚脲、 聚氨酯、聚烯烃、聚卤代乙烯、聚卤代亚乙烯、聚乙烯基醚、聚乙烯基芳 族化合物、聚乙烯基酯、聚丙烯腈、醇酸树脂、聚硅氧烷、环氧树脂、乙 烯醇聚合物、聚磷腈、聚磷酸酯、聚磷酸酯聚羟基链烷酸酯、聚酸酐、聚 氨基酸、聚甲醛和聚酰亚胺;聚己内酯、聚戊内酯、聚酐、聚乙二醇、聚 环氧乙烷包括酰基聚环氧乙烷及其共聚物、吡咯烷酮和乙烯基吡咯烷酮、 以及上述共聚物,例如具有基于丙烯酸,丙烯酰胺和丙烯酸酯的单体的共 聚物。
23.在一个优选实施例中,本发明的颗粒(微球)包含共价结合的碘,即 该颗粒包含碘与之共价结合的聚合物(如上所述)。
24.电荷
25.颗粒的聚合物优选在6-8范围的ph下携带总体电荷,这帮助结合荷 电药物。颗粒可例如通过具有游离的季铵基团带阳离子电荷,或例如通过 具有游离的羧酸根或磺酸根基团带阴离子电荷。优选地,它们在6-8的ph 下带阴离子电荷。方便地,可通过掺入荷电的共聚单体将电荷引入聚合物 内。
26.水凝胶
27.水凝胶聚合物是优选的,因为它们允许负载药物容易地通过颗粒聚合 物的所有部分。水可溶胀但不溶于水的聚合物是优选的。包含共价结合的 碘并且包含大于30%水(w/w)的水凝胶是优选的。包含至少40%水的此类 水凝胶已提供了良好的结果。水凝胶可具有高达99%的水w/w,但通常具 有高达80或90%的水w/w。在此范围内,子范围例如54-82%、50-85%、 54-82%、50-75%和60-55%是优选的。
28.优选的聚合物是聚乙烯醇(pva)的聚合物和共聚物,特别当聚合物是 优选物理或共价交联的时。特别优选的是共聚物,例如具有丙烯酰胺、甲 基丙烯酰胺、丙烯酸酯或甲基丙烯酸酯的共聚物。此类聚合物的实例包括 pva共聚-丙烯酸钠(例如wo2006/119968的实例1)或用n-丙烯酰基
‑ꢀ
氨基乙醛二甲基缩醛(naaada)改性的pva,以形成pva大分子单体,并 且用2-丙烯酰胺基-2-甲基丙磺酸(amps)交联,如wo04071495、实例 1(pva-amps)中所述。
29.还优选的是聚乙二醇的聚合物和共聚物,特别是peg大分子单体的聚 合物,例如peg-丙烯酰胺(例如peg-二丙烯酰胺)或peg-甲基丙烯酸 酯的聚合物。这些包括用荷电单体交联的聚乙二醇的聚合物和共聚物,所 述荷电单体例如丙烯酸3-磺基丙酯或2-丙烯酰胺基-2-甲基丙磺酸(参见例 如wo 2015/070094)。
30.还优选的是丙烯酸类聚合物,例如丙烯酸酯和甲基丙烯酸酯的聚合物, 例如聚甲基丙烯酸(参见例如thanoo等人,j.appl.p.sci.,1990(38), 1153-1161和us4,622,367)。此类聚合物可由未水解的前体制备,所述未 水解的前体例如丙烯酸甲酯(ma)、甲基丙烯酸
甲酯(mma)、甲基丙烯酸 乙酯(ema)、甲基丙烯酸六甲基酯(hmma)或甲基丙烯酸羟乙酯(hema), 且随后水解。合适的交联剂包括基于二醇的材料,例如乙二醇二甲基丙烯 酸酯(egdma)、二乙二醇二甲基丙烯酸酯(degdma)或特别是三乙二醇二 甲基丙烯酸酯(tegdma)。特别优选的是包含用tegdma交联的甲基丙 烯酸的颗粒,其可用聚膦嗪涂层例如聚(三氟乙氧基)膦嗪涂布(如 wo2006/046155中所述)。
31.碘化
32.本文所述颗粒中碘含量的单位是毫克碘/毫升珠(mg i/ml)。这指在盐 水中完全水合的作为填充珠体积的珠中的碘含量。也就是说,如同通过量 筒测量的体积。
33.在一个优选实施例中,本发明的颗粒(微球)包含共价结合的碘,即 该颗粒包含碘与之共价结合的聚合物(如上所述)。碘化部分与聚合物的 偶联增加了聚合物的疏水性,因此,例如,尽管在一个实施例中,颗粒的 聚合物是亲水的并且可为水可溶胀的,但是不溶于水,该聚合物的性质通 过碘或碘化部分的偶联来改变,以增加聚合物的疏水性。优选地,碘基本 上在颗粒各处结合。
34.优选地,聚合物包含至少20mg i/ml的珠。优选至少30mg i/ml,且更 优选至少60、至少100mg、至少130或至少150i/ml。碘的较高水平通常 由在x射线下显现珠的能力和其它因素支配,所述其它因素例如对颗粒结 合且释放药物的能力的作用、珠的密度等等,并且将由技术人员按照要求 确定。碘含量为155mg i/ml的颗粒具有6769hu的射线不透性,并且视为 提供了良好水平的射线不透性,通过荧光照相术可充分显现,提供良好的 乳液稳定性以及药物如多柔比星的负载和释放。然而,碘含量的上限可高 达200或250mg i/ml。30至200mg i/ml的范围视为有用的,例如30-175、 30-160、50-200、60-200、100-175、100-200和125-160mg i/ml。实例证实 碘含量为33-155mg i/ml的颗粒。
35.碘优选通过芳族基团例如苯基与聚合物结合,所述芳族基团本身优选 共价附着到聚合物。因此,1、2、3或4个碘可通过此类基团与聚合物结 合,例如作为单、二、三或四碘苯基。这允许方便地附着高密度的碘。
36.将此类基团与聚合物偶联的几种方法是已知的。例如,例如通过由碘 化单体或共聚单体形成聚合物,可在聚合物合成期间引入碘。已使用了卤 化单体例如丙烯酸酯、甲基丙烯酸酯和丙烯酰胺。通过benzina等人 (biomat.15(14)1122-1128(1994)和j.biomed.mater.res.32(3),459-466 (1996))描述了可与其它烯键式不饱和单体偶联的甲基丙烯酸2-(2'-碘苯甲 酰基)乙酯或甲基丙烯酸2-(2',3',5'-三碘苯甲酰基)乙酯。
37.这种方法还用于通过掺入丙烯酰胺基-3-丙酰氨基)-3-三碘-2,4,6-苯甲 酸制备碘化交联的三羟甲基甲基丙烯酰胺(us5648100)。
38.替代方法涉及将碘化基团与预形成颗粒如微球(合适的芳族基团,例 如碘化苯基)偶联。这可例如通过将反应性基团(例如碘化基团上的酰基 氯)与聚合物上的合适官能团(例如丙烯酸2-羟基酯的羟基(例如hema 颗粒中的甲基丙烯酸2-羟基乙酯基团,参见us4622367)偶联来实现。可 替代地,使用碳二亚胺或碳二咪唑偶联,可将醇(例如三碘苯甲醇)酸(例 如三碘苯甲酸)、胺(例如碘苄胺)或其它合适的碘化芳族基团衍生物与 聚合物偶联(参见例如wo 2014/152488)。
39.在一个优选实施例中,具有包含1,2或1,3-二醇的聚合物主链(例如 pva)的聚合物颗粒与碘化芳族醛(例如2,3,5-三碘苯甲醛)偶联,使得(pva) 主链包含通过环状缩醛共
价偶联的碘化芳族基团(例如三碘苯基),如 wo2015/033092(式i)中所述:
[0040][0041]
因此,在一个优选实施例中,颗粒包含pva的聚合物或共聚物。聚合 物是优选物理或共价交联的,并且包含至少20mg i/ml,优选高达250mgi/ml,其中碘优选通过芳族基团与聚合物共价偶联,所述芳族基团本身共 价偶联至聚合物;该芳族基团具有1、2、3或4个碘。当pva聚合物是 pva-共聚-丙烯酸钠或pva-amps聚合物(wo04071495)时,该方法是特别 优选的。
[0042]
油
[0043]
油是非矿物质(即有机)油,特别是植物衍生的油,并且应优选是通 过注射途径药学可接受的。
[0044]
虽然本发明根据的使用来描述,所述提供特别的 优点(例如由于掺入的碘的射线不透性),但可使用其它油。包含不溶于 水的脂质,特别是甘油单酯、甘油二酯或甘油三酯,或其游离脂肪酸,它 们的氢化产物或其酯(例如甲酯、乙酯和丙酯,优选乙酯),和/或这些的 卤化(例如碘化或溴化)产物是优选的,由于它们易于代谢的潜力。例如 罂粟籽油、蓖麻油、玉米油、棉籽油、橄榄油、花生油、薄荷油、红花油、 芝麻油、大豆油及其游离脂肪酸(如亚油酸、油酸、棕榈酸和硬脂酸)、 这些的氢化产物或其酯(例如甲酯、乙酯和丙酯,优选乙酯)、和/或这些 的卤化(例如碘化或溴化)产物。包含硬脂酸乙酯的油,特别是这些的碘 化产物是优选的,例如单碘硬脂酸乙酯和二碘硬脂酸乙酯。
[0045]
组合物
[0046]
油:水性比
[0047]
优选的乳液是油包水型;通过这种结构,油内的水相在离开导管时被 保护不接触血液。这防止水滴立即分散在血液中,导致乳液中存在的任何 药物分散到循环内。乳液中油(lipiodol)相/水相的比率应该大于1:1体积/ 体积lipiodol:水相,即乳液中lipiodol的比例应该超过水相的比例。优选 地,该比率为至少1.1:1、或至少1.5:1,例如在1.1:1和10:1或5:1之间。 特别地,范围为1.5:1至10:1、或1.5:1至6:1或5:1。
[0048]
颗粒:lipiodol比率
[0049]
一般而言,待在制剂中使用的颗粒数量将取决于所需的栓塞程度和达 到血流停滞所需的颗粒数量。用于任何乳液制备的最小数量将是使乳液稳 定的量,并且将根据乳液的组成成分而变化。通常,组合物中颗粒/lipiodol 的比率为1:100至1:1,优选1:20或1:40至1:1v/v,且更优选1:10或1:5 至1:1。
[0050]
体积指在颗粒干燥之前,在生理盐水(1mm磷酸钠ph7.2-7.4, 0.9%nacl)中完全水合的颗粒的填充体积(例如可使用量筒进行测量)(参 见实例1)。
[0051]
稳定性
[0052]
本发明的乳液证实改善的稳定性,并且通常稳定至少10分钟,优选 至少30分钟,更优选至少60分钟,更优选至少80分钟或90分钟。当根 据实例3a测量稳定性时,稳定性定义为10%乳液体积分离花费的时间。
[0053]
本发明的乳液在流动中也保持内聚性。乳液在实例3c中描述的静态 流动测试中形成稳定的油滴,并且在实例3d的连续流动测试中趋于在分 叉点处保持稳定。
[0054]
水相
[0055]
水相可为例如水或盐水(例如1mm磷酸钠ph7.2-7.4,0.9%nacl), 并且可包含另外的组分,例如药物或造影剂。
[0056]
造影剂
[0057]
造影剂可为允许通过成像模式(例如x射线、磁共振、超声、正电子 发射造影剂)检测水相(和因此乳液)的任何组分。此类试剂包括用于基 于x射线的系统,如荧光透视或投影射线照相术的含碘造影剂,用于mri 的含有钆、铁、铂或锰的造影剂;气泡制剂,例如用于超声的含气微气球, 或者用于正电子发射的含18f化合物、或64cu或68ga。通常,造影剂是 x射线造影剂,例如含碘化合物,特别是含有非离子碘的造影剂,例如碘 帕醇、碘海醇、碘克沙醇或碘普罗胺。
[0058]
药物
[0059]
当本组合物包含一种或多种药物活性剂时,它是特别有利的,所述药 物活性剂可存在于颗粒、油和/或水相中。油、水和颗粒相的存在提供了将 不同类型的药物掺入各自内的机会,例如本发明考虑提供乳液,其中油相 包含疏水性药物(其可为固体形式或溶解于油中),而水相包含亲水性药 物(其可为固体形式或溶解于水相中)。本发明还考虑了在颗粒和水相中 提供不同的亲水性药物。
[0060]
优选地,颗粒包含药物活性剂,其优选通过离子相互作用可释放地结 合到颗粒。
[0061]
抗肿瘤药物是优选的。特别是喜树碱(如伊立替康和拓扑替康)、蒽 环类药物(如多柔比星)、含铂药物(如螺铂、顺铂、奥沙利铂、米铂或 卡铂)、抗代谢物(如胸苷酸合成酶抑制剂,如5-fu)、激酶抑制剂(如 vegfr和egfr抑制剂,如舒尼替尼、索拉非尼、厄洛替尼、吉非替尼 和凡德他尼)、有丝分裂毒物(如紫杉烷,如紫杉醇或多西他塞;或长春 花生物碱,如长春碱和长春新碱以及合成形式如长春瑞滨)、芳香酶抑制 剂如阿那曲唑)、17α-羟化酶/c17,20裂解酶(cyp17a1)抑制剂(例如阿比 特龙或其乙酸盐)、抗叶酸剂(如氨甲蝶呤)、激素受体拮抗剂(如他莫昔 芬和地加瑞克)或激动剂(如布舍瑞林)、烷化剂(如苯丁酸氮芥、白消 安、链脲佐菌素、洛莫司汀和环磷酰胺)、视黄醇活化剂(如贝沙罗汀)。
[0062]
当颗粒荷电时,优选活性物在相同条件下携带相反电荷,以便促进药 物的负载。当活性物不荷电时,这可通过提供盐形式的活性物来实现。在 优选组合中,颗粒包含如上所述在ph6-8下带阴离子电荷的聚合物,并且 以可释放形式与聚合物结合,带阳离子电荷的药物。特别优选的是适用于 tace的药物。
[0063]
考虑的药物包括:
[0064]
放线菌素d、阿比特龙或其乙酸盐、阿地白介素、阿利维a酸、别嘌 呤醇、六甲蜜胺、氨磷汀、氨鲁米特、两性霉素b、安吖啶、阿那曲唑、 安丝菌素、阿糖腺苷、苯达莫司汀、苯甲酰胺、贝沙罗汀、博来霉素、3
‑ꢀ
溴丙酮酸、布舍瑞林、白消安、卡鲁睾酮、卡培他滨、卡铂、苯
丁酸氮芥、 卡铂、顺铂、米铂、螺铂、卡折来新、卡莫司汀、塞来昔布、苯丁酸氮芥、 克拉屈滨、环磷酰胺、阿糖胞苷、氟达拉滨、达卡巴嗪、多柔比星、柔红 霉素、表柔比星、伊达比星、地尼白介素、地塞米松、屈他雄酮、地加瑞 克、厄洛替尼、吉非替尼、伊马替尼、拉帕替尼、舒尼替尼、索拉非尼、 雌莫司汀、依托泊苷、依西美坦、非格司亭和聚乙二醇化衍生物、5-fu、 氟尿苷、氟他胺、氟维司群、地西他滨、吉西他滨、乙酸戈舍瑞林、羟基 脲、伊达比星、异环磷酰胺、干扰素、伊立替康、托泊替康、兰瑞肽、来 那度胺、来曲唑、甲酰四氢叶酸、亮丙瑞林(leuprolide)、亮丙瑞林(leuprorelin)、 洛莫司汀、meciorthamine、甲地孕酮、美法仑、巯基嘌呤、巯基聚赖氨酸、 氨甲蝶呤、培美曲塞、雷替曲塞、甲氧沙林、光辉霉素、丝裂霉素、米托 坦、米托蒽醌、苯丙酸诺龙、奥曲肽、奥普瑞白介素、奥沙利铂、紫杉醇、 帕米膦酸钠、喷司他丁、哌泊溴烷、普卡霉素、卟吩姆钠、丙卡巴肼、奎 纳克林、雷替曲塞、链脲佐菌素、他莫昔芬、替加氟-尿嘧啶、替莫唑胺、 替尼泊苷、睾内酯、硫鸟嘌呤、硫代tepa、托泊替康、托瑞米芬、曲奥 舒凡、维a酸、曲洛司坦、曲普瑞林、戊柔比星、凡德他尼、长春碱、长 春新碱、长春地辛、长春瑞滨、唑来膦酸。
[0065]
多柔比星、伊达比星、丝裂霉素、米托蒽醌、表柔比星、柔红霉素、 伊立替康、托泊替康、舒尼替尼、凡德他尼、米铂和索拉非尼是特别优选 的。
[0066]
乳液
[0067]
本发明的乳液包含趋于在水相中聚集的颗粒。水相中的颗粒在离开导 管时在乳液内受保护。因此,优选大多数颗粒与水相结合。
[0068]
疏水性
[0069]
不希望受任何理论的束缚,本发明人已鉴定通过使颗粒碘化改变聚合 物的亲水性,以增加聚合物的疏水特性。
[0070]
因此,本发明的一个进一步方面提供了乳液组合物,其包含连续相、 不连续相和多个颗粒,所述不连续相是水性的,并且所述连续相包含油; 其中所述颗粒是足够疏水的,使得使用2:1的碘油:水相比并且其中所述水 相不含造影剂、根据本文实例2制备的乳液在18至22℃下稳定至少10分 钟,优选至少30分钟,优选至少60分钟,更优选至少80分钟,且最优 选至少90分钟。
[0071]
使用力-距离-振幅方案和硅探针尖端,使用接触原子力光谱学(cafs), 可获得颗粒的相对亲水性/疏水性的近似值。这提供了硅尖端与作为干粉在 空气中分析的颗粒表面的相互作用的量度。
[0072]
本发明人已确定,当根据实例4a中所述的方案测量时,具有的悬臂 偏转(以伏特为单位测量)小于非碘化颗粒的悬臂偏转的颗粒在稳定乳液 方面有效。
[0073]
特别地,当冻干且用硅探针测量时,具有的悬臂偏转(cd)小于dc bead (70-150)um的悬臂偏转的颗粒是有效的。具有小于或等于0.2v的cd的颗 粒,特别是具有小于或等于0.15或0.1v的cd的那些颗粒是优选的。
[0074]
可替代地,具有比dc bead的悬臂偏转小至少0.5,优选至少0.6,且 更优选至少0.7v的cd的那些颗粒是优选的。
[0075]
可替代地,具有小于或等于dc珠的cd的0.25倍,优选小于或等于 dc珠的cd的0.2,且更优选小于或等于dc珠的cd的0.15或0.125x 的那些颗粒是优选的。
[0076]
发明陈述
[0077]
相应地,本发明的一个进一步方面提供了乳液组合物,其包含连续相、 不连续相和多个颗粒,所述不连续相为水性,并且所述连续相包含油;其 中当根据实例4a中所述的方案测量时,所述颗粒具有的悬臂偏转(以伏 特为单位测量)小于dc珠的悬臂偏转。
[0078]
方法
[0079]
本发明的一个进一步方面提供了用于制备如上所述的乳液的方法,其 包括:
[0080]
a.提供如本文所述包含油的连续相;
[0081]
b.提供如本文所述的水相
[0082]
c.提供如本文所述的多个颗粒,所述颗粒包含碘与之共价结合的聚合 物;和
[0083]
将它们组合以提供乳液。
[0084]
上文描述了组合物及其组分的优选特征。优选地,颗粒冻干提供。优 选地,在加入水相之前将颗粒与油相组合。优选地,水相包含如本文所述 的造影剂、或如本文所述的药物活性剂、或两者,在乳液形成期间,药物 被快速吸收到颗粒内,尤其是在其中聚合物荷电的情况下,并且如上所述, 药物携带相反电荷。当使用干燥颗粒时,这种负载过程加速,因此当使用 药物时,颗粒优选是冻干的。优选地,当颗粒冻干提供时,在它们仍处于 真空下的同时,水相或油相与颗粒组合。方便地,通过使组分在两个注射 器之间通过来形成乳液。
[0085]
优选通过使组分来回通过小孔来混合组分,所述小孔提供足够湍流以 形成乳液,方便地这通过使组分在两个注射器之间来回通过连接器如活塞 来实现。所得到的乳液稳定至少10分钟,优选至少30分钟,更优选至少 60分钟,更优选至少80分钟或90分钟。当根据实例3a测量稳定性时, 稳定性定义为10%乳液体积分离花费的时间。
[0086]
本发明的一个进一步方面是根据本发明的任何方面的乳液组合物,其 可通过如上所述的方法制备(或当制备时)。
[0087]
治疗方法
[0088]
本发明的一个进一步方面提供了在患有肿瘤且需要这种栓塞治疗的 患者中的栓塞治疗的方法,其包括提供如本文所述的栓塞乳液组合物并且 将该组合物递送至肿瘤的血管,递送通常是这样的,以便减少对肿瘤的血 液流动。
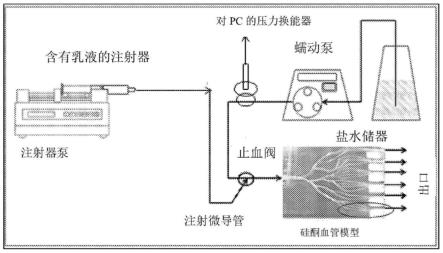
[0089]
肿瘤通常是富血管瘤,例如肝细胞癌。该组合物优选以足以减少对肿 瘤的血液流动的量递送,特别是栓塞的血管中的流动停滞或接近停滞。该 组合物通常通过导管递送到供应肿瘤的血管内,使得血流将组合物携带到 肿瘤内。至少在离开导管时,颗粒保持与乳液相结合,并且优选保留在油 包水乳液的小滴内。
[0090]
第二医疗用途
[0091]
本发明的一个进一步方面提供了用于通过栓塞疗法的肿瘤治疗中的 药物活性剂(如本文所述),其中如本文所述的,所述药物活性剂在根据 本发明的乳液组合物中递送。
[0092]
药物活性剂优选是抗肿瘤药物,并且优选选自多柔比星、伊达比星、 丝裂霉素、米托蒽醌、表柔比星、柔红霉素、伊立替康、拓扑替康、舒尼 替尼、凡德他尼、米铂和索拉非尼。
[0093]
在一个特别优选的实施例中,乳液组合物包含连续相、不连续相和多 个颗粒,所述不连续相是水性的,并且所述连续相包含油;其中:
[0094]
a)所述颗粒包含碘与之共价结合的聚合物,
[0095]
b)所述颗粒是足够疏水的,使得使用2:1的碘油:水相比并且其中所述 水相不含造影剂、根据本文实例2制备的乳液在18至22℃下稳定至少10 分钟,优选至少30分钟,优选
至少60分钟,更优选至少80分钟,且最 优选至少90分钟;或
[0096]
c)当根据实例4a中所述的方案测量时,所述颗粒具有的悬臂偏转(以 伏特为单位测量)小于dc珠的悬臂偏转。
[0097]
本发明的优选特征如上所述。
[0098]
试剂盒
[0099]
本发明还提供了用于制备本发明乳液的试剂盒,并且因此本发明的一 个进一步方面提供了用于制备乳液的试剂盒,所述乳液包含油和多个颗粒, 所述颗粒包含与所述颗粒共价结合的碘,所述试剂盒包含优选冻干提供的 如本文所述的多个颗粒和如本文所述的油。该试剂盒还可提供水相,其优 选为注射用水或盐水,并且可另外包含药物,所述药物可为本文所述的那 些中的任一种,但优选选自多柔比星、伊达比星、丝裂霉素、米托蒽醌、 表柔比星、柔红霉素、伊立替康、托泊替康、舒尼替尼、凡德他尼、米铂 和索拉非尼、
[0100]
现在将使用下述非限制性实施例和附图进一步描述本发明,在所述附
[0101]
图中:
附图说明
[0102]
图1示出了关于不同碘含量的珠的珠密度和含湿量。
[0103]
图2示出了使用2:1油/水的乳液,用不同碘含量的珠制备的乳液的乳 液稳定性和珠沉降。
[0104]
图3比较了使用非碘化珠制备的乳液与使用碘含量为155mg i/ml的珠 制备的乳液的显微照片。该图也是以33mg/ml碘的代表性颗粒。
[0105]
图4示出了代表性乳液制剂的盐水滴落测试结果,低碘颗粒具有 33mg/ml的碘含量,并且高碘颗粒具有155mg/ml的碘含量。
[0106]
图5是实例中使用的血管流动模型的图解表示。
[0107]
图6示出了在流动条件下的乳液行为的评分系统。
[0108]
图7显示了在流动模型中使用高碘(155mg i/ml)和低碘(33mg i/ml)微 球的示例性高含水量和低含水量乳液。
[0109]
图8示出了在乳液的部分分离后,用非碘化和高碘(147mg i/ml)微球 制备的再乳化乳液的效应。
[0110]
图9示出了在限制流动条件下来自本发明乳液的多柔比星的洗脱曲线, 建模了在体内来自栓塞组合物的药物释放。
[0111]
图10示出了关于微球的原子力显微镜检查研究结果。图10a示出了 计算硅尖端和微球表面之间的拉脱(粘附)力的原理,并且显示了具有悬 臂偏转的力-距离曲线。图10b示出了用未修饰的微球获得的结果,图10c 示出了使用具有33mg/ml碘的微球获得的结果,并且图10d示出了使用具 有155mg/ml碘的微球获得的结果。
具体实施方式
[0112]
实例:
[0113]
实例1碘化水凝胶微球的制备。
[0114]
通过将2,3,5-三碘苯甲醛与预先形成的pva-amps水凝胶微球(dc
biocompatibles uk ltd,farnham;uk)偶联来制备一系列碘化微球。 根据wo04071495的实例1,高amps形式直至且包括真空干燥以去除残 留溶剂的步骤,来制备微球。然后根据wo2015/033092的实例5和6进 行偶联,以提供包含经由环状缩醛与pva主链连接的三碘苄基的微球。制 备样品,其具有33至155mg/ml填充珠体积的碘含量和1020至6769hu 的射线不透性(根据wo2015/033092的实例12测量)。根据wo04071495 的实例1,高amps形式制备对照非碘化珠,并且该过程继续到染色步骤 的结束。筛分微球以提供70-150um的尺寸范围。
[0115]
这种碘共轭不仅具有由于存在不透射线的碘原子而增加珠的射线不 透性的效应,而且还在结构内引入疏水部分以降低含水量,并改变其表面 性质。
[0116]
表1示出了该系列碘改性珠的一些物理化学性质。图1示出了关于不 同碘含量的珠的珠密度和含湿量。
[0117]
表1:碘化栓塞微球的物理化学性质
[0118][0119]
*碘含量是在生理盐水中每ml完全水合的微球的填充体积测定的。一 旦冻干,碘化微球在完全再水合时就不恢复到完全相同的体积,因此本文 提及的微球积的所有测量指在它们已经历冻干之前每ml完全水合的微球 的碘含量。
[0120]
实例2:颗粒-油乳液的制备
[0121]
使用非碘化或碘化微球(155mg/ml碘)制备一系列乳液制剂。将含有 2ml根据实例1制备的完全水合的微球(填充体积-通过量筒测量)的各个 小瓶冻干,并且在真空下干燥贮存直至使用。经由注射器针通过小瓶密封 件将ultrafluide(10ml)加入干微球的小瓶内,而不破坏真空, 并且充分混合5分钟以确保将油摄取到微球内。然后将微球转移到20ml 聚丙烯注射器(becton dickson)内。将两毫升多柔比星水溶液(25mg/ml)抽 吸到10ml聚丙烯注射器(becton dickson)内。根据需要将另外的注射用水 或350造影剂(ge healthcare)加入多柔比星溶液中,以在与微 球混合时获得所需的油相和水相比率。
[0122]
使用聚酰胺3向旋塞(b.braun),将含有多柔比星混合物的注 射器附接到含有微球和lipiodol的20ml注射器。通过将水性药物溶液缓 慢加入lipiodol和微球中,并且混合以便在油相中生成水性药物液滴且形 成均质混合物,来执行2个注射器内容物的初始混合。
[0123]
然后将内容物在注射器之间快速混合(20次)。每5分钟重复一次共 30分钟,以确保药物分隔到乳液内和微球悬浮于乳液中。
[0124]
使用的乳液制剂在表3中给出。
[0125]
实例3:颗粒-油乳液的评价
[0126]
3a.稳定性:
[0127]
将制备的颗粒-油乳液转移到10ml聚丙烯注射器(becton dickson)内, 并且以直立方向放置,即注射器的长度处于垂直位置。目视监测油相和水 相的分离,以及乳液中微球的沉降。乳液稳定性时间确定为油相和水相分 离达到初始乳液体积的10%花费的时间。在显示微球沉降的制剂中,还注 意到微球沉降以达到初始乳液体积的大约10%花费的时间。
[0128]
使用最疏水性微球(155mg/ml碘)和亲水性微球(无碘)评估具有 各种比率的油和水的乳液的稳定性。表3报告了根据表2中所述的标准评 价的乳液的比较稳定性。
[0129]
表2:关于乳液稳定性的评价等级标准
[0130]
评级乳液稳定性(分钟)微球沉降(分钟)+《1《1++2-32-3+++3-53-5++++5-105-10+++++》10》10
[0131]
含有范围为1:1至5:1的油水比的疏水性微球的乳液的相对稳定性比 在具有亲水性微球(即无碘)的乳液(其通常仅稳定2-3分钟)中观察到 的那种好得多。
[0132]
对于具有2:1的油/水比的代表性乳液(66.7%lipiodol、33.3%aq,其 中20%是造影剂),与珠碘含量有关的乳液稳定性和珠沉降在图2中示出。
[0133]
表3:乳液稳定性评价
[0134][0135]
3b.外观:
[0136]
将含有非碘化或碘化微球(155或33mg/ml碘)的一滴乳液置于培养 皿上,并且立即用玻璃盖玻片覆盖。使用bx50显微镜,colorview iii相 机和stream essential成像软件(olympus)获得光学显微照片(x4或x10放 大率)。为了区分油相和水相,将活性蓝4染料在水中的水溶液(50mg/ml) 逐滴加入培养皿上的乳液中。乳液的水相可通过在显微镜下蓝色染料溶液 朝向其的迁移来鉴定。注意到乳液的类型(水包油或油包水)和微球相对 于油相或水相的位置。
[0137]
图3示出了颗粒-油乳液。尽管碘化微球相对高的水含量,但它们具有 位于油相中的优先,并且在液滴界面处积聚,因此稳定了液滴使之免于聚 结。即使在油/水的1:1比率下,其中乳液的连续相看起来是水性的,碘化 微球也仍然占优势地聚集在油滴周围,并且位于水和油之间的界面处。相 比之下,非碘化微球更亲水,并且观察到即使在具有高油组成(即2:1和 3:1油水比)的乳液中也位于水相中。
[0138]
3c.在静态流动条件下(盐水滴落测试)的乳液稳定性(内聚性)
[0139]
在室温下通过18号钝头填充针(becton dickson),将乳液样品递送到 0.9%盐水
溶液的表面下方。根据表4中定义的特征,观察且评定乳液的外 观和行为。显示为含有微球但没有碎裂或崩解的球形液滴的乳液视为具有 更好的流动行为和乳液稳定性。
[0140]
表4:静态流动特性的评价等级标准
[0141][0142]
图4示出了在代表性的颗粒-油乳液中观察到的流动特性,所述颗粒
‑ꢀ
油乳液具有范围大约为1.5:1至5:1的油/水比。含有碘的更疏水性的微球 导致液滴更具球形,并且具有比不含碘的相对亲水性微球更好的流动特性。 增加颗粒-油乳液中的含水量导致液滴更不具球形。这在不含碘的微球中更 显而易见。表5示出了结果
[0143]
表5:在静态流动下含有疏水性微球(33和155mg/ml)和亲水性微 球的乳液的行为
[0144][0145]
*具有33mg i/ml和155mg i/ml的微球表现相同。
[0146]
在其中油:水比为至少2:1的组合物中,含有以33mg/ml和155mg/ml 水平两者的碘化微球的乳液形成含有微球的稳定油滴。在较低的油-水比下, 乳液仍然能够形成含有颗粒的稳定油滴。
[0147]
相比之下,不含碘的微球显示与碘化样品相比较差的流动行为。测试 了具有这些微球的另外制剂,使用为2:1至3:1的油水比范围和不同的造 影剂组合物。这些并未改善乳液流动行为,使得它与用疏水改性的微球观 察到的流动行为可比较。
[0148]
3d.在连续流动下的行为
[0149]
体外血管流动模拟器(图5)用于概况分析在连续流动条件下乳液的 物理稳定性。在非限制性连续流动条件下测试在静态流动条件下(在上文 的"c."中)测试的颗粒-油乳液。
[0150]
将乳液转移到与微导管(progreat 2.4fr,terumo)附接的3ml聚丙烯 注射器(becton dickson)内,用于施用到设置为开环系统的硅酮血管流动模 拟器模型(elastrat sari,瑞士)内。
[0151]
微导管的远端在血管通道中最近定位,并且通过蠕动泵,将在环境温 度下的
0.9%盐水溶液以60ml/分钟的脉动速率泵送通过流动模型。颗粒
‑ꢀ
油乳液以大约0.5ml/分钟的注射速率手动施用通过微导管。就其流动特性 观察从微导管递送且进入血管流动模型和递送通道内的乳液的外观(表5), 并且评级形成离散油滴和在其流过内部血管网络时维持液滴完整性的能 力。显示为含有微球的离散球形油滴的乳液视为具有最佳的流动行为和稳 定性,即高得分,而流珠(不在油滴内)被定义为较不稳定和低得分的。
[0152]
可接受稳定性的最低要求是乳液具有(+++)等级,即显示为油流和珠 一起或稳定液滴或含有珠的油流,其在油/水界面处显著。
[0153]
表6:连续流动中的流动特性的评价等级标准
[0154][0155]
图7示出了在流动条件下的示例乳液,并且显示在连续流动下,用含 有碘的微球制备的乳液一致地产生微球位于其中的稳定液滴,当液滴通过 血管模型的分叉时具有完全保留。
[0156]
增加颗粒-油乳液中的含水量对其流动特性具有直接影响,其中非碘微 球不能形成含有微球的稳定油滴,即使当包含高油含量时。相比之下,亲 水性微球不形成含有珠的坚固液滴。在具有高油含量的乳液组合物中,的 确形成油滴,但微球趋于位于油的界面处并且具有在连续流动下移位且脱 落的趋势。
[0157]
表7报告了根据表5的流动特性评价。
[0158]
表7在连续流动下含有疏水性微球(33和155mg/ml)的乳液的行为
[0159][0160]
这些发现在健康猪的荧光镜引导递送和流动性质评估后得到体内支 持。根据体外结论,碘化微球(xxmg i/ml-70-150um)作为离散的乳液包流 动,而ctace lipiodol乳液和用未改性的微球制备的乳液呈现松散的
ꢀ“
whispy”流动性质,指示弱流动稳定性。
[0161]
3e.水相密度对颗粒-油乳液的作用
[0162]
当水相为水(具有比造影剂的比重低得多的比重)时,颗粒-油乳液的 行为与其中水相包含造影剂的乳液可比较。图8显示了在颗粒-油乳液中观 察到的流动特性的代表性图像,所述颗粒-油乳液使用水或造影剂以2:1的 油水比制备(表8)。
[0163]
表8:乳液的组成
[0164]
%lipiodol%水性%造影剂组分(在水性中)66.733.320.066.733.30
[0165]
在仅用水制备的乳液中,静态流动测试(盐水滴落)中乳液液滴的均 质性略微更低,然而,在连续流动下,它与用造影剂制备的乳液可比较。
[0166]
3f.在再混合时的乳液特性
[0167]
在初始制备后以及在相分离和随后的再混合之后,评估颗粒-油乳液的 流动特性
及其外观。含有更亲水性微球的颗粒-油乳液,没有结合的碘,在 流动下或在注射器中不形成稳定和坚固的乳液。一旦相分离已发生(3分 钟),乳液的再混合就加剧分开,并且总体注射器稳定性进一步降低至1 分钟。
[0168]
相比之下,含碘微球形成乳液,其稳定超过60分钟,并且一旦再混 合在注射器中仍然稳定并且能够在连续流动下形成稳定的液滴。在油和水 滴的相分离和聚结时,疏水性微球能够在再混合后稳定乳液,并且证实它 们的原始特性(参见图8)。
[0169]
3g.在具有受限流动的血流模拟器中乳液的体外药物洗脱行为
[0170]
从颗粒油乳液中释放的药物在连续流动条件下进行概况分析,在样品 递送时具有部分受限的流速。如节段3d中制备颗粒-油乳液和体外系统, 但如下将体外系统设置为半闭环系统。
[0171]
在其出口端口使用27μm微孔网(织造的聚酰胺)限制单个样品递送 通道,以模拟一旦乳液施用,流动限制在微通道中的效应。未用于样品递 送的硅酮血管模型上的其它出口不受限制,其出口将洗脱介质(0.9%盐水 溶液)再循环回盐水储器(加热至37℃)。将微导管远端放入单个样品递 送通道内,并且将盐水溶液以大约80ml/分钟的流速泵送通过受限的样品 递送通道。
[0172]
如上制备的颗粒-油乳液使用注射器自动注射器(phd ultra;harvardapparatus)以0.5ml/分钟的注射速率施用通过微导管。递送乳液直至观察 到在递送通道的出口端口处的流速已显著降低。在递送乳液期间,捕获来 自样品递送通道的盐水,并且通过uv/vis分光光度法(cary 50bio,varian) 在483nm的波长下分析,以确定洗脱的多柔比星的量。通过将其确定为所 施用的理论剂量的百分比,将经过20分钟时间洗脱的累积药物标准化。 表9给出了乳液的细节,关于其的数据显示于图9中。
[0173]
表9:实例3g中测试的乳液的组成
[0174][0175]
4a.微球表面性质的测量
[0176]
通过使用力-距离-振幅方案,使用接触原子力光谱学,来测量微球表 面的相对亲水性/疏水性。
[0177]
在dimension 3000原子力显微镜(afm)(digital instruments)上执行初 始定性
评价,并且使用nanoscope ida软件(digital instruments)收集数据。 当探针以1hz的恒定扫描速率从表面上方大约750-1800nm接近表面时, 通过测量来自悬臂的偏转信号(电压)来获得力距离曲线。悬臂偏转观察 为当尖端从微球表面缩回时以及当尖端离开表面时的信号电压差(图10)。 使用硅afm探针(pointprobe nch-w;nanosensors),预期粘附力和悬臂 偏转在具有更亲水表面性质的微球中将是最高的。
[0178]
不含碘的微球具有0.8v的最高悬臂偏转信号,并且在具有最高碘量 的微球中观察到0.1v的最低信号(表10),因此指示比较疏水性随着微球 中碘的增加而增加。
[0179]
表10不同碘含量的微球中的afm悬臂偏转信号
[0180]
碘含量(mg/ml)悬臂偏转(v)00.8330.21550.1
[0181]
4b交替afm测量
[0182]
使用asylum research cypher afm仪器(oxford instruments)和 contscr-10悬臂(硅探针)(nanoworld),执行粘附力的进一步验证。在 4μm
×
4μm的总扫描尺寸区域内,对于每个微球生成力图。力图包括总共 256个个别力距离曲线(在扫描区域内),其彼此间隔250μm(即,在16
×
16 测量的规则阵列中)。
[0183]
通过测量afm悬臂(保持未涂布的硅探针)在其接近微球表面且从 微球表面缩回时的偏转来获得力-距离曲线。每个曲线以1hz的恒定扫描 速率获取,并且包括在接近和缩回循环期间的2000个点。探针的尖端在 微球上方300nm处开始,并且在缩回之前被压入微球表面内20nm。取决 于微球表面的曲率,扫描区域上的z高度(afm探针尖端在微球表面上方 的距离)为大约300-800nm。悬臂偏转测量为信号电压,并且使用悬臂的 弹簧常量计算以给出粘附力。
[0184]
确定疏水性微球上的粘附力的这些评价(表11)显示,具有较低碘浓 度的疏水性微球具有最大的拉脱力,并且因此与硅afm探针的粘附力更 大。因为探针视为亲水性的,所以较低碘样品确定为比较高碘样品更不疏 水。
[0185]
表11含有碘的微球中的afm粘附力
[0186]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1