LINC00938在神经细胞凋亡中的应用的制作方法
linc00938在神经细胞凋亡中的应用
技术领域
1.本发明涉及生物医药技术领域,具体涉及一种长链非编码rna linc00938在神经细胞凋亡中的应用。
背景技术:
2.脑卒中(或中风)是指因大脑血液循环障碍而导致脑功能障碍的一类疾病,是一种急性脑血管疾病,包括缺血性脑卒中和出血性脑卒中。其中,缺血性脑卒中发病率较高,占脑卒中总数的60-70%。此外,缺血性脑卒中的致残率和死亡率也较高。不同类型的脑卒中,其治疗方式不同。研究可知,脑卒中的主要发病机制是缺血再灌注引起的损伤,诱导神经细胞发生显著的损伤。因此,进一步研究如何降低缺血再灌注引起的损伤,或促进神经损伤修复,对于脑卒中的预防和/或治疗具有重要的意义。
3.心肌缺血的损伤是因为心肌缺氧、缺营养成分所造成心肌细胞坏死或暂时功能受损,多部分会发生传导阻滞,下壁心肌梗死,可能会导致完全性右束枝阻滞。而缺血再灌注损伤是因为血液hbo2中的氧与受损心肌细胞或坏死心肌细胞的溶解物质反应形成氧自由基对部分心肌有损伤作用。缺血再灌注损伤可分为3种类型:心肌顿抑、再灌注性心律失常和心肌坏死。其主要表现为心肌细胞坏死、凋亡,线粒体功能障碍,脂质过氧化物增加,自由基大量生成,并导致恶性心律失常发生,左心室收缩力减弱,室内压下降等心肌功能的抑制。专利cn201310572068.2公开了鸢尾素在制备预防心肌缺血再灌注损伤的药物中的应用。专利cn201910802423.8则公开了alox12抑制剂在制备心脏缺血再灌注损伤治疗药物中的应用。
4.长链非编码rna类(lncrna)指的是长于200核苷酸的不编码蛋白质的转录物,其缺少或无开放阅读编码框,与编码蛋白基因相比,具有更高的组织器官特异性,且物种间的保守序列低,保守率《10%。根据其与邻近基因的位置可以分为反义lncrna、增强子lncrna、基因间lncrna、双向lncrna、和内含子lncrna。它具有多种生物学功能,比如在细胞核中作为分子支架、协助可变剪接、调节染色体结构,或在细胞质中调控翻译、促进或抑制mrna降解、吸附mirna(作为cerna)等。lncrna参与调控基因组印记、干细胞多潜能分化、胚胎发育、心脏发育、造血与免疫系统以及内分泌系统等多种生物生理学过程。在一系列疾病,比如神经退行性疾病、心血管疾病、肾脏疾病、糖尿病和肿瘤中,都发现了lncrna的表达异常。检测不同细胞或疾病状态下的lncrna表达量有助于发现其功能、揭示其作用机理、或鉴定有效的分子标志物。
5.神经细胞损伤可在体外通过sh-sy5y(人神经母细胞瘤细胞系)缺氧和葡萄糖剥夺(ogd)/再氧合(ogd/r)程序进行模拟,因此,围绕降低神经细胞ogd/r损伤,促进神经损伤修复,探索脑卒中有效干预手段,具有重要意义。
技术实现要素:
6.针对上述不足,本发明提供了一种长链非编码rna linc00938在神经细胞凋亡中
的应用。本发明通过sh-sy5y(人神经母细胞瘤细胞系)缺氧和葡萄糖剥夺(ogd)/再氧合(ogd/r)实验发现,长链非编码rna linc00938(ncbi登录号:nr_028408.1)可直接影响mapk信号通路,进而抑制神经细胞凋亡,对于缺血再灌注引起的损伤或脑卒中的预防和/或治疗具有重要的意义。
7.为了实现上述发明目的,本发明的技术方案如下:
8.一方面,本发明提供了长链非编码rna linc00938在制备预防和/或治疗神经细胞凋亡的药物中的应用。
9.具体地,所述的药物包括长链非编码rna linc00938。
10.具体地,所述的药物的剂型根据给药方式包括但不限于:经胃肠道给药剂型或非经胃肠道给药剂型。
11.进一步具体地,所述的经胃肠道给药剂型包括但不限于散剂、片剂、颗粒剂、胶囊剂、溶液剂、乳剂、混悬剂、油剂。
12.进一步具体地,所述的非经胃肠道给药剂型包括但不限于:注射给药剂型、呼吸道给药剂型、皮肤给药剂型、粘膜给药剂型、腔道给药剂型。
13.进一步具体地,所述的注射给药剂型包括但不限于:静脉注射剂、肌内注射剂、皮下注射剂、皮内注射剂、腔内注射剂。
14.进一步具体地,所述的呼吸道给药剂型包括但不限于喷雾剂、气雾剂、粉雾剂。
15.进一步具体地,所述的皮肤给药剂型包括但不限于外用溶液剂、洗剂、搽剂、软膏剂、硬膏剂、糊剂、贴剂。
16.进一步具体地,所述的粘膜给药剂型包括但不限于滴眼剂、滴鼻剂、眼用软膏剂、含漱剂、舌下片剂、粘贴片及贴膜剂。
17.进一步具体地,所述的腔道给药剂型包括但不限于栓剂、气雾剂、泡腾片、滴剂及滴丸剂。
18.具体地,所述的药物还包括药学上可接受的辅料。
19.进一步具体地,所述的药学上可接受的辅料包括但不限于溶剂、乳化剂、崩解剂、增溶剂、抗氧剂、ph调节剂、渗透压调节剂、抑菌剂、稀释剂、润湿剂、粘合剂、成膜剂等。
20.另一方面,本发明提供了长链非编码rna linc00938在制备预防和/或治疗缺血再灌注损伤的药物中的应用。
21.具体地,所述的药物包括长链非编码rna linc00938。
22.具体地,所述的药物的剂型根据给药方式包括但不限于:经胃肠道给药剂型或非经胃肠道给药剂型。
23.进一步具体地,所述的经胃肠道给药剂型包括但不限于散剂、片剂、颗粒剂、胶囊剂、溶液剂、乳剂、混悬剂、油剂。
24.进一步具体地,所述的非经胃肠道给药剂型包括但不限于:注射给药剂型、呼吸道给药剂型、皮肤给药剂型、粘膜给药剂型、腔道给药剂型。
25.进一步具体地,所述的注射给药剂型包括但不限于:静脉注射剂、肌内注射剂、皮下注射剂、皮内注射剂、腔内注射剂。
26.进一步具体地,所述的呼吸道给药剂型包括但不限于喷雾剂、气雾剂、粉雾剂。
27.进一步具体地,所述的皮肤给药剂型包括但不限于外用溶液剂、洗剂、搽剂、软膏
剂、硬膏剂、糊剂、贴剂。
28.进一步具体地,所述的粘膜给药剂型包括但不限于滴眼剂、滴鼻剂、眼用软膏剂、含漱剂、舌下片剂、粘贴片及贴膜剂。
29.进一步具体地,所述的腔道给药剂型包括但不限于栓剂、气雾剂、泡腾片、滴剂及滴丸剂。
30.具体地,所述的药物还包括药学上可接受的辅料。
31.进一步具体地,所述的药学上可接受的辅料包括但不限于溶剂、乳化剂、崩解剂、增溶剂、抗氧剂、ph调节剂、渗透压调节剂、抑菌剂、稀释剂、润湿剂、粘合剂、成膜剂等。
32.又一方面,本发明提供了长链非编码rna linc00938在制备预防和/或治疗脑缺血再灌注损伤及其相关疾病的药物中的应用。
33.具体地,所述的脑缺血再灌注损伤及其相关疾病包括但不限于:脑卒中、脑血管手术等。
34.具体地,所述的药物包括长链非编码rna linc00938。
35.具体地,所述的药物的剂型根据给药方式包括但不限于:经胃肠道给药剂型或非经胃肠道给药剂型。
36.进一步具体地,所述的经胃肠道给药剂型包括但不限于散剂、片剂、颗粒剂、胶囊剂、溶液剂、乳剂、混悬剂、油剂。
37.进一步具体地,所述的非经胃肠道给药剂型包括但不限于:注射给药剂型、呼吸道给药剂型、皮肤给药剂型、粘膜给药剂型、腔道给药剂型。
38.进一步具体地,所述的注射给药剂型包括但不限于:静脉注射剂、肌内注射剂、皮下注射剂、皮内注射剂、腔内注射剂。
39.进一步具体地,所述的呼吸道给药剂型包括但不限于喷雾剂、气雾剂、粉雾剂。
40.进一步具体地,所述的皮肤给药剂型包括但不限于外用溶液剂、洗剂、搽剂、软膏剂、硬膏剂、糊剂、贴剂。
41.进一步具体地,所述的粘膜给药剂型包括但不限于滴眼剂、滴鼻剂、眼用软膏剂、含漱剂、舌下片剂、粘贴片及贴膜剂。
42.进一步具体地,所述的腔道给药剂型包括但不限于栓剂、气雾剂、泡腾片、滴剂及滴丸剂。
43.具体地,所述的药物还包括药学上可接受的辅料。
44.进一步具体地,所述的药学上可接受的辅料包括但不限于溶剂、乳化剂、崩解剂、增溶剂、抗氧剂、ph调节剂、渗透压调节剂、抑菌剂、稀释剂、润湿剂、粘合剂、成膜剂等。
45.又一方面,本发明提供了长链非编码rna linc00938在制备缺血性脑卒中的靶标分子中的应用。
46.又一方面,本发明提供了一种药物,所述的药物包括长链非编码rna linc00938。
47.具体地,所述的药物的剂型根据给药方式包括但不限于:经胃肠道给药剂型或非经胃肠道给药剂型。
48.进一步具体地,所述的经胃肠道给药剂型包括但不限于散剂、片剂、颗粒剂、胶囊剂、溶液剂、乳剂、混悬剂、油剂。
49.进一步具体地,所述的非经胃肠道给药剂型包括但不限于:注射给药剂型、呼吸道
给药剂型、皮肤给药剂型、粘膜给药剂型、腔道给药剂型。
50.进一步具体地,所述的注射给药剂型包括但不限于:静脉注射剂、肌内注射剂、皮下注射剂、皮内注射剂、腔内注射剂。
51.进一步具体地,所述的呼吸道给药剂型包括但不限于喷雾剂、气雾剂、粉雾剂。
52.进一步具体地,所述的皮肤给药剂型包括但不限于外用溶液剂、洗剂、搽剂、软膏剂、硬膏剂、糊剂、贴剂。
53.进一步具体地,所述的粘膜给药剂型包括但不限于滴眼剂、滴鼻剂、眼用软膏剂、含漱剂、舌下片剂、粘贴片及贴膜剂。
54.进一步具体地,所述的腔道给药剂型包括但不限于栓剂、气雾剂、泡腾片、滴剂及滴丸剂。
55.具体地,所述的药物还包括药学上可接受的辅料。
56.进一步具体地,所述的药学上可接受的辅料包括但不限于溶剂、乳化剂、崩解剂、增溶剂、抗氧剂、ph调节剂、渗透压调节剂、抑菌剂、稀释剂、润湿剂、粘合剂、成膜剂等。
57.在某些实施例中,本发明进行了长链非编码rna linc00938对神经细胞凋亡的影响实验,其中包括:
58.构建了长链非编码rna linc00938的过表达慢病毒以及sirna干扰慢病毒,通过免疫印迹(westernblot)实验和tunel染色实验,结果显示,长链非编码rna linc00938表达升高抑制ogd/r后的神经细胞凋亡,长链非编码rna linc00938表达降低促进神经细胞的凋亡;
59.进一步,本发明利用神经细胞系sh-sy5y,通过rna seq高通量测序,检测了在长链非编码rna linc00938表达异常情况下,细胞内差异性表达的基因,及其富集的生物学过程及生物学信号通路,发现长链非编码rna linc00938表达异常情况下,mapk信号通路的变化较为明显;
60.进一步,本发明检测了在长链非编码rna linc00938表达异常情况下,通过westernblot实验检测了mapk信号通路中erk、jnk及p38信号通路的表达变化,westernblot结果显示,蛋白水平上,长链非编码rna linc00938沉默,会显著增加p-jnk及p-p38蛋白水平,激活jnk及p38 mapk信号通路,而ogd/r的神经细胞中,jnk及p38 mapk信号通路也是被激活,在氧糖剥夺的神经细胞中过表达长链非编码rna linc00938,可显著抑制jnk及p38 mapk信号通路;
61.进一步,本发明通过利用jnk信号通路及p38 mapk信号通路抑制剂,通过westernblot实验证实,在长链非编码rna linc00938沉默时,同时处理jnk信号通路或p38 mapk信号通路抑制剂,可显著抑制神经细胞凋亡。
62.本发明通过实验证实了,长链非编码rna linc00938能调节神经细胞的凋亡,长链非编码rna linc00938能调控mapk信号通路,长链非编码rna linc00938能通过调节mapk信号通路来抑制神经细胞凋亡。
63.本发明提供了长链非编码rna linc00938及其在信号通路调控中的用途,具体涉及该长链非编码rna linc00938能直接调节jnk信号通路及p38 mapk信号通路,进而影响神经细胞ogd/r凋亡的行为的用途。
64.与现有技术相比,本发明的积极和有益效果在于:
65.(1)本发明首次公开了长链非编码rna linc00938与神经细胞凋亡和缺血再灌注损伤及其相关疾病有关,其可以作为缺血性脑卒中的靶标分子,为研究脑卒中的发生、发展、预后的分子机理提供新的思路,具有重要的临床应用价值。
66.(2)本发明所述的长链非编码rna linc00938在神经细胞凋亡和缺血再灌注损伤中具有重要的调控作用,可用于神经细胞凋亡和缺血再灌注损伤及相关疾病的治疗,对于缺血再灌注引起的损伤或脑卒中的预防和/或治疗具有重要的意义。
附图说明
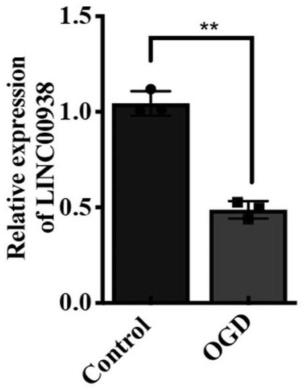
67.图1为linc00938在ogd/r组与对照组的shsy5y细胞中表达水平检测结果图。
68.图2为linc00938敲降后,敲降组与对照组的shsy5y细胞凋亡水平检测结果图,其中,a为分别采用含sirna1、sirna2、sirna3的慢病毒感染shsy5y细胞情况;b为分别采用含sirna1、sirna2、sirna3的慢病毒感染shsy5y细胞后,linc00938的相对表达量;c、d为采用western blot实验,检测含sirna2的慢病毒感染shsy5y细胞后,细胞凋亡水平;e为采用tunel实验,检测含sirna2的慢病毒感染shsy5y细胞后,细胞凋亡水平。
69.图3为linc00938过表达后,实验组与对照组的shsy5y细胞凋亡情况检测结果图,其中,a为慢病毒感染包含linc00938过表达的慢病毒和对照慢病毒;b为tunel检测对照组、ogd/r组和ogd/r组同时过表达linc00938,shsy5y细胞凋亡情况;c为ogd/r组和ogd/r组同时过表达linc00938组,凋亡相关蛋白表达水平;d为c的统计结果。
70.图4为rna-seq检测linc00938抑制神经细胞凋亡的机制结果图,其中,a为对照组和linc00938敲降组中,差异性表达的rna的聚类图;b为对照组和linc00938敲降组中,差异性表达的rna的火山图;c为对照组和linc00938敲降组中,差异性表达的rna的富集的go图;d为对照组和linc00938敲降组中,差异性表达的rna的富集的kegg图。
71.图5为westernblot实验检测linc00938通过调控mapk信号通路抑制神经细胞凋亡检测结果图,其中,a、b为westernblot实验检测对照组、ogd/r组和ogd/r同时过表达linc0038组中,mapk信号通路中的jnk、p38及erk信号通路的蛋白表达变化;c、d为westernblot实验检测对照组和linc00938敲降组中jnk和p38信号通路的表达变化;e、f为western blot实验检测分别/或同时抑制jnk和p38信号通路,linc00938对sh-sy5y细胞凋亡的影响。
72.图6为linc00938对斑马鱼的检测结果图,其中,a为过表达linc00938对斑马鱼无明显毒副作用;b为ao染色显示过表达linc00938可以降低缺氧导致的斑马鱼脑部神经细胞凋亡。
具体实施方式
73.下面结合具体实施例,对本发明作进一步详细的阐述,下述实施例不用于限制本发明,仅用于说明本发明。以下实施例中所使用的实验方法如无特殊说明,实施例中未注明具体条件的实验方法,通常按照常规条件,下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到。
74.实施例中未注明具体技术或条件者,均按照本领域内的文献所描述的技术或条件(如参考j.萨姆布鲁克等著,黄培堂等译的《分子克隆实验指南》,第三版,科学出版社)或者
按照产品说明书进行。
75.实施例1.长链非编码rnal inc00938的表达量检测
76.采用qpcr实验,检测氧糖剥夺/再氧合(ogd/r)的sh-sy5y细胞(人神经母细胞瘤细胞系)中人源长链非编码rna linc00938的表达。
77.其中,sh-sy5y细胞培养采用常规sh-sy5y培养方法,即用含10%fbs(胎牛血清),1%的ps(青霉素-链霉素双抗)的dmem(高糖培养基)培养基培养;细胞培养在含5%co2,37℃的细胞恒温培养箱中。
78.氧糖剥夺/再氧合(ogd/r)的sh-sy5y细胞培养方法如下:用含1%的ps(青霉素-链霉素双抗)的无糖dmem(无糖培养基)培养基培养,培养条件为:94%n2,1%o2,5%co2,37℃的细胞恒温培养箱中,培养24h后,恢复至正常细胞培养条件2h,以建立sh-sy5y细胞氧糖剥夺/再氧合(ogd/r)模型。
79.qpcr实验如下:
80.qpcr反应体系:7μl 2*mastermix,1μl linc00938 qpcr正向引物(5μm),1μl linc00938 qpcr反向引物(5μm),1μl sh-sy5y细胞来源cdna(浓度为20ng/μl),7μl超纯水(高压灭菌);所述人源长链非编码rna linc00938正向引物核苷酸序列如seq id no.1所示(5
’‑
agtctgcagtgggcaaatct-3’),人源长链非编码rna linc00938反向引物核苷酸序列如seq id no.2所示(5
’‑
gcaaccgcctcttgaaaagt-3’);其中内参18s rna正向引物核苷酸序列如seq id no.3所示(5
’‑
gcgccgctagaggtgaaattc-3’),内参18s rna反向引物核苷酸序列如seq id no.4所示(5
’‑
ttggcaaatgctttcgctc-3’);
81.qpcr扩增步骤如下:50℃2min,95℃2min,40个循环(94℃15sec,60℃60sec);
82.其中,qpcr的结果采用2^(-δδct)方法来计算非编码rna linc00938在氧糖剥夺/再氧合(ogd/r)的sh-sy5y细胞中的相对表达量(采用内参18srna进行标化)。
83.结果如图1所示,人源长链非编码rna linc00938在ogd/r的sh-sy5y细胞中表达显著下调。
84.实施例2.长链非编码rna linc00938敲降促进sh-sy5y细胞凋亡
85.采用慢病毒感染敲降sh-sy5y细胞中长链非编码rna linc00938,设计3个包含长链非编码rna linc00938 sirna序列的慢病毒过表达质粒,其中sirna序列为seq id no.5:gaggcgagagatctgtcaaca,seq id no.6:gaagcctgtggagtaattgta,seq id no.7:ggcatgtggatcaccaagata所示,其中慢病毒包装由南京科瑞斯生物科技有限公司提供,linc00938敲除程序如下,当细胞达到60%汇合时,用linc00938慢病毒或阴性对照(nc)慢病毒和含有ploybrene(10μg/ml)的新鲜常规培养基替换之前培养基。慢病毒转染后24h后,替换为常规培养基,转染72h后收集细胞进行拍照、qpcr、western blot和tunel实验。
86.其中,拍照设备为nikon eclipse ts2-fl;
87.qpcr实验步骤跟方法与实施例1中qpcr一致;
88.western blot实验方法为常规实验方法,简述为:使用含有1mm pmsf(苯甲磺酰氟)的ripa裂解缓冲液收集sh-sy5y;使用8-20%的丙烯酰胺/双丙烯酰胺凝胶分离蛋白质,然后将蛋白质转移到pvdf膜上;用5%封闭剂(含5%脱脂奶粉的1
×
tbst)在室温下封闭非特异性蛋白质;将膜与一抗(1:1000-1:5000)在封闭试剂中于4℃孵育过夜;然后,用1
×
tbst清洗膜三次,然后在室温下用hrp-结合的第二抗体(1:1000-1:5000)在封闭试剂中孵
育1小时;并用tanon 6200拍照观测;
89.tunel实验采用碧云天tunel检测试剂盒,操作步骤按照试剂盒使用说明,简述为:用pbs清洗细胞两次,用4%的pfa(多聚甲醛)固定30min;然后用pbs清洗固定细胞,用含有0.3%triton x-100的pbs培养5min;接下来,用pbs清洗细胞两次,用tunel检测液培养细胞60min,然后用pbs清洗两次,并加入dapi染色15min,用pbs洗涤两次,然后用尼康eclipse ts2 fl观察和拍摄图像。
90.结果如图2所示,长链非编码rna linc00938表达降低促进神经细胞的凋亡。
91.实施例3.长链非编码rna linc00938过表达抑制氧糖剥夺/再氧合(ogd/r)的sh-sy5y细胞凋亡
92.采用慢病毒感染在氧糖剥夺/再氧合(ogd/r)的sh-sy5y细胞中过表达长链非编码rna linc00938,其中linc00938过表达序列为ncbi数据库序列(ncbi登录号:nr_028408.1),慢病毒包装由南京科瑞斯生物科技有限公司提供,linc00938过表达步骤如下,当细胞达到60%汇合时,用linc00938慢病毒或阴性对照(nc)慢病毒和含有ploybrene(10μg/ml)的新鲜常规培养基替换之前培养基。慢病毒转染后24h后,替换为常规培养基,转染48h后,进行ogd/r,之后进行拍照,及收集细胞进行qpcr、westernblot和tunel实验。
93.其中,拍照、qpcr、westernblot和tunel实验操作如实施例2所示。
94.结果如图3所示,长链非编码rna linc00938表达升高抑制ogd/r后的神经细胞凋亡。
95.实施例4.长链非编码rna linc00938敲降影响mapk信号通路
96.采用高通量rna-seq测序,检测长链非编码rna linc00938抑制神经细胞凋亡的机制,其中,收集3组常规培养的sh-sy5y细胞,及3组长链非编码rna linc00938敲降的sh-sy5y细胞,提取rna,进行高通量rna-seq测序,高通量rna-seq测序实验由上海欧易生物医学科技有限公司完成。对rna-seq测序进行go及kegg分析,结果如图4所示,linc00938敲降的sh-sy5y细胞中,mapk信号通路变化最为明显。
97.实施例5.mapk信号通路中的jnk、p38mapk信号通路介导长链非编码rna linc00938影响sh-sy5y细胞凋亡
98.mapk信号通路包括jnk、p38mapk和erk信号通路,为了确定长链非编码rna linc00938抑制ogd/r神经细胞凋亡的具体作用机制,首先,采用western blot检测,ogd/r后mapk信号通路变化水平,结果如图5所示,ogd/r后,erk信号通路中的erk蛋白及磷酸化erk蛋白(p-erk)表达变化无明显差异;而jnk信号通路中的p-jnk蛋白表达水平明显上升,p38 mapk信号通路中的p-p38蛋白水平也明显上升;此外,在ogd/r处理的sh-sy5y细胞中同时过表达长链非编码rna linc00938,结果如图5所示,长链非编码rna linc00938过表达可明显降低jnk及p38 mapk信号通路的激活;其次,在sh-sy5y细胞中敲降长链非编码rna linc00938,也会激活jnk和p38 mapk信号通路;再次,为了确定长链非编码rna linc00938是否是通过jnk和p38mapk信号通路发挥神经保护作用,采用jnk和p38 mapk信号通路的抑制剂sp600125和sb203580,在敲低长链非编码rna linc00938的sh-sy5y细胞中,同时分别进行sp600125和sb203580处理,发现抑制jnk和p38 mapk信号通路时,敲低长链非编码rna linc00938导致的神经细胞凋亡明显降低。
99.其中,western blot实验步骤跟方法与实施例2中western blot实验方法一致;
100.jnk和p38 mapk信号通路的抑制sp600125和sb203580处理细胞的浓度为10μm。
101.实施例6.长链非编码rna linc00938过表达抑制斑马鱼缺氧模型头部细胞凋亡
102.首先,构建斑马鱼缺氧模型,用来模拟脑卒中,收集斑马鱼胚胎,待胚胎饲养至受精后24h(24hpf),将斑马鱼胚胎分为两组,斑马鱼缺氧模型利用氯化钴处理斑马鱼胚胎,且斑马鱼胚胎每隔24h换一次含氯化钴的养殖水直至96hpf,对照组用普通养殖水饲养斑马鱼;其次,收集斑马鱼胚胎,在1-细胞期对斑马鱼胚胎进行显微注射,注射组分为两组,分别为长链非编码rna linc00938注射组和对照组;待其生长至24hpf,待胚胎饲养至受精后24h(24hpf),将上述2组斑马鱼胚胎每组再分为2组,分别为斑马鱼缺氧模型组(利用氯化钴处理斑马鱼胚胎,且斑马鱼胚胎每隔24h换一次含氯化钴的养殖水直至96hpf)和对照组(用普通养殖水饲养斑马鱼);其次,将上述4组斑马鱼在发育至96hpf时进行吖啶橙染色(ao staining),具体步骤如下:斑马鱼胚胎在24h内用苯硫脲(ptu)处理,并维持96hpf;用10μg/ml吖啶橙(ao)进行染色;斑马鱼幼鱼染色30min,然后洗涤三次,最后用tricaine麻醉幼虫,并通过尼康eclipse ts2 fl荧光显微镜进行拍照。
103.其中,氯化钴的使用终浓度为:10mm;吖啶橙的使用终浓度为:10μg/ml。
104.结果如图6所示,linc00938对斑马鱼无毒副作用,且可以拯救因缺氧导致的脑部细胞凋亡。
105.以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1