一种BVDV灭活疫苗及其制备方法
一种bvdv灭活疫苗及其制备方法
技术领域
1.本发明属于疫苗制备技术领域,尤其涉及一种bvdv灭活疫苗及其制备方法。
背景技术:
2.牛病毒性腹泻(粘膜病)是由牛病毒性腹泻病毒(bovine viral diarrhea virus,bvdv)引起的一种接触性传染病,主要感染牛,也感染猪、羊、骆驼等其他生物,宿主范围较广。其中,牛、羊以消化道黏膜糜烂、腹泻、呼吸道疾病、繁殖障碍、免疫机能障碍、持续感染等为主要特征。牛病毒性腹泻病毒具有高感染率、高发病率和高死亡率,发病率可达50%,死亡率可达到90%。牛病毒性腹泻病毒的毒株包括致细胞病变型(cp型)bvdv标准株nadl毒株和非致细胞病变型(ncp型)bvdv分离株shz 132毒株。
3.疫苗免疫常是预防和控制牛病毒性腹泻(粘膜病)的重要措施,现阶段被正式认证过的牛病毒性腹泻病毒疫苗累计数量达到160余种,毒株的遗传以及抗原具有多样性,种类不同的疫苗在机体中能够发挥的作用也具有差异性,并且其副作用也不相同。其中灭活疫苗在使用过程中具有较好的安全性,具有较高的经济价值,可以有效的预防该病的发生和流行。相关研究证实,在接种bvdv疫苗以后,能够全面减少怀孕母牛流产、减少持续性感染流产等。病毒的灭活具有很多方法,物理方法有高温加热,紫外线灭活等;化学方法有甲醛灭活,β-丙内酯(βpl)灭活等。这些方法虽然会有效灭活病毒的活力,但是对于病毒抗原性的破坏也是不可忽略的。考虑到上述灭活疫苗存在的种种问题,寻找合适的新灭活剂对疫苗的研制至关重要。h2o2是一种高效氧化剂,通常用作抗菌剂和防腐剂。目前还未有以h2o2作为灭活剂制备bvdv灭活疫苗的有关报道。
技术实现要素:
4.有鉴于此,本发明的目的在于提供一种采用h2o2制备bvdv灭活疫苗的方法,制备所得的bvdv灭活疫苗具有高安全性和免疫原性。
5.为了实现上述发明目的,本发明提供了以下技术方案:
6.本发明提供了一种制备bvdv灭活疫苗的方法,包括如下步骤:将bvdv毒株病毒液与过氧化氢溶液混合至过氧化氢的浓度为1%-3%,灭活,得bvdv毒株灭活病毒液,将bvdv毒株灭活病毒液与弗氏佐剂混合,乳化得bvdv灭活疫苗。
7.优选的,所述bvdv毒株为bvdv nadl毒株。
8.优选的,所述bvdv毒株病毒液的浓度为10
6.6
tcid
50
/0.1ml。
9.优选的,所述bvdv毒株病毒液的制备方法包括如下步骤:将bvdv毒株接种至mdbk细胞中,进行病毒的扩繁,裂解mdbk细胞释放bvdv毒株,得bvdv毒株病毒液。
10.优选的,所述灭活的温度为27℃。
11.优选的,所述灭活的时间为2h-8h。
12.优选的,bvdv毒株灭活病毒液与弗氏佐剂的体积比为1:1。
13.优选的,所述弗氏佐剂为弗氏完全佐剂和弗氏不完全佐剂的混合液。
14.更优选的,弗氏完全佐剂和弗氏不完全佐剂的体积比为1:1。
15.本发明还提供了一种上述制备方法制备所得的bvdv灭活疫苗。
16.本发明的有益效果:
17.h2o2可以破坏脂质膜双层,氧化蛋白质骨架、氨基酸侧链并对核酸造成氧化损伤,诱导基因组rna或dna中的单链和双链断裂,是不可逆灭活机制。此外,本发明用h2o2作为bvdv疫苗灭活剂,由于h2o2可以分解成水和氧气从空气处理系统中排出,所以灭活bvdv毒株后即便是不进行后处理,也不会留下残留物。本发明用h2o2灭活bvdv毒株,不仅保留了bvdv病毒的免疫原性,而且在不影响其抗原性的情况下实现了不可逆地灭活bvdv病毒。与本领域常用的其他灭活剂相比,本发明采用h2o2灭活疫苗更安全、更有效。本发明将灭活完全后的病毒液用于灭活疫苗的制备,并且在小鼠上进行了免疫效果的验证,展示出安全、良好的免疫原性。
附图说明
18.图1为bvdv nadl株感染mdbk细胞后的病变情况(
×
400),其中a为正常mdbk细胞,b-d分别代表bvdv nadl株感染24h、48h和72h的结果;
19.图2为7%过氧化氢灭活的病毒液的细胞接种情况,其中a为7%过氧化氢灭活的病毒液组(
×
400),b为mdbk阴性对照组(
×
400);
20.图3为盲传三代后不同组别细胞接种情况,其中a为mdbk阴性对照组(
×
400),b为bvdvnadl阳性对照组(
×
400),c为灭活病毒液接种至mdbk细胞组(
×
400);
21.图4为细胞培养物中5'-utr基因的pcr结果,其中m为dl 500dna marker,nc为阴性对照(mdbk正常细胞盲传三代后的细胞记为阴性对照),1为正常细胞对照,2为阳性病毒对照,3为灭活病毒液盲传第三代的细胞培养物;
22.图5为过氧化氢灭活疫苗和甲醛灭活疫苗外观检验结果,上方两支为过氧化氢灭活疫苗,下方两支为甲醛灭活疫苗;
23.图6过氧化氢灭活疫苗和甲醛灭活疫苗稳定性检验结果,左侧为过氧化氢灭活疫苗,右侧为甲醛灭活疫苗;
24.图7为免疫小鼠血清bvdv特异性igg抗体水平检测结果;
25.图8为免疫小鼠ifn-γ分泌水平的动态变化;
26.图9为免疫小鼠il-4分泌水平的动态变化。
具体实施方式
27.本发明提供了一种制备bvdv灭活疫苗的方法,包括如下步骤:将bvdv毒株病毒液与过氧化氢溶液混合至过氧化氢的浓度为1%-3%,灭活,得bvdv毒株灭活病毒液,将bvdv毒株灭活病毒液与弗氏佐剂混合,乳化得bvdv灭活疫苗。
28.在本发明中,所述bvdv毒株优选为bvdv nadl毒株。本发明使用bvdv cp型的nadl株,能引起培养细胞空泡形成及死亡,具有较强的免疫原性。在本发明中,所述bvdv毒株病毒液的制备方法优选的包括如下步骤:将bvdv毒株接种至mdbk细胞中,进行病毒的扩繁,裂解mdbk细胞释放bvdv毒株,得bvdv毒株病毒液。本发明对于mdbk细胞和bvdv毒株的具体来源没有特殊限定。在本发明中,将bvdv毒株接种至mdbk细胞中的具体方法优选为:待mdbk细
胞长成单层且融合度达到70%-80%时,弃去原培养液,pbs清洗,加入无血清dmem液,并按培养液体积与病毒液体积10:1的比例接种bvdv毒株,病毒吸附细胞2h后,更换为含体积分数为2%fbs的dmem培养液继续培养。当bvdv毒株mdbk细胞病变达到80%以上时,裂解mdbk细胞释放bvdv毒株,收集病毒液。所述bvdv毒株病毒液的浓度优选为10
6.6
tcid
50
/0.1ml。本发明对于裂解mdbk细胞的具体方法没有特殊限定。
29.本发明对于过氧化氢溶液的具体来源没有特殊限定,所述灭活的温度优选为27℃,所述灭活的时间优选为2h-8h。灭活后得bvdv毒株灭活病毒液,然后与弗氏佐剂混合。bvdv毒株灭活病毒液与弗氏佐剂混合的体积比优选为1:1。所述弗氏佐剂优选为弗氏完全佐剂和弗氏不完全佐剂的混合液,弗氏完全佐剂和弗氏不完全佐剂的体积比优选为1:1。本发明对于弗氏完全佐剂和弗氏不完全佐剂的具体来源没有特殊限定。本发明对于乳化的具体方法没有特殊限定。
30.本发明还提供了一种上述制备方法制备所得的bvdv灭活疫苗。
31.下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
32.下述实施例中,如无特殊说明,均为常规方法。
33.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
34.实施例1
35.从液氮中取出mdbk细胞冻存管,用37℃温水快速融化,在超净工作台中转移至含有4ml细胞培养液的离心管中,800r/min离心5min,弃上清液,加入2ml培养液重悬细胞,转移至细胞培养板中放入37℃、5%二氧化碳、饱和湿度的培养箱中培养。待mdbk细胞长成单层且融合度达到70%-80%时,弃去原培养液,pbs清洗细胞3遍,加入无血清dmem液,并按培养液体积与病毒液体积10:1的比例接种bvdv nadl病毒,在37℃、含5%co2、饱和湿度的培养箱中病毒吸附细胞2h后,更换为含体积分数为2%fbs的dmem培养液继续培养。在24h、48h和72h后,使用倒置显微镜观察细胞形态进行拍照记录,结果如图1所示。
36.当bvdv nadl组mdbk细胞病变达到80%以上时,通过室温与-80℃条件下反复冻融细胞3次,使之完全破裂释放病毒,收集病毒液,1000r/min离心5min,0.22μm滤膜过滤后保存在-80℃冰箱。
37.采用millipore超滤管对收集的病毒液进行浓缩。将收集的所有病毒液充分混匀,0.22μm滤膜再次过滤后,取12ml滤液加入超滤管,4℃,12000r/min离心15min,至超滤管中浓缩液体积达1ml左右。将收集的所有浓缩液混匀,分装在1.5ml的离心管中,保存在-80℃,用于tcid
50
的测定。
38.bvdvnadl病毒浓缩液tcid
50
的测定
39.将mdbk细胞消化后接种96孔细胞培养板,每孔接种约1
×
104个细胞。待每个孔的细胞长成单层约60%的丰度即可接种上述浓缩步骤获得的病毒。使用多道加样器吸去原培养液,pbs清洗细胞3遍,每孔加入100μl无血清的dmem液。在无菌ep管中用无血清的dmem原液将nadl浓缩病毒液进行10倍倍比稀释(10-1
,10-2
,
……
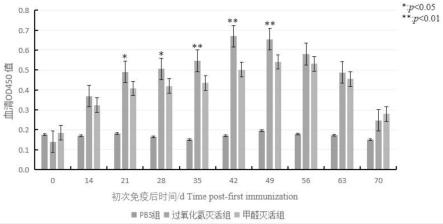
,10-10
),每个稀释度接种8个孔,每孔加入100μl病毒液,设空白细胞对照组。将培养板置于37℃、含5%co2、饱和湿度的培养箱吸附2h,更换为含体积分数为2%fbs的dmem培养液继续培养48h,显微镜下观察细胞病变,逐日观察并记录每个稀释度病变的孔数,按照reed-muench两氏法计算病毒的tcid
50
。
40.reed-muench两氏法计算公式如下:
41.距离比例=(高于50%病变率的百分数-50%)/(高于50%病变率的百分数-低于50%病变率的百分数)
42.lgtcid
50
=距离比例
×
稀释对数之间的差+高于50%病变率的稀释度的对数。
43.当收集的病毒液达到10
6.6
tcid
50
/0.1ml时,将该bvdv病毒液与30%浓度的过氧化氢溶液混匀,使过氧化氢溶液的终浓度为3%,于27℃灭活温度条件灭活反应2h,得bvdv毒株灭活病毒液。
44.将获得的bvdv毒株灭活病毒液与弗氏佐剂(弗氏完全佐剂与弗氏不完全佐剂的体积比为1:1)混合物按1:1混合均匀后,加入至用封口膜缠好针管口(防止乳化过程中漏液)的10ml注射器中,将注射器手柄去除,针管口朝下置于冰中,确保乳化仪的头部垂直伸入注射器中进行乳化,乳化至混合物呈乳状,取乳剂疫苗滴于冷水表面,除第1滴呈云雾状扩散外,其余各滴均不分散,即得bvdv灭活疫苗。
45.实施例2
46.过氧化氢灭活bvdvnadl毒株时灭活剂终浓度的确定
47.当收集的病毒液达到10
6.6
tcid
50
/0.1ml时(病毒液的获取方法同实施例1),将该bvdv病毒液与30%浓度的过氧化氢溶液混匀,使过氧化氢溶液的终浓度分别为7%、5%、3%、2%、1%、0.5%、0.3%、0.1%,于27℃下反应2h,过氧化氢酶终止反应后接种至生长良好的单层mdbk细胞上。培养4日后,通过倒置显微镜观察细胞状态。结果7%、5%、3%、2%、1%这5种灭活浓度下的细胞没有出现细胞病变情况;而0.5%、0.3%、0.1%浓度下的过氧化氢灭活组,观察到了细胞病变现象,但是7%、5%灭活组的细胞出现了空斑(如图2所示,以未接种病毒液的mdbk细胞作为阴性对照组),细胞形态发生变化,部分细胞脱落,表明7%、5%灭活组灭活剂浓度过高,残留的过氧化氢抑制了mdbk细胞的正常生长。
48.实施例3
49.过氧化氢灭活bvdvnadl毒株时灭活温度的确定
50.当收集的病毒液达到10
6.6
tcid
50
/0.1ml时(病毒液的获取方法同实施例1),将该bvdv病毒液与30%浓度的过氧化氢溶液混匀,使过氧化氢溶液的终浓度为3%,分别于22℃、27℃、32℃、37℃、42℃共五种温度条件下反应2h,过氧化氢酶终止反应后接种至生长良好的单层mdbk细胞上。培养4日后,通过倒置显微镜观察细胞状态。结果22℃、32℃、37℃、42℃四个温度梯度下的细胞状态并不理想,培养液中均可以看到漂浮的凋亡细胞,且37℃、42℃灭活温度下,贴壁细胞量大量减少;而27℃灭活温度下的细胞状态良好。所以,过氧化氢灭活bvdvnadl毒株的最适温度为27℃。
51.实施例4
52.过氧化氢灭活bvdvnadl毒株时灭活时间的确定
53.当收集的病毒液达到10
6.6
tcid
50
/0.1ml时(病毒液的获取方法同实施例1),将该bvdv病毒液与30%浓度的过氧化氢溶液混匀,使过氧化氢溶液的终浓度为3%,于27℃条件下分别反应2h、4h、6h、8h,过氧化氢酶终止反应后接种至生长良好的单层mdbk细胞上。培养4日后,通过倒置显微镜观察细胞状态。结果2h、4h、6h、8h四个灭活时间梯度下的细胞状态均良好。
54.实施例5
55.当收集的病毒液达到10
6.6
tcid
50
/0.1ml时(病毒液的获取方法同实施例1),将该bvdv病毒液与30%浓度的过氧化氢溶液混匀,使过氧化氢溶液的终浓度为3%,于27℃条件下反应2h,过氧化氢酶终止反应后接种至生长良好的单层mdbk细胞上进行了三代盲传,同时设立阳性病毒对照组(并未采用过氧化氢溶液进行灭活处理)和阴性对照组(未接种病毒液的mdbk细胞)。盲传三代后,通过倒置显微镜观察细胞状态。结果如图3所示,与阴性对照(图3a)和阳性对照(图3b)比较,盲传三代后(见图3c)细胞状态良好,未出现细胞病变,与阴性对照结果一致。
56.同时收集盲传三代后的细胞培养物,提取细胞的总rna,反转录后通过pcr鉴定细胞培养物中是否有病毒核酸5'-utr基因,结果(见图4)显示,bvdv病毒灭活完全,可用于后期的疫苗制备。
57.对比例1
58.以甲醛作为灭活剂制备bvdvnadl灭活疫苗,具体方法为:将bvdv nadl浓缩液(10
7.6
tcid
50
/ml)与甲醛溶液混合,使甲醛最终浓度为0.1%,置于37℃摇床灭活24h(以瓶内温度达到37℃开始计时),期间振摇3-4次。灭活后与弗氏佐剂(弗氏完全佐剂与弗氏不完全佐剂的体积比为1:1)混合物按1:1混合均匀后,加入至用封口膜缠好针管口(防止乳化过程中漏液)的10ml注射器中,将注射器手柄去除,针管口朝下置于冰中,确保乳化仪的头部垂直伸入注射器中进行乳化,乳化至混合物呈乳状,取乳剂疫苗滴于冷水表面,除第1滴呈云雾状扩散外,其余各滴均不分散,即得甲醛灭活bvdvnadl疫苗。
59.实施例6
60.对实施例1和对比例1所得的两种bvdv nadl灭活疫苗进行物理性状的检验
61.按照《兽医生物制品制造及检验规程》中的规定,对油乳佐剂灭活疫苗进行物理性状的检验。
62.外观检验结果:通过肉眼观察的方式对实施例1和对比例1制备完成的两种不同灭活剂制备的bvdv nadl灭活疫苗进行颜色和均匀度的检验,结果如图5所示,图5中上方两支为过氧化氢灭活疫苗,为质地均匀的乳白色乳剂,图5中下方两支为甲醛灭活疫苗,为质地均匀的淡粉色乳剂。
63.粘度检验结果:在室温下吸取过氧化氢灭活疫苗和甲醛灭活疫苗各1ml,垂直自然流出0.4ml,过氧化氢灭活疫苗需要5s,甲醛灭活疫苗需要3.5s,说明两种灭活疫苗的粘稠度较好,适合注射用。
64.剂型检验结果:弗氏佐剂属于油乳剂型,所制的两种灭活疫苗在水中呈油滴状,不扩散,为油包水型油乳剂,符合要求。
65.稳定性检验结果:取实施例1和对比例1两种灭活疫苗各1ml,在4000rpm/min条件下离心15min,结果如图6所示,两种疫苗均未发生分层现象,说明本发明制备所得的疫苗稳定性较好。
66.实施例7
67.实施例1和对比例1所得的两种bvdv nadl灭活疫苗的无菌检验和安全检验
68.无菌检测:将实施例1和对比例1制备完成的两种灭活疫苗分别接种于普通肉汤培养基和血琼脂培养基中进行无菌检验,37℃温箱中培养72h后,没有见到肉汤浑浊现象以及血琼脂培养基上没有出现肉眼可见的菌落,镜检未检出细菌,表明本发明制备的疫苗均无
细菌污染,符合要求。
69.安全性试验结果:将实施例1和对比例1制备完成的两种灭活疫苗在室温环境下进行回温,回温结束后通过背部皮下多点注射的方式接种spf级雌性昆明小鼠(每种灭活疫苗均接种10只小鼠),注射剂量分别为1ml/只,接种后饲养于实验室无菌条件的动物房,让其自由采食并观察两周。结果表明,接种过两种灭活疫苗的10只小鼠体温、精神、食欲均表现正常,无任何不良反应,且注射部位吸收良好,表明制备的两种疫苗具有良好的安全性,可以用于后续实验。
70.实施例8
71.将经实施例7和实施例8检验合格后的两种灭活疫苗分别免疫4周龄清洁级小白鼠(以注射pbs为阴性对照组),注射部位为腹膜腔多点注射方式,注射剂量分别为1ml/只,共免疫两次,每次间隔两周。免疫期间,观察记录小鼠的健康状况。
72.两种灭活疫苗免疫小鼠血清中bvdv特异性igg抗体的检测结果
73.采用间接elisa方法对免疫前和免疫后采集的各试验组小鼠血清bvdv特异性igg抗体水平进行检测。具体方法为:包被:首先使用包被液与实施例1中浓缩纯化所得到的bvdv nadl病毒液按1:16进行稀释,以100μl/孔的量加入酶标板中,4℃过夜。封闭:弃去包被液,并用pbst洗涤酶标板,重复三次,每次静置3min,每孔再加入5%的脱脂奶粉200μl作为封闭液,37℃封闭2h。结合一抗:弃去封闭液,重复洗涤三次后,用pbst将采集的血清稀释至500倍,以100μl/孔的量加入酶标板中,并设立阴性对照,37℃作用1h。结合二抗:弃去血清,重复洗涤三次后,加入经pbst稀释5000倍的酶标二抗(hrp标记的羊抗小鼠igg),100μl/孔,37℃作用1h。显色:弃去二抗,重复洗涤三次,完全拍干净后,加入100μl/孔的tmb显色液,室温避光静置10min。终止:加入50μl/孔的终止液终止反应。测定od值:用酶标仪检测od450值,计算p/n值:
74.p/n值=样品od值/阴性对照平均od值
75.p/n值≥2.1者为阳性;p/n值≤2.1者为阴性
76.结果如图7所示,与pbs对照相比,在首次接种过氧化氢灭活疫苗与甲醛灭活疫苗后14d,小鼠血清中就产生了bvdv特异性igg抗体,而且在二次免疫后呈现一个逐渐上升而后缓慢下降的过程。过氧化氢灭活组在第14d达到了保护的水平,此时的p/n值达到了2.18,第42d的p/n值达到峰值为3.97,并且一直维持较高水平至第63d,此时过氧化氢组的p/n值为2.82,抗体检测仍为阳性,还可以产生有效的保护。而在注射了甲醛灭活疫苗后的第21d,小鼠血清中bvdv特异性igg抗体达到了保护的水平(p/n值为2.27),在第56d,抗体水平达到峰值(p/n值为3.00);第70d过氧化氢灭活组与甲醛灭活组的抗体水平均大幅度下降至p/n值≤2.1。可见,两种不同灭活剂过氧化氢和甲醛制备的疫苗均能够使得免疫小鼠产生明显的体液免疫应答,且抗体水平随着免疫时间上升,分别在免疫后第42d和56d达到抗体水平峰值;过氧化氢灭活的病毒抗原能够诱导更高的的bvdv特异性igg抗体,且差异显著(p《0.05)。
77.两种灭活疫苗免疫小鼠血清中th1型(ifn-γ)细胞因子的检测
78.采用定量分析酶联免疫检测试剂盒检测免疫小鼠血清中ifn-γ含量的动态变化。结果如图8所示,免疫过氧化氢灭活疫苗的小鼠血清中ifn-γ的含量在首免后14~28d逐渐升高,分泌量高于pbs对照组,14d时差异不显著(p》0.05),28d时显著高于对照组(p《0.05);
在第28d达到峰值,第42d开始逐渐降低,第70d时,ifn-γ的含量恢复到免疫前水平。接种了甲醛灭活bvdv疫苗的小鼠血清中ifn-γ的含量在首免后14d~42d逐渐升高,分泌量高于pbs对照组,在第14d和28d时低于过氧化氢灭活组,但差异均不显著(p》0.05);在第42d达到峰值,首免后56d即下降到免疫前水平。可见,两种不同灭活剂制备的灭活疫苗均能够诱导小鼠体内th1型细胞因子ifn-γ的分泌。
79.两种灭活疫苗免疫小鼠血清中th2型(il-4)细胞因子的检测
80.采用定量分析酶联免疫检测试剂盒检测免疫小鼠血清中il-4含量的动态变化。结果如图9所示,过氧化氢组小鼠血清中il-4含量在首免后14d开始升高,且显著高于pbs对照组(p《0.05);在第28d时到达峰值,42d之后开始降低;第70d基本恢复到免疫前水平。甲醛组小鼠血清中il-4含量同样在首免后14d开始升高,在第28d时到达峰值,显著高于pbs对照组(p《0.05),42d之后开始降低;第70d基本恢复到免疫前水平。免疫后14~42d,过氧化氢灭活组小鼠血清中il-4含量高于甲醛组;第56d~70d,甲醛组小鼠血清中il-4含量较高,差异均不显著(p》0.05)。
81.本发明上述各组数据均使用spss软件进行结果统计。
82.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1