一种磷酸锰纳米材料在制备提高脂质体化疗药物渗透率的制剂中的应用
1.本发明属于生物医学技术领域,具体涉及一种磷酸锰纳米材料在制备提高脂质体化疗药物渗透率的制剂中的应用。
背景技术:
2.化疗是化学药物治疗的简称,目前临床上使用的化疗药物主要包括:盐酸阿霉素、紫杉醇、顺铂等小分子化疗药物。然而,小分子化疗药物的副作用却是影响临床上安全性的重要因素,由于小分子缺少靶向性、且半衰期短,因此其缺点主要体现在心脏毒性、肝毒性及肿瘤内药物积累量少等。为了解决小分子药物的副作用,小分子药物纳米化成为了热门研究,其中最主要的是脂质体化的纳米药物。以阿霉素为例,就已经有例如doxil(jinjun shi,philip w.kantoff,richard wooster,et al.cancer nanomedicine:progress,challenges and opportunities[j]nature reviews cancer,2017,17,20-37)、myocet等脂质体盐酸阿霉素。
[0003]
锰元素是人体组织中含量最丰富的金属元素之一,血液中锰的正常浓度范围为0.072μm-0.27μm,人脑中锰的正常浓度范围为20μm-53μm。锰一般以二价、三价的化合物存在于人体中,它在肌肉、骨髓、肝、肾、胰腺中含量较多。锰对人体起着必不可少的作用,如促进骨骼的生长发育、保护线粒体的完整、保持正常的脑功能、维持正常的糖代谢和脂肪代谢、改善机体的造血功能、抗氧化损伤等。研究显示,含锰离子在细胞外基质的研究中显示出降低细胞外基质成分的能力(f l
ü
then,u bulnheim,pd m
ü
ller,et al.influence of manganese ions on cellular behavior of human osteoblasts in vitro[j].biomolecular engineering,2007,24,531-536),但游离的锰离子的生理毒性较大。因此,将锰离子纳米化的研究具有重要意义。
[0004]
纳米药物能够明显的延长化疗药物的半衰期、增加药物的血液循环时间、降低小分子药物副作用等。但是,并未能够增加肿瘤内药物的积累。这是由肿瘤微环境的特性决定的,因为肿瘤是由密集的细胞外基质(如胶原、成纤维蛋白等)、血管组成的,纳米药物难以渗透进去。因此,增强纳米药物的肿瘤渗透是肿瘤治疗中的一个难题。
技术实现要素:
[0005]
为了克服现有技术的不足,本发明提供了一种磷酸锰纳米材料在制备提高脂质体化疗药物渗透率的制剂中的应用。本发明的制备方法所制备的磷酸锰纳米材料降低细胞外基质相关蛋白的表达,抑制肿瘤中细胞外基质(ecm)的产生并调节肿瘤细胞外基质,从而增强脂质体化疗药物渗透的作用。
[0006]
所述磷酸锰纳米材料采用如下步骤制备:
[0007]
(1)将含锰无机盐溶液按照锰离子终浓度为1mm~100mm加至细胞基础培养基中,调控仿生矿化反应的温度,维持仿生矿化反应体系ph值,进行仿生矿化反应;
[0008]
(2)收集步骤(1)所得的反应液,离心收集沉淀,清洗得到所述的磷酸锰纳米材料。
[0009]
作为本发明的优选方案,所述的含锰无机盐为水溶性的锰盐;所述的细胞基础培养基为dmem、mem、rpmi-1640中的一种或多种的混合。
[0010]
作为本发明的优选方案,步骤(1)中,所述的仿生矿化反应温度为25℃~42℃,ph值为7.0~7.5,反应时间为10min~24h。
[0011]
作为本发明的优选方案,所述的步骤(2)中的清洗为:将沉淀先用去离子水清洗再离心,然后再用无水乙醇清洗。
[0012]
作为本发明的优选方案,所述的磷酸锰纳米材料为球状纳米材料,平均直径范围为100nm。
[0013]
作为本发明的优选方案,所述的脂质体化疗药物为脂质体盐酸阿霉素(doxil)、脂质体光敏剂(bodypi)。
[0014]
所制备的磷酸锰纳米材料能够降低细胞外基质相关蛋白的表达,抑制肿瘤中细胞外基质(ecm)的产生并调节肿瘤细胞外基质,从而促进纳米药物的渗透,增强抗肿瘤效应。
[0015]
通过构建肿瘤动物模型,采用皮下注射技术在小鼠右后肢种上4t1细胞形成肿瘤组织,并采用静脉注射的方式化疗,分别使用纯化疗药物和所述的磷酸锰纳米材料加化疗药物对结果进行比较。
[0016]
本发明采用仿生矿化的方法,制备方法简单,条件安全可控;并通过tem表征技术表征其颗粒的性质;通过激光共聚焦表征技术证明其能够调节肿瘤细胞外基质,从而促进纳米药物的渗透,增强抗肿瘤效应。
附图说明
[0017]
图1.磷酸锰纳米材料的热场发射扫描电镜(fe-sem)图;
[0018]
图2.细胞微球的激光共聚焦变化(clsm)图;
[0019]
图3.免疫荧光染色的激光共聚焦(clsm)图;
[0020]
图4.实时荧光定量pcr(qpcr)图;
[0021]
图5.纳米药物渗透的激光共聚焦(clsm)图;
[0022]
图6.纳米药物体内渗透的流式细胞仪平均荧光强度图;
[0023]
图7.动物模型的体重变化图。
具体实施方式
[0024]
下面结合具体实施方式对本发明做进一步阐述和说明。所述实施例仅是本公开内容的示范且不圈定限制范围。本发明中各个实施方式的技术特征在没有相互冲突的前提下,均可进行相应组合。
[0025]
实施例1
[0026]
1)取5ml浓度为1m的mncl2溶液加入到495ml的dmem溶液中进行反应,反应在37℃的环境下进行,反应1h后,溶液变成浑浊的反应液。
[0027]
2)上述锰溶液的中锰离子理论浓度为10mm。
[0028]
3)将步骤1所得反应液用8000rpm离心10min,沉淀用去离子水和无水乙醇洗涤,重复三次,50℃烘干,得到100nm球状磷酸锰纳米材料(mnp)。
[0029]
所得磷酸锰纳米材料为实心球状材料,该颗粒直径为100nm,如图1所示。
[0030]
实施例2
[0031]
1)取所制备的100nm磷酸锰纳米材料,置于紫外下灭菌2h,无菌条件下加入适量的细胞培养基超声重悬,使其浓度为50μg/ml。
[0032]
2)称取1.5g琼脂糖,加入100毫升细胞培养基,高温高压灭菌30min后,趁热铺在6cm
2 dish中。
[0033]
3)待铺有琼脂糖溶液的培养皿冷却,成为固体琼脂糖板。
[0034]
4)将4t1细胞(小鼠乳腺癌细胞),以200000个细胞,铺于6cm2培养皿中生长成悬浮细胞球,待48h后,加入上述磷酸锰纳米材料,设置加入磷酸锰纳米材料的终浓度为50μg/ml。
[0035]
5)24h后,将步骤2)所得的细胞微球收集,并以800rpm常温离心3min,而后用hochest33342避光染色1h。
[0036]
6)1h后,将细胞微球以800rpm常温离心3min,用多聚甲醛固定液固定4h。
[0037]
7)4h后,将细胞微球以800rpm常温离心3min,去除多聚甲醛固定液后,加入1毫升pbs溶液,并转移至玻底培养皿中。
[0038]
本实施例所得的细胞微球在纳米磷酸锰纳米材料处理24h后,由细胞球破裂成单个细胞(图2)。由于细胞微球的形成是由细胞外基质紧密连接的,而所得的磷酸锰纳米材料能够使细胞球分散成单个细胞,证明其能够破坏细胞外基质。
[0039]
实施例3
[0040]
1)取所制备的100nm磷酸锰纳米材料,置于紫外下灭菌2h,无菌条件下加入适量的细胞培养基超声重悬,使其浓度为50μg/ml。
[0041]
2)将4t1细胞(小鼠乳腺癌细胞),以100000个细胞,铺于6孔板中的载玻片上,待细胞进入指数增长期时,加入上述磷酸锰纳米材料,设置加入磷酸锰纳米材料的终浓度为50μg/ml。
[0042]
3)12h后,将细胞爬片收集。
[0043]
4)将细胞爬片进行免疫荧光染色,所染蛋白为α-sma、col
‑ⅰ
。
[0044]
本实施例所得的细胞爬片在磷酸锰纳米材料处理12h后,进行免疫荧光染色。由于α-sma、col
‑ⅰ
为细胞外基质的主要成分,因此对这两个蛋白进行染色。激光共聚焦的结果显示,由所得的磷酸锰纳米材料处理过的细胞,其α-sma、col
‑ⅰ
的荧光强度明显降低,进一步证明其能够破坏细胞外基质(图3)。
[0045]
实施例4
[0046]
1)将4t1细胞(小鼠乳腺癌细胞)和细胞微球被不同的材料(dmem和mnp)处理12h。
[0047]
2)将细胞及细胞微球分别用trizol裂解液裂解,收集于1.5ml的ep管中,置于-80℃冰箱中保存。
[0048]
3)将样品取出并溶解,加入1mlreagent,剧烈震荡后加入0.2ml氯仿。
[0049]
4)室温放置2-3min,并以12000g,4℃离心15min,而后将上清液转移至1.5ml离心管,加入等体积的纯度为70%的乙醇,振荡混匀。
[0050]
5)转移上清液至高速旋转离心机,并以12000g,常温离心15s离心,弃去废液,加入50μl无rna酶的脱氧核糖核酸酶缓冲液(rnase-free dnase buffer)。
[0051]
6)室温下静置10min,彻底去除残余的基因组dna。加入700μl洗涤缓冲液i(wash buffer i)至高速旋转离心机,并以12000g,常温离心1min,弃去废液。加入500μl洗涤缓冲液ii(wash buffer ii)至高速旋转离心机,并以12000g,常温离心1min,弃去废液;重复一次。
[0052]
7)加入40-100μl depc处理水(rnase-free water)至高速旋转离心机中心(含新的1.5ml离心管),室温放置。
[0053]
8)1min后,以12000g,常温离心2min,用紫外分光光度计和电泳测定其含量、纯度及质量,贮存在-80℃冰箱中。
[0054]
本实施例所处理的细胞及细胞微球通过qpcr测定分析(图4)col-i和α-sma的表达水平均降低。由于调节α-sma和col-i的表达在ecm反应中起着至关重要的作用,证明mnp能够降低细胞外基质相关蛋白的表达,抑制肿瘤中细胞外基质(ecm)的产生并调节肿瘤细胞外基质。
[0055]
实施例5
[0056]
1)取所制备的100nm磷酸锰纳米材料,置于紫外下灭菌2h,无菌条件下加入适量的细胞培养基超声重悬,使其浓度为50μg/ml。
[0057]
2)称取1.5g琼脂糖,加入100毫升细胞培养基,高温高压灭菌30min后,趁热铺在6cm
2 dish中。
[0058]
3)待铺有琼脂糖溶液的dish冷却,成为固体琼脂糖板。
[0059]
4)将4t1细胞(小鼠乳腺癌细胞),以200000个细胞,铺于6cm
2 dish中,待48h后,加入上述磷酸锰纳米材料,设置加入磷酸锰纳米材料的终浓度为50μg/ml。
[0060]
5)12h后,将细胞微球收集,并以800rpm常温离心3min,而后分成3组用纳米药物doxil分别处理10min,1h,2h。
[0061]
6)doxil处理后,将细胞微球收集,并以800rpm常温离心3min,而后用hochest33342避光染色1h。
[0062]
7)1h后,将细胞微球以800rpm常温离心3min,用多聚甲醛固定液固定4h。
[0063]
8)4h后,将细胞微球以800rpm常温离心3min,去除多聚甲醛固定液后,加入1毫升pbs溶液,并转移至玻底培养皿中。
[0064]
本实施例所得的细胞微球在磷酸锰纳米材料处理12h后,再用纳米药物共培养,在激光共聚焦显微镜下显示,磷酸锰纳米材料处理后的细胞其红色荧光(doxil的荧光)更强,证明磷酸锰纳米材料能够促进纳米药物的渗透(图5)。
[0065]
实施例6
[0066]
1)将雌性blab/c小鼠右后肢皮下中注射4t1细胞(2
×
106个)(小鼠背部朝上)。
[0067]
2)当肿瘤细胞生长到约300mm3时,将小鼠分为3组(pbs、doxil、mnp+doxil)。
[0068]
3)将小鼠根据分组进行瘤内注射50μl pbs和50μl mnp,随后将除pbs组外的剩余两组小鼠均通过静脉注射100μl doxil(dox含量为2.5mg/ml)。
[0069]
4)24h后,将已经注射过pbs的小鼠继续加入50μl pbs,经过联合处理组的小鼠加入50μl mnp。
[0070]
5)48h后,处死小鼠,并解剖取出其肿瘤组织,添加胶原酶和dna酶将其剪碎并消化,用70μm的滤网将其过滤。
[0071]
6)将ep管编号序列,加入与编号相对应的悬液,并以300g常温离心5min,去上清后进行流式分析。
[0072]
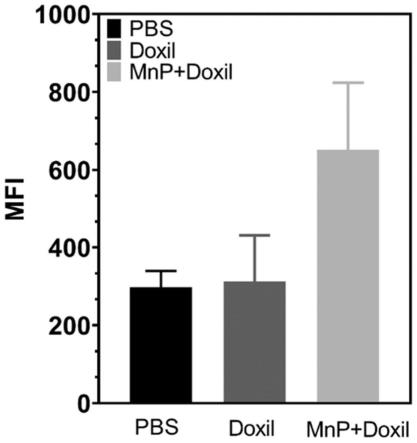
本实施例所处理的肿瘤组织通过流式分析测定肿瘤内的药物含量(图6),mnp与doxil联合处理组显示出最佳的药物积累能力,因此,mnp在体内也显示出良好的促进药物渗透与药物积累能力。
[0073]
实施例7
[0074]
1)将雌性blab/c小鼠右后肢皮下中注射4t1细胞(2
×
106个)(小鼠背部朝上)。
[0075]
2)当肿瘤细胞生长到约100mm3时,将小鼠分为4组(pbs、mnp、doxil、mnp+doxil)。
[0076]
3)将50μl pbs和50μl mnp分别注射到对应组的小鼠瘤内,100μl doxil(dox含量为2.5mg/ml)通过静脉注射到doxil组及联合给药组中,治疗给药为2天/次,共5次。
[0077]
4)使用游标卡尺每2天检测一次肿瘤大小,并按以下公式计算肿瘤体积:(长度
×
宽度2)/2。
[0078]
图7为本实施例所得的肿瘤生长曲线,根据图示可证明mnp+doxil组具有明显的抗肿瘤作用,与pbs组相比,肿瘤体积减少了62.65%,且单纯的doxil组的肿瘤抑制率仅为37.16%,进一步证实mnp处理可有效提高doxil的渗透,实现良好的抗肿瘤效果。
[0079]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1