注射用帕尼培南倍他米隆复方组合药物及其制备方法与流程
1.本发明涉及化学药物领域,具体地涉及注射用帕尼培南倍他米隆复方组合药物及其制备方法,尤其涉及其液氮速冻成型及冻干工艺制备方法。
背景技术:
2.随着抗生素药物的临床广泛应用,耐药性菌株的产生随之增加,给人类健康带来威胁,同时给临床治疗抗感染用药造成危机。碳青霉烯类抗生素药物已成为重度、复杂感染核心治疗药物,注射用帕尼培南(panipenem)和倍他米隆(betami-pron)无菌粉末,以抗菌谱广、抗菌活性强、毒性及耐药性低等特点,已成为重感染、多重耐药菌感染、混合感染的首选药物。帕尼培南单独使用时对肾脏有毒性,临床上倍他米隆与帕尼培南合剂使用,倍他米隆作为有机离子运送抑制剂,无抗菌活性肾保护剂,其具有抑制帕尼培南向肾小管分泌,从而降低帕尼培南在肾皮质的浓度,减弱帕尼培南的肾毒性。倍他米隆配伍应用,其复合制剂是帕尼培南与倍他米隆按0.5g:0.5g配比。
3.目前帕尼培南-倍他米隆在配制注射用相关制剂时,依然存在下述问题:
4.(1)帕尼培南倍他米隆冻干粉体分装剂量不精确、制剂原料易氧化、吸潮等问题;
5.(2)以往的冻干燥工艺过程中存在无法升华干燥、外观无法成型、水份偏高及产品稳定性差的问题;
6.(3)制剂相关工艺中存在二次污染问题,同时医护人员在临床使用中可能出现混药差错;
7.(4)常规制剂工艺中还存在药物在预冻中的降解问题。
8.因此,目前仍亟需一种注射用帕尼培南倍他米隆复方组合药物及其制备方法。
技术实现要素:
9.为解决现有技术中的技术问题,本发明使用同一容器利用液氮速冻冷却的方式将两种不同药物溶液分层冷冻成型,首先灌入下层倍他米隆溶液,经液氮快速冷凝固后,再灌入上层帕尼培南溶液,再经液氮快速冷凝固,制备成双层,且两种药物不相互溶解,并在特定温度下进行回温处理,其能够确保两种药物在冻干过程中保持外观良好、降解杂质低、复溶性优良、质量稳定的冻干产品以解决生产工艺技术难题。具体地,本发明包括以下内容。
10.本发明的第一方面,提供一种注射用帕尼培南倍他米隆复方组合药物的制备方法,其包括:
11.(1)使倍他米隆溶液在第一冻结温度形成第一冻结层;
12.(2)使帕尼培南溶液在第二冻结温度并在所述第一冻结层上形成第二冻结层;
13.(3)将所述第一冻结层和所述第二冻结层进行梯度回温处理。
14.在某些实施方案中,根据本发明所述的制备方法,优选地,进一步包括(4)升华干燥和(5)解析干燥。
15.本发明中,帕尼培南和倍他米隆可以通过商购获得或通过已知方法合成,对此不
特别限定。其中,帕尼培南化学名:(5r,6s)-2-[(s-1-(乙酸亚胺吡咯-3-基)硫]-6-[(r)-1-羟乙基]-1-碳青霉-2-烯-3-羧酸,其分子式为c
15h21
n3o4s,分子量为339.41;倍他米隆化学名:n-苯甲酰基-β-丙氨酸,分子式:c
10h11
no3,分子量为193.20。
[0016]
优选地,本发明的倍他米隆溶液的配制包括以下步骤:取倍他米隆于注射用水搅拌,浓度为0.05-0.5g/ml,优选0.1-0.2g/ml。然后向其中缓慢滴加浓度为0.05-0.2g/ml,优选0.15-0.2g/ml的碱液,碱液的实例包括但不限于氢氧化钠或氢氧化钾溶液。溶解后,使用酸溶液调节ph至6.5-7.5,酸溶液包括但不限于盐酸或硫酸溶液。过滤除菌后,低温保存备用。
[0017]
优选地,本发明的帕尼培南溶液的配制包括以下步骤:取帕尼培南100-500g,优选200-400g于含钠盐的注射用水中搅拌,注射用水为3-6l,优选4-5l。钠盐的实例包括但不限于:氯化钠、氯化钾等,钠盐为10-50g,优选20-40g。溶解后向其中缓慢滴加0.05-0.2mol/l,优选0.05-0.15mol/l的碱液调节ph至6.5-7.0,碱液的实例包括但不限于碳酸氢钠溶液。过滤除菌后,低温充氮保存备用。
[0018]
优选地,本发明所使用的帕尼培南溶液在差示扫描量热仪(dsc)显示-27.60~-27.34℃的玻璃化转变温度区温度,-22.88~-19.27℃的崩解温度区温度;倍他米隆溶液在差示扫描量热仪显示-30.53~-29.21℃的璃化转变温度区温度、-21.66~-17.96℃的崩解温度区温度。
[0019]
优选地,步骤(1)和(2)的冻结发生在同一注射容器内,容器不特别限定,在具体实施方案中,其为管制中性硼硅瓶。冻结所使用的设备不特别限定,但优选在负压层流液氮隧道中进行。
[0020]
优选地,步骤(1)和(2)中使用的倍他米隆溶液和帕尼培南溶液的体积比为1:1-3,还优选为1:1.5-2.5,进一步优选为1:2。
[0021]
在某些实施方案中,根据本发明所述的制备方法,优选地,所述第一冻结温度为-75~-60℃。还优选地,步骤(1)的冻结时间为60-120s。
[0022]
在某些实施方案中,根据本发明所述的制备方法,优选地,所述第二冻结温度为-65~-55℃。还优选地,步骤(2)的冻结时间为90-150s。
[0023]
优选地,在进行步骤(3)之前,进一步包括所述第一冻结层和所述第二冻结层预冻处理,预冻温度为-45~-55℃,还优选为-48~-52℃。预冻时间为25-40分钟,优选为28-32分钟。预冻可以采用本领域已知的任何冻干设备,例如冻干机冻干箱。
[0024]
在某些实施方案中,根据本发明所述的制备方法,优选地,所述梯度回温处理包括至少一个阶段的退火过程,例如依次进行两个阶段的退火过程,更优选进行三个阶段的退火过程。
[0025]
在某些实施方案中,根据本发明所述的制备方法,优选地,所述退火过程包括下述三个阶段的至少一个阶段:
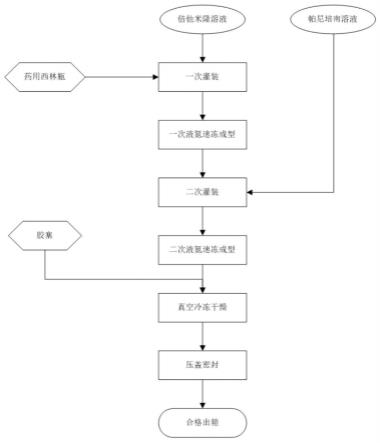
[0026]
第一阶段退火过程:在-50℃以下,使所述第一冻结层和所述第二冻结层保持一段时间,优选1-3h,例如1.5-2.5h,然后以-7~-12℃/小时,优选-8~-11℃/小时,还优选-9~-11℃/小时升温速率进行升温,升温至-25~-5℃,优选-22~-18℃,保持一段时间,优选0.5-2h,例如0.5-1h,然后以与所述升温速率相同的降温速率降温至-50℃,再次保持一段时间,优选1-3h,例如1.5-2.5h。
[0027]
第二阶段退火过程:在-50℃以下,使所述第一冻结层和所述第二冻结层保持一段时间,优选1-3h,还优选1.5-2.5h,然后以-7~-12℃/小时,优选-7.5~-9.5℃/小时,还优选-8~-9℃/小时的升温速率进行升温,升温至-18~-5℃,优选-16~-10℃,保持一段时间,优选0.5-2h,还优选1.2-1.8h,然后以与所述升温速率相同的降温速率降温至-50℃,再次保持一段时间,优选1-3h,还优选1.5-2.5h。
[0028]
第三阶段退火过程:在-50℃以下,使所述第一冻结层和所述第二冻结层保持一段时间,优选1-3h,还优选1.5-2.5h,然后以-7~-12℃/小时,优选-8~-11℃/小时,还优选-9~-11℃/小时的升温速率进行升温,升温至-18~-5℃,优选-12~-5℃,保持一段时间,优选0.5-2h,还优选0.5-1h,然后以与所述升温速率相同的降温速率降温至-50℃,再次保持一段时间,优选1-3h,还优选1.5-2.5h。
[0029]
本发明人在试验中发现两次液氮速冻成型中,由于液氮温度(-189℃)过低,药液快速冷却冻结过程中所产生的冰晶较小,导致升华干燥阶段不利于升华,但采用3次不同梯度回温(退火)步骤,能够显著改善速冻成型造成冰晶较小,后期升华干燥困难的问题。
[0030]
在某些实施方案中,根据本发明所述的制备方法,优选地,所述升华干燥包括下述至少一个阶段:
[0031]
a.第一阶段升华干燥:升温至-50℃~-30℃下,真空度控制在10~20pa,升温速率控制在-0.5~-5℃/小时,升温至-30℃,在此温度下维持6~8小时;
[0032]
b.第二阶段升华干燥:升温-30~-10℃下,升温速率控制在-0.5~-5℃/小时,真空度控制在10~20pa,升温至-10℃,在此温度下维持3~4小时;
[0033]
c.第三阶段升华干燥:升温-10~0℃下,升温速率控制在-0.5~-5℃/小时,真空度控制在10~20pa,升温至-0℃,在此温度下维持1~2小时。
[0034]
本发明的第二方面,提供一种注射用帕尼培南倍他米隆复方组合药物,其通过第一方面所述的制备方法得到。
[0035]
本发明技术效果包括但不限于:
[0036]
(1)本发明采用同一注射用容器内两种药物分层冷冻、一次真空冷冻干燥的技术,解决了帕尼培南倍他米隆冻干粉体分装剂量不精确、制剂原料易氧化、吸潮等问题。
[0037]
(2)本发明同时解决了两种药液分别配制、按比例互溶混合后因两种药物溶液共晶点不同以至冷冻干燥工艺过程中无法升华干燥、外观无法成型、水份偏高及产品稳定性差的问题。
[0038]
(3)本发明同一注射用容器分装的复合制剂在临床上解决了注射用粉针溶解及转移的二次污染问题,同时也避免医护人员在临床使用中出现混药差错,降低临床使用风险,方便临床使用。
[0039]
(4)本发明制备方法有利于解决对温度不稳定药物在预冻中的降解问题。
[0040]
此外,采用负压层流液氮隧道将两种药物溶液先后半浸渍在液氮中速冷冻成上下层,其操作简单,工业化生产简单可控,蒸发的液氮气体可利用至中央空调冷却系统,减少能源损耗。帕尼培南作为冻干制剂主要原料药物,配制成药液后其化学性质极不稳定,速冻低温条件及减少生产周期,有利于提高药物的质量和稳定性,同时大幅度降低制剂过程中杂质产生。因此,本发明为复杂药物制剂提供了一个确实可行的技术方案。
附图说明
[0041]
图1为本发明倍他米隆溶液差示扫描量热仪(dsc)玻璃化转变温度图。
[0042]
图2为本发明帕尼培南溶液差示扫描量热仪(dsc)玻璃化转变温度图。
[0043]
图3为注射用帕尼培南倍他米隆复方组合药物的冻干工艺及制备方法工艺流程图。
[0044]
图4为本发明实施例3冷冻干燥工艺曲线图,其中横坐标为时间(h),纵坐标为温度(℃)。
[0045]
图5为实施例1帕尼培南图谱(总杂率5.704%)。
[0046]
图6为实施例1倍他米隆图谱(总杂率2.161%)。
[0047]
图7为实施例2帕尼培南图谱(总杂率3.996%)。
[0048]
图8为实施例2倍他米隆图谱(总杂率1.398%)。
[0049]
图9为实施例3帕尼培南图谱(总杂率1.464%)。
[0050]
图10为实施例3倍他米隆图谱(总杂率0.633%)。
[0051]
图11为比较例1帕尼培南图谱(总杂率22.055%)。
[0052]
图12为比较例1倍他米隆图谱(总杂率22.414%)。
[0053]
图13为比较例2帕尼培南图谱(总杂率7.516%)。
[0054]
图14为比较例2倍他米隆图谱(总杂率4.289%)。
[0055]
图15为帕尼培南光照试验(5天)图谱(总杂率1.417%)。
[0056]
图16为倍他米隆光照试验(5天)图谱(总杂率0.693%)。
[0057]
图17为帕尼培南光照试验(10天)图谱(总杂率2.077%)。
[0058]
图18为倍他米隆光照试验(10天)图谱(总杂率0.132%)。
[0059]
图19为帕尼培南高温试验(5天)图谱(总杂率2.988%)。
[0060]
图20为倍他米隆高温试验(5天)图谱(总杂率0.101%)。
[0061]
图21为帕尼培南高温试验(10天)图谱(总杂率2.526%)。
[0062]
图22为倍他米隆高温试验(10天)图谱(总杂率0.728%)。
[0063]
图23为帕尼培南高湿试验(5天)图谱(总杂率2.616%)。
[0064]
图24为倍他米隆高湿试验(5天)图谱(总杂率0.220%)。
[0065]
图25为帕尼培南高湿试验(10天)图谱(总杂率2.409%)。
[0066]
图26为帕尼培南高湿试验(10天)图谱(总杂率0.922%)。
具体实施方式
[0067]
现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
[0068]
应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为具体公开了该范围的上限和下限以及它们之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
[0069]
除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规
技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。除非另有说明,否则“%”为基于重量的百分数。
[0070]
实施例1
[0071]
本实施例示出了注射用帕尼培南倍他米隆复方组合药物的制备方法,包括:
[0072]
1.倍他米隆药液配制工艺步骤
[0073]
a.精密称取naoh 72.5g,搅拌溶于500ml注射用水中,降至室温备用。
[0074]
b.精密称取倍他米隆300g,倒入2000ml注射用水中搅拌,缓慢滴加a制备的溶液,使倍他米隆完全溶解。
[0075]
c.调节ph=6.5~7.5(用0.5n的盐酸溶液调节)。
[0076]
d.用注射用水调节倍他米隆药液至总量为2800ml。
[0077]
e.精密称取总液量的0.5%针用活性炭,搅拌20min后先滤过0.45um滤膜脱炭,再过0.22um滤膜除菌,低温密封保存(2~5℃),待灌装。
[0078]
2.帕尼培南药液配制工艺步骤
[0079]
a.量取注射用水5000ml,称取氯化钠30g搅拌溶于注射用水中,冰浴降温至3~5℃保温备用。
[0080]
b.配制0.1mol/l的碳酸氢钠溶液。
[0081]
c.精密称取帕尼培南300g,将帕尼培南缓慢加入至a制备的溶液中搅拌溶解,缓慢滴加入b制备的溶液,控制ph=6.5~7.0。
[0082]
d.用注射用水调整帕尼培南药液至总量为5600ml。
[0083]
e.精密称取总液量的0.1%针用活性炭,搅拌20min后先滤过0.45um滤膜脱炭,再过0.22um滤膜除菌。
[0084]
f.配制液在2~5℃处充氮密封保存,待灌装。
[0085]
3.灌装工艺
[0086]
3.1一次灌装速冻成型:
[0087]
倍他米隆液每支装4.0ml(下层),移至多孔冻干专用不锈钢托盘中,再转送至负压层流液氮隧道中(-189℃)速冻60~120秒,将倍他米隆层冻结后,传输至多头灌装机工位处。
[0088]
3.2二次灌装速冻成型:
[0089]
帕尼培南液每支装8.0ml(上层),再转送至负压层流液氮隧道(-189℃)速冻90~150秒,将帕尼培南及倍他米隆层完全冻结且上下层清晰,不互相溶解。然后转入冻干机冻干箱内制品预冻至-50℃保持30min。
[0090]
4.真空冷冻干燥
[0091]
帕尼培南倍他米隆维持在-50℃以下,保持2小时,隔板缓慢升温,其升温速率控制在-10℃/小时,升温至-20℃时,保持1小时,然后降温至-50℃,其降温速率控制在-10℃/小时,保持2小时。
[0092]
第一阶段升华干燥:升温至-50℃~-30℃下,并开启真空泵,真空度控制在10~20pa,升温速率控制在-2.5℃/小时,升温至-30℃,在此温度下维持6~8小时;
[0093]
第二阶段升华干燥:升温-30~-10℃下,升温速率控制在-2.5℃/小时,真空度控制在10~20pa,升温至-10℃,在此温度下维持3~4小时;
[0094]
第三阶段升华干燥:升温-10~0℃下,升温速率控制在-2.5℃/小时,真空度控制在10~20pa,升温至-0℃,在此温度下维持1~2小时;
[0095]
第四阶段解析干燥:升温0~25℃下,升温速率控制在5℃/小时,真空度控制在10~30pa,升温至25℃,在此温度下维持2~4小时;冻干程序结束,保持真空条件下,压胶塞密封,出箱,扎铝盖,即得。
[0096]
实施例2
[0097]
1.倍他米隆药液配制工艺步骤
[0098]
a.精密称取naoh 72.5g,搅拌溶于500ml注射用水中,降至室温备用。
[0099]
b.精密称取倍他米隆300g,倒入2000ml注射用水中搅拌,缓慢滴加a中制备的溶液,使倍他米隆完全溶解。
[0100]
c.调节ph=6.5~7.5(用0.5n的盐酸溶液调节)。
[0101]
d.用注射用水调节倍他米隆药液至总量为2800ml。
[0102]
e.精密称取总液量的0.5%针用活性炭,搅拌20min后先滤过0.45um滤膜脱炭,再过0.22um滤膜除菌,低温密封保存(2~5℃),待灌装。
[0103]
2.帕尼培南药液配制工艺步骤
[0104]
a.量取注射用水5000ml,称取氯化钠30g搅拌溶于注射用水中,冰浴降温至3~5℃保温备用。
[0105]
b.配制0.1mol/l的碳酸氢钠溶液。
[0106]
c.精密称取帕尼培南300g,将帕尼培南缓慢加入至a制备的溶液中搅拌溶解,缓慢滴加入b制备的溶液,控制ph=6.5~7.0。
[0107]
d.用注射用水调整帕尼培南药液至总量为5600ml。
[0108]
e.精密称取总液量的0.1%针用活性炭,搅拌20min后,先滤过0.45um滤膜脱炭,再过0.22um滤膜除菌。
[0109]
f.配制液在2~5℃处充氮密封保存,待灌装。
[0110]
3.灌装工艺
[0111]
3.1一次灌装速冻成型:
[0112]
倍他米隆液每支装4.0ml(下层),移至多孔冻干专用不锈钢托盘中,再转送至负压层流液氮隧道中(-189℃)速冻60~120秒,将倍他米隆层冻结后,传输至多头灌装机工位处。
[0113]
3.2二次灌装速冻成型:
[0114]
帕尼培南液每支装8.0ml(上层),再转送至负压层流液氮隧道(-189℃)速冻90~150秒,将帕尼培南及倍他米隆层完全冻结且上下层清晰,不互相溶解。然后转入冻干机冻干箱内制品预冻至-50℃保持30min。
[0115]
4.真空冷冻干燥
[0116]
一次回温处理:帕尼培南倍他米隆维持在-50℃以下,保持2小时,隔板缓慢升温,其升温速率控制在-10℃/小时,升温至-20℃时,保持1小时,然后降温至-50℃,其降温速率控制在-10℃/小时,保持2小时。
[0117]
二次回温处理:帕尼培南倍他米隆维持在-50℃以下,保持2小时,隔板缓慢升温,其升温速率控制在-8.75℃/小时,升温至-15℃时,保持1.5小时,然后降温至-50℃,其降温速率控制在-8.75℃/小时,保持2小时。
[0118]
第一阶段升华干燥:升温至-50℃~-30℃下,并开启真空泵,真空度控制在10~20pa,升温速率控制在-2.5℃/小时,升温至-30℃,在此温度下维持6~8小时;
[0119]
第二阶段升华干燥:升温-30~-10℃下,升温速率控制在-2.5℃/小时,真空度控制在10~20pa,升温至-10℃,在此温度下维持3~4小时;
[0120]
第三阶段升华干燥:升温-10~0℃下,升温速率控制在-2.5℃/小时,真空度控制在10~20pa,升温至-0℃,在此温度下维持1~2小时;
[0121]
第四阶段解析干燥:升温0~25℃下,升温速率控制在5℃/小时,真空度控制在10~30pa,升温至25℃,在此温度下维持2~4小时;冻干程序结束,保持真空条件下,压胶塞密封,出箱,扎铝盖,即得。
[0122]
实施例3
[0123]
1.倍他米隆药液配制工艺步骤
[0124]
a.精密称取naoh 72.5g,搅拌溶于500ml注射用水中,降至室温备用。
[0125]
b.精密称取倍他米隆300g,倒入2000ml注射用水中搅拌,缓慢滴加a中制备的溶液,使倍他米隆完全溶解。
[0126]
c.调节ph=6.5~7.5(用0.5n的盐酸溶液调节)。
[0127]
d.用注射用水调节倍他米隆药液至总量为2800ml。
[0128]
e.精密称取总液量的0.5%针用活性炭,搅拌20min后,先滤过0.45um滤膜脱炭,再过0.22um滤膜除菌,低温密封保存(2~5℃),待灌装。
[0129]
2.帕尼培南药液配制工艺步骤
[0130]
a.量取注射用水5000ml,称取氯化钠30g搅拌溶于注射用水中,冰浴降温至3~5℃保温备用。
[0131]
b.配制0.1mol/l的碳酸氢钠溶液。
[0132]
c.精密称取帕尼培南300g,将帕尼培南缓慢加入至a制备的溶液中搅拌溶解,缓慢滴加入b制备的溶液,控制ph=6.5~7.0。
[0133]
d.用注射用水调整帕尼培南药液至总量为5600ml。
[0134]
e.精密称取总液量的0.1%针用活性炭,搅拌20min后,先滤过0.45um滤膜脱炭,再过0.22um滤膜除菌。
[0135]
f.配制液在2~5℃处充氮密封保存,待灌装。
[0136]
3.灌装工艺
[0137]
3.1一次灌装速冻成型:
[0138]
倍他米隆液每支装4.0ml(下层),移至多孔冻干专用不锈钢托盘中,再转送至负压层流液氮隧道中(-189℃)速冻60~120秒,将倍他米隆层冻结后,传输至多头灌装机工位处。
[0139]
3.2二次灌装速冻成型:
[0140]
帕尼培南液每支装8.0ml(上层),再转送至负压层流液氮隧道(-189℃)速冻90~150秒,将帕尼培南及倍他米隆层完全冻结且上下层清晰,不互相溶解。然后转入冻干机冻
干箱内制品预冻至-50℃保持30min。
[0141]
4.真空冷冻干燥
[0142]
一次回温处理:帕尼培南倍他米隆维持在-50℃以下,保持2小时,隔板缓慢升温,其升温速率控制在-10℃/小时,升温至-20℃时,保持1小时,然后降温至-50℃,其降温速率控制在-10℃/小时,保持2小时。
[0143]
二次回温处理:帕尼培南倍他米隆维持在-50℃以下,保持2小时,隔板缓慢升温,其升温速率控制在-8.75℃/小时,升温至-15℃时,保持1.5小时,然后降温至-50℃,其降温速率控制在-8.75℃/小时,保持2小时。
[0144]
三次回温处理:帕尼培南倍他米隆维持在-50℃以下,保持2小时,隔板缓慢升温,其升温速率控制在-10℃/小时,升温至-10℃时,保持1小时,然后降温至-50℃,其降温速率控制在-10℃/小时,保持2小时。
[0145]
第一阶段升华干燥:升温至-50℃~-30℃下,并开启真空泵,真空度控制在10~20pa,升温速率控制在-2.5℃/小时,升温至-30℃,在此温度下维持6~8小时;
[0146]
第二阶段升华干燥:升温-30~-10℃下,升温速率控制在-2.5℃/小时,真空度控制在10~20pa,升温至-10℃,在此温度下维持3~4小时;
[0147]
第三阶段升华干燥:升温-10~0℃下,升温速率控制在-2.5℃/小时,真空度控制在10~20pa,升温至-0℃,在此温度下维持1~2小时;
[0148]
第四阶段解析干燥:升温0~25℃下,升温速率控制在5℃/小时,真空度控制在10~30pa,升温至25℃,在此温度下维持2~4小时;冻干程序结束,保持真空条件下,压胶塞密封,出箱,扎铝盖,即得。
[0149]
比较例1
[0150]
1.倍他米隆药液配制工艺步骤
[0151]
a.精密称取naoh 72.5g搅拌溶于500ml注射用水中,降至室温备用。
[0152]
b.精密称取倍他米隆300g,倒入2000ml注射用水中搅拌,缓慢滴加a制备的溶液,使倍他米隆完全溶解。
[0153]
c.调节ph=6.5~7.5(用0.5n的盐酸溶液调节)。
[0154]
d.用注射用水调节倍他米隆药液至总量为2800ml。
[0155]
e.精密称取总液量的0.5%针用活性炭,搅拌20min后先滤过0.45um滤膜脱炭,再过0.22um滤膜除菌,低温密封保存(2~5℃),待灌装。
[0156]
2.帕尼培南药液配制工艺步骤
[0157]
a.量取注射用水5000ml,称取氯化钠30g搅拌溶于注射用水中,冰浴降温至3~5℃保温备用。
[0158]
b.配制0.1mol/l的碳酸氢钠溶液。
[0159]
c.精密称取帕尼培南300g,将帕尼培南缓慢加入至a制备的溶液中搅拌溶解,缓慢滴加入b制备的溶液,控制ph=6.5~7.0。
[0160]
d.用注射用水调整帕尼培南药液至总量为5600ml。
[0161]
e.精密称取总液量的0.1%针用活性炭,搅拌20min后,先滤过0.45um滤膜脱炭,再过0.22um滤膜除菌。
[0162]
f.配制液在2~5℃处充氮密封保存,待灌装。
[0163]
g.将上述所得两种药液混合,灌入西林瓶内,加胶塞输送至冻干箱内。
[0164]
4.真空冷冻干燥
[0165]
一次回温处理:帕尼培南倍他米隆维持在-50℃以下,保持2小时,隔板缓慢升温,其升温速率控制在-10℃/小时,升温至-20℃时,保持1小时,然后降温至-50℃,其降温速率控制在-10℃/小时,保持2小时。
[0166]
二次回温处理:帕尼培南倍他米隆维持在-50℃以下,保持2小时,隔板缓慢升温,其升温速率控制在-8.75℃/小时,升温至-15℃时,保持1.5小时,然后降温至-50℃,其降温速率控制在-8.75℃/小时,保持2小时。
[0167]
三次回温处理:帕尼培南倍他米隆维持在-50℃以下,保持2小时,隔板缓慢升温,其升温速率控制在-10℃/小时,升温至-10℃时,保持1小时,然后降温至-50℃,其降温速率控制在-10℃/小时,保持2小时。
[0168]
第一阶段升华干燥:升温至-50℃~-30℃下,并开启真空泵,真空度控制在10~20pa,升温速率控制在-2.5℃/小时,升温至-30℃,在此温度下维持6~8小时;
[0169]
第二阶段升华干燥:升温-30~-10℃下,升温速率控制在-2.5℃/小时,真空度控制在10~20pa,升温至-10℃,在此温度下维持3~4小时;
[0170]
第三阶段升华干燥:升温-10~0℃下,升温速率控制在-2.5℃/小时,真空度控制在10~20pa,升温至-0℃,在此温度下维持1~2小时;
[0171]
第四阶段解析干燥:升温0~25℃下,升温速率控制在5℃/小时,真空度控制在10~30pa,升温至25℃,在此温度下维持2~4小时;冻干程序结束,保持真空条件下,压胶塞密封,出箱,扎铝盖,即得。
[0172]
比较例2
[0173]
1.倍他米隆药液配制工艺步骤
[0174]
a.精密称取naoh 72.5g搅拌溶于500ml注射用水中,降至室温备用。
[0175]
b.精密称取倍他米隆300g倒入2000ml注射用水中搅拌,缓慢滴加a制备的溶液,使倍他米隆完全溶解。
[0176]
c.调节ph=6.5~7.5(用0.5n的盐酸溶液调节)。
[0177]
d.用注射用水调节倍他米隆药液至总量为2800ml。
[0178]
e.精密称取总液量的0.5%针用活性炭,搅拌20min后先滤过0.45um滤膜脱炭,再过0.22um滤膜除菌,低温密封保存(2~5℃),待灌装。
[0179]
2.帕尼培南药液配制工艺步骤
[0180]
a.量取注射用水5000ml,称取氯化钠30g搅拌溶于注射用水中,冰浴降温至3~5℃保温备用。
[0181]
b.配制0.1mol/l的碳酸氢钠溶液。
[0182]
c.精密称取帕尼培南300g,将帕尼培南缓慢加入至a制备的溶液中搅拌溶解,缓慢滴加入b制备的溶液,控制ph=6.5~7.0。
[0183]
d.用注射用水调整帕尼培南药液至总量为5600ml。
[0184]
e.精密称取总液量的0.1%针用活性炭,搅拌20min后,先滤过0.45um滤膜脱炭,再过0.22um滤膜除菌。
[0185]
f.配制液在2~5℃处充氮密封保存,待灌装。
[0186]
3.灌装工艺
[0187]
3.1一次灌装速冻成型:
[0188]
帕尼培南液每支装8.0ml(下层),再转送至负压层流液氮隧道(-189℃)速冻90~150秒,将帕尼培南冻结固化后,传输至多头灌装机工位处。
[0189]
3.2二次灌装速冻成型:
[0190]
倍他米隆液每支装4.0ml(上层),移至多孔冻干专用不锈钢托盘中,再转送至负压层流液氮隧道中(-189℃)速冻60~120秒,将倍他米隆层冻结后,传输至冻干箱内。
[0191]
4.真空冷冻干燥
[0192]
一次回温处理:帕尼培南倍他米隆维持在-50℃以下,保持2小时,隔板缓慢升温,其升温速率控制在-10℃/小时,升温至-20℃时,保持1小时,然后降温至-50℃,其降温速率控制在-10℃/小时,保持2小时。
[0193]
二次回温处理:帕尼培南倍他米隆维持在-50℃以下,保持2小时,隔板缓慢升温,其升温速率控制在-8.75℃/小时,升温至-15℃时,保持1.5小时,然后降温至-50℃,其降温速率控制在-8.75℃/小时,保持2小时。
[0194]
三次回温处理:帕尼培南倍他米隆维持在-50℃以下,保持2小时,隔板缓慢升温,其升温速率控制在-10℃/小时,升温至-10℃时,保持1小时,然后降温至-50℃,其降温速率控制在-10℃/小时,保持2小时。
[0195]
第一阶段升华干燥:升温至-50℃~-30℃下,并开启真空泵,真空度控制在10~20pa,升温速率控制在-2.5℃/小时,升温至-30℃,在此温度下维持6~8小时;
[0196]
第二阶段升华干燥:升温-30~-10℃下,升温速率控制在-2.5℃/小时,真空度控制在10~20pa,升温至-10℃,在此温度下维持3~4小时;
[0197]
第三阶段升华干燥:升温-10~0℃下,升温速率控制在-2.5℃/小时,真空度控制在10~20pa,升温至-0℃,在此温度下维持1~2小时;
[0198]
第四阶段解析干燥:升温0~25℃下,升温速率控制在5℃/小时,真空度控制在10~30pa,升温至25℃,在此温度下维持2~4小时;冻干程序结束,保持真空条件下,压胶塞密封,出箱,扎铝盖,即得。
[0199]
试验例:
[0200]
1.实验目的
[0201]
考察帕尼培南倍他米隆冻干粉针不同实施例的稳定性考察。
[0202]
2.材料和方法
[0203]
2.1帕尼培南
[0204]
实验采用高效液相色谱法,仪器型号为waters e2695;色谱柱:c18(welch materials.inc.规格:4.6
×
250mm,5μm);流动相(0.02mol/l磷酸二氢钾,用koh调节ph=8.0):乙腈=97:3;进样量:10μl;柱温:40℃;流速:1.0ml/min;检测波长:300nm最佳,参考波长为260nm,time:25min。
[0205]
2.2倍他米隆
[0206]
实验采用高效液相色谱法,仪器型号为waters e2695;色谱柱:c18(welchmaterials.inc.规格:4.6
×
250mm,5μm);流动相:(0.02mol/l磷酸二氢钾,加3~4滴三乙胺,磷酸调节ph=3.1):乙腈=80:20;进样量:10μl;柱温:40℃;流速:1.0ml/min;检测
波长:210nm;time:25min。
[0207]
2.3计算公式
[0208][0209][0210]
其中,a:峰面积;p:标准品含量;w:重量(mg)。
[0211]
2.4含量测定:按干燥品计算,含帕尼培南(c
15h21
n3o4s)和倍他米隆(c
10h11
no3)均不得少于40.0%,帕尼培南(c
15h21
n3o4s)和倍他米隆(c
10h11
no3)之比为0.95~1.05。(内控标准)
[0212]
3.结果
[0213]
各实施例、比较例冻干制剂检测数据下表。
[0214][0215][0216]
结论:以上各实施例及比较例检测数据表明,实施例3》实施例2》比较例2》实施例1》比较例1。实施例1、实施例2液氮速冻成型造成冰晶太小,升华过程中通道受阻升华干燥困难,易造成水分偏高,导致制剂杂质增多。其中比较例1由于两种药液混合其共晶点温度差异较大,升华干燥阶段水分子无法快速升华,造成塌陷萎缩现象。比较例2由于倍他米隆层溶液浓度较高,水分升华较慢,阻碍了帕尼培南层的水分升华,导致空洞萎缩现象。实施例3经过3次梯度回温处理,改变液氮速冻成型造成的冰晶较小,升华困难的技术缺陷,进一步说明3次梯度回温处理,能改善液氮速冻成型造成的冰晶较小升华困难的有效方法。
[0217]
实施例3倍他米隆帕尼培南制剂,各项检测指标符合质量要求,以该实施例作为下一步试验样品。
[0218]
4.影响因素试验
[0219]
根据《中国药典》、国食药监局标准ybh04002011和《化学药品稳定性指导原则》确定的稳定性考察项目及标准,检测结果见下表。
[0220][0221]
试验结果表明,实施例3制剂质量稳定,在高温、光照和高温条件下,样品稳定性较好,5天、10天样品的外观性状、含量、总杂、干燥失重、澄明度与色泽等指标在质量要求限度内。
[0222]
尽管本发明已经参考示例性实施方案进行了描述,但应理解本发明不限于公开的示例性实施方案。在不背离本发明的范围或精神的情况下,可对本发明说明书的示例性实施方案做多种调整或变化。权利要求的范围应基于最宽的解释以涵盖所有修改和等同结构与功能。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1