一种负载干细胞的水凝胶制剂及其应用
1.本发明属于细胞制剂应用技术领域,具体涉及一种负载干细胞的水凝胶制剂及其制备方法与应用。
背景技术:
2.糖尿病是一种以高血糖为特征的代谢性疾病。据报道,目前我国约有1.4亿人患有糖尿病,并且预估到2045年,中国糖尿病患者人数将上升到1.74亿。作为最常见的糖尿病并发症之一,糖尿病足溃疡(diabetic foot ulcer,dfu)具有较高的发病率与死亡率。糖尿病足溃疡是由糖尿病引起的足部缺血性、神经性以及神经缺血性病变,导致患者足部供血不足、感觉异常,并伴随有伤口溃烂、感染等症状,严重者可影响肌肉与骨骼,导致足部坏死并截肢。
3.目前,针对糖尿病足溃疡的传统治疗方法主要包括局部伤口清创去除坏死组织、高压氧治疗改善组织缺氧以及血糖控制等方法。然而,上述方法的临床疗效均难以达到预期,严重影响患者的生活质量,因此亟需寻找一种新的治疗方式。
4.人脐带间充质干细胞(human umbilical cord-derived mesenchymal stem cells,huc-mscs)是存在于新生儿脐带组织中的一种多功能干细胞。以脐带间充质干细胞为首的干细胞疗法作为再生医学的一大分支,其具有自我更新、多向分化的潜能,能够促进血管生成以及组织的修复与重建,因此在伤口愈合的过程中展现出巨大的应用前景。
5.随着再生医学的发展以及干细胞研究的深入,越来越多的研究关注将干细胞用于糖尿病足治疗的可能性。有临床试验结果表明,将干细胞注射在伤口部位对于伤口愈合具有良好的促进作用(moon,k.c.et al.diabetes,2019,68(4):837-836;carstens,m.h.et al.stem cells translational medicine,2021,10(8):1138-1147)。然而,这种局部注射或者全身注射干细胞的治疗方式也存在一定局限性,包括细胞凋亡率高、病灶部位滞留率低以及细胞定向分化效率低等。因此,最新的研究通过使用生物支架对干细胞进行局部移植。生物支架通过构建类细胞外基质环境,为细胞提供一个空间、立体的生存环境,从而利于细胞的生存、增殖、粘附与分化等。
技术实现要素:
6.本发明的目的可以通过以下技术方案实现:
7.一种用于负载脐带间充质干细胞的纤维蛋白水凝胶制剂的制备方法,该方法包括以下步骤:
8.(1)溶液a配制:在无菌环境下,称取一定重量单位的纤维蛋白原,使用干细胞保护液溶解纤维蛋白原,得到溶液a,溶液a中纤维蛋白原的浓度为1~50mg/ml;优选:溶液a中纤维蛋白的浓度为5~20mg/ml;
9.(2)溶液b配制:在无菌环境下,称取一定重量单位的凝血酶,使用干细胞保护液溶解凝血酶,并在其中加入一定量的抗纤溶剂,得到溶液b;溶液b中凝血酶的浓度为10~
100u/ml,所述的抗纤溶剂包括抑肽酶、氨甲环酸、4-氨甲基苯甲酸、6-氨基己酸中的一种或两种以上的混合物;
10.优选:溶液b中凝血酶的浓度为20~50u/ml;
11.(3)混合干细胞:在无菌环境下,用溶液a混合并重悬干细胞,每1
×
106个干细胞使用10~1000μl浓度为1~50mg/ml的纤维蛋白溶液重悬;
12.优选:每1
×
106个干细胞使用20~100μl浓度为5~20mg/ml的纤维蛋白溶液重悬;
13.(4)溶液混合得纤维蛋白水凝胶:在无菌环境下,将步骤(2)得到的溶液b加入步骤(3)中混有干细胞的溶液a中,混合均匀,并静置于恒温环境下3-5min,即得纤维蛋白水凝胶。
14.本发明技术方案中:步骤(1)中所述纤维蛋白原包括人纤维蛋白原、牛纤维蛋白原、兔纤维蛋白原、鼠纤维蛋白原、羊纤维蛋白原及其他种属来源纤维蛋白原中的一种或两种以上的混合物;
15.步骤(1)中所述凝血酶包括人凝血酶、牛凝血酶、兔凝血酶、鼠凝血酶、羊凝血酶及其他种属来源凝血酶中的一种或两种以上的混合物;
16.步骤(2)中所述的抗纤溶剂包括抑肽酶、反-4-氨甲基环已烷甲酸、4-氨甲基苯甲酸、6-氨基己酸中的一种或两种以上的混合物。
17.本发明技术方案中:步骤(1)与步骤(2)中使用的溶剂为干细胞保护液,其由以下几种组分构成:复方氨基酸溶液、l-谷氨酰胺、无水葡萄糖、无水氯化钙、复方电解质溶液、人血清白蛋白溶液;
18.该保护液各组分含量如下:每100ml的干细胞保护液中,含有复方氨基酸溶液0.1~30ml、l-谷氨酰胺0.01~2g、无水葡萄糖0.1~2g、无水氯化钙0.01~1g、复方电解质溶液50~90ml、人血清白蛋白溶液1-20ml;进一步优选:每100ml的干细胞保护液中,含有复方氨基酸溶液1~10ml、l-谷氨酰胺0.1~1g、无水葡萄糖0.5~1g、无水氯化钙0.05~0.5g复方电解质溶液75~90ml、人血清白蛋白溶液5~20ml。
19.本发明技术方案中:所述干细胞包括骨髓间充质干细胞、脐带间充质干细胞、脂肪间充质干细胞、胎盘间充质干细胞、羊膜间充质干细胞、牙髓间充质干细胞或肌源性干细胞。
20.本发明技术方案中:水凝胶成胶基质材料还可包括纤维蛋白、胶原、透明质酸、海藻酸、琼脂糖、壳聚糖、聚乙烯、聚乙二醇、丙烯酸及其衍生物中的一种或两种以上的混合物。
21.一种用于负载干细胞的水凝胶制剂的应用,该应用为负载有干细胞的水凝胶用于糖尿病大鼠皮肤溃疡伤口的修复;
22.进一步的,负载干细胞的水凝胶在糖尿病大鼠皮肤溃疡修复中的应用,包括以下步骤:取用双联注射器,在注射器的两支针筒中分别灌装入负载有干细胞的溶液a以及溶液b,将溶液均匀滴加至创面,待成胶后粘上无菌敷贴;
23.更进一步的,负载干细胞的水凝胶在糖尿病大鼠皮肤溃疡修复中的应用,还包括使用溶液a重悬干细胞,之后将溶液b加入溶液a中混合均匀,待形成稳定的凝胶后移植至伤口创面并粘上无菌敷贴。
24.本发明中我们设计并成功制备了具有促进伤口修复作用的负载干细胞的水凝胶
制剂,在使用水凝胶作为细胞支架的基础上,加入干细胞保护液提高水凝胶内干细胞的存活率,并加入抗纤溶剂以提高其稳定性从而发挥干细胞的长效治疗作用,从而实现对糖尿病足溃疡更加高效、持久的治疗。
25.本发明的有益效果:
26.(1)本发明中所制备的水凝胶,具有利于干细胞存活的优势。相较于已有研究中使用的水凝胶,本发明中添加的干细胞保护液具有提高干细胞存活率、存活时间的功能。此外,本发明中添加的抗纤溶剂可以提高水凝胶的稳定性,从而发挥干细胞的长效治疗作用。
27.(2)本发明中所制备的水凝胶,具有促进干细胞生长与增殖的功能。相较于干细胞的二维培养,水凝胶为干细胞生长提供了一个三维的类细胞外基质环境,可以有效避免二维培养所产生的细胞接触抑制现象,从而促进干细胞的增殖。
28.(3)本发明中水凝胶中的干细胞可以分泌干细胞外泌体、血管内皮生长因子(vascular endothelial growth factor,vegf)、血管生成素-1(angiopoietin-1,ang-1)以及碱性成纤维细胞生长因子(basic fibroblast growth factor,bfgf)等细胞因子对伤口进行修复。
29.(4)本发明中所制备的水凝胶,本身具有良好的止血性能以及生物黏合性能,有利于促进伤口溃疡的修复。
30.(5)因此,本发明能够简便高效的制备一种安全低毒的水凝胶制剂,具有潜在的医用前景。
附图说明
31.图1为体外环境下,不同比例纤维蛋白水凝胶中干细胞的增殖情况的结果。
32.图2为体外环境下,添加入不同抗纤溶剂的纤维蛋白水凝胶中干细胞的增殖情况的结果。
33.图3为体外环境下,不同处方纤维蛋白水凝胶中干细胞的增殖情况的结果。
34.图4为体外环境下,纤维蛋白水凝胶中干细胞的粘附情况的结果。
35.图5为pcr法检测干细胞伤口修复相关基因表达的结果。
36.图6为负载脐带间充质干细胞的纤维蛋白水凝胶制剂促进糖尿病创面愈合情况的结果。其中,图6(a)为不同治疗组在第0、3、5、7、14天的创面大小对比图;图6(b)为不同治疗组在第0、3、5、7、14天的创面大小统计图。
37.图7为不同组别经14天治疗后,伤口组织的h&e染色结果。
38.图8为不同组别经14天治疗后,伤口组织的cd31免疫组化染色结果。
具体实施方式
39.本发明设计成功并制备了负载干细胞的水凝胶制剂,该水凝胶以纤维蛋白原与凝血酶作为成胶基质材料,并加入抗纤溶剂以提高其稳定性,同时还添加入干细胞保护液以维持水凝胶内干细胞的生存。本发明以水凝胶作为生物支架,其模拟了三维的细胞外基质生长环境,能够支持干细胞的生长、增殖与分化,实现了对糖尿病伤口溃疡的修复。
40.在本发明的一个实施例中,选用了wistar大鼠作为主要模型以评估纤维蛋白水凝胶制剂的促伤口修复效果。在模型构建过程中,采用了高脂饲料喂养加链脲佐菌素注射的
方法构建糖尿病模型,之后在wistar大鼠背部构建皮肤全层损伤切除模型。
41.下面结合附图和具体实施例对本发明作进一步详细说明,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。实施例中未注明具体条件的实验方法及未说明配方的试剂均为按照本领域常规条件。
42.实施例1
43.(1)在无菌条件下,准确称取下述材料:无水氯化钙0.5g、无水葡萄糖1g、l-谷氨酰胺0.5g、复方氨基酸注射液5ml、复方电解质注射液90ml、人血清白蛋白5ml,用于配制干细胞保护液;
44.所述复方氨基酸注射液产品名称为复方氨基酸注射液(15aa),规格为250ml:20g(总氨基酸),购自湖北宜昌三峡制药有限公司。
45.(2)在无菌条件下,准确称取10mg纤维蛋白原,使用配置好的干细胞保护液溶解纤维蛋白原,得到浓度为10mg/ml的纤维蛋白原溶液,将1
×
106个人脐带间充质干细胞使用1ml纤维蛋白原溶液将其重悬得到溶液a。
46.(3)在无菌条件下,准确称取效价25u的凝血酶粉末,使用配置好的干细胞保护液溶解凝血酶,得到浓度为25u/ml的凝血酶溶液。之后,在0.8ml凝血酶溶液中入100μl浓度为15000u/ml的抑肽酶溶液以及100μl浓度为15mg/ml的氨甲环酸溶液混合均匀得溶液b。
47.(4)在无菌环境下,于孔板中将上述溶液a与溶液b按5:1、3:1、1:1的体积比混合均匀,在37℃恒温环境中静置3min即得稳定的干细胞水凝胶。
48.图1为体外环境下,不同比例纤维蛋白水凝胶中干细胞的增殖情况的结果。通过cck-8法评估不同比例纤维蛋白水凝胶中干细胞的增殖情况,吸光度结果表明随着干细胞培养时间的增加,水凝胶中的干细胞发生明显的增殖现象。
49.实施例2
50.设置以下4个组,除步骤(3)外,其他步骤(1)(2)(4)与实施例1中所述相同,溶液a与溶液b体积比为1:1。
51.空白水凝胶组:步骤(3)在无菌条件下,准确称取效价25u的凝血酶粉末,使用配置好的干细胞保护液溶解凝血酶,得到凝血酶溶液浓度为25u/ml的溶液b。
52.氨甲环酸组:步骤(3)在无菌条件下,准确称取效价25u的凝血酶粉末,使用配置好的干细胞保护液溶解凝血酶,得到浓度为25u/ml的凝血酶溶液。之后,在0.8ml凝血酶溶液中入200μl浓度为15mg/ml的氨甲环酸溶液得到溶液b。
53.抑肽酶组:步骤(3)在无菌条件下,准确称取效价25u的凝血酶粉末,使用配置好的干细胞保护液溶解凝血酶,得到浓度为25u/ml的凝血酶溶液。之后,在0.8ml凝血酶溶液中加入200μl浓度为15000u/ml的抑肽酶溶液得到溶液b。
54.氨甲环酸/抑肽酶组:步骤(3)在无菌条件下,准确称取效价25u的凝血酶粉末,使用配置好的干细胞保护液溶解凝血酶,得到浓度为25u/ml的凝血酶溶液。之后,在0.8ml凝血酶溶液中加入100μl浓度为15000u/ml的抑肽酶溶液以及100μl浓度为15mg/ml的氨甲环酸溶液得到溶液b。
55.图2为体外环境下,添加入不同抗纤溶剂的纤维蛋白水凝胶中干细胞的增殖情况的结果。通过cck-8法评估添加入不同抗纤溶剂的纤维蛋白水凝胶中干细胞的增殖情况,吸
光度结果表明单独添加入氨甲环酸或抑肽酶的纤维蛋白水凝胶更利于干细胞的生长,这是由其延缓纤维蛋白水凝胶降解所造成的,稳定成凝胶时间可以达到10天左右,并且将抑肽酶与氨甲环酸联用的纤维蛋白水凝胶可稳定成凝胶达到14天以上,从而更利于水凝胶内干细胞的生存与增殖。
56.实施例3
57.设置4个组,分组情况如下:
58.1.空白水凝胶组:
59.(1)在无菌条件下,准确称取10mg纤维蛋白原,使用pbs溶液溶解纤维蛋白原,得到浓度为10mg/ml的纤维蛋白原溶液,1
×
106个人脐带间充质干细胞使用1ml纤维蛋白原溶液将其重悬得到溶液a。
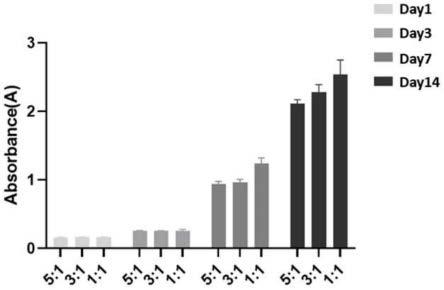
60.(2)在无菌条件下,准确称取效价25u的凝血酶粉末,使用pbs溶液溶解凝血酶,得到浓度为25u/ml的凝血酶溶液。
61.(3)在无菌环境下,于孔板中将上述含有人脐带间充质干细胞的纤维蛋白溶液与凝血酶溶液按1:1的体积比混合均匀,在37℃恒温环境中静置3min即得稳定的干细胞水凝胶。
62.2.氨甲环酸/抑肽酶组:
63.(1)在无菌条件下,准确称取10mg纤维蛋白原,使用pbs溶液溶解纤维蛋白原,得到浓度为10mg/ml的纤维蛋白原溶液,1
×
106个人脐带间充质干细胞使用1ml纤维蛋白原溶液将其重悬得到溶液a。
64.(2)在无菌条件下,准确称取效价25u的凝血酶粉末,使用pbs溶液溶解凝血酶,得到浓度为25u/ml的凝血酶溶液。之后,在0.8ml凝血酶溶液中加入100μl浓度为15000u/ml的抑肽酶溶液以及100μl浓度为15mg/ml的氨甲环酸溶液得到溶液b。
65.(3)在无菌环境下,于孔板中将溶液a与溶液b按1:1的体积比混合均匀,在37℃恒温环境中静置3min即得稳定的干细胞水凝胶。
66.3.干细胞保护液组:
67.(1)在无菌条件下,准确称取下述材料:无水氯化钙0.5g、无水葡萄糖1g、l-谷氨酰胺0.5g、复方氨基酸注射液1ml、复方电解质注射液90ml、人血清白蛋白9ml,用于配制干细胞保护液。
68.(2)在无菌条件下,准确称取10mg纤维蛋白原,使用配置好的干细胞保护液溶解纤维蛋白原,得到浓度为10mg/ml的纤维蛋白原溶液,1
×
106个人脐带间充质干细胞使用1ml纤维蛋白原溶液将其重悬得到溶液a。
69.(3)在无菌条件下,准确称取效价25u的凝血酶粉末,使用配置好的干细胞保护液溶解凝血酶,得到浓度为25u/ml的凝血酶溶液得到溶液b。
70.(4)在无菌环境下,于孔板中将上述溶液a与溶液b按1:1的体积比混合均匀,在37℃恒温环境中静置3min即得稳定的干细胞水凝胶。
71.4.氨甲环酸/抑肽酶/干细胞保护液组:
72.(1)在无菌条件下,准确称取下述材料:无水氯化钙0.5g、无水葡萄糖1g、l-谷氨酰胺0.5g、复方氨基酸注射液1ml、复方电解质注射液90ml、人血清白蛋白9ml,用于配制干细胞保护液。
73.(2)在无菌条件下,准确称取10mg纤维蛋白原,使用配置好的干细胞保护液溶解纤维蛋白原,得到浓度为10mg/ml的纤维蛋白原溶液,1
×
106个人脐带间充质干细胞使用1ml纤维蛋白原溶液将其重悬得到溶液a。
74.(3)在无菌条件下,准确称取效价25u的凝血酶粉末,使用配置好的干细胞保护液溶解凝血酶,得到浓度为25u/ml的凝血酶溶液。之后,在0.8ml凝血酶溶液中加入100μl浓度为15000u/ml的抑肽酶溶液以及100μl浓度为15mg/ml的氨甲环酸溶液。
75.(4)在无菌环境下,于孔板中将溶液a与溶液b按1:1的体积比混合均匀,在37℃恒温环境中静置3min即得稳定的干细胞水凝胶。
76.图3为体外环境下,不同处方纤维蛋白水凝胶中干细胞的增值情况的结果。通过cck-8法评估不同处方纤维蛋白水凝胶中干细胞的增殖情况,吸光度结果表明处方中加入抗纤溶剂能有效延缓纤维蛋白水凝胶的降解,将稳定成凝胶时间由3天提升至14天以上。由于水凝胶的降解延缓,干细胞能够更长时间粘附于水凝胶的三维网格结构上,从而利于其存活与增殖,并实现长效分泌治疗性细胞因子。同时,吸光度结果表明,加入干细胞保护液作为水凝胶基质材料的分散介质更利于细胞增殖,表明干细胞保护液提供的水性环境更利于干细胞的生长与存活。
77.实施例4
78.使用活细胞工作站观察纤维蛋白水凝胶内干细胞形态,所述纤维蛋白水凝胶的制备方法为:
79.(1)在无菌条件下,准确称取下述材料:无水氯化钙0.5g、无水葡萄糖1g、l-谷氨酰胺0.5g、复方氨基酸注射液1ml、复方电解质注射液90ml、人血清白蛋白9ml,用于配制干细胞保护液。
80.(2)在无菌条件下,准确称取10mg纤维蛋白原,使用配置好的干细胞保护液溶解纤维蛋白原,得到浓度为10mg/ml的纤维蛋白原溶液,1
×
106个人脐带间充质干细胞使用1ml纤维蛋白原溶液将其重悬得溶液a。
81.(3)在无菌条件下,准确称取效价25u的凝血酶粉末,使用配置好的干细胞保护液溶解凝血酶,得到浓度为25u/ml的凝血酶溶液。之后,在0.8ml凝血酶溶液中加入100μl浓度为15000u/ml的抑肽酶溶液以及100μl浓度为15mg/ml的氨甲环酸溶液得溶液b。
82.(4)在无菌环境下,于孔板中将上述溶液a与溶液b按1:1的体积比混合均匀,在37℃恒温环境中静置3min即得稳定的干细胞水凝胶。
83.图4为体外环境下纤维蛋白水凝胶中干细胞的粘附情况的结果。通过观察不同时间点时纤维蛋白水凝胶的细胞形态,结果表明在第0天时,干细胞呈球状,均匀分散在纤维蛋白水凝胶中。在第1天时,干细胞产生丝状伪足,表明干细胞发生粘附。此外观察后续几天的干细胞形态,均呈现长梭状,表明水凝胶中的干细胞具有良好的生存状态。纤维蛋白水凝胶为干细胞提供了一个类细胞外基质的三维网状结构环境,干细胞粘附于其上,从而利于其增殖并发挥长效治疗作用。
84.实施例5
85.图5为pcr法检测干细胞伤口修复相关基因表达的结果。通过rt-qpcr法检测培养第7天时干细胞vegf、ang-1、bfgf的表达量,以评估干细胞凝胶三维培养系统在基因水平是否影响伤口修复功能。结果表明,干细胞凝胶的三维培养系统不会对干细胞伤口修复功能
造成损害,并且vegf、ang-1、bfgf的基因表达相较二维培养均有提高。
86.表1 rt-qpcr检测涉及基因的引物序列:
87.vegf-forwardgaggagcagttacggtctgtgvegf-reversetcctttccttagctgacacttgtang1-forwardtaaatcaaacatcccctcttang1-reverseaggtgtccagctcttcctbfgf-forwardagaagagcgaccctcacatcabfgf-reversecggttagcacacactcctttggapdh-forwardgacatgccgaagctcactggapdh-reversegcttcaccaccttcttgatg
88.实施例6
89.(1)在无菌条件下,准确称取下述材料:无水氯化钙0.2g、无水葡萄糖0.1g、l-谷氨酰胺0.01g、复方氨基酸注射液1ml、复方电解质注射液90ml、人血清白蛋白9ml,用于配制干细胞保护液。
90.(2)在无菌条件下,准确称取10mg纤维蛋白原,使用1ml配置好的干细胞保护液溶解纤维蛋白原,得到浓度为10mg/ml的纤维蛋白原溶液,2
×
106个人脐带间充质干细胞使用1ml纤维蛋白原溶液将其重悬得溶液a。
91.(3)在无菌条件下,准确称取效价25u的凝血酶粉末,使用1ml配置好的干细胞保护液溶解凝血酶,得到浓度为25u/ml的凝血酶溶液。之后,在0.8ml凝血酶溶液中加入100μl浓度为20000u/ml的抑肽酶溶液以及100μl浓度为20mg/ml的氨甲环酸溶液得溶液b。
92.(4)在无菌环境下,于孔板中将上述溶液a与溶液b按1:1的体积比混合均匀,在30℃恒温环境中静置5min即得稳定的干细胞水凝胶。
93.实施例7
94.(1)在无菌条件下,准确称取下述材料:无水氯化钙0.25g、无水葡萄糖1g、l-谷氨酰胺0.05g、复方氨基酸注射液5ml、复方电解质注射液80ml、人血清白蛋白15ml,用于配制干细胞保护液。
95.(2)在无菌条件下,准确称取20mg纤维蛋白原,使用1ml配置好的干细胞保护液溶解纤维蛋白原,得到浓度为20mg/ml的纤维蛋白原溶液,1
×
106个人脐带间充质干细胞使用1ml纤维蛋白原溶液将其重悬得溶液a。
96.(3)在无菌条件下,准确称取效价50u的凝血酶粉末,使用1ml配置好的干细胞保护液溶解凝血酶,得到浓度为50u/ml的凝血酶溶液。之后,在0.8ml凝血酶溶液中加入100μl浓度为10000u/ml的抑肽酶溶液以及100μl浓度为25mg/ml的氨甲环酸溶液得溶液b。
97.(4)在无菌环境下,于孔板中将上述溶液a与溶液b按1:1的体积比混合均匀,在25℃恒温环境中静置10min即得稳定的干细胞水凝胶。
98.实施例8
99.1、观察负载干细胞的水凝胶制剂对糖尿病大鼠皮肤溃疡伤口的治疗效果,选取7~8周龄的wistar大鼠为实验对象,使用45%高脂饲料喂养四周后,以65mg/kg的剂量腹腔注射链脲佐菌素。注射完3天后检测大鼠血糖,高于16.7mmol/l视为糖尿病造模成功,进行后续实验。
100.2、维持糖尿病一周后,在大鼠背部构建一个20mm
×
20mm的全层皮肤缺损创面,之后分组进行治疗。pbs组为在伤口创面边缘处皮下注射1ml pbs并贴上无菌敷贴。凝胶治疗组为分别在双联注射器两支中加入500μl纤维蛋白溶液(15mg/ml)与500μl凝血酶溶液(50u/ml),在伤口创面上注射,待形成稳定凝胶后贴上无菌敷贴。干细胞治疗组为在伤口创面边缘处皮下注射1ml干细胞悬液(1
×
106个/ml)。干细胞凝胶治疗组为分别在双联注射器两支中加入500μl混有106个干细胞的纤维蛋白溶液(15mg/ml,制备方法同实施例1)与500μl含有1500u/ml的抑肽酶溶液以及1.5mg/ml的氨甲环酸的凝血酶溶液(50u/ml),在伤口创面上注射,待形成稳定凝胶后贴上无菌敷贴。
101.3、分别于治疗的第0、3、5、7、14天拍照记录伤口大小,14天后剪去新生皮肤组织进行后续实验。
102.图6(a)为不同治疗组在第0、3、5、7、14天的创面大小对比图。图片结果表明,相较于pbs组,干细胞凝胶组具有更好的促进伤口修复的能力,伤口面积显著减小。
103.图6(b)为不同治疗组在第0、3、5、7、14天的创面大小统计图。通过计算对比不同伤口面积,可以看到干细胞凝胶组具有最好的伤口修复能力,在14天时伤口愈合率可以达到90.3%。纤维蛋白水凝胶由于其具有一定的伤口修复能力,能够加速伤口愈合的过程进入凝固期,因此也具有一定的促进伤口愈合能力。
104.图7为不同组别经14天治疗后,伤口组织的he染色结果。通过对比不同治疗组的伤口he染色结果表明,pbs组在伤口部位仍存在大量血细胞,且具有明显的缺损,而干细胞凝胶治疗组在伤口部位已经形成明显的表皮层与真皮层,同时毛囊出现,表明伤口修复效果较好。
105.图8为不同组别经14天治疗后,伤口组织的cd31免疫组化染色结果。cd31免疫组化用于观察伤口组织的新生血管情况。通过对比不同治疗组的伤口cd31免疫组化染色结果表明,干细胞凝胶治疗组的新生血管数量最多,且拥有完整的官腔结构,伤口修复效果较好。
106.上述实施例仅仅是为清楚地说明所作的举例,公开了本次制备的纤维蛋白水凝胶制剂的实施例和附图,而并非对实施方式的限定。本领域内的科研人员可以理解:在不脱离本发明及所附权利要求的精神和范围内,各种替换、变化和修改都是可行的,因此,本发明的范围不局限于实施例和附图所公开的内容,而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1