EpCAM单抗修饰的氧化石墨烯纳米粒肿瘤靶向基因递送载体系统
epcam单抗修饰的氧化石墨烯纳米粒肿瘤靶向基因递送载体系统
技术领域
1.本发明属于生物医药学领域,涉及一种具有靶向性的抗肿瘤基因药物递送系 统:gce/sirna。
背景技术:
2.近年来,基因治疗已迅速发展为一项重要的医疗技术并逐渐被广泛接受,在 多种疾病中,rna干扰技术(rna interference,rnai)被认为是一种独特的基 因治疗方法。在基因治疗中,最常用的两种基因递送载体是病毒载体以及非病毒 载体。尽管逆转录病毒和腺病毒等病毒载体转染效率较高,但其生物安全问题限 制了其进一步的临床应用,如细胞毒性,高免疫原性和潜在的致癌性。目前,非 病毒载体如阳离子聚合物类(如聚乙烯亚胺pei)、阳离子多糖、鱼精蛋白、阳 离子脂质和阳离子表面活性剂,因其低毒、低免疫原性和易制备等特点成为基因 治疗研究的热点。然而,非病毒载体的细胞转染效率不高和靶向性差的特点,使 其体内应用并不理想。因此,寻找一种高效、低毒、靶向性的非病毒载体已成为 基因治疗研究的最紧迫和最具挑战性的问题。
3.氧化石墨烯(graphene oxide,go)是石墨烯的一种衍生物,它是由单层sp2 杂化碳原子堆积形成的具有二维蜂窝状结构的碳材料。研究表明,go表面有大 量的含氧官能团(羧基、羟基、环氧基),以及大的共轭结构有利于共价和非共 价的功能化修饰。近年来,go在生物医学领域引起了越来越多的关注,由于其 具有良好的水分散性、胶体稳定性、比表面积大、官能团丰富等优点而得到研究 和应用。许多研究都证明了go可用于药物和基因载体的应用、细胞成像技术、 用于治疗和诊断疾病的生物传感器和抗菌材料。因此,在基因递送载体研究领域 中,有必要对go进行适当的功能化修饰,来保证基因的负载能力和靶向性。壳 聚糖(chitosan,cs)是自然界中存在的无毒的唯一带正电荷的天然碱性多糖, 在体内可被生物降解,因此生物相容性较好,且分子结构中存在大量氨基基团, 可用于go的正电化修饰。上皮细胞黏附分子(epithelial cell adhesion molecule, epcam)在正常组织中的表达只局限在上皮组织的基底膜处,而在肿瘤细胞中 则大量表达,尤其是腺癌和鳞状细胞癌中。利用anti-epcam(epithelial celladhesion molecule antibody,epcam单克隆抗体)对go进行修饰,可以起到主 动靶向的作用,实现药物或基因的靶向递送。
4.本发明对go进行羧基化处理后,利用cs对其进行正电性修饰,然后利用 单克隆抗体anti-epcam进行靶向性修饰,得到能够负载基因药物survivin-sirna 的靶向递送载体gce。本发明为提高survivin-sirna的负载量,选用比表面积 较大的氧化石墨烯作为载体,并通过共价连接cs以及与靶向性单克隆抗体 anti-epcam连接,制备得到gce,用于负载survivin-sirna,并通过各项评价 确证了该递送系统的抗肿瘤效果和肿瘤靶向性。根据上述靶向基因药物递送载体 的制备与评价研究,发明人提出了本发明。
技术实现要素:
5.本发明的目的在于提供一种具有靶向性的抗肿瘤基因药物递送系统: go-cs/anti-epcam/survivin-sirna(gce/sirna)。
6.本发明所述的靶向基因药物递送系统,由靶向基因药物递送载体gce和抗 肿瘤基因治疗药物survivin-sirna制备而成。
7.本发明所述的靶向基因药物递送系统,gce与survivin-sirna的质量比为 20-40:0.5-2,优选为30:1。
8.本发明所述的靶向基因药物递送系统,为纳米结构。
9.本发明所述的靶向基因药物递送系统,靶向递送载体gce由以下成分制成: go、cs、anti-epcam。
10.本发明的另一个目的在于提供基因递送载体的制备方法。
11.本发明所述的制备方法:基因递送载体gce与抗肿瘤基因survivin-sirna 按照质量比为30:1在常温下混合,室温静置,即得gce/sirna。
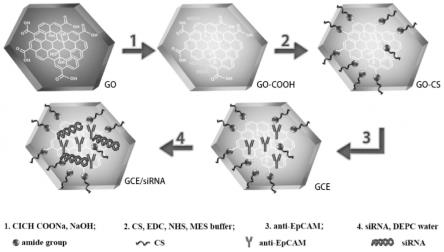
12.其中,靶向递送载体gce的制备:氧化石墨烯(go)在naoh溶液中,与 clch2coona反应,得到羧基化的氧化石墨烯(go-cooh),再通过与壳聚糖 (cs)进行酰胺化反应,得到go-cs,最后室温下与epcam单抗(anti-epcam) 混合,得到gce载体。
13.优选的,本发明所述的靶向基因药物递送系统的制备方法,包括以下步骤:
14.1)制备go-cooh
15.称取go于圆底烧瓶中,加入水,超声使其形成均匀分散的go分散液,冰 浴下,加入naoh,再适当分散后,加入clch2coona,超声反应,再使用磁 力搅拌器室温搅拌,反应停止后,将反应液离心后弃上清,沉淀用水洗涤至中性, 干燥,即得羧基化的氧化石墨烯go-cooh;
16.2)制备go-cs
17.称取go-cooh和cs溶于mes缓冲液中,超声使其均匀分散,称取edc 和nhs,缓缓加入上述混合液中,继续超声;然后,将反应液室温下磁力搅拌, 反应停止后,将混合液离心后弃上清,用乙酸溶液多次洗涤沉淀物以除去未反应 的cs,再用水洗涤至中性,干燥,即得产物go-cs;
18.3)制备gce
19.称取go-cs,超声使其均匀分散于水中,加入anti-epcam,室温搅拌过夜, 反应停止后,将反应液离心,沉淀物用水洗涤,干燥,即得产物gce;
20.4)制备gce/sirna
21.称取gce分散在depc水中,超声使其分散均匀,再将gce与 survivin-sirna混合,室温静置,即得gce/sirna。
22.进一步优选的,本发明所述的靶向基因药物递送系统的制备方法,包括以下 步骤:
23.1)制备go-cooh
24.称取50mg go于圆底烧瓶中,加入30ml水,超声使其形成均匀分散的 go分散液,冰浴下,加入5g naoh,再适当分散后,加入5g clch2coona, 超声反应3h,再使用磁力搅拌器室温搅拌2h。反应停止后,将反应液离心(10 000
×
g,4℃)10min后弃上清,沉淀用水洗涤至
中性,干燥,即得羧基化的氧化 石墨烯go-cooh。
25.2)制备go-cs
26.称取20mg go-cooh和140mg cs溶于10ml的mes缓冲液(0.1m,ph5)中,超声使其均匀分散。称取edc 300mg和nhs 300mg,缓缓加入上述混 合液中,继续超声6h;然后,将反应液室温下磁力搅拌16h。反应停止后,将 混合液离心(10 000
×
g,4℃)60min后弃上清,用1%乙酸溶液多次洗涤沉淀 物以除去未反应的cs,再用水洗涤至中性,干燥,即得产物go-cs。
27.3)制备gce
28.称取3mg go-cs,超声使其均匀分散于3ml水中,加入6μg anti-epcam, 室温搅拌过夜。反应停止后,将反应液离心(10 000
×
g,4℃)60min,沉淀物 用水洗涤三次,干燥,即得产物gce。
29.4)制备gce/sirna
30.称取2mg gce分散在2ml depc水中,超声使其分散均匀,再将gce与 survivin-sirna按照30:1的质量比混合,室温静置30min,即得gce/sirna。
31.本发明的另一个目的在于提供靶向基因药物递送系统在递送抑制肿瘤的药 物方面的应用。
32.本发明的另一个目的在于评价靶向基因药物递送系统gce/sirna在mrna 和蛋白水平下调survivin表达的效率。
33.本发明的另一个目的在于评价靶向基因药物递送系统gce/sirna抑制肿瘤 细胞增殖的作用。
34.本发明的另一个目的在于评价靶向基因药物递送系统gce/sirna促进细胞 凋亡的效率。
35.本发明的另一个目的在于评价靶向基因药物递送系统gce/sirna对细胞周 期的影响。
36.本发明的另一个目的在于评价靶向基因药物递送系统gce/sirna抑制肿瘤 细胞迁移与侵袭的效率。
37.本发明的另一个目的在于评价靶向基因药物递送系统gce/sirna抑制人乳 腺癌mcf-7移植瘤裸鼠肿瘤生长的作用。
38.本发明的另一个目的在于评价靶向基因药物递送系统gce/sirna对人乳腺 癌mcf-7移植瘤裸鼠肿瘤的靶向性作用。
39.对说明书中出现的以下词语作进一步的解释:
40.go:graphene oxide,氧化石墨烯
41.cs:chitosan,壳聚糖
42.epcam:epithelial cell adhesion molecule,上皮细胞黏附分子
43.pei:聚乙烯亚胺
44.edc:1-(3-二甲基氨基丙基)-3-乙基碳化二亚胺
45.nhs:n-羟基琥珀酰亚胺
46.od值:光密度值
47.depc:焦碳酸二乙酯
48.nc:非同源-sirna
49.rpmi 1640:罗斯韦尔公园纪念研究所研发细胞培养液
50.fbs:fatal bovine serun,胎牛血清
51.pbs:phosphate buffer saline,磷酸缓冲盐溶液
52.fam:羟基荧光素
53.mtt:3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐
54.dmso:二甲基亚砜
55.dapi:4',6-二脒基-2-苯基吲哚
56.ns:生理盐水
57.cy5:花青染料荧光标记
58.elisa:酶联免疫吸附测定
59.rt-qpcr:实时定量逆转录-聚合酶链式反应
60.pi:溴化丙啶
61.dox:阿霉素
62.h&e:苏木精-伊红染色法。
附图说明:
63.图1.gce/sirna的制备路线示意图 注:gce/sirna为go-cs/anti-epcam/survivin-sirna的指代写法。
64.图2.go、cs、go-cooh、go-cs和gce的红外光谱图
65.图3.go(a)和gce(b)的原子力显微镜图(n=3)
66.图4.go(a)、go-cs(b)、gce(c)和gce/sirna(w/w=30:1)(d)的 zeta电位,go(e)、go-cs(f)、gce(g)和gce/sirna(w/w=30:1)(h) 的粒径(n=3)
67.图5.go(a)和gce(b)的透射电镜图(n=3)
68.注:gce/sirna为go-cs/anti-epcam/survivin-sirna的指代写法。
69.图6.go(a)、gce(b)的分散性和稳定性,gce(c)的丁达尔现象结果
70.图7.sirna与go(a)和gce(b)的琼脂糖凝胶阻滞实验结果
71.图8.rnase a降解naked sirna(a)和gce/sirna(b)实验结果注:gce/sirna为go-cs/anti-epcam/survivin-sirna的指代写法。
72.图9.激光共聚焦显微镜法测定gce/sirnamcf-7细胞的细胞转染图像
73.图10.实时反转录定量聚合酶链反应检测不同处理组的mcf-7细胞 survivin-mrna水平(n=3)
74.图11.酶联免疫吸附法法检测不同处理组的mcf-7细胞的survivin蛋白水平 (n=3)
75.注:gce/sirna为go-cs/anti-epcam/survivin-sirna的指代写法;nc为非同 源阴性对照sirna;lipo为阳性对照载体材料。
76.图12.mtt法检测gce对mcf-7细胞的细胞毒性(n=3)
77.图13.gce/sirna对mcf-7细胞的抗增殖作用(n=3)
78.图14.gce/sirna对mcf-7细胞凋亡形态学的影响
79.图15.survivin-sirna作用48h后mcf-7细胞的细胞周期分布(a)和统计图(b) (n=3)
80.图16survivin-sirna诱导mcf-7细胞凋亡48h后的细胞凋亡分布(a)和统计图 (b)(n=3)
81.注:gce/sirna为go-cs/anti-epcam/survivin-sirna的指代写法;nc为非同 源阴性对照sirna;lipo为阳性对照载体材料。
82.图17.划痕实验观察survivin-sirna对mcf-7细胞迁移的结果图像(a)和细胞 迁移率统计图(b)(n=3)
83.图18.transwell法研究survivin-sirna对mcf-7细胞迁移的影响。(a)空白对 照组;(b)gce/nc;(c)gce/sirna;(d)不同处理组mcf-7细胞迁移率 统计图(n=3)
84.图19.transwell法研究survivin-sirna对mcf-7细胞侵袭的影响。(a)空白对 照组;(b)gce/nc;(c)gce/nc;(d)不同处理组mcf-7细胞侵袭率统 计图(n=3)
85.注:gce/sirna为go-cs/anti-epcam/survivin-sirna的指代写法;nc为非同 源阴性对照sirna;lipo为阳性对照载体材料。
86.图20.balb/c裸鼠尾静脉注射survivin-sirna后不同时间点的体内活体荧光图 像(a)和给药后8h取各组重要实质性器官图像(b)
87.注:gce/sirna为go-cs/anti-epcam/survivin-sirna的指代写法。
88.图21.不同处理组裸鼠肿瘤体积变化(n=6)
89.图22.不同处理组裸鼠肿瘤的图像
90.图23.不同处理组裸鼠器官重量与体重之比(n=6)
91.图24.注射a)生理盐水(空白对照组),b)naked sirna,c)gce/sirna,d) dox的裸鼠肿瘤组织的h&e染色(100
×
)(n=6)
92.注:gce/sirna为go-cs/anti-epcam/survivin-sirna的指代写法;dox为阳 性对照药物阿霉素。
93.给药剂量:空白对照生理盐水组为0.2ml/只,naked sirna给药剂量为0.3mg/kg, gce/sirna组中survivin-sirna给药剂量为0.3mg/kg,dox给药剂量为1.2 mg/kg。
94.图25.不同处理组裸鼠各主要实质性器官的h&e染色(100
×
)
95.图26.不同处理组大鼠红细胞的溶血率(n=3)
96.图27.不同处理组裸鼠血液生化指标包括肝功能指标:alt、ast、alp、tb 和alb,肾功能指标:crea、ua和尿素(n=5)
97.注:gce/sirna为go-cs/anti-epcam/survivin-sirna的指代写法;lipo为阳 性对照载体材料;dox为阳性对照药物阿霉素;alt为丙氨酸氨基转移酶;ast 为天门冬氨酸氨基转移酶;alp为碱性磷酸酶;tp为总蛋白;alb为白蛋白; crea-j为肌酐;ua为尿酸;urea为尿素。
98.图28.gce/sirna对裸鼠血常规的结果(n=5)
99.注:gce/sirna为go-cs/anti-epcam/survivin-sirna的指代写法;dox为阳 性对照药物阿霉素;rbc为红细胞计数;hgb为血红蛋白;hct为红细胞压积; mcv为红细胞平均体积;mch为平均血红蛋白量;mchc为平均血红蛋白浓 度;rdw为红细胞分布宽度;plt为血小板计数;wbc为白细胞计数。
具体实施方式:
100.为了进一步阐述本发明,下面给出一系列实施例。这些实施例完全是例证性的,它们仅用来对本发明进行具体描述,不应当理解为对本发明的限制。
101.实施例1制备gce/sirna
102.制备go-cooh
103.称取50mggo于圆底烧瓶中,加入30ml水,超声使其形成均匀分散的go分散液,冰浴下,加入5gnaoh,再适当分散后,加入5gclch2coona,超声反应3h,再使用磁力搅拌器室温搅拌2h。反应停止后,将反应液离心(10000
×
g,4℃)10min后弃上清,沉淀用水洗涤至中性,干燥,即得羧基化的氧化石墨烯go-cooh。
104.测定红外光谱。傅立叶转换红外线光谱(ftir,thermoscientific
tm
nicolet
tm
is
tm
5,cm-1
):3144.23,1715.07,1574.34。
105.制备go-cs
106.称取20mggo-cooh和140mgcs溶于10ml的mes缓冲液(0.1m,ph5)中,超声使其均匀分散。称取edc300mg和nhs300mg,缓缓加入上述混合液中,继续超声6h;然后,将反应液室温下磁力搅拌16h。反应停止后,将混合液离心(10000
×
g,4℃)60min后弃上清,用1%乙酸溶液多次洗涤沉淀物以除去未反应的cs,再用水洗涤至中性,干燥,即得产物go-cs。
107.测定红外光谱。傅立叶转换红外线光谱(ftir,thermoscientific
tm
nicolet
tm
is
tm
5,cm-1
):3270.37,1557.60,1373.98,1028.43。
108.制备gce
109.称取3mggo-cs,超声使其均匀分散于3ml水中,加入6μganti-epcam,室温搅拌过夜。反应停止后,将反应液离心(10000
×
g,4℃)60min,沉淀物用水洗涤三次,干燥,即得产物gce。
110.测定红外光谱。傅立叶转换红外线光谱(ftir,thermoscientific
tm
nicolet
tm
is
tm
5,cm-1
):3350.99,3220.21,1583.34,1373.55,1059.63。
111.制备gce/sirna
112.称取2mggce分散在2mldepc水中,超声使其分散均匀,再将gce与survivin-sirna按照不同比例的质量比混合,室温静置30min,即得转染复合物gce/sirna。
113.测定gce/sirna中survivin-sirna的负载量
114.配制样品用depc水配制gce:sirna(质量比)为2:1,5:1,10:1,20:1,30:1,40:1,50:1的混合悬浮液100μl,摇匀,室温静置30min。
115.实验步骤称取0.5g琼脂糖于100ml烧杯中,加入5mltbe(10
×
)和45ml超纯水,置于微波炉内中火加热2min将琼脂糖完全溶化。稍冷却后加入10μl溴化乙锭溶液(10mg/ml),搅匀,倒入电泳仪模具中,插入梳子,凝固后备用。取30mltbe(10
×
)和270ml超纯水,混合均匀后倒入电泳槽中作为电泳液。取出凝固后的琼脂糖凝胶,置于电泳槽中,每孔加样20μl。打开电源,将电压设置成120v,时间设置为30min。从电泳槽中取出琼脂糖凝胶,置于凝胶成像仪中观察并拍照。
116.实验结果如图7所示,不同质量比的gce/sirna的荧光条带均比游离sirna组(对照)弱,说明survivin-sirna被不同程度地阻滞在上样孔里,表明survivin-sirna成功被
部分或完全稳定负载在gce表面。当质量比为30:1时, 荧光条带完全消失,说明此时survivin-sirna被完全阻滞在上样孔里,即 survivin-sirna被完全负载在gce表面。所以,1mg gce可以负载33.3μgsurvivin-sirna。
117.实施例2测定gce的纳米结构
118.实验方法 取少量go及gce粉末,在水中分散后经过适当稀释,取20μl至 铺有碳膜的铜网上,将铜网置于37℃烘箱中至少干燥48h后,使样品在铜网上 充分沉积浓缩干燥,用透射电镜(tem,jem-1230,jeol,日本)观察其形态 并记录图片。再各取20μl滴加到云母片上,置于37℃烘箱中至少干燥48h后, 将各样品置于原子力显微镜(afm,veeco instruments,inc,plainview,usa) 下观察其形态并记录图片。
119.实验结果 从图5中的透射电镜图像我们可以看出go为平面片层结构。而gce 的合成没有破坏go较大的比表面积,仍呈二维平面片层结构,且gce片层尺 寸大小约为300nm左右。另外,图3中的原子力显微镜图像显示,未修饰的go (a)直径在(70-280)nm范围内,厚度为1.603nm,而修饰后的gce(b) 粒径增大,在(80-350)nm之间,且厚度也明显增加到7.089nm,明cs和 anti-epcam被成功修饰到go表面,同时,go的粒子边缘较锋利,而gce粒 子边缘较厚,推测这可能是与高聚物cs的包裹和折叠有关。
120.实施例3测定gce的稳定性与丁达尔效应
121.实验方法 取一定量的go和gce分别均匀分散于水、pbs、ns、rpmi 1640 细胞培养液中,静置,72h后根据分层状况观察其稳定性。再取一定量go和 gce的水分散液于样品瓶里,用激光笔(λ=650nm)照射分散液,观察go和 gce的水分散液是否产生丁达尔效应。以纯水作为空白对照。
122.实验结果 从图6可以看出,go在pbs、ns、rpmi 1640细胞培养液中发生了 不同程度的絮凝,而制备的载体gce在同样的介质中可以均匀分散,并没有聚 集;此外,修饰后的gce载体溶液可以产生丁达尔效应,证明合成的gce溶液 是纳米级别的。
123.实施例4测定gce和gce/sirna的zeta电位和水合粒径
124.实验方法分别将1mg go及go-cs、gce溶解分散在纯水中,以及gce/sirna (w/w=30:1)溶液稀释后分别用激光纳米粒度分析仪和纳米粒度及动电位测定 仪测量zeta电位与粒径分布。
125.实验结果 从图4可以看出,go的粒径为(204.0
±
2.2)nm,zeta电位值为(-42.91
ꢀ±
3.37)mv,氧化石墨烯结构中的含氧基团使go在水溶液中带有负电;经过 cs共价修饰后,go-cs的粒径为(326.6
±
2.4)nm,电位值变为(38.18
±
0.61) mv,go-cs的粒径增大,电位值发生反转,由于cs表面富含氨基带有较强的 正电荷,说明氧化石墨烯的正电化修饰成功;anti-epcam非共价修饰go-cs后, 粒径为(335.1
±
1.7)nm,电位值为(41.94
±
0.34)mv,仍具有正电性,且粒 径增大,证明修饰成功,我们制备的gce可以作为基因载体作为研究。 gce/sirna(w/w=30:1)粒径为(374.6
±
1.5)nm,电位值下降为(35.27
±
1.61) mv,说明gce成功负载survivin-sirna,且仍具有正电性,有利于细胞摄取。
126.实施例5测定gce/sirna的体外抗rnase a降解情况
127.实验方法 实验设置naked survivin-sirna(naked sirna)组和gce/sirna组, 取1μg survivin-sirna及相同sirna质量的gce/sirna(w/w=30:1),分别加入 等体积的rnase a溶液(0.1mg/ml),使用微型涡旋振荡器充分混合后,放入 37℃烘箱内静置30min。
在设定的时间点,分别加入5μl edta溶液(5mm) 终止rnase a对sirna的降解,然后再分别加入20μl肝素钠(0.8mg/ml), 放入37℃烘箱内静置30min,以取代gce/sirna载体保护的survivin-sirna。
128.将两组各个时间点的样品按照前面所述琼脂糖凝胶电泳阻滞实验的方法进 行操作,根据各个时间点的荧光条带强弱判断gce/sirna体外抗rnase a降解 情况。
129.实验结果 从图8可以看出,未经载体负载的naked survivin-sirna在5min内 被rnase a全部降解,而经修饰后的载gce负载后的survivin-sirna在与rnasea混合6h时,仍能观察到荧光条带,这表明gce载体可以有效保护 survivin-sirna不被核酸酶降解。
130.实施例6激光共聚焦显微镜考察mcf-7细胞对gce/sirna的细胞摄取情况 实验方法
131.1)细胞培养:人乳腺癌mcf-7细胞在rpmi 1640培养基(10%fbs,1%青霉 素和链霉素)中培养,置于37℃,5%co2细胞培养箱中。细胞每周传代2-3次, 至融合率达80%。
132.2)激光共聚焦显微镜测定:将3
×
105个(2.0
×
105/ml)mcf-7细胞种于内径 10mm的激光共聚焦小皿中,37℃、5%co2培养24h,待细胞贴壁后,分别 用等体积空白培养基、survivin-sirna(100nm)、gce/sirna(含100nmsurvivin-sirna)和lipo/sirna(含100nm survivin-sirna)处理细胞,转染5h 后,弃掉含药培养基,用pbs洗三次,每皿加入hoechst 33342工作液1ml, 孵育15min后弃掉,用pbs洗三遍,最后在每皿中预留少量pbs防止干片。 置于激光共聚焦显微镜(leica,tcssp5,德国)下观察并拍照。
133.实验结果 fam是一种羧基化的荧光素类标记试剂,激发波长492nm,发射波 长518nm。如图9所示,空白对照组和游离的survivin-sirna组蓝色的细胞核 周围没有绿色荧光出现,表明未经载体负载的survivin-sirna不能进入细胞,而 我们的载体实验组可以看到,细胞核周围有绿色荧光出现,说明有survivin-sirna 传入细胞膜,分布在细胞质中,这一现象与阳性对照组lipo组的结果一致,表 明我们制备的载体gce可以负载survivin-sirna有效递送进入mcf-7细胞内。
134.实施例7实时反转录定量聚合酶链反应评价gce/sirna沉默survivin基因的 作用
135.实验方法
136.1)细胞培养与转染:在6孔板中均匀接种2ml细胞液浓度为1.5
×
105/ml的 mcf-7细胞悬液,放入37℃、5%co2培养箱中孵育,待24h细胞贴壁后各孔 细胞用pbs缓冲液洗3遍,加入2ml含有survivin-sirna,gce/nc,lipo/nc, gce/sirna,lipo/sirna的无血清rpmi 1640培养基,每组设3个复孔,置于 37℃、5%co2培养箱中孵育5h后,吸去各孔培养液,用pbs缓冲液洗3遍, 换成完全培养液继续培养43h。
137.2)细胞全rna的提取:实验前用rnase a清除剂擦拭工作台面,并使用无酶 离心管和枪头。
138.取出转染后的6孔板,吸去各孔培养液,每孔加入1ml的trizol裂解液, 并用移液枪充分吹打细胞,使细胞完全裂解,转移至无酶离心管中,室温静置5 min后,向每管中加入0.2ml氯仿,剧烈震荡15s,再室温静置5min后,离心 (1 000
×
g,4℃)15min,液体分为三层,提取得到的rna为水溶性,存在于最 上层的无色水相中。
139.用移液枪小心吸去最上层无色水相至无酶离心管中,各管加入0.5ml异丙 醇,震荡混匀后室温静置10min,离心(1000
×
g,4℃)15min,离心后可以看 到提取的rna被沉淀至
离心管底部。小心弃去上清液,每管加入1ml 5.2.1.1 中配制好的75%乙醇,充分震荡后,再次离心,重复清洗两遍沉淀。弃去上清液, 各管室温静置10min左右,使rna沉淀充分干燥。
140.为测定各组细胞提取得到的rna含量,用depc水重悬各组rna,并充分 吹打液体,使rna完全溶解于depc水中,置于冰盒中待测(若不能及时测定 可放于-80℃冰箱中保存)。用depc水清洗并校正nanodrop-1000,用移液枪 吸取各管2μl的rna溶液样品,滴加在上样池中,测定并读取各组细胞提取 的rna浓度。
141.3)逆转录:
142.设定rna上样量为2μg,根据上一步得到的各组细胞rna浓度分别计算 本步骤所需的rna上样体积。取一块microamp
tm optical 96-well reaction plate 专用板,各孔加入计算好的所需的rna上样体积,再向各孔中加入10μl 2
×
rtbuffer和1μl 20
×
rt enzymemix,各孔溶液体积若不足20μl,用depc水补 足,然后用配套的封口膜将板子封口,轻轻摇晃板子使各孔溶液混合均匀,离心 后排除板底部气泡。将pcr板放入pcr system 9700,设置逆转录反应条件,94℃ 进行5min,94℃进行30s,75℃进行30s,72℃进行25s,72℃进 行7min,4℃进行∞时长,共设置30个循环。
143.逆转录结束后,用nanodrop-1000测定各组cdna的浓度,同之前的方法, 仪器用depc水校正后,用移液枪吸取各孔溶液2μl进行测定,读取各组逆 转录得到的cdna浓度。
144.4)rt-pcr
145.设定cdna上样量为50ng,根据上一步得到的各组cdna浓度分别计算本 步骤所需的cdna上样体积。取一块microamp
tm optical 96-well reaction plate 专用板,各孔加入计算好的所需的cdna上样体积,再向各孔中加入4℃融化 后的gene expression master mix和2.5μl gapdh引物,并用depc 水补足至50μl,然后用配套的封口膜将板子封口,轻轻摇晃板子使各孔溶液混 合均匀,离心后排除板底部气泡。将pcr板放入applied biosystems 7500 real-time pcr system,设置参数条件,50℃进行2min,95℃进行10min,95℃ 进行15s,60℃进行1min,共设置40个循环。上述实验重复三次。
146.采用2^
‑△△
ct法处理rt-pcr测定得到的数据,实验结果见下表。
147.表1.在gce/sirna作用下mcf-7细胞的survivin-mrna的相对量(均值
±
sd,n=3)
[0148][0149]
从图10可以看出:阴性对照组游离的survivin-sirna和gce/nc的survivin-mrna相对表达量与空白对 照组比较,无显著性差异(p》0.05),即两者均不能有效下调mrna的表达。而gce/sirna实验组和 lipo/sirna阳性对照组分别与空白对照组相比,survivin-mrna相对量均有显著性差异(p《0.01),实验 组和阳性对照组均可有效下调mrna的表达量,其下
调率分别为(48.24
±
2.50)%和(45.76
±
1.98)%, 且二者之间无显著性差异(p》0.05)。
[0150]
实施例8酶联免疫吸附法评价gce/sirna下调survivin蛋白表达的作用
[0151]
实验方法
[0152]
1)细胞培养与转染:在6孔板中均匀接种2ml细胞液浓度为1.5
×
105/ml的 mcf-7细胞悬液,放入37℃、5%co2培养箱中孵育,待24h细胞贴壁后各孔 细胞用pbs缓冲液洗3遍,加入2ml含有survivin-sirna,gce/nc,lipo/nc, gce/sirna,lipo/sirna的无血清rpmi 1640培养基,每组设3个复孔,置于 37℃、5%co2培养箱中孵育5h后,吸去各孔培养液,用pbs缓冲液洗3遍, 换成完全培养液继续培养43h。
[0153]
2)bca protein assay kit测定培养液上清中总蛋白浓度
[0154]
用bca蛋白定量试剂盒,按照说明描绘标准曲线,测定每组蛋白样品的浓 度。
[0155]
3)elisa试剂盒测定样品蛋白中suivivin的含量
[0156]
取出试剂盒中的微孔板,取100μl的assay diluent rd1-9(测定稀释剂) 加入至孔内。分别设置对照组、标准组和样品组,对照组中每孔加入100μl的 calibrator diluent rd5-33(1
×
)溶液,标准组中每孔加入100μl已配制好的 survivin标准溶液,样品组加入总蛋白为130μg的样品,不足100μl的样品用 depc水补足。将微孔板轻轻摇晃混匀,用试剂盒内的粘性胶带密封微孔板,置 于涡旋仪上涡旋2h。涡旋结束后,小心弃掉各孔内液体,甩干后,向各孔中加 入400μl的wash buffer(1
×
)溶液,清洗3次,然后将微孔板倒扣在一张干净 的滤纸上,轻轻拍打使其孔内无液体。每孔加入200μl的survivin conjugate, 用粘性胶带密封微孔板后,室温静置2h。重复上述甩干清洗,然后每孔加入200 μl的substrate solution溶液,用粘性胶带密封微孔板后,避光,室温静置30min。 最后,每孔加入50μl的stop solution溶液终止反应,此时各孔溶液由蓝变黄, 若溶液颜色变绿或颜色变化不一,轻轻敲打或低速涡旋微孔板,使其充分混匀。 终止反应30min内,使用酶标仪测定各孔样品在450nm波长下的吸光度。
[0157]
上述实验重复三次。实验结果
[0158]
表2.在gce/sirna作用下mcf-7细胞的survivin蛋白 的相对量(均值
±
sd,n=3)
[0159][0160]
从图11可以看出:阴性对照组游离的survivin-sirna和gce/nc的survivin 蛋白相对表达量与空白对照组比较,无显著性差异(p》0.05),即两者均不能 有效下调survivin蛋白的表达。而gce/sirna实验组和lipo/sirna阳性对照组 分别与空白对照组相比,survivin蛋白相对量均有显著性差异(p《0.01),实验 组和阳性对照组均可有效下调survivin蛋白的表达量,其下调率分别为(44.12
±ꢀ
3.03)%和(41.77
±
1.97)%,且二者之
间无显著性差异(p》0.05)。
[0161]
实施例9评价gce/sirna的细胞毒性和抑制肿瘤细胞增殖的作用
[0162]
(1)gce的细胞毒性实验
[0163]
实验方法
[0164]
取对数期生长的mcf-7细胞,调整细胞液浓度为5
×
104/ml接种于96孔板 中,不添加细胞的作为空白组(调零孔),并在96孔板最外围一圈用pbs缓冲 液液封。37℃、5%co2培养箱中培养24h,待细胞贴壁后换成配制好的含gce 的无血清培养基100μl,设gce浓度分别为10μg/ml、20μg/ml、40μg/ml、 60μg/ml、80μg/ml、100μg/ml、120μg/ml、150μg/ml,空白组和对照组不 加药,每个浓度设置5个复孔,于37℃、5%co2培养箱中培养48h后,每孔加 入25μl mtt工作液,前后左右轻晃96孔板使溶液混合均匀,放入37℃、5%co2培养箱中孵育4h。4h后,将96孔板小心放入离心机中离心(1 000
×
g,5min), 弃掉上清液,每孔加入150μl的dmso溶液,并置于微型振荡器上充分振荡均 匀。使用酶标仪,设置检测波长为570nm,测定96孔板各孔od值,计算每孔 中细胞存活率。利用公式:以 上实验步骤重复三次。
[0165]
实验结果:如图12所示,随着gce载体溶液浓度的增大,mcf-7细胞存活率没有明显下 降,当浓度增大到150μg/ml时,细胞存活率仍保持在95%以上,且各浓度实验组之间没有 显著性差异(p》0.05),不具有统计学意义,可以认为修饰后的gce纳米粒对mcf-7细 胞未表现出明显细胞毒性,有良好的生物相容性。
[0166]
(2)gce/sirna抑制mcf-7细胞增殖的作用
[0167]
实验方法
[0168]
取对数期生长的mcf-7细胞,调整细胞液浓度为5
×
104/ml接种于96孔板 中,不添加细胞的作为空白组(调零孔),并在96孔板最外围一圈用pbs缓冲 液液封。37℃、5%co2培养箱中培养24h,待细胞贴壁后,小心弃去每孔中的 完全培养液,每孔分别加入100μl的0nm、20nm、40nm、80nm、120nm、 160nm(按sirna计算)的nc-sirna、survivin-sirna、gce/nc、lipo/nc、 gce/sirna、lipo/sirna的含药不完全培养液(不含胎牛血清和双抗),各种 药物每浓度设置3个平行孔,放于37℃、5%co2培养箱中孵育5h。转染5h 后,弃去各孔含药培养液,加入100μl rpmi 1640完全培养液,放于37℃、5% co2培养箱中继续培养43h后,每孔加入25μl的mtt工作液,于37℃、5%co2培养箱中孵育4h,将96孔板小心放入离心机中离心,弃掉上清液,每孔加入 150μl的dmso溶液,并置于微型振荡器上充分振荡均匀。使用酶标仪,设置 检测波长为570nm,测定96孔板各孔od值,计算每孔中细胞存活率。以上实 验步骤重复三次。
[0169]
实验结果:以mtt法考察gce/sirna纳米载药体系的抗肿瘤活性,结果如图13 所示,随着各组给药浓度的增加,增加至160nm时,naked nc组、naked sirna 组的mcf-7细胞存活率没有明显下降,存活率均在90%以上,且组内各浓度之 间的细胞存活率没有显著性差异(p》0.05),不具有统计学意义,可以认为 nc-sirna和游离的survivin-sirna不具有体外抗细胞增殖作用,对mcf-7细胞 存活率未产生明显影响。而我们制备的靶向基因药物递送系统gce/sirna组随 着给药浓度的增加,mcf-7细胞存活率出现明显下降,其体外抗增殖效果产生 极显著性差异(p《0.01)且存在剂量依赖性,各浓度与阳性对照组lipo/sirna 组
结果无显著性差异,表明gce/sirna可以产生很好的体外抗增殖效果。
[0170]
实施例10评价gce/sirna对mcf-7细胞的促凋亡作用
[0171]
(1)激光共聚焦显微镜测定细胞凋亡形态
[0172]
实验方法:取对数生长期mcf-7细胞3
×
105个(1.5
×
105/ml)接种于内径20mm 的玻底培养皿中,37℃、5%co2培养箱中培养24h,待细胞贴壁后,将培养皿 内培养基换成配制好的各含药培养基(不含fbs和双抗),分别设空白对照组 (加入等体积的不完全培养液)、gce/nc组和gce/sirna组。37℃、5%co2培养箱中孵育转染5h后,小心弃掉各含药培养液,用pbs洗三遍,每皿加入 2.5ml rpmi 1640完全培养液,置于37℃、5%co2培养箱中继续培养43h后, 保持屋内环境黑暗,弃掉培养液,用pbs洗三遍,加入10%福尔马林固定液固 定细胞20min,弃掉固定液,用pbs洗三遍,每皿加入1ml dapi工作液,置 于37℃、5%co2培养箱中孵育8min后弃掉染色液,用pbs洗三遍,最后在每 皿中留有少量pbs缓冲液防止风化干片。在激光共聚焦显微镜下观察并拍照其 细胞凋亡情况。
[0173]
实验结果:利用激光共聚焦观察被各组药物处理48h后的mcf-7细胞核经dapi 染色后的形态结果如图14所示,我们可以看到,空白对照组和gce/nc阴性对 照组的细胞核形态为圆形且染色质致密,而gce/sirna组(实验组)细胞体积 变小,细胞核发生皱缩、边缘化,核形态不规则,且蓝色荧光变深是由于染色质 发生高度浓集,细胞核裂解成碎块,这些现象与阳性对照组的结果一致,均表现 出细胞凋亡的细胞核形态的特征,符合细胞凋亡的细胞形态学变化特点。
[0174]
(2)流式细胞术检测细胞周期
[0175]
实验方法:取转染48h后的空白对照组、阴性对照组和实验组细胞,胰酶消化 后收集于离心管中离心,再用4℃预冷的pbs缓冲液洗涤各组细胞两次,分别 加入到装有5ml-20℃预冷75%乙醇的离心管中,4℃固定细胞过夜,并小心 吹打均匀成单细胞悬液,第二天离心后用4℃预冷的pbs缓冲液洗涤各组细胞 两次,再加入1ml pi(50μg/ml,含rnase),混合均匀后置于37℃水浴中避 光反应30min,立即转移至流式管中使用流式细胞仪进行检测各组细胞周期。实 验重复操作三次。
[0176]
实验结果:细胞周期检测结果如图15所示,从图中可以看到,空白对照组与 gce/nc组的细胞周期各时相间没有显著性差异(p》0.05),说明nc-sirna 不能对mcf-7细胞周期产生影响,而gce/sirna实验组分别与空白对照组和 gce/nc组相比,细胞周期各时相均有显著性差异(p《0.01),且g0/g1期细 胞比例显著增加,s期和g2/m期细胞比例显著减少,表明survivin-sirna经gce 载体负载后进入mcf-7细胞对其细胞周期可产生影响,通过使细胞周期阻滞于 g0/g1期,有效地抑制细胞增殖从而达到抗肿瘤效果。
[0177]
(3)流式细胞术检测细胞凋亡率
[0178]
实验方法:取转染48h后的空白对照组、阴性对照组和实验组细胞,胰酶消化 后收集于离心管中离心,再用4℃预冷的pbs缓冲液洗涤各组细胞两次,分别 加入250μl 1
×
binding buffer重悬各组细胞,计数并调整细胞悬液浓度为1
×
106个/ml。根据alexa488annexin
ⅴ
细胞凋亡检测试剂盒使用说明,取100 μl各组细胞悬液于离心管中,分别加入5μl alexa488annexin
ⅴ
和1 μl pi(100μg/ml),混合均匀后室温避光反应15min,加入400μl 1
×
bindingbuffer,然后立即转移至流式管中使用流式细胞仪进行检测,设置激发波长488nm, 发射波长530nm,计算各组mcf-7细胞凋亡率。实验重复操作三
次。
[0179]
实验结果:由实验结果图16可以看出,经各组药物转染48h的mcf-7细胞, 实验组gce/sirna的细胞凋亡率(23.9
±
2.6)%显著高于空白对照组(3.9
±
1.3)% 和gce/nc组(5.8
±
2.1)%(p《0.01),这一结果表明我们制备的载体gce 可以有效负载survivin-sirna并进入细胞诱导其发生凋亡,survivin-sirna产生 了沉默mcf-7细胞survivin蛋白的表达。
[0180]
实施例11 gce/sirna的体外抗细胞迁移与侵袭作用的评价
[0181]
(1)细胞划痕法评价体外抗肿瘤迁移作用
[0182]
实验方法:在6孔板背面用marker笔平行均匀画6条间距0.5cm直线,分别取对 数生长期mcf-7细胞4
×
105个(2
×
105/ml)接种于6孔板内,置于37℃、5%co2培养箱中培养24h至细胞融合成为单层细胞状态时,取出培养板,小心吸取各 孔培养液,用200μl移液枪枪头垂直于背面直线在各孔内部中央区域划一条直 线,注意保持枪头垂直,不要倾斜,且力度均匀相同以保证各孔划痕初始宽度一 致,用pbs缓冲液清洗各孔三遍,以去除划痕划掉的细胞,然后置于倒置显微 镜下拍照,记为时间点0h的细胞划痕宽度。拍照后,分别设空白对照组(只添 加培养液)、gce/nc组(阴性对照组)和gce/sirna组(实验组),加入2ml 含相应药物的rpmi 1640不完全培养液,每组设置3个复孔,置于37℃、5%co2培养箱中培养,分别于不同时间点24h和48h在显微镜下拍照观察各组细胞划 痕宽度,并计算细胞迁移率,按照公式计算:
[0183]
以上实验步骤重复 三次。
[0184]
实验结果
[0185]
细胞划痕愈合实验反应了肿瘤细胞的迁移能力,各处理组细胞迁移0h、24h 和48h的划痕宽度结果如图17所示,当划痕愈合24h时,空白对照组及gce/nc 组(阴性对照组)的mcf-7细胞划痕迁移率分别为(57.93
±
3.45)%和(55.64
±ꢀ
2.63)%,且二者之间无统计学意义(p》0.05),而经实验组gce/sirna处理 过的细胞划痕迁移率明显降低,为(33.99
±
2.01)%,分别与空白对照组及阴性 对照组均有显著性差异(p《0.01);划痕愈合48h时,空白对照组及阴性对照 组的mcf-7细胞划痕迁移率分别为(80.59
±
2.74)%和(76.82
±
3.82)%,且 二者之间无统计学意义(p》0.05),而经实验组gce/sirna处理过的细胞迁移 率明显降低,为(39.29
±
2.52)%,与空白对照组及阴性对照组比较均有显著性 差异(p<0.01),该实验说明转染survivin-sirna的细胞可以抑制mcf-7细胞 的迁移能力。
[0186]
(2)transwell法评价体外抗肿瘤迁移作用
[0187]
实验方法
[0188]
分别取对数生长期培养48h的空白对照组细胞、gce/nc组(阴性对照组) 和gce/sirna组(实验组)细胞,并饥饿培养12h后,胰酶消化,离心,用含 0.1%bsa的无胎牛血清rpmi 1640培养液重悬各组给药细胞,计数2
×
104个 (2
×
105/ml)接种于上室,每组设置3个复孔,在下室中加入600μl含10%胎 牛血清的rpmi 1640培养液,置于37℃、5%co2培养箱中培养24h。
[0189]
弃去transwell小室中培养液,再用棉签小心擦去上室中未迁移的细胞,用 pbs洗
两遍。取新的24孔板,在下室中加入4%多聚甲醛600μl,将小室放入 其中,室温固定细胞30min,弃去固定液,自然风干,然后每孔加入600μl 0.1% 结晶紫将小室浸没染色20min,弃去染色液,用pbs洗三遍,自然风干。将 transwell小室反过来底朝上,正置显微镜下置于载玻片上观察,随机选取5个 视野进行拍照(
×
200)并对细胞个数进行计数,
[0190][0191]
实验结果:transwell法评价细胞迁移的实验结果如图18所示,利用各组各视野内 穿膜细胞数量计算细胞迁移率,得到gce/nc组(阴性对照组)的细胞迁移率 为(92.26
±
4.96)%,且与空白对照组相比差异无统计学意义(p》0.05),而 经gce/sirna转染后的细胞迁移率较空白对照组和阴性对照组有显著性降低(p 《0.01),其细胞迁移率为(49.24
±
4.04)%,结果表明我们制备的gce载体负 载survivin-sirna进入细胞后,通过沉默survivin基因可以发挥抑制肿瘤细胞迁 移的作用。
[0192]
(3)transwell法评价体外抗肿瘤侵袭作用
[0193]
实验方法
[0194]
1)铺胶
[0195]
从-20℃冰箱中取出matrigel放入4℃冰箱24h使其融化,在冰中进行操作, 将融化的matrigel与4℃无胎牛血清rpmi 1640培养液1:8稀释混合,将transwell 小室放入24孔板中,小室内称为上室,培养板称为下室,在上室中加入80μlmatrigel稀释液,放入37℃、5%co2培养箱中静置2h使其形成凝胶。
[0196]
2)水化基底膜
[0197]
向上室中加入50μl含0.1%bsa的无胎牛血清rpmi 1640培养液,将培养 板放入37℃、5%co2培养箱中静置30min,使基质胶水化。
[0198]
3)接种细胞与侵袭
[0199]
分别取对数生长期培养48h的空白对照组细胞、gce/nc组(阴性对照组) 和gce/sirna组(实验组)细胞,并饥饿培养12h后,胰酶消化,离心,用含 0.1%bsa的无胎牛血清rpmi 1640培养液重悬各组给药细胞,计数2
×
104个 (2
×
105/ml)接种于上室,每组设置3个复孔,在下室中加入600μl含10%胎 牛血清的rpmi 1640培养液,置于37℃、5%co2培养箱中培养24h。
[0200]
4)染色与计数
[0201]
弃去transwell小室中培养液,再用棉签小心擦去上室中未侵袭的细胞和基 质胶,用pbs洗两遍。取新的24孔板,在下室中加入4%多聚甲醛600μl,将 小室放入其中,室温固定细胞30min,弃去固定液,自然风干,然后每孔加入 600μl 0.1%结晶紫将小室浸没染色20min,弃去染色液,用pbs洗三遍,自然 风干。将transwell小室反过来底朝上,正置显微镜下置于载玻片上观察,随机 选取5个视野进行拍照(
×
200)并对细胞个数进行计数,
[0202][0203]
实验结果
[0204]
transwell法评价细胞侵袭的实验通过在transwell小室聚碳酸酯膜上添加 matrigel基质胶模拟细胞外基质的存在,结果如图19所示,gce/nc组(阴性 对照组)的细胞
侵袭率为(97.28
±
3.69)%,且与空白对照组相比差异无统计学 意义(p》0.05),而经gce/sirna转染后的细胞穿膜数量较空白对照组和阴性 对照组有显著性减少(p《0.01),其细胞侵袭率为(40.08
±
5.32)%,提示 survivin-sirna进入mcf-7细胞后,通过沉默survivin基因可以发挥抑制肿瘤细 胞侵袭的作用。
[0205]
实施例12 gce/sirna的体内肿瘤靶向性评价
[0206]
实验方法
[0207]
1)移植瘤裸小鼠模型的建立
[0208]
通过建立人乳腺癌mcf-7裸小鼠移植瘤模型的方法,选取4-6周龄、体重 15-17g的balb/c雌性裸小鼠,每三天腹腔注射苯甲酸雌二醇10mg/kg,持续 两周。取对数生长期mcf-7细胞,将1
×
107个/只细胞皮下接种于裸小鼠左侧腋 窝,建立人乳腺癌mcf-7裸小鼠移植瘤模型,并于隔天开始每三天腹腔注射苯 甲酸雌二醇10mg/kg。用游标卡尺测量移植瘤的长短径,利用公式计算瘤体积, 移植瘤体积达到100mm3时,给药。
[0209]
2)分组与给药
[0210]
本实验采用cy5荧光染料对survivin-sirna进行标记,并注意避光保存。将 已建立人乳腺癌mcf-7裸小鼠移植瘤模型的裸小鼠随机分为4组:ns组,nakedsirna组,gc/sirna组和gce/sirna组,每组3只,按照如下给药方式给药:
ꢀ①
ns组:每只注射0.2ml生理盐水;
②
naked sirna组:每只注射0.3mg/kg nakedsirna;
③
gc/sirna组:按survivin-sirna计算,每只注射gc/sirna 0.3mg/kg;
ꢀ④
gce/sirna组:按survivin-sirna计算,每只注射gce/sirna 0.3mg/kg,用 酒精棉球擦拭裸鼠尾部后,对各组裸鼠进行尾静脉注射0.2ml相应药物一次。
[0211]
3)裸鼠活体荧光成像实验
[0212]
各组裸鼠给药后,分别在设定的给药后1h、2h、4h和8h时间点时,将裸 鼠放入通有2%异氟烷的密闭玻璃箱内,对各组裸鼠进行气体麻醉后,将裸鼠从 麻醉箱里拿出,放入仪器内,在规定位置上将裸鼠摆好,然后,在电脑上进行参 数设置,并对裸鼠的活体荧光成像进行拍照。在给药8h后,对裸鼠采取颈椎脱 臼法处死,对其进行解剖,取出心、肝、脾、肺、肾,对各组给药后裸鼠的器官 内荧光分布进行拍照。
[0213]
实验结果
[0214]
由图20a可以看到,随着时间的推移,在注射给药后2h、4h和8h时, gc/sirna组和gce/sirna组小鼠肿瘤部位的荧光强度逐渐变强,表明经过载 体负载的survivin-sirna可以在小鼠体内通过血液循环系统在肿瘤内蓄积;而对 比gc/sirna组和靶向制剂gce/sirna组,在2h、4h和8h时间点时,靶向 制剂gce/sirna组小鼠肿瘤部位荧光强度明显高于gc/sirna组,说明经 epcam单抗修饰后的靶向制剂组有更多的survivin-sirna聚集在小鼠肿瘤部位, 可以在体内产生良好的肿瘤靶向性。图20b是观察给药8h后药物在小鼠体内各 主要实质性器官的分布,可以看到,实验组肾脏均有较强的荧光出现,推测肾脏 是分子量小且极性大的sirna主要代谢器官,而gc/sirna组和gce/sirna组 小鼠的肝脏也有明显荧光,推测我们制备的氧化石墨烯纳米粒主要通过肝脏代谢 后经胆汁排泄,此外,gce/sirna组各器官的荧光强度均低于gc/sirna组, 进一步证实肿瘤组织中sirna积累较多。
[0215]
实施例13 gce/sirna的体内抗肿瘤活性评价
[0216]
实验方法
[0217]
1)移植瘤裸小鼠模型的建立
[0218]
通过建立人乳腺癌mcf-7裸小鼠移植瘤模型的方法,选取4-6周龄、体重 15-17g的balb/c雌性裸小鼠,每三天腹腔注射苯甲酸雌二醇10mg/kg,持续 两周。取对数生长期mcf-7细胞,将1
×
107个/只细胞皮下接种于裸小鼠右侧腋 窝,建立人乳腺癌mcf-7裸小鼠移植瘤模型,并于隔天开始每三天腹腔注射苯 甲酸雌二醇10mg/kg。用游标卡尺测量移植瘤的长短径,计算瘤体积,移植瘤体 积达到100mm3时,给药。利用公式计算:
[0219]
2)gce/sirna在移植瘤裸小鼠体内的抗肿瘤活性和病理组织学观察
[0220]
将已建立人乳腺癌mcf-7裸小鼠移植瘤模型的裸小鼠随机分为4组(n=6): ns组,naked sirna组,gce/sirna组和dox组。按照如下给药方式给药:
ꢀ①
ns组:每只注射0.2ml生理盐水;
②
naked sirna组:每只注射0.3mg/kgsurvivin-sirna;
③
gce/sirna组:按sirna计算,每只注射gce/sirna 0.3mg/kg;
ꢀ④
dox组:每只注射1.2mg/kg dox。用酒精擦拭裸鼠尾部后,对各组裸鼠采 取尾静脉注射方式给药0.2ml,并于隔天再次给药,共给药5次。每次给药前 称量各组裸小鼠体重,并用游标卡尺测量移植瘤的长短径,计算瘤体积并记录。 最后一次给药结束后,次日对各组裸小鼠断颈处死,取出心、肝、脾、肺、肾、 脑、肿瘤,分别称重记录,并计算抑瘤率,利用公式计算:利用公式计算:并采用he染色法,对小鼠肿瘤及体内各重 要器官进行病理组织学观察。
[0221]
实验结果:图21和图22可以明显看到gce/sirna组的平均肿瘤体积显著低于游 离survivin-sirna组,而与dox组无显著性差异(p《0.01)。另外,gce/sirna 组的抑瘤率(54.74
±
5.51)%显著高于游离survivin-sirna组(4.87
±
8.49)%。 对比各处理组的脏体比之间没有显著性差异。图24利用h&e染色技术对给药 后小鼠肿瘤组织进行病理组织学研究,可以明显看到,生理盐水空白对照组与游 离survivin-sirna组肿瘤细胞排列紧密,而gce/sirna组的肿瘤细胞排列变得 稀疏,细胞间隙变大,呈现出点状坏死,细胞凋亡较明显,这一现象与阳性对照 组dox组结果基本一致。
[0222]
裸鼠体内各重要组织器官心、肝、脾、肺、肾的he染色结果如图25所示, 可以明显观察到,在各组心、肝、脾、肺、肾的染色结果中,未看到明显病理特 征,表明gce/sirna对裸鼠体内各重要器官无明显毒性。
[0223]
实施例14 gce/sirna的血液安全性评价
[0224]
(1)体外抗溶血实验
[0225]
实验方法
[0226]
将一只正常sd大鼠(250g左右)腹腔注射7ml/kg的20%乌拉坦进行麻 醉,对大鼠采取颈动脉插管取血,得到5ml全血置于干燥的含抗凝血剂edta 的采血管内,离心(2 000
×
g,10min),用移液枪小心吸取上层血浆、白细胞 与血小板后弃掉,用pbs洗三遍下层红细胞至离心后上清液几乎不再呈红色为 止,得到下层压积红细胞,并用pbs溶液制备成2%(v/v)的红细胞悬液,实 验操作中应全程避免因剧烈震荡导致红细胞发生溶血的现象。
[0227]
取100μl的20nm、40nm、80nm、120nm、160nm(按sirna计算) 的naked sirna、gce、
gce/sirna、lipo/sirna的pbs溶液,加入900μl的 2%红细胞悬液,轻轻摇匀,以pbs与红细胞悬液共孵育作为阴性对照组,水与 红细胞悬液共孵育作为阳性对照组,pbs与红细胞悬液共孵育作为阳性对照组, 放入37℃培养箱内孵育1h。孵育结束后将各样品离心(3 000
×
g,10min),小 心取各样品上清液加入96孔板内,每个样品浓度设置三个复孔,并将96孔板最 外围一圈边缘孔用pbs溶液液封,使用酶标仪,设置检测波长为540nm,读取 96孔板各孔od值,并利用公式计算各孔中样品溶血率。
[0228][0229]
实验结果:用溶血实验来评价纳米材料的体外生物相容性,由图26中可以发现, 当gce/sirna浓度增大到160nm较高浓度时,未发现明显溶血现象,且溶血 率《3%,结果表明gce具有良好的生物相容性。
[0230]
(2)血生化与血常规检查
[0231]
实验方法:取20只正常balb/c雌性裸鼠,随机分为4组,每组5只:ns组, naked sirna组,gce/sirna组和dox组,给药方式同9.2.2。于最后一次给药 后次日,用含edta抗凝剂的1ml采血管对各组裸鼠眼眶取血,于当日进行血 常规检查。再用不含抗凝剂的采血管取全血用于血生化检查,全血在室温下静置 2h,注意避免振荡,避免气泡,否则易发生溶血现象,离心(3 000
×
g,4℃) 10min,然后小心吸取上清(即血清),可-80℃低温保存,用于检测裸鼠肝功 能和肾功能的血液生化参数,检测项目包括:丙氨酸氨基转移酶(alt)、天门 冬氨酸氨基转移酶(ast)、碱性磷酸酶(alp)、总蛋白(tp)、白蛋白(alb)、 肌酐(crea)-j、尿酸(ua)、尿素(urea)。
[0232]
实验结果:通过测定纳米粒对裸鼠血液生化参数值来判断对肝肾功能的影响,结 果如图27所示,与空白对照组相比,肝功能指标(alt、ast、alp、tb、alb) 和肾功能指标(crea、ua、urea)差异均无统计学意义(p》0.05)。裸鼠 血常规检查结果如图28所示,给药后各组裸鼠血常规指标与空白对照组相比无 显著性差异。以上结果表明gce是一种安全的sirna载体,在给药过程中不会 引起明显的器官或血液损伤。
[0233]
实施例15、对比实验
[0234]
本发明的药物递送系统gce/sirna与已知的最接近的药物递送系统 go-cs/pdna、go-cs/dtx进行比较,本发明通过改进go-cs的制备方法,在 中性环境中,gce电位值(+38.18mv)比go-cs电位值(+6.7mv)增大,避 免发生絮凝,溶液稳定性提升;同时,go-cs/pdna无相关动物体内研究,且 最接近的药物递送系统未被用于sirna的递送,本发明进一步证明壳聚糖修饰 的氧化石墨烯可用于sirna的递送,并提供了体内药效学研究,且经过epcam 单抗修饰后的go-cs,提高了药物递送肿瘤的特异性与靶向性,为rna干扰技 术的研究与应用提供研究基础。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1