一种金纳米颗粒可控地打开血脑屏障提高其通透性的方法及应用
1.本发明属于生物纳米医用技术领域,具体涉及一种金纳米颗粒(aunps)可控地打开血脑屏障(bbb)提高其通透性的方法及应用。
背景技术:
2.血脑屏障是指由脑毛细血管内皮细胞与神经胶质细胞形成的血液与脑细胞之间的屏障和由脉络丛形成的血液和脑脊液之间的屏障,这些屏障能够阻止血液中的大分子(往往是有害物质)进入脑组织,屏障主要由脑的连续毛细血管内皮及其细胞间的紧密连接、完整的基膜、周细胞以及星形胶质细胞脚板围成的神经胶质膜构成,其中血管内皮是bbb的主要结构。bbb具有选择透过性,仅允许部分血液中的物质(如气体分子和脂溶性化合物等)从脑毛细血管进入中枢神经系统,且其能控制物质穿越bbb的速度,保护中枢神经系统不受循环血液中有害物质的损害,从而保持脑组织内环境的基本稳定,对维持中枢神经系统正常生理状态具有重要的生物学意义。这样的特殊功能虽可保护大脑免受神经毒物的侵害,但也在很大程度上给治疗脑疾病的药物传输和释放造成了困难,以至于减缓了药物研发和临床治疗的进程。因此,可控地开闭血脑屏障来输送药物是一个长期探索的基础科学问题。
3.在大脑中,bbb有三种形态,即黏性连接型、紧密连接型和孔隙连接型,其中,紧密连接型是bbb的主要形态。内皮细胞上的一个钙黏蛋白可与相邻内皮细胞上的钙黏蛋白形成钙黏蛋白对,如此产生的众多钙黏蛋白对使相邻的血管内皮细胞紧密连接,构成具有选择透过性的结构。在bbb功能正常情况下,一些小分子能通过被动传输的方式穿过bbb,而一些具有较高电荷、极性和亲水性的大分子物质(如葡萄糖、氨基酸和大多数药物)必须通过特殊的转运蛋白才能穿过bbb。因此,大部分药物很难穿越bbb。为提高脑疾病治疗药物传输效率,科研工作者进行了大量尝试,开发了多种提升药物穿过bbb效率的方法,例如:将药物和前药进行化学修饰,暂时打开bbb的紧密连接,或通过神经外科手术传药以及借助纳米颗粒调控药物传输等。纳米颗粒运载药物穿过bbb呈现出多种优势,如无创、良好的生物相容性、稳定性、靶向性和高度可控的药物装载和释放,从而受到研究者与医学工作者的青睐。目前,已有纳米颗粒运载多肽、蛋白质、核酸、抗体、抗逆转录病毒和抗癌药物等分子穿过bbb的报道。将药物负载到纳米颗粒上,然后将药物纳米颗粒复合体注射到体内,使其随血液循环到达大脑毛细血管。药物纳米颗粒复合体接触到血管内皮细胞的血管腔一侧,被细胞膜包覆内吞后,进入血管内皮细胞,穿过整个血管内皮层到达血管内皮细胞的另一侧,再通过胞吐作用被释放而进入大脑内部。最后,药物从纳米颗粒释放到达病灶,进行针对治疗。然而,纳米颗粒运载药物穿越bbb的方法操作复杂且耗时。为了进一步提高药物传输效率,科研工作者们开发了调节渗透压、微气泡和超声的方式暂时性地打开bbb的紧密连接,在毛细血管壁上产生孔隙,使药物能够快速通过这些孔隙。但是,这些方法诱发的bbb通透性在一定程度上损伤内皮细胞,导致bbb功能恢复减缓等问题。
4.本人所在研究团队发现纳米材料可与血管内皮细胞之间的钙黏蛋白(ve-cadherin)相互作用,诱导可控的血管内皮渗漏,并将这一现象命名为nanomaterialsinducedendothelial leakiness(nanoel)。目前已有报道指出金纳米颗粒能解离皮肤血管内皮的钙黏蛋白对,从而提高血管的通透性。相较于皮肤血管内皮细胞,血脑屏障内皮细胞之间的钙黏蛋白对连接更加紧密,只允许部分小分子通过,长度大约10nm,目前很难可控地开闭血脑屏障且不引起二次伤害,而皮肤血管内皮细胞间连接大约24nm,通透性比血脑屏障高。此外,皮肤毛细血管内皮细胞是单层的,血脑屏障是由多层细胞构成,结构更复杂,目前还没有将金纳米颗粒应用在血脑屏障上提高其通透性的报道,纳米颗粒诱发bbb渗漏促进药物传输的研究仍是空白。
技术实现要素:
5.针对上述技术问题,本发明提供一种金纳米颗粒可控地打开血脑屏障提高其通透性的方法及应用,首次将金纳米颗粒用于打开脑血管内皮细胞间的连接,诱导血脑屏障渗漏,增强了血脑屏障的通透性,可促进药物穿越bbb快速到达病灶,为实现脑部给药提供了一种新的方式,为脑疾病临床治疗奠定基础。
6.为实现上述目的,本发明采用以下技术方案:
7.一种金纳米颗粒可控地打开血脑屏障提高其通透性的方法,包括以下步骤:
8.(1)制备金纳米颗粒;
9.(2)构建血脑屏障模型:采用人脑微血管内皮细胞(hbmec)和正常人星形胶质细胞(nha)构建;
10.(3)将金纳米颗粒作用于血脑屏障模型,诱导血脑屏障模型产生渗漏。
11.优选的,所述金纳米颗粒的粒径为12.44
±
1.05nm。
12.优选的,所述金纳米颗粒的表层附有阴离子,水中zeta电位-38.22
±
0.59mv,培养基中zeta电位为-7.28
±
1.29mv。
13.优选的,所述金纳米颗粒的制备方法,具体包括以下步骤:
14.(1)制备34.17mm柠檬酸三钠水溶液,制备0.09m氯金酸水溶液;
15.(2)采用水热法,先将柠檬酸三钠水溶液加热至95℃,再快速加入氯金酸水溶液,在95℃下持续反应30min;
16.(3)反应结束后,将反应体系置于冰水浴中快速降温得到产品,将产品置于4℃条件下保存。
17.优选的,所述柠檬酸三钠和氯金酸的摩尔比为3.8:1。
18.优选的,在所述步骤(2)建成血脑屏障模型后,先用n-乙酰半胱氨酸(nac)预处理细胞,再进行所述步骤(3)的操作。
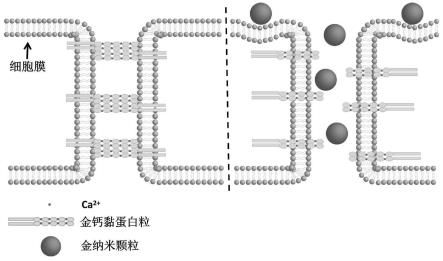
19.进一步优选的,所述n-乙酰半胱氨酸的浓度为2.5mm,预处理时间为2h。
20.优选的,所述血脑屏障模型的构建方法具体为:
21.(1)分别培养hbmec和nha,具体培养条件为37℃,培养6-7d;
22.(2)先将nha种在transwell小室膜的下方,培养4h;
23.(3)再在transwell小室膜的上方种上hbmec,两种细胞共同培养约3d,至hbmec之间形成紧密连接,得到血脑屏障模型。
24.上述所述的一种金纳米颗粒可控地打开血脑屏障提高其通透性的方法在药物穿越bbb中的应用也属于本发明的保护范围。
25.本发明的有益技术效果为:
26.1、本发明首次提出将金纳米颗粒用于打开脑血管内皮细胞间的连接,诱导血脑屏障渗漏,可促进药物穿越bbb快速到达病灶,为实现脑部给药提供了一种新的方式,为脑疾病临床治疗奠定基础;
27.2、金纳米颗粒可以和脑血管内皮细胞之间紧密连接的钙黏蛋白相互作用,使钙黏蛋白对连接断裂,在紧密连接的细胞间形成大小不一的孔隙,产生可控的血管内皮渗漏,从而增强了血脑屏障的通透性;
28.3、金纳米颗粒诱发血管内皮渗漏后,血管内皮细胞能够在短时间内产生新的钙黏蛋白对,从而恢复内皮细胞之间的紧密连接,避免长时间高通透性导致的有害物质侵入,且发生过内皮渗漏的bbb恢复周期稳定;
29.4、本发明中合成的金纳米颗粒大小均匀、性能稳定,用于诱导bbb模型渗漏效果明显,且金纳米颗粒生物相容性高,不会导致二次脑伤害;
30.5、本发明的金纳米颗粒直径与脑血管内皮细胞间的钙黏蛋白对长度相近,更容易打开内皮细胞间的连接;
31.6、本发明采用n-乙酰半胱氨酸预处理可消除金纳米颗粒诱导hbmec和nha产生的活性氧物质(ros),以避免在金纳米颗粒诱发bbb渗漏过程中ros导致的bbb模型渗漏。
附图说明
32.图1为本发明金纳米颗粒诱导bbb模型血管内皮渗漏的示意图;
33.图2为本发明实施例1制备得到的金纳米颗粒的透射电子显微镜及紫外-可见吸收光谱图;
34.图3为本发明实施例2中不同浓度金纳米颗粒诱导单层连续的hbmec渗漏的激光共聚焦显微镜图;
35.图4为本发明bbb模型的构建示意图;
36.图5为本发明实施例3中实施n-乙酰半胱氨酸预处理后,不同浓度金纳米颗粒诱导bbb模型渗漏的激光共聚焦显微镜图;
37.图6为本发明实施不同浓度金纳米颗粒处理bbb模型30min后,异硫氰酸荧光素右旋糖酐(fitc-dextran)在渗漏的bbb模型中的透过情况图;
38.图7为本发明实施例6中不同浓度金纳米颗粒处理bbb模型30min后,不同时间段内bbb模型的恢复情况,即渗漏的bbb模型在不同恢复时间段内可透过fitc-dextran的情况图。
具体实施方式
39.下面结合具体实施例对本发明作进一步说明。
40.实施例1
41.制备金纳米颗粒,具体包括以下步骤:
42.(1)制备34.17mm柠檬酸三钠水溶液,制备0.09m氯金酸水溶液;
43.(2)采用水热法,先将柠檬酸三钠水溶液加热至95℃,再快速加入氯金酸水溶液,在95℃下持续反应30min;
44.(3)反应结束后,将反应体系置于冰水浴中快速降温得到产品,将产品置于4℃条件下保存。
45.所述柠檬酸三钠和氯金酸的摩尔比为3.8:1。
46.经透射电子显微镜观察上述制备得到的金纳米颗粒,如图2所示,其结构均匀、稳定,粒子直径为12.44
±
1.05nm。
47.上述制备得到的金纳米颗粒的表层附有阴离子,水中zeta电位-38.22
±
0.59mv,培养基中zeta电位为-7.28
±
1.29mv。
48.实施例2
49.bbb模型是由hbmec和nha两种细胞构建的,比hbmec单层连续结构连接更紧密、更复杂,更难被纳米颗粒打开,因此本实施例首先使用金纳米颗粒打开hbmec单层连续结构,评估金纳米颗粒对单层连续的hbmec产生的渗漏效果,确定金纳米颗粒可以诱发脑内皮单层连续细胞之间产生孔隙,再去诱导bbb模型渗漏。
50.具体操作为:将hbmec以25k/孔细胞接种至8孔腔室载玻片,每孔完全培养基体积200μl,培养至单层连续的hbmec,形成紧密连接得到hbmec模型,设置对照组和实验组。
51.经电感耦合等离子体发射光谱仪测定实施例1中的金纳米颗粒的实际浓度后,用内皮细胞培养基分别配制浓度为10、20、50、100和200μm的金纳米颗粒,将不同浓度的金纳米颗粒分别作用于上述实验组的hbmec模型细胞,30min后移除金纳米颗粒,pbs溶液浸洗一次后,用4%的多聚甲醛在冰上固定15min;pbs溶液浸洗一次后,用0.2%的曲拉通溶液在冰上处理细胞15min;然后配制2%牛血清白蛋白、0.1%曲拉通和pbs溶液混合液,冰上孵育1h,pbs溶液浸泡洗两次,每次3min;用0.2%牛血清白蛋白、0.1%曲拉通和pbs溶液按一抗公司推荐稀释一抗,每孔150μl,4摄氏度冰箱孵育过夜;pbs溶液浸泡洗三次,每次3min;按二抗公司推荐比例,取适量用pbs溶液稀释合适体积,每孔200μl,室温避光孵育1h;pbs溶液浸泡洗三次,每次3min,移除溶液后去除腔室载玻片的腔室,每孔滴加含dapi的封片液10μl;盖上盖玻片并封片,置于4℃条件下避光存放。
52.本实施例采用激光共聚焦电子显微镜直观地评价金纳米颗粒解离hbmec之间的紧密连接的程度,通过激光共聚焦电子显微镜观察,以对照组为标准,被金纳米颗粒处理过30min的hbmec连接处出现孔隙,且随金纳米颗粒的浓度增高,细胞之间孔隙变大、孔隙率变高,具有金纳米颗粒浓度依赖性,如图3所示。
53.实施例3
54.由于金纳米颗粒处理细胞时,细胞内的氧化应激增高,导致hbmec之间的钙黏蛋白对的稳定性变低,从而使hbmec连接处产生孔隙,因此,在实施例2中hbmec形成紧密连接后,用2.5mm的n-乙酰半胱氨酸(nac)预处理细胞2h,排除活性氧物质的影响后再进行实施例2的后续操作。通过激光共聚焦电子显微镜观察,以对照组为标准,实验组细胞间的孔隙率和孔隙大小在整体上依旧呈金纳米颗粒浓度依赖性加剧,但整体上孔隙率低于未加nac处理的实验组,孔隙尺寸上也相应偏小,如图3所示。
55.实施例4
56.评估金纳米颗粒诱导血脑屏障细胞模型渗漏效果。
57.首先构建bbb模型,如图4所示,具体包括以下步骤:
58.(1)分别培养hbmec和nha,具体培养条件为37℃,培养6-7d;
59.(2)先将nha种在transwell小室膜的下方,培养4h;
60.(3)再在transwell小室膜的上方种上hbmec,两种细胞共同培养约3d,至hbmec之间形成紧密连接,得到血脑屏障模型。设置对照组和实验组。
61.将金纳米颗粒作用于上述实验组的血脑屏障模型,诱导血脑屏障模型产生渗漏,如图5所示,金纳米颗粒可以和脑血管内皮细胞之间紧密连接的钙黏蛋白相互作用,使钙黏蛋白对断裂,在紧密连接的细胞间形成大小不一的孔,从而增强了血脑屏障的通透性。
62.本实施例采用透过bbb模型的fitc-dextran的荧光值来定量地评估金纳米颗粒解离bbb模型紧密连接的程度。具体为:用内皮细胞培养基配制不同浓度的金纳米颗粒(10、20、50、100和200μm),将不同浓度的金纳米颗粒+相同浓度的fitc-dextran处理30min后移除transwell小室,将下室的培养基充分混匀后,用酶标仪测其荧光值。对照组fitc-dextran的荧光值设为1,实验组的荧光值呈金纳米颗粒浓度依赖式上升,且200μm金纳米颗粒处理的bbb模型组的荧光值高达1.40,如图6所示。
63.实施例5
64.金纳米颗粒处理导致细胞内的氧化应激增高,hbmec之间的钙黏蛋白对的稳定性变低,从而使其连接处产生孔隙,进而增强了fitc-dextran的渗漏。按照实施例4中,建成血脑屏障模型后,为了排除金纳米颗粒处理细胞后氧化应激产生的影响,用2.5mm的n-乙酰半胱氨酸预处理2h,再实行实施例4中后续的操作。以对照组fitc-dextran的荧光值为1,实验组的荧光值呈金纳米颗粒浓度依赖式上升,且200μm金纳米颗粒组的荧光值为1.35,如图6所示。
65.实施例6
66.本实施例通过侵袭小室法验证不同剂量金纳米颗粒诱导bbb模型渗漏后,渗漏的bbb模型可在一定时间内自主恢复功能。按照实施例5操作,移除金纳米颗粒后,换成完全培养基,让bbb模型分别恢复0.5、1.5、2.5、5、10和15h,配制含fitc-dextran的培养基加入到transwell小室上室中在bbb模型上作用0.5h,通过检测下室培养基中透过bbb模型的fitc-dextran荧光强度来评估bbb模型的恢复情况。结果显示,2.5小时后,浓度10和20μm金纳米颗粒处理的bbb模型组功能完全恢复,于对照组无显著差异;5小时后,50μm金纳米颗粒处理的bbb模型恢复功能,且10小时后,100和200μm金纳米颗粒处理的bbb模型组功能恢复,如图7所示。这说明金纳米颗粒诱发bbb模型渗漏后,血管内皮细胞能够在短时间内产生新的钙黏蛋白对,从而恢复内皮细胞之间的紧密连接,避免长时间高通透性导致的有害物质侵入。
67.以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的技术方案的基础上,本领域技术人员不需要付出创造性劳动即可做出的各种修改或变形仍在本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1