JAK抑制剂防治辐射诱导骨髓抑制和肠道损伤药物中的应用
本发明属于医药,涉及jak抑制剂在药学领域中的应用。更具体的说是jak抑制剂在制备防治辐射诱导骨髓抑制(骨髓抑制性死亡)或肠道损伤药物中的应用。
背景技术:
1、外界的物理、化学及生物等有害因素会通过多种效应对机体造成损伤作用,其中电离辐射可以产生dna损伤、细胞凋亡和氧化应激,对机体的损害通常更加严重且致命。骨髓造血以及肠道的正常执行对于机体的生命和健康状态的维持具有关键作用,加之其对电离辐射损伤的高度敏感性,因此成为辐射防护及救治的研究应用中的重要内容。随着放射性物质的广泛应用以及接受放射性治疗人数的增加,开发有效的辐射防护和救治、减少放疗副作用的药物,尤其是减少辐射诱导骨髓抑制的药物,就显得愈加迫切且重要。
2、辐射诱导的骨髓抑制表现为骨髓增殖能力下降、外周血细胞尤其是白细胞数目降低、适应性免疫减弱等。针对骨髓移植,目前临床上多采用生长因子类药物以及加强营养状态促进造血干细胞增殖,并辅以抗氧化损伤的化合物或中药制剂。辐射诱导的肠道损伤在于早期死亡,放射性肠炎等。多种药物的联合应用就不可避免地造成治疗成本的升高和多种副作用的产生,使得当下的治疗方式存在局限性,需要更佳疗效的药物应用等的治疗方案优化措施。
3、janus激酶(jak)家族是细胞因子受体胞内衔接的信号分子家族,成员为非受体类酪氨酸激酶,于ifn信号通路的研究过程中发现。哺乳动物的jak共包含四种:jak1、jak2、jak3以及tyk2。四种jak共有四个结构域:①ferm结构域,介导与跨膜受体的相互作用并参与激酶活性的激活;②sh2结构域,介导与受体的相互作用;③假激酶结构域,调节激酶活性;④激酶结构域,发挥酪氨酸激酶的活性。jak能够识别50多种细胞因子的受体,包括干扰素(ifn)、白介素(il)、集落刺激因子(csf)以及多种激素的跨膜受体,并通过jak-stat信号通路发挥转导和调控作用。当细胞因子配体与受体结合后,受体二聚化引起jak的磷酸化激活,激活的jak发挥酪氨酸激酶活性磷酸化受体并形成stat结合位点,募集的stat又被jak磷酸化激活脱离,随后入核发挥基因转录的调节作用。
4、jak-stat信号通路被认为是细胞功能的中心调节通路之一,在机体免疫系统的调节的方面都有着重大作用,参与免疫细胞的分化与成熟、造血干细胞功能发挥等过程。因此,jak也被认为是免疫性、炎症性疾病的关键靶点,jak抑制剂在造血、免疫系统疾病的治疗上存在巨大潜力。迄今为止,全球范围内已有8款jak抑制剂获批上市,包括5款一代jak抑制剂(广泛jak抑制剂):芦可替尼(ruxolitinib)、托法替尼(tofacitinib)、巴瑞替尼(baricitinib)、吡西替尼(peficitinib)、迪高替尼(delgocitinib),以及4款二代jak抑制剂(选择性jak抑制剂):菲卓替尼(fedratinib)、乌帕替尼(upadacitinib)、非戈替尼(filgotinib)、阿布昔替尼(abrocitinib)。其中托法替尼、巴瑞替尼、芦可替尼、乌帕替尼和阿布昔替尼已在国内获批。这些jak抑制剂主要用于治疗类风湿性关节炎、特应性皮炎、溃疡性结肠炎、银屑病关节炎骨髓纤维化以及移植物抗宿主病等。
5、尽管jak抑制剂已经作为临床上治疗免疫系统紊乱疾病的常用药物,但其在辐射防护救治方面的应用还未有报道。相关研究发现,jak对于骨髓细胞的内稳态至关重要,包括干细胞的维持、造血和免疫细胞发育。基于目前用于辐射损伤防治尤其是骨髓抑制治疗药物的尚有不足的现状,本发明人开展了jak抑制剂在辐射损伤防护方面的研究,并在实验中首次发现了jak抑制剂对辐射损伤有明显的治疗作用,尤其是在辐射诱导的骨髓抑制和肠道损伤的救治方面,基于以上发现进行了进一步的实验并完成本发明。
技术实现思路
1、本发明旨在找到能够防治与治疗电离辐射损伤的药物。
2、本发明的目的,一方面在于提供jak抑制剂在制备预防或治疗辐射诱导骨髓移植药物中的的应用,另一方面在于提供jak抑制剂在放疗防护中应用,具体与营养物质和其他药物如促进骨髓细胞增殖药物混合制成组合物,降低放疗所带来的毒副作用。
3、为实现上述发明目的,设计了如下的技术方案:
4、一种jak抑制剂在制备预防电离辐射诱导骨髓抑制药物和肠道损伤中的应用。所述的电离辐射诱导的骨髓抑制和肠道损伤,包括但不限于:接受放射治疗的肿瘤患者、辐射暴露的工作人员、意外辐射性同位素暴露的人员。
5、本发明所述骨髓抑制,包括外周血白细胞下降、骨髓增生不良或再生障碍性贫血。肠道损伤主要为放射性肠炎。
6、本发明进一步公开了含有jak抑制剂的药物组合物,它是将治疗有效量的jak抑制剂与药学上可接受的药用辅料混合制成组合物。
7、本发明更进一步公开了含有jak抑制剂与其它营养物质、促进骨髓细胞增殖药物或抗肿瘤药物的组合物,其中包括临床各种剂型的治疗药物、预防药物及保健食品等等。它是将jak抑制剂与其他营养物质、促进骨髓细胞增殖药物混合制成组合物。
8、本发明所述的其他营养物质包括:其他的氨基酸营养液、维生素、葡萄糖、脂肪乳、离子等。
9、本发明所述促进骨髓细胞增殖的药物包括:各种中药制剂如多糖类(枸杞、银耳、党参、黄芪、人参多糖等)、生物碱类(小檗碱、苦参总碱等)、皂甙类(人参皂甙、黄芪甙等)及其他如六味地黄口服液等升白中药制剂;人粒细胞巨噬细胞集落刺激因子(rhugm-csf)、升白欣、肌苷、左旋咪唑、三株口服液、康力龙等。
10、本发明所述的jak抑制剂与药学上可接受的药用辅料混合制成各种药物组合物,包括:片剂、胶囊剂、颗粒剂、丸剂、滴丸剂、预乳剂、微乳剂、混悬剂、糖浆剂、各种肠溶制剂或注射剂制剂等等。各制剂可以根据常规的工艺制备而成。在制备成药剂时可以加入药学上可接受的辅料,所述的药学上可接受的辅料,包括制剂中常规的稀释剂、填充剂(如甘露醇、乳糖、聚乙二醇),粘合剂(淀粉、微晶纤维素),崩解剂(如羧甲基纤维素、低取代的羟丙基纤维素),润滑剂(如滑石粉、硬脂酸镁),湿润剂(如丙二醇、乙醇),稳定剂(edta-2na、硫代硫酸钠、焦亚硫酸钠、亚硫酸钠、乙醇胺、碳酸氢钠)等等。
11、当jak抑制剂与药学上可接受的药用辅料混合组成药物组合物时,组合物中含有的活性成分jak抑制剂的量可以根据患者的病情、医生诊断的情况特定的加以应用,所用jak抑制剂的量或浓度在一个较宽的范围内调节,通常jak抑制剂的量范围为组合物的0.5%~90%(重量)。另一优选的范围为0.5%-70%。再一优选的范围为3%-50%。
12、本发明所述的jak抑制剂与其他营养物质、促进骨髓细胞增殖药物混合制成药物组合物或jak抑制剂作为支持药物与抗肿瘤药物配合使用。一般使用常规的技术,与制剂学上可接受的固体或液体载体结合,以及使之任意地与制剂学上可接受的辅助剂和赋形剂结合制备成微粒或微球。固体剂型包括片剂、分散颗粒、胶囊、缓释片、缓释微丸等等。固体载体可以是至少一种物质,其可以充当稀释剂、香味剂、增溶剂、润滑剂、悬浮剂、粘合剂、崩解剂以及包裹剂。惰性固体载体包括磷酸镁、硬脂酸镁、滑粉糖、乳糖、果胶、丙二醇、聚山梨酯80、糊精、淀粉、明胶、纤维素类物质例如甲基纤维素、微晶纤维素、低熔点石蜡、聚乙二醇、甘露醇、可可脂等。液体剂型包括溶剂、悬浮液例如注射剂、粉针剂等等。
13、本发明对辐射诱导骨髓抑制的试验内容主要包括以下几个方面:
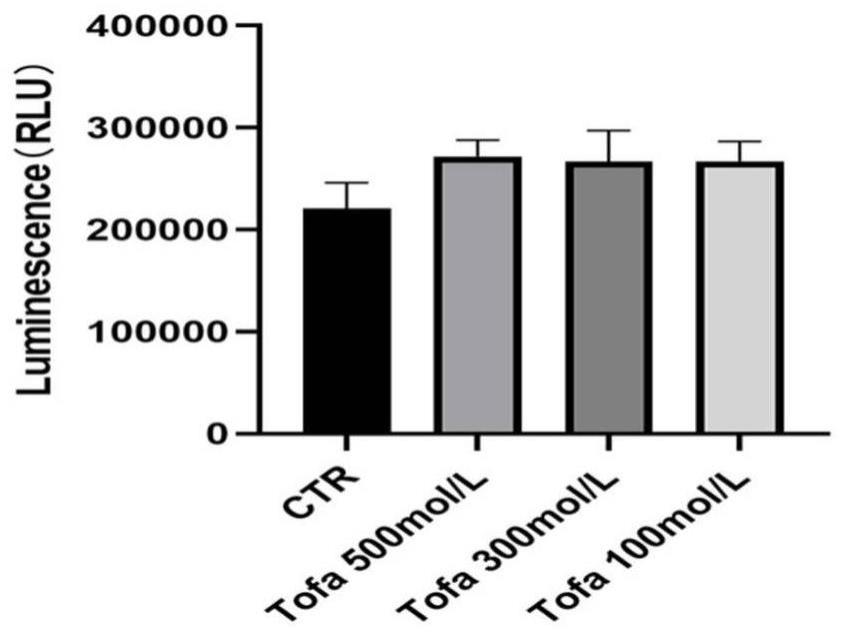
14、1.jak抑制剂正常状态骨髓细胞无毒性作用。
15、2.jak抑制剂能够提高接受全身照射的小鼠的存活率。
16、3.jak抑制剂降低了辐射暴露小鼠骨髓细胞的ros水平。
17、4.jak抑制剂降低了辐射暴露小鼠骨髓细胞凋亡水平。
18、本发明选用了一代泛jak抑制剂托法替尼进行相关探究,下面通过生物学实验进一步说明jak抑制剂在预防或治疗辐射、化学毒物诱导骨髓抑制作用的实验情况。
19、具体实验方法
20、1、全身照射小鼠生存率测定
21、c57bl/6小鼠随机分组,10只/组,托法替尼在小鼠照射前1h灌胃给药(20mg/kg/d),全身照射7.2gy后,定期称重,每日灌胃给药并观察小鼠死亡情况。
22、2、骨髓单个核细胞分离
23、无菌取小鼠股骨,使用含2%fcs的hunks液冲洗骨髓,制备单个核细胞悬液,洗涤,计数调整所需的细胞浓度后待用。
24、3、细胞活力测定
25、分离小鼠骨髓细胞并培养于96孔板中,每孔加入100μl单个核细胞悬液,按设计加入处理药物100ul,照射1gy后37℃培养箱孵育18h。取出培养板,放置室温,加入生物发光试剂cell-titer 20ul,振荡混匀后,转入黑色测定板,glomaxtm发光检测仪采用promega自带检测程序cell-titer protocol进行检测。检测结果自动生成excel数据。
26、4、细胞活性氧测定
27、分离小鼠骨髓细胞并培养于96孔板中,每孔加入100μl单个核细胞悬液,按设计加入处理药物100ul,照射1gy后37℃培养箱孵育18h。取出培养板,放置室温,加入配置好的dfch试剂(500μl/样)。pbs洗涤后重悬细胞,通过流式细胞术检测细胞活性氧水平。
28、5、细胞凋亡检测
29、分离小鼠骨髓细胞并培养于96孔板中,每孔加入100μl单个核细胞悬液,按设计加入处理药物100ul,照射1gy后37℃培养箱孵育18h。取出培养板,放置室温,加入annexin v/pi凋亡检测试剂盒binding buffer(200ul/管),混匀,再依次加入1ul annexin v-fitc,2ul pi每孔,室温避光孵育15min。随后流式细胞术检测细胞凋亡水平。
- 还没有人留言评论。精彩留言会获得点赞!