一种用于骨修复材料的矿化胶原的制备方法与流程
1.本发明涉及生物医用材料领域,尤其是涉及一种用于骨修复材料的矿化胶原的制备方法。
背景技术:
2.天然硬组织是一种有机-无机复合材料,有机成分主要为ⅰ型胶原,还包括少量的非胶原蛋白和多糖,无机成分主要为低结晶度的羟基磷灰石。在自然界中硬组织的形成过程中,胶原分子自组装形成的网络结构充当模板,作为用于胶原沉积的纳米隔室。目前临床上用于硬组织缺损的修复材料中,自体骨是最理想的移植物,但数量有限且会对取骨部位造成损伤,异体骨则存在免疫排斥反应和感染疾病的风险。对于合成材料,虽然不断开发出了新的材料和结构,可以实现更为理想的修复效果,但若用于临床,仍然需要较长时间的验证。就目前而言,对于人体硬组织缺损的修复及其再生的促进,矿化胶原是优选的生物材料。
3.矿化胶原的制备方法,一般是将胶原蛋白置于钙磷盐溶液中,使钙磷矿物沉积于胶原纤维内和胶原纤维外,再通过交联提高胶原蛋白的结构稳定性,降低其降解速率。先矿化后交联,一定程度上破坏了胶原分子经自组装形成的三维网络结构,交联后沉积于胶原蛋白内部网络中的羟基磷灰石的分布也会受到影响,甚至极有可能因胶原网络结构的改变而脱落。
4.胶原在硬组织的形成过程中起着关键作用,但越来越多的研究发现,虽然人体硬组织中的非胶原蛋白含量远远低于胶原蛋白含量,但非胶原蛋白在硬组织的形成中起着尤为关键的作用。目前对于胶原矿化的研究,为更好地模拟天然硬组织的形成,可在体系中添加非胶原蛋白类似物,例如聚电解质,提高矿化的效率及程度。然而,一方面,引入的聚电解质难以去除,可能会影响矿化胶原的性能和安全性。另一方面,可通过引入的天然高分子,替代有毒性的聚电解质,天然高分子可降解且降解产物无毒副作用,但是其对材料植入后的微环境的影响未可知,可能会影响组织再生方向。
5.鉴于以上,制备矿化胶原的关键是充分发挥胶原蛋白本身的诱导作用和模板作用,即尽可能引入更少添加剂。首先提供稳定的网络结构,再通过控制体系的组成,使钙磷矿物质充分沉积在胶原蛋白网络内部的空隙及纤维表面和纤维之间,同时实现纤维内和纤维外矿化,以达到最佳的胶原矿化效果,制备出组成最为接近自然硬组织的胶原/羟基磷灰石复合物,用于骨缺损的修复和促进骨组织再生。
6.因此,如何实现较高的矿化效率同时又减少添加剂的引入是本领域技术人员致力于研究的方向之一。
技术实现要素:
7.本发明的目的是为了解决上述现有技术中存在的问题,即针对现有的胶原矿化方法存在的矿化效率往往较低且引入组分过多的问题,提供了一种用于骨修复材料的矿化胶
原的制备方法。
8.本发明的目的是这样实现的:
9.本发明用于骨修复材料的矿化胶原的制备方法,包括以下步骤:
10.步骤1:将ⅰ型胶原溶于0.1m醋酸溶液中,搅拌使其完全溶解,配制0.1~10mg/ml酸性胶原溶液;
11.步骤2:将步骤1所得酸性胶原溶液置于碱性氛围中,使ⅰ型胶原完成自组装,得到自组装ⅰ型胶原;将酸性ⅰ型胶原溶液置于碱性氛围中,使胶原自组装形成具有周期性横纹的胶原纤维,经过自组装的ⅰ型胶原兼具可吸引钙磷离子的带电域和供钙磷矿物沉积的纳米隔室。胶原分子以自组装的方式形成多孔网格结构,其中的空隙区作为矿物质沉积的位点,再通过交联提高了胶原蛋白的构象稳定性,使纤维网络结构更加稳定致密,为矿物沉积提供更多空间;
12.步骤3:将步骤2所得的自组装ⅰ型胶原放置于质量浓度为0.05%戊二醛溶液中,交联4~48h,随后将交联ⅰ型胶原置于层析柱中,充分洗去残留戊二醛,得到交联胶原;选择了戊二醛作为交联剂,其链两端各带一个醛基,醛基对钙离子有螯合作用,而戊二醛是通过与氨基酸分子的ε-氨基反应从而产生交联作用,戊二醛的引入不会影响胶原分子中羧酸根基团的数量,即胶原分子对钙离子的吸附作用不会减弱。但经过交联的胶原网络上具有更多带负电的醛基,可以吸附更多钙离子,因而利于矿化;使用戊二醛对ⅰ型胶原进行交联,提高胶原蛋白的构象稳定性,使胶原纤维网络结构更加稳定致密,为矿物沉积提供更多空间。
13.步骤4:将步骤3所得的交联胶原依次置于浓度逐级升高的含钙离子和磷离子的溶液中,在37℃下完成交联胶原的逐级矿化,得到矿化胶原;将交联ⅰ型胶原依次置于浓度逐渐升高的钙磷盐溶液或模拟体液中,对ⅰ型胶原进行逐级矿化。通过控制体系中钙离子和磷离子的浓度,使得矿物前体首先以离子的形式或小体积的钙磷结合物的形式进入胶原网络的空隙中,待钙磷矿物填充于胶原纤维内的空隙后,再在胶原纤维表面和胶原纤维之间沉积。研究表明,在含有钙离子和磷离子的体系中,钙磷离子会自发地形成聚集体,聚集体的尺寸与离子浓度有关。经过交联后胶原网络结构更为致密,体积较大的钙磷结合物难以进入胶原纤维内部。为了避免交联对矿物沉积的阻碍作用,本发明提出通过调控矿化体系的浓度,使羟基磷灰石前体最初以离子的形式或小体积的钙磷结合物的形式进入胶原网络中,再由于静电作用,钙离子和磷酸根离子相互吸引成核,形成无定型磷酸钙,沉积于胶原蛋白网络结构中,再转变为羟基磷灰石。待纤维内的空隙被磷酸钙矿物质填充后,由于胶原分子的酸性基团对钙离子的静电吸引作用,钙离子或矿物质前体会继续沉积在胶原纤维表面和纤维间,实现纤维外矿化;
14.步骤5:将步骤4所得的矿化胶原进行冷冻干燥,研磨得到矿化胶原粉末。
15.上述制备方法,步骤2中,所述碱性氛围为k2hpo4溶液,通过将酸性胶原溶液置于k2hpo4溶液中透析1~5d,使胶原完成自组装;或,所述碱性氛围为氨水,将酸性胶原溶液置于含氨水的密闭容器中保持2~24h,使胶原完成自组装。
16.上述制备方法,步骤3中,所述质量浓度为0.05%戊二醛溶液与自组装ⅰ型胶原的体积质量比为100:1。
17.上述制备方法,步骤4中,所述含钙离子和磷离子的溶液为钙磷盐溶液或模拟体液sbf。
18.上述制备方法,步骤4中,所述交联胶原的逐级矿化包括以下步骤:
19.步骤a1:将步骤3所得的交联胶原置于1~2.5mmcacl2溶液中,搅拌使其分散均匀,静置1~12h后在其中加入k2hpo4,控制ca/p为1.67,搅拌均匀,用naoh调节ph为7~9,静置1~24h;
20.步骤b1:离心,过滤,将所得沉淀置于5~7.5mmcacl2溶液中,搅拌使其分散均匀,静置1~12h后在其中加入k2hpo4,控制ca/p为1.67,搅拌均匀,用naoh调节ph为7~9,静置1~24h;
21.步骤c1:离心,过滤,将所得沉淀置于10~12.5mmcacl2溶液中,搅拌使其分散均匀,静置1~12h后在其中加入k2hpo4,控制ca/p为1.67,搅拌均匀,用naoh调节ph为7~9,静置1~24h;
22.步骤d1:离心,过滤,取所得沉淀,即为矿化胶原。
23.或,所述交联胶原的逐级矿化包括以下步骤:
24.步骤a2:将步骤3所得的交联胶原置于1倍模拟体液(1
×
sbf)中,充分搅拌后放置12~24h;
25.步骤b2:离心,过滤,将所得沉淀置于3倍模拟体液(3
×
sbf)中,充分搅拌后放置12~24h;
26.步骤c2:离心,过滤,将所得沉淀置于5倍模拟体液(5
×
sbf)中,充分搅拌后放置12~24h;
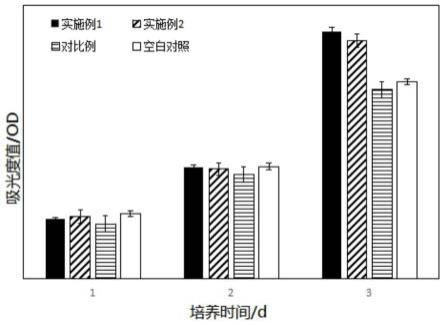
27.步骤d2:离心,过滤,取所得沉淀,即为矿化胶原。
28.与现有技术相比,本发明具有以下有益效果:
29.本发明矿化胶原的制备方法,所涉及的矿化体系不添加任何稳定剂及促矿化剂,可避免添加的化学物质的潜在毒性及对植入微环境的不利影响。同时本发明制备方法所制备的矿化胶原,与添加稳定剂或促矿化剂所制备的矿化胶原相比,矿化程度并无明显差异。
30.本发明矿化胶原的制备方法,流程简单,引入物质少,并可同时实现纤维内和纤维外的逐级矿化。
附图说明
31.图1a是未矿化的ⅰ型胶原的tem图像;
32.图1b是实施例1制备的矿化胶原的tem图像;
33.图1c是实施例2制备的矿化胶原的tem图像;
34.图1d是对比例制备的矿化胶原的tem图像;
35.图2是实施例1、实施例2及对比例制备的矿化胶原及自然骨骼中的无机物含量数据;
36.图3是实施例1、实施例2及对比例制备的矿化胶原采用mtt法测试细胞毒性对应的吸光度值。
具体实施方式
37.下面将结合实施例,对本发明作进一步说明。应该指出,以下详细说明都是示例性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有
与本发明所属技术领域的普通技术人员通常理解的相同含义。
38.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
39.实施例1
40.本实施例用于骨修复材料的矿化胶原的制备方法,具体步骤为:
41.(1)胶原溶液的配制:将ⅰ型胶原溶于0.1m醋酸溶液中,搅拌使其完全溶解,配制1mg/ml酸性胶原溶液。
42.(2)胶原的自组装:将步骤(1)所得的酸性胶原溶液置于0.2mm的k2hpo4溶液中透析48h,使ⅰ型胶原完成自组装,得到自组装ⅰ型胶原。
43.(3)胶原的交联:将步骤(2)所得的自组装ⅰ型胶原放置于质量浓度为0.05%戊二醛溶液中,每克自组装ⅰ型胶原对应100ml戊二醛溶液,交联24h。随后将交联ⅰ型胶原置于层析柱中,洗涤24h,充分洗去残留戊二醛,得到交联胶原。
44.(4)胶原的逐级矿化:将步骤(4)所得的交联胶原置于2.5mmcacl2溶液中,搅拌使其分散均匀,静置12h后在其中加入k2hpo4,控制ca/p为1.67,搅拌均匀,用naoh调节ph为9,静置24h;离心,过滤,将所得沉淀置于7.5mmcacl2溶液中,搅拌使其分散均匀,静置12h后在其中加入k2hpo4,控制ca/p为1.67,搅拌均匀,用naoh调节ph为9,静置24h;离心,过滤,将所得沉淀置于12.5mmcacl2溶液中,搅拌使其分散均匀,静置12h后在其中加入k2hpo4,控制ca/p为1.67,搅拌均匀,用naoh调节ph为9,静置24h;离心,过滤,取所得沉淀,即为矿化胶原。
45.(5)将步骤(4)所得的矿化胶原冷冻干燥,研磨得到矿化胶原粉末。
46.实施例2
47.本实施例用于骨修复材料的矿化胶原的制备方法,具体步骤为:
48.(1)胶原溶液的配制:将ⅰ型胶原溶于0.1m醋酸溶液中,搅拌使其完全溶解,配制1mg/ml酸性胶原溶液。
49.(2)胶原的自组装:将步骤(1)所得的酸性胶原溶液置于0.2mm的k2hpo4溶液中透析48h,使ⅰ型胶原完成自组装,得到自组装ⅰ型胶原。
50.(3)胶原的交联:将步骤(2)所得的自组装ⅰ型胶原放置于质量浓度为0.05%戊二醛溶液中,每克自组装ⅰ型胶原对应100ml戊二醛溶液,交联24h。随后将交联ⅰ型胶原置于层析柱中,洗涤24h,充分洗去残留戊二醛,得到交联胶原。
51.(4)胶原的逐级矿化:将步骤(4)所得的交联胶原置于1倍模拟体液1
×
sbf中,充分搅拌后放置24h;离心,过滤,将所得沉淀置于3
×
sbf中,充分搅拌后放置24h;离心,过滤,将所得沉淀置于5
×
sbf中,充分搅拌后放置24h;离心,过滤,取所得沉淀,即为矿化胶原。
52.(5)将步骤(4)所得的矿化胶原冷冻干燥,研磨得到矿化胶原粉末。
53.对比例
54.以聚丙烯酸paa作为无定型磷酸钙稳定剂的矿化胶原的制备,具体步骤如下:
55.(1)配制仿生矿化液:取cacl2,溶于去离子水中,配制7.5mmcacl2溶液,待无机盐固体完全溶解后,在溶液中加入paa,使其浓度为300μg/ml,搅拌至完全溶解。向上述所得溶液中加入k2hpo4固体,保证ca/p为1.67,搅拌使固体完全溶解,得到含稳定无定型磷酸钙的仿
生矿化液。
56.(2)胶原溶液的配制:将ⅰ型胶原溶于0.1m醋酸溶液中,搅拌使其完全溶解,配制1mg/ml酸性胶原溶液。
57.(3)胶原的自组装:将步骤(2)所得酸性胶原酸溶液置于0.2mm的k2hpo4溶液中透析48h,使ⅰ型胶原完成自组装,得到自组装ⅰ型胶原。
58.(4)胶原的交联:将步骤(3)所得自组装ⅰ型胶原放置于质量浓度为0.05%戊二醛溶液中,每克自组装ⅰ型胶原对应100ml戊二醛溶液,交联24h。随后将交联ⅰ型胶原置于层析柱中,洗涤24h,充分洗去残留戊二醛,得到交联胶原。
59.(5)胶原的矿化:将上述步骤所得交联胶原置于步骤(1)所得仿生矿化液中,搅拌均匀后于37℃环境中放置5d,完成ⅰ型胶原的矿化。
60.(6)离心、过滤取沉淀,经冷冻干燥后研磨得到矿化胶原粉末。
61.实验分析结果:
62.1、tem(透射电镜图)观察形貌:
63.图1a为未矿化的ⅰ型胶原的tem图像,有明显的明暗交替的周期结构。
64.图1b、c和d分别为实施例1、实施例2和对比例制备的矿化胶原成品的tem图像,可见经矿化后ⅰ型胶原周期结构消失,说明周期性的孔洞被矿化形成的无机矿物填充,表明本发明提出的方法可实现胶原纤维内矿化。
65.2、热重分析
66.对实施例1、实施例2和对比例制备的矿化胶原进行热重分析,从700℃后剩余质量为样品中无机物含量,无机物含量反映矿化程度。三组样品及天然骨骼的无机物含量如图2所示,可以看出,本发明提出的矿化胶原的制备方法,所得矿化胶原与添加矿化诱导剂的情况相比,矿化程度相近,均在60%~70%范围内,接近自然骨骼的组成。与此同时,本发明提出的制备方法,在更短的时间内便可达到与对照例接近的矿化程度,具有更高的矿化效率。
67.3、细胞毒性
68.将实施例1、实施例2和对比例制备的矿化胶原与mc3t3-e1细胞进行共培养,用mtt法检测细胞毒性。不同时间点的吸光度值如图3所示,细胞在实施例1和实施例2下所制备的矿化胶原存在的情况下具有更高的增殖活性,表明本发明提出的方法所制备的矿化胶原,具有更低的细胞毒性,主要是由于没有聚电解质的引入,成分简单,相对安全。
69.本发明矿化胶原的制备方法,所涉及的矿化体系不添加任何稳定剂及促矿化剂,可避免添加的化学物质的潜在毒性及对植入微环境的不利影响。同时本发明提出的方法所制备的矿化胶原,与添加稳定剂或促矿化剂所制备的矿化胶原相比,矿化程度并无明显差异。
70.本发明制备方法流程简单,引入物质少,并可同时实现纤维内和纤维外的逐级矿化。
71.以上实施例仅供说明本发明之用,而非对本发明的限制,有关技术领域的技术人员,在不脱离本发明的精神和范围的情况下,还可以作出各种变换或变型,因此所有等同的技术方案也应该属于本发明的范畴,应由各权利要求所限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1