一种干巴菌胞外多糖及其应用
1.本发明属于天然产物提取制备技术领域,具体涉及一种干巴菌胞外多糖及其应用。
背景技术:
2.公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
3.干巴菌(thelephora ganbajun),又称牛牙齿菌或对花菌,属于担子菌亚门(basidiomycotina)层菌纲(hymenomycetes)非褶菌目(aphyllophorales)革菌科(thelephoraceae)革菌属(thelephora)的一类真菌,其主要生长于亚热带云南松林或针阔混交林下,为中国云南特有的珍稀野生菌,主要分布于海拔1000~2200m的松林中,与云南松、思茅松等松属植物有共生关系,目前还未能实现人工栽培。
4.干巴菌不仅具有香味浓郁、肉质脆嫩、嚼味无穷、味道鲜美等特点,而且其菌丝体中富含氨基酸、蛋白质、多糖、黄酮、维生素、微量元素等丰富的营养物质,具有很高的营养保健价值。有研究表明,干巴菌具有抗氧化、抗肿瘤、提高免疫力、延缓衰老等功效。
5.食用菌的液体发酵技术较传统的固体栽培技术有明显的优越性,具有生产周期短,菌丝体生长旺盛,可以连续化生产的特点。食用菌的液体发酵技术可以产生胞外多糖,胞外多糖是从食用菌液体发酵培养产生的发酵液中提取的多糖。据报道,食用菌胞外多糖具有良好的生物学活性功能,但是目前针对干巴菌胞外多糖及其应用仍然鲜有报道,因此有必要针对干巴菌胞外多糖进行进一步深入研究,从而有效提高干巴菌利用率,提升干巴菌产品附加值,并延长干巴菌产业链。
技术实现要素:
6.针对现有技术的不足,本发明提供一种干巴菌胞外多糖及其应用。本发明通过试验研究发现,采用特定工艺制备获得的干巴菌胞外多糖具有良好的抗氧化、抗炎症以及美白功效,因此具有良好的实际应用之价值。
7.为实现上述技术目的,本发明采用的技术方案如下:
8.本发明的第一个方面,提供干巴菌胞外多糖在制备抗氧化性、抗炎症和/或美白产品中的应用。
9.所述产品包括但不限于食品、药品、日化用品和饲料。
10.本发明中的干巴菌胞外多糖是从干巴菌发酵液提取获得的干巴菌多糖成分。
11.本发明的第二个方面,提供一种干巴菌胞外多糖的制备方法,所述制备方法包括:
12.s1、向干巴菌发酵液中加入乙醇混合静置后,收集固形物;
13.s2、所述固形物去蛋白,经阴离子交换柱分离后获得干巴菌胞外多糖。
14.本发明的第三个方面,提供一种具有抗氧化、抗炎症以及美白功效的产品,所述产
品包含干巴菌胞外多糖,具体的,所述干巴菌胞外多糖是通过上述第二方面所述制备方法获得的。经试验证明,所述eps-2具有极佳的抗氧化、抗炎症以及抑制黑色素形成能力,因此可以制备相应产品进行使用。
15.上述一个或多个技术方案的有益技术效果:
16.上述技术方案中以干巴菌发酵液为原料,通过优化提取纯化工艺条件,最终获得干巴菌胞外多糖eps-1和eps-2,同时进行试验验证,干巴菌胞外多糖eps-2不仅在abts自由基清除能力上优于eps-1,同时其在清除体内自由基、抑制炎症反应以及抑制黑色素生成等方面亦具有显著作用,因此可广泛应用于食品、药品、日化用品和饲料等领域,有效提高了干巴菌的综合利用价值。
附图说明
17.构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
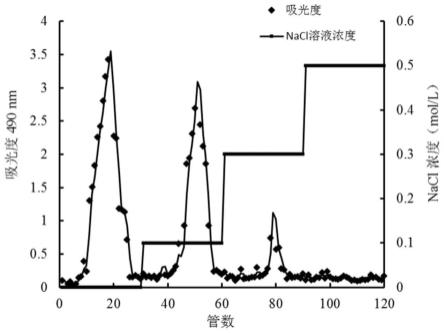
18.图1为本发明实施例1中干巴菌胞外多糖的deae-52洗脱曲线。
19.图2为本发明实施例2中干巴菌胞外多糖eps-1和eps-2的abts自由基的清除能力。
20.图3为本发明实施例3中干巴菌胞外多糖eps-2的hplc色谱图。
21.图4为本发明实施例4中干巴菌胞外多糖eps-2体内清除体内自由基的能力。
22.图5为本发明实施例5中干巴菌胞外多糖eps-2体内抑制中性粒细胞迁移的能力。
23.图6为本发明实施例6中干巴菌胞外多糖eps-2体内抑制黑色素形成的能力。
具体实施方式
24.应该指出,以下详细说明都是例示性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
25.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。
26.本发明的一个典型具体实施方式中,提供干巴菌胞外多糖在制备抗氧化性、抗炎症和/或美白产品中的应用。
27.其中,所述抗氧化性具体表现为其不仅具有极佳的abts阳离子自由基清除能力,同时在斑马鱼氧化应激模型中,干巴菌胞外多糖eps-2还表现出良好的体内自由基清除能力,充分证明了本发明的干巴菌胞外多糖具有良好的抗氧化性能。
28.此外,本发明通过试验研究发现,干巴菌胞外多糖对炎症还具有明显的改善作用,能够通过抑制中性粒细胞的迁移、聚集达到改善炎症实现抗炎的效果。同时,本发明的干巴菌胞外多糖在斑马鱼黑色素形成抑制试验中,还表现出良好的抑制黑色素形成能力,因此可作为美白化妆品原料进行使用。上述试验充分证明本发明的干巴菌胞外多糖在抗氧化
性、抗炎症和/或美白产品的开发方面具有广阔的市场价值。
29.所述产品包括但不限于食品、药品、日化用品和饲料。
30.本发明中的干巴菌胞外多糖是从干巴菌进行培养时分泌到菌丝体外部的代谢物中中提取获得的多糖成分,即实际为一种干巴菌多糖,因此对其提取制备工艺不做具体限定。
31.本发明的又一具体实施方式中,所述干巴菌胞外多糖eps-2至少包含如下单糖:甘露糖、半乳糖醛酸、葡萄糖、半乳糖;进一步的,所述干巴菌胞外多糖的组成可以包括甘露糖,氨基葡萄糖,核糖,鼠李糖,葡萄糖醛酸,半乳糖醛酸,葡萄糖,半乳糖,阿拉伯糖和岩藻糖。
32.其中,甘露糖,氨基葡萄糖,核糖,鼠李糖,葡萄糖醛酸,半乳糖醛酸,葡萄糖,半乳糖,阿拉伯糖和岩藻糖的摩尔比为25-30:0.5-2:0.01-0.1:1-3:2-4:10-15:30-35:15-20:1-3:0.5-2。
33.本发明的又一具体实施方式中,提供一种干巴菌胞外多糖的制备方法,所述制备方法包括:
34.s1、向干巴菌发酵液中加入乙醇混合静置后,收集固形物;
35.s2、所述固形物去蛋白,经阴离子交换柱分离后获得干巴菌胞外多糖。
36.其中,所述步骤s1中,
37.所述乙醇为高浓度乙醇,所述乙醇可以为70%及以上浓度的乙醇,如70%、71%、72%、73%、74%、75%、76%、77%、78%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%乙醇,在本发明的一个具体实施方式中,所述乙醇为95%乙醇。
38.所述干巴菌发酵液可以为发酵培养上述干巴菌的过程中获得的液体;所述液体可以包含干巴菌(菌丝体),但并不必然需要含有干巴菌。
39.在本发明中,所述干巴菌发酵液具体为上述干巴菌的发酵培养液经离心、过滤、沉降或所属领域中已知的其他手段将在发酵培养液中生长的干巴菌菌丝体与液体分离,去除干巴菌菌体时所剩余的液体。为进一步提高胞外多糖产率,菌丝体分离后获得的干巴菌发酵液可再经浓缩处理,如浓缩至原发酵液液体体积的2/3-1/2。
40.发酵过程中,使用的发酵培养基不做具体限定,只要是可以用于培养真菌特别是食用真菌的培养基即可,当然可以优选为培养干巴菌的培养基,在本发明的一个具体实施方式中,所述培养基为马铃薯葡萄糖培养基。
41.所述干巴菌发酵液与酒精的体积比为1:1~5,如1:1,1:2,1:3,1:4,1:5,如本发明的一个具体实施方式中,所述干巴菌发酵液与酒精为1:3。
42.静置时间为1-24h,如3h、8h、12h、18h、24h,在本发明的一个具体实施方式中,所述静置时间为12h。
43.所述步骤s2中,所述去蛋白方法可以采用本领域已知的任意方法,如sevag法,在此不做具体限定,所述阴离子交换柱具体为deae阴离子交换柱。
44.经deae阴离子交换柱分离后,干巴菌胞外多糖可以被纯化为2个主要组分,分别被命名为eps-1和eps-2。
45.具体的,所述eps-1和eps-2具体纯化过程如下:
46.依次使用去离子水和0.1、0.3、0.5mol/l的nacl溶液进行洗脱,洗脱液的流速为0.5-5ml/min(优选为1ml/min),每个洗脱浓度分别收集25-35管(优选为30管)洗脱液,每管体积为0.5-5ml(优选为2ml),收集5-28管,冻干,即为eps-1;收集40-58管,冻干,即为eps-2。
47.洗脱过程中使用苯酚-硫酸法逐管检测,以管数为横坐标,吸光度(a
490nm
)为纵坐标绘制洗脱曲线。
48.发明人经试验证明,采用上述方法制得的干巴菌胞外多糖对炎症具有改善作用,具体通过抑制中性粒细胞的迁移、聚集实现抗炎的效果。同时,本发明的干巴菌胞外多糖还具有极佳的abts阳离子自由基和体内自由基清除能力,表明本发明的干巴菌胞外多糖具有良好的抗氧化性能。此外,本发明的干巴菌胞外多糖在斑马鱼黑色素形成抑制试验中,还表现出良好的抑制黑色素形成能力,因此可作为美白化妆品原料进行使用。上述试验充分证明本发明的干巴菌胞外多糖在抗氧化性、抗炎症和/或美白产品的开发方面具有广阔的市场价值,因此具有良好的实际应用之价值。
49.本发明的又一具体实施方式中,提供一种具有抗氧化性、抗炎症和/或美白的产品,所述产品包含上述干巴菌胞外多糖。具体的,所述干巴菌胞外多糖是通过上述制备方法获得的。经试验证明,所述eps-2具有极佳的抗氧化、抗炎症以及抑制黑色素形成能力,因此可以制备相应产品进行使用。
50.所述干巴菌胞外多糖eps-2包含如下单糖:甘露糖、半乳糖醛酸、葡萄糖、半乳糖;进一步的,干巴菌胞外多糖eps-2包含如下单糖:甘露糖,氨基葡萄糖,核糖,鼠李糖,葡萄糖醛酸,半乳糖醛酸,葡萄糖,半乳糖,阿拉伯糖和岩藻糖。
51.更具体的,所述干巴菌胞外多糖eps-2其所含有的甘露糖,氨基葡萄糖,核糖,鼠李糖,葡萄糖醛酸,半乳糖醛酸,葡萄糖,半乳糖,阿拉伯糖和岩藻糖的摩尔比如下:25-30:0.5-2:0.01-0.1:1-3:2-4:10-15:30-35:15-20:1-3:0.5-2。
52.所述产品包括但不限于食品、药品、日化用品和饲料。
53.需要说明的是,在本发明中,所使用的术语“食品”应做广义的理解,其可以理解为可以使任何可以被食用的形式,例如,本发明中的食品包括普通食品和特殊食品,本发明所述特殊食品包括保健食品和特殊医学用途配方食品;而普通食品时相对于特殊食品而言的,是适合所有人的食品。
54.所述食品包含但不限于固体食品、液体食品;所述固体食品包括但不限于烘焙食品(如饼干、面包、蛋糕)、糖果、固体饮料等;所述液体食品包括但不限于液体饮料(如碳酸饮料、果汁饮料、乳饮料)等。
55.根据本发明,当所述产品为药品时,所述药品还包括至少一种药物非活性成分。
56.所述药物非活性成分可以是药学上通常使用的载体、赋形剂及稀释剂等。而且,根据通常的方法,可以制作成粉剂、颗粒剂、片剂、胶囊剂、混悬剂、乳剂、糖浆剂、喷雾剂等的口服剂、外用剂、栓剂及无菌注射溶液形式的剂型使用。
57.所述可以包含的载体、赋形剂及稀释剂等非药物活性成分在领域内是熟知的,本领域普通技术人员能够确定其符合临床标准。
58.本发明的又一具体实施方式中,所述载体、赋形剂及稀释剂包括但不限于有乳糖、葡萄糖、蔗糖、山梨糖醇、甘露醇、木糖醇、赤藓糖醇、麦芽糖醇、淀粉、阿拉伯胶、藻酸盐、明
胶、磷酸钙、硅酸钙、纤维素、甲基纤维素、微晶纤维素、聚乙烯吡咯烷酮、水、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石粉、硬脂酸镁和矿物油等。
59.所述日化用品可为衣物洗涤剂、个人卫生清洁剂和化妆品等,优选为化妆品,所述化妆品进一步优选为护肤品,其至少具有抗氧化、抗炎舒缓以及美白等功效。
60.所述护肤品还可以包含任意化妆品领域允许添加的其他原料成分,包括但不限于乳化剂、润肤剂、保湿剂、增稠剂、稳定剂、防腐剂、抗氧化剂和溶剂等,在此不做具体限定。本领域技术人员可根据实际情况进行调整。同时,本发明通过合理添加上述原料成分,也可以以此制备不同护肤品剂型,如水、乳、霜等,同时,基于上述基础护肤品品类,进一步衍生制备的获得的其他化妆品品类,其均属于本技术的保护范围之内。
61.所述饲料即为农业或牧业饲养的动物的食物。本发明的干巴菌胞外多糖可作为饲料添加剂添加至任意品种饲料中,所述饲料包括但不限于全价配合饲料、浓缩饲料和预混合饲料。
62.以下通过实施例对本发明做进一步解释说明,但不构成对本发明的限制。应理解这些实施例仅用于说明本发明而不用于限制本发明的范围。需要说明的是,本发明实施例中,使用的干巴菌编号为bncc 230987,为申请人自北京北纳创联生物技术研究院购得,并已在cn109880750a等专利中公开,公众可通过市售等方式获得。
63.实施例1
64.干巴菌(bncc 230987)胞外多糖的制备。将斜面保藏的干巴菌接种于活化培养基平板中,25℃培养5d,取0.5cm2活化菌种接入种子培养基中,于摇床振荡培养6d(25℃,130r/min),即为种子液。取0.5ml种子液分别转接入马铃薯葡萄糖液体培养基中,于摇床振荡培养7d(25℃,130r/min)。将培养物过滤或离心分离菌丝体和发酵液。发酵液浓缩至2/3-1/2体积,加入3倍体积酒精(95%),静置12h,离心(10000r/min,10min),沉淀于55℃烘干,采用sevag法去蛋白。将去蛋白后的多糖溶于去离子水中,用0.45μm的微孔滤膜过滤,加5ml样品溶液于deae-52纤维素阴离子交换柱(1.6cm
×
30cm)中,用去离子水和0.1、0.3、0.5mol/l的nacl溶液进行洗脱,洗脱液的流速为1ml/min,每个洗脱浓度分别收集30管,用全自动部分收集器收集洗脱液(2ml/管),用苯酚-硫酸法逐管检测,以管数为横坐标,吸光度(a
490 nm
)为纵坐标绘制洗脱曲线。
65.由图1可见,干巴菌胞外多糖可以被纯化为2个主要组分,收集5-28管,冻干,即为eps-1;收集40-58管,冻干,即为eps-2。
66.实施例2
67.abts阳离子自由基清除能力的测定。实验组:将abts溶液(7mmol/l)和过硫酸钾溶液(4.9mmol/l)等体积混合,避光静置20h,用磷酸盐缓冲液(0.1mol/l,ph 7.4)稀释,使其在波长734nm处吸光度为0.7
±
0.02,即为abts工作液。取abts工作液3ml,样品1ml于试管中,室温避光反应6min,于波长734nm处测定吸光度a。实验对照组:将abts工作液换为磷酸钠盐缓冲液,测得吸光度为ac。空白对照组:将样品换为水,测得吸光度为ab。abts阳离子自由基清除率按公式计算:abts自由基清除率(%)=[1-(a-ac)/ab]
×
100。
[0068]
由图2可知,eps-1的ec
50
值为349.28mg/l,eps-2的ec
50
值为96.54mg/l,eps-1和eps-2均具有清除abts自由基的能力,且eps-2清除abts自由基的能力显著高于eps-1。
[0069]
实施例3
[0070]
采用柱前衍生hplc法测定eps-2的单糖组成。将50mg eps-2溶于10ml h2so4(1mol/l)中,100℃水浴8h,用naoh(2mol/l)中和为中性。取50μl单糖标准品溶液或eps-2溶液与50μl pmp-甲醇溶液(0.5mol/l)及50μl naoh(0.3mol/l)混合均匀,70℃水浴30min,冷却至室温,加入50μl hcl(0.3mol/l)和100μl去离子水。向混合液中加入1ml氯仿,涡旋混匀30s随后静置5min,吸取下层液弃去。从“加入1ml氯仿”起重复操作4次,即得衍生化的标准品或待测样品。hplc条件:色谱柱c18柱(250mm
×
4.6mm,5μl);流动相a—100mmol/l磷酸钠缓冲液(ph=6.5),流动相b—乙腈;检测波长:245nm;柱温:30℃;流速:1ml/min;进样量20μl。
[0071]
由图3可知,eps-2含有的单糖种类及其摩尔百分比含量为,甘露糖29.43%,氨基葡萄糖1.36%,核糖0.07%,鼠李糖2.2%,葡萄糖醛酸2.59%,半乳糖醛酸13.19%,葡萄糖32.59%,半乳糖15.33%,阿拉伯糖2.46%,岩藻糖0.78%。
[0072]
实施例4
[0073]
tg(krt4:ntr-hkitgr)cy17转基因斑马鱼的绿色荧光皮肤细胞可以表达硝基还原酶,当环境中含有甲硝唑时,皮肤荧光细胞将产生大量的体内自由基,引起皮肤细胞死亡,荧光点消失。抗氧化物质可以及时清除自由基,当待测物质具有抗氧化能力时,可以避免斑马鱼皮肤细胞的绿色荧光点消失。因此,待测物质的抗氧化能力可以用tg(krt4:ntr-hkitgr)cy17转基因斑马鱼进行评价。
[0074]
将受精24h的tg(krt4:ntr-hkitgr)cy17转基因斑马鱼受精卵的卵膜用1mg/ml的胰蛋白酶去除。发育正常的胚胎随机转移到24孔板中(10只每孔),并进行以下分组:溶剂对照组(vc)不添加任何药品,仅为养鱼水;模型组(mc)添加甲硝唑(10mmol/l);阳性对照组(pc)添加维生素c(25μg/ml)和甲硝唑(10mmol/l);eps-2低、中、高干预组(i,ii,iii)分别添加低、中、高浓度的eps-2(25,50和75μg/ml)和甲硝唑(10mmol/l)。所有组别28℃培养24h后进行荧光拍照,并计算荧光点数。
[0075]
如图4可见,添加甲硝唑的(mc)组中斑马鱼皮肤绿色荧光点数量较(vc)组显著降低,斑马鱼氧化应激模型构建成功。(i,ii,iii)组中,随着eps-2浓度的增加皮肤荧光点数逐渐增多。较mc,eps-2干预组(i,ii,iii)的荧光点数分别增加了60.88%,102.80%和147.36%。并且i的荧光点数与pc无显著差异(p》0.05),ii,iii均显著高于pc(p《0.01)。因此,eps-2具有良好的抗氧化能力。
[0076]
实施例5
[0077]
中性粒细胞的迁移和聚集是炎症反正的重要特征之一。tg(lyz:gfp)转基因斑马鱼的中性粒细胞被标记为绿色荧光,当斑马鱼的侧线上的神经丘被硫酸铜损伤时,中性粒细胞会迁移至侧线。具有抗炎症作用的物质可以抑制中性粒细胞向侧线的迁移。将受精后72h的斑马鱼转移至24孔板中(10条鱼每孔,每孔2ml溶液)。将不同浓度eps-2或吲哚美辛与斑马鱼共孵育2h,然后用硫酸铜处理2h。溶剂对照组(vc)仅为养鱼水,不添加任何药物;模型组(mc)的养鱼水含有硫酸铜(20μmol/l);阳性对照组(pc)的养鱼水含有硫酸铜(20μmol/l)和吲哚美辛(5μg/ml);eps-2干预组(i,ii,iii,iv,v)的养鱼水分别含有不同浓度eps-2(10、25、50、100、200μg/ml)和硫酸铜(20μmol/l)。在荧光显微镜下拍照并计算侧线上的中性粒细胞个数。
[0078]
如图5所示,在硫酸铜的作用下,mc组斑马鱼侧线的中性粒细胞迁移数显著增多,炎症模型构建成功。当eps-2存在时(i、ii、iii、iv、v),随着eps-2浓度的增加,斑马鱼侧线
中的中性粒细胞迁移数逐渐减少。较mc组斑马鱼,i、ii、iii、iv、v组斑马鱼侧线中的中性粒细胞数量分别降低44.16%,49.91%,50.28%,69.02%和92.58%。并且,高剂量eps-2干预组(v)与抗炎症药物吲哚美辛(pc)组侧线中性粒细胞迁移数无显著差异性(p》0.05)。因此,eps-2具有良好的抗炎症能力。
[0079]
实施例6
[0080]
当野生型斑马鱼(ab系)受精卵发育到21h时,用1mg/ml的胰蛋白酶去除受精卵的卵膜。选取发育正常的斑马鱼幼鱼进行以下分组:(i,ii,iii)将斑马鱼幼鱼暴露于不同浓度的eps-2溶液中(10,30和50μg/ml);(pc)将斑马鱼暴露于20mg/ml的熊果苷溶液中;(vc)将斑马鱼幼鱼暴露于不添加任何药品的养鱼水中。将所有组别的斑马鱼置于28℃下培养24h。拍照并计算黑色素面积。
[0081]
由图6可知,eps-2中、高浓度干预组(ii,iii)的黑色素面积较vc组降低17.95%(p《0.05)和19.55%(p《0.05)。熊果苷干预组(pc)的黑色素面积较vc组降低63.33%(p《0.01)。需要说明的是,熊果苷在eps-2干预剂量下(10-50μg/ml)未表现出黑色素抑制能力,pc组的干预剂量(20mg/ml)为eps-2高剂量干预组(50μg/ml)的400倍。因此,eps-2具有良好的抑制黑色素形成能力。
[0082]
应注意的是,以上实例仅用于说明本发明的技术方案而非对其进行限制。尽管参照所给出的实例对本发明进行了详细说明,但是本领域的普通技术人员可根据需要对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1