杂合AAV-指环载体的制作方法
背景技术:
1、一直需要开发用于制备合适的病毒载体的组合物和方法,以将治疗性效应物递送至患者。
技术实现思路
1、本披露提供了一种指环载体(例如合成的指环载体),该指环载体可用作递送媒介物,例如用于向真核细胞(例如人细胞或人组织中的细胞)递送遗传物质、递送效应物(例如有效载荷)、或者递送治疗剂或治疗性效应物。通常,指环载体包含含有指环病毒orf1分子的蛋白质外壳(例如,与指环病毒orf1蛋白具有至少30%、40%、50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的衣壳蛋白,例如,如本文所述)和包封在蛋白质外壳内的遗传元件,其中该遗传元件包含来自除指环病毒之外的病毒的至少一个核酸序列(例如,长度为至少10、20、30、40、50、60、70、80、90、100、125、150、175、200、250、300、400、500、600、700、800、900、1000、1500、2000、2500、3000、3500或4000个核苷酸的连续核酸序列),或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的序列。在一些实施例中,来自除指环病毒之外的病毒的核酸序列来自腺相关病毒(aav)(例如,如本文所述)。在一些实施例中,效应物(例如,有效载荷)或编码该效应物的序列与非指环病毒序列是分开的。在一些实施例中,蛋白质外壳能够将遗传元件引入靶细胞(例如,哺乳动物细胞,例如,人细胞)中。本披露进一步提供了用于施用例如如本文所述的指环载体(例如合成的指环载体)的组合物和方法,该指环载体可以用作递送媒介物,例如,用于向真核细胞(例如人细胞或人组织)递送遗传物质、递送效应物(例如有效载荷)、或者递送治疗剂或治疗性效应物。
2、可以在用于递送本文所述的效应物的方法中使用的指环载体及其组分(例如,使用如本文所述的组合物或方法产生)通常包含封装在蛋白质外壳(例如,包含以下的蛋白质外壳:指环病毒衣壳蛋白,例如指环病毒orf1分子,例如指环病毒orf1蛋白或由指环病毒orf1核酸编码的多肽,例如如本文所述,或与其具有至少30%、40%、50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的多肽)中的遗传元件(例如,包含或编码效应物(例如外源性或内源性效应物,例如治疗性效应物)的遗传元件),能够将该遗传元件引入细胞(例如,哺乳动物细胞,例如人细胞)中。遗传元件通常包含来自除指环病毒之外的病毒(例如来自aav,例如aav1、aav2或aav5)的至少一个核酸序列(例如,长度为至少10、20、30、40、50、60、70、80、90、100、125、150、175、200、250、300、400、500、600、700、800、900、1000、1500、2000、2500、3000、3500或4000个核苷酸的连续核酸序列),或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的序列。在一些实施例中,非指环病毒序列包含非指环病毒复制起点,例如,衍生自单dna病毒(monodnavirus),例如,称德病毒(shotokuvirus)(例如,单环编码病毒门(cressdnaviricota)[例如,雷东多病毒(redondovirus)、圆环病毒(circovirus){例如,猪圆环病毒(porcine circovirus),例如,pcv-1或pcv-2;或者喙羽症病毒(beak-and-feather disease virus)}、双生病毒(geminivirus){例如,番茄金花叶病毒(tomatogolden mosaic virus)}或矮缩病毒(nanovirus){例如,bbtv、mdv1、scsvf或fbnyv}]),或细小病毒(parvovirus)(例如,依赖性细小病毒(dependoparavirus),例如,博卡病毒(bocavirus)或腺相关病毒(aav))。在一些实施例中,非指环病毒复制起点衍生自aav(例如,aav1、aav2或aav5)。在一些实施例中,非指环病毒复制起点包含aav rep-结合基序(rbm)(例如,如本文所述),或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%或99%序列同一性的序列。在一些实施例中,非指环病毒复制起点包含aav末端解离位点(trs)(例如,如本文所述),或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%或99%序列同一性的序列。在一些实施例中,非指环病毒复制起点包含在反向末端重复(itr)中,例如aav itr,例如,如本文所述。
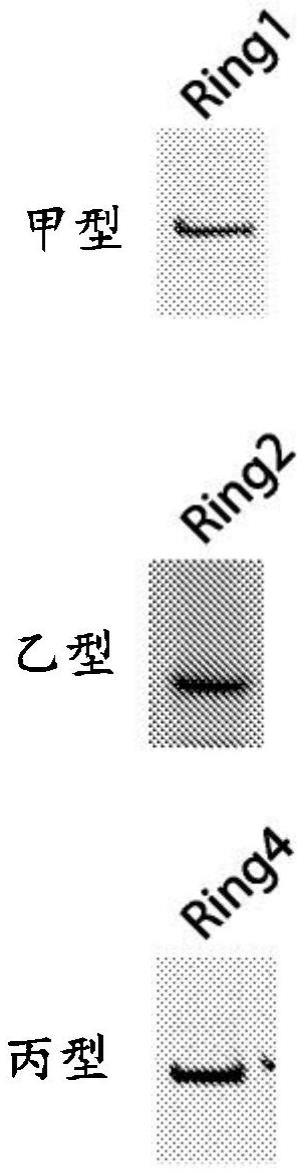
3、在一些实施例中,指环载体是感染性媒介物或颗粒,其包含蛋白质外壳(例如衣壳),该蛋白质外壳包含由指环病毒orf1核酸(例如,甲型细环病毒、乙型细环病毒或丙型细环病毒的orf1核酸,例如甲型细环病毒分支1、甲型细环病毒分支2、甲型细环病毒分支3、甲型细环病毒分支4、甲型细环病毒分支5、甲型细环病毒分支6或甲型细环病毒分支7的orf1,例如,如本文所述)编码的多肽,或与其具有至少30%、40%、50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的多肽。在实施例中,本文所述的指环载体包含由指环病毒orf1核酸(例如,具有如表a1、b1、b3、c1、e1、f1、f3或f5中任一个所述的序列,或与其具有至少80%、85%、90%、95%、96%、97%、98%或99%序列同一性的序列)编码的多肽。在实施例中,本文所述的指环载体包含具有orf1蛋白的序列(例如,具有如表a2、b2、b4、c2、e2、f2、f4或f6中任一个所述序列)的多肽,或与其具有至少80%、85%、90%、95%、96%、97%、98%或99%序列同一性的多肽。在实施例中,本文所述的指环载体是感染性媒介物或颗粒,例如,包含封装非指环病毒基因组的指环病毒衣壳。指环病毒衣壳的产生可包括指环病毒orf1分子(例如,如本文所述)的体外产生或宿主细胞表达。
4、在一些实施例中,本披露的指环载体的遗传元件是环状和/或单链dna分子(例如,环状和单链的)。在一些实施例中,本披露的指环载体的遗传元件是线性和/或单链dna分子(例如,线性和单链的)。在一些实施例中,遗传元件包括与包封它的蛋白质外壳结合的蛋白结合序列,或与之相连的多肽,这可能有助于将遗传元件包封在蛋白质外壳内,和/或相对于其他核酸而言,将遗传元件富集在蛋白质外壳内。在一些实施例中,指环载体的遗传元件使用如本文所述的组合物或方法产生。
5、在一些情况下,可用于递送本文所述的效应物的方法的指环载体包含遗传元件,该遗传元件包含或编码效应物(例如,核酸效应物如非编码rna,或多肽效应物如蛋白质),例如,可以在细胞中表达的效应物。在一些实施例中,效应物是治疗剂或治疗性效应物,例如,如本文所述的。在一些实施例中,效应物是内源性效应物或外源性效应物,例如针对野生型指环病毒或靶细胞而言的内源性效应物或外源性效应物。在一些实施例中,效应物针对野生型指环病毒或靶细胞而言是外源性的。在一些实施例中,指环载体可以通过接触细胞并将编码效应物的遗传元件引入细胞中,从而将效应物递送到细胞内,使得效应物由细胞产生或表达。在某些情况下,效应物是内源性效应物(例如,针对靶细胞而言是内源性的,但是,例如由指环载体以更大的量提供的内源性效应物)。在其他情况下,效应物是外源性效应物。在一些情况下,效应物可以调节细胞的功能或者调节细胞中靶分子的活性或水平。例如,效应物可以降低细胞中靶蛋白的水平。在另一实例中,指环载体可以在体内递送和表达效应物,例如外源性蛋白。例如,指环载体可用于将遗传物质递送至靶细胞、组织或受试者;将效应物递送至靶细胞、组织或受试者;调节生物应答,例如细胞或分子应答;或者用于治疗病症(如疾病和障碍),例如通过将可作为调节剂和/或治疗剂起作用的效应物递送至所期望的细胞、组织或受试者。
6、在一些实施例中,本文所述的组合物和方法可用于例如在宿主细胞中产生合成指环载体的遗传元件,该遗传元件要被用于如本文所述的施用指环载体的方法。合成指环载体与野生型病毒(例如,野生型指环病毒,例如,如本文所述)相比具有至少一种结构差异,例如,相对于野生型病毒的缺失、插入、置换、修饰(例如,酶促修饰)。在一些实施例中,结构差异包含遗传元件的非指环病毒序列,例如,如本文所述。通常,合成指环载体包括包封在蛋白质外壳内的外源性遗传元件,其可用于将遗传元件或在其中编码的(例如,多肽或核酸效应物)效应物(例如,外源性效应物或内源性效应物)递送至真核(例如,人类)细胞中。在实施例中,指环载体不会造成可检测的和/或不必要的免疫或炎症反应,例如,不会造成一种或多种炎症分子标志如tnf-α、il-6、il-12、ifn增加超过1%、5%、10%、15%,以及不会造成b细胞应答,如反应性或中和性抗体,例如,指环载体对靶细胞、组织或受试者是基本上非免疫原性的。
7、在一些实施例中,本文所述的组合物和方法可用于产生指环载体的遗传元件,该指环载体是例如可用于递送本文所述的效应物的方法的指环载体,该指环载体包含:(i)遗传元件,其包含启动子元件和编码效应物(例如内源性或外源性效应物)的序列,和蛋白结合序列(例如,外壳蛋白结合序列,如包装信号);以及(ii)蛋白质外壳;其中将遗传元件被包封在蛋白质外壳(例如,衣壳)内;并且其中指环载体能够将遗传元件递送到真核(例如,哺乳动物,例如人)细胞中。在一些实施例中,遗传元件是单链和/或环状dna。可替代地或组合地,遗传元件具有以下特性中的一种、两种、三种或所有:是环状的,是单链的,它整合到细胞基因组中的频率低于进入细胞的遗传元件的约0.0001%、0.001%、0.005%、0.01%、0.05%、0.1%、0.5%、1%、1.5%或2%,和/或它以少于1、2、3、4、5、6、7、8、9、10、15、20、25或30个拷贝/基因组整合到靶细胞的基因组中。在一些实施例中,整合频率是通过对从游离载体中分离出来的基因组dna进行定量凝胶纯化测定来确定的,例如,如wang等人(2004,gene therapy[基因治疗],11:711-721,其通过引用以其全文并入本文)中所述。在一些实施例中,将遗传元件包封在蛋白质外壳内。在一些实施例中,指环载体能够将遗传元件递送到真核细胞中。在一些实施例中,遗传元件包含与野生型指环病毒序列(例如,野生型细环病毒(ttv)、小细环病毒(ttmv)或ttmdv序列,例如,如本文所述的野生型指环病毒序列)具有至少75%(例如,至少75%、76%、77%、78%、79%、80%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)序列同一性的核酸序列(例如,300-4000个核苷酸的核酸序列,如300-3500个核苷酸、300-3000个核苷酸、300-2500个核苷酸、300-2000个核苷酸、300-1500个核苷酸的核酸序列)。在一些实施例中,遗传元件包含与野生型指环病毒序列(例如,如本文所述的野生型指环病毒序列)具有至少75%(例如,至少75%、76%、77%、78%、79%、80%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)序列同一性的核酸序列(例如,至少300个核苷酸、500个核苷酸、1000个核苷酸、1500个核苷酸、2000个核苷酸、2500个核苷酸、3000个核苷酸或更多个核苷酸的核酸序列)。在一些实施例中,核酸序列经过密码子优化,例如,用于在哺乳动物(如,人)细胞中表达。在一些实施例中,核酸序列中至少50%、60%、70%、80%、90%、95%、96%、97%、98%、99%或100%的密码子经过密码子优化,例如,用于在哺乳动物(如,人)细胞中表达。
8、在一些实施例中,本文所述的组合物和方法可用于产生包含衣壳(例如,包含指环病毒orf如orf1、多肽的衣壳)的感染性(例如,对人细胞具有感染性)指环载体、媒介物或颗粒的遗传元件,该衣壳封装遗传元件,该遗传元件包含与衣壳结合的蛋白结合序列和编码治疗性效应物(该治疗性效应物可用于本文所述的施用指环载体的方法)的异源(针对指环病毒而言)序列。在实施例中,指环载体能够将遗传元件递送至哺乳动物(例如,人)细胞中。在一些实施例中,遗传元件与野生型指环病毒基因组序列具有小于约6%(例如,小于10%、9.5%、9%、8%、7%、6%、5.5%、5%、4.5%、4%、3.5%、3%、2.5%、2%、1.5%或更小)的同一性。在一些实施例中,遗传元件与野生型指环病毒基因组序列具有不超过1.5%、2%、2.5%、3%、3.5%、4%、4.5%、5%、5.5%或6%的同一性。在一些实施例中,遗传元件与野生型指环病毒具有至少约2%到至少约5.5%(例如,2%至5%、3%至5%、4%至5%)的同一性。在一些实施例中,遗传元件具有大于约2000、3000、4000、4500或5000个核苷酸的非病毒序列(例如,非指环病毒基因组序列)。在一些实施例中,遗传元件具有大于约2000至5000、2500至4500、3000至4500、2500至4500、3500或4000、4500(例如,约3000至4500)个核苷酸的非病毒序列(例如,非指环病毒基因组序列)。在一些实施例中,遗传元件是单链环状dna。可替代地或组合地,遗传元件具有以下特性中的一种、两种或三种:是环状的,是单链的,它以少于进入细胞的遗传元件的约0.001%、0.005%、0.01%、0.05%、0.1%、0.5%、1%、1.5%、或2%的频率整合进入细胞的基因组中,它以小于1、2、3、4、5、6、7、8、9、10、15、20、25或30个拷贝/基因组整合进入靶细胞的基因组中或以少于进入细胞的遗传元件的约0.0001%、0.001%、0.005%、0.01%、0.05%、0.1%、0.5%、1%、1.5%或2%的频率整合(例如,相对于来自细胞裂解物的遗传元件序列比较进入基因组dna的整合频率)。在一些实施例中,整合频率是通过对从游离载体中分离出来的基因组dna进行定量凝胶纯化测定来确定的,例如,如wang等人(2004,gene therapy[基因治疗],11:711-721,其通过引用以其全文并入本文)中所述。
9、在一些实施例中,根据本文所述的方法施用的指环病毒或指环载体可用作有效递送媒介物,用于将作用剂如本文所述的效应物引入靶细胞中,例如,待接受治疗性或预防性治疗的受试者中的靶细胞。
10、在一些实施例中,本文所述的组合物和方法可用于产生包含蛋白质外壳的指环载体(该指环载体可用于本文所述的施用方法的)的遗传元件,该蛋白质外壳包含多肽(例如合成多肽,如orf1分子),该多肽包含(例如,以串联方式):
11、(i)第一区,其包含精氨酸富集区,例如,包含至少60%、70%或80%碱性残基(例如,精氨酸、赖氨酸或其组合)的至少约40个氨基酸的序列,
12、(ii)第二区域,其包含胶冻卷结构域,例如,包含至少6个β链的序列,
13、(iii)第三区域,其包含本文所述的n22结构域序列,
14、(iv)第四区域,其包含本文所述的指环病毒orf1 c-末端结构域(ctd)序列,以及
15、(v)任选地,其中该多肽具有与例如本文所述的野生型指环病毒orf1蛋白存在小于100%、99%、98%、95%、90%、85%、80%序列同一性的氨基酸序列。
16、在一方面,本发明的特征在于包含遗传元件序列的分离的核酸分子(例如,核酸构建体),该遗传元件序列包含与编码效应物例如有效载荷的序列可操作地连接的启动子元件,以及外壳蛋白结合序列。在一些实施例中,外壳蛋白结合序列包括与例如本文披露的指环病毒的5’utr序列存在至少75%(至少80%、85%、90%、95%、97%、100%)同一性的序列。在实施例中,遗传元件是单链dna,是环状的,以少于进入细胞的遗传元件的约0.001%、0.005%、0.01%、0.05%、0.1%、0.5%、1%、1.5%、或2%的频率整合,和/或以小于1、2、3、4、5、6、7、8、9、10、15、20、25或30个拷贝/基因组整合进入靶细胞的基因组中或以少于进入细胞的遗传元件的约0.001%、0.005%、0.01%、0.05%、0.1%、0.5%、1%、1.5%或2%的频率整合。在一些实施例中,整合频率是通过对从游离载体中分离出来的基因组dna进行定量凝胶纯化测定来确定的,例如,如wang等人(2004,gene therapy[基因治疗],11:711-721,其通过引用以其全文并入本文)中所述。在实施例中,效应物并非源自ttv,也不是sv40-mir-s1。在实施例中,核酸分子不包含ttmv-ly2的多核苷酸序列。在实施例中,启动子元件能够指导效应物在真核(例如哺乳动物,例如人类)细胞中的表达。
17、在一些实施例中,核酸分子是环状的。在一些实施例中,核酸分子是线性的。在一些实施例中,本文所述的核酸分子包含一个或多个经修饰的核苷酸(例如碱基修饰、糖修饰或骨架修饰)。
18、在一些实施例中,核酸分子包含编码orf1分子(例如,指环病毒orf1蛋白,例如,如本文所述)的序列。在一些实施例中,核酸分子包含编码orf2分子(例如,指环病毒orf2蛋白,例如,如本文所述)的序列。在一些实施例中,核酸分子包含编码orf3分子(例如,指环病毒orf3蛋白,例如,如本文所述)的序列。在一方面,本发明的特征在于遗传元件,其包含以下中的一种、两种或三种:(i)启动子元件和编码效应物(例如,外源性或内源性效应物)的序列;(ii)至少72个连续核苷酸(例如,至少72、73、74、75、76、77、78、79、80、90、100或150个核苷酸),其与野生型指环病毒序列具有至少75%(例如,至少75%、76%、77%、78%、79%、80%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)序列同一性;或至少100(例如,至少300、500、1000、1500)个连续核苷酸,其与野生型指环病毒序列具有至少72%(例如,至少72%、73%、74%、75%、76%、77%、78%、79%、80%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)序列同一性;以及(iii)蛋白结合序列,例如外壳蛋白结合序列,并且其中核酸构建体是单链dna;并且其中核酸构建体是环状的,以少于进入细胞的遗传元件的约0.001%、0.005%、0.01%、0.05%、0.1%、0.5%、1%、1.5%或2%的频率整合,和/或以小于1、2、3、4、5、6、7、8、9、10、15、20、25或30个拷贝/基因组整合进入靶细胞的基因组中。在一些实施例中,编码效应物(例如,外源性或内源性效应物,例如,如本文所述)的遗传元件经过密码子优化。在一些实施例中,遗传元件是环状的。在一些实施例中,遗传元件是线性的。在一些实施例中,本文所述的遗传元件包含一个或多个经修饰的核苷酸(例如碱基修饰、糖修饰或骨架修饰)。在一些实施例中,遗传元件包含编码orf1分子(例如,指环病毒orf1蛋白,例如,如本文所述)的序列。在一些实施例中,遗传元件包含编码orf2分子(例如,指环病毒orf2蛋白,例如,如本文所述)的序列。在一些实施例中,遗传元件包含编码orf3分子(例如,指环病毒orf3蛋白,例如,如本文所述)的序列。
19、在一方面,本发明的特征在于宿主细胞,其包含:(a)一种或多种核酸分子,其包含编码orf1分子、orf2分子或orf3分子中的一种或多种的序列(例如,编码本文所述的指环病毒orf1多肽的序列),例如,其中核酸分子是质粒、是病毒核酸、或整合到染色体中;以及(b)遗传元件,其中遗传元件包含(i)与编码效应物(例如,外源性效应物或内源性效应物)的核酸序列(例如,dna序列)可操作地连接的启动子元件,和(ii)结合(a)的orf1分子的蛋白结合序列,其中(b)的遗传元件不编码orf1多肽(例如,orf1蛋白)、orf2多肽(例如,orf2蛋白)和/或orf3多肽(例如,orf3蛋白)中的一种或多种。例如,宿主细胞包含以顺式(均是同一核酸分子的一部分)或反式(各自是不同核酸分子的一部分)存在的(a)和(b)。在实施例中,(a)的一种或多种核酸可以是环状、单链dna;在其他实施例中,(a)的一种或多种核酸可以是线性dna。在实施例中,(b)的遗传元件是环状单链dna。在一些实施例中,宿主细胞是生产细胞系,例如,如本文所述的。在一些实施例中,宿主细胞是贴壁的或悬浮的,或者二者兼有。在一些实施例中,宿主细胞或辅助细胞在微载剂中生长。在一些实施例中,宿主细胞或辅助细胞符合cgmp生产规范。在一些实施例中,宿主细胞或辅助细胞在适合促进细胞生长的培养基中生长。在某些实施例中,一旦宿主细胞或辅助细胞已经充分生长(例如,达到适当的细胞密度),就可以将培养基更换为适于宿主细胞或辅助细胞产生指环载体的培养基。
20、在一方面,本发明的特征在于药物组合物,该药物组合物包含指环载体(例如,合成指环载体),例如,可以通过本文所述的方法施用的指环载体。在实施例中,药物组合物进一步包含药学上可接受的载剂或赋形剂。在实施例中,药物组合物包含单位剂量,该单位剂量包含每千克目标受试者约105-1014(例如,约106-1013、107-1012、108-1011或109-1010)个基因组当量的指环载体。在一些实施例中,包含制剂的药物组合物在可接受的期限和温度范围内是稳定的,和/或与所期望的施用途径和/或该施用途径所需的任何装置(例如,针头或注射器)相容。在一些实施例中,将药物组合物配制用于作为单剂量或多剂量施用。在一些实施例中,将药物组合物在施用场所配制,例如由医疗保健专业人员配制。在一些实施例中,药物组合物包含所期望的浓度的指环载体基因组或基因组当量(例如,由每体积的基因组数量来定义)。
21、在一方面,本发明的特征在于治疗受试者中疾病或障碍的方法,该方法包括向该受试者施用指环载体,例如,合成指环载体,例如,如本文所述的。
22、在一方面,本发明的特征在于将效应物或有效载荷(例如,内源性或外源性效应物)递送至细胞、组织或受试者的方法,该方法包括向该受试者施用指环载体,例如合成指环载体,例如,如本文所述的,其中该指环载体包含编码该效应物的核酸序列。在实施例中,有效载荷是核酸。在实施例中,有效载荷是多肽。
23、在一方面,本发明的特征在于将指环载体递送至细胞的方法,该方法包括使该指环载体(例如合成指环载体,例如,如本文所述)与细胞(例如真核细胞,如哺乳动物细胞)进行接触,例如,在体内或离体条件下进行接触。
24、在一方面,本发明的特征在于制备指环载体的方法,该指环载体是例如可用于本文所述的施用指环载体的方法的合成指环载体。该方法包括:
25、(a)提供宿主细胞,其包含:
26、(i)第一核酸分子,其包含指环载体,例如如本文所述的指环载体的遗传元件的核酸序列;和
27、(ii)第二核酸分子,其编码指环病毒orf1多肽,或者选自orf1、orf2、orf2/2、orf2/3、orf1/1或orf1/2的氨基酸序列中的一种或多种,例如,如本文所述的,或与其具有至少70%(例如,至少70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%)序列同一性的氨基酸序列;以及
28、(b)在适于遗传元件的核酸序列复制(例如,滚环式复制)的条件下孵育宿主细胞,从而产生遗传元件;以及
29、任选地,(c)在适于将遗传元件包封在蛋白质外壳(例如,包含由第二核酸分子编码的多肽)中的条件下孵育宿主细胞。
30、在另一方面,本发明的特征在于生产指环载体组合物(例如,可用于本文所述的施用方法的指环载体组合物)的方法,该组合物包括(a)、(b)和(c)中的一项或多项(例如,全部):
31、a)提供宿主细胞,该宿主细胞包含,例如表达指环载体,例如合成指环载体,例如本文所述的合成指环载体的一种或多种组分(例如,所有组分);
32、b)在适合从该宿主细胞产生指环载体制剂的条件下培养该宿主细胞,其中该制剂的指环载体包含封装该遗传元件(例如,如本文所述)的蛋白质外壳(例如,包含指环载体orf1多肽),从而制备指环载体的制剂;以及
33、任选地,c)配制指环载体制剂,例如,作为适于向受试者施用的药物组合物。
34、例如,在该生产方法中提供的宿主细胞包含(a)核酸,该核酸包含编码本文所述的指环病毒orf1多肽的序列,其中该核酸是质粒、病毒核酸或基因组,或者整合到辅助细胞染色体中;以及(b)核酸构建体,该核酸构建体能够产生遗传元件(例如,该遗传元件包含遗传元件序列和/或遗传元件区域,例如,如本文所述),例如,其中该遗传元件包含(i)与编码效应物(例如,外源性效应物或内源性效应物)的核酸序列(例如,dna序列)可操作地连接的启动子元件和(i)结合(a)的多肽的蛋白结合序列(例如包装序列),其中该宿主细胞包括以顺式或以反式的(a)和(b)。在实施例中,(b)的遗传元件是环状单链dna。在一些实施例中,宿主细胞是生产细胞系。
35、在一些实施例中,将指环载体的组分在产生时引入宿主细胞中(例如,通过瞬时转染)。在一些实施例中,宿主细胞稳定表达指环载体的组分(例如,其中将编码指环载体组分的一种或多种核酸引入宿主细胞或其祖细胞中,例如,通过稳定转染)。
36、在一方面,本发明的特征在于一种生产指环载体组合物的方法,该方法包括:a)提供多个本文所述的指环载体,或本文所述的指环载体的制剂;以及b)将这些指环载体或其制剂配制成例如适合施用于受试者的药物组合物。
37、在一方面,本发明的特征在于制备包含指环载体的宿主细胞的方法,该宿主细胞是例如第一宿主细胞或生产细胞(例如,如pct/us19/65995的图12所示),例如第一宿主细胞群,该方法包括将能够产生遗传元件的核酸构建体(例如,如本文所述)引入宿主细胞中并在适于产生指环载体的条件下培养该宿主细胞。在实施例中,该方法进一步包括将辅助物,例如辅助病毒引入宿主细胞中。在实施例中,引入包括用指环载体对宿主细胞进行转染(例如,化学转染)或电穿孔。
38、在一方面,本发明的特征在于制备指环载体的方法,该方法包括提供包含指环载体(例如本文所述的指环载体)的宿主细胞,例如第一宿主细胞或生产细胞(例如,如pct/us19/65995的图12所示),并从该宿主细胞中纯化该指环载体。在一些实施例中,该方法进一步包括,在提供步骤之前,使宿主细胞与核酸构建体或指环载体,例如本文所述的核酸构建体或指环载体进行接触,并在适于产生指环载体的条件下孵育宿主细胞。在实施例中,宿主细胞是上述制备宿主细胞的方法中描述的第一宿主细胞或生产细胞。在实施例中,从宿主细胞中纯化指环载体包括裂解宿主细胞。
39、在一些实施例中,该方法进一步包括使由第一宿主细胞或生产细胞产生的指环载体与第二宿主细胞进行接触的第二步骤,该第二宿主细胞是例如允许细胞(例如,如pct/us19/65995的图12所示),例如,第二宿主细胞群。在一些实施例中,该方法进一步包括在适于产生指环载体的条件下孵育第二宿主细胞。在一些实施例中,该方法进一步包括从第二宿主细胞中纯化指环载体,例如,从而产生指环载体种子群。在实施例中,从第二宿主细胞群中产生的指环载体比从第一宿主细胞群中产生的指环载体多出至少约2-100倍。在实施例中,从第二宿主细胞中纯化指环载体包括裂解第二宿主细胞。在一些实施例中,该方法进一步包括使由第二宿主细胞产生的指环载体与第三宿主细胞进行接触的第三步骤,该第三宿主细胞是例如允许细胞(例如,如pct/us19/65995的图12所示),例如,第三宿主细胞群。在一些实施例中,该方法进一步包括在适于产生指环载体的条件下孵育第三宿主细胞。在一些实施例中,该方法进一步包括从第三宿主细胞中纯化指环载体,例如,从而产生指环载体储备群。在实施例中,从第三宿主细胞中纯化指环载体包括裂解第三宿主细胞。在实施例中,从第三宿主细胞群中产生的指环载体比从第二宿主细胞群中产生的指环载体多出至少约2-100倍。
40、在一些实施例中,宿主细胞在适合促进细胞生长的培养基中生长。在某些实施例中,一旦宿主细胞已经充分生长(例如,达到适当的细胞密度),就可以将培养基更换为适于宿主细胞产生指环载体的培养基。在一些实施例中,在与第二宿主细胞接触之前,将由宿主细胞产生的指环载体从宿主细胞中分离出来(例如,通过裂解宿主细胞)。在一些实施例中,使由宿主细胞产生的指环载体与第二宿主细胞进行接触,而无需中间的纯化步骤。
41、在一方面,本发明的特征在于制备药物指环载体制剂(例如,要被用于本文所述的施用方法的制剂)的方法。该方法包括(a)制备如本文所述的指环载体制剂,(b)针对以下一种或多种药物质量控制参数评估该制剂(例如,药物指环载体制剂、指环载体种子群体或指环载体储备物群体):同一性、纯度、滴度、效力(例如,以每个指环载体颗粒的基因组当量)和/或例如来自指环载体所包含的遗传元件的核酸序列,和(c)配制用于评估的药物用途的制剂满足预定标准,例如,满足药物规范。在一些实施例中,评价鉴别包括评价(例如,确认)指环载体遗传元件的序列,例如,编码效应物的序列。在一些实施例中,评价纯度包括评价杂质的量,例如,支原体、内毒素、宿主细胞核酸(例如,宿主细胞dna和/或宿主细胞rna)、动物源性的工艺杂质(例如,血清白蛋白或胰蛋白酶)、可复制型因子(rca),例如可复制型病毒或不必要的指环载体(例如,除了所期望的指环载体,例如本文所述合成指环载体之外的指环载体)、游离病毒衣壳蛋白、外源因子和聚集体。在一些实施例中,评价效价包括评价制剂中功能性与非功能性(例如,感染性与非感染性)指环载体的比率(例如,通过hplc进行评价)。在一些实施例中,评价效力包括评价制剂中可检测到的指环载体功能(例如,其中编码的效应物或基因组当量的表达和/或功能)水平。
42、在实施例中,配制的制剂基本上不含病原体、宿主细胞污染物或杂质;具有预定水平的非感染性颗粒或预定比率的颗粒:感染单位(例如,<300:1、<200:1、<100:1或<50:1)。在一些实施例中,可以在单个批次中产生多种指环载体。在实施例中,可以评价在该批次中产生的指环载体的水平(例如,单独或一起评价)。
43、在一方面,本发明的特征在于宿主细胞,其包含:
44、(i)第一核酸分子,其包含如本文所述的核酸构建体,和
45、(ii)任选地,第二核酸分子,其编码选自orf1、orf2、orf2/2、orf2/3、orf1/1或orf1/2的氨基酸序列中的一种或多种,例如,如本文所述的,或与其具有至少约70%(例如,至少约70%、80%、90%、95%、96%、97%、98%、99%或100%)序列同一性的氨基酸序列。
46、在一方面,本发明的特征在于一种反应混合物,其包含本文所述的指环载体和可用于本文所述施用方法的辅助病毒,其中该辅助病毒包含编码外壳蛋白的多核苷酸(例如,能够结合外壳蛋白结合序列和任选的脂质包膜的外壳蛋白),编码复制蛋白(例如聚合酶)的多核苷酸或其任何组合。
47、在一些实施例中,指环载体(例如,合成指环载体)是分离出来的,例如,从宿主细胞中分离出来和/或从溶液的其他成分(例如,上清液)中分离出来。在一些实施例中,指环载体(例如,合成指环载体)是经纯化的,例如,从溶液(例如,上清液)中纯化。在一些实施例中,相对于溶液中的其他成分,指环载体在溶液中是经富集的。
48、在任何前述指环载体、组合物或方法的一些实施例中,提供指环载体包括从组合物中分离(例如,收获)指环载体,该组合物包含指环载体产生细胞,例如,如本文所述的。在其他实施例中,提供指环载体包括获得指环载体或其制剂,例如,从第三方获得。
49、在实施例中,遗传元件不能进行自我复制和/或自我扩增。在实施例中,遗传元件能够以反式进行复制和/或被扩增,例如,在辅助物存在的情况下,如在辅助病毒存在的情况下。
50、任何前述指环载体、组合物或方法的其他特征包括以下列举的实施例中的一个或多个。
51、本领域技术人员将会认识到,或者仅使用常规实验就能够确定本文所述本发明的具体实施例的许多等同形式。这样的等同形式意在由以下列举的实施例所涵盖。
52、列举的实施例
53、1.一种包含环状dna的病毒颗粒,该环状dna包含(i)aav复制起点,(ii)与编码治疗性rna或多肽的序列可操作地连接的启动子,以及(iii)结合指环病毒orf1分子的序列,该环状dna被包含指环病毒orf1分子的衣壳包裹。
54、2.一种包含环状dna的病毒颗粒,该环状dna包含(i)aav复制起点,以及(ii)与编码治疗性rna或多肽的序列可操作地连接的启动子,其中该环状dna被包含指环病毒orf1分子的衣壳包裹。
55、3.一种载体,其包含:
56、a)包含指环病毒orf1分子的蛋白质外壳;以及
57、b)包含非指环病毒复制起点的遗传元件;
58、任选地,其中该遗传元件进一步包含:(i)编码外源性效应物的核酸序列,和/或(ii)与编码该外源性效应物的该核酸序列可操作地连接的启动子元件。
59、4.如实施例3所述的载体,其中该非指环病毒复制起点衍生自dna病毒,例如单链dna(ssdna)病毒,例如线性ssdna病毒。
60、5.如实施例3或4所述的载体,其中该非指环病毒复制起点衍生自单dna病毒,例如,称德病毒(例如,单环编码病毒门[例如,雷东多病毒、圆环病毒{例如,猪圆环病毒,例如,pcv-1或pcv-2;或者喙羽症病毒}、双生病毒{例如,番茄金花叶病毒}或矮缩病毒{例如,bbtv、mdv1、scsvf或fbnyv}]),或者细小病毒(例如,依赖性细小病毒,例如博卡病毒或aav)。
61、6.如实施例5所述的载体,其中该非指环病毒复制起点衍生自单dna病毒,例如称德病毒,例如单环编码病毒门,例如第五病毒纲(quintoviricetes),例如小病毒目(piccovirales),例如细小病毒科(parvoviridae),例如细小病毒亚科(parvovirinae),例如依赖性细小病毒属(dependoparvovirus),例如腺相关病毒(aav)。
62、7.如实施例5所述的载体,其中该非指环病毒复制起点是aav(例如,aav1、aav2或aav5)复制起点。
63、8.如实施例5所述的载体,其中该非指环病毒复制起点衍生自通过滚环式复制进行复制的病毒。
64、9.如实施例5所述的载体,其中该非指环病毒复制起点衍生自通过滚卡复制进行复制的病毒。
65、10.如实施例5所述的载体,其中该非指环病毒复制起点衍生自感染动物(例如,哺乳动物,例如人)、植物、真菌或细菌的病毒。
66、11.如前述实施例中任一项所述的载体,其中该非指环病毒复制起点包含aavrep-结合基序(rbm)或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%或99%序列同一性的序列。
67、12.如前述实施例中任一项所述的载体,其中该非指环病毒复制起点包含aav末端解离位点(trs),或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%或99%序列同一性的序列。
68、13.如前述实施例中任一项所述的载体,其中该非指环病毒复制起点包含反向末端重复(itr)。
69、14.如前述实施例中任一项所述的载体,其中该非指环病毒复制起点不包含指环病毒复制起点,或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%或99%序列同一性的核酸序列。
70、15.如前述实施例中任一项所述的载体,其中该非指环病毒复制起点基本上不通过滚环式复制进行复制(例如,不能复制)。
71、16.如前述实施例中任一项所述的载体,其中该非指环病毒复制起点不包含来自指环病毒基因组(例如,如本文所述)的至少10、20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190或200个核苷酸的连续序列。
72、17.一种遗传元件,其包含:
73、特异性结合指环病毒orf1分子的蛋白结合序列(例如,5’utr);和
74、aav复制起点,例如,包含在第一aav反向末端重复(itr)中;
75、任选地,编码外源性效应物(例如,治疗性外源性效应物)的核酸序列;以及
76、任选地,与编码该外源性效应物的该核酸序列可操作地连接的启动子元件。
77、18.一种遗传元件构建体,其包含:
78、特异性结合指环病毒orf1分子的蛋白结合序列(例如,5’utr);和
79、aav复制起点,例如,包含在第一aav反向末端重复(itr)中;
80、任选地,编码外源性效应物(例如,治疗性外源性效应物)的核酸序列;以及
81、任选地,与编码该外源性效应物的该核酸序列可操作地连接的启动子元件。
82、19.一种系统,其包含:
83、a)第一核酸,其中该第一核酸是遗传元件或遗传元件构建体,该第一核酸包含:
84、aav复制起点,例如,包含在第一aav反向末端重复(itr)中;
85、任选地,编码外源性效应物(例如,治疗性外源性效应物)的核酸序列;以及
86、任选地,与编码该外源性效应物的该核酸序列可操作地连接的启动子元件;
87、b)编码指环病毒orf1分子的第二核酸。
88、20.如实施例19所述的系统,其中该第一核酸进一步包含特异性结合指环病毒orf1分子的蛋白结合序列(例如,指环病毒的5’utr或gc富集区)。
89、21.如实施例19或20所述的系统,其进一步包含编码指环病毒orf2分子的核酸序列。
90、22.如实施例21所述的系统,其中该编码指环病毒orf2分子的核酸序列位于第三核酸上。
91、23.如实施例19-22中任一项所述的系统,其进一步包含编码aav rep2分子(例如,aav rep2多肽,例如,aav rep2蛋白)的核酸序列。
92、24.如实施例23所述的系统,其中该编码aav rep2分子的核酸序列位于第四核酸上。
93、25.如实施例19-24中任一项所述的系统,其进一步包含编码腺病毒e2a分子、腺病毒e4分子和腺病毒varna分子中的一种或多种(例如,全部)的一种或多种核酸序列。
94、26.如实施例25所述的系统,其中该编码腺病毒e2a分子、腺病毒e4分子和腺病毒varna分子的核酸序列位于第五核酸上。
95、27.如实施例19-26中任一项所述的系统,其中该第一、第二、第三、第四和第五核酸中的一个或多个(例如,全部)是质粒。
96、28.如实施例19-27中任一项所述的系统,其中该核酸是混合的或在分开的体积中。
97、29.如实施例19-28中任一项所述的系统,其中该核酸在细胞,例如人细胞,例如293细胞或molt4细胞中。
98、30.一种dna酶保护的蛋白质复合物,其包含:
99、a)包含指环病毒orf1分子的蛋白质外壳;以及
100、b)包含aav复制起点(例如,包含在第一aav反向末端重复(itr)中)的遗传元件;
101、任选地,其中该遗传元件进一步包含:(i)编码外源性效应物的核酸序列,和/或(ii)与编码该外源性效应物的该核酸序列可操作地连接的启动子元件。
102、31.如实施例30所述的dna酶保护的蛋白质复合物,其中:
103、该遗传元件基本上不含指环病毒序列,
104、该遗传元件不包含超过100个与野生型指环病毒基因组的任何100个核苷酸序列具有超过50%的同一性的核苷酸,或
105、该遗传元件不包含指环病毒5’utr。
106、32.一种dna酶保护的蛋白质复合物,其包含:
107、a)包含指环病毒orf1分子的蛋白质外壳;以及
108、b)遗传元件;
109、其中:
110、该遗传元件基本上不含指环病毒序列,
111、该遗传元件不包含超过10、20、30、40、50、60、70、80、90或100个与野生型指环病毒基因组的相同长度的任何序列具有超过50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%同一性的连续核苷酸,和/或
112、该遗传元件不包含指环病毒5’utr;
113、任选地,其中该遗传元件进一步包含:(i)编码外源性效应物的核酸序列,和/或(ii)与编码该外源性效应物的该核酸序列可操作地连接的启动子元件。
114、33.如实施例32所述的dna酶保护的蛋白质复合物,其中该遗传元件进一步包含(iii)第一itr,例如第一aav itr。
115、34.一种混合物,其包含:
116、指环病毒orf1分子,和
117、包含aav复制起点(例如,包含在第一aav反向末端重复(itr)中)的核酸。
118、35.一种混合物,其包含:
119、指环病毒orf1分子,和
120、核酸(例如,遗传元件);
121、其中:
122、该核酸基本上不含指环病毒序列,
123、该核酸不包含超过100个与野生型指环病毒基因组的任何100个核苷酸序列具有超过50%的同一性的核苷酸,或
124、该核酸不包含指环病毒5’utr;
125、36.如实施例34或35所述的混合物,其中该指环病毒orf1分子与包含第一aav itr的核酸结合。
126、37.如实施例34-36中任一项所述的混合物,其中包含第一aav复制起点的核酸是遗传元件,例如根据前述实施例中任一项所述的遗传元件。
127、38.一种复合物,其包含:
128、前述实施例中任一项所述的遗传元件,和
129、与该遗传元件结合的衣壳蛋白(例如orf1分子)。
130、39.如实施例34-38中任一项所述的混合物或复合物,其在无细胞系统或基本上无细胞的组合物中。
131、40.如实施例38或39所述的复合物,其中该复合物在细胞(例如,宿主细胞,例如辅助细胞)中。
132、41.一种细胞,其包含如前述实施例中任一项所述的遗传元件或遗传元件构建体。
133、42.如实施例41所述的细胞,其是人细胞,例如293细胞、expi293细胞、expi293f细胞或molt-4细胞。
134、43.一种将外源性效应物递送至靶细胞(例如脊椎动物细胞,例如哺乳动物细胞,例如人细胞)的方法,该方法包括将如前述实施例中任一项所述的载体引入该细胞中。
135、44.一种在有需要的受试者中调节生物活性的方法,该方法包括向该受试者中引入如前述实施例中任一项所述的载体。
136、45.一种在有需要的受试者中治疗或预防疾病或障碍的方法,该方法包括向该受试者中引入如前述实施例中任一项所述的载体。
137、46.一种对有需要的受试者接种疫苗的方法,该方法包括向该受试者中引入如前述实施例中任一项所述的载体,其中该外源性效应物包含来自感染原(例如,病毒或细菌)的抗原。
138、47.如实施例43-46中任一项所述的方法,其中该靶细胞是人细胞,例如,293细胞、expi293细胞、expi293f细胞或molt-4细胞。
139、48.如实施例43-46中任一项所述的方法,其中该靶细胞是来自动物(例如农业动物,例如牛、绵羊、猪、山羊、马、野牛或骆驼)的细胞。
140、49.如实施例48所述的方法,其中该动物是鸟类动物(例如,火鸡、鸡、鹌鹑、鸸鹋或鸵鸟)。
141、50.如实施例43-49中任一项所述的方法,其中该靶细胞是在体内或体外。
142、51.如实施例43-50中任一项所述的方法,其中该载体在体外、离体或体内与细胞接触。
143、52.如前述实施例中任一项所述的载体,其中该遗传元件基本上被保护免受dna酶i的酶切。
144、53.如前述实施例中任一项所述的载体,其中如果该外源性效应物用mkate替代,则该载体可在体外将mkate递送至多个靶细胞(例如,molt4细胞)中,导致至少约10%、20%、30%、40%、50%或60%的与该载体接触的细胞具有高于背景水平的荧光,其中该背景水平是与缺乏orf1的其它类似载体接触的所有细胞中荧光最强的1%、2%、3%、4%、5%、6%、7%、8%、9%或10%的细胞的水平,例如,在实例5的流式细胞术测定中。
145、54.如前述实施例中任一项所述的载体,其中如果该外源性效应物用纳米荧光素酶替代,则该载体可在体外将纳米荧光素酶递送至多个靶细胞(例如,vero细胞或mcf7细胞)中,导致与该载体接触的细胞群显示出至少约2、3、4、5、6、7、8、9、10或15倍背景水平的发光,其中该背景水平是未与该载体接触的其他类似细胞的发光,例如,在实例4或8的发光测定中。
146、55.如前述实施例中任一项所述的载体,其以约1.2-1.4g/ml的密度沉积在cscl梯度上,例如根据实例5。
147、56.一种制备载体的方法,该方法包括:
148、(a)提供包含如前述实施例中任一项所述的遗传元件的宿主细胞,以及
149、(b)在适合将该遗传元件包封在蛋白质外壳(例如,包含指环病毒orf1分子的蛋白质外壳)的条件下孵育该宿主细胞,
150、从而制备该载体。
151、57.一种制备载体的方法,该方法包括:
152、(a)提供包含如前述实施例中任一项所述的系统的宿主细胞,以及
153、(b)在适合将该遗传元件包封在蛋白质外壳(例如,包含指环病毒orf1分子的蛋白质外壳)的条件下孵育该宿主细胞,
154、从而制备该载体。
155、58.如实施例56或57所述的方法,其包括宿主细胞的裂解。
156、59.如实施例56-58中任一项所述的方法,其包括从该宿主细胞的上清液收获该载体。
157、60.如实施例56-59中任一项所述的方法,其该宿主细胞进一步包含编码指环病毒orf2分子、aav rep2分子、腺病毒e2a分子、腺病毒e4分子和腺病毒varna分子中的一种或多种(例如,全部)的一种或多种另外的核酸。
158、61.一种制备治疗性组合物的方法,该方法包括:
159、(a)提供一种或多种包含外源性dna的宿主细胞,该外源性dna包含:
160、(i)aav复制起点,
161、(ii)与编码治疗性效应物(例如,治疗性rna或多肽)的序列可操作地连接的启动子,
162、(iii)任选地编码指环病毒orf1分子的序列,
163、(iv)任选地编码指环病毒orf2分子的序列,
164、(v)任选地编码rep蛋白(例如,aav rep蛋白,例如aav rep2蛋白)的序列,以及
165、(vi)任选地编码一种或多种辅助蛋白例如腺病毒辅助蛋白,例如e2a分子、腺病毒e4分子和/或腺病毒varna分子的序列;
166、(b)在适合于形成载体(例如,指环载体,例如病毒颗粒)的条件下培养该一种或多种宿主细胞,该载体包含蛋白质外壳(例如,衣壳),该蛋白质外壳包含足够数量的orf1分子以包封(例如,包裹)遗传元件,该遗传元件包含与编码治疗性效应物的序列可操作地连接的启动子;任选地,其中遗传元件是环状的或线性的;
167、(c)从细胞培养物中富集,例如纯化步骤(b)中产生的载体,
168、从而制备治疗性组合物。
169、62.如实施例61所述的方法,该方法进一步包括:
170、(d)评价纯化的病毒颗粒的一种或多种选自以下的杂质:内毒素、支原体、宿主细胞核酸(例如,宿主细胞dna和/或宿主细胞rna)、动物衍生的加工杂质(例如,血清白蛋白或胰蛋白酶)、可复制型颗粒、游离病毒衣壳蛋白、外源因子和聚集体;
171、(e)如果在步骤(d)中检测到,则任选地从这些病毒颗粒中减少或去除该一种或多种杂质;以及
172、(f)任选地配制用于施用于人的纯化病毒颗粒,从而制备治疗性组合物。
173、63.如实施例61或62所述的方法,其中(a)(i)-(vi)所述的外源性dna在一种宿主细胞中提供。
174、64.如实施例61-63中任一项所述的方法,其中(a)(i)-(vi)所述的外源性dna在多种宿主细胞中提供。
175、65.如实施例61-64中任一项所述的方法,其中(a)(i)和(ii)所述的外源性dna在一种宿主细胞中提供,并且(a)(iii)-(vi)所述的外源性dna在第二宿主细胞中提供。
176、66.如实施例61-65中任一项所述的方法,其中(a)(i)-(ii)所述的外源性dna不是宿主细胞染色体的一部分。
177、67.如实施例61-66中任一项所述的方法,其中(a)(i)-(ii)所述的外源性dna是相同核酸的一部分,例如环状dna或线性dna。
178、68.如实施例61-67中任一项所述的方法,其中(a)(i)-(ii)所述的外源性dna是根据前述实施例中任一项所述的遗传元件。
179、69.如实施例61-68中任一项所述的方法,其中将(a)(iii)所述的一种或多种外源性dna整合到宿主细胞染色体中。
180、70.如实施例61-69中任一项所述的方法,其中(a)(iv)-(vi)中任一项所述的一种或多种外源性dna,如果存在,则被整合到宿主细胞染色体中。
181、71.如实施例61-70中任一项所述的方法,其中(a)(iii)所述的一种或多种外源性dna是质粒的一部分。
182、72.如实施例61-71中任一项所述的方法,其中(a)(iv)-(vi)中任一项所述的一种或多种外源性dna,如果存在,则是质粒的一部分。
183、73.如实施例61-72中任一项所述的方法,其中该宿主细胞是哺乳动物细胞(例如,人细胞,例如hek293细胞)。
184、74.如实施例61-73中任一项所述的方法,其中该宿主细胞是永生化细胞。
185、75.一种制备治疗性组合物的方法,该方法包括:
186、(a)提供包含以下的溶液:
187、(i)包含aav复制起点和启动子的遗传元件,该启动子与编码治疗性效应物(例如,治疗性rna或多肽)的序列可操作地连接,以及
188、(ii)多个orf1分子(例如,同一orf1分子的多个拷贝);
189、(b)在适于形成包含蛋白质外壳(例如,衣壳)的载体(例如,指环载体,例如病毒颗粒)的条件下孵育该溶液,该蛋白质外壳包含足够数量的orf1分子以包封(例如,包裹)遗传元件;以及
190、(c)任选地从该溶液中富集,例如纯化步骤(b)中产生的载体,从而制备治疗性组合物。
191、76.如实施例75所述的方法,其中该遗传元件使用以下制备:
192、(iii)任选地编码指环病毒orf1分子的序列,
193、(iv)任选地编码指环病毒orf2分子的序列,
194、(v)任选地编码aav rep2序列的序列
195、(vi)任选地编码一种或多种辅助蛋白例如腺病毒辅助蛋白,例如e2a分子、腺病毒e4分子和/或腺病毒varna分子的序列。
196、77.如实施例61-76中任一项所述的方法,其中步骤(b)中产生的载体是前述实施例中任一项所述的载体。
197、78.一种宿主细胞(例如脊椎动物细胞,例如哺乳动物细胞,例如人细胞),其包含如前述实施例中任一项所述的遗传元件或遗传元件构建体。
198、79.如实施例78所述的宿主细胞,其进一步包含指环病毒orf1分子或编码该指环病毒orf1分子的核酸。
199、80.如实施例78或79所述的宿主细胞,其进一步包含指环病毒orf2分子、aav rep2分子、腺病毒e2a分子、腺病毒e4分子和腺病毒varna分子中的一种或多种(例如,全部)。
200、81.如实施例78-80中任一项所述的宿主细胞,其进一步包含编码指环病毒orf2分子、aav rep2分子、腺病毒e2a分子、腺病毒e4分子和腺病毒varna分子中的一种或多种(例如,全部)的一种或多种核酸。
201、82.一种宿主细胞,其包含如前述实施例中任一项所述的载体。
202、83.一种制备如实施例78-82中任一项所述的宿主细胞的方法,该方法包括将遗传元件引入细胞中,例如,其中引入该遗传元件包括在允许产生该遗传元件的条件下将遗传元件构建体引入该细胞中。
203、84.如前述实施例中任一项所述的遗传元件、遗传元件构建体、系统、细胞、方法或载体,其中该遗传元件进一步包含第二aav复制起点,例如,包含在第二aav反向末端重复(itr)中。
204、85.如实施例84所述的遗传元件、遗传元件构建体、系统、细胞、方法或载体,其中该第二itr与该第一itr具有相反取向。
205、86.如实施例84所述的遗传元件、遗传元件构建体、系统、细胞、方法或载体,其中该第二itr相对于该第一itr具有相同取向。
206、87.如实施例84-86中任一项所述的遗传元件、遗传元件构建体、系统、细胞、方法或载体,其中该第二itr具有与该第一itr相同的序列。
207、88.如实施例84-86中任一项所述的遗传元件、遗传元件构建体、系统、细胞、方法或载体,其中该第二itr相对于该第一itr具有一个或多个序列差异。
208、89.如实施例84-88中任一项所述的遗传元件、遗传元件构建体、系统、细胞、方法或载体,其中编码该外源性效应物的核酸序列位于该第一itr和该第二itr之间。
209、90.如前述实施例中任一项所述的遗传元件、遗传元件构建体、系统、细胞、方法或载体,其中该第一aav itr包含seq id no:1051-1059中任一个的序列,或与其具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%序列同一性的序列。
210、91.如前述实施例中任一项所述的遗传元件、遗传元件构建体、系统、细胞、方法或载体,其中该遗传元件是线性的。
211、92.如前述实施例中任一项所述的遗传元件、遗传元件构建体、系统、细胞、方法或载体,其中该遗传元件是环状的。
212、93.如前述实施例中任一项所述的遗传元件、遗传元件构建体、系统、细胞、方法或载体,其中该遗传元件构建体是环状的。
213、94.如前述实施例中任一项所述的遗传元件、遗传元件构建体、系统、细胞、方法或载体,其中该遗传元件构建体是线性的。
214、95.如前述实施例中任一项所述的遗传元件、遗传元件构建体、系统、细胞、方法或载体,其中该遗传元件具有约500-1000、1000-1500、1500-2000、2000-2500、2500-3000、3000-3500、3500-4000、4000-4100、4100-4200、4200-4300、4300-4400、4400-4500、4500-4600、4600-4700、4700-4800、4800-4900、4900-5000、5000-5500、5500-6000或6000-7000个核苷酸长度。
215、96.如前述实施例中任一项所述的遗传元件、遗传元件构建体、系统、细胞、方法或载体,其中该遗传元件具有至少500、1000、1500、2000、2500、3000、3500、4000、4100、4200、4300、4400、4500、4600、4700、4800、4900、5000、5100、5200、5300、5400、5500或6000个核苷酸长度。
216、97.如前述实施例中任一项所述的遗传元件、遗传元件构建体、系统、细胞、方法或载体,其中该遗传元件包含dna。
217、98.如前述实施例中任一项所述的遗传元件、遗传元件构建体、系统、细胞、方法或载体,其中该遗传元件由dna组成。
218、99.如前述实施例中任一项所述的遗传元件、遗传元件构建体、系统、细胞、方法或载体,其中该遗传元件由至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%的dna组成。
219、100.如前述实施例中任一项所述的遗传元件、遗传元件构建体、系统、细胞、方法或载体,其中该遗传元件是单链dna或双链dna。
220、101.如前述实施例中任一项所述的遗传元件、遗传元件构建体、系统、细胞、方法或载体,其中该遗传元件构建体是单链dna或双链dna。
221、102.如前述实施例中任一项所述的遗传元件,其使用环化的双链dna产生,例如,其中该环化的dna通过体外环化产生。
222、103.如前述实施例中任一项所述的遗传元件、遗传元件构建体、系统、细胞、方法或载体,其中该启动子元件对于指环病毒而言是内源的。
223、104.如前述实施例中任一项所述的遗传元件、遗传元件构建体、系统、细胞、方法或载体,其中该启动子元件对于aav而言是内源的。
224、105.如前述实施例中任一项所述的遗传元件、遗传元件构建体、系统、细胞、方法或载体,其中该启动子元件对于指环病毒而言是外源的。
225、106.如前述实施例中任一项所述的遗传元件、遗传元件构建体、系统、细胞、方法或载体,其中该启动子元件对于aav而言是外源的。
226、107.如前述实施例中任一项所述的遗传元件构建体,其包含适于该遗传元件构建体复制(例如,适于在细菌细胞中复制)的骨架区。
227、108.如前述实施例中任一项所述的遗传元件构建体,其中该骨架区包含复制起点和选择性标志之一或二者。
228、109.如前述实施例中任一项所述的遗传元件、遗传元件构建体、系统、细胞、方法或载体,其中该遗传元件进一步包含指环病毒5’utr、指环病毒gc富集区和指环病毒3’utr或其任意组合。
229、110.如前述实施例中任一项所述的遗传元件、遗传元件构建体、系统、细胞、方法或载体,其中该遗传元件进一步包含表a1、b1、b3、c1、e1、f1、f3或f5中任一项所述的指环病毒5’utr。
230、111.如前述实施例中任一项所述的遗传元件、遗传元件构建体、系统、细胞、方法或载体,其中该遗传元件进一步包含表a1、b1、b3、c1、e1、f1、f3或f5中任一项所述的指环病毒gc富集区。
231、112.如前述实施例中任一项所述的遗传元件、遗传元件构建体、系统、细胞、方法或载体,其中该遗传元件进一步包含表a1、b1、b3、c1、e1、f1、f3或f5中任一项所述的指环病毒3’utr。
232、113.如前述实施例中任一项所述的遗传元件、遗传元件构建体、系统、细胞、方法或载体,其中编码外源性效应物的核酸序列为约20-50、50-100、100-200、200-300、300-400、400-500、500-600、600-700、700-800、800-900或900-1,000个核苷酸长度。
233、114.如前述实施例中任一项所述的遗传元件、遗传元件构建体、载体、混合物、复合物、方法或宿主细胞,其中该效应物包含mirna。
234、115.如前述实施例中任一项所述的遗传元件、遗传元件构建体、载体、混合物、复合物、方法或宿主细胞,其中该效应物例如mirna靶向宿主基因,例如调节该基因的表达,例如增加或减少该基因的表达。
235、116.如前述实施例中任一项所述的遗传元件、遗传元件构建体、载体、混合物、复合物、方法或宿主细胞,其中该效应物包含mirna,并且减少宿主基因的表达。
236、117.如前述实施例中任一项所述的遗传元件、核酸构建体、ca载体、复合物、方法或宿主细胞,其中该效应物包含长度为约20-200、30-180、40-160、50-140或60-120个核苷酸的核酸序列。
237、118.如前述实施例中任一项所述的遗传元件、遗传元件构建体、载体、混合物、复合物、方法或宿主细胞,其中编码该效应物的核酸序列的长度为约20-200、30-180、40-160、50-140或60-120个核苷酸。
238、119.如前述实施例中任一项所述的遗传元件、遗传元件构建体、载体、混合物、复合物、方法或宿主细胞,其中编码该效应物的序列大小为至少约100个核苷酸。
239、120.如前述实施例中任一项所述的遗传元件、遗传元件构建体、载体、混合物、复合物、方法或宿主细胞,其中编码该效应物的序列的大小为约100至约5000个核苷酸。
240、121.如前述实施例中任一项所述的遗传元件、遗传元件构建体、载体、混合物、复合物、方法或宿主细胞,其中编码该效应物的序列的大小为约100-200、200-300、300-400、400-500、500-600、600-700、700-800、800-900、900-1000、1000-1500或1500-2000个核苷酸。
241、122.如前述实施例中任一项所述的遗传元件、遗传元件构建体、载体、混合物、复合物、方法或宿主细胞,其中该遗传元件是dna。
242、123.如前述实施例中任一项所述的遗传元件、遗传元件构建体、载体、混合物、复合物、方法或宿主细胞,其中该载体是复制缺陷型的。
243、124.如前述实施例中任一项所述的遗传元件、遗传元件构建体、载体、混合物、复合物、方法或宿主细胞,其中:
244、(i)该遗传元件基本上不含指环病毒序列,
245、(ii)该遗传元件不包含超过10、20、30、40、50、60、70、80、90或100个与野生型指环病毒基因组的相同长度的任何序列具有超过50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%同一性的连续核苷酸,和/或
246、(iii)该遗传元件不包含指环病毒5’utr;
247、125.如前述实施例中任一项所述的遗传元件、遗传元件构建体、载体、混合物、复合物、方法或宿主细胞,其中该载体是病毒颗粒。
248、126.一种药物组合物,其包括如前述实施例中任一项所述的载体,以及药学上可接受的载剂和/或赋形剂。
249、根据说明书和附图并且根据权利要求,本发明的其他特征、目的和优点将是显而易见的。
250、除非另外定义,否则本文所用的所有技术和科学术语均具有与本发明所属领域的普通技术人员通常所理解的相同含义。本文提及的所有出版物、专利申请、专利和其他参考文献均通过引用以其全文并入。另外,材料、方法和实例仅是说明性的,而并非意在进行限制。
- 还没有人留言评论。精彩留言会获得点赞!