一种新冠病毒、流感病毒和/或RSV的联合疫苗、其制备方法与应用与流程
本发明属于生物医药领域,具体涉及预防新型冠状病毒、流感病毒和rsv感染的新冠病毒、流感病毒和rsv的联合疫苗、其制备方法与应用。
背景技术:
1、无论是下呼吸道感染还是上呼吸道感染,绝大部分是由病毒引起的,称病毒性呼吸道感染,常见的病毒包括新型冠状病毒(sars-cov-2)、流感病毒和rsv。
2、新型冠状病毒(sars-cov-2,或者简称为新冠病毒)是一种单股正链的rna病毒,基因组约为30kb,由内部的遗传物质rna以及刺突蛋白(spike protein,s蛋白)、包膜蛋白(envelop protein,e蛋白)、膜蛋白(membrane protein,m蛋白)和核衣壳蛋白(nucleoprotein,n蛋白)等构成。其中刺突蛋白(s蛋白)是形成病毒“冠状”形态的主要蛋白之一,介导sars-cov-2进入细胞,其在病毒粒子表面形成较大的皇冠状突起,高度糖基化,是病毒感染宿主细胞的武器。冠状病毒宿主特异性的重要决定因素就是位于囊膜表面的三聚体刺突糖蛋白。s蛋白可分为n端的s1亚单位和靠近病毒膜的c端s2区,跨膜区和一段小的胞内区。sars-cov-2的受体结合区(receptor binding domain,rbd)位于s1的c端,约有240个氨基酸残基,可以与哺乳动物细胞上的受体ace2(血管紧张素转换酶2,angiotensinconverting enzyme 2)结合,并介导sars-cov-2病毒进入细胞,病毒进入细胞后,不断增殖的sars-cov-2病毒颗粒通过胞吐作用进入细胞外液中,进而感染其他宿主细胞。
3、流感病毒(influenza virus)是流行性感冒病毒的简称。属于正黏液病毒科,为单链rna膜病毒,其rna含有八个片断。流感病毒的基因结构使其有不断交换基因片断进而形成优势变异的条件。根据核蛋白和膜表面蛋白抗原,它分为甲(a)、乙(b)、丙(c)和丁(d)型,流感病毒的外层有两种不同糖蛋白构成辐射状突起,即血凝素(h)和神经氨酸酶(n)。流感病毒的抗原变异就是指h和n抗原结构的改变。其中人类主要以甲型和乙型感染为主,甲型流感病毒最容易发生变异,流感大流行就是甲型流感病毒出现新亚型或旧亚型重现引起的。甲型流感病毒根据h和n抗原不同,又分为许多亚型,h可分为18个亚型(h1~h18),n有11个亚型(n1~n11)。常见的乙型流感病毒包括by和bv。
4、rsv是呼吸道合胞病毒(respiratory syncytial virus,rsv)的简称,于1955年首次被发现,属于副黏病毒科(paramyxoviridae),肺炎病毒亚科(pneumovirinae),肺炎病毒属(pneumovirus),依据g蛋白的序列可分为a和b两个亚型。rsv为非节段性的负链rna病毒,其基因组长度为15.2kb,有10个基因,共编码11种蛋白,包括非结构蛋白(ns1,ns2)、核蛋白(n)、磷蛋白(p)、基质蛋白(m)、rna依赖rna聚合酶(l)、转录延伸因子(m2-1)、调控因子(m2-2)和3种包膜糖蛋白(黏附蛋白(g)、融合蛋白(f)和小疏水蛋白(sh))。
5、rsv是引起呼吸道感染(respiratory tract infection,rti)的病毒性病原体,感染主要引起下呼吸道感染症状,其中严重症状的患者占有相当高的比例(如毛细支气管炎和肺炎),需要住院治疗,具有较高的死亡率。rsv可以通过人与人之间接触传播,或者通过咳嗽或打喷嚏而吸入传播,也可通过接触污染物而获得感染,主要感染鼻腔以及肺部大、小气道的上皮细胞,也可能感染肺泡巨噬细胞和肺部其它类型的细胞,可引起细胞融合在一起形成合胞体。
6、根据现有的数据,新型冠状病毒、流感病毒和rsv的流行时间窗口有很大程度的重合。因而开发同时针对新型冠状病毒、流感病毒和rsv的联合疫苗将会在免疫接种方案和成本上提供极大的方便和优势。
7、然而,无论是sars-cov-2、流感病毒还是rsv,都是一种rna病毒,容易在复制过程中出错,大量复制可引起多种变异,并且变异速度极快,因此经常会因为突变而出现免疫逃逸的现象,导致疫苗的保护性下降。随着新冠病毒、流感病毒和rsv的不断进化,现有疫苗的保护效果受到不同程度的影响。因此,研究和开发更为有效的、针对各种突变毒株的通用型疫苗对于预防新型冠状病毒、流感病毒和rsv感染具有重要的意义和广泛的临床应用前景。
技术实现思路
1、为解决上述技术问题,本发明提供一种具有预防新型冠状病毒(sars-cov-2,或者简称为新冠病毒)、流感病毒和/或rsv感染,更为有效的、针对各种突变毒株的通用型疫苗,具体的,
2、本发明第一方面,提供一种联合疫苗,所述联合疫苗包括:i、包括来自sars-cov-2的融合蛋白的新冠疫苗原液;ii、包括来自流感病毒的血凝素的流感疫苗原液和iii、包括来自rsv的融合蛋白的rsv疫苗原液中的至少两种,其中,
3、i、所述来自sars-cov-2的融合蛋白包括sars-cov-2的刺突蛋白(s蛋白)rbd的突变蛋白,所述突变蛋白包括相对于野生型s蛋白rbd的突变,所述突变包括第28、99、126、128、134、142、166和/或168位中一个或者多个位点的突变;
4、ii、所述血凝素来自至少一种流感病毒亚型;
5、iii、所述来自rsv的融合蛋白包括pre-f蛋白的突变蛋白,所述突变蛋白包括相对于野生型pre-f蛋白的突变,所述突变包括第67、88、110、144、159、173、202、227、236、248、289、309、334、344、370、389、419和/或468位中一个或者多个位点的突变。
6、进一步的,所述组分i、ii、iii在下文进行更为详细的说明。
7、i、包括来自sars-cov-2的融合蛋白的新冠疫苗原液:
8、优选的,所述突变蛋白的突变包括取代、缺失和/或添加。
9、优选的,所述突变包括取代,更优选的,所述突变位点包括28、99、126、128、134、142、166和/或168位;
10、进一步优选的,所述突变蛋白包括选自下列残基取代的突变:r28t、k99n、k126t、g128s、l134r、n142k、e166a和/或f168v。
11、优选的,所述野生型s蛋白rbd参考序列如seq id no.13所示,可以理解的是,不同亚型或者不同株病毒的野生型s蛋白rbd氨基酸不一定相同,可能会有替换、插入或者删除的突变,上述参考序列如seq id no.13所示,但也可以是其它结构不同的野生型序列,其突变位点对应于seq id no.13的上述位点,所述对应理解为基于氨基酸结构和/或功能分析后的对应关系。
12、更优选的,所述s蛋白rbd的突变蛋白包括下述任一种:
13、a1-i)氨基酸序列是seq id no.1的蛋白质;
14、a2-i)将seq id no.1所示的氨基酸序列经过氨基酸残基的取代和/或缺失和/或添加得到的与a1-i)所示的蛋白质具有80%以上的同一性且具有相同功能的蛋白质,进一步优选的,所述氨基酸残基的取代和/或缺失和/或添加发生在第28、99、126、128、134、142、166和168位之外。
15、所述突变蛋白命名可为rbd8m蛋白。
16、本文所述取代可为保守性取代(也称为保守性替换)或非核心功能区的非保守性取代。本领域技术人员所公知,保守性取代或是在非核心功能区进行非保守取代,对蛋白质的功能通常不会产生质的影响。本文所述取代不包括本发明所述8个突变位点上的氨基酸残基的取代。
17、优选的,所述融合蛋白包括突变蛋白的n端和/或c端连接标签或信号肽。
18、本文所述连接标签包括但不限于:gst(谷胱甘肽巯基转移酶)标签蛋白、his标签蛋白(his-tag)、mbp(麦芽糖结合蛋白)标签蛋白、flag标签蛋白、gst标签蛋白、sumo标签蛋白、ha标签蛋白、myc标签蛋白、egfp(增强型绿色荧光蛋白)、ecfp(增强型青色荧光蛋白)、eyfp(增强型黄绿色荧光蛋白)、mcherry(单体红色荧光蛋白)或avitag标签蛋白。
19、优选的,所述来自sars-cov-2的融合蛋白还包括多聚体标签蛋白(或者称之为多聚体标签),所述多聚体标签蛋白使得突变蛋白与多聚体标签蛋白融合后形成多聚体。
20、所述多聚体优选为三聚体或二聚体。
21、所述三聚体标签蛋白可以使任意目的蛋白与三聚体标签蛋白融合后形成三聚体。
22、进一步地,所述三聚体标签蛋白可以使任意目的蛋白三聚体化,该目的蛋白与三聚体标签融合后形成的三聚体可以模拟其在体内生理状态发挥功能的结构,作为免疫原时针对这种三聚体结构产生的中和抗体更加有效。
23、进一步地,所述三聚体标签蛋白可为能够使本文任一所述突变蛋白或融合蛋白形成三聚体的任何多肽或蛋白质。
24、所述形成三聚体标签蛋白可为形成生物分子复合物,使三个相同的分子聚合成一个单一的三聚体。
25、所述三聚体标签蛋白包括但不限于t4噬菌体纤维蛋白(foldon)“折叠”三聚体结构域(t4foldon)、源自酵母转录激活因子gcn4的异亮氨酸拉链和卷曲螺旋三聚体结构域、前胶原c-前肽结构域(trimer-tag)、大肠杆菌天冬氨酸转氨甲酰酶(atcase)的催化亚基、胶原蛋白xv的三聚体结构域、胶原蛋白xviii的三聚体结构域、真核热休克转录因子的卷曲螺旋三聚体结构域等。
26、进一步地,所述三聚体标签蛋白具体可为t4噬菌体纤维蛋白(foldon)“折叠”三聚体结构域(t4foldon)。
27、进一步地,所述t4foldon的氨基酸序列可如seq id no.4的第252-277位所示,或者上述序列经过氨基酸残基的取代和/或缺失和/或添加得到的与seq id no.4的第252-277位所示的蛋白质具有80%以上的同一性且具有相同功能的蛋白质。
28、优选的,所述多聚体标签蛋白可直接或通过接头连接在所述突变蛋白的n端或c端。
29、进一步地,所述三聚体标签蛋白可直接或通过接头连接在所述rbd8m蛋白的n端或c端。
30、进一步地,所述三聚体标签蛋白可通过接头连接在所述rbd8m蛋白的c端。
31、进一步地,所述接头(linker)可为柔性肽接头,如包括甘氨酸和/或丝氨酸残基的肽接头。所述接头可为ggggs(seq id no.9)、gsgsgsg(seq id no.10)、ggggsggggs(seq idno.11)或gsgggsggggsggggs(seq id no.12)但不限于此。所述接头具体可为gsgsgsg(seqid no.10)。
32、优选的,所述融合蛋白从n端到c端依次包括信号肽、突变蛋白、接头、多聚体标签蛋白和连接标签。
33、进一步地,所述来自sars-cov-2的融合蛋白可包括下述任一种:
34、b1-i)氨基酸序列包括seq id no.4的第26-244位和第252-277位,或者包括seqid no.4的第26-277位的蛋白质;
35、b2-i)将b1-i)所示的氨基酸序列经过氨基酸残基的取代和/或缺失和/或添加得到的与b1-i)所示的蛋白质具有80%以上的同一性且具有相同功能的蛋白质;
36、b3-i)在b1-i)或b2-i)的n端和/或c端连接标签或信号肽得到的具有相同功能的融合蛋白质;
37、其中优选,b3-i)所述融合蛋白质可包括下述任一种:
38、c1-i)氨基酸序列包括seq id no.4的第1-277位的蛋白质或将seq id no.4的第1-277位所示的氨基酸序列经过氨基酸残基的取代和/或缺失和/或添加得到的与seq idno.4的第1-277位所示的蛋白质具有80%以上的同一性且具有相同功能的蛋白质;
39、c2-i)氨基酸序列包括seq id no.4的蛋白质或将seq id no.4所示的氨基酸序列经过氨基酸残基的取代和/或缺失和/或添加得到的与seq id no.4所示的蛋白质具有80%以上的同一性且具有相同功能的蛋白质。
40、b1-i)-b3-i)所述的融合蛋白命名可为rbd8m-t4foldon三聚体融合蛋白(简称rbd8m-t4foldon蛋白)。
41、seq id no.4的第26-277位所示的rbd8m-t4foldon蛋白是在seq id no.1所示的rbd8m蛋白(seq id no.4的第26-244位)的c端通过接头(gsgsgsg,seq id no.10)(seq idno.4的第245-251位)融合三聚体标签t4foldon(seq id no.4的第252-277位)得到的三聚体融合蛋白。
42、b3-i)中所述信号肽的氨基酸序列可为seq id no.4的第1-25位,所述信号肽的核苷酸序列可为seq id no.3的第1-75位。
43、seq id no.4的第1-277位所示的融合蛋白命名可为rbd8mfoldon蛋白,其是为了便于蛋白的分泌表达,在seq id no.4的第26-277位所示的rbd8m-t4foldon蛋白的n端融合了seq id no.4的第1-25位所示的信号肽得到的融合蛋白。
44、seq id no.4所示的融合蛋白命名可为rbd8mfoldon-his蛋白,其是为了便于蛋白的纯化和检测,在seq id no.4的第1-277位所示的rbd8mfoldon蛋白的c端融合了his标签(8-histag,hhhhhhhh,seq id no.8)得到的融合蛋白。其中,seq id no.4的第1-25位为信号肽的氨基酸序列(即seq id no.4的第1-25位),seq id no.4的第26-244位为rbd8m蛋白的氨基酸序列(即seq id no.1),seq id no.4的第245-251位为接头序列(即gsgsgsg,seqid no.10),seq id no.4的第252-277位为三聚体标签(t4foldon)的氨基酸序列(即seq idno.4的第252-277位),seq id no.4的第278-285位为his标签序列(8-histag,即seq idno.8)。
45、所述联合疫苗中,来自sars-cov-2的融合蛋白(rbd8m-t4foldon蛋白、rbd8mfoldon蛋白或rbd8mfoldon-his蛋白)的含量可为10-80μg/ml,可以是上述范围内的任一范围或者数值,例如具体可为10、12、15、18、20、25、30、35、40、42、45、48、50、55、60、65、68、72、76、80μg/ml,或者12-75、16-62、18-60、30-60μg/ml等等。
46、ii、包括来自流感病毒的血凝素的流感疫苗原液:
47、优选的,所述流感病毒至少包括一种或者多种流感病毒亚型,更优选的,所述流感病毒来自甲型、乙型、丙型和/或丁型流感病毒。
48、更优选的,所述流感病毒至少包括甲型流感病毒,例如h1n1、h3n2、h5n1、h7n1、h7n2、h7n3、h7n7、h7n9、h9n2和h10n8等等。
49、在一个具体的实施方式中,所述流感病毒至少包括h1n1和h3n2亚型;
50、更优选的,所述流感病毒包括甲型和乙型流感病毒。
51、在一个具体的实施方式中,所述流感病毒至少包括h1n1、h3n2亚型、乙型by和bv亚型。
52、所述联合疫苗中,所述每种流感病毒亚型的血凝素含量为15-50μg/ml,可以是上述范围内的任一范围或者数值,例如具体可为15、18、20、22、25、18、30、35、40、45、48、50μg/ml。
53、iii、包括来自rsv的融合蛋白的rsv疫苗原液:
54、所述来自rsv的融合蛋白包括pre-f蛋白的突变蛋白,所述突变蛋白包括相对于野生型pre-f蛋白的突变,所述突变包括第67、88、110、144、159、173、202、227、236、248、289、309、334、344、370、389、419和/或468位中一个或者多个位点的突变。
55、优选的,所述突变包括在第88位的突变,更优选的,所述突变包括在第88和289位的突变,或者包括在第88和389位的突变,进一步优选的,所述突变包括在第88、289、309和468位的突变;第67、88、144和389位的突变;或者在第67、88、110、144、289、309、389和468位的突变。
56、优选的,所述突变包括在第202和334位的突变,更优选的,所述突变包括在第202位、334和389位的突变,或者在第202位、289和334的突变;进一步优选的,所述突变包括在第159、202、248、334、344和389位,第67、110、144、202、227、248、334、344和389位,第159、202、289、334、344和468位,或者第67、110、144、159、202、236、248、289、309、334、370、389、419和468位的突变。
57、更为优选的,所述突变包括在143和144之间插入半胱氨酸。
58、优选的,所述突变包括替换、插入和/或缺失。优选的,所述突变包括替换,或者插入,更优选的,所述突变包括如下a1-iii)-a19-iii)中至少一种突变后得到的蛋白:
59、a1-iii)将pre-f蛋白氨基酸序列第67位的异亮氨酸突变为天冬酰胺;
60、a2-iii)将pre-f蛋白氨基酸序列第88位的丝氨酸突变为天冬酰胺;
61、a3-iii)将pre-f蛋白氨基酸序列第110位的半胱氨酸突变为丙氨酸;
62、a4-iii)将pre-f蛋白氨基酸序列第143位和第144位氨基酸之间插入;
63、a5-iii)将pre-f蛋白氨基酸序列在第144位天冬酰胺突变为半胱氨酸;
64、a6-iii)将pre-f蛋白氨基酸序列第159位的酪氨酸突变为半胱氨酸;
65、a7-iii)将pre-f蛋白氨基酸序列第173位的半胱氨酸缺失;
66、a8-iii)将pre-f蛋白氨基酸序列第202位的丙氨酸突变为半胱氨酸;
67、a9-iii)将pre-f蛋白氨基酸序列第227位的异亮氨酸突变为天冬酰胺;
68、a10-iii)将pre-f蛋白氨基酸序列第236位的丝氨酸突变为精氨酸;
69、a11-iii)将pre-f蛋白氨基酸序列第248位的丝氨酸突变为半胱氨酸;
70、a12-iii)将pre-f蛋白氨基酸序列第289位的谷氨酸突变为天冬酰胺;
71、a13-iii)将pre-f蛋白氨基酸序列第309位的丝氨酸突变为天冬酰胺;
72、a14-iii)将pre-f蛋白氨基酸序列第334位的精氨酸突变为酪氨酸;
73、a15-iii)将pre-f蛋白氨基酸序列第344位的天冬酰胺突变为谷氨酸;
74、a16-iii)将pre-f蛋白氨基酸序列第370位的丝氨酸突变为甘氨酸;
75、a17-iii)将pre-f蛋白氨基酸序列第389位的天冬酰胺突变为半胱氨酸;
76、a18-iii)将pre-f蛋白氨基酸序列第419位的半胱氨酸突变为酪氨酸;
77、a19-iii)将pre-f蛋白氨基酸序列第468位的精氨酸突变为天冬酰胺。
78、上述突变位点和突变类型可以进行任一的组合,例如:
79、a1-1)所述突变包括在第88位的丝氨酸突变为天冬酰胺;
80、a1-2)所述突变包括在第88位和第289位的突变为天冬酰胺;
81、a1-3)所述突变包括在第88位的丝氨酸突变为天冬酰胺和第389位的天冬酰胺突变为半胱氨酸;
82、a1-4)所述突变包括在第202位的丙氨酸突变为半胱氨酸和第334位的精氨酸突变为酪氨酸;
83、a1-5)所述突变包括在第202位的丙氨酸突变为半胱氨酸、第334位的精氨酸突变为酪氨酸和第389位的天冬酰胺突变为半胱氨酸;或者,
84、a1-6)所述突变包括在第202位的丙氨酸突变为半胱氨酸、第289位的谷氨酸突变为天冬酰胺和第334位的精氨酸突变为酪氨酸。
85、所述pre-f蛋白(或者野生型pre-f蛋白)氨基酸参考序列如seq id no.14所示,可以理解的是,不同亚型或者不同株病毒的野生型pre-f蛋白氨基酸不一定相同,可能会有替换、插入或者删除的突变,上述参考序列如seq id no.14所示,但也可以是其它结构不同的野生型序列,其突变位点对应于seq id no.14的上述位点,所述对应理解为基于氨基酸结构和/或功能分析后的对应关系。
86、在一个具体的实施方式中,所述pre-f蛋白包括如下任一种:
87、(a1-iii)seq id no.15-22所示的蛋白;
88、(a2-iii)在(a1-iii)所述蛋白的n端或/和c端连接标签得到的融合蛋白;
89、(a3-iii)将(a1-iii)-(a2-iii)任一种经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的具有相同功能的蛋白;
90、(a4-iii)与(a1-iii)-(a2-iii)任一种具有80%以上同一性且具有相同功能的蛋白。
91、优选的,所述来自rsv的融合蛋白还包括铁蛋白突变体;
92、所述铁蛋白突变体为将野生型铁蛋白氨基酸序列进行如下b1-iii)-b3-iii)中至少一种突变后得到的蛋白:
93、b1-iii)将野生型铁蛋白氨基酸序列第15位的天冬酰胺突变为谷氨酰胺;
94、b2-iii)将野生型铁蛋白氨基酸序列第96位的丝氨酸突变为天冬酰胺;
95、b3-iii)将野生型铁蛋白氨基酸序列第119位的酪氨酸突变为精氨酸;
96、优选的,所述野生型铁蛋白氨基酸参考序列如seq id no.23所示,可以理解是,不同亚型或者不同株病毒的野生型铁蛋白氨基酸不一定相同,可能会有替换、插入或者删除的突变,上述参考序列如seq id no.23所示,但也可以是其它结构不同的野生型序列,其突变位点对应于seq id no.23的第15、96和/或119,所述对应理解为基于氨基酸结构和/或功能分析后的对应关系。
97、在一个具体的实施方式中,所述铁蛋白包括如下任一种:
98、(b1-iii)seq id no.24所示的蛋白;
99、(b2-iii)在(b1-iii)所述蛋白的n端或/和c端连接标签得到的融合蛋白;
100、(b3-iii)将(b1-iii)-(b2-iii)任一种经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的具有相同功能的蛋白;
101、(b4-iii)与(b1-iii)-(b2-iii)任一种具有80%以上同一性且具有相同功能的蛋白。
102、更进一步的,所述来自rsv的融合蛋白包括如下任一种:
103、(c1-iii)seq id no.25-32所示的蛋白;
104、(c2-iii)在(c1-iii)所述蛋白的n端或/和c端连接标签得到的融合蛋白;
105、(c3-iii)将(c1-iii)-(c2-iii)任一种经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的具有相同功能的蛋白;
106、(c4-iii)与(c1-iii)-(c2-iii)任一种具有80%以上同一性且具有相同功能的蛋白。
107、本文中,同一性是指氨基酸序列或核苷酸序列的同一性。可使用国际互联网上的同源性检索站点测定氨基酸序列的同一性,如ncbi主页网站的blast网页。例如,可在高级blast2.1中,通过使用blastp作为程序,将expect值设置为10,将所有filter设置为off,使用blosum62作为matrix,将gap existence cost,per residue gap cost和lambda ratio分别设置为11,1和0.85(缺省值)并进行检索以对氨基酸序列的同一性进行计算,然后即可获得同一性的值(%)。
108、本文中,所述80%以上的同一性可为至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性。
109、上述(a2-iii)或(b2-iii)或(c2-iii)所述的融合蛋白中,所述标签是指利用dna体外重组技术,与目的蛋白一起融合表达的一种多肽或者蛋白,以便于目的蛋白的表达、检测、示踪和/或纯化。所述标签可为flag标签、his标签、mbp标签、ha标签、myc标签、gst标签和/或sumo标签等。
110、上述(a3-iii)或(b3-iii)或(c3-iii)所述的融合蛋白中,所述一个或几个氨基酸残基的取代和/或缺失和/或添加为在上述a1-iii)-a19-iii)或b1-iii)-b3-iii)所述氨基酸突变位点以外进行不超过10个氨基酸残基的取代和/或缺失和/或添加。
111、上述任一所述蛋白或融合蛋白可人工合成,也可先合成其编码基因,再进行生物表达得到。
112、所述来自rsv的融合蛋白的含量为1-10μg/ml,可以是上述范围内的任一范围或者数值,例如具体可为1.0、1.5、2.0、2.4、2.8、3.0、3.6、4.0、4.2、4.8、5.0、5.4、5、8、6.0、6.2、6.6、6.8、7.0、7.5、8.0、8.5、9.0、9.5、10μg/ml等等。
113、优选的,所述联合疫苗还可包括iv、佐剂(adjuvant)和/或v、疫苗递送系统(vaccine delivery system)。
114、iv、佐剂
115、所述佐剂可为一种可以刺激机体产生针对与其一同接种的抗原更强烈体液和/或细胞免疫应答的物质。本文所述佐剂可以是本领域技术人员公知的,包括但不限于:植物佐剂(如烷基胺、酚类成分、奎宁、皂角素、倍半萜、蛋白质、多肽、多糖、糖脂、植物血凝素等)、细菌佐剂(如霍乱毒素、大肠埃希菌不耐热毒素、细菌脂多糖等)、铝佐剂及其他无机成分佐剂(如钙佐剂)、细胞因子和核酸佐剂(如单核细胞克隆刺激因子、白细胞因子il-1、il-2、il-4、il-5、il-6、ifn-γ、cpg基序、核酸载体等)、乳剂佐剂(如弗氏佐剂)。所述佐剂可为药学上可以接受的佐剂。在本发明的一个或多个实施方案中,所述佐剂为氢氧化铝佐剂(al(oh)3佐剂)、cpg1018佐剂(购自广州锐博生物技术有限公司,批号0210426)、cpg-cjx1佐剂(序列为5’-tgactgaacgttttaacgtcagactga-3’,seq id no.5)、cpg7909佐剂(序列为5’-tcgtcgttttgtcgttttgtcgtt-3’,seq id no.6)中的至少任一种。
116、优选的,所述疫苗原液:佐剂质量比为1:(40-60),可以是上述范围内的任意范围或者任意值,例如1:40、1:42、1:45、1:48、1:50、1:52、1:55、1:58、1:60等等。
117、优选的,所述佐剂包括铝佐剂和/或cpg佐剂,更优选的,所述cpg佐剂包括cpg1018佐剂、cpg-cjx1和/或cpg7909佐剂。
118、进一步地,所述佐剂可为al(oh)3(氢氧化铝)佐剂。
119、进一步的,所述佐剂包括铝佐剂和cpg双佐剂,更优选的,所述双佐剂中,所述铝佐剂与cpg佐剂的质量比可为(22-28):1,具体可为22:1、23:1、24:1、25:1、26:1、27:1或28:1,优选为25:1。所述铝佐剂为al(oh)3(氢氧化铝),所述cpg佐剂为cpg-cjx1佐剂。
120、所述联合疫苗中,铝佐剂的含量可为400-600μg/m,可以是上述范围内的任一范围或者数值,例如具体可为400、420、450、480、500、520、550、580、600μg/ml。
121、所述联合疫苗中,cpg佐剂的含量可为10-30μg/ml,可以是上述范围内的任一范围或者数值,例如具体可为10、12、15、18、20、23、26、28、29、30μg/ml等等。
122、本领域技术人员所熟知的是,为了增强抗原蛋白的免疫原性,除了加入具有免疫增强作用的化合物作为佐剂外,还可通过调整基因组合使之表达成颗粒性结构;或在体外加以聚团化,包入脂质体或胶囊微球中。
123、v、疫苗递送系统:
124、所述疫苗递送系统可为一类能够将抗原物质携带至机体的免疫系统,并在其中较长时间存储和发挥其抗原作用的物质。本文所述疫苗递送系统可为吕盐凝胶佐剂疫苗递送系统、乳剂佐剂疫苗递送系统、脂质体佐剂疫苗递送系统或纳米佐剂疫苗递送系统。
125、进一步的,所述联合疫苗还包括一种或者是多种药学上可接受的载体。
126、所述药学上可接受的载体可为稀释剂、赋形剂、填充剂、粘合剂、湿润剂、崩解剂、吸收促进剂、吸附载体、表面活性剂或润滑剂但不限于此。
127、本发明所述用于预防新型冠状病毒感染的疫苗可为肌肉内液体注射剂、静脉内液体注射剂、鼻腔内液体注射剂、皮内液体注射剂或皮下液体注射剂。
128、在一个具体的实施方式中,所述联合疫苗包括:
129、①、i、来自sars-cov-2的融合蛋白和ii、来自流感病毒的血凝素,或者,
130、②、i、来自sars-cov-2的融合蛋白和iii、来自rsv的融合蛋白,或者,
131、③、ii、来自流感病毒的血凝素和iii、来自rsv的融合蛋白,或者,
132、④、i、来自sars-cov-2的融合蛋白、ii、来自流感病毒的血凝素和iii、来自rsv的融合蛋白。
133、优选的,所述i、来自sars-cov-2的融合蛋白包括seq id no.4所示的第26-244和252-277位或者seq id no.4所示的第26-277位,所述来自sars-cov-2的融合蛋白的含量为10-80μg/ml,
134、所述ii、来自流感病毒的血凝素来自于h1n1、h3n2亚型、乙型by和bv亚型,每种亚型的血凝素含量为15-50μg/ml,
135、所述iii、来自rsv的融合蛋白包括seq id no.15-22的任意序列或seq id no.25-32的任意序列,所述来自rsv的融合蛋白的含量为1-10μg/ml。
136、所述iv佐剂包括铝佐剂和/或cpg佐剂,铝佐剂的含量可为400-600μg/m,所述cpg佐剂的含量可为10-30μg/ml。
137、优选的,所述来自sars-cov-2的融合蛋白包括rbd8m-t4foldon蛋白(seq id no.4的第26-277位)、rbd8mfoldon蛋白(seq id no.4的第1-277位)或rbd8mfoldon-his蛋白(seq id no.4)。
138、本发明第二方面,提供一种上述联合疫苗的制备方法,所述制备方法包括:
139、1)制备包括来自sars-cov-2的融合蛋白的新冠疫苗原液;
140、2)制备包括来自流感病毒的血凝素的流感疫苗原液,和/或,
141、3)制备包括来自rsv的融合蛋白的rsv疫苗原液。
142、步骤1)-3)的进一步详细说明如下:
143、步骤1)、制备包括来自sars-cov-2的融合蛋白的新冠疫苗原液:
144、优选的,所述制备步骤1)包括:编码所述s蛋白rbd的突变蛋白的核酸分子在宿主细胞中进行表达得到所述突变蛋白,或使编码本文中任一所述来自sars-cov-2的融合蛋白的核酸分子在宿主细胞中进行表达得到所述融合蛋白,
145、优选的,所述方法可包括如下步骤:
146、h1-i)构建含有编码所述突变蛋白的核酸分子的重组表达载体;
147、h2-i)将所述重组表达载体导入宿主细胞,得到重组细胞;
148、h3-i)培养所述重组细胞,经分离和/或纯化得到所述突变蛋白;
149、或,所述方法可包括如下步骤:
150、g1-i)构建含有编码本文中任一所述融合蛋白的核酸分子的重组表达载体;
151、g2-i)将所述重组表达载体导入宿主细胞,得到重组细胞;
152、g3-i)培养所述重组细胞,经分离和/或纯化得到所述融合蛋白;
153、在上述制备方法中,本发明还提供了生物材料,所述生物材料可为下述任一种:
154、d1-i)编码上述任一s蛋白rbd的突变蛋白(rbd8m蛋白)的核酸分子;
155、d2-i)编码上述任一来自sars-cov-2的融合蛋白的核酸分子;
156、d3-i)含有d1-i)和/或d2-i)所述核酸分子的表达盒;
157、d4-i)含有d1-i)和/或d2-i)所述核酸分子的重组载体、或含有d3-i)所述表达盒的重组载体;
158、d5-i)含有d1-i)和/或d2-i)所述核酸分子的重组微生物、或含有d3-i)所述表达盒的重组微生物、或含有d4-i)所述重组载体的重组微生物;
159、d6-i)含有d1-i)和/或d2-i)所述核酸分子的重组宿主细胞、或含有d3-i)所述表达盒的重组宿主细胞、或含有d4-i)所述重组载体的重组宿主细胞;
160、优选,所述核酸分子包括下述任一种:
161、e1-i)、编码序列包括seq id no.2全长或者包括seq id no.3的第76-732和754-831位,例如是seq id no.2全长、seq id no.3的第76-831位、seq id no.3的第1-831位或seq id no.3全长的dna分子;
162、e2-i)、核苷酸序列包括seq id no.2全长或者包括seq id no.3的第76-732和754-831位,例如是seq id no.2全长、seq id no.3的第76-831位、seq id no.3的第1-831位、seq id no.3或seq id no.7全长的dna分子。
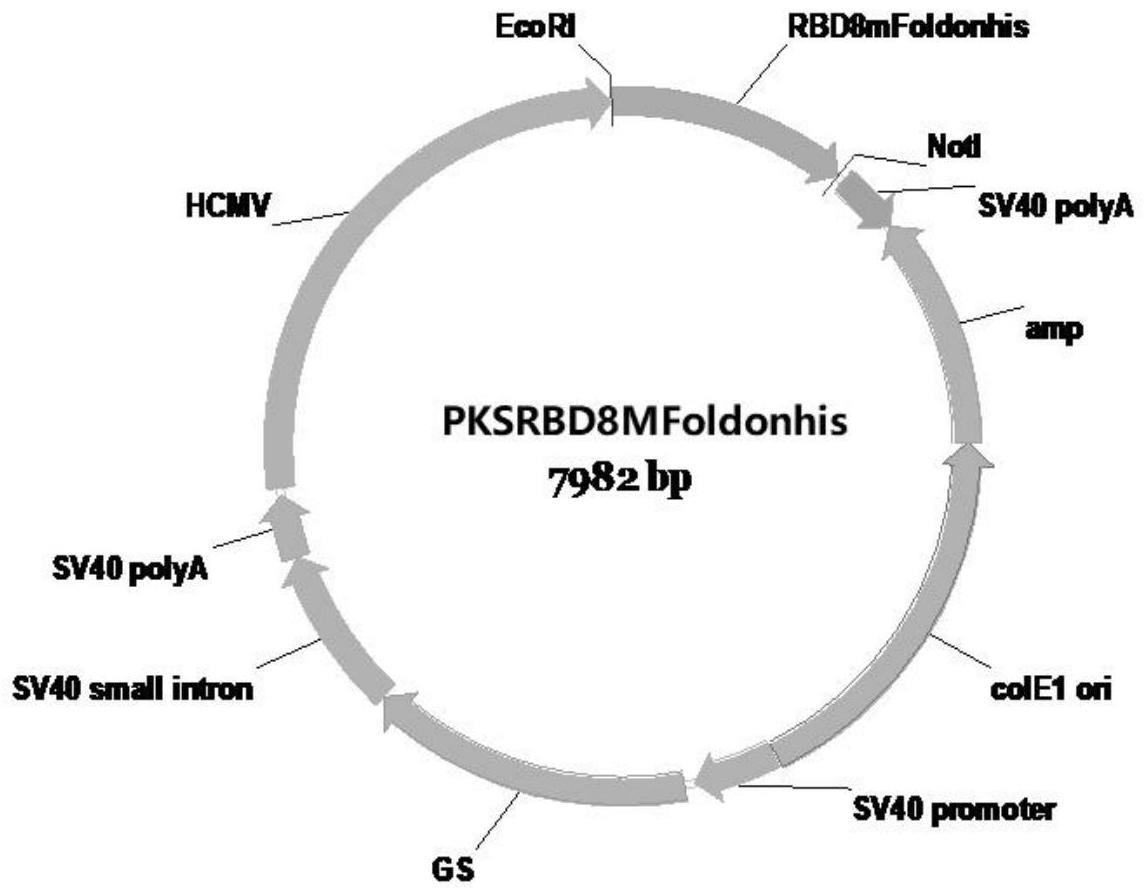
163、e3-i)、e1-i)或e2-i)的互补或者简并序列;
164、e4-i)、与e1-i)、e2-i)、e3-i)具有至少75%以上的同一性,并能编码上述任意融合蛋白的dna分子。
165、进一步地,d3-i)所述表达盒、d4-i)所述重组载体、d5-i)所述重组微生物和d6-i)所述重组宿主细胞均可表达d1-i)和/或d2-i)所述核酸分子。
166、seq id no.2所示的dna分子可为对rbd8m蛋白(seq id no.1)的核苷酸进行密码子优化,得到的编码rbd8m蛋白的dna分子,其命名可为rbd8m基因。
167、seq id no.3的第76-831位所示的dna分子可为对rbd8m-t4foldon蛋白(seq idno.4的第26-277位)的核苷酸序列进行密码子优化,得到的编码rbd8m-t4foldon蛋白的dna分子,其命名可为rbd8m-t4foldon基因。
168、seq id no.3的第1-831位所示的dna分子可为编码rbd8mfoldon蛋白(seq idno.4的第1-277位)的dna分子,其命名可为rbd8mfoldon基因。
169、seq id no.3所示的dna分子可为编码rbd8mfoldon-his蛋白(seq id no.4)的dna分子,其命名可为rbd8mfoldon-his基因。
170、seq id no.7所示的dna分子可为对三聚体融合蛋白rbd8mfoldon(rbd8mfoldon-his)的编码序列(seq id no.3)经密码子优化,并在两端增加ecor i和not i识别位点,最终优化得到的dna分子。其中:seq id no.7的第1-6位为ecor i识别位点序列,seq id no.7的第7-15位为kozak序列,seq id no.7的第16-90位为信号肽核苷酸序列(即seq id no.3的第1-75位),seq id no.7的第91-747位为rbd8m基因的核苷酸序列(即seq id no.2),seqid no.7的第748-768位为接头(gsgsgsg,seq id no.10)的核苷酸序列,seq id no.7的第769-846位为三聚体标签(t4foldon)的核苷酸序列,seq id no.7的第847-870位为his标签(hhhhhhhh,seq id no.8)的核苷酸序列,seq id no.7的第871-876位为2个终止密码子序列,seq id no.7的第877-884位为not i识别位点序列。
171、seq id no.7的第16-870位即为seq id no.3所示的dna分子(rbd8mfoldon-his基因)。
172、所述核酸分子还可包括在seq id no.2、seq id no.3的第76-831位、seq id no.3的第1-831位、seq id no.3或seq id no.7所示核苷酸序列基础上经密码子偏好性改造得到的核酸分子。考虑到密码子的简并性以及不同物种密码子的偏爱性,本领域技术人员可以根据需要使用适合特定物种表达的密码子。
173、本发明中,d4-i)所述重组载体可为pksrbd8mfoldonhis。
174、所述重组载体pksrbd8mfoldonhis的载体图谱如图1所示,重组载体pksrbd8mfoldonhis表达氨基酸序列如seq id no.4所示的rbd8mfoldon-his蛋白。
175、d5-i)所述重组微生物可为top10/pksrbd8mfoldonhis。所述top10/pksrbd8mfoldonhis是将所述重组载体pksrbd8mfoldonhis导入top10感受态细胞得到的重组微生物。
176、d6-i)所述重组宿主细胞可为cho/pksrbd8mfoldonhis。所述cho/pksrbd8mfoldonhis是将所述重组载体pksrbd8mfoldonhis导入cho-k1q得到的重组宿主细胞。
177、所述导入可为通过化学转化法(如ca2+诱导的转化法、聚乙二醇介导的转化法或金属阳离子介导的转化法)或电穿孔转化法等任何已知的转化方法将携带本发明dna分子的载体转化宿主菌;也可为通过噬菌体转导的方法将本发明dna分子转导进入宿主菌。所述导入还可为通过磷酸钙共沉淀法、脂质体介导法、电穿孔法或病毒载体法等任何已知的转染方法将携带本发明dna分子的载体转染宿主细胞。
178、更优选,h1-i)中所述核酸分子可为seq id no.2所示的dna分子,
179、更优选,g1-i)中所述核酸分子包括seq id no.3的第76-732和754-831位,例如可为seq id no.3的第76-831位、seq id no.3的第1-831位、seq id no.3或seq id no.7所示的dna分子。
180、g1-i)中所述融合蛋白可为rbd8m-t4foldon蛋白、rbd8mfoldon蛋白或rbd8mfoldon-his蛋白。
181、进一步地,编码rbd8m-t4foldon蛋白(seq id no.4的第26-277位)的核酸分子可为seq id no.3的第76-831位所示的rbd8m-t4foldon基因;编码rbd8mfoldon蛋白(seq idno.4的第1-277位)的核酸分子可为seq id no.3的第1-831位所示的rbd8mfoldon基因;编码rbd8mfoldon-his蛋白(seq id no.4)的核酸分子可为seq id no.3所示的rbd8mfoldon-his基因。
182、进一步地,所述宿主细胞可为cho-k1q细胞。
183、进一步地,所述导入可通过电转方式导入。
184、步骤2)、制备包括来自流感病毒的血凝素的流感疫苗原液:
185、优选的,所述步骤2)包括流感病毒扩增、收获、裂解和灭活。
186、更优选的,所述收获后对收获液进行澄清和过滤,获得澄清液,所述过滤包括初过滤和精细过滤。进一步优选的,所述初过滤膜孔径为1.0-3.0μm,优选为2.0μm,所述精细过滤膜孔径小于1.0μm,例如0.8、0.6、0.45、0.3μm等等。
187、更优选的,所述过滤步骤后包括对澄清液进行超滤浓缩获得浓缩液。进一步优选的,所述超滤浓缩包括用450-550kd,优选500kd的超滤膜分别对单价病毒澄清液进行超滤浓缩,将单价病毒澄清液浓缩至1/40-1/60,优选1/51体积,补加缓冲液进行循环洗滤。洗滤至单价病毒澄清液原倍体积后停止洗滤,浓缩至原倍体积的1/40-1/60,优选1/51体积后收获病毒浓缩液。在一个具体的实施方式中,所述缓冲液为0.01mol/l pbs。
188、更优选的,所述超滤浓缩步骤后对浓缩液离心,更优选的,所述离心采用蔗糖密度梯度离心法对单价病毒浓缩液进行离心纯化。
189、更优选的,所述离心纯化步骤后对离心液进行脱糖,获得单价病毒梯度后液。在一个具体的实施方式中,选用450-550kd,优选500kd的超滤膜对单价病毒离心液进行洗滤脱糖。洗滤至单价病毒离心液的15-25,优选20倍体积,再浓缩至单价病毒浓缩液的原倍体积。即为单价病毒梯度后液。
190、更优选的,所述步骤2)还包括纯化步骤,所述纯化步骤可以在收获后、裂解后,或者灭活后。进一步优选的,所述纯化包括层析纯化,在一个具体的实施方式中,所述纯化步骤包括在脱糖步骤后进行层析纯化,进一步优选的,所述层析纯化中按照1:(3500-4500),优选1:4000比例加入非离子型去污剂,例如吐温80进行层析纯化。
191、更优选的,所述裂解步骤包括用裂解剂对病毒液进行裂解,病毒液中蛋白浓度为0.5~2.5mg/ml。进一步优选的,所述裂解剂包括但不仅限于tritonx-100、去氧胆酸钠等等。
192、更优选的,所述灭活步骤包括灭活剂对病毒液进行灭活,获得单价原液,病毒液中蛋白浓度为0.5~2.5mg/ml。进一步优选的,所述灭火剂包括但不仅限于甲醛、β-丙内酯(bpl)等等。
193、更优选的,所述步骤2)还包括将单价原液进行混合获得裂解的多价流感疫苗原液。
194、步骤3)、制备包括来自rsv的融合蛋白的rsv疫苗原液:
195、优选的,所述步骤3)包括来自rsv的融合蛋白人工合成,也可先合成其编码基因,再进行生物表达得到。
196、更为优选的,生物表达的步骤包括:
197、h1-iii)构建含有编码所述突变蛋白或者融合蛋白的核酸分子的重组表达载体;
198、h2-iii)将所述重组表达载体导入宿主细胞,得到重组细胞;
199、h3-iii)培养所述重组细胞,经分离和/或纯化得到所述突变蛋白或者融合蛋白。
200、在上述制备方法中,本发明还提供了以下生物材料:
201、本发明提供的生物材料为下述d1-iii)-d5-iii)中至少一种:
202、d1-iii)编码上述突变蛋白或融合蛋白的核酸分子;
203、d2-iii)含有d1-iii)所述核酸分子的表达盒;
204、d3-iii)含有d1-iii)所述核酸分子的重组载体、或含有d2-iii)所述表达盒的重组载体;
205、d4-iii)含有d1-iii)所述核酸分子的重组微生物、含有d2-iii)所述表达盒的重组微生物、或含有b3-iii)所述重组载体的重组微生物;
206、d5-iii)含有d1-iii)所述核酸分子的重组细胞系、含有d2-iii)所述表达盒的重组细胞系、或含有d3-iii)所述重组载体的重组细胞系。
207、所述突变蛋白或融合蛋白参见本发明第一方面iii来自rsv的融合蛋白的定义。
208、其中,所述核酸分子可以是dna,如重组dna;所述核酸分子也可以是rna,如mrna。
209、在一个具体的实施方式中,编码所述突变蛋白或融合蛋白的核酸分子包括e1-iii)-e3-iii):
210、e1-iii)、seq id no.33-40任意序列的第1-1422或者全长所示的dna分子;
211、e2-iii)、e1-iii)的互补或者简并序列;
212、e3-iii)、与e1-iii)或e3-iii)限定的dna分子具有75%以上的同一性且编码所述融合蛋白的dna分子。
213、进一步地,d2-iii)所述表达盒、d3-iii)所述重组载体、d4-iii)所述重组微生物和d5-iii)所述重组宿主细胞均可表达上述突变蛋白、融合蛋白和/或d1-iii)所述核酸分子。
214、本领域普通技术人员可以很容易地采用已知的方法,例如定向进化和点突变的方法,对本发明的编码上述蛋白或融合蛋白的核苷酸序列进行突变。那些经过人工修饰的,具有编码上述突变蛋白或融合蛋白的核苷酸序列75%或者更高同一性的核苷酸,只要编码上述突变蛋白或融合蛋白且具有相同功能,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。
215、所述同一性是指与天然核酸序列的序列相似性。“同一性”包括与本发明的编码seq id no.15-32所示的氨基酸序列组成的蛋白质的核苷酸序列具有75%或更高,具有80%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
216、上述75%或75%以上同一性,可为80%、85%、90%或95%以上的同一性。
217、上述生物材料中,所述表达盒是指能够在宿主细胞中表达上述蛋白或融合蛋白的dna,该dna不但可包括启动上述蛋白或融合蛋白编码基因序列转录的启动子,还可包括终止上述蛋白或融合蛋白编码基因序列转录的终止子。进一步,所述表达盒还可包括增强子序列。
218、上述步骤1)和3)的生物材料中,
219、本文所述载体是指能够把外源dna或目的基因运载进入宿主细胞进行扩增和表达的载体,所述载体可以是克隆载体也可以是表达载体,包括但不限于:质粒、噬菌体(如λ噬菌体或m13丝状噬菌体等)、黏粒(即柯斯质粒)、ti质粒、病毒载体(如逆转录病毒(包括慢病毒)、腺病毒、腺相关病毒等)。在本发明的一个或多个实施方案中,所述载体为puc57载体和/或pks001载体。
220、本文所述微生物可为细菌、真菌、放线菌、原生动物、藻类或病毒。其中,所述细菌可来自埃希氏菌属(escherichia sp.)、欧文氏菌属(erwinia sp.)、土壤杆菌属(agrobacterium sp.)、黄杆菌属(flavobacterium sp.)、产碱菌属(alcaligenes sp.)、假单胞菌属(pseudomonas sp.)、芽胞杆菌属(bacillus sp.)等但不限于此,例如所述细菌可为大肠杆菌(escherichia coli)、枯草芽孢杆菌(bacillus subtilis)或短小芽孢杆菌(bacillus pumilus)。在本发明的一个或多个实施方案中,所述微生物为top10感受态细胞。
221、本文所述宿主细胞(也称为受体细胞)可为植物细胞或动物细胞。所述宿主细胞可理解为不仅是指特定的受体细胞,而且也指这种细胞的后代,且由于天然的、偶然的或有意的突变和/或改变,该子代可以不必与原始的亲代细胞完全一致,但仍包括在宿主细胞的范围中。合适的宿主细胞为本领域已知的,其中:所述植物细胞可为拟南芥(arabidopsisthaliana)、烟草(nicotiana tabacum)、玉米(zea mays)、水稻(oryza sativa)、小麦(triticum aestivum)等植物细胞但不限于此;所述动物细胞可为哺乳动物细胞(例如中国仓鼠卵巢细胞(cho细胞)、非洲绿猴肾细胞(vero细胞)、幼仓鼠肾细胞(bhk细胞)、小鼠乳腺癌细胞(c127细胞)、人胚胎肾细胞(hek293细胞)、人hela细胞、成纤维细胞、骨髓细胞系、t细胞或nk细胞等)、禽类细胞(例如鸡或鸭细胞)、两栖类细胞(例如非洲爪蟾(xenopuslaevis)细胞或大鲵(andrias davidianus)细胞)、鱼类细胞(例如草鱼、鲤鱼、虹鳟鱼或鲶鱼细胞)、昆虫细胞(例如sf21细胞或sf-9细胞)等但不限于此。在本发明的一个或多个实施方案中,所述宿主细胞为cho-k1q细胞。
222、在一个具体的实施方式中,所述步骤1)或3)包括如下步骤:将编码所述来自新冠病毒或rsv的突变蛋白或融合蛋白的核酸分子导入cho k1q细胞,得到重组细胞;培养所述重组细胞,得到所述突变蛋白或融合蛋白。
223、更进一步的,所述蛋白或融合蛋白的核酸分子通过重组质粒导入cho k1q细胞。
224、所述重组质粒为将所述突变蛋白或融合蛋白的核酸分子插入载体质粒后得到的质粒。
225、在本发明的具体实施例中,所述载体质粒为pks001载体质粒。所述重组质粒为重组质粒pks001-rsv-pref-a-np、pks001-rsv-pref-b-np、pks001-rsv-pref-c-np、pks001-rsv-pref-d-np、pks001-rsv-pref-e-np、pks001-rsv-pref-f-np、pks001-rsv-pref-g-np或pks001-rsv-pref-h-np。
226、优选的,所述制备方法还包括步骤4)、将步骤1)、2)和/或3)的疫苗原液至少两种原液混合后,添加佐剂和缓冲液,以获得预期的浓度。
227、优选的,所述疫苗原液:佐剂质量比为1:(40-60),可以是上述范围内的任意范围或者任意值,例如1:40、1:42、1:45、1:48、1:50、1:52、1:55、1:58、1:60等等。
228、更优选的,所述佐剂如本发明第一方面所定义。
229、更优选的,所述缓冲液包括pbs等。
230、本发明第三方面,还提供一种上述任一联合疫苗应用,所述应用包括下述任一种:
231、f1)在制备用于预防和/或治疗sars-cov-2、流感病毒和/或rsv感染引起的疾病的产品中的应用;
232、f2)在制备用于诱导sars-cov-2、流感病毒和/或rsv抗原免疫反应的产品中的应用;
233、f3)在预防和/或治疗sars-cov-2、流感病毒和/或rsv感染引起的疾病中的应用;
234、f4)在用于诱导sars-cov-2、流感病毒和/或rsv抗原免疫反应中的应用;
235、f5)在预防sars-cov-2、流感病毒和/或rsv感染中的应用。
236、本文所述产品可为试剂或药物。
237、f1)和f2)中所述产品可为sars-cov-2、流感病毒和/或rsv抗体,包括全长抗体或抗原结合片段(如fab片段、fv片段、fab′片段、f(ab′)2片段、单链抗体(scfv)、纳米抗体(单域抗体)、双特异性抗体或最小识别单位(mru)等但不限于此)。
238、进一步地,所述sars-cov-2抗体可为特异性结合sars-cov-2刺突蛋白(s蛋白)受体结合区(receptor binding domain,rbd)的中和抗体。所述中和抗体可为针对多种流行株的新型冠状病毒的高滴度中和抗体。
239、上述应用中,所述sars-cov-2、流感病毒和/或rsv感染引起的疾病可包括呼吸系统感染、消化系统感染、心血管系统感染、和/或神经系统感染等,
240、优选,所述呼吸系统感染可包括呼吸道感染和/或肺部感染,
241、优选,所述消化系统感染可包括肠道疾病、纳差、恶心、呕吐、腹痛和/或腹泻,
242、更优选,所述呼吸道感染可包括严重急性呼吸道综合征、低氧性呼吸衰竭、脓毒症、脓毒性休克、鼻咽炎、鼻炎、咽喉炎、气管炎和/或支气管炎,
243、更优选,所述肺部感染可包括肺炎和/或肺损伤,
244、更优选,所述肺炎可包括新型冠状病毒肺炎(covid-19,简称新冠肺炎)。
245、sars-cov-2可以与表达于消化道黏膜上皮细胞的ace2受体结合,进而累及消化道(李明松,刘占举,董卫国,田德安.关于炎症性肠病患者有效预防和治疗sars-cov-2感染的共识.现代消化及介入诊疗2020,25(2):146-149.)。
246、本发明第四方面,还提供了一种产生免疫应答的方法,所述方法可包括给受试者施用上述任一的联合疫苗。
247、上述方法中,给受试者施用所述联合疫苗后,可在受试者中引发针对sars-cov-2、流感病毒和/或rsv的免疫反应。所述免疫反应可为细胞免疫反应,或体液免疫反应,或细胞免疫反应和体液免疫反应。
248、所述细胞免疫反应可包括b细胞免疫反应和t细胞免疫反应。
249、本文所述受试者可为人类或非人类动物。
250、进一步地,所述非人类动物可为非人类哺乳动物。
251、所述非人类哺乳动物可为小鼠、大鼠、豚鼠、仓鼠、猪,犬,羊,猴,兔、猫、牛、马中的任意一种但不限于此。
252、本文所述受试者包括但不限于健康受试者、有症状感染受试者、无症状感染受试者或康复受试者(sars-cov-2、流感病毒和/或rsv感染后恢复的受试者)。
253、本文所述施用包括但不限于肌肉注射、皮下注射、皮内注射、静脉注射、动脉注射、腹腔注射、微针注射、粘膜给药、口服、口鼻腔喷入或雾化吸入。
254、本发明第五方面,还提供一种预防和/或治疗sars-cov-2、流感病毒和/或rsv感染引起的疾病的方法,所述方法可包括给受试者施用所述联合疫苗。
255、上述方法中,所述sars-cov-2、流感病毒和/或rsv感染引起的疾病可包括呼吸系统、消化系统、心血管系统和/或神经系统感染。
256、上述方法中,所述呼吸系统感染可包括呼吸道感染和/或肺部感染。
257、上述方法中,所述呼吸道感染可包括严重急性呼吸道综合征、低氧性呼吸衰竭、脓毒症、脓毒性休克、鼻咽炎、鼻炎、咽喉炎、气管炎和/或支气管炎,所述肺部感染可包括肺炎和/或肺损伤。
258、上述方法中,所述肺部感染可包括新型冠状病毒肺炎(covid-19,简称新冠肺炎)。
259、上述方法中,所述消化系统感染可包括肠道疾病、纳差、恶心、呕吐、腹痛和/或腹泻。
260、上述方法中,给受试者施用所述联合疫苗后,可在受试者中引发针对sars-cov-2、流感病毒和/或rsv的免疫反应。所述免疫反应可为细胞免疫反应,或体液免疫反应,或细胞免疫反应和体液免疫反应。
261、所述细胞免疫反应可包括b细胞免疫反应和t细胞免疫反应。
262、本文所述受试者可为人类或非人类动物。
263、进一步地,所述非人类动物可为非人类哺乳动物。
264、所述非人类哺乳动物可为小鼠、大鼠、豚鼠、仓鼠、猪,犬,羊,猴,兔、猫、牛、马中的任意一种但不限于此。
265、本文所述受试者包括但不限于健康受试者、有症状感染受试者、无症状感染受试者或康复受试者(sars-cov-2感染后恢复的受试者)。
266、本文所述施用包括但不限于肌肉注射、皮下注射、皮内注射、静脉注射、动脉注射、腹腔注射、微针注射、粘膜给药、口服、口鼻腔喷入或雾化吸入。
267、本发明第六方面,还提供上述生物材料本身,包括:
268、来自sars-cov-2的融合蛋白,所述融合蛋白见本发明第一方面i、来自sars-cov-2的融合蛋白的定义;
269、来自rsv的融合蛋白,所述融合蛋白见本发明第一方面iii、来自rsv的融合蛋白的定义;
270、d1-i)-d6-i),d1-iii)-d5-iii)分别所定义的核酸分子、表达盒、重组载体、重组微生物、重组宿主细胞和/或重组细胞系。
271、本发明第七方面,提供上述生物材料或利用上述生物材料获得的突变蛋白、融合蛋白和/或疫苗在如下y1)-y4)任一种中的应用:
272、y1)作为免疫原;
273、y2)制备抗新冠、流感和/或呼吸道合胞病毒的产品;
274、y3)制备预防和/或治疗新冠、流感和/或呼吸道合胞病毒感染的产品;
275、y4)制备预防和/或治疗新冠、流感和/或呼吸道合胞病毒所致疾病的产品。
276、本发明第八方面,提供包含上述生物材料的产品,所述产品包括例如疫苗或者药物组合物等等。
277、优选的,所述疫苗或者药物组合物包括本发明第一方面定义的佐剂、递送系统或药学上可接受的载体。
278、需要说明的是,本发明中的任意形式的编号,例如i、ii、iii、a、b、a、b、①、②等形式的编号仅仅是为了区分彼此而进行的命名,并不表明时间或空间的先后顺序,有另外说明除外。
279、本发明疫苗中,
280、新冠疫苗的设计是基于新型冠状病毒原始病毒rbd区域的抗原表位序列,同时分析后期发现的变异病毒的rbd区域中的关键抗原表位,通过比对sars-cov-2不同亚型的基因序列,参考已报道的sars-cov rbd蛋白三聚体结构相关研究,对sars-cov-2 rbd基因做了进一步的改造,设计了8个重要位点突变,得到突变蛋白(rbd8m蛋白,seq id no.1),在此基础上,通过引入三聚体标签t4foldon(seq id no.4的第252-277位)获得三聚体融合蛋白rbd8m-t4foldon(seq id no.4的第26-277位),同时,为了更便于蛋白的分泌表达,在rbd8m-t4foldon蛋白(seq id no.4的第26-277位)的n端融合了信号肽(seq id no.4的第1-25位),得到rbd8mfoldon蛋白(seq id no.4的第1-277位),进一步在rbd8mfoldon蛋白(seq id no.4的第1-277位)的c端融合8-histag得到rbd8mfoldon-his蛋白(seq id no.4)以便纯化和检测。
281、虽然本发明设计构建了三聚体融合蛋白rbd8m-t4foldon、rbd8mfoldon和rbd8mfoldon-his,但本发明不限于该特定融合蛋白序列,本领域技术人员可对三聚体融合蛋白中的三聚体标签、接头、信号肽和/或纯化标签进行替换。例如采用本领域公知的其他三聚体标签(如源自酵母转录激活因子gcn4的异亮氨酸拉链和卷曲螺旋三聚体结构域、前胶原c-前肽结构域(trimer-tag)、大肠杆菌天冬氨酸转氨甲酰酶(atcase)的催化亚基、胶原蛋白xv的三聚体结构域、胶原蛋白xviii的三聚体结构域或真核热休克转录因子的卷曲螺旋三聚体结构域等),只要该三聚体标签能够使本文所述突变蛋白(rbd8m蛋白)形成三聚体,并且得到的三聚体复合物与本发明所述融合蛋白功能相同,均可视为与本发明融合蛋白等同的融合蛋白,这些等同的融合蛋白均未脱离本发明的保护范围。
282、本发明利用cho真核细胞表达体系,表达纯化rbd8mfoldon三聚体蛋白,经sds-page检测蛋白表达成功。纯化的rbd8mfoldon三聚体蛋白作为抗原辅以佐剂后免疫小鼠获得抗体血清,通过elisa,elispot,以及假病毒中和试验加以认证。结果表明本发明制备的疫苗在动物体内有很好的保护效果,其能有效的阻断病毒的结合,中和病毒感染。
283、rsv疫苗中通过特异性的抗原突变设计增强了pre-f蛋白的有效免疫原性、稳定性和安全性,并通过在纳米颗粒表面的展示将所需要的表位外露,进一步增强了免疫原性。通过实验证明:本发明制备的疫苗可以在低剂量时获得较好的免疫效果,其中,rsv-pref-c-np组中和效价可达到19836。
284、本发明解决了野生抗原稳定性差的问题,本发明制备的铁蛋白-pref融合蛋白在进入生物体内之后能够诱导出具备中和活性的呼吸道合胞病毒抗体,从而赋予该机体相应的免疫保护。
285、本发明制备的铁蛋白-pref融合蛋白能够有效激发机体的细胞免疫机制,并且引起的免疫反应是th1/th2平衡的,可以避免th2偏激所导致的免疫过激反应,具备较好的安全性。
286、本发明通过将rsv的pre-f相关序列及铁蛋白纳米颗粒进行突变设计,并将pre-f突变蛋白和铁蛋白突变体颗粒在真核细胞中进行融合表达,得到具备多个pre-f在表面集中展示的铁蛋白-pref融合蛋白纳米颗粒,该铁蛋白-pref融合蛋白纳米颗粒通过稳定和暴露所需要展现的抗原表位,破坏或隐藏不需要的抗原表位,有效的提高了抗原的免疫原性、生产稳定性和安全性。通过实验表明:将本发明制备的铁蛋白-pref融合蛋白注射至小鼠,可以获取到高保护效价的血清,且小鼠血清针对真病毒可产生较高的中和效价,同时通过稳定性实验和安全性实验证明:本发明制备的铁蛋白-pref融合蛋白还具备足够的物理稳定性和较好的安全性。
287、概括来说,与现有技术相比,本发明的有益效果为:
288、(1)联合疫苗中的新冠疫苗,引入三聚体标签t4foldon,形成三聚体立体蛋白。
289、(2)联合疫苗中的新冠疫苗,本发明构建表达的三聚体融合蛋白使用非常小的剂量就能够引起小鼠特异性抗体的产生,对新型冠状病毒rbd蛋白具有特异性中和作用。为后期研发新型冠状病毒重组蛋白疫苗提供了实验基础。
290、(3)联合疫苗中的新冠疫苗,通过有选择性地选择关键抗原表位作为免疫原,可以精准产生具有病毒感染中和性的抗体,避免产生其他非中和性抗体,从而避免可能潜在的ade风险,同时避免大量非中和抗体生成所导致过度“免疫消耗”。
291、(4)联合疫苗中的rsv疫苗,本发明对野生型pre-f以及铁蛋白进行突变,增强了疫苗的有效免疫原性、稳定性和安全性,同时对铁蛋白进行突变,进一步提高了疫苗的抗原性和稳定性。
292、(5)联合疫苗中,广谱抗原,可同时刺激机体产生针对多种流行株的新型冠状病毒、多种亚型的流感病毒以及多种rsv亚型的高滴度中和抗体,能有效中和新冠原始毒株和各种变异毒株、各亚型流感病毒毒株和/或rsv毒株。
293、(6)联合疫苗中,采用佐剂包括铝佐剂和吉诺卫自主研发设计的全硫代修饰的线性cpg odn佐剂,可同时刺激b细胞和t细胞免疫,微量蛋白即可激发小鼠非常高的免疫反应,短时间内即可达到良好的保护效果。
294、(7)联合疫苗中,两种或三种抗原组分疫苗之间没有相互抑制,能很好兼容,同时具备安全性和稳定性。
295、(8)联合疫苗中,两种或三种抗原组分疫苗之间还具有协同作用,能相互促进,增加机体产生对病毒的抗体滴度,提高体液或者细胞免疫保护效力。
296、(9)本发明的联合疫苗适用人群广,幼儿成人均有效,而目前上市的亚单位疫苗仅批准用于成人。
297、(10)本发明的联合疫苗预防的疾病均为季节性的呼吸道系统疾病,联合使用方便,减少受试者的疫苗接种次数,同时预防多种疾病,从而降低因多次来接种点而感染疾病的风险和多次接种所带来的不良反应的发生率,包括多次接种而导致的更多剂量的防腐剂及佐剂带来的不良反应,多次注射给婴儿和父母所带来的身体和心理的痛苦等等。
- 还没有人留言评论。精彩留言会获得点赞!