一种去细胞真皮水凝胶及其制备方法与应用与流程
本发明涉及生物,尤其涉及一种去细胞真皮水凝胶及其制备方法与应用。
背景技术:
1、皮肤创面愈合是皮肤在受到各种外界损伤因素之后修复的过程。因此,促进这些意外和故意伤害的愈合,最大限度地减少对患者的美学影响,最大限度地恢复组织功能,仍然是临床护理的中心问题。
2、而临床上治疗皮肤缺损主要是皮瓣手术治疗,但皮瓣的重建和再植往往需要较长时间的固定以及恢复,且不适用于大范围皮肤缺损。传统的生物工程解决方案侧重于生长因子,细胞和支架分开,缺乏对伤口愈合的整体考虑,其结果有限。现有的生物工程从传统的种子细胞到模拟细胞外基质(ecm),提供天然的细胞与不同组织结构之间的强相互作用,为伤口愈合提供了更好的解决办法。
3、去细胞生物支架(decm)是将组织、器官内细胞成分去除的一种天然生物材料,保留了细胞外基质的特有结构,含有、隐肽等活性成分,为细胞的生存及活动提供理化支持,有效促进组织、器官重塑、再生。decm还具有良好的生物活性、生物相容性和非免疫原性。这些优势使decm成为转化医学领域最有前途的ecm模拟组织再生支架之一。然而,decm的几何和机械特性极大地限制了其临床应用。
4、目前,促伤口愈合材料主要包括:水凝胶、绷带、海绵和药物粉末等,其中水凝胶材料因有助于控制出血,还有助于保持伤口湿润,广泛应用在伤口愈合中。
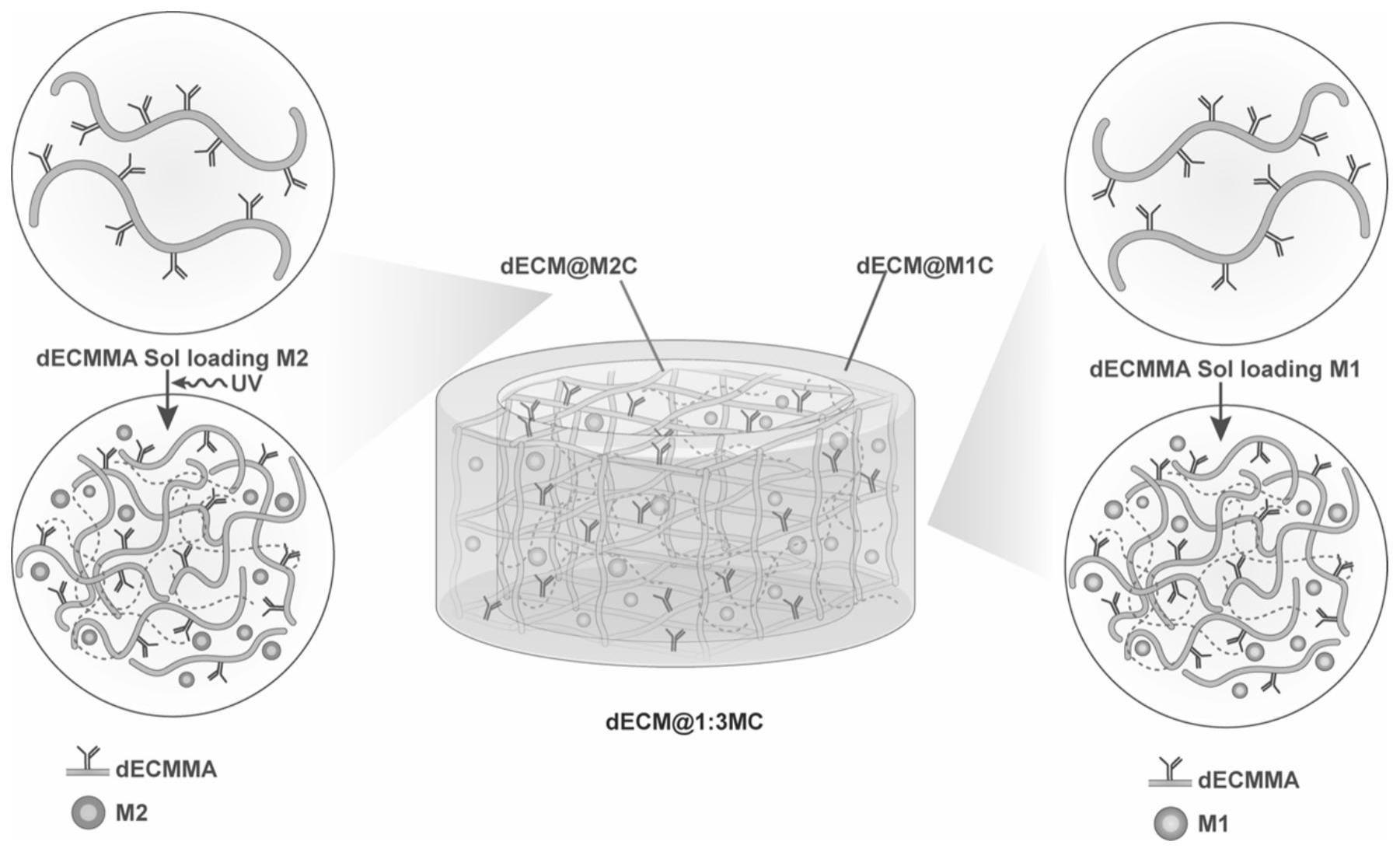
5、水凝胶是一种由高分子和水分子构成的三维网络结构材料,包括天然水凝胶和合成水凝胶,前者由于其良好的生物相容性和部分水凝胶本身所具有的止血、促进组织再生等性质,广泛应用于生物医药领域。
6、伤口愈合分为止血、炎症、增殖和重塑4个阶段,每个阶段并不是完全独立的,而是同时进行的,在伤口愈合的早期阶段,激活的皮肤组织巨噬细胞和招募的骨髓来源的单核细胞被极化为促炎(m1)巨噬细胞,产生促炎趋化因子、细胞因子(如肿瘤坏死因子(tnf)、白细胞介素-1β(il-1β)、il-6、il-33、干扰素(ifn)-γ)、生长因子、抗微生物肽和活性氧,吞噬细胞碎片和坏死细胞以防止病原体感染。随着创面愈合进入增殖阶段,m1巨噬细胞转化为抗炎(m2)表型,m2表型分泌多种血管生成生长因子、细胞因子和趋化因子(如金属蛋白酶、血小板衍生生长因子(pdgf)、血管内皮生长因子(vegf)、il-8、转化生长因子-β(tgf-β)、il-10),促进创面血运重建、基质生成和再上皮化。然而,由于创面局部条件差,巨噬细胞功能缺失导致巨噬细胞极化无效,特别是巨噬细胞m1表型向巨噬细胞m2的表型切换受损或早熟,阻碍了促炎和促愈合细胞因子环境的形成和转变,导致创面愈合进程受损。因此,促炎和促愈合细胞因子混合物在皮肤伤口中模拟巨噬细胞介导的免疫微环境可能对伤口愈合有积极的调节作用。
7、然而,皮瓣的重建和再植往往需要较长时间的固定以及恢复,且不适用于大范围皮肤缺损。传统的干性伤口敷料(绷带、海绵和药物粉末等)不能提供一个潮湿的伤口环境,且存在成本效益较低,愈合率低,伤口感染率高的问题。普通的天然水凝胶和合成水凝胶往往针对伤口愈合中的单个时期的伤口愈合速率,具有较差的机械性能和对水的敏感性。
8、因此,亟需一种物理机械性能可调、成本低廉、来源广泛、无免疫原性、具有可生物降解性、具有光敏性、可定制任意伤口形状,可以调节体内免疫微环境的仿时序性的去细胞外基质水凝胶。
技术实现思路
1、本发明的目的是针对现有技术中的不足,提供一种去细胞真皮水凝胶及其制备方法与应用。
2、为实现上述目的,本发明采取的技术方案是:
3、本发明的第一方面是提供一种去细胞真皮水凝胶的制备方法,步骤包括:
4、s1、制备m1表型极化的巨噬细胞条件培养基以及m2表型极化的巨噬细胞条件培养基;
5、s2、取动物来源的真皮层,将所述真皮层依次进行去细胞处理、第一冻干处理以及粉碎处理,制得真皮去细胞支架;
6、s3、将所述真皮去细胞支架溶解于含有盐酸以及胃蛋白酶的pbs溶液中,制得真皮去细胞支架溶液,并依次进行消化处理、酰化处理、透析处理以及第二冻干处理,制得光敏性去细胞真皮冻干粉;
7、s4、将所述m1表型极化的巨噬细胞条件培养基、所述光敏性去细胞真皮冻干粉以及光引发剂混合,制得m1型免疫因子的去细胞预凝胶;
8、s5、将所述m2表型极化的巨噬细胞条件培养基、所述光敏性去细胞真皮冻干粉以及光引发剂混合,制得m2型免疫因子的去细胞预凝胶;
9、s6、将所述m1型免疫因子的去细胞预凝胶包覆于所述m2型免疫因子的去细胞预凝胶之外,并于紫外照射下进行固化处理,即得所述去细胞真皮水凝胶。
10、优选地,步骤s1包括:
11、s11、分离小鼠的胫骨以及股骨,消毒后,采用dmem完全培养基将胫骨以及股骨中的骨髓冲洗至离心管中;
12、s12、在所述离心管中加入红细胞裂解液,反复吹打后静置,静置后进行离心处理并去除上清液;
13、s13、在所述离心管内加入dmem细胞培养液悬浮细胞并进行过滤处理后进行离心,去除上清液并重复本步骤一次;
14、s14、在所述离心管内加入刺激培养基,诱导所述骨髓细胞分化为所述巨噬细胞;调整细胞密度至1×106个/ml并置于37℃、5% co2培养箱中培养,待后续处理;所述刺激培养基为含有10ng/ml巨噬细胞集落刺激因子的所述dmem完全培养基;
15、s15、更换所述刺激培养基继续培养4天后,再次更换所述刺激培养基;在所述刺激培养基中加入100ng/ml脂多糖或含有50ng/ml ifnγ的100ng/ml脂多糖,进行所述m1极化处理;或
16、在所述刺激培养基中加入10ng/ml il-4和/或10ng/ml il-13,进行所述m2极化处理;
17、s16、分别收集所述m1极化处理以及所述m2极化处理后的培养基,离心取上清,即得所述m1表型极化的巨噬细胞条件培养基以及所述m2表型极化的巨噬细胞条件培养基。
18、优选地,步骤s2中,所述去细胞处理包括:将所述真皮层依次进行若干次的搅拌处理;
19、所述搅拌处理的程序包括:
20、
21、优选地,步骤s3中,所述消化处理包括:将所述真皮去细胞支架溶液在35℃-40℃持续搅拌48h-96h后,过滤去除大颗粒并加入10×pbs溶液终止消化;所述10×pbs溶液与所述真皮去细胞支架溶液的体积比为1:(8-10);
22、所述酰化处理包括:在所述消化处理完成后所述真皮去细胞支架溶液中加入碱性溶液调节ph至8-9,并加入甲基丙烯酸,35℃-40℃持续搅拌24h-72h后,加入1×pbs溶液终止酰化反应;所述1×pbs溶液与所述真皮去细胞支架溶液的体积比为(4-6):1;
23、所述透析处理包括:在所述酰化处理完成后的所述真皮去细胞支架溶液中加入碱性溶液调节ph至7.35-7.45,并透析48h-96h;
24、所述冻干处理包括:将所述透析处理完成后的所述真皮去细胞支架溶液在35℃-40℃的温度下持续搅拌48h-96h,并于-85℃~-75℃冷冻0.5h-1.5h。
25、更优选地,所述pbs溶液中,所述真皮去细胞支架的浓度为8mg/ml-12mg/ml,所述盐酸的浓度为0.005mol/l-0.015mol/l,所述胃蛋白酶的浓度为0.5mg/ml-2mg/ml;所述碱性溶液的浓度为8mol/l-12mol/l;所述甲基丙烯酸与所述真皮去细胞支架的比例为0.5ml/g-1.5ml/g;所述甲基丙烯酸的滴加速度为0.3ml/min-0.8ml/min。
26、优选地,所述光引发剂为光引发剂i2959,所述光引发剂的浓度为0.5mg/ml-1.5mg/ml;所述m1型免疫因子的去细胞预凝胶中以及所述m2型免疫因子的去细胞预凝胶中,所述光敏性去细胞真皮冻干粉的浓度均为40mg/ml-60mg/ml。
27、优选地,步骤s6中,所述m1型免疫因子的去细胞预凝胶与所述m2型免疫因子的去细胞预凝胶的体积比为1:(1-3);所述固化处理中,紫外光的波长为365nm-395nm。
28、本发明的第二方面是提供一种由上述制备方法制得的去细胞真皮水凝胶。
29、本发明的第三方面是提供一种用于促进创面愈合的敷料,包括:上述的去细胞真皮水凝胶。
30、本发明采用以上技术方案,与现有技术相比,具有如下技术效果:
31、本发明的去细胞真皮水凝胶具有良好的凝胶化时间,适合于动态创面;良好的形状适应性,使其适用于形状不规则的创面;本发明的去细胞真皮水凝胶通过调节细胞增殖、迁移和免疫应答对组织再生发挥多重作用,从而促进创面的全层修复,对组织过程和再生医学的发展具有重要的作用;本发明的去细胞真皮水凝胶通过仿时序性细胞因子释放调控体内免疫微环境,促进血管内皮细胞和成纤维细胞的生长增殖,促进皮肤附属器官再生,显著促进创面愈合,与商品敷料相比,本发明的去细胞真皮水凝胶极大地缩短了创面愈合时间,加速了皮肤结构和功能的重建。
- 还没有人留言评论。精彩留言会获得点赞!