药物载体、DNA四面体药物及其制备方法和应用
本技术属于生物医药,尤其涉及药物载体、dna四面体药物及其制备方法和应用。
背景技术:
1、急性肝功能衰竭(acute liver failure,alf)是临床危重病症之一,短期内可引起多器官功能障碍,常因并发心肺功能衰竭,肾功能衰竭,胃肠道出血和败血症等而死亡,病死率极高,当前尚无有效综合治疗方法。由于alf发病机制非常复杂,并且多种因素可相互影响,目前具体机制尚不十分明确。alf发生时主要表现为肝细胞呈一次性坏死,坏死面积≥肝实质的2/3,伴存活肝细胞严重变性,窦壁网架不塌陷或少量非完全性塌陷。通常,对于急性肝脏功能衰竭患者来说,原位肝移植被认为是alf治疗的主要手段,但遗憾的是,有相当数量的患者因供体不足、费用高或自身修复能力差而死亡。除此之外,基于干细胞的治疗如胚胎干细胞(escs),间充质干细胞(mscs)、造血干细胞(hscs)和诱导多能干细胞(ipsc),在过去十年中已成为人类肝病研究的热点,但确切机制尚不明确,需要进一步研究,其有效应用于临床还有很长的路要走。尽管该病的临床表现、生化改变及病理机制具有高度的异质性及个体地域差异。
2、已知活性氧(ros)是肝损伤的重要因素之一,过量ros的产生可能导致炎症和肝细胞坏死,这将加重疾病的症状。除此之外,alf诱导的天然免疫系统的激活也可能导致大量炎症介质的产生,从而进一步导致系统性疾病和alf损伤的加重。尤其是在肝损伤早期,单核细胞源性巨噬细胞具有促炎作用,加重炎症。因此,近年来干扰rna、抗氧化剂或抗炎药物的开发和应用引起了人们对alf治疗的极大兴趣,但是,干扰rna容易在血浆和肾脏中被各种核酸酶降解或脱靶,限制了其在临床上的广泛应用,抗氧化剂或抗炎药物在血液中半衰期短,严重阻碍了对药物的有效利用。
3、目前采用无机纳米材料如氧化铈纳米材料、量子点、磁性纳米粒子、碳纳米材料等,和有机纳米材料如脂质体纳米粒子、化学聚合物纳米材料等,一般通过在纳米材料上特异性修饰适配体、多肽或靶向抗体等物质将上述药物靶向运输到特异性组织部位。但是,这些运载纳米材料合成复杂;且大多数硬纳米材料,如金、银、铜和锰等纳米粒子具有积累毒效应且不易降解,在临床治疗中使用这些纳米材料将具有产生不良反应的潜在影响。此外,在纳米材料表面修饰裸的sirna在体内容易被降解,同时复杂的材料合成过程会限制这些纳米载体的大规模应用。
技术实现思路
1、基于此,本技术提供了药物载体、dna四面体药物及其制备方法和应用,能有效解决现有的药物载体合成复杂、具有积累毒效应且不易生物降解,负载核酸类药物容易在体内被降解的技术问题。
2、本技术第一方面提供了一种药物载体,包括:
3、单链dna和g-四链体;
4、所述单链dna具有seq id no.1、seq id no.2、seq id no.3、seq id no.4、seq idno.5和seq id no.6所示核苷酸序列;
5、所述g-四链体具有seq id no.7所示核苷酸序列;
6、所述seq id no.1、所述seq id no.2、所述seq id no.3的末端分别连接有第一接头;所述seq id no.4、所述seq id no.5、所述seq id no.6的末端分别连接有第三接头;所述g-四链体的末端连接有第二接头;
7、所述第一接头的序列与所述第二接头的序列互补配对;
8、所述单链dna相互连接形成dna四面体结构;所述g-四链体通过所述第二接头与所述单链dna互补连接。
9、本技术的药物载体可与核酸类药物和化学药物连接,作为可同时递送核酸类药物和化学药物的载体。
10、具体的,本技术的药物载体可通过在核酸类药物的末端连接与所述第三接头互补配对的第四接头,使得所述核酸类药物通过所述第四接头与所述单链dna互补连接;所述化学药物可作为g4配体通过π-π堆积相互作用与所述dna四面体结合,或者所述化学药物通过化学基团(如醌环)平面嵌插到dna的gc-cg碱基对之间,或者所述化学药物通过静电吸附与dna四面体结合,所述化学药物也可通过共价连接所述dna四面体。
11、本技术第二方面提供了dna四面体药物,包括:
12、单链dna、g-四链体、核酸类药物和化学药物;
13、所述单链dna具有seq id no.1、seq id no.2、seq id no.3、seq id no.4、seq idno.5和seq id no.6所示核苷酸序列;
14、所述g-四链体具有seq id no.7所示核苷酸序列;
15、所述seq id no.1、所述seq id no.2、所述seq id no.3的末端分别连接有第一接头;所述seq id no.4、所述seq id no.5、所述seq id no.6的末端分别连接有第三接头;所述g-四链体的末端连接有第二接头;所述核酸类药物的序列末端连接有第四接头;
16、所述第一接头的序列与所述第二接头的序列互补配对;所述第三接头的序列与所述第四接头的序列互补配对;
17、所述单链dna相互连接形成四面体结构;所述g-四链体通过所述第二接头与所述单链dna互补连接;所述核酸类药物通过所述第四接头与所述单链dna互补连接。
18、具体的,第一接头、第二接头、第三接头和第四接头的序列可通过筛选和软件评估得到,没有固定的规律,其作用是构建使得seq id no.1~seq id no.6构建dna四面体,且使得该dna四面体负载核酸类药物。
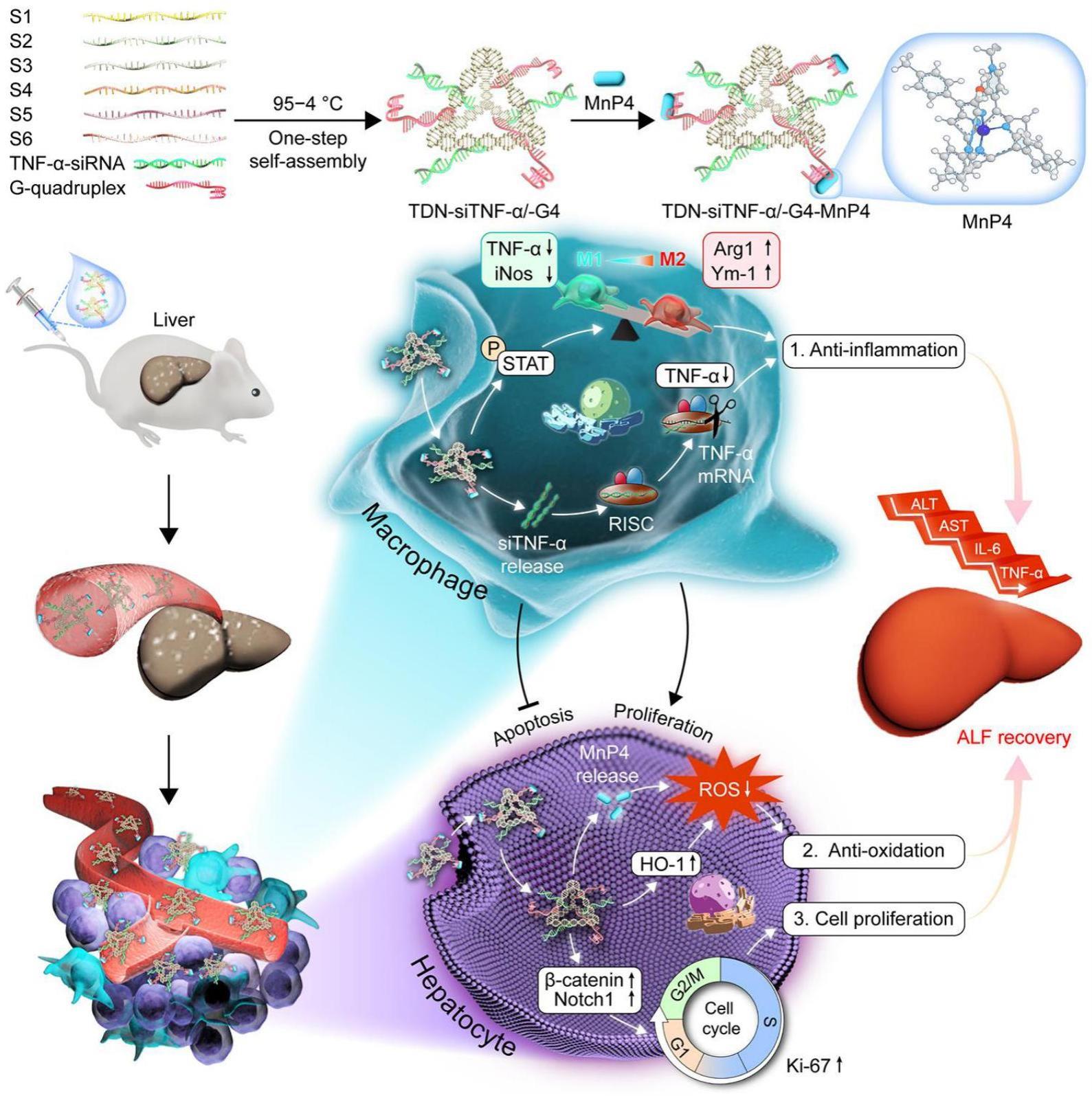
19、另一实施例中,所述核酸类药物选自tnf-αsirna、bcl-2sirna、p53 sirna、rex1sirna、apob1 sirna、ngf sirna、mdm2 sirna、akt2 sirna、raf反义寡核苷酸、plk1反义寡核苷酸或cpg dna中的一种或多种。
20、具体的,可以通过调控第一接头、第二接头、第三接头和第四接头的序列设计,可使得dna四面体携带不同的包括sirna在内的其他不同核酸类药物,包括tnf-αsirna用于肝衰竭抗炎治疗,bcl-2sirna靶向抗凋亡蛋白bcl2用于肺癌治疗,p53 sirna治疗急性肾衰竭,rex1 sirna调控干细胞神经分化,apob1 sirna治疗高胆固醇血症、ngf sirna治疗胰腺癌、mdm2 sirna治疗非小细胞肺癌、akt2 sirna治疗结肠直肠肝转移、raf反义寡核苷酸治疗恶性黑色素瘤、plk1反义寡核苷酸治疗原发性胃癌肿瘤,cpg dna调控免疫刺激活性等。可同时携带两种或多种不同药物扩大治疗疾病的范围,也可通过设计运载不同药物同时治疗两种不同的疾病。
21、另一实施例中,所述化学药物选自抗氧化剂、抗生素药物、抗肿瘤药物或光敏剂中的一种或多种。
22、另一实施例中,所述tnf-α-sirna具有seq id no.8所示核苷酸序列。
23、另一实施例中,所述抗氧化剂选自阴离子化合物锰卟啉、铁卟啉、维生素c、n-乙酰半胱氨酸中的一种或多种;所述抗生素药物选自阿霉素、米托蒽醌、柔红霉素、表阿霉素、表柔比星、吡柔比星、卡柔比星中的一种或多种;所述抗肿瘤药物选自替莫唑胺、5-氟尿嘧啶(5-fu)、紫杉醇、喜树碱、铂类药物中的一种或多种;所述光敏剂选自二氢卟吩e6(ce6)、5,10,15,20-四(1-甲基-4-吡啶)卟啉四(对甲苯磺酸)(tmpyp4)、原卟啉ix(pix)中的一种或多种。
24、具体的,dna四面体除了可携带特异的阴离子化合物卟啉类药物,也可以携带其他药物,例如:抗氧化剂维生素c、n-乙酰半胱氨酸可有效通过共价连接与dna四面体结合。抗生素药物阿霉素可以通过醌环平面嵌插到dna的gc-cg碱基对之间;米托蒽醌从小沟方向插入到dna分子中,对5'-cg碱基对有特异性识别作用;柔红霉素、表阿霉素、表柔比星、吡柔比星、卡柔比星等可通过嵌插作用结合到dna上。抗肿瘤药物替莫唑胺通过静电吸附与dna四面体结合;铂类药物可通过嵌插作用结合到dna上;5-氟尿嘧啶、紫杉醇、喜树碱等可与dna结构通过共价连接。光敏剂二氢卟吩e6可通过共价连接与dna结构结合,tmpyp4、pix可通过嵌插作用直接与dna结合。携带不同药物可治疗不同的疾病。
25、具体的,所述dna四面体纳米递送系统利用g-四链体(g4-dna)通过π-π堆积作用携带阴离子化合物锰卟啉(mnp4)。六条dna单链通过互补配对,自组装形成dna四面体结构,并通过互补配对携带核酸类药物(如短干扰rna功能核酸序列tnf-α-sirna),增强核酸类药物的体内稳定性,并实现其特定器官靶向性递送。
26、另一实施例中,所述dna四面体药物还包括荧光染料,所述荧光染料修饰在所述单链dna上。
27、另一实施例中,所述荧光染料选自fam、cy5、cy7、alexa fluor 488、amca、cy3、cy5.5、quasar 670、tamra和texas red中的一种或多种。
28、具体的,所述荧光染料可修饰在一条或多条所述单链dna上。
29、本技术第三方面提供了所述的dna四面体药物的制备方法,其特征在于,包括以下步骤:
30、步骤1、将单链dna、g-四链体和核酸类药物在缓冲液中混合加热进行退火,得到反应物;
31、步骤2、将所述反应物与化学药物混合反应,得到dna四面体药物。
32、另一实施例中,所述单链dna、所述g-四链体和所述核酸类药物的摩尔比为1:3:3;所述化学药物的添加浓度为50μm。
33、具体的,所述单链dna、所述g-四链体和所述核酸类药物的质量比为1:3:3。
34、具体的,所述单链dna(seq id no.1~seq id no.6的浓度之和)终浓度为200nm。seq id no.1、seq id no.2、seq id no.3、seq id no.4、seq id no.5、seq id no.6为相同浓度,等体积混合。
35、具体的,所述缓冲液为退火缓冲液tm buffer(10mm tris,5mm mgcl2,ph 8.0)。
36、具体的,所述化学药物为阴离子化合物锰卟啉,所述锰卟啉的添加浓度为20μm。
37、另一实施例中,步骤1中,所述退火的温度为95℃,所述退火的时间为5min;步骤2中,所述混合反应的温度为25℃,所述混合反应的时间为1h。
38、具体的,步骤1中,所述退火的温度为95℃,所述退火的时间为5min;步骤2中,所述混合反应的温度为25℃,所述混合反应的时间为1h。
39、本技术第四方面公开了所述dna四面体药物在制备肝脏疾病治疗中的应用;所述核酸类药物为tnf-α-sirna,所述化学药物为阴离子化合物锰卟啉。
40、本技术通过六条dna单链形成dna四面体,可作为药物载体,然后通过碱基互补配对可在该dna四面体上连接核酸类药物,同时可通过正负电荷吸引、静电吸附、共价连接、物理空间嵌插等方式将化学药物负载到该dna四面体上,从而获得同时负载有核酸类药物和化学药物的dna四面体药物,本技术的dna四面体药物直接通过被动靶向,特异性富集在特定器官,这将有助于提高各种器官类疾病的精准治疗,降低对正常组织细胞的伤害,提高治疗安全性;dna四面体起到运载药物的作用,本技术的dna四面体与其他常见金属纳米材料和高分子聚合物纳米材料相比,具有良好的生物相容性和生物可降解性,自身对人体无毒性,可看作生物内源性纳米颗粒,其在体内最终被降解成核苷酸,然后进入核苷酸循环被重新吸收利用。此外,相比于传统的单一治疗方法,本技术的dna四面体可运载多种不同的核酸类药物和化学药物,可同时进行不同的治疗,促进了不同疾病的多模式联合或协同治疗,可以弥补单一治疗方法的不足。而且,本技术的dna四面体药物具有合成简单快速,分子特性识别及灵活可编程等特性。
- 还没有人留言评论。精彩留言会获得点赞!