用于治疗痴呆中的激越行为的包含右美沙芬化合物和奎尼丁的药物组合物的制作方法
本发明涉及与中枢神经系统(cns)障碍诸如阿尔茨海默症相关的行为障碍诸如激越行为(agitation)和/或攻击行为和/或相关症状的治疗。与本发明相关的方法包括对于患有中枢神经系统(cns)障碍诸如阿尔茨海默症中激越行为和/或攻击行为和/或相关症状的受试者,单独给药右美沙芬化合物或给药右美沙芬化合物和cyp2d6抑制剂诸如奎尼丁(q)的组合。本发明还涉及药物组合,其包含单独的右美沙芬化合物或右美沙芬化合物与cyp2d6抑制剂诸如奎尼丁(q)的组合。
背景技术:
1、阿尔茨海默症是一种进行性神经变性疾病,最终会导致死亡。据估计,有540万名美国人患有阿尔茨海默症。自1980年以来,该数据已增加了一倍;预计到2050年,患病人数将高达1600万(brookmeyer等人,alzheimers dement.2011;7(1):61-73)。在美国65岁以上的成年人当中,痴呆的患病率估计为5%至15%,而阿尔茨海默症为痴呆中最常见的类型(kaplan and sadock’ssynopsis of psychiatry:behavioral sciences,1998;evans等人,jama.1989;262(18):2551-6;losonczy等人,public health reports.,1998;113:273-80)。
2、广泛认为激越行为是阿尔茨海默症及其他形式的痴呆的常见和重要的临床特征(ballard cg等人,nat rev neurol.2009;5(5):245-255)。虽然临床医师与护理人员可容易辨识出痴呆中激越行为,但是直到最近才由国际老年精神病学学会(ipa)的激越行为定义工作小组(adwg)拟定出一个共识定义,其判定标准如下:“1)发生在患有认知缺损或痴呆综合征的患者中;2)所表现出的行为与情绪困扰相符;3)表现出过度的动作活动、言语或人身攻击行为;及4)导致过度障碍从而损害了关系和/或日常活动、且并非完全归因于另一种障碍(精神病学、医学或精神活性物质相关的障碍)的明显行为”(cummings j等人,int.psychogeriatr.2014:1-11)。估计高达约80%的痴呆患者受到激越行为和/或攻击行为的影响(ryu s-h等人,am j geriatr psychiatry.2005;13(11):976-983;tractenbergre等人,j geriatr psychiatry neurol.2003;16(2):94-99),并且患病率随着病情的进展而升高。
3、痴呆患者的激越行为伴随着下列各者:功能障碍增加(rabins p v等人,alzheimer’s dement.2013;9(2):204-207);生活品质更差(gonzález-salvador t等人,int j geriatr psychiatry.2000;15(2):181-189);更早被病院安置(steele c等人,am jpsychiatry.1990;147(8):1049-1051);增加护理者的负担(rabins pv等人,alzheimer’sdement.2013;9(2):204-207);增加医疗费用(murman dl等人,neurology.2002;59(11):1721-1729);发展成重度痴呆所需的时间更短(peters me等人,am j geriatrpsychiatry.2014;22(3):s65-s66);及加速死亡(peters me等人,am j geriatrpsychiatry.2014;22(3):s65-s66)。鉴于这些原因,激越行为与攻击行为是阿尔茨海默症患者最可能需要药物介入的神经精神病学症状(ballard cg等人,nat rev neurol.2009;5(5):245-255)。
4、然而,目前并无fda批准的用于治疗阿尔茨海默症中激越行为的药物,而临床医师最终仅能借助于抗精神病药物、镇静剂/安眠药、抗焦虑药物、抗抑郁剂的脱靶(off-target)用途,以试图控制症状(maher ar等人jama.2011;306(12):1359-1369)。不幸地,这些治疗的效用有限,仅有的小幅疗效也因着相对较差的依从性、安全性与耐受性而被抵消(ballard cg等人,nat rev neurol.2009;5(5):245-255;schneider ls等人,n engl jmed.2006;355(15):1525-1538;huybrechts kf等人,bmj 2012;344:e977)。因而,急迫需要研发用于治疗痴呆中激越行为的安全又有效的药物介入。该项治疗可对于患者护理有深远的影响,减轻护理者的负担,并潜在地改善总体的疾病预后。
5、因为尚无美国食品药物管理局(fda)批准的用于阿尔茨海默症相关行为症状的治疗方法,一直以来普遍通过脱靶使用抗精神病药物处方来治疗诸如攻击行为与激越行为的症状(salzman等人,j.clin.psychiatry.2008;69(6):889-98;levenson and crecelius,amda:publications-caring for the ages.,2003;4(6):31,34-35)。非典型抗精神病药物的短期治疗(6至12周)对于攻击行为具有小幅效果,但较长期治疗的效益有限,因为不良反应往往抵消了潜在疗效(scheider等人,n.engl.j.med.2006;355(15):1525-38)。对于诸如激越行为的其他症状的效益则较不明确(sultzer等人,am.j.psychiatry.2008;165(7):844-54)。此外,使用抗精神病药物引发严重不良结果的可能性亦受到严重关切,包括引发中风与死亡率升高(hybrechts等人,bmj.2012;344:e977)。也研究了非抗精神病的精神科用药在缓解症状与作为二级预防方面的用途,但其成效甚微(tariot等人,arch.gen.psychiatry.2011;68(8):853-61)。因此,势必需要仔细考量用于治疗阿尔茨海默症患者的激越行为与攻击行为的其他药理与非药理方法(ballard等人,curr.opin.psychiatry.2009;22(6):532-40;lyketsos等人,the journal of alzheimer’s association.2011;7(5):532-9)。
6、右美沙芬是(+)-3-甲氧基-n-甲基吗啡喃的通用名称。其为吗啡样阿片类物质的右旋类似物的分子类型中的一者。已知右美沙芬具有影响中枢神经系统神经元的至少三种不同的受体活性。虽然右美沙芬的药理性质指向针对数种适应症的临床疗效,但当单独给药右美沙芬时,其疗效相较于安慰剂而言是令人失望的。
7、长久以来,已知在大多数人(估计涵盖约90%的美国总人口)的体内,右美沙芬在肝脏进行大规模的o-去甲基作用而成为右啡烷,右啡烷则经cyp2d6催化并被迅速排出体外(ramachander等人,j.pharm.sci.1977;66(7):1047-8;和vetticaden等人,pharm.res.1989;6(1):13-9)。cyp2d6为以高浓度存在于肝脏中的氧化酶类型中的一员,并被称作细胞色素p450酶(kronbach等人,anal.biochem.1987;162(1):24-32;和dayer等人,clin.pharmacol.ther.1989;45(1):34-40)。
8、除了代谢右美沙芬外,cyp2d6亦负责人类体内的多态性异喹胍羟化作用(schmid等人,clin.pharmacol.ther.1985;38:618-624)。一替代途径主要由cyp3a4与n-去甲基作用介导而形成3-甲氧基吗啡喃(von moltke等人,j.pharm.pharmacol.,1998;50:997-1004)。右啡烷与3-甲氧基吗啡喃皆可进一步去甲基成为3-羟基吗啡喃,3-羟基吗啡喃然后进行葡萄苷酸化作用。在大多数人的体内,将右美沙芬转化为右啡烷的途径是主要代谢途径,这也是使用右美沙芬作为探针而将个体分成cyp2d6泛代谢者与不良代谢者表现型的背后的原理(kupfer等人,lancet.1984;2:517-518;guttendorf等人,ther.drugmonit.1988;10:490-498)。约有7%的白种人显现不良代谢者的表型,而在华人与非洲黑人中的不良代谢者表型的发生率还要更低(droll等人,pharmacogenetics.1998;8:325-333)。在检测右美沙芬在泛代谢者与不良代谢者中增加疼痛阈值的能力的一项研究中发现,右美沙芬的镇痛效应在不良代谢者中显著,但在泛代谢者中不显著(desmeules等人,j.pharmacol.exp.ther.1999;288:607-612)。这些结果与母体右美沙芬(而非右啡烷代谢物)对于神经调节作用的直接效应相符。
技术实现思路
1、如上所述,针对阿尔茨海默症患者的激越行为、攻击行为和/或相关症状,仍迫切需要其他或改进形式的治疗。本发明提供治疗阿尔茨海默症患者的激越行为和/或攻击行为和/或相关症状的方法,且不增加严重不良反应的风险。
2、本发明的第一方面提供用于治疗痴呆受试者的激越行为和/或攻击行为和/或相关症状的方法,其通过给药与cyp2d6抑制剂诸如奎尼丁(q)组合的右美沙芬化合物。本发明亦涵盖在所述方法中使用右美沙芬化合物与奎尼丁中任一者或二者的药学上可接受的盐类。亦可在本发明所述的方法中使用奎尼丁的类似物或衍生物。在一个实施方案中,该痴呆为阿尔茨海默症类型的痴呆。
3、本发明的第二方面涉及右美沙芬化合物与cyp2d6抑制剂诸如奎尼丁的组合。本发明亦涵盖在所述组合中使用右美沙芬化合物与奎尼丁中任一者或二者的药学上可接受的盐类。该组合可用于治疗痴呆受试者的激越行为和/或攻击行为和/或相关症状。在该组合中亦可使用奎尼丁的类似物或衍生物。在一个实施方案中,该痴呆为阿尔茨海默症类型的痴呆。
4、在一些实施方案中,依据本发明的第一与第二方面,右美沙芬化合物的给药量或用量为每天约10mg至每天约200mg,而奎尼丁的给药量或用量为每天约0.05mg至每天少于约50mg。
5、在一些实施方案中,奎尼丁的给药量或用量为每天约4.75mg至每天约20mg。在一些实施方案中,右美沙芬化合物的给药量或用量为每天约10mg至每天约90mg。
6、在一些实施方案中,奎尼丁和右美沙芬化合物中任一者或二者为药学上可接受的盐的形式。根据本发明的药学上可接受的盐包括碱金属盐、锂盐、钠盐、钾盐、碱土金属盐、钙盐、镁盐、赖氨酸盐、n,n’二苄基乙二胺盐、氯普鲁卡因盐、胆碱盐、二乙醇胺盐、乙二胺盐、葡甲胺盐、普鲁卡因盐、tris盐、游离酸的盐、游离碱的盐、无机盐、硫酸盐、盐酸盐和氢溴酸盐。在一些实施方案中,该右美沙芬化合物为右美沙芬氢溴酸盐或氘化右美沙芬氢溴酸盐的形式。在一些实施方案中,奎尼丁为硫酸奎尼丁的形式。
7、在一些实施方案中,右美沙芬化合物和奎尼丁以单位剂型给药或使用。在一些实施方案中,该单位剂型包含约4.75mg、4.9mg、9mg、或10mg奎尼丁(例如、硫酸奎尼丁)和约45mg、34mg、30mg、28mg、24mg、23mg、20mg、18mg、15mg、或10mg右美沙芬化合物(例如,氘化右美沙芬氢溴酸盐或右美沙芬氢溴酸盐)。在一个实施方案中,该单位剂型包含约10mg奎尼丁(例如,硫酸奎尼丁)和约20mg或30mg右美沙芬化合物(例如,右美沙芬氢溴酸盐或氘化右美沙芬氢溴酸盐)。在另一实施方案中,该单位剂型包含约9mg奎尼丁(例如,硫酸奎尼丁)和约15mg或23mg右美沙芬化合物(例如,右美沙芬氢溴酸盐或氘化右美沙芬氢溴酸盐)。在另一实施方案中,该单位剂型包含约4.9mg奎尼丁(例如,硫酸奎尼丁)和约18mg、24mg、28mg、30mg、或34mg右美沙芬化合物(例如,右美沙芬氢溴酸盐或氘化右美沙芬氢溴酸盐)。在另一实施方案中,该单位剂型包含约4.75mg奎尼丁(例如,硫酸奎尼丁)和约18mg、24mg、28mg、30mg、或34mg右美沙芬化合物(例如,右美沙芬氢溴酸盐或氘化右美沙芬氢溴酸盐)。在一些实施方案中,右美沙芬化合物和奎尼丁的单位剂型为片剂或胶囊的形式。
8、在一些实施方案中,右美沙芬化合物和奎尼丁以组合的剂量或独立剂量给药或使用,其中右美沙芬化合物与奎尼丁的重量比为约1:1或更少。在一些实施方案中,该重量比为约1:1、1:0.95、1:0.9、1:0.85、1:0.8、1:0.75、1:0.7、1:0.65、1:0.6、1:0.55或1:0.5或更少。同样,在某些实施方案中,所述剂量具有的右美沙芬化合物与奎尼丁的重量比小于约1:0.5,例如,约1:0.45、1:0.4、1:0.35、1:0.3、1:0.25、1:0.2、1:0.15、或1:0.1、1:0.09、1:0.08、1:0.07、1:0.06、1:0.05、1:0.04、1:0.03、1:0.02、或1:0.01或更少。该重量比可为例如、约1:0.75、约1:0.68、约1:0.6、约1:0.56、约1:0.5、约1:0.44、约1:0.39、约1:0.38、约1:0.31、约1:0.30、约1:0.29、约1:0.28、约1:0.27、约1:0.26、约1:0.25、约1:0.24、约1:0.23、约1:0.22、约1:0.21、约1:0.20、约1:0.19、约1:0.18、约1:0.17、1:0.16、约1:0.15、约1:0.14、约1:0.13、约1:0.12、约1:0.11和约1:0.10。在一些实施方案中、右美沙芬游离碱与奎尼丁游离碱的重量比为约1:0.68、约1:0.56、约1:0.44、约1:0.38。在某些其它实施方案中、d6-氘化右美沙芬的游离碱与奎尼丁游离碱的重量比为约1:0.30、约1:0.22、约1:0.19、约1:0.18、约1:0.16和约1:0.15。
9、该右美沙芬化合物和奎尼丁可以每天一份组合剂量或以每天至少两份组合剂量给药或使用。在一个实施方案中该右美沙芬化合物和奎尼丁联合给药。
10、在一些实施方案中,通过使用与奎尼丁组合的右美沙芬化合物进行治疗而在阿尔茨海默症受试者的激越行为和/或攻击行为和/或相关症状中所获的改善,可通过下列一或多项评分的改善而予以测量:
11、·神经精神症状问卷(npi)的激越行为/攻击行为领域;
12、·npi总评分;
13、·npi激越行为/攻击行为、易怒性/不稳定性、异常的动作行为及焦虑领域的综合评分(npi4a);
14、·npi激越行为/攻击行为、易怒性/不稳定性、异常的动作行为及去抑制作用领域的综合评分(npi4d);
15、·npi护理者的困扰-激越行为/攻击行为领域;
16、·修正型阿尔茨海默症合作研究-对于激越行为的临床总体印象改变(adcs-cgic)评分;和/或
17、·对于激越行为的患者总体印象改变(pgi-c)评分。
18、在一个实施方案中,相比于未治疗的受试者或给药安慰剂的受试者,受试者的激越行为/攻击行为npi评分减少至少1.5。
19、在一个实施方案中,相比于未治疗的受试者或给药安慰剂的受试者,受试者的np14a评分减少至少2.4。
20、在一个实施方案中,相比于未治疗的受试者或给药安慰剂的受试者,受试者的np14d评分减少至少3.0。
21、在一个实施方案中,相比于未治疗的受试者或给药安慰剂的受试者,受试者的激越行为的adcs-cgic评分改善至少0.5。
22、在一个实施方案中,相比于未治疗的受试者或给药安慰剂的受试者,受试者的激越行为的pgi-c评分改善至少0.6。
23、本文公开的药物制剂可任选地包括药学上可接受的载体、佐剂、填料或其他药物组合物,且可依本领域所知的多种形式或途径中的任一者给药。
24、本文公开的方法亦可任选地包括连同其他治疗剂一起给药右美沙芬化合物与cyp2d6抑制剂诸如奎尼丁,所述其他治疗剂诸如例如已知或鉴定用于治疗阿尔茨海默症的一或多种治疗剂。
25、应该理解前述的一般说明与如下的详细说明仅为例示性与说明性,其意欲提供本发明的进一步的非限制性说明。
26、附图简述
27、图1显示本发明的右美沙芬化合物的一种实施方案,即,d6-氘-修饰的右美沙芬的化学结构。
28、图2提供阿尔茨海默症中激越行为的临床研究的研究设计。“右美沙芬/奎尼丁20/10”是指20mg的右美沙芬与10mg的奎尼丁的剂量。qd与bhd分别指每天一次与每天二次的剂量。星号(*)表示参与者在第1周访问前即中止,因此并无可用于主要疗效终点的任何基线后数据。
29、图3提供本技术所述的阿尔茨海默症中激越行为临床研究的报告试验的统一标准(consort)患者流程图的示意图。标示有的群体代表被包括在连续平行比较设计(spcd)中的那些。
30、图4说明本技术所述的阿尔茨海默症中激越行为临床研究所包括的受试者在第一阶段中的平均npi激越行为/攻击行为评分,其采用连续平行比较设计(或spcd)。示出了各次访问的p值,其从分析协方差(ancova)模型(以治疗为固定效应且以基线为协变量)计算而得。a=所观察的情况。
31、图5说明阿尔茨海默症中激越行为临床研究(采用spcd)所包括的受试者在第二阶段中的平均npi激越行为/攻击行为评分。示出各次访问的p值,其从ancova模型(以治疗为固定效应且以基线为协变量)计算而得。a=所观察的情况。
32、图6说明在本技术所述的阿尔茨海默症中激越行为临床研究的10周的次级分析中平均npi激越行为/攻击行为评分。为期10周的次级分析仅包括在研究期间一直被分配为相同治疗中的受试者,亦即在整个研究期间经随机分配仅接受右美沙芬/奎尼丁或仅接受安慰剂的受试者,从而模拟平行设计。示出各次访问的p值,其从ancova模型(以治疗为固定效应且以基线为协变量)计算而得。a=所观察的情况。
33、图7显示帕罗西汀与avp-786-第1组的治疗随时间的平均血浆浓度。
34、图8显示帕罗西汀与avp-786-第2组的治疗随时间的平均血浆浓度。
35、图9显示度洛西汀与avp-786-第3组的治疗随时间的平均血浆浓度。
36、图10显示度洛西汀与avp-786-第4组的治疗随时间的平均血浆浓度。
37、发明详述
38、下列详细说明与实施例说明本发明的某些实施方案。本技术领域的技术人员将认知到存在本发明的各种变化与修饰,其被包括在本发明范围内。因此,特定实施方案的说明不应被视为限制本发明的范围。
39、在本技术中所引述的所有参考文献,包括但不限于已公开与未公开的申请、专利及文献参考资料,皆在此完整地并入本案作为参考,及据此成为本说明书的一部分。
40、定义
41、“改善”与“治疗”等术语以可互换方式使用,且包括治疗性处理。该二术语是指改善、减少、抑制、减弱、减轻、遏制或稳定疾病(如本技术中所述的疾病或障碍)或疾病的单一症状或一群症状(如综合征)的发展或进行。在本技术中所用的“治疗”是指缓解或减轻受试者疾病的至少一种症状。例如,就行为障碍而言,“治疗”可指缓解或减轻激越行为和/或攻击行为和/或相关症状及其表现的任何组合(如击打、咒骂、捶打、踱步、抗拒等)和相关行为(如易怒性、焦虑等)。在本发明的含义的内,术语“治疗”亦表示遏止、延缓其发作(即疾病在临床表现前的期间),和/或降低疾病发生或恶化的风险。
42、“疾病”是指损害或干扰细胞、组织、器官或生物体的正常功能的任一病症或障碍。
43、术语“痴呆”是指归因于器官性或心理因素的总体心智退化;其特征在于定向力障碍;记忆力、判断力及智力受损;及情绪表浅而不稳定。本技术中的痴呆包括血管型痴呆、缺血性血管型痴呆(ivd)、额颞叶型痴呆(ftd)、路易氏体痴呆、阿尔茨海默氏痴呆等。最常见的痴呆形式系与阿尔茨海默症(ad)相关联。
44、“阿尔茨海默症(ad)”是指进行性心智退化,其表现出记忆丧失、混淆及定向力障碍,一般在晚年发病,及通常在5至10年间导致死亡。阿尔茨海默症可由熟练的神经科医师或临床医师诊断出来。在一个实施方案中,患有阿尔茨海默症的受试者将符合美国国家神经疾病与沟通障碍及中风研究所/阿尔茨海默症与相关疾病学会(nincds/adrda)针对推定存在阿尔茨海默症的标准。
45、术语“类似物”或“衍生物”在本技术中按常规的药学含义使用,指在结构上与基准分子(诸如右美沙芬、氘化右美沙芬或奎尼丁)类似的分子,但已依靶向和受控的方式用替代取代基代替该基准分子的一或多个特定取代基,以使得产生在结构上与该基准分子类似的分子。类似物的合成和筛选(如使用结构和/或生物化学分析)以鉴定可具有改进或偏移的特性(诸如效力较高和/或对于特定的靶向受体类型的选择性较高、穿透哺乳类动物的血脑屏障的能力较高、副作用较少等)的已知化合物的略作修饰的版本,是药学化学中众所周知的一种药物设计方法。此外,使用本领域技术人员所知的方法,可产生本发明的化合物的具有增进的治疗效力的类似物与衍生物,即具有较高的效力和/或对于特定的靶向受体类型的选择性较高、穿透哺乳类动物的血脑屏障的能力较高或较低(如较高或较低的血脑屏障渗透率)、较少的副作用、在受试者体内留存较久等。
46、如本发明中所用的术语“激越行为”是一总称,其可指一系列的行为失调或障碍,包括攻击行为、好斗及过动。就本发明的目的而言,该定义包括如下所述的激越行为:cummings等人international psychogeriatrics;volume27;issue 01;2015年1月,pp 7-17。广义上,cummings等人将激越行为定义为:1)发生在患有认知缺损或痴呆综合征的患者中;2)所表现出的行为与情绪困扰相符;3)表现出过度的动作活动、言语或人身攻击行为;及4)导致过度障碍且并非完全归因于另一种障碍(精神病学、医学或精神活性物质相关的)的明显行为。术语激越行为还包括:
47、1)与内心的紧张感相关联的过度的动作活动。该活动通常是无益及重复性的,且由诸如无法坐着不动、踱步、拧扭双手及拉扯衣服的行为所组成;
48、2)无法就需求或混乱(confusion)本身来解释的不适当的言语、声音或动作活动。包括诸如漫无目的游荡、踱步、咒骂、尖叫、咬及打斗的行为;
49、3)在一特定环境中的具有破坏性、不安全或干扰护理进行的声音或动作行为。其包括四种行为领域,如发出声音、动作失调、攻击性及抗拒护理;
50、4)让他人得知该个体正经历不愉快的激动状态及在介入减少内在与外在刺激后仍维持不变的这些行为,介入性治疗处置包括处理抗拒情况、缓解令人厌恶的身体征象、减少所积累压力的来源;及
51、5)该个体拒绝合作、不让人帮忙或者难以处理的行为。
52、如本技术所用的术语“相关症状”是指与患者相关联的症状,而该患者符合认知缺损或痴呆综合征(如阿尔茨海默症、额颞叶型痴呆、路易氏体痴呆、血管型痴呆、其他痴呆、一种前痴呆认知缺损综合征诸如轻微认知缺损或其他认知性障碍)的标准。相关症状例如包括与所观察到或推断的情绪困扰的证据(如情绪的快速变化、易怒、脾气爆发)相关的行为。在一些情况下,该行为在至少为期两周的期间是持续性或经常复发的,且代表不同于患者平时的行为。术语“相关症状”还包括过度的动作活动(实例包括:踱步、来回摆动、做手势、指指点点、烦躁不安、进行重复性举止);言语攻击(如大呼小叫、用过大的声音说话、骂脏话、尖叫、呼喊);人身攻击(如抓取、推挤、推、抗拒、击打别人、踢物体或人、抓伤、咬、投掷物体、击打自己、摔门、撕东西和毁坏财物)。
53、在涉及活性成分时所用的术语“组合”在本技术中用于限定单一药物组合物(制剂),其包含本发明的二种药物(即右美沙芬化合物与奎尼丁),或用于限定待联合给药的二种独立的药物组合物(制剂),其各包含本发明的一种药物(即右美沙芬化合物或奎尼丁)。
54、在本发明的含义内,术语“联合给药”系用于指右美沙芬化合物与奎尼丁在一种组合物中的同时给药,或在不同组合物中的同时给药,或相继给药。对于被视为“联合给药”的相继给药,右美沙芬化合物与奎尼丁需间隔一段时间给药,使得在受试者中产生针对中枢神经系统(cns)障碍的相关行为障碍产生治疗、预防、遏止、延缓其发作和/或降低其恶化风险的有益效应。例如在一些实施方案中,右美沙芬化合物与奎尼丁在同一天给药(如每天各给药一次或二次)。
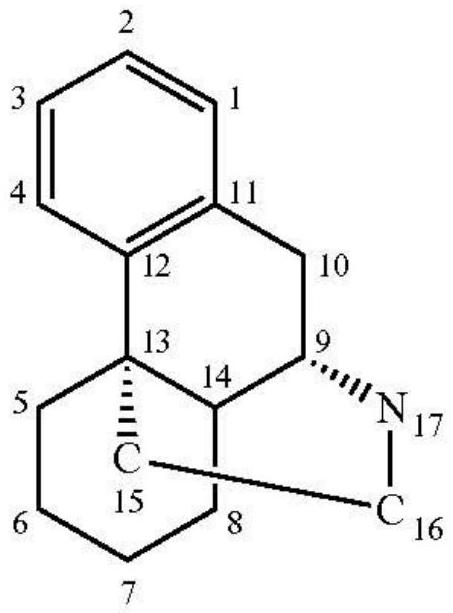
55、如本文所述,总npi评分为标准12项npi领域的综合评分。npi是在包括痴呆在内的多种疾病情况下用于评估精神病理学的一种经过验证的临床工具。npi为一种回顾性的护理者-被调查者访谈,其涵盖12项神经精神病学症状领域:妄想、幻觉、激越行为/攻击行为、烦躁/抑郁、焦虑、欣快症/兴高采烈、淡漠/漠不关心、去抑制化行为、易怒性/不稳定性、异常的动作行为、夜间行为失调及食欲/饮食失调。定稿的npi访谈包括针对各症状领域的综合筛选问题;当一个筛选问题引发阳性回应时,则有要接续提出的关乎领域特定行为的一系列问题。一种领域内的神经精神病学表现由护理者同时按频率(0至4)与严重性(1至3)进行评分,而获得各认定为阳性的领域的1至12的综合(频率x严重性)症状领域评分。已在频率与严重性评量表中限定了定位点,以提高护理者的回应的可信度。在通过评分0(毫不困扰)至5(极度困扰)所定位的量表上,就各阳性的神经精神病学症状领域来评定护理者的困扰分数。如本技术所用,npi4a评分为包含npi激越行为/攻击行为、异常的动作行为、易怒性/不稳定性及焦虑领域的综合评分。如本技术所用,npi4d评分为包含npi激越行为/攻击行为、异常的动作行为、易怒性/不稳定性及去抑制化行为领域的综合评分。
56、在论及剂量或量时所用的术语“治疗有效的”是指化合物或药物组合物的量,其在给药至有需要的受试者时足以产生所需活性。在本技术中,当术语“治疗有效量/剂量”用于包含右美沙芬化合物的药物组合物时,其可与术语“神经学上有效量/剂量”互换使用,且是指化合物或药物组合物的量/剂量,其足以产生有效的神经学反应,即在给药至受试者时改善与中枢神经系统障碍相关联的行为障碍。
57、与本发明的组合物结合使用的“药学上可接受的”一词,是指当给药至受试者(如人类)时,该组合物的分子实体及其他成分为生理上可耐受的,及通常不会产生不良反应。在一些实施方案中,“药学上可接受的”一词是指由联邦政府或州政府的主管机关批准,或指在美国药典或其他一般公认的药典中列为适用于哺乳类动物及尤其适用于人类。
58、用于本发明的药物组合物的术语“载体”,是指伴随活性化合物(如右美沙芬化合物或奎尼丁)给药的稀释剂、赋形剂或载剂。该药物载体可为无菌液体,诸如水、盐水溶液、右旋糖水溶液、甘油水溶液;及油类,包括那些来自石油、动物、植物或合成来源者,诸如花生油、大豆油、矿物油、芝麻油等。适宜的药物载体描述于e.w.martin的“remington'spharmaceutical sciences”的第18版中。
59、如本技术所用的术语“受试者”包括哺乳动物(如啮齿动物诸如小鼠或大鼠)。在一些实施方案中,该术语是指呈现与中枢神经系统障碍相关的行为障碍的人类,该障碍诸如激越行为和/或攻击行为。术语“受试者”亦包括呈现痴呆的神经精神病学症状或行为症状的人类。
60、应理解在所合成的化合物中存在天然同位素丰度的一些变化,其取决于合成中所用的化学原料来源。因而,右美沙芬的制剂将固有地含有少量的氘化和/或含13c的同位素体(isotopologue)。尽管存在该变化,相较于本发明的化合物的稳定的同位素取代程度,天然丰度的稳定氢与碳同位素的浓度是微小且无关紧要的。参见,例如,wada e等人,seikagaku1994,66:15;ganes l z等人,comp biochem physiol a mol integr physiol 1998,119:725。在本发明的化合物中,当一特定位置被指定具有氘时,应理解在该位置的氘丰度显著大于氘的天然丰度(一般约为0.015%)。在该化合物中指定为氘的各原子上,指定具有氘的位置通常具有至少为3000的最低同位素富集因子(掺入45%的氘)。
61、如本技术所用的术语“同位素富集因子”是指特定同位素的同位素丰度与天然丰度间的比率。
62、在其它实施方案中,本发明的化合物对各指定的氘原子具有的同位素富集因子为至少3500(在各指定氘原子处掺入52.5%氘),至少4000(掺入60%氘),至少4500(掺入67.5%氘),至少5000(掺入75%氘),至少5500(掺入82.5%氘),至少6000(掺入90%氘),至少6333.3(掺入95%氘),至少6466.7(掺入97%氘),至少6600(掺入99%氘),或至少6633.3(掺入99.5%氘)。
63、在本发明的化合物中,未特别指定为特定同位素的任何原子是指代表该原子的任何稳定同位素。除非另有说明,否则当一位置特别指定为“h”或“氢”时,应理解该位置所具有的氢为其天然丰度同位素组成。
64、术语“同位素体”是指,除了在一或多个位置的同位素组成之外(如氢相对于氘),其所具有的化学结构与化学式和本发明的特定化合物相同的物质。因而,同位素体与本发明的特定化合物的差异仅在于其同位素组成上。
65、如本技术所用的术语“化合物”意欲包括其任一盐类、溶剂化物或水合物。为了便于在本技术中使用,术语“右美沙芬化合物”将包括下列术语:右美沙芬;或氘化右美沙芬;或右美沙芬的类似物或衍生物;或氘化右美沙芬的类似物或衍生物。
66、通常,本发明的右美沙芬化合物在被称作“吗啡喃”结构的构型中具有四个分子环,其如下所示:
67、
68、在该图中,碳原子按常规方式编号,而与碳原子9及13偶联的楔形键表明这些键在吗啡喃结构中的其他三个环的平面上凸起。
69、在酸与该化合物的碱性基团诸如氨基官能团之间,或者在碱与该化合物的酸性基团诸如羧基官能团之间,形成本发明的化合物的盐。依据另一实施方案,该化合物为药学上可接受的酸加成盐。
70、通常用于形成药学上可接受的盐的酸包括无机酸,如氢二硫化物(hydrogenbisulfide)、盐酸、氢溴酸、氢碘酸、硫酸和磷酸,以及有机酸如对甲苯磺酸、水杨酸、酒石酸、酸式酒石酸(bitartaric acid)、抗坏血酸、马来酸、苯磺酸(besylic acid)、富马酸、葡糖酸、葡糖醛酸、甲酸、谷氨酸、甲磺酸、乙磺酸、苯磺酸、乳酸、草酸、对溴苯基磺酸、碳酸、琥珀酸、柠檬酸、苯甲酸和乙酸,以及相关无机和有机酸。该药学上可接受的盐因此包括硫酸盐、焦硫酸盐、硫酸氢盐、亚硫酸盐、亚硫酸氢盐、磷酸盐、磷酸一氢盐、磷酸二氢盐、偏磷酸盐、焦磷酸盐、氯化物、溴化物、碘化物、乙酸盐、丙酸盐、癸酸盐(decanoate)、辛酸盐、丙烯酸盐、甲酸盐、异丁酸盐、癸酸盐(caprate)、庚酸盐、丙炔酸盐、草酸盐、丙二酸盐、琥珀酸盐、辛二酸盐、癸二酸盐、富马酸盐、马来酸盐、丁炔-1,4-二酸盐、己炔-1,6-二酸盐、苯甲酸盐、氯苯甲酸盐、甲基苯甲酸盐、二硝基苯甲酸盐、羟基苯甲酸盐、甲氧基苯甲酸盐、邻苯二甲酸盐、对苯二甲酸盐、磺酸盐、二甲苯磺酸盐、苯基乙酸盐、苯基丙酸盐、苯基丁酸盐、柠檬酸盐、乳酸盐、β-羟基丁酸盐、羟乙酸盐、马来酸盐、酒石酸盐、甲磺酸盐、丙磺酸盐、萘-1-磺酸盐、萘-2-磺酸盐、扁桃酸盐及其他盐类。在一个实施方案中,药学上可接受的酸加成盐包括与矿物酸(如盐酸和氢溴酸)所形成的那些,且包括与有机酸如马来酸所形成的那些。
71、在一些实施方案中,药学上可接受的盐包括碱金属盐、锂盐、钠盐、钾盐、碱土金属盐、钙盐、镁盐、赖氨酸盐、n,n’二苄基乙二胺盐、氯普鲁卡因盐、胆碱盐、二乙醇胺盐、乙二胺盐、葡甲胺盐、普鲁卡因盐、tris盐、游离酸的盐、游离碱的盐、无机盐、硫酸盐、盐酸盐和氢溴酸盐。
72、除非另外指明,本技术中所述的剂量分别指右美沙芬化合物与奎尼丁的氢溴酸盐与硫酸盐的盐类形式。基于该信息,本领域技术人员可计算活性成分的各自游离酸或游离碱的对应剂量。本领域的技术人员可计算右美沙芬的盐类的分子量及右美沙芬的游离碱的分子量,及使用该比值计算游离碱以及盐类的适当剂量。例如可给药或使用剂量为15mg的右美沙芬氢溴酸盐(具有分子式c18h25no.hbr.h2o)及9mg的硫酸奎尼丁(具有分子式(c20h24n2o2)2.h2so4.2h2o),其对应于约11mg的右美沙芬与7.5mg的奎尼丁。其他剂量例如包括23mg的右美沙芬氢溴酸盐与9mg硫酸奎尼丁(对应于约17mg的右美沙芬与约7.5mg的奎尼丁);20mg的右美沙芬氢溴酸盐与10mg硫酸奎尼丁(对应于约15mg的右美沙芬与8.3mg的奎尼丁);30mg的右美沙芬氢溴酸盐与10mg硫酸奎尼丁(对应于约22mg的右美沙芬与8.3mg的奎尼丁)。
73、可给药剂量为24mg d6-氘化右美沙芬氢溴酸盐(具有分子式c18h19d6no.hbr.h2o)和4.75mg硫酸奎尼丁(具有分子式(c20h24n2o2)2.h2so4.2h2o)(对应于约18mg右美沙芬和3.96mg奎尼丁)。d6-氘化右美沙芬的其它剂量包括,例如,34mg d6-右美沙芬氢溴酸盐和4.75mg硫酸奎尼丁(对应于约25.18mg d6-右美沙芬和约3.96mg奎尼丁);18mg d6-右美沙芬氢溴酸盐和4.9mg硫酸奎尼丁(对应于约13.33mg d6-右美沙芬和4.08mg奎尼丁);24mgd6-右美沙芬氢溴酸盐和4.9mg硫酸奎尼丁(对应于约17.78mg d6-右美沙芬和4.08mg奎尼丁);28mg d6-右美沙芬氢溴酸盐和4.9mg硫酸奎尼丁(对应于约20.74mg d6-右美沙芬和4.08mg奎尼丁);30mg d6-右美沙芬氢溴酸盐和4.9mg硫酸奎尼丁(对应于约22.22mg d6-右美沙芬和4.08mg奎尼丁);34mg d6-右美沙芬氢溴酸盐和4.9mg硫酸奎尼丁(对应于约25.18mg d6-右美沙芬和4.08mg奎尼丁)。
74、如本文所述,术语“水合物”是指进一步包含通过非共价分子间力结合的化学计量或非化学计量的水的化合物。
75、如本文所述,术语“溶剂合物”是指进一步包含通过非共价分子间力结合的化学计量或非化学计量的溶剂(如水、丙酮、乙醇、甲醇、二氯甲烷、2-丙醇等)的化合物。
76、本发明的化合物(例如,下述式i化合物),可因为例如氘取代或其他原因,而含有一个非对称碳原子。因此,本发明的化合物能以单独对映异构体或二个对映异构体的混合物的形式存在。因此,本发明的化合物将包括外消旋混合物,也包括各个单独的立体异构体,其基本上不含另一种可能的立体异构体。如本技术所用的术语“基本上不含其他立体异构体”,是指所存在的其他立体异构体少于25%;在一些实施方案中,所存在的其他立体异构体少于10%;在一些实施方案中,所存在的其他立体异构体少于5%;及在一些实施方案中,所存在的其他立体异构体少于2%,或所存在的其他立体异构体系少于“x”%(其中x为0至100的数字且包括0与100在内)。获得或合成特定化合物的单独对映异构体的方法是本领域众所周知的,并且可根据实际情况而应用于最终化合物或起始原料或中间产物。
77、如本技术所用的术语“稳定化合物”所指的化合物,是具有的稳定性足以促成其制造,及在一段充分的时间内维持该化合物的完整性,使其适用于本技术所详述的目的(如配制成治疗用产品、用于生产治疗用化合物的中间体、可分离或可储存的中间化合物;用于治疗对于治疗剂有反应的疾病或病症)。
78、“d”是指氘。
79、“立体异构体”是指对映异构体和非对映异构体二者。
80、在本说明书中,变量可泛指(如“各r”)或可特指(如r1或r2)。除非另有说明,当变量为泛指时,其意欲包括该特定变量的所有具体实施方案。
81、如本技术所用的术语“包含”与“包括”、“含有”或“特征在于”同义,且为包容性或开放式的,及不排除其他未引述的元件或方法步骤。
82、应理解用于表达说明书中所用成分、反应条件等的量的所有数值,在所有情况下皆用术语“约”来修饰。因此,除非另外说明,本技术所记载的数值参数为近似值,其可依所需性质而变化。就最低限度而言,且并非试图在对于本技术主张优先权的任何申请中任何权利要求的范围上限制等同原则的施用,各数值参数的解释应鉴于有效数字的数目及常规的四舍五入法。
83、治疗化合物
84、右美沙芬(dm)为可待因类似物左啡诺的非阿片样物质d-异构体,且在过去约50年曾广泛作为非处方(otc)镇咳剂。右美沙芬的药理学复杂,对于数种不同的受体具有结合亲和力,而其主要活性针对中枢神经系统(cns)。右美沙芬因其作为弱的非竞争性n-甲基-d-天冬氨酸(nmda)受体拮抗剂的活性而众所周知(ki=1500nm),(tortella等人trendspharmacol sci.1989;10(12):501-7;chou yc等人,brain res.1999;821(2):516-9;netzer r等人,eur j pharmacol.1993;238(2-3):209-16;jaffe db等人,neuroscilett.1989;105(1-2):227-32),且具有抗谷氨酸兴奋性活性的相关潜力。右美沙芬还为有效的sigma-1激动剂(zhou gz等人,eur j pharmacol.1991;206(4):261-9;maurice t等人,brain res brain res rev.2001;37(1-3):116-32;cobos ej等人,currneuropharmacol.2008;6(4):344-66),(ki=200nm),且以高亲和力与5-羟色胺转运子结合(sert;ki=40nm)。虽然右美沙芬对于去甲肾上腺素运载体的亲和力仅为中等(ki=13μm),但其可有效抑制去甲肾上腺素的摄取(ki=240nm)(codd ee等人,j pharmacol expther.1995;274(3):1263-70)。右美沙芬为α3β4烟碱型乙酰胆碱受体的拮抗剂,据报导ic50值(产生50%抑制作用的浓度)为0.7μm(damaj等人,j pharmacol exp ther.2005;312(2):780-5)。
85、由于这些相互作用中的一种或多种的结果,右美沙芬降低钾刺激的谷氨酸释放作用(annels sj等人,brain res.1991;564(2):341-3),及调控单胺(5-羟色胺、去甲肾上腺素及多巴胺)神经传递作用(codd ee等人,j pharmacol exp ther.1995;274(3):1263-70;maurice t等人,pharmacol ther.2009;124(2):195-206;maurice t等人,progneuropsychopharmacol biol psychiatry.1997;21(1):69-102)。右美沙芬对于α3β4烟碱型乙酰胆碱受体的拮抗作用(damaj mi等人,j pharmacol exp ther.2005;312(2):780-5)可应用在一些中枢神经系统运动障碍和成瘾(silver aa等人,j am acad child adolescpsychiatry.2001;40(9):1103-10)。当单独给药时,右美沙芬先在肝脏中迅速代谢成为右啡烷(dx),造成生物利用度过低,因而限制中枢神经系统的暴露。虽然与右啡烷相互作用的一些受体与右美沙芬的相同,但对于关键受体的亲和力却不同,其迅速进行葡糖苷酸缀合作用,进而大幅阻止其穿越血脑屏障,因而降低所开剂量对于中枢神经系统的效应(churchj等人,eur j pharmacol.1985;111(2):185-90;franklin ph等人,mol pharmacol.1992;41(1):134-46)。
86、本发明提供式i的化合物,包括其药学上可接受的盐、溶剂合物和水合物:
87、
88、其中,r1选自ch3、ch2d、chd2和cd3;且r2选自ch3、ch2d、chd2和cd3。
89、所有具有至少一个氘的式i的化合物称为氘化右美沙芬。在一个实施方案中r1和r2都为cd3。该化合物也称为d6-右美沙芬或d6-dm。在另一实施方案中,r1和r2中只有一个为cd3。
90、在另一实施方案中,该化合物选自表1所示化合物的任一个。
91、表1:式i的示例性化合物
92、 化合物编号 <![cdata[r<sup>1</sup>]]> <![cdata[r<sup>2</sup>]]> 100 <![cdata[cd<sub>3</sub>]]> <![cdata[ch<sub>3</sub>]]> 101 <![cdata[cd<sub>3</sub>]]> <![cdata[cd<sub>3</sub>]]> 102 <![cdata[cd<sub>2</sub>h]]> <![cdata[cd<sub>3</sub>]]> 103 <![cdata[cd<sub>3</sub>]]> <![cdata[cd<sub>2</sub>h]]> 104 <![cdata[ch<sub>3</sub>]]> <![cdata[cd<sub>3</sub>]]> 105 <![cdata[ch<sub>2</sub>d]]> <![cdata[ch<sub>2</sub>d]]> 106 <![cdata[ch<sub>2</sub>d]]> <![cdata[cd<sub>3</sub>]]> 107 <![cdata[cd<sub>3</sub>]]> <![cdata[ch<sub>2</sub>d<!-- 12 -->]]> 108 <![cdata[ch<sub>3</sub>]]> <![cdata[ch<sub>3</sub>]]>
93、在另一组实施方案中,上述或下列任一实施方案中的未指定为氘的任何原子,以其天然同位素丰度存在。
94、在另一组的实施方案中,式i的化合物被分离或纯化,例如,所存在的式i的化合物纯度分别为所存在的式i的同位素体总量的至少50%重量(例如,至少55%,60%,65%,70%,75%,80%,85%,90%,95%,97%,98%,98.5%,99%,99.5%或99.9%)。因而,在一些实施方案中,包含式i的化合物的组合物可包括该化合物的同位素体的分布,条件是至少50重量%的同位素体为所述的化合物。
95、在一些实施方案中,式i的化合物中所指定具有氘的任一位置,在式i的化合物所指定位置具有至少45%(例如,至少52.5%,至少60%,至少67.5%,至少75%,至少82.5%,至少90%,至少95%,至少97%,至少99%,或至少99.5%)的最低氘掺入。因而,在一些实施方案中,包含式i的化合物的组合物可包括该化合物的同位素体的分布,条件是至少45%的同位素体在所指定位置包括氘。
96、在一些实施方案中,式i化合物“基本上不含”该化合物的其它同位素体,例如,存在少于50%、少于25%、少于10%、少于5%、少于2%、少于1%、或少于0.5%的其它同位素体。
97、普通的合成化学家即可轻易完成式i的化合物的合成。相关程序及中间体例如公开于kim h c等人,bioorg med chem lett 2001,11:1651和newman a h等人,j med chem1992,35:4135中。
98、可使用对应的氘化型及任选地其他含有同位素的试剂和/或中间体,或引用本领域已知用于将同位素原子引入化学结构中的标准合成方案,从而进行这些方法,以合成本技术所述的化合物。
99、氘化(d6)-右美沙芬(d6-dm)(图1)为右美沙芬的一种氘化同位素,其中用氘置换位于特定位置上的6个氢原子。氘为氢的一种稳定、非放射性同位素,且普遍存在于环境中,包括普遍存在于水中。在医学研究中经常使用稳定同位素,其在从新生儿到成人的各年龄层人的应用历史悠久。氘最常以示踪剂水平在pk与代谢研究中使用。相较于来自天然来源诸如水的每天暴露量,预计在氘化治疗性药物的长期给药期间的预期暴露水平亦相当低。例如,来自30mg剂量的d6-右美沙芬的暴露量估计约相当于20毫升(0.7盎司)的水。这是基于水中氘的天然丰度为0.0156%,及假设所摄取的所有d6-右美沙芬(mw=277.43)剂量将被代谢成为d3-右啡烷(d3-dx),且释出氘化水(mw=20.03)。后者的假设高估了所释出的氘化水量,但提供了关于所消耗氘的对比量的一个概念。
100、本发明者用氘化右美沙芬进行的药理学研究显示,氘化作用并未改变右美沙芬的基础药理学。pk与药物代谢研究指出,d6-右美沙芬的代谢途径与右美沙芬相同。通过氘的取代作用,最容易让通过cyp2d6的代谢作用受到抑制。体外代谢研究亦指出,d6-右美沙芬与右美沙芬(通过不同物种,包括人)的代谢作用产生相同的代谢物,即相较于右美沙芬,并未辨识出d6-右美沙芬产生任何独特的代谢物。组织分布研究显示,来自14c-标记的d6-右美沙芬(14c-d6-dm)与来自14c-标记的右美沙芬(14c-dm)的放射性标记的分布类似。使用d6-右美沙芬进行的毒理学研究显示,在相当的暴露下,d6-右美沙芬与右美沙芬的剂量限制性毒性(dlt)是相当的,且是基于与中枢神经系统效应相关联的不良临床体征的。在使用d6-右美沙芬/奎尼丁进行的一项为期13周的毒性研究中(该研究包括高剂量的右美沙芬/奎尼丁以供比较),所评估的毒性测量显示d6-右美沙芬/奎尼丁与非氘化右美沙芬/奎尼丁所得的研究结果相似。
101、示例性合成
102、一种方便的合成式i化合物的方法替代了制备右美沙芬中使用的合成方法中的适当合适的氘化中间体和试剂。这些方法描述于例如,美国专利号7,973,049,其以其整体在此引入作为参考。式i的化合物可从以下所示的已知中间体x、xi和xii之一制备,且可从可易于由已知步骤得到的相关中间体制备。
103、
104、方案1显示式i化合物的通用路径。
105、
106、
107、方案1显示制备其中r1不为ch3的式i化合物的通用途径。将hbr盐10,在用nh4oh处理后,进行n-脱甲基化以得到11。使用氯甲酸乙酯将胺11酰化以提供氨基甲酸酯12,其然后使用bbr3进行o-脱甲基化以得到醇13。在碱的存在下,用适当氘化的碘甲烷处理化合物13,以得到醚14,其使用氘化铝锂(lad)还原以得到其中r2═cd3的式i化合物,或使用氢化铝锂(lah)还原以得到其中r2═ch3的化合物。对于其中r1为ch3的化合物,氨基甲酸酯12直接用lad处理以制备其中r2为cd3的化合物。
108、如上所示的特定方法与化合物并非旨在限制。本文的方案中的化学结构所描述的变量,在此限定为与本技术的化合物化学式中对应位置的化学基团定义(部分、原子等)相称,不论是否标识为相同的变量名称(即r1或r2)与否。化合物结构中化学基团用于合成另一化合物的适宜性,落在本领域技术人员的知识范围内。
109、合成式i的化合物及它们的合成前体的其他方法,包括在本技术的方案中未明确显示的途径中的那些,属于本领域中一般技术的化学家的手段之内。适于合成可适用化合物的合成化学转化及保护基团方法(保护与去保护作用)是本领域已知的,且例如包括下列各者所述者:larock r,comprehensive organic transformations,vch publishers(1989);greene t w等人,protective groups in organic synthesis,3rded.,john wileyand sons(1999);fieser l等人,fieser and fieser's reagents for organicsynthesis,john wiley and sons(1994);和paquette l,ed.,encyclopedia of reagentsfor organic synthesis,john wiley and sons(1995);及它们的后续版本。
110、本发明所设想的取代基与变量的组合,是导致形成稳定化合物的那些。
111、氘化右美沙芬和右美沙芬的类似物或衍生物
112、应理解本发明的方法和组合中使用的右美沙芬化合物包括右美沙芬和氘化右美沙芬二者的类似物或衍生物。例如,在一个实施方案中,根据本发明的组合或方法包括氘化右美沙芬,且在另一实施方案中,该组合和方法包括氘化右美沙芬的类似物或衍生物。类似的,在另一实施方案中,根据本发明的组合或方法包括右美沙芬,且在另一实施方案中,该组合或方法包括右美沙芬的类似物或衍生物。
113、术语“烷基”,如本文所述,是指任何无支链或支链、取代或未取代的饱和烃。烷基部分可为支链或直链。烷基可具有1至10个碳原子(每当在本技术中出现时,诸如“1至10”的数值范围是指所给定范围内的各整数;例如,“1至10个碳原子”是指该烷基可由1个碳原子、2个碳原子、3个碳原子等所组成,至多且包括由10个碳原子组成,但是本定义亦涵盖未指定数值范围的术语“烷基”)。
114、术语“取代的”具有其通常含义,如见于相关领域的众多现代专利中。参见,例如,美国专利no.6,509,331;6,506,787;6,500,825;5,922,683;5,886,210;5,874,443;和6,350,759;其均以其整体在此引入作为参考。具体地,“取代的”的定义与美国专利号6,509,331所提供的一样宽泛,其所限定的术语“取代的烷基”是指烷基,其在一些实施方案中具有1至10个碳原子及其中具有1至5个取代基,且在一些实施方案中具有1至3个取代基,所述取代基选自烷氧基、取代的烷氧基、环烷基、取代的环烷基、环烯基、取代的环烯基、酰基、酰基氨基、酰氧基、氨基、取代的氨基、氨基酰基、氨基酰氧基、氧基酰基氨基、氰基、卤素、羟基、羧基、羧基烷基、酮基、硫酮基、巯基、硫代烷氧基、取代的硫代烷氧基、芳基、芳基氧基、杂芳基、杂芳基氧基、杂环基、杂环基氧基、羟基氨基、烷氧基氨基、硝基、-so-烷基、-so-取代的烷基、-so-芳基、-so-杂芳基、-so2-烷基、-so2-取代的烷基、-so2-芳基和-so2-杂芳基。如上所列的其他专利也提供术语“取代的”的标准定义,其是本领域技术人员所充分理解的。
115、术语“环烷基”是指任何非芳族烃环,在一些实施方案中,该环具有5至12个组成环的原子。术语“杂环”或“杂环的”是指任何非芳族烃环,其中在该环中具有至少一个杂原子如氧、硫或氮原子以及至少一个碳原子。
116、如本技术所用的术语“烯基”,是指在二个碳之间含有双键的任何无支链或支链、取代或未取代的不饱和烃。如本技术所用的术语“炔基”,是指在二个碳之间含有三键的任何无支链或支链、取代或未取代的不饱和烃。
117、如本技术所用的术语“芳基”与“杂芳基”是指芳族烃环,在一些实施方案中该环具有5、6或7个原子,而在其他实施方案中该环具有6个原子。“杂芳基”是指芳族烃环,其中在该环中具有至少一个杂原子如氧、硫或氮原子以及具有至少一个碳原子。术语“杂环”或“杂环的”是指含有一或多个杂原子的任何环状化合物。芳基、杂环及杂芳基可被任何取代基取代,包括上述及本领域所知的这些取代基。
118、单独出现且不带有指定数字的取代基“r”,是指选自烷基、环烷基、芳基、杂芳基(经由环碳而键结)及杂脂环基(经由环碳而键结)的取代基。
119、术语“氨基烷基”是指选自-rnr'r"、-rnhr'和-rnh2的取代基,其中r、r’及r”各自独立地为本文所限定的r。
120、如本技术所用的术语“卤素原子”,是指元素周期表第七列的任何一个放射性稳定的原子,如氟、氯、溴或碘。
121、术语“烷氧基”是指任何无支链或支链,取代或未取代的,饱和或不饱和的醚,例如c1-c6无支链饱和未取代的醚、甲氧基、和二甲基醚、二乙基醚、甲基-异丁基醚、和甲基-叔丁基醚。
122、已发现数种右美沙芬的类似物可减缓或阻止右美沙芬的代谢。在一些实施方案中,可用体积较大的基团置换位于芳基环的2位的氢,即r1。
123、
124、如本文所述,术语“体积大的”或“体积较大的”是指锥角大于氢的取代基。合适的取代基包括但不限于c1-c10烷基、c2-c10烯基、c2-c10炔基、c6-c12芳基、c7-c13芳基烷基、c3-c10环烷基、c2-c10杂环、c3-c10杂环烷基、c3-c12杂芳基、c4-c12杂芳基烷基、烷基氨基和二烷基氨基,其中各氢任选被低级烷基、烷氧基或卤素取代。
125、不希望受限于任何特定的理论,据信当引入体积较大的基团时,会阻断cyp2d6启动将右美沙芬化合物转化为右啡烷与其他代谢物的催化作用。因此,可阻止或大幅减少右美沙芬类似物(包括氘化类似物)的快速代谢作用。例如,叔丁基烷基借助其相对较大的锥角,可保护与氧键结的甲基,及阻止右美沙芬或氘化右美沙芬的o-去甲基作用。或者,若该大型基团含有碱性氮,该氮存在于距离甲氧基5至7埃处,则可通过抑制cyp2d6而阻止氧化作用。
126、在2位具有体积大的基团的合适的类似物包括化合物(1-1)和(1-2),如下所示。
127、
128、在其它实施方案中,3位的甲氧基可被较大的基团or2取代。
129、
130、合适的取代基包括但不限于以下:r1选自氢、c1-c10烷基、c2-c10烯基、c2-c10炔基、c6-c12芳基、c7-c13芳基烷基、c3-c10环烷基、c2-c10杂环、c3-c10杂环烷基、c3-c12杂芳基、c4-c12杂芳基烷基、烷基氨基和二烷基氨基,其中各个氢任选取代有低级烷基、烷氧基或卤素;且r2选自c2-c10烷基、c2-c10烯基、c2-c10炔基、c6-c12芳基、c7-c13芳基烷基、c3-c10环烷基、c2-c10杂环、c4-c10杂环烷基、c3-c12杂芳基、c4-c12杂芳基烷基、烷基氨基和二烷基氨基,其中各个氢任选被低级烷基、烷氧基或卤素取代。当r1为氢,r2不能为氢或甲基以排除右美沙芬和右啡烷。
131、在3位具有大体积的-or2基团的合适的类似物包括化合物(ii-1)-(ii-4),如下所示。
132、
133、
134、在其它实施方案中,3位的甲氧基可被包含硫原子的较大的基团取代。
135、
136、合适的取代基包括但不限于以下:各r1独立地选自氢、c1-c10烷基、c2-c10烯基、c2-c10炔基、c6-c12芳基、c7-c13芳基烷基、c3-c10环烷基、c2-c10杂环、c3-c10杂环烷基、c3-c12杂芳基、c4-c12杂芳基烷基、烷基氨基和二烷基氨基,其中各个氢任选被低级烷基、烷氧基或卤素取代;且r2选自-sr1,
137、
138、在3-位具有含硫的大体积基团的合适的类似物包括化合物(iii-1)-(iii-3),如下所示。
139、
140、不希望受限于任何特定的理论,据信在3位引入含有氧原子或硫原子的体积较大的基团,可改善右美沙芬或氘化右美沙芬的半衰期(t1/2)。通过增加半衰期,可在右美沙芬类似物代谢成为右啡烷前,使其血中浓度提高达一段较长的时间。备选的取代基与取代作用亦在本发明的精神与范围内。尤其,包括一或多个氘原子的取代基与取代作用(例如d6dm),落在本发明的范围内。本领域的一般技术人员将知悉如何进行本发明的右美沙芬类似物的修饰作用,以提供氘化右美沙芬类似物。
141、在本发明的范围内亦包括newman等人于j med chem.1992年10月30日;35(22):4135-42中所述的化合物。newman在惊厥作用的多种体外与体内模型中确定这些化合物展现出抗惊厥活性。
142、cyp2d6抑制剂
143、本发明设想右美沙芬化合物连同cyp2d6抑制剂诸如奎尼丁的使用。虽然奎尼丁最常用于共同给药,但其它抗氧化剂,如inaba等人,drug metabolism anddisposition.1985;13:443-447,forme-pfister等人,biochem.pharmacol.1988;37:3829-3835,和broly等人,biochem.pharmacol.1990;39:1045-1053中所述的那些,亦可与右美沙芬化合物共同给药,以降低其代谢作用。如inaba等人所报导,其ki值(michaelis-menton抑制值)为50微摩尔或更低的cyp2d6抑制剂包括去甲替林、氯丙嗪、多潘立酮、氟哌啶醇、匹泮哌隆、拉贝洛尔、美托洛尔、氧烯洛尔、普萘洛尔、噻吗洛尔、美西律、奎宁、苯海拉明、阿义马林、洛贝林、罂粟碱和育亨宾。具有特别有效的抑制活性的化合物包括育亨宾、氟哌啶醇、阿义马林、洛贝林和匹泮哌隆,其具有的ki值范围为4至0.33μm。除了上述所报导的抗氧化剂外,亦发现eli lilly and co.以商品名所销售的氟西汀,在一些人中具有增加血中的右美沙芬浓度的效用。此外,下列化合物中的任一者可用于抑制cyp2d6:特比萘芬、西那卡塞、丁丙诺啡、丙米嗪、安非他酮、利托那韦、舍曲林、度洛西汀、硫利达嗪、甲氧氯普胺、帕罗西汀、或氟伏沙明。其他抗氧化剂的剂量将依抗氧化剂而异,并以个体为基础而决定。
144、意外地发现可用右美沙芬化合物与一定量的奎尼丁的组合来治疗患有阿尔茨海默症中的激越行为和/或攻击行为的受试者,其中奎尼丁的量显著低于先前认为提供显著治疗效果所需的最低量。
145、通过cyp2d6抑制剂连同右美沙芬的共同给药,可进一步避开右美沙芬或其氘化形式的代谢作用。奎尼丁是一种有效的cyp2d6抑制剂,且已进行过关于该项用途的具体研究(授予smith的美国专利5,206,248)。奎尼丁的化学结构如下:
146、
147、奎尼丁共同给药至少具有二项不同的有益效应。首先,其大幅增加右美沙芬化合物在血液中的循环量。此外,其还产生更为一致及可预期的右美沙芬浓度。涉及右美沙芬或奎尼丁和右美沙芬共同给药的研究,以及奎尼丁对于血浆浓度的影响的研究,描述于专利文献(参见,例如,美国专利5,166,207,美国专利5,863,927,美国专利5,366,980,美国专利5,206,248,美国专利5,350,756和美国专利7,973,049)。
148、奎尼丁给药可将具有泛代谢者表型的个体转变为不良代谢者表型(inaba等人,br.j.clin.pharmacol.1986;22:199-200)。当右美沙芬与奎尼丁共同给药时,血液中的右美沙芬水平随着右美沙芬剂量线性增加,但是当单独给药右美沙芬时,即使在高剂量时,在大部分的受试者中仍然无法检测出右美沙芬(zhang等人,clin.pharmac.&therap.1992;51:647-55)。因而,在右美沙芬与奎尼丁的共同给药后,在快速代谢者中所观察到的血浆水平,与在不良代谢者中所观察到的血浆水平类似。因此,医师应谨慎看待在可能为不良代谢者的受试者中的奎尼丁的给药。
149、药物组合物
150、所公开方法与组合的特征之一,在于它们具有减少阿尔茨海默症患者的激越行为和/或攻击行为的功能。在一些情况下,在未采用镇静方式或以其他方式显著干预意识或警觉性时,和/或不增加严重不良反应的风险的情况下,达到这种减少作用。如本技术所用的“显著干预”是指在临床水平上显著(例如,它们将引起医师或心理医师的特别关注),或在个人或社会水平上显著(诸如通过引发嗜睡,其严重程度足以损害个人驾驶车辆的能力)的不良事件。相反地,由非处方药物如含有右美沙芬的止咳糖浆在建议剂量使用时可能引起的非常轻微的副作用类型,则不视为显著干预。
151、用于短期或长期管理阿尔茨海默症受试者的激越行为和/或攻击行为的与奎尼丁组合的右美沙芬化合物的治疗剂量,可依下列因素而异,诸如病症的具体原因、病症的严重性及给药途径。剂量和/或给药频率亦可能依个体受试者的年龄、体重及反应而异。
152、在一个实施方案中,右美沙芬化合物和奎尼丁以组合剂量给药,或以独立剂量给药。该独立剂量可基本上同时给药。在一个实施方案中,右美沙芬化合物与奎尼丁的重量比为约1:1或更少。在一些实施方案中,该重量比为约1:1,1:0.95,1:0.9,1:0.85,1:0.8,1:0.75,1:0.7,1:0.65,1:0.6,1:0.55或1:0.5或更少。同样,在某些实施方案中,所述剂量具有的右美沙芬化合物与奎尼丁的重量比少于约1:0.5,例如,约1:0.45,1:0.4,1:0.35,1:0.3,1:0.25,1:0.2,1:0.15,或1:0.1,1:0.09,1:0.08,1:0.07,1:0.06,1:0.05,1:0.04,1:0.03,1:0.02,或1:0.01,或更少。该重量比可为例如,约1:0.75,约1:0.68,约1:0.6,约1:0.56,约1:0.5,约1:0.44,约1:0.39,约1:0.38,约1:0.31,约1:0.30,约1:0.29,约1:0.28,约1:0.27,约1:0.26,约1:0.25,约1:0.24,约1:0.23,约1:0.22,约1:0.21,约1:0.20,约1:0.19,约1:0.18,约1:0.17,1:0.16,约1:0.15,约1:0.14,约1:0.13,约1:0.12,约1:0.11和约1:0.10。在一些实施方案中,右美沙芬游离碱与奎尼丁游离碱的重量比为约1:0.68,约1:0.56,约1:0.44,约1:0.38。在某些其它实施方案中,d6-氘化右美沙芬的游离碱与奎尼丁游离碱的重量比为约1:0.30,约1:0.22,约1:0.19,约1:0.18,约1:0.16和约1:0.15。
153、在某些实施方案中,当右美沙芬化合物和奎尼丁以1:1或更少的重量比给药时,任一次给药少于50mg的奎尼丁。例如,在某些实施方案中,给药的奎尼丁为约30mg、25mg或20mg或更少。在其它实施方案中,给药的奎尼丁为约15mg、10mg、9.5mg、9.0mg、8.5mg、8.0mg、7.5mg、7.0mg、6.5mg、6.0mg、5.5mg、5.0mg、或更少。在其它实施方案中,奎尼丁给药约5.00mg、4.95mg、4.90mg、4.85mg、4.80mg、4.75mg、4.70mg、4.65mg、4.60mg、4.55mg、4.50mg、4.45mg、4.40mg、4.35mg、4.30mg、4.25mg、4.20mg、4.15mg、4.10mg、4.05mg、4.00mg、3.95mg、3.90mg、3.85mg、3.80mg、3.75mg、3.70mg、3.65mg、3.60mg、3.55mg、3.50mg、3.45mg、3.40mg、3.35mg、3.30mg、3.25mg、3.20mg、3.15mg、3.10mg、3.05mg、3.00mg、2.95mg、2.90mg、2.85mg、2.80mg、2.75mg、2.70mg、2.65mg、2.60mg、2.55mg、2.50mg、2.45mg、2.40mg、2.35mg、2.30mg、2.25mg、2.20mg、2.15mg、2.10mg、2.05mg、2.00mg、1.95mg、1.90mg、1.85mg、1.80mg、1.75mg、1.70mg、1.65mg、1.60mg、1.55mg、1.50mg、1.45mg、1.40mg、1.35mg、1.30mg、1.25mg、1.20mg、1.15mg、1.10mg、1.05mg、1.00mg、0.95mg、0.90mg、0.85mg、0.80mg、0.75mg、0.70mg、0.65mg、0.60mg、0.55mg、0.50mg、0.45mg、0.40mg、0.35mg、0.30mg、0.25mg、0.20mg、0.15mg、0.10mg、或0.05mg、或更少。
154、在一些实施方案中,重量比为1:1或更少的组合剂量(或同时给药的独立剂量)每天一次、每天两次、每天三次、每天四次、或更频繁给药,以向受试者每天提供一定剂量水平,例如:每天60mg奎尼丁和60mg右美沙芬化合物,以两份剂量提供,各剂量包含30mg奎尼丁和30mg右美沙芬化合物;每天50mg奎尼丁和50mg右美沙芬化合物,以两份剂量提供,各剂量包含25mg奎尼丁和25mg右美沙芬化合物;每天40mg奎尼丁和40mg右美沙芬化合物,以两份剂量提供,各剂量包含20mg奎尼丁和20mg右美沙芬化合物;每天30mg奎尼丁和30mg右美沙芬化合物,以两份剂量提供,各剂量包含15mg奎尼丁和15mg右美沙芬化合物;或每天20mg奎尼丁和20mg右美沙芬化合物,以两份剂量提供,各剂量包含10mg奎尼丁(即,约9mg奎尼丁游离碱)和10mg右美沙芬化合物。在一些实施方案中,可依照每天所给药的剂量数目,调整组合剂量中右美沙芬化合物和奎尼丁的总量,以提供对受试者适宜的每天总剂量,同时将重量比维持在1:1以下。
155、在一些实施方案中,用于治疗阿尔茨海默症受试者中的激越行为和/或攻击行为的右美沙芬化合物与奎尼丁的组合的总每日剂量,为约10mg或更少至约200mg或更多的右美沙芬化合物,组合约0.05mg或更少至约60mg或更多的奎尼丁。在一些实施方案中,用于治疗阿尔茨海默症受试者的激越行为和/或攻击行为的日剂量为约10mg至约90mg右美沙芬化合物组合约2.5mg至约60mg奎尼丁,为单一或分开的剂量。在一些实施方案中,右美沙芬化合物的总每日剂量为约15mg、16mg、17mg、18mg、19或20mg,组合约15mg、10mg、9.5mg、9.0mg、8.5mg、8.0mg、7.5mg、7.0mg、6.5mg、6.0mg、5.5mg、5.00mg、4.95mg、4.90mg、4.85mg、4.80mg、4.75mg、4.70mg、4.65mg、4.60mg、4.55mg、4.50mg、4.45mg、4.40mg、4.35mg、4.30mg、4.25mg、4.20mg、4.15mg、4.10mg、4.05mg、4.00mg、3.95mg、3.90mg、3.85mg、3.80mg、3.75mg、3.70mg、3.65mg、3.60mg、3.55mg、3.50mg、3.45mg、3.40mg、3.35mg、3.30mg、3.25mg、3.20mg、3.15mg、3.10mg、3.05mg、3.00mg、2.95mg、2.90mg、2.85mg、2.80mg、2.75mg、2.70mg、2.65mg、2.60mg、2.55mg、2.50mg、2.45mg、2.40mg、2.35mg、2.30mg、2.25mg、2.20mg、2.15mg、2.10mg、2.05mg、2.00mg、1.95mg、1.90mg、1.85mg、1.80mg、1.75mg、1.70mg、1.65mg、1.60mg、1.55mg、1.50mg、1.45mg、1.40mg、1.35mg、1.30mg、1.25mg、1.20mg、1.15mg、1.10mg、1.05mg、1.00mg、0.95mg、0.90mg、0.85mg、0.80mg、0.75mg、0.70mg、0.65mg、0.60mg、0.55mg、0.50mg、0.45mg、0.40mg、0.35mg、0.30mg、0.25mg、0.20mg、0.15mg、0.10mg、或0.05mg或更少的奎尼丁。
156、在一些实施方案中,用于治疗阿尔茨海默症受试者的激越行为和/或攻击行为的日剂量为约20mg、21mg、22mg、23mg、24mg、25mg、26mg、27mg、28mg、29mg、或30mg右美沙芬化合物,组合约15mg、10mg、9.5mg、9.0mg、8.5mg、8.0mg、7.5mg、7.0mg、6.5mg、6.0mg、5.5mg、5.00mg、4.95mg、4.90mg、4.85mg、4.80mg、4.75mg、4.70mg、4.65mg、4.60mg、4.55mg、4.50mg、4.45mg、4.40mg、4.35mg、4.30mg、4.25mg、4.20mg、4.15mg、4.10mg、4.05mg、4.00mg、3.95mg、3.90mg、3.85mg、3.80mg、3.75mg、3.70mg、3.65mg、3.60mg、3.55mg、3.50mg、3.45mg、3.40mg、3.35mg、3.30mg、3.25mg、3.20mg、3.15mg、3.10mg、3.05mg、3.00mg、2.95mg、2.90mg、2.85mg、2.80mg、2.75mg、2.70mg、2.65mg、2.60mg、2.55mg、2.50mg、2.45mg、2.40mg、2.35mg、2.30mg、2.25mg、2.20mg、2.15mg、2.10mg、2.05mg、2.00mg、1.95mg、1.90mg、1.85mg、1.80mg、1.75mg、1.70mg、1.65mg、1.60mg、1.55mg、1.50mg、1.45mg、1.40mg、1.35mg、1.30mg、1.25mg、1.20mg、1.15mg、1.10mg、1.05mg、1.00mg、0.95mg、0.90mg、0.85mg、0.80mg、0.75mg、0.70mg、0.65mg、0.60mg、0.55mg、0.50mg、0.45mg、0.40mg、0.35mg、0.30mg、0.25mg、0.20mg、0.15mg、0.10mg、或0.05mg或更少的奎尼丁;或约30mg、31mg、32mg、33mg、34mg、35mg、36mg、37mg、38mg、39mg、或40mg右美沙芬化合物,组合约15mg、10mg、9.5mg、9.0mg、8.5mg、8.0mg、7.5mg、7.0mg、6.5mg、6.0mg、5.5mg、5.00mg、4.95mg、4.90mg、4.85mg、4.80mg、4.75mg、4.70mg、4.65mg、4.60mg、4.55mg、4.50mg、4.45mg、4.40mg、4.35mg、4.30mg、4.25mg、4.20mg、4.15mg、4.10mg、4.05mg、4.00mg、3.95mg、3.90mg、3.85mg、3.80mg、3.75mg、3.70mg、3.65mg、3.60mg、3.55mg、3.50mg、3.45mg、3.40mg、3.35mg、3.30mg、3.25mg、3.20mg、3.15mg、3.10mg、3.05mg、3.00mg、2.95mg、2.90mg、2.85mg、2.80mg、2.75mg、2.70mg、2.65mg、2.60mg、2.55mg、2.50mg、2.45mg、2.40mg、2.35mg、2.30mg、2.25mg、2.20mg、2.15mg、2.10mg、2.05mg、2.00mg、1.95mg、1.90mg、1.85mg、1.80mg、1.75mg、1.70mg、1.65mg、1.60mg、1.55mg、1.50mg、1.45mg、1.40mg、1.35mg、1.30mg、1.25mg、1.20mg、1.15mg、1.10mg、1.05mg、1.00mg、0.95mg、0.90mg、0.85mg、0.80mg、0.75mg、0.70mg、0.65mg、0.60mg、0.55mg、0.50mg、0.45mg、0.40mg、0.35mg、0.30mg、0.25mg、0.20mg、0.15mg、0.10mg、或0.05mg或更少的奎尼丁;或约40mg、41mg、42mg、43mg、44mg、45mg、46mg、47mg、48mg、49mg、或50mg右美沙芬化合物,组合约15mg、10mg、9.5mg、9.0mg、8.5mg、8.0mg、7.5mg、7.0mg、6.5mg、6.0mg、5.5mg、5.00mg、4.95mg、4.90mg、4.85mg、4.80mg、4.75mg、4.70mg、4.65mg、4.60mg、4.55mg、4.50mg、4.45mg、4.40mg、4.35mg、4.30mg、4.25mg、4.20mg、4.15mg、4.10mg、4.05mg、4.00mg、3.95mg、3.90mg、3.85mg、3.80mg、3.75mg、3.70mg、3.65mg、3.60mg、3.55mg、3.50mg、3.45mg、3.40mg、3.35mg、3.30mg、3.25mg、3.20mg、3.15mg、3.10mg、3.05mg、3.00mg、2.95mg、2.90mg、2.85mg、2.80mg、2.75mg、2.70mg、2.65mg、2.60mg、2.55mg、2.50mg、2.45mg、2.40mg、2.35mg、2.30mg、2.25mg、2.20mg、2.15mg、2.10mg、2.05mg、2.00mg、1.95mg、1.90mg、1.85mg、1.80mg、1.75mg、1.70mg、1.65mg、1.60mg、1.55mg、1.50mg、1.45mg、1.40mg、1.35mg、1.30mg、1.25mg、1.20mg、1.15mg、1.10mg、1.05mg、1.00mg、0.95mg、0.90mg、0.85mg、0.80mg、0.75mg、0.70mg、0.65mg、0.60mg、0.55mg、0.50mg、0.45mg、0.40mg、0.35mg、0.30mg、0.25mg、0.20mg、0.15mg、0.10mg、或0.05mg或更少的奎尼丁;或约50mg、51mg、52mg、53mg、54mg、55mg、56mg、57mg、58mg、59mg、或60mg右美沙芬化合物,组合约15mg、10mg、9.5mg、9.0mg、8.5mg、8.0mg、7.5mg、7.0mg、6.5mg、6.0mg、5.5mg、5.00mg、4.95mg、4.90mg、4.85mg、4.80mg、4.75mg、4.70mg、4.65mg、4.60mg、4.55mg、4.50mg、4.45mg、4.40mg、4.35mg、4.30mg、4.25mg、4.20mg、4.15mg、4.10mg、4.05mg、4.00mg、3.95mg、3.90mg、3.85mg、3.80mg、3.75mg、3.70mg、3.65mg、3.60mg、3.55mg、3.50mg、3.45mg、3.40mg、3.35mg、3.30mg、3.25mg、3.20mg、3.15mg、3.10mg、3.05mg、3.00mg、2.95mg、2.90mg、2.85mg、2.80mg、2.75mg、2.70mg、2.65mg、2.60mg、2.55mg、2.50mg、2.45mg、2.40mg、2.35mg、2.30mg、2.25mg、2.20mg、2.15mg、2.10mg、2.05mg、2.00mg、1.95mg、1.90mg、1.85mg、1.80mg、1.75mg、1.70mg、1.65mg、1.60mg、1.55mg、1.50mg、1.45mg、1.40mg、1.35mg、1.30mg、1.25mg、1.20mg、1.15mg、1.10mg、1.05mg、1.00mg、0.95mg、0.90mg、0.85mg、0.80mg、0.75mg、0.70mg、0.65mg、0.60mg、0.55mg、0.50mg、0.45mg、0.40mg、0.35mg、0.30mg、0.25mg、0.20mg、0.15mg、0.10mg、或0.05mg或更少的奎尼丁;或约60mg、61mg、62mg、63mg、64mg、65mg、66mg、67mg、68mg、69mg、或70mg右美沙芬化合物,组合约15mg、10mg、9.5mg、9.0mg、8.5mg、8.0mg、7.5mg、7.0mg、6.5mg、6.0mg、5.5mg、5.00mg、4.95mg、4.90mg、4.85mg、4.80mg、4.75mg、4.70mg、4.65mg、4.60mg、4.55mg、4.50mg、4.45mg、4.40mg、4.35mg、4.30mg、4.25mg、4.20mg、4.15mg、4.10mg、4.05mg、4.00mg、3.95mg、3.90mg、3.85mg、3.80mg、3.75mg、3.70mg、3.65mg、3.60mg、3.55mg、3.50mg、3.45mg、3.40mg、3.35mg、3.30mg、3.25mg、3.20mg、3.15mg、3.10mg、3.05mg、3.00mg、2.95mg、2.90mg、2.85mg、2.80mg、2.75mg、2.70mg、2.65mg、2.60mg、2.55mg、2.50mg、2.45mg、2.40mg、2.35mg、2.30mg、2.25mg、2.20mg、2.15mg、2.10mg、2.05mg、2.00mg、1.95mg、1.90mg、1.85mg、1.80mg、1.75mg、1.70mg、1.65mg、1.60mg、1.55mg、1.50mg、1.45mg、1.40mg、1.35mg、1.30mg、1.25mg、1.20mg、1.15mg、1.10mg、1.05mg、1.00mg、0.95mg、0.90mg、0.85mg、0.80mg、0.75mg、0.70mg、0.65mg、0.60mg、0.55mg、0.50mg、0.45mg、0.40mg、0.35mg、0.30mg、0.25mg、0.20mg、0.15mg、0.10mg、或0.05mg或更少的奎尼丁;或约70mg、71mg、72mg、73mg、74mg、75mg、76mg、77mg、78mg、79或80mg右美沙芬化合物,组合约15mg、10mg、9.5mg、9.0mg、8.5mg、8.0mg、7.5mg、7.0mg、6.5mg、6.0mg、5.5mg、5.00mg、4.95mg、4.90mg、4.85mg、4.80mg、4.75mg、4.70mg、4.65mg、4.60mg、4.55mg、4.50mg、4.45mg、4.40mg、4.35mg、4.30mg、4.25mg、4.20mg、4.15mg、4.10mg、4.05mg、4.00mg、3.95mg、3.90mg、3.85mg、3.80mg、3.75mg、3.70mg、3.65mg、3.60mg、3.55mg、3.50mg、3.45mg、3.40mg、3.35mg、3.30mg、3.25mg、3.20mg、3.15mg、3.10mg、3.05mg、3.00mg、2.95mg、2.90mg、2.85mg、2.80mg、2.75mg、2.70mg、2.65mg、2.60mg、2.55mg、2.50mg、2.45mg、2.40mg、2.35mg、2.30mg、2.25mg、2.20mg、2.15mg、2.10mg、2.05mg、2.00mg、1.95mg、1.90mg、1.85mg、1.80mg、1.75mg、1.70mg、1.65mg、1.60mg、1.55mg、1.50mg、1.45mg、1.40mg、1.35mg、1.30mg、1.25mg、1.20mg、1.15mg、1.10mg、1.05mg、1.00mg、0.95mg、0.90mg、0.85mg、0.80mg、0.75mg、0.70mg、0.65mg、0.60mg、0.55mg、0.50mg、0.45mg、0.40mg、0.35mg、0.30mg、0.25mg、0.20mg、0.15mg、0.10mg、或0.05mg或更少的奎尼丁;或约80mg、81mg、82mg、83mg、84mg、85mg、86mg、87mg、88mg、89mg、90mg右美沙芬化合物,组合约15mg、10mg、9.5mg、9.0mg、8.5mg、8.0mg、7.5mg、7.0mg、6.5mg、6.0mg、5.5mg、5.00mg、4.95mg、4.90mg、4.85mg、4.80mg、4.75mg、4.70mg、4.65mg、4.60mg、4.55mg、4.50mg、4.45mg、4.40mg、4.35mg、4.30mg、4.25mg、4.20mg、4.15mg、4.10mg、4.05mg、4.00mg、3.95mg、3.90mg、3.85mg、3.80mg、3.75mg、3.70mg、3.65mg、3.60mg、3.55mg、3.50mg、3.45mg、3.40mg、3.35mg、3.30mg、3.25mg、3.20mg、3.15mg、3.10mg、3.05mg、3.00mg、2.95mg、2.90mg、2.85mg、2.80mg、2.75mg、2.70mg、2.65mg、2.60mg、2.55mg、2.50mg、2.45mg、2.40mg、2.35mg、2.30mg、2.25mg、2.20mg、2.15mg、2.10mg、2.05mg、2.00mg、1.95mg、1.90mg、1.85mg、1.80mg、1.75mg、1.70mg、1.65mg、1.60mg、1.55mg、1.50mg、1.45mg、1.40mg、1.35mg、1.30mg、1.25mg、1.20mg、1.15mg、1.10mg、1.05mg、1.00mg、0.95mg、0.90mg、0.85mg、0.80mg、0.75mg、0.70mg、0.65mg、0.60mg、0.55mg、0.50mg、0.45mg、0.40mg、0.35mg、0.30mg、0.25mg、0.20mg、0.15mg、0.10mg、或0.05mg或更少的奎尼丁;其为单一或分开的剂量。
157、在一些实施方案中,右美沙芬化合物和奎尼丁的日剂量为30mg右美沙芬氢溴酸盐和30mg硫酸奎尼丁。其它剂量包括,例如,15mg右美沙芬氢溴酸盐和9mg硫酸奎尼丁(对应于约11mg右美沙芬和约7.5mg奎尼丁);23mg右美沙芬氢溴酸盐和9mg硫酸奎尼丁(对应于约17mg右美沙芬和约7.5mg奎尼丁);20mg右美沙芬氢溴酸盐和10mg硫酸奎尼丁(对应于约15mg右美沙芬和8.3mg奎尼丁);30mg右美沙芬氢溴酸盐和10mg硫酸奎尼丁(对应于约22mg右美沙芬和8.3mg奎尼丁)。
158、可给药或使用30mg d6-右美沙芬氢溴酸盐(分子式为c18h19d6no.hbr.h2o)和30mg硫酸奎尼丁(分子式为(c20h24n2o2)2.h2so4.2h2o)的剂量(对应于约22.22mg右美沙芬和25mg奎尼丁)。d6-氘化右美沙芬的其它剂量包括,例如,24mg d6-右美沙芬氢溴酸盐和4.75mg硫酸奎尼丁(对应于约18mg d6-右美沙芬和约3.96mg奎尼丁);34mg d6-右美沙芬氢溴酸盐和4.75mg硫酸奎尼丁(对应于约25.18mg d6-右美沙芬和约3.96mg奎尼丁);18mg d6-右美沙芬氢溴酸盐和4.9mg硫酸奎尼丁(对应于约13.33mg d6-右美沙芬和4.08mg奎尼丁);24mgd6-右美沙芬氢溴酸盐和4.9mg硫酸奎尼丁(对应于约17.78mg d6-右美沙芬和4.08mg奎尼丁);28mg d6-右美沙芬氢溴酸盐和4.9mg硫酸奎尼丁(对应于约20.74mg d6-右美沙芬和4.08mg奎尼丁);30mg d6-右美沙芬氢溴酸盐和4.9mg硫酸奎尼丁(对应于约22.22mg d6-右美沙芬和4.08mg奎尼丁);34mg d6-右美沙芬氢溴酸盐和4.9mg硫酸奎尼丁(对应于约25.18mg d6-右美沙芬和4.08mg奎尼丁)。
159、在一些实施方案中,该治疗以较低的日剂量起始,例如每天约18或30mg右美沙芬化合物组合约2.5至10mg奎尼丁,且增加至约90mg右美沙芬化合物组合约10至20mg或更高的奎尼丁,取决于受试者的总体响应。在一些实施方案中,婴儿、孩童、超过65岁的个体及肾功能或肝功能受损的那些个体,最初接受较低剂量,其基于个体反应与血液水平所决定。一般而言,大部分的个体对于18至90mg右美沙芬化合物和4.75至20mg奎尼丁的每天剂量的耐受性良好。
160、如本领域技术人员所显而易见的,在一些情况下可给药在所公开的这些范围之外的剂量。而且,应注意到具一般技术的临床医师或主治医师将根据个体反应而明白何时中断、调整或终止治疗。
161、可采用任何适宜的给药途径,以向该受试者提供用于治疗阿尔茨海默症受试者的激越行为和/或攻击行为的有效剂量的右美沙芬化合物与奎尼丁的组合。例如,可采用口服、直肠、经皮、肠胃外(皮下、肌内、静脉内)、鞘内、局部、吸入式及类似形式的给药。适宜的剂型包括片剂、糖锭、分散剂、悬浮剂、溶液、胶囊、贴剂等。通过可将这些化合物导入血流中的任何适宜方法,进行由本技术中所述化合物制备的药物的给药。在一些实施方案中,所述制剂可含有由活性化合物与本领域技术人员所知的药学上可接受的载体或稀释剂所组成的混合物。
162、本文公开的药物组合物包含右美沙芬化合物与cyp2d6抑制剂如奎尼丁的组合,或右美沙芬化合物和/或奎尼丁的药学上可接受的盐,作为活性成分,且还可包含药学上可接受的载体,且任选地,其它治疗成分。
163、术语“药学上可接受的盐”或“其药学上可接受的盐”是指从药学上可接受的、无毒的酸或碱制备的盐。合适的药学上可接受的盐包括金属盐,例如,铝、锌的盐;碱金属盐如锂、钠和钾盐;碱土金属盐如钙和镁盐;有机盐,例如,赖氨酸、n,n′-二苄基乙二胺、氯普鲁卡因、胆碱、二乙醇胺、乙二胺、葡甲胺(n-甲基葡糖胺)、普鲁卡因和tris盐;游离酸和碱的盐;无机盐,例如,硫酸盐、盐酸盐和氢溴酸盐;和目前在药学上广泛使用及列于本领域技术人员众所周知的来源(诸如the merck index)的其他盐类。
164、可选择任何适宜组分来制造本技术中所述的活性药物的盐,条件是其不具毒性及基本上不干扰所需活性。除了盐类之外,亦可采用这些化合物的药学上可接受的前体与衍生物。氘化右美沙芬和/或奎尼丁的药学上可接受的酰胺、低级烷基酯及受保护的衍生物亦适用于本技术所公开的组合物与方法中。在某些实施例中,氘化右美沙芬以氘化右美沙芬氢溴酸盐的形式给药,右美沙芬以右美沙芬氢溴酸盐的形式给药,而奎尼丁以硫酸奎尼丁的形式给药。
165、所述组合物可以任何所需形式制备,例如,片剂、粉末、胶囊、可注射剂、悬浮剂、囊剂、扁囊剂、贴剂、溶液、酏剂和气雾剂。载体如淀粉、糖、微晶纤维素、稀释剂、成粒剂、润滑剂、粘合剂、崩解剂等可用于口服固体制剂。在某些实施方案中,该组合物被制备为口服固体制剂(如粉末、胶囊和片剂)。在某些实施方案中,该组合物被制备为口服液体制剂。在一些实施方案中,该口服固体制剂为片剂。如果需要的话,片剂可通过标准水性或非水性技术涂覆。
166、除了上述剂型,本文公开的化合物也可通过缓释、延迟释放或控制释放组合物和/或递送装置给药,例如,如美国专利号3,845,770;3,916,899;3,536,809;3,598,123;和4,008,719所述的那些。
167、适用于口服给药的药物组合物可以独立单元形式提供,诸如胶囊剂、扁囊剂、囊剂、贴剂、可注射剂、片剂及气雾型喷剂,其中各含有预定量的活性成分,其作为粉末或颗粒的形式,或为在水性液体、非水性液体、水包油型乳化液或油包水型液态乳化液中的溶液或悬浮剂的形式。这些组合物可通过任一常规的制药学方法制备,但大部分的这些方法通常包括将活性成分与构成一种或多种成分的载体结合的步骤。一般而言,这些组合物的制备通过将活性成分与液态载体、细分的固态载体或二者均匀且密切地混合,然后任选地使产物成型而具有所需的外观。
168、例如可通过任选地与一或多种附加成分一起进行压制或模制,而制备片剂。可通过在适宜机器中压制处于诸如粉末或颗粒的自由流动形式的活性成分,及任选地与粘合剂、润滑剂、惰性稀释剂、表面活性剂或分散剂混合,而制备压制的片剂。可在适宜机器中,通过对用惰性液态稀释剂润湿的粉末状化合物的混合物进行模制,而制成模制型片剂。
169、在一些实施方案中,各片剂包含约30mg右美沙芬氢溴酸盐和30mg硫酸奎尼丁。该片剂可包含,例如,15mg右美沙芬氢溴酸盐和9mg硫酸奎尼丁(对应于约11mg右美沙芬和约7.5mg奎尼丁);23mg右美沙芬氢溴酸盐和9mg硫酸奎尼丁(对应于约17mg右美沙芬和约7.5mg奎尼丁);20mg右美沙芬氢溴酸盐和10mg硫酸奎尼丁(对应于约15mg右美沙芬和8.3mg奎尼丁);30mg右美沙芬氢溴酸盐和10mg硫酸奎尼丁(对应于约22mg右美沙芬和8.3mg奎尼丁)。
170、该片剂可包含30mg d6-右美沙芬氢溴酸盐(分子式为c18h19d6no.hbr.h2o)和30mg硫酸奎尼丁(分子式为(c20h24n2o2)2.h2so4.2h2o)(对应于约22.22mg右美沙芬和25mg奎尼丁)。该片剂可包其它剂量,例如,24mg d6-右美沙芬氢溴酸盐和4.75mg硫酸奎尼丁(对应于约18mg d6-右美沙芬和约3.96mg奎尼丁);34mg d6-右美沙芬氢溴酸盐和4.75mg硫酸奎尼丁(对应于约25.18mg d6-右美沙芬和约3.96mg奎尼丁);18mg d6-右美沙芬氢溴酸盐和4.9mg硫酸奎尼丁(对应于约13.33mg d6-右美沙芬和4.08mg奎尼丁);24mg d6-右美沙芬氢溴酸盐和4.9mg硫酸奎尼丁(对应于17.78mg d6-右美沙芬和4.08mg奎尼丁);28mg d6-右美沙芬氢溴酸盐和4.9mg硫酸奎尼丁(对应于约20.74mg d6-右美沙芬和4.08mg奎尼丁);30mgd6-右美沙芬氢溴酸盐和4.9mg硫酸奎尼丁(对应于约22.22mg d6-右美沙芬和4.08mg奎尼丁);34mg d6-右美沙芬氢溴酸盐和4.9mg硫酸奎尼丁(对应于约25.18mg d6-右美沙芬和4.08mg奎尼丁)。
171、如本技术所用的“最低有效治疗量”为,对于右美沙芬化合物从身体的迅速排除产生令人满意的抑制程度的量,同时并未引发不良反应,或所引发的不良事件的程度与性质可接受。更具体而言,在一些实施方案中,有效治疗量为,每天自约9、10、18、20、25或30mg至约90mg范围内的右美沙芬化合物与低于约50mg的奎尼丁。在一些实施方案中,该有效治疗量为,每天自约20或30mg至约90mg范围内的右美沙芬化合物与约0.5mg至约30mg的奎尼丁。在一些实施方案中,该量基于右美沙芬化合物的血浆半衰期,以分开剂量给药。例如,在一个实施方案中,氘化右美沙芬和奎尼丁按所指定的毫克增量的方式给药,以达到以μg/ml血浆为单位的特定水平的氘化右美沙芬的靶浓度,其中氘化右美沙芬与奎尼丁的最大指定剂量是基于体重的。在一些实施方案中,该目标剂量每12小时给药一次。在一些实施方案中,该目标剂量每天给药一次。在一些实施方案中,将奎尼丁的水平降至最低,且减少或排除在高剂量奎尼丁时所观察到的副作用,使得所提供的效益显著优于含有右美沙芬化合物及更高水平的奎尼丁的组合物。
172、在一些实施方案中,其它治疗剂与右美沙芬化合物和奎尼丁组合给药。例如,右美沙芬化合物和奎尼丁可与化合物组合给药以治疗抑郁症或焦虑。
173、在一些实施方案中,右美沙芬化合物和奎尼丁作为已知治疗剂的佐剂以用于治疗阿尔茨海默症的症状。治疗阿尔茨海默症的症状的药物包括,但不限于,胆碱酯酶抑制剂如多奈哌齐、利伐斯的明、加兰他敏和他克林、美金刚和维生素e。
174、实施例
175、实施例1:阿尔茨海默症临床研究中的激越行为和攻击行为
176、进行临床研究,以测定右美沙芬与奎尼丁的组合是否有效减少阿尔茨海默症患者的激越行为和/或攻击行为。
177、该项研究为一项为期10周的随机、双模拟、安慰剂对照的多中心研究,其研究口服右美沙芬/奎尼丁在可能患有阿尔茨海默症及临床显著的激越行为的个体中的疗效。该项研究在美国境内的42个地点进行,其中包括阿尔茨海默症的门诊诊所及协助生活与看护的机构。
178、合格的参与者的年龄为50岁至90岁,且可能患有阿尔茨海默症(2011nationalinstitute on aging—alzheimer association criteria)及临床显著的激越行为,临床显著的激越行为定义为组织性不佳及漫无目的的心理运动性活动的一种状态,其特征在于具有下列的至少一项:攻击性言语(如尖叫、谩骂);攻击性肢体行为(如毁坏物品、抢夺、打架);及非攻击性肢体行为(如踱步、烦躁不安)。合格的参与者在筛选前的七天内出现激越行为(间歇性或持续性),且该激越行为症状的严重性足以干扰日常生活且需要药物治疗。合格的参与者在激越行为的病情严重程度的临床总体印象量表(cgis)上的评分为≥4(病情中等严重),及简易精神状态检查(mmse)的评分为8至28。容许使用稳定剂量的阿尔茨海默症用药(≥2个月;美金刚和/或乙酰基胆碱酯酶抑制剂)及抗抑郁剂、抗精神病药物或安眠药(≥1个月;包括短效苯并二氮杂和非苯并二氮杂);其剂量在整个研究期间维持稳定。当研究调查人员认为必要时,可在研究期间容许使用口服劳拉西泮(在7天期间内最高1.5mg/日且最多3天)以作为激越行为的“救援”药物。
179、剔除标准为非阿尔茨海默症痴呆、并非阿尔茨海默症继发型的激越行为、在精神医疗机构住院治疗、明显抑郁症(康奈尔(cornell)痴呆抑郁量表[csdd]≥10)、精神分裂症、情感分裂性障碍或双相情感障碍、重症肌无力(因为这是奎尼丁的用药禁忌)或临床显著/不稳定的全身性疾病;具有完全心脏传导阻滞、qt间隔(qtc)延长的校正变化或尖端扭转性心室搏动过速的病史;具有先天性qt延长的家族病史;在过去一年内有发生姿势性或不明原因性晕厥的记录;或在3年内有精神活性物质(substance)/酒精滥用的记录。不允许使用第一代抗精神病药、三环类与单胺氧化酶抑制剂型抗抑郁剂。
180、为期10周的试验具有二个连续的双盲5周的阶段(第一阶段与第二阶段)(图2)。在第一阶段中,按3:4(活性成分:安慰剂)的比例随机分派参与者。第一阶段中的随机分派通过基线认知功能(mmse>15vs≥15)与激越行为严重性(cgis 4-5vs 6-7)进行分层;通过区组随机分派确保在各层中的治疗平衡。就第一阶段的前7天(第1至7天)而言,活性成分治疗组在早晨接受avp-923-20(20mg右美沙芬和10mg奎尼丁)及在晚上接受安慰剂;而安慰剂组则每天接受安慰剂二次。就第一阶段的后2周(第8至21天)而言,avp-923组每天接受avp-923-20二次,而安慰剂组则每天接受安慰剂二次。在第22天,avp组的用药剂量增加至每天给药avp-923-30(30mg的右美沙芬与10mg的奎尼丁)二次。在第一阶段剩余2周(第22至35天),avp组继续每天接受avp-923-30二次,而接受安慰剂的参与者则继续每天接受安慰剂二次。
181、在第二阶段中,凡在第一阶段中接受avp-923的参与者继续在为期5周的整个期间每天接受avp-923二次。在第一阶段中接受安慰剂的参与者则在第一阶段结束(第4次访问)时分层为二个亚组,这依据其临床反应,该反应根据病情严重程度的临床总体印象(cgis)评分及其神经精神症状问卷(npi)的激越行为/攻击行为领域评分评估。若参与者的激越行为cgis评分低于3分(轻度病情)及其npi激越行为/攻击行为领域评分与基线相比下降25%或更多,则将其视为“有反应者”。未符合这些标准的参与者则视为“无反应者”。然后按1:1的比例将各安慰剂亚组(有反应者与无反应者)重新随机分派接受avp-923或匹配的安慰剂。在第一阶段期间接受安慰剂及在第二阶段中重新随机分派为avp-923的参与者,在研究的前7天(第二阶段,第36至42天)在早晨接受avp-923-20及在晚上接受匹配的安慰剂。从第43天开始,参与者连续二周(第二阶段,第43至56天)每天接受avp-923-20二次;及从第57天开始在剩余的2周期间(第二阶段,第57至70天),参与者每天接受avp-923-30二次直到研究结束为止。
182、参与者在筛选、基线(第1天)及在第8天、第22天、第36天、第43天、第57天及第70天(第2至7次访问)参加了临床访问。包括筛选阶段在内,各参与者参与本研究的时间长度约为14周。供测量血浆中的药物水平的血液样品在第36天(第4次访问)及在第70天(第7次访问)收集。供细胞色素p450-2d6(cyp2d6)基因型分析用的血液样品在第1天(基线访问)收集。
183、研究者或赞助单位可在间发疾病、不良事件、与参与者的健康或幸福感等有关的其它原因的情况下,或在不合作、不遵从医嘱、违反程序或其他管理上的原因的情况下,中止参与者继续参与研究。此外,当参与者在随机分派后的任一时间所呈现的qtc间隔(bazett-校正的qt(qtcb)或fridericia-校正的qt(qtcf))大于500毫秒(除非是由于心室起搏)或其筛选心电图(ecg)结果的qtc间隔变化大于60毫秒时,其退出研究。评估qtc数值的临床显著性并且记录下来。要求在研究完成前退出的参与者回到诊所来完成第7次访问(研究结束时)的评估。若参与者在研究完成前退出或停止参与,则尽一切努力来记录参与者的结果。如果参与者退出研究,若护理者和/或参与者的代表撤回对于未来信息披露的同意书,则不再进行进一步的评估,亦不再收集附加的数据。
184、参与者与护理者已被告知,参与者应该大约每12小时±4小时(早晨与晚上)用水服用研究用药。所提供的avp-923与安慰剂的胶囊具有相同外观,并装于有防儿童取用的盖子的85cc的白色塑胶瓶中,一个瓶子有白色标签供早晨给药,一个瓶子有蓝色标签供晚上给药。avp-923胶囊与安慰剂胶囊的组成示于表2。
185、表2:
186、 成分(mg的量) avp-923-30 avp-923-20 安慰剂 右美沙芬氢溴酸盐usp,ep 30.00 20.00 0 硫酸奎尼丁二水合物usp,ep 10.00 10.00 0 交联羧甲基纤维素钠nf 7.80 7.80 7.80 微晶纤维素nf 94.00 94.00 94.00 胶体二氧化硅nf 0.65 0.65 0.65 乳糖一水合物nf 116.90 126.90 156.90 硬脂酸镁nf 0.65 0.65 0.65
187、ep=欧洲药典;usp=美国药典;nf=国家药品集
188、参与者与护理者被告知要在第8天、第22天、第36天、第43天、第57天及第70天(第2至7次访问)将任何未服用的研究用药及空瓶带到诊所。就本研究而言,遵嘱性定义为参与者服用至少80%的给定剂量。向护理者提供日志卡,及告知护理者每天记录所服用的胶囊数量及服药时间。在第8天、第22天、第36天、第43天、第57天及第70天(第2至7次访问)或在提早终止参与研究的时间点上收集日志卡。
189、功效
190、主要疗效终点为在激越行为/攻击行为npi领域的改善。次要疗效终点包括与下列各项的基线相比的变化:npi总评分(范围:1-144);各npi领域评分;及包含激越行为/攻击行为、异常的动作行为及易怒性/不稳定性领域加上焦虑(npi4a)或去抑制化行为(npi4d)的npi综合评分。就各被认定为阳性的npi领域取得npi-护理者的困扰评分(npi-cds;0-5,从毫无困扰至非常困扰)。在第5周与第10周对以下进行评估,其提供了用以衡量临床意义的量度:阿尔茨海默症合作研究-变化的临床总体印象评分(adcs-cgic;1-7,从显著改善至明显恶化)及由护理者评比的对于变化的患者总体印象(pgi-c)评分(1至7分,从改善许多至恶化许多)。其他的次要终点包括adcs-日常生活的活动清单(adcs-adl;0至54分,评分越高表示功能越好);csdd(0至38分,评分越高表示抑郁症越严重);护理者压力指数(csi;0至13分,评分越高表示压力水平越高);生活品质-阿尔茨海默症(qol-ad;13至52分,评分越高表示生活品质越好);及精神科用药的变化/应急性使用劳拉西泮。使用mmse(0至30分,评分越低表示认知缺损越大)与阿尔茨海默症评估量表-认知子量表(adas-cog;0至70分,评分越高表示认知缺损越大)来评估认知能力。安全性结果包括不良事件(ae)、生命体征、临床实验室检验结果及ecg结果。就心率的变异进行qt间隔结果的校正,并采用qtcf(qt/3√[rr])计算。
191、在研究期间的下列时间点评估上述的疗效参数:在基线及第1、3、5、6、8及10周评估csi及所有的npi领域;在基线及第5与第10周评估adcs-cgic激越行为、qol-ad(护理者)及adas-cog;在筛选时及在第5与第10周评估csdd与mmse;及在第5与第10周评估pgi-c。
192、基于所公开的连续平行比较设计(spcd)方法(fava等人,psychother.psychosom.2003;72(3):115-127;chen等人,contemp.clin.trials.,2011;32(4):592-604),分析主要与次要疗效终点,其采用普通最小二乘法(ols),按1:1的权重,分析来自两个5周的阶段的数据,且在第一阶段中包括所有参与者而在第二阶段中仅包括经重新随机分派的安慰剂组无反应者(图2)。事前设定主要研究终点分析;并未进行校正来解决次要终点的多重性。采用α=0.05显著性水平的双侧检验,比较右美沙芬/奎尼丁组与安慰剂组。此外,采用以治疗作为固定效应及基线作为协变量的协方差分析(ancova),来分别比较在各阶段与访问的治疗组的平均值。最后,为模拟一项为期10周的平行臂设计(如图2中所示),在为期10周的整个试验期间在经随机分派仅接受右美沙芬/奎尼丁(n=93)或仅接受安慰剂(n=66)的参与者(不论反应者的状态)之间,就npi激越行为/攻击行为评分进行事前设定的比较。使用第9.1版或更高版本(sas institute,cary,nc,usa)进行所有统计分析。
193、鉴于采用spcd方法,及为了对于来自主要分析的发现提供保证,进行了主要终点的更多的探察性灵敏度分析。其中之一采用doros等人(doros等人,stat.med.2013;32(16):2767-2789)所述的重复测量模型(mmrm,预先设定的),以测试遗漏数据及排除在第二阶段中经重新随机分派的安慰剂组“有反应者”的潜在影响。该模型使用npi激越行为/攻击行为领域中所有可取得的数据。采用三个独立的模型,以估计治疗效应,且包括在基线、在第一阶段结束时及在第二阶段结束时所收集的数据,其中通用模型容许纳入中间访问的数据。根据fda的建议,在研究揭盲之后,所进行的主要终点的第二灵敏度分析,其在spcd中使用似不相关回归(sur)方法(doros等人,stat.med.2013;32(16):2767-2789;zellner等人,j.am.stat.assoc.1962;57(298):348-368;tamura和huang,clin.trials.2007;4(4):309-317),而非ols方法,以厘清遗漏数据的遗失是否可为非随机性。除了上述之外,进行主要终点的预先设定的探察性分析,其采用主要分析所用的上述相同的spcd方法,但同时包括在第二阶段中经重新随机分派的安慰剂组有反应者与无反应者。
194、在已发表的痴呆相关激越行为的治疗研究中,npi激越行为/攻击行为评分变化的标准差(sd)的估算值为3.1至5.2分(herrmann等人,cnsdrugs.2011;25(5):425-433;mintzer等人,am.j.geriatr.psychiatry.2007;15(11):918-931;herrmann等人,dement.geriatr.cogn.disord.2007;23(2):116-119)。假设标准差为5.0分,且基于显著性水平为5%的来自独立样品平均值的一项双侧、二样品的比较,计算196名参与者的样本量以在检测出2.5分的平均差异上提供90%检验力(power)。样本量的计算基于平行设计,因为在治疗阿尔茨海默症患者的激越行为方面并无spcd试验的先例。
195、安全性分析组包括曾服用至少一个剂量的研究用药所有参与者。针对疗效的调整意向治疗(mitt)分析组,包括在第一阶段中具有基线后npi激越行为/攻击行为评估的所有参与者。使用最后一次观察来推算遗漏数据。
196、在安全性分析组中纳入了所有220名随机参与者(126名女性及94名男性);在针对疗效的mitt分析组包括了218名参与者,且194名(88.2%)完成了本研究(图3)。在进入第二阶段时,通过spcd及安慰剂组的重新随机分派,总共有152名参与者接受右美沙芬/奎尼丁(93名从第一阶段开始而另外的49名在第二阶段中从安慰剂组重新随机分派),且127名参与者接受安慰剂,使得右美沙芬/奎尼丁的暴露(1153名患者-周)约比安慰剂的暴露(911名患者-周)高约26.7%。接受右美沙芬/奎尼丁的参与者中有17名(11.2%)中途停止参与,而接受安慰剂的参与者中有9名(7.1%)中途停止参与,其中分别有8名(5.3%)与4名(3.1%)是由于不良事件(ae)。各治疗组在参与者特征上取得良好的平衡,且示于表3与表4(mitt疗效组)。在第二阶段的重新随机分派的组之间亦有良好的平衡。mitt spcd经重新随机分派的安慰剂组的特征示于表5。
197、表3:
198、
199、
200、各治疗组的参与者特征。a随机分派的安全性分析组;b用于疗效分析的调整意向治疗分析群组(安慰剂,n=125;右美沙芬/奎尼丁,n=93)。
201、表4:
202、
203、
204、基于第一阶段随机分派的调整意向治疗(mitt)疗效群体。“大量”代谢者包括“正常”代谢者与“正常或中等”代谢者。
205、表5:
206、
207、
208、
209、调整意向治疗(mitt)连续平行比较设计(spcd)的第二阶段经重新随机分派的安慰剂无反应者。“大量”代谢者包括“正常”代谢者与“正常或中等”代谢者。
210、在mitt群体中的主要spcd分析中,相较于安慰剂,右美沙芬/奎尼丁显著改善npi激越行为/攻击行为评分(ols z-统计:-3.95;p<0.001)。各阶段的结果亦显示右美沙芬/奎尼丁优于安慰剂(表6)。在第一阶段中,接受右美沙芬/奎尼丁者的npi激越行为/攻击行为评分平均值(95% ci)从7.1(6.6,7.6)降至3.8(3.1,4.5),而接受安慰剂者从7.0(6.6,7.4)降至5.3(4.7,5.9)(p<0.001),最小二乘法(ls)的平均值(95% ci)治疗差异为-1.5(-2.3,-0.7)。在第1周即注意到差别反应(-0.8[-1.5,-0.03];p=.04;图4)。在第二阶段(安慰剂无反应者经重新随机分派接受右美沙芬/奎尼丁或安慰剂),接受右美沙芬/奎尼丁者的平均(95% ci)npi激越行为/攻击行为评分从5.8(4.9,6.7)降至3.8(2.9,4.7),而接受安慰剂者从6.7(5.9,7.5)降至5.8(4.7,6.9)(p=0.02),ls平均(95% ci)治疗差异为-1.6[-2.9,-0.3];图5)。npi激越行为/攻击行为领域的改善在第1周及在研究结束前的每个时间点上具有统计显著性,除了第6周(在第二阶段期间)之外。在为期10周的整个试验期间,在经随机分派仅接受右美沙芬/奎尼丁(n=93)或仅接受安慰剂(n=66)的参与者(不论其是否为有反应者状态,模拟如图2中所示的平行臂设计)之间,进行npi激越行为/攻击行为评分的预先设定的比较,亦显示右美沙芬/奎尼丁优于安慰剂(ls平均治疗差异[95% ci]为-1.8[-2.8,-0.7];表6、图6)。相较于安慰剂,对于右美沙芬/奎尼丁的响应似乎并未因疾病阶段而有所不同。按基线mmse评分(>15vs≤15)与基线cgis(4或5vs.6或7)的分层随机分派,在激越行为与认知功能方面产生了平衡的治疗组。进行了用于评估这些因素的潜在影响的补充分析,而这些补充分析并未显示在反应上有差异,虽然在这些分析中有些分层的数量小,且这项观察将需要在较大型试验中加以确认。
211、表6:
212、
213、
214、
215、
216、*治疗差异:右美沙芬/奎尼丁-安慰剂;a第一阶段:包括所有参与者并测量各结果从第一阶段基线至第5周的变化;b第二阶段:仅包括来自第一阶段的经重新随机分派的安慰剂无反应者,并测量所有结果从第二阶段基线(第5周)至第10周的变化,除了pgi-c(原始的第一阶段基线至第10周);c十周分析仅包括在整个参与研究期间皆维持其原有治疗的参与者(即仅服用右美沙芬/奎尼丁或仅服用安慰剂,以模拟平行比较设计),并测量第一阶段基线至第10周;d在基线、第1、3、5、6、8及10周进行评估;e在基线、第5与第10周进行评估;f在筛选时、第5与第10周进行评估;g在第5与第10周进行评估。hspcd(连续平行比较设计)分析是针对主要疗效分析所指定的程序,且基于研究的各阶段的npi激越行为/攻击行为领域的50/50权重,将第一阶段中所有患者及第二阶段中经重新随机分派的“安慰剂无反应者”的结果合并;i对于qol-ad(护理者)而言,由护理者评量患者的生活品质;各阶段的p值基于协方差分析(ancova)分析;spcd分析的p值系基于普通最小二乘法(ols)。
217、预先设定的次要结果的spcd分析(表6)显示,右美沙芬/奎尼丁在总评量分数(pgi-c与cgic)、npi总评分、npi异常动作行为及易怒性/不稳定性领域、npi 4a与4d总分、npi护理者的困扰(同时包括激越行为/攻击行为领域及总体)、csi及csdd方面的改善明显更好。相对于安慰剂而言,qol-ad、adcs-adl、mmse及adas-cog(探察性结果)的变化结果并不显著。事后分析显示,相较于未服用这些药剂的参与者而言,右美沙芬/奎尼丁在伴随服用乙酰胆碱酯酶抑制剂、美金刚、抗抑郁剂或抗精神病药物的参与者中,产生类似的npi激越行为/攻击行为评分的改善。在接受右美沙芬/奎尼丁及接受安慰剂的参与者中,分别在152名中有10名(6.6%)及在125名中有13名(10.4%)使用了劳拉西泮作为应急用药。在为期10周的治疗结束时,就adcs-cgic而言,仅用右美沙芬/奎尼丁治疗的参与者(n=82)中有45.1%被判定为“有很大的改善”或“有极大的改善”,相比较,仅服用安慰剂的参与者(n=59)中有27.1%被如此判定。
218、安全性与耐受性
219、接受多种伴随用药的群体对于右美沙芬/奎尼丁的耐受性普遍良好,并未伴有认知功能损害。基于不良事件发生时所指派的治疗,来归属治疗后出现的不良事件(teae)。在用右美沙芬/奎尼丁或用安慰剂治疗期间,参与者(安全性组)中,分别在152名中有93名(61.2%)及在127名中有55名(43.3%)报告发生teae。就右美沙芬/奎尼丁相对于安慰剂而言,最常发生的teae(>3%)分别为跌倒(8.6%vs 3.9%)、腹泻(5.9%vs 3.1%)、尿道感染(5.3%vs3.9%)、头晕(4.6%vs 2.4%)及激越行为(3.3%vs 4.7%)。12名(7.9%)接受右美沙芬/奎尼丁的参与者及6名(4.7%)接受安慰剂的参与者出现严重不良事件(sae)。接受右美沙芬/奎尼丁的参与者所出现的sae包括胸痛(n=2)、贫血、急性心肌梗塞(在给药结束后2天发生)、心搏过缓、肾脏感染、股骨骨折、脱水、结肠癌、脑血管意外、攻击行为及血尿(每种的n=1)。接受安慰剂的参与者所出现的sae包括特发性血小板减少性紫瘢、眩晕、肺炎、胃肠炎、挫伤、暂时性脑缺血及激越行为(每种的n=1)。接受右美沙芬/奎尼丁的参与者中有8名(5.3%)及接受安慰剂的参与者中有4名(3.1%)因为不良事件而停止治疗,其中分别有4名(2.6%)与2名(1.6%)是因为sae。研究期间并无死亡事件发生。
220、在接受右美沙芬/奎尼丁期间跌倒的13名参与者当中,9名已有既往的跌倒记录。在两种情况中,3名参与者在研究结束后2至4天跌倒,及1名参与者在接受劳拉西泮应急用药后24小时内跌倒二次;在接受安慰剂期间跌倒的参与者并无既往的跌倒记录。有二次的跌倒伴有严重不良事件(sae):接受右美沙芬/奎尼丁的参与者发生股骨骨折,而接受安慰剂的参与者发生挫伤。
221、在ecg参数上并未在组别间观察到具有临床意义的差异。在最后一次访问时,接受右美沙芬/奎尼丁的参与者(n=138)及接受安慰剂的参与者(n=60)的qtcf平均值(sd)分别为5.3(14.06)毫秒及-0.3(12.96)毫秒。接受avp 923的参与者中有15名(10.3%)及接受安慰剂的参与者中有8名(6.7%)在任一次访问时的qtcf变化≥30毫秒;一名接受安慰剂的参与者的qtcf变化>60毫秒。并无参与者的qtcf>500毫秒。
222、表6及图4、图5与图6中所呈现的数据清楚表示,相较于安慰剂,右美沙芬与奎尼丁的组合在治疗可能患有阿尔茨海默症的患者的激越行为与攻击行为上显著有效。此外,年长群体对于该组合的耐受性普遍良好,并未伴有认知功能损害、镇静作用或临床上显著的qtc延长作用。
223、实施例2:研究用avp-786治疗阿尔茨海默症中激越行为的原理
224、avp-786为氘化(d6)-右美沙芬氢溴酸盐(d6-dm)和硫酸奎尼丁(q)的组合产物,氘化(d6)-右美沙芬氢溴酸盐为中枢神经系统(cns)-活性成分,而硫酸奎尼丁经由细胞色素p450(cyp)肝同工酶2d6(cyp2d6)被用作d6-dm代谢的抑制剂。avp-786可提供对于治疗阿尔茨海默症受试者(ad)的激越行为的临床效益。
225、d6-dm与负责调节谷氨酸、单胺、sigma-1及烟碱型胆碱能通路的受体结合,这可能是中枢神经系统治疗的关键。本发明人用d6-dm所进行的药理学研究已经证实,氘化作用并未改变dm的基础药理。同时,药代动力学(pk)与药物代谢研究显示,d6-dm的代谢是经由与dm相同的代谢途径,但氘化作用导致通过cyp2d6的代谢速率降低。
226、本发明人最近所进行的ii期研究达到了主要疗效终点,且相较于接受安慰剂的患者,接受avp-923的患者显示在激越行为上的明显改善。本研究为一项为期10周的随机、双盲、安慰剂对照的二阶段连续平行比较设计(spcd)的研究,其用于评估avp-923在220名阿尔茨海默症患者中治疗激越行为的疗效、安全性及耐受性。由神经精神症状问卷(npi)的激越行为/攻击行为领域的测量可见,相较于接受安慰剂的患者,接受avp-923的患者的激越行为显著减少(p<0.001)。所研究的次要终点中的大部分(如npi-总分、npi-激越行为/攻击行为领域护理者的困扰、对于变化的临床总体印象[cgic]-激越行为、对于严重性的临床总体印象[cgis]-激越行为及对于变化的患者总体印象[pgic])也是统计上显著的。临床医师及患者/护理者对于变化的印象,均证实所观察到的激越行为改善的临床意义。如简易精神状态检查(mmse)与阿尔茨海默症评估量表-认知子量表(adas-cog)所测得,在认知方面观察到数值上的有利反应,但均未达到统计显著性。
227、本发明人所进行的进一步研究已显示,右美沙芬(dm)的d6-氘修饰作用降低了cyp2d6代谢作用的速率,使得与显著较低剂量的奎尼丁(低于avp-923中所含奎尼丁的量的50%)的组合足以分别在avp-786与avp-923中达到d6-dm与dm的生物等效性。avp-786中的较低量的奎尼丁可减少与其他cyp2d6底物的相互作用,即使在cyp3a4抑制剂存在下亦限制奎尼丁的水平,且减少对于心脏复极与qtc间隔的影响。
228、实施例3:用于评估avp-786(氘化[d6]-右美沙芬氢溴酸盐[d6-dm]/硫酸奎尼丁[q])在治疗阿尔茨海默型痴呆患者的激越行为上的疗效、安全性及耐受性的3期、多中心、随机、双盲、安慰剂对照的研究
229、本研究被设计用于评估avp-786在治疗阿尔茨海默型痴呆患者的激越行为上的疗效、安全性及耐受性。
230、avp-786治疗持续期的原理
231、为期12周的治疗期间被认为是评估疗效的最佳治疗持续期,且基于用avp-923所进行的研究12-avr-131的数据的审查(papakostas gi等人,am jpsychiatry.2012;169(12):1267-1274;marshall r,leigh-pemberton r,memisoglu a,等人,opioidmodulation:a novel mechanism for the treatment of depression:results of thealks 5461phase 2study.2004;2:5461)。在为期12周的整个研究期间,患者被指派接受相同的治疗,同时容许在一段更长的时间评估治疗反应。
232、研究人群
233、患者数目:将约有380名患者在美国约60个中心加入研究。
234、病症/疾病:出现阿尔茨海默型痴呆所继发的激越行为的患者。可能患有阿尔茨海默症的诊断将根据美国国家老年研究所(nia)-阿尔茨海默症协会(aa)工作小组所发布的“2011diagnostic guidelines for alzheimer’sdisease”(mckhann gm等人,alzheimersdement.2011;7(3):263-269)。激越行为的诊断将根据国际老年精神病学学会(ipa)的激越行为定义工作小组所制订的有关认知障碍患者中激越行为的暂定共识定义(cummings j等人,int psychogeriatr.2014:1-11)。
235、关键入选标准:在筛选时具有临床上显著的中度/重度激越行为且该行为在随机分派前持续至少2周的患者,该激越行为干扰日常生活,且根据研究者的意见指示适用处方用药。在筛选时及在基线的病情严重程度的临床总体印象量表(cgis)的激越行为评分≥4(病情中等严重)方能参与研究。合格的患者必需有一名可靠的护理者,这名护理者能够且乐意遵守研究程序,包括在研究期间不给予任何禁用的药物。
236、关键剔除标准:所患有的主要是非阿尔茨海默型痴呆(如血管型痴呆、额颞叶型痴呆、帕金森病、精神活性物质-诱导的痴呆)的患者,和所具有的激越行为并非阿尔茨海默症继发型(例如继发于疼痛、其它精神性疾病或谵妄症)的患者,将不符合参与资格。
237、研究设计
238、结构:这是一项iii期、多中心、随机、双盲、安慰剂对照的研究。
239、持续期间:患者将参加这项研究达约16周;其中包括4周的筛选期及12周的治疗期。
240、研究治疗:研究产品为avp-786(氘化[d6]-右美沙芬氢溴酸盐[d6-dm]/硫酸奎尼丁[q])。将评估avp-786的二种剂量:d6-dm 28mg/q 4.9mg和d6-dm 18mg/q 4.9mg,此后分别称作avp-786-28/4.9与avp-786-18/4.9。
241、avp-786的组成:研究产品与安慰剂的二种剂量的定性与定量组成均列于以下表7。
242、表7:
243、
244、
245、ep-欧洲药典;usp-美国药典;nf-国家处方集
246、对照:将使用外观与研究用药相同的安慰剂胶囊作为对照。
247、随机分派/分层:在研究中随机分派合格的患者接受avp-786-28/4.9胶囊、avp-786-18/4.9胶囊或匹配的安慰剂胶囊。随机分派将按神经精神症状问卷(npi)的激越行为/攻击行为领域评分(≤6vs.>6)、跌倒风险的评估(正常/轻度vs.中度/重度)及伴随使用抗精神病药物(是vs.否)进行分层。
248、给药方案:在基线访问时,随机指派合格的患者接受avp-786或匹配的安慰剂胶囊。在研究的前7天,被随机分派接受avp-786-28/4.9的患者将开始在每天早晨接受avp-786-18/4.9一次及在晚上接受安慰剂。从第8天起,患者将每天接受avp-786-18/4.9两次,为期14天。从第22天起,在研究所剩下的9周期间,患者将每天接受avp-786-28/4.9两次。在研究的前7天,被随机分派接受avp-786-18/4.9的患者将开始在每天早晨接受avp-786-18/4.9一次及在晚上接受安慰剂。从第8天起,在研究所剩下的11周期间,患者将每天接受avp-786-18/4.9两次。患者将有至少50%的机会在研究期间的某个时点接受avp-786。研究药物将在整个研究中每天口服给药两次(bid,早上1个胶囊和晚上1个胶囊,相隔约12小时)。
249、评价和访问
250、患者将在筛选、基线(第1天)和第8天(第1周)、第22天(第3周)、第43天(第6周)、第64天(第9周)和第85天(第12周)参加临床访问。将在第29天(第4周)和第71天(第10周)进行安全性电话随访。研究程序将在每次访问时进行,如评价和访问时间表(表8)所述。在整个研究中,尽可能由同一评估者进行评估。
251、表8:评价和访问时间表
252、
253、
254、adas-cog-阿尔茨海默症评估量表-认知子量表;adcs-cgic-对于变化的临床总体印象;ae-不良事件;cgis-疾病严重程度的临床总体印象;csdd-康奈尔痴呆抑郁症量表;demqol-痴呆生活质量量表;ecg-心电图;eq-5d-5l-euroqol 5维5级;et-提前终止;gmhr-通用医疗健康评级;mmse-简易精神状态检查;npi-神经精神病问卷;pgic-由护理者评定的变化的患者总体印象;pk-药代动力学;rud-痴呆的资源利用;s-sts-sheehan自杀跟踪量表;tug-计时起立行走;zbi-zarit负荷访谈
255、1研究访问有+/-3天的窗口,基线、访问2和电话除外。基线、访问2和电话有+3天的窗口。
256、2应向患者/护理者打电话,以收集不良事件并查询并用药物的情况。
257、3在研究完成前退出的患者提前终止访问。
258、4从研究早期终止或不进行延伸研究(研究15-avp-786-303)的患者将在最后一次给药研究药物后的30天接受安全性电话随访。
259、5对于每个患者,将完成一个方案适格性表格。
260、6体重应该仅在基线访问时测量。
261、7只应进行tug测试以进行访问4和6的跌倒风险评估。
262、8ecg在给药前和给药后进行。
263、9只有npi的激越行为/攻击行为领域应在筛选访问时进行。其应在cgis之前进行。
264、10代理人版本由护理者评定。非代理人版本仅由基线时mmse评分≥10的患者评定。
265、11adas-cog只能由基线时mmse评分≥10的患者评定。
266、12pgic由护理者评定。
267、13应该从患者带来的吸塑卡中给药研究药物。在检查合格之后,应将吸塑卡和日志卡退回给患者/护理者。
268、14筛查访问时应进行甲状腺功能试验(tsh,和反射t3和t4,如果tsh异常的话)。
269、15只对有生育能力的女性进行尿妊娠试验。
270、响应测量
271、疗效的主要量度:将采用神经精神症状问卷(npi)的激越行为/攻击行为领域进行主要疗效的评估。
272、疗效的次要量度:次要疗效量度包括对于变化的临床总体印象(cgic)-激越行为、npi-激越行为/攻击行为领域的护理者的困扰评分、npi-异常的动作行为领域、zarit负荷访谈(zbi)、npi-易怒性/不稳定性领域、对于变化的患者总体印象(pgic,由护理者所评量)、痴呆生活品质(demqol)、康奈尔(cornell)痴呆抑郁量表(csdd)、痴呆的资源应用(rud)、总npi评分、cgis激越行为、阿尔茨海默症评估量表-认知子量表(adas-cog)、一般医疗健康评级(gmhr)及euroqol 5维5级(eq-5d-5l)。
273、药代动力学:将测量d6-dm、其代谢产物和q的血浆浓度。
274、安全性与耐受性:通过所报告的不良事件(ae)、身体与神经系统检查、生命体征、临床实验室评估、静息12导联心电图(ecg)、sheehan自杀倾向追踪量表(s-sts)、简易精神状态检查(mmse)及计时起身行走(tug)测试,评估avp-786的安全性与耐受性。将针对具有生育能力的女性进行妊娠试验。
275、通用统计方法与分析类型
276、疗效分析:本研究的主要疗效终点为从基线至第12周(第85天)的npi激越行为/攻击行为领域评分的变化。通过在观察的数据上采用一种以可能性为基础的线性混合效应模型重复测量(mmrm),而估算治疗效果。对于两个主要的比较:avp-786-28/4.9vs.安慰剂和avp-786-18/4.9vs.安慰剂,将使用门控-保持程序来控制在双侧α=0.05处的总体i型误差。次要功效终点包括以下功效测量的从基线到第12周(第85天)的变化:cgic激越行为、npi-激越行为/攻击行为领域护理者的困扰评分、npi-异常运动行为领域、zbi、npi-易怒性/不稳定性领域、pgic、demqol、csdd、rud、总npi、cgis激越行为、adas-cog、gmhr和eq-5d-5l。
277、安全性分析:将通过治疗组总结安全性量度。
278、样品大小计算:假设avp-786-28/4.9(高剂量)相对于安慰剂的主要功效终点的双变量正态分布,进行检验力计算。基于所完成的ii期研究的结果,假定治疗差异为-2.1,标准偏差为4.7(效应大小为-0.45)。总累积退出率为20%。在avp-786-28/4.9相对于安慰剂的比较中,所计划纳入的380名患者产生约93%的检验力来拒绝无效假设,其中在双侧α=0.05水平具有类型一的错误率。为将总体i型误差率控制在0.05的水平,关于低剂量avp-786-18/4.9的无效假设将仅在高剂量的无效假设被拒绝时被测试。
279、实施例4:iii期、多中心、随机、双盲、安慰剂对照的研究,以评估avp-786(氘化[d6]-右美沙芬氢溴酸盐[d6-dm]/硫酸奎尼丁[q])在治疗患有阿尔茨海默型痴呆的患者的激越行为方面的疗效、安全性和耐受性
280、研究的目的是评估用于治疗阿尔茨海默型痴呆患者的激越行为的avp-786相较于安慰剂的疗效、安全性及耐受性。
281、被开发用于治疗慢性病症的药物需显示持续的效应。专家与主管机关一般认为12周的治疗持续期是用于评估供长期使用的化合物的急性与慢性效应及安全性的合理时间范围。为确保耐受性,分配至研究治疗(avp-786)的患者将被逐步暴露于更高剂量;从每天给药低剂量(avp-786-18/4.9)一次持续一周开始,接着每天给药低剂量二次,为期二周,然后在所剩下的9周研究期间每天给药高剂量(avp-786-28/4.9)二次。此外,对于在高剂量出现耐受性问题的患者,将容许一次性地向下调定至低剂量。
282、研究人群
283、患者数目:将约有325名患者在美国约50个中心加入研究。
284、病症/疾病:出现阿尔茨海默型痴呆所继发的激越行为的患者。可能患有阿尔茨海默症的诊断将根据美国国家老年研究所(nia)-阿尔茨海默症协会(aa)工作小组所发布的“2011diagnostic guidelines for alzheimer’sdisease”(mckhann gm等人,alzheimersdement.2011;7(3):263-269)。激越行为的诊断将根据国际老年精神病学学会(ipa)的激越行为定义工作小组所制订的患有认知障碍患者中激越行为的暂定共识定义(cummings j等人,mintzer j,brodaty h等人agitation in cognitive disorders:internationalpsychogeriatric association provisional consensus clinical and researchdefinition.int psychogeriatr.2014:1-11)。
285、关键入选标准:在筛选时具有临床上显著的中度/重度激越行为且该行为在随机分派前持续至少2周的患者,该激越行为干扰日常生活,且根据研究者的意见指示适用处方用药。在筛选时及在基线的病情严重程度的临床总体印象量表(cgis)的激越行为评分≥4(病情中等严重)方能参与研究。合格的患者必需有一名可靠的护理者,这名护理者能够且乐意遵守研究程序,包括在研究期间不给予任何禁用的药物。
286、关键剔除标准:所患有的主要是非阿尔茨海默型痴呆(如血管型痴呆、额颞叶型痴呆、帕金森病、精神活性物质-诱导的痴呆)的患者,和所具有的激越行为并非阿尔茨海默症继发型(例如继发于疼痛、其它精神性疾病或谵妄症)的患者,将不符合参与资格。
287、研究设计
288、结构:这是一项iii期、多中心、随机、双盲、安慰剂对照研究。
289、持续期间:患者将参加这项研究达约16周;其中包括4周的筛选期及12周的治疗期。
290、研究治疗:研究产品为avp-786(氘化[d6]-右美沙芬氢溴酸盐[d6-dm]/硫酸奎尼丁[q])。将通过滴定(titration)评估avp-786的二种剂量:d6-dm 28mg/q 4.9mg和d6-dm18mg/q 4.9mg,此后分别将其称作avp-786-28/4.9与avp-786-18/4.9。
291、avp-786的组成:研究产品与安慰剂的二种剂量的定性与定量组成列于以下表9。
292、表9:
293、
294、ep-欧洲药典;usp-美国药典;nf-国家处方集
295、对照:将使用外观与研究用药相同的安慰剂胶囊作为对照。
296、随机分派/分层:在研究中随机分派合格的患者接受avp-786胶囊或匹配的安慰剂胶囊。随机分派将按神经精神症状问卷(npi)的激越行为/攻击行为领域评分(≤6vs.>6)、跌倒风险的评估(正常/轻度vs.中度/重度)及伴随使用抗精神病药物(是vs.否)进行分层。
297、给药方案:在基线访问时,随机指派合格的患者接受avp-786或匹配的安慰剂胶囊。研究药物将在整个研究中每天口服给药两次(bid,早上1个胶囊和晚上1个胶囊,相隔约12小时)。在研究的前7天,被随机分派接受avp-786的患者将在开始时每天早晨接受avp-786-18/4.9一次及在晚上接受安慰剂。从第8天起,患者将每天接受avp-786-18/4.9两次,为期14天。从第22天起,在研究所剩下的9周期间,患者将每天接受avp-786-28/4.9两次。如果研究者认为有必要,将在第3次访问后直至第5次访问及包括第5次访问在内(亦即第23天至第64天),允许将剂量一次性向下调整至avp-786-18/4.9,且患者在剩下的研究时间将被维持在较低的研究药物剂量。需要剂量调整的患者需要进行不定期的访问以进行安全性评估。在研究期间的某个时间点,患者将有至少50%的机会接受avp-786。
298、评价和访问
299、患者将在筛选、基线(第1天)和第8天(第1周)、第22天(第3周)、第43天(第6周)、第64天(第9周)和第85天(第12周)进行临床访问。将在第29天(第4周)和第71天(第10周)进行安全性电话随访。研究程序将在每次访问时进行,如评价和访问时间表(表10)所述。
300、表10:评价和访问时间表
301、
302、
303、adas-cog-阿尔茨海默症评估量表-认知子量表;adcs-cgic-对于变化的临床总体印象;ae-不良事件;cgis-疾病严重程度的临床总体印象;csdd-康奈尔痴呆抑郁症量表;demqol-痴呆生活质量量表;ecg-心电图;eq-5d-5l-euroqol 5维5级;et-提前终止;gmhr-通用医疗健康评级;mmse-简易精神状态检查;npi-神经精神病问卷;pgic-由护理者评定的变化的患者总体印象;pk-药代动力学;rud-痴呆的资源利用;s-sts-sheehan自杀跟踪量表;tug-计时起立行走;zbi-zarit负荷访谈
304、1研究访问有+/-3天的窗口,除了基线、访问2和电话访谈除外。基线、访问2和电话访谈有+3天的窗口。
305、2应向患者/护理人员打电话,以收集不良事件并查询并用药物的情况。
306、3在研究完成前退出的患者提前终止访问。
307、4从研究早期终止或不进行延伸研究(研究15-avp-786-303)的患者将在最后一次研究药物给药后30天接受安全性电话随访。
308、5对于每个患者,将完成一个方案适格性表格。
309、6体重应该仅在基线访问时测量。
310、7只应进行tug测试以进行访问4和6的跌倒风险评估。
311、8ecg在给药前和给药后进行。
312、9只有npi的激越行为/攻击行为领域应在筛选访问时进行。其应在cgis之前进行。
313、10代理人版本由护理者评定。非代理人版本仅由基线时mmse评分≥10的患者评定。
314、11adas-cog只能由基线时mmse评分≥10的患者评定。
315、12pgic由护理者评定。
316、13应该从患者带来的吸塑卡中给药研究药物。在检查合格之后,应将吸塑卡和日志卡退回给患者/护理人员。
317、14筛查访问时应进行甲状腺功能试验(tsh,和反射t3和t4,如果tsh异常的话)。
318、15只对有生育能力的女性进行尿妊娠试验。
319、16在第3次访问(第3周)后直至第5次访问(第9周)及包括第5次访问(第9周)在内,即第23天至第64天,允许将剂量一次性向下调整。患者将需要回到诊所进行一次未预先安排的访问,以进行安全性评估。
320、响应测量
321、疗效的主要量度:将采用神经精神症状问卷(npi)的激越行为/攻击行为领域进行主要疗效的评估。
322、疗效的次要量度:次要疗效量度包括对于变化的临床总体印象(cgic)-激越行为、npi-激越行为/攻击行为领域的护理者的困扰评分、npi-异常的动作行为领域、zarit负荷访谈(zbi)、npi-易怒性/不稳定性领域、对于变化的患者总体印象(pgic,由护理者所评量)、痴呆生活品质(demqol)、康奈尔(cornell)痴呆抑郁量表(csdd)、痴呆的资源应用(rud)、总npi评分、cgis激越行为、阿尔茨海默症评估量表-认知子量表(adas-cog)、一般医疗健康评级(gmhr)及euroqol 5维5级(eq-5d-5l)。
323、药代动力学:将测量d6-dm、其代谢产物和q的血浆浓度。
324、安全性与耐受性:通过所报告的不良事件(ae)、身体与神经系统检查、生命体征、临床实验室评估、静息12导联心电图(ecg)、sheehan自杀倾向追踪量表(s-sts)、简易精神状态检查(mmse)及计时起身行走(tug)测试,评估avp-786的安全性与耐受性。将针对具有生育能力的女性进行妊娠试验。
325、通用统计方法与分析类型
326、分析群体:将使用三种分析群体;调整意向治疗(mitt)、意向治疗(itt)及安全性。mitt群体包括在研究中经随机分派的所有患者(且有至少一次基线后疗效评估),且其将用于所有的疗效分析。mitt群体中的患者将被包括在治疗组中,在其中不论所接受的治疗为何,而对其进行随机分派。itt群体包括研究中的所有经随机分派的患者,且将用于探察性疗效分析。安全性群体包括接受研究治疗的所有患者,且将用于所有的安全性分析。患者将基于实际接受的治疗而被包括在治疗组中。
327、疗效分析:主要疗效终点为从基线至第12周(第85天)的npi激越行为/攻击行为领域评分的变化。通过采用线性混合效应模型重复测量(mmrm)而进行治疗的比较。该模型将包括对于治疗、访问、治疗与访问的相互作用、基线与访问的相互作用及基线协变量的固定效应,基线协变量包括基线数值及其他随机分派分层因素。将采用非结构化协方差模型。次要疗效终点包括下列疗效量度从基线至第12周(第85天)的变化:cgic激越行为、npi-激越行为/攻击行为领域的护理者困扰评分、npi-异常的动作行为领域、zbi、npi-易怒性/不稳定性领域、pgic、demqol、csdd、rud、总npi、cgis激越行为、adas-cog、gmhr及eq-5d-5l。
328、安全性分析:安全性分析将由生物参数与不良事件的数据汇总所组成。安全性分析将按治疗进行列表。
329、样本量的计算:假设主要疗效终点的二变量的常态分布,进行检验力的计算。在一项已完成的ii期研究中,针对主要疗效量度所观察到的治疗效应量在第一阶段中为-0.51,而在第二阶段中为-0.34。就该项为期12周的单一阶段研究而言,假设治疗效应量(avp-786vs.安慰剂)为-0.40。考虑到研究期间的退出率为20%,所计划的325名患者(~163/组)的总样本量将具有90%的检验力,其中在双侧α=0.05具有一型误差。
330、实施例5:avp-786(氘化[d6]右美沙芬氢溴酸盐[d6-dm]/硫酸奎尼丁[q])的用于治疗阿尔茨海默型痴呆患者的激越行为的安全性与疗效的iii期多中心、长期、延伸研究
331、研究的目的是评估用于治疗阿尔茨海默型痴呆患者的激越行为的avp-786的长期安全性与疗效维持性。
332、研究人群
333、患者数目:将约有550名患者在美国约110个中心加入研究。
334、病症/疾病:出现阿尔茨海默型痴呆所继发的激越行为的患者。可能患有阿尔茨海默症的诊断将根据美国国家老年研究所(nia)-阿尔茨海默症协会(aa)工作小组所发布的“2011diagnostic guidelines for alzheimer’sdisease”(mckhann gm等人,alzheimersdement.2011;7(3):263-269)。激越行为的诊断将根据国际老年精神病学学会(ipa)的激越行为定义工作小组所制订的有关认知障碍患者中激越行为的暂定共识定义(cummings j等人,mintzer j,brodaty h等人agitation in cognitive disorders:internationalpsychogeriatric association provisional consensus clinical and researchdefinition.int psychogeriatr.2014:1-11)。
335、关键入选标准:患者已成功完成研究15-avp-786-301、15-avp-786-302或12-avr-131。合格的患者必需有一名可靠的护理者,这名护理者能够且乐意遵守所有要求的研究程序,包括在研究期间不给予任何禁用的药物。
336、关键剔除标准:在离开研究15-avp-786-301与15-avp-786-302后,或就来自研究12-avr-131的患者而言在基线前的30天内,患者正在参与或已经参与其他介入型(药物或装置)的临床研究。患者同时存在临床显著或不稳定的全身性疾病,其可混淆研究的安全性结果的解释。
337、研究设计
338、结构:这是15-avp-786-301与15-avp-786-302iii期研究的一项iii期的多中心、长期、延伸研究,其亦允许纳入来自ii期研究12-avr-131的患者。来自研究15-avp-786-301与15-avp-786-302的患者将在先前研究的最后一次访问(第6次访问,第85天)的3天内加入本研究。虽然所有加入的患者都将接受avp-786,但对于患者、研究者、研究工作人员以及赞助商将屏蔽所指派的治疗剂量。
339、持续时间:患者将参与该研究约52周。
340、研究治疗:研究产品为avp-786(氘化[d6]-右美沙芬氢溴酸盐[d6-dm]/硫酸奎尼丁[q])。两个剂量的avp-786将通过滴定评估:d6-dm 28mg/q 4.9mg和d6-dm 18mg/q4.9mg,以下分别称为avp-786-28/4.9和avp-786-18/4.9。
341、avp-786的组成:二种剂量的研究产品的定性与定量组成列于以下表11。
342、表11:
343、
344、ep-欧洲药典;usp-美国药典;nf-国家药品集
345、1.avp-786-18/4.9剂量的吸塑卡将含有avp-786安慰剂胶囊,供第1至7天的晚间给药。
346、对照:无
347、治疗指派:按照在先前研究(15-avp-786-301与15-avp-786-302)中所接受的最后一次治疗及研究者对于剂量调整的评估,将按屏蔽方式,指派合格的患者接受avp-786-28/4.9或avp-786-18/4.9胶囊。将经由互动式网络回馈系统(iwrs)分配研究药物。
348、在先前研究中接受安慰剂的患者及来自研究12-avr-131的患者,将在本研究中被指派接受avp-786-18/4.9。先前接受avp-786-18/4.9的患者若不需要剂量调整,将被指派接受相同剂量;或者若研究者认为有必要增加剂量,则指派接受avp-786-28/4.9。先前接受avp-786-28/4.9的患者将由研究者酌情决定继续接受avp-786-28/4.9,或被指派接受较低剂量avp-786-18/4.9。
349、给药方案:在研究期间,将以口服方式每天给药研究药物二次(bid,在早晨服用一个胶囊及在晚上服用一个胶囊,间隔约12小时)。对于在先前研究中接受安慰剂的患者及来自研究12-avr-131的患者而言,第1至7天的晚间剂量将为avp-786安慰剂胶囊,且从第22天(第3周)起每天接受avp-786-28/4.9两次,除非需要调整剂量。由研究者酌情决定,可基于安全性理由,在研究期间的任何时间将研究药物的剂量向下逐步调整(titrate)。
350、评估与访问
351、在研究中安排了8次访问。患者将在基线(第1天)及第15天(第2周)、第43天(第6周)、第85天(第12周)、第169天(第24周)、第253天(第36周)、第337天(第48周)及第365天(第52周)参加门诊访问。将在第29天(第4周)、第127天(第18周)、第211天(第30周)及第295天(第42周)用电话进行安全性随访。由研究者酌情决定,需要调整剂量的患者可进行未预先安排的访问,以进行安全性评估。将如评估与访问时间表中所列,在各次访问时进行研究程序(表12)。
352、表12:
353、
354、
355、adas-cog-阿尔茨海默症评估量表-认知子量表;adcs-cgic-对于变化的临床总体印象;ae-不良事件;cgis-疾病严重程度的临床总体印象;csdd-康奈尔痴呆抑郁症量表;demqol-痴呆生活质量量表;ecg-心电图;eq-5d-5l-euroqol 5维5级;et-提前终止;gmhr-通用医疗健康评级;mmse-简易精神状态检查;npi-神经精神病问卷;pgic-由护理者评定的变化的患者总体印象;pk-药代动力学;rud-痴呆的资源利用;s-sts-sheehan自杀跟踪量表;tug-计时起立行走;zbi-zarit负荷访谈
356、1基线访问应在患者离开研究15-avp-786-301或15-avp-786-302的三天内进行。
357、2第2次(第15天)与第3次(第43天)研究访问及第29天的电话访谈有+/-3天的窗口。其他所有的研究访问及电话访谈有+/-7天的窗口。
358、3对于在研究结束前退出的患者进行提前终止的访问。
359、4就提早终止研究的患者而言,将在提前终止后的五天用电话联络患者/患者的护理者,以查询该名患者的整体状况。此外,所有患者将在接受最后一次剂量的30天后,接受一次后续电话随访。
360、5对于从研究15-avp-786-301与15-avp-786-302转入(rolling over)的患者而言,可在离开这些研究的访问时签署知情同意书。
361、6应仅针对来自研究12-avr-131的患者进行程序。
362、7在第5次与第8次访问时应仅进行用于评估跌倒风险的tug测试。
363、8将针对各患者填写方案适格性表格,其包括对纳入/剔除标准的审查。
364、9患者将经由iwrs而被指派接受avp-786d6 dm 28mg/q 4.9mg或d6 dm 18mg/q4.9mg。
365、10仅在基线访问时测量体重。
366、11ecg应在给药后2至3小时进行。
367、12就来自研究12-avr-131的患者而言,ecg应在给药前及给药后进行。
368、13在第4次、第6次及第7次访问时应仅进行npi的激越行为/攻击行为领域。其应在cgis前进行。
369、14代理人版本由护理者进行评量。非代理人版本仅由在基线时的mmse评分≥10的患者进行评量。
370、15adas-cog由在基线时的mmse评分≥10的患者进行评量。
371、16pgic由护理者进行评量。
372、17仅对于从研究12-avr-131入选的患者,还应在基线访问时进行甲状腺功能检查(tsh,和反射t3和t4,如果tsh异常的话)。
373、18仅针对具有生育能力的女性进行尿妊娠试验。
374、19研究药物应从患者所带来的吸塑卡给药。在审查遵嘱性后,应将吸塑包装盒与日志卡归还患者/护理者。
375、响应测量
376、安全性与耐受性:通过所报告的不良事件(ae)、身体与神经系统检查、生命体征、临床实验室评估、静息12导联心电图(ecg)、sheehan自杀倾向追踪量表(s-sts)、简易精神状态检查(mmse)、阿尔茨海默症评估量表-认知子量表(adas-cog)及计时起身行走(tug)测试,评估avp-786的安全性与耐受性。将针对具有生育能力的女性进行妊娠试验。
377、疗效:使用神经精神症状问卷(npi)、对于变化的临床总体印象(cgic)-激越行为、病情严重程度的临床总体印象量表(cgis)-激越行为、zarit负荷访谈(zbi)、对于变化的患者总体印象(pgic-由护理者进行评量)、痴呆生活品质(demqol)、康奈尔(cornell)痴呆抑郁量表(csdd)、痴呆的资源应用(rud)、总体健康状况评比(gmhr)、euroqol 5维5级(eq-5d-5l)及工具性日常生活活动(iadl)来评估疗效。
378、通用统计方法与分析类型
379、分析群体:包括接受研究治疗的所有患者的安全性群体将用于所有功效和安全性数据汇总。将呈现三个治疗组的安全性和功效:avp-786-28/4.9、avp-786-18/4.9,和所有组合的患者。不进行治疗比较。
380、安全性分析:将使用描述性统计和/或频率表格来总结安全性与耐受性的量度,其包括所报告的不良事件、生命体征、临床实验室评估、静息12联心电图、s-sts、mmse、adas-cog及tug。
381、疗效分析:对于按访问所观察到的疗效数据将提供概括统计。当适用时,将呈现所观察到的原始数值和与基线相比的变化。
382、样本量的计算:550名参与患者的样本量将提供足以符合法规要求的充分的研究药物暴露。
383、实施例6:在健康个体中的avp-786(氘化[d6]右美沙芬氢溴酸盐[dm]/硫酸奎尼丁[q])与帕罗西汀之间及avp-786与度洛西汀之间的i期、单中心、开放标记、连续药物相互作用研究
384、本研究的主要目的为在健康个体中测定avp-786(d6-右美沙芬/奎尼丁)对于帕罗西汀的稳态药代动力学的影响;在健康个体中测定avp-786对于度洛西汀的稳态药代动力学的影响;和在健康个体中测定帕罗西汀与度洛西汀对于avp-786的稳态药代动力学的影响。本研究的次要目的是评估在健康个体中将avp-786与帕罗西汀及度洛西汀同时给药的安全性与耐受性。帕罗西汀与度洛西汀为抗抑郁剂,其可令人信服地给药于阿尔茨海默症患者。
385、完成了调查d6-dm的药代动力学、安全性及耐受性的二项研究。12-avr-132为i期随机、双盲、单剂量及多剂量研究,其评估在健康个体中单独给药或与q组合给药不同口服剂量的avp786后,单剂量与多剂量avp786在血浆中的药代动力学。13-avr-134为i期、单中心、随机、开放标记研究,其在健康志愿者中评估avp-786的药代动力学、安全性及耐受性。
386、方法
387、本研究以单中心进行,且由开放标记、连续设计所组成,以测定avp-786对于帕罗西汀与度洛西汀的药代动力学的影响,并测定帕罗西汀与度洛西汀对于avp-786的药代动力学的影响。56名受试者分别加入四个治疗组中的一组:
388、组1:n=14
389、·帕罗西汀20mg,每天一次,第1-20天;
390、· avp-786-30/4.75(d6-dm 30mg/q 4.75mg),bid第13天直到第20天早上。
391、组2:n=14
392、· avp-786-30/4.75(d6-dm 30mg/q 4.75mg),bid第1天直到第20天早上;
393、·帕罗西汀20mg,每天一次,第9-20天。
394、组3:n=14
395、·度洛西汀20mg,bid第1天直到第13天早上;
396、· avp-786-30/4.75(d6-dm 30mg/q 4.75mg),bid第6天直到第13天早上。
397、组4:n=14
398、· avp-786-30/4.75(d6-dm 30mg/q 4.75mg),bid第1天直到第13天早上;
399、·度洛西汀20mg,bid第9天直到第13天早上。
400、在入选(第1天)前的14天内,受试者参加在诊所的的筛选访问。如果合格的话,受试者在第1天加入至四个组中的一组(不同组别的第1天设定在不同的日期,以确保单位在这些日期有床位可供使用)。受试者每天回到诊所以接受门诊患者给药,直到第二天(早晨)的pk采样(不同治疗组的该天的日期不相同)。在第二天(早晨)pk采样后,受试者在次日进行(完整的)pk采样前,在该晚即向诊所报到。受试者留在住院单位直到最后一天的pk采样(不同治疗组的住院时间不同,其基于研究药物达到稳定状态所需的时间长度)。
401、收集供pk评估用的样品直至研究药物的最后一次给药后的36小时。视情况,在所有样品中分析:d6-dm、d3-右啡烷(d3-dx)、q、帕罗西汀及度洛西汀。
402、在研究期间,在所有个体中进行安全性评估,且其包括所报告的不良事件(ae)、心电图(ecg)、实验室评估、身体检查及生命体征。使用哥伦比亚自杀严重程度评定量表(c-ssrs),进行研究期间的自杀意念与行为的前瞻性评估。
403、受试者在研究药物的最后一次给药7-10天后,回来参加后续安全性访问。
404、计划(及分析)的受试者数目
405、组1:计划n=14;参与n=14(安全性群体);分析n=11(pk群体)。组2:计划n=14;参与n=14(安全性群体);分析n=14(pk群体)。组3:计划n=14;参与n=14(安全性群体);分析n=14(pk群体)。组4:计划n=14;参与n=14(安全性群体);分析n=11(pk群体)。
406、诊断与纳入标准
407、年龄18至50岁及身体质量指数(bmi)为18-300kg/m2的健康成年男性与女性个体,且其所表现出的cyp2d6基因型赋予其泛代谢者(extensive metabolizers)的概况。
408、研究治疗
409、测试产品:avp-786-30/4.75(d6-dm 30mg/q 4.75mg)胶囊。帕罗西汀20mg片剂。度洛西汀20mg胶囊。受试者按照在以上方法中提供的研究时间表接受研究药物。
410、用240毫升的室温温度的水,口服给药各剂量(由一个胶囊/片剂所组成)。在早晨剂量之前,禁食过夜(即至少8小时,不包括水),在晚间剂量前则禁食至少2小时。所有的给药皆在给药后进行至少2小时的禁食(不包括水)。
411、评价标准
412、安全性:在研究期间,在所有个体中进行安全性评估,且包括所报告的不良事件(ae)、心电图(ecg)、实验室评估、身体检查及生命体征。使用哥伦比亚自杀严重程度评定量表(c-ssrs),进行研究期间的自杀意念与行为的前瞻性评估,按照fda的指南“suicidalideation and behavior:prospective assessment of occurrence in clinicaltrials”,将其作为安全性评估的一部分。
413、药代动力学:在以下时间点收集血样(单一给药为6ml且组合给药为12ml)以测定血浆d6-dm、d3-dx、q、帕罗西汀和度洛西汀:
414、在给药前及在单一药物给药的最后一天的早晨剂量后的0.5、1、2、3、4、6、8及12小时。仅对于第1组,因为每天给药帕罗西汀一次,在单一给药的最后一天的24小时后(在第一次组合给药前),进行附加样品的取样。
415、在给药前及在组合给药的最后一天的早晨剂量后0.5、1、2、3、4、6、8、12、24及36小时。
416、在第4天的早晨剂量之前(只有第2组与第4组)和在单一药物给药的最后一天与组合给药的最后一天之前的2天中的任一天。
417、非分室方法用于测定药代动力学参数,包括auc0-12,auc0-24,cmax,tmax,kel,t1/2,cmin和tmin。
418、统计方法
419、安全性:按治疗总结安全性变量,其包括不良事件发生率、生命体征、ecg参数及临床实验室结果。针对各受试者列出对于c-ssrs问卷的回应。针对回应异常的任何问题,提出个别受试者的概况。
420、药代动力学:对于d6-dm、d3-dx、q及帕罗西汀或度洛西汀(当适用时)的血浆浓度,对各时间点的描述性统计按照治疗进行列表。在线性与半对数标度上,按治疗绘制平均血浆浓度-时间曲线。此外,衍生获得非分室pk参数。组合治疗(第1组vs第2组,avp-786与帕罗西汀;第3组vs第4组,avp-786与度洛西汀)之间的比较,以cmax与auc0-12(帕罗西汀为auc0.24)的几何平均比值形式呈现,其具有90%信赖区间。使用对数转换数据测定点估计值及置信界限,然后转换回原标度。使用关于受试者与治疗的变量分析,进行分析。
421、结果
422、药代动力学:
423、帕罗西汀和avp-786相互作用:不同分析物按治疗组的随时间的平均多重剂量血浆浓度被示于图7与图8中。按治疗与分析物的平均值(cv%)(tmax的#中值(范围))(表13):
424、表13:
425、
426、通过对数转换的anova比较组合给药相对于单一治疗给药(表14):
427、表14:
428、
429、度洛西汀和avp-786相互作用:多种分析物按治疗组随时间的平均多重剂量血浆浓度示于图9和10。按治疗和分析物的平均(cv%)(tmax的#中值(范围))(表15):
430、表15:
431、
432、通过对数转换的anova比较组合给药相对于单一治疗给药(表16):
433、表16:
434、
435、
436、安全性:
437、并无死亡事件。有一名受试者(受试者r112,帕罗西汀/avp-786)经历二件并发的严重不良事件(sae):在每天接受20mg的帕罗西汀一次(第1天至第16天)及每天接受avp-786-30/4.75两次(第13天至第16天)后发生低钾血症与低氯血症。二者均被认为中度严重。该名受试者在第15天出现与直立性低血压相关的头晕,及在第16天出现双腿肌肉无力与麻刺感觉。在第17天获得的用于协助评估临床症状的血液检验与心电图发现了低钾血症、代谢性碱中毒及qtc延长。症状在补充液体与电解质后完全消除。基于本技术人对于这些sae的细节的医学审查及一名心脏专科医师的独立评估,该临床情况与帕罗西汀或avp-786的已知药物效应并不一致。
438、有四名参与者因下列不良事件而退出:自杀意念(受试者r107,在8剂量的帕罗西汀之后),低钾血症与低氯血症(受试者r112,见上述),尿道感染(受试者r411,在12剂量的avp-786之后),和呕吐(受试者r412,在9剂量的avp-786之后)。
439、帕罗西汀和avp-786相互作用:
440、在第1组与第2组中,14名受试者中有7名(50%)在接受帕罗西汀后(在12天给药期间)、14名受试者中有9名(64%)在接受avp-786后(在8天给药期间)、12名受试者中有10名(83%)在接受帕罗西汀/avp-786组合后(在8天给药期间)及14名受试者中有13名(93%)在接受avp-786/帕罗西汀组合后(在12天给药期间),报告了治疗后出现不良事件。
441、大部分的不良事件(115件不良事件中的104件即90%)被认与研究治疗相关(可能或很可能)。最常见的相关不良事件为头晕与姿势性头晕、头痛、腹泻、恶心、梦魇及注意力受到干扰。只有对接受帕罗西汀与avp-786组合的受试者报告过梦魇与注意力受到干扰的不良事件。相较于接受帕罗西汀或avp-786的单一治疗,当受试者接受组合疗法时所报告的头晕发生率较高。注意到只有接受帕罗西汀或接受帕罗西汀与avp-786组合的受试者报告了头痛与恶心,只接受avp-786的受试者并未如此报告。
442、大部分的不良事件的严重性归类为轻度,并无不良事件被归类为严重。被认为与研究治疗相关的中等严重的不良事件为自杀意念、低钾血症与低氯血症及抑郁症。
443、度洛西汀和avp-786相互作用:
444、在第3组与第4组中,14名个体中有6名(43%)在接受度洛西汀后(在5天给药期间)、14名个体中有7名(50%)在接受avp-786后(在8天给药期间)、14名个体中有7名(50%)在接受度洛西汀/avp-786组合后(在8天给药期间)及11名个体中有5名(45%)在接受avp-786/度洛西汀组合后(在5天给药期间),报告了治疗后出现不良事件。
445、大部分的不良事件(50件不良事件中的40件即80%)被认与研究的治疗相关(可能或很可能)。最常见的相关不良事件为疲劳与肌肉紧张。相较于接受度洛西汀或avp-786的单一治疗,当个体接受avp-786与度洛西汀组合时常见不良事件的发生率并没有变得更高。注意到只有第4组中单独接受avp-786的个体报告疲劳,而第2组中接受avp-786的个体并未如此报告。
446、大部分的不良事件的严重性被归类为轻度,有一件不良事件被归类为严重。严重强度的不良事件为呕吐(1名受试者,avp-786),其被认为有可能与研究治疗相关。被认为与研究治疗相关的中等严重性的不良事件为呕吐、冒冷汗、头痛、头晕及下腹部疼痛。
447、各组按严重性的不良事件汇总显示,在治疗之间并无差异。各治疗之间,在通过临床实验室检验、生命体征及ecg检查所评估的安全性方面并无明显差异。
448、结论
449、相较于单一治疗的多重剂量,avp-786与帕罗西汀或avp-786与度洛西汀的多重剂量组合在安全性评估方面并无临床显著的差异。
450、相较于单独给药帕罗西汀,当帕罗西汀与avp-786共同给药时,帕罗西汀的稳态全身性暴露显著增加(至约150%)。相较于单独给药avp-786,当avp-786与帕罗西汀共同给药时,avp-786分析物的稳态全身性暴露有显著变化,其中d6-dm的全身性暴露增加为约二倍,而d3-dx明显降低(至约75%),表明当avp-786与帕罗西汀组合给药时,d6-dm代谢为d3-dx的代谢速率下降。在q的全身性暴露方面存在中等增加(至约130%)。
451、相较于单独给药度洛西汀,当度洛西汀与avp-786共同给药时,度洛西汀的稳态全身性暴露显著增加(至约180%)。相较于单独给药avp-786,当avp-786与度洛西汀共同给药时,在avp-786分析物的稳态全身性暴露方面并无显著变化。
452、本发明涉及以下实施方案:
453、1.在患有痴呆的受试者中治疗激越行为和/或攻击行为和/或相关症状的方法,包括向有需要的受试者给药氘化右美沙芬或其药学上可接受的盐与奎尼丁或其药学上可接受的盐的组合。
454、2.根据实施方案1所述的方法,其中所述痴呆为阿尔茨海默症类型的痴呆。
455、3.根据实施方案1或实施方案2所述的方法,其中氘化右美沙芬的给药量在每天约10mg至约200mg的范围内,且奎尼丁的给药量在每天约0.05mg至少于约50mg的范围内。
456、4.根据实施方案1至3任一项的方法,其中奎尼丁的给药量在每天约4.75mg至约20mg范围内。
457、5.根据实施方案1至4任一项的方法,其中氘化右美沙芬的给药量在每天约10mg至约90mg的范围内。
458、6.根据实施方案1至5任一项的方法,其中奎尼丁和氘化右美沙芬中的至少一种为选自以下的药学上可接受的盐的形式:碱金属盐、锂盐、钠盐、钾盐、碱土金属盐、钙盐、镁盐、赖氨酸盐、n,n’二苄基乙二胺盐、氯普鲁卡因盐、胆碱盐、二乙醇胺盐、乙二胺盐、葡甲胺盐、普鲁卡因盐、tris盐、游离酸的盐、游离碱的盐、无机盐、硫酸盐、盐酸盐和氢溴酸盐。
459、7.根据实施方案1至6任一项的方法,其中所述氘化右美沙芬为氘化右美沙芬氢溴酸盐的形式。
460、8.根据实施方案1至7任一项的方法,其中所述奎尼丁为硫酸奎尼丁的形式。
461、9.根据实施方案1至8任一项的方法,其中氘化右美沙芬和奎尼丁以单位剂型给药,该单位剂型包含约24mg氘化右美沙芬氢溴酸盐和约4.75mg硫酸奎尼丁。
462、10.根据实施方案1至8任一项的方法,其中氘化右美沙芬和奎尼丁以单位剂型给药,该单位剂型包含约34mg氘化右美沙芬氢溴酸盐和约4.75mg硫酸奎尼丁。
463、11.根据实施方案1至8任一项的方法,其中氘化右美沙芬和奎尼丁以单位剂型给药,该单位剂型包含约18mg氘化右美沙芬氢溴酸盐和约4.9mg硫酸奎尼丁。
464、12.根据实施方案1至8任一项的方法,其中氘化右美沙芬和奎尼丁以单位剂型给药,该单位剂型包含约28mg氘化右美沙芬氢溴酸盐和约4.9mg硫酸奎尼丁。
465、13.根据实施方案1至8任一项的方法,其中氘化右美沙芬和奎尼丁以单位剂型给药,该单位剂型包含约30mg氘化右美沙芬氢溴酸盐和约4.9mg硫酸奎尼丁。
466、14.根据实施方案1至8任一项的方法,其中氘化右美沙芬和奎尼丁以单位剂型给药,该单位剂型包含约24mg氘化右美沙芬氢溴酸盐和约4.9mg硫酸奎尼丁。
467、15.根据实施方案1至8任一项的方法,其中氘化右美沙芬和奎尼丁以单位剂型给药,该单位剂型包含约34mg氘化右美沙芬氢溴酸盐和约4.9mg硫酸奎尼丁。
468、16.根据实施方案1至15任一项的方法,其中氘化右美沙芬和奎尼丁以组合剂量给药,且其中该组合剂量中氘化右美沙芬与奎尼丁的重量比选自约1:0.16、约1:0.18、约1:0.20、约1:0.22、约1:0.23和约1:0.31。
469、17.根据实施方案1至16任一项的方法,其中所述氘化右美沙芬和奎尼丁以每天一份组合剂量给药。
470、18.根据实施方案1至16任一项的方法,其中所述氘化右美沙芬和奎尼丁以每天至少两份组合剂量给药。
471、19.根据实施方案1至18任一项的方法,其中氘化右美沙芬和奎尼丁以片剂单位剂型或胶囊单位剂型给药。
472、20.氘化右美沙芬或其药学上可接受的盐与奎尼丁或其药学上可接受的盐的组合,其用于治疗患有痴呆的受试者中的激越行为和/或攻击行为和/或相关症状。
473、21.根据实施方案20的组合,其中所述痴呆为阿尔茨海默症类型的痴呆。
474、22.根据实施方案20至21任一项的组合,其中氘化右美沙芬的给药量在每天约10mg至约200mg的范围内,且其中奎尼丁的给药量在每天约0.05mg至少于约50mg的范围内。
475、23.根据实施方案20至22任一项的组合,其中奎尼丁的给药量在每天约4.75mg至约20mg的范围内。
476、24.根据实施方案20至23任一项的组合,其中氘化右美沙芬的给药量在每天约10mg至约90mg的范围内。
477、25.根据实施方案20至24任一项的组合,其中奎尼丁和氘化右美沙芬中的至少一种为选自以下的药学上可接受的盐的形式:碱金属盐、锂盐、钠盐、钾盐、碱土金属盐、钙盐、镁盐、赖氨酸盐、n,n’二苄基乙二胺盐、氯普鲁卡因盐、胆碱盐、二乙醇胺盐、乙二胺盐、葡甲胺盐、普鲁卡因盐、tris盐、游离酸的盐、游离碱的盐、无机盐、硫酸盐、盐酸盐和氢溴酸盐。
478、26.根据实施方案20至25任一项的组合,其中所述氘化右美沙芬为氘化右美沙芬氢溴酸盐的形式。
479、27.根据实施方案20至26任一项的组合,其中所述奎尼丁为硫酸奎尼丁的形式。
480、28.根据实施方案20至27任一项的组合,其中氘化右美沙芬和奎尼丁以单位剂型给药,该单位剂型包含约24mg氘化右美沙芬氢溴酸盐和约4.75mg硫酸奎尼丁。
481、29.根据实施方案20至27任一项的组合,其中氘化右美沙芬和奎尼丁以单位剂型给药,该单位剂型包含约34mg氘化右美沙芬氢溴酸盐和约4.75mg硫酸奎尼丁。
482、30.根据实施方案20至27任一项的组合,其中氘化右美沙芬和奎尼丁以单位剂型给药,该单位剂型包含约18mg氘化右美沙芬氢溴酸盐和约4.9mg硫酸奎尼丁。
483、31.根据实施方案20至27任一项的组合,其中氘化右美沙芬和奎尼丁以单位剂型给药,该单位剂型包含约28mg氘化右美沙芬氢溴酸盐和约4.9mg硫酸奎尼丁。
484、32.根据实施方案20至27任一项的组合,其中氘化右美沙芬和奎尼丁以单位剂型给药,该单位剂型包含约30mg氘化右美沙芬氢溴酸盐和约4.9mg硫酸奎尼丁。
485、33.根据实施方案20至27任一项的组合,其中氘化右美沙芬和奎尼丁以单位剂型给药,该单位剂型包含约24mg氘化右美沙芬氢溴酸盐和约4.9mg硫酸奎尼丁。
486、34.根据实施方案20至27任一项的组合,其中氘化右美沙芬和奎尼丁以单位剂型给药,该单位剂型包含约34mg氘化右美沙芬氢溴酸盐和约4.9mg硫酸奎尼丁。
487、35.根据实施方案20至34任一项的组合,其中氘化右美沙芬和奎尼丁以组合剂量给药,且其中该组合剂量中氘化右美沙芬与奎尼丁的重量比选自约1:0.16、约1:0.18、约1:0.20、约1:0.22、约1:0.23和约1:0.31。
488、36.根据实施方案20至35任一项的组合,其中所述氘化右美沙芬和奎尼丁以每天一份组合剂量给药。
489、37.根据实施方案20至35任一项的组合,其中所述氘化右美沙芬和奎尼丁以每天至少两份组合剂量给药。
490、38.根据实施方案20至37任一项的组合,其中氘化右美沙芬和奎尼丁以片剂单位剂型或胶囊单位剂型给药。
491、39.在患有痴呆的受试者中治疗激越行为和/或攻击行为和/或相关症状的方法,包括向需要的受试者给药右美沙芬或其药学上可接受的盐与奎尼丁或其药学上可接受的盐的组合。
492、40.根据实施方案39的方法,其中所述痴呆为阿尔茨海默症类型的痴呆。
493、41.根据实施方案39或40的方法,其中右美沙芬的给药量在每天约10mg至约200mg的范围内,且其中奎尼丁的给药量在每天约0.05mg至少于约50mg的范围内。
494、42.根据实施方案39至41任一项的方法,其中奎尼丁的给药量在每天约4.75mg至约20mg的范围内。
495、43.根据实施方案39至42任一项的方法,其中右美沙芬的给药量在每天约10mg至约90mg的范围内。
496、44.根据实施方案39至43任一项的方法,其中奎尼丁和右美沙芬中的至少一种为选自以下的药学上可接受的盐的形式:碱金属盐、锂盐、钠盐、钾盐、碱土金属盐、钙盐、镁盐、赖氨酸盐、n,n’二苄基乙二胺盐、氯普鲁卡因盐、胆碱盐、二乙醇胺盐、乙二胺盐、葡甲胺盐、普鲁卡因盐、tris盐、游离酸的盐、游离碱的盐、无机盐、硫酸盐、盐酸盐和氢溴酸盐。
497、45.根据实施方案39至44任一项的方法,其中所述右美沙芬为右美沙芬氢溴酸盐的形式。
498、46.根据实施方案39至45任一项的方法,其中所述奎尼丁为硫酸奎尼丁的形式。
499、47.根据实施方案39至46任一项的方法,其中右美沙芬和奎尼丁以单位剂型给药,该单位剂型包含约20mg右美沙芬氢溴酸盐和约10mg硫酸奎尼丁。
500、48.根据实施方案39至46任一项的方法,其中右美沙芬和奎尼丁以单位剂型给药,该单位剂型包含约30mg右美沙芬氢溴酸盐和约10mg硫酸奎尼丁。
501、49.根据实施方案39至46任一项的方法,其中右美沙芬和奎尼丁以单位剂型给药,该单位剂型包含约45mg右美沙芬氢溴酸盐和约10mg硫酸奎尼丁。
502、50.根据实施方案39至46任一项的方法,其中右美沙芬和奎尼丁以单位剂型给药,该单位剂型包含约15mg右美沙芬氢溴酸盐和约9mg硫酸奎尼丁。
503、51.根据实施方案39至46任一项的方法,其中右美沙芬和奎尼丁以单位剂型给药,该单位剂型包含约23mg右美沙芬氢溴酸盐和约9mg硫酸奎尼丁。
504、52.根据实施方案39至51任一项的方法,其中所述右美沙芬和奎尼丁以组合剂量给药,且其中该组合剂量中右美沙芬与奎尼丁的重量比选自约1:0.68、约1:0.56、约1:0.44、约1:0.38和约1:0.25。
505、53.根据实施方案39至52任一项的方法,其中所述右美沙芬和奎尼丁以每天一份组合剂量给药。
506、54.根据实施方案39至52任一项的方法,其中所述右美沙芬和奎尼丁以每天至少两份组合剂量给药。
507、55.根据实施方案39至54任一项的方法,其中右美沙芬和奎尼丁以片剂单位剂型或胶囊单位剂型给药。
508、56.右美沙芬或其药学上可接受的盐与奎尼丁或其药学上可接受的盐的组合,其用于治疗患有痴呆的受试者中的激越行为和/或攻击行为和/或相关症状。
509、57.根据实施方案56的组合,其中所述痴呆为阿尔茨海默症类型的痴呆。
510、58.根据实施方案56或实施方案57的组合,其中右美沙芬的给药量在每天约10mg至约200mg的范围内,且其中奎尼丁的给药量在每天约0.05mg至少于约50mg的范围内。
511、59.根据实施方案56至58任一项的组合,其中奎尼丁的给药量在每天约4.75mg至约20mg的范围内。
512、60.根据实施方案56至59任一项的组合,其中右美沙芬的给药量在每天约10mg至约90mg的范围内。
513、61.根据实施方案56至60任一项的组合,其中奎尼丁和右美沙芬中的至少一种为选自以下的药学上可接受的盐的形式:碱金属盐、锂盐、钠盐、钾盐、碱土金属盐、钙盐、镁盐、赖氨酸盐、n,n’二苄基乙二胺盐、氯普鲁卡因盐、胆碱盐、二乙醇胺盐、乙二胺盐、葡甲胺盐、普鲁卡因盐、tris盐、游离酸的盐、游离碱的盐、无机盐、硫酸盐、盐酸盐和氢溴酸盐。
514、62.根据实施方案56至61任一项的组合,其中所述右美沙芬为右美沙芬氢溴酸盐的形式。
515、63.根据实施方案56至62任一项的组合,其中所述奎尼丁为硫酸奎尼丁的形式。
516、64.根据实施方案56至63任一项的组合,其中右美沙芬和奎尼丁以单位剂型给药,该单位剂型包含约20mg右美沙芬氢溴酸盐和约10mg硫酸奎尼丁。
517、65.根据实施方案56至63任一项的组合,其中右美沙芬和奎尼丁以单位剂型给药,该单位剂型包含约30mg右美沙芬氢溴酸盐和约10mg硫酸奎尼丁。
518、66.根据实施方案56至63任一项的组合,其中右美沙芬和奎尼丁以单位剂型给药,该单位剂型包含约45mg右美沙芬氢溴酸盐和约10mg硫酸奎尼丁。
519、67.根据实施方案56至63任一项的组合,其中右美沙芬和奎尼丁以单位剂型给药,该单位剂型包含约15mg右美沙芬氢溴酸盐和约9mg硫酸奎尼丁。
520、68.根据实施方案56至63任一项的组合,其中右美沙芬和奎尼丁以单位剂型给药,该单位剂型包含约23mg右美沙芬氢溴酸盐和约9mg硫酸奎尼丁。
521、69.根据实施方案56至68任一项的组合,其中所述右美沙芬和奎尼丁以组合剂量给药,且其中该组合剂量中右美沙芬与奎尼丁的重量比选自约1:0.68、约1:0.56、约1:0.44、约1:0.38和约1:0.25。
522、70.根据实施方案56至69任一项的组合,其中所述右美沙芬和奎尼丁以每天一份组合剂量给药。
523、71.根据实施方案56至69任一项的组合,其中所述右美沙芬和奎尼丁以每天至少两份组合剂量给药。
524、72.根据实施方案56至71任一项的组合,其中右美沙芬和奎尼丁以片剂单位剂型或胶囊单位剂型给药。
- 还没有人留言评论。精彩留言会获得点赞!