一种外泌体缓释多孔微球及其制备方法与流程
本发明属于药物制剂领域,具体涉及一种外泌体缓释多孔微球及其制备方法。
背景技术:
1、骨缺陷通常是高能量创伤、感染、肿瘤切除或先天性缺陷的结果骨。此外,它们经常伴有软组织损伤,包括肌肉、肌腱和关节损伤,给患者带来了严重的健康问题。作为全球严重的公共卫生问题,骨缺损会导致畸形、长期住院、生活质量恶化和巨大的经济负担。骨愈合是一个形成新骨骼的高度复杂、精心策划的再生过程,并参与一系列基本的细胞和分子事件。但是,骨组织的内在再生能力若没有手术干预,无法修复超过临界尺寸的骨骼缺陷。再生临界骨缺损的标准方法之一依赖于自体移植,自体移植不仅对缺陷区域的骨形成具有理想的骨导骨和骨感应特性。尽管自体和同源性骨移植已被广泛用于修复骨缺损,但这两种治疗方法仍然存在一些局限性,如炎症、自体骨受限和免疫排斥。此外,理想的骨移植替代品应具有以下特征:骨传导、骨合并、骨整合和成骨。然而,到目前为止,没有一种材料具有所有必要的特性来有效促进骨骼再生。近年来,基于干细胞治疗一直处于骨再生医学领域的前沿,这为骨骼修复和再生开辟了一条新道路。然而,它的分子机制并不精确,仍然存在一些局限性,如高成本、捐赠者有限等。因此,迫切需要新的治疗策略来满足骨骼疾病的临床要求。
2、研究表明,干细胞促进骨修复的功能主要归因于它们的旁分泌。大小为30-200nm的间充质干细胞(msc)衍生外泌体(exo)被用作重要的旁分泌通信介质,并为细胞之间的物质和信号交换提供途径,可以被骨髓间充质干细胞(bmscs)内吞并已被证明可以刺激细胞迁移、增殖和成骨分化,促进骨缺陷的骨再生。它们具有天然归导或趋化能力,并将生理活性化学物质输送到靶细胞,通过这种方式,在传统手术技术中,可以绕过干细胞治疗和骨缺乏引起的免疫排斥的exo被认为是一种无细胞靶向治疗的良好候选者。但由于骨修复和再生是一个长期、复杂的多阶段过程,而exo由于其流体的流动容易造成组织内损失和失活,使得其体内治疗效果受到限制。因此,急需选择一种良好的载体来装载exo并在受伤部位持续释放,以增加其保留力和作用时间。
3、研究发现,聚乳酸-羟基乙酸聚合物(plga)因其独特的生物相容性和可调的生物降解性而被美国食品药品监督管理局批准为用于可体内植入的药物缓释载体材料。plga作为药物缓释载体应用,通常需要将其制备成具有纳微米尺寸的微球,进而在微球里装载药物或生物分子进行体内注射治疗。然而对于骨缺损修复治疗,plga在骨组织内降解所形成的酸性微环境严重抑制了新骨的再生过程,因此,在plga材料内部复合羟基磷灰石、碳酸钙、碳酸镁等无机材料,用于中和plga降解过程中所形成的酸性降解产物有效解决的plga在骨修复领域的使用瓶颈。另外,加入的钙、镁类无机盐在中和plga酸性降解产物的同时,释放出的钙镁离子还可以有效促进骨诱导和骨传导过程,加速新骨再生。
4、利用plga微球作为exo缓释载体需要解决的问题是如何将足够剂量的外泌体装载到微球内部或表面,同时还要使外泌体与微球载体之间有一定的相互作用力,防止外泌体在植入到组织过程中或植入后发生突释效应,从而降低了外泌体在组织内部的作用时间和治疗效果。通过w/o/w复乳液技术将plga制备成具有微孔结构的微球载体,有利于提高plga微球对exo的负载效率。特别地,如果对微球表面进行亲和涂层的修饰,不但可以进一步提高微球的负载量,同时,还可以通过涂层与exo之间的相互作用,控制或延长exo的释放周期,提高外泌体的治疗效果。聚多巴胺(pda)作为生物涂层的应用,具有修饰方法简单,生物相容性好,可以通过迈克尔加成反应和席夫碱反应与生物分子间形成共价键,从而稳定、高效地负载生物分子。因此,通过pda对多孔plga微球进行涂层修饰后,将极大的增加exo在微球上的负载效率,并防止exo的突释效应,延长外泌体在组织内的作用时间和治疗效果。
5、cn115252818a公开了一种药物缓释微球的制备方法,采用乳化法制备nhap/plga的w/o/w乳液,进行冻干,得到nhap/plga多孔微球,再经过pda修饰的nhap/plga得到nhap/plga-pda多孔微球,用于运输重组人ⅱ型肿瘤坏死因子受体抗体融合蛋白,治疗类风湿关节炎的,该现有技术为本发明制备外泌体缓释多孔微球提供了理论基础。
技术实现思路
1、针对现有技术的不足,本发明提供一种外泌体缓释多孔微球。
2、本发明的技术方案如下:一种外泌体缓释多孔微球的制备方法,包括以下步骤:
3、1)将pasp溶液和cacl2溶液混合后进行螯合30min,将paa溶液和na2hpo4·12h2o溶液混合后进行螯合30min,将上述螯合后的cacl2溶液和na2hpo4·12h2o溶液以一定的比例共混并充分搅拌反应后收集样品。样品离心,水洗三次,即可得到nhap;
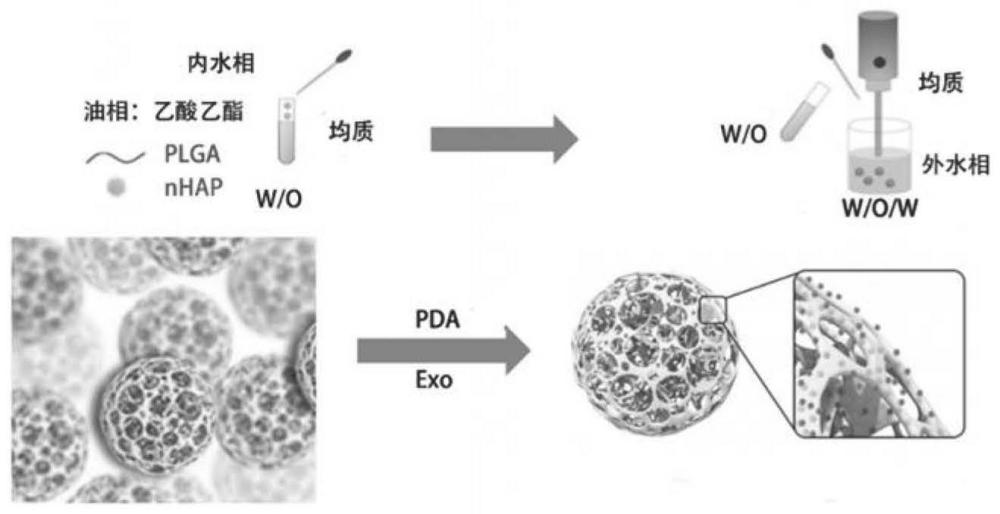
4、2)将步骤1)制备的nhap分散于碳酸氢铵溶液中,作为内水相,将plga和pdlla-peg-pdlla溶解在乙酸乙酯中作为油相,将内水相加入油相中进行乳化得到w/o乳液,再将所述w/o乳液加入到pva溶液中进行乳化得到w/o/w乳液,对其进行冷冻干燥,得到nhap/plga多孔微球;
5、3)将步骤2)制备的nhap/plga多孔微球与da溶解于tris-hcl缓冲液中,避光搅拌反应,离心水洗后冷冻干燥得到pda修饰的nhap/plga-pda多孔微球;
6、4)将步骤3)制备的nhap/plga-pda多孔微球分散在磷酸盐缓冲液中,并加入exo溶液,避光搅拌一段时间,水洗离心后得到可注射的nhap/plga-pda@exo缓释多孔微球。
7、在一些实施方案中,所述步骤1)中pasp溶液的浓度为15mg/ml,用量为10~20ml。cacl2溶液为cacl2溶解于ph=7.6,1mm tris溶液中,使得cacl2的浓度为0.1mol/l,cacl2溶液用量为200ml。
8、在一些实施方案中,所述步骤1)中paa溶液的浓度为25mg/ml,用量为20~40ml;na2hpo4·12h2o溶液为na2hpo4·12h2o溶解于ph=7.1,50mm hepes溶液中,使得na2hpo4·12h2o的浓度为0.06mol/l,用量为200ml。
9、在一些实施方案中,所述步骤1)中螯合后的cacl2溶液和na2hpo4·12h2o溶液的共混比例为1:1~1:2。
10、在一些实施方案中,所述步骤2)碳酸氢铵溶液中nhap的质量浓度为10-50mg/ml。
11、在一些实施方案中,所述步骤2)中碳酸氢铵溶液的质量分数为1-5%,用量为5ml。
12、在一些实施方案中,所述步骤2)油相中plga的质量分数为1~5%;pdlla-peg-pdlla的质量分数为1~5%。
13、在一些实施方案中,所述步骤2)中制备w/o乳液时内水相和油相的混合体积比为1:1-1:5。
14、在一些实施方案中,所述步骤2)中pva溶液的质量分数为1~5%。
15、在一些实施方案中,所述步骤2)中制备w/o/w乳液时w/o乳液和pva溶液体积比为1:5-1:10。
16、在一些实施方案中,所述步骤3)中nhap/plga多孔微球与da的质量比为2:1~10:1。
17、在一些实施方案中,所述步骤3)中tris-hcl缓冲液中nhap-plga的浓度为5mg/ml。
18、在一些实施方案中,所述步骤3)中tris-hcl缓冲液ph值为8~9。
19、在一些实施方案中,所述步骤4)中磷酸盐缓冲液的ph值为7~8。
20、在一些实施方案中,所述步骤4)磷酸盐缓冲液中nhap/plga-pda的浓度为5~10mg/ml。
21、在一些实施方案中,所述步骤4)磷酸盐缓冲液中exo溶液的浓度为1-5mg/ml。
22、本发明的有益效果:1)根据本发明的方案,制备高分散稳定性的nhap,可提高nhap在plga微球中的分散性,防止颗粒聚集。
23、2)将nhap有效分散在油相的内部,通过乳化制备w/o乳液,接着与聚乙烯醇溶液进行乳化,再通过溶剂挥发析出成球。微球基生物材料,作为可注射的微支架可通过微创手术填充不规则形状的骨缺损并完成进一步的再生。
24、3)通过将nhap复合在plga微球中,能够在plga微球降解时有效地缓冲降解时的酸性环境,从而降低酸性环境对成骨再生的抑制作用。同时,nhap与酸性物质反应后所释放的钙离子还可以起到骨传导和骨诱导作用,可以加速新骨再生。
25、4)本发明制备的plga微球具有多孔结构,极大提高了微球的比表面积,有利于提高exo的负载量。进一步,通过da在微球表面原位聚合形成pda生物涂层,可以增加exo与微球之间的相互作用力,进一步提高exo的装载效率和负载稳定性,在防止exo发生突释的同时还可以有效延长exo的释放周期,提高exo在体内的生物利用度。
26、5)通过本发明制备的nhap/plga-pda@exo外泌体缓释微球可以作为微支架通过微创手术或注射的方式填充到骨缺损位置,通过微球降解过程中释放的干细胞外泌体及钙离子,促进骨的再生和修复。
27、相关说明
28、pasp:聚天冬氨酸
29、paa:聚丙烯酸
30、nhap:纳米羟基磷灰石
31、plga:聚乳酸-羟基乙酸
32、pdlla-peg-pdlla:聚乙二醇-聚消旋乳酸
33、pva:聚乙烯醇
34、da:多巴胺
35、pda:聚多巴胺
36、exo:人脐间充质干细胞来源的外泌体
- 还没有人留言评论。精彩留言会获得点赞!