一种包载铁死亡相关药物的白蛋白纳米粒及其制备方法和应用
本发明属于生物医药材料制备,涉及一种人血清白蛋白包载铁死亡相关药物的绿色纳米粒构建方法和应用,具体涉及一种人血清白蛋白包载铁死亡相关药物的绿色纳米粒的构建方法和抗肿瘤应用。
背景技术:
1、肿瘤是一种恶性程度高、进展快、预后差的疾病,是全球第二大致死因素。由于肿瘤细胞比正常细胞更依赖铁来促进其高增殖率,诱导铁死亡对于肿瘤治疗的重要性已经越来越受到重视。铁死亡是通过ros的积累、脂质过氧化物和gsh的消耗介导的一种以铁依赖形式的调控细胞死亡的策略在癌症治疗中具有巨大的潜力。铁死亡主要有两种模式:一种是典型的铁死亡诱导模式,破坏肿瘤细胞的膜保护机制,激活铁垂,主要由gpx4途径管理。gpx4蛋白被认为是唯一一种能保护生物膜免受氢过氧化作用的谷胱甘肽过氧化物酶(gpxs)家族分子。靶向gpx4通路诱导铁死亡的治疗方法主要有两种。第一个是gpx4蛋白的失活和耗尽。例如,(1s,3r)-rsl3(rsl3)可以共价结合到gpx4的活性位点上,从而介导gpx4调控的铁垂病。第二种方法是消耗细胞内的gsh含量。还原性谷胱甘肽是抗氧化剂的一种三肽形式,可作为gpx4的协同分子,协助gpx4消除脂质ros。另外的主要机制是利用细胞内铁的可用性和脂质过氧化水平引起的。第二种非经典模式是通过增加肿瘤细胞中的fe2+含量来启动的。例如,hmox1蛋白的过度激活、铁转运蛋白表达下调和转铁蛋白表达上调可能导致肿瘤细胞中fe2+超载一些外源性含铁物质(氯化血红素、fecl2和(nh4)2fe(so4))2)可引起细胞内铁超载,从而有效引起铁死亡。因此,通过消耗细胞内gsh来减少gpx4蛋白的表达,外源性铁使细胞内铁超载,加剧细胞内脂质过氧化水平和激活hmox1两种模式的组合可以实现铁死亡发挥最大化治疗效果。由于gpx4蛋白下调与细胞内fe2+超载的协同作用,有效增加细胞内脂质ros含量,诱导铁死亡发生,上调细胞内bid、aif和endog蛋白表达,在体外表现出优异的抗肿瘤功效。
2、同时,恶性肿瘤的发生发展伴随着机体免疫系统功能紊乱和免疫监视功能失调。肿瘤免疫治疗通过主动或被动的方式重新激活免疫系统,恢复其免疫监视功能以达到控制及清除肿瘤的目的,是肿瘤治疗领域的革命性突破。因为铁死亡治疗过程中引起gpx4系统在肿瘤部位的显著下调导致t细胞表面cd36受体过表达,大量摄入脂肪酸引起脂质过氧化使得t细胞发生铁死亡,进一步促进肿瘤细胞的免疫逃逸影响铁死亡的治疗效果。cd36是一种清道夫受体,在多种细胞类型中表达。在免疫系统中,cd36介导树突状细胞抗原的获取和呈递,并支持调节性t细胞功能。研究表明靶向cd36可能是提高cd8+t细胞免疫疗法的抗肿瘤药效的有效策略,为临床治疗提供了新的思路和可能。cd36通过摄取肿瘤环境中的脂肪酸,尤其是多不饱和脂肪-花生四烯酸,导致了cd8+t细胞内脂质过氧化物的堆积,铁离子含量升高,铁死亡过程增多,杀伤性的细胞因子分泌减少。通过阻断cd36的表达,或者添加铁死亡的抑制剂,可以显著减少cd8+t细胞内脂质过氧化物的含量,增加杀伤性分泌分子的表达,恢复免疫细胞的功能。
3、作为一种天然生物材料,人血清白蛋白(hsa)是一种优秀的纳米药物载体,可利用官能团和疏水结合位点包载药物,具有非血溶性、表面可修饰、可生物清除、稳定性好、体内半衰期时间长以及安全无毒的优势,且可通过epr效应介导的被动靶向作用高效递送药物。药物通过静电作用、π-π共轭和疏水作用与白蛋白的疏水域包载药物形成纳米粒。白蛋白可避免纳米体系被内皮网状系统吞噬,实现纳米制剂长循环,以实现药物有效入胞协同发挥铁死亡诱导最大化,并通过多方面启动和激活抗肿瘤免疫治疗效果。
技术实现思路
1、有鉴于此,本发明的目的是提供一种安全无毒、稳定、复合纳米尺寸的包载铁死亡相关药物的白蛋白纳米粒及其制备方法和应用。
2、为了实现上述目的,本发明采用如下技术方案:
3、本发明的第一个技术目的是提供一种包载铁死亡相关药物的白蛋白纳米粒,所述的铁死亡相关药物与白蛋白组装为纳米粒,铁死亡相关药物与白蛋白通过静电作用、π-π堆积和疏水作用共组装形成的载药纳米粒;
4、所述铁死亡相关药物组成包括卟啉化类药物、不饱和脂肪酸类药物-胱胺和磺基琥珀酰亚胺油酸酯sso,且卟啉化类药物、不饱和脂肪酸类药物-胱胺和sso的摩尔比为4:1:1~1:4:1。
5、本发明中白蛋白包载铁死亡相关药物的绿色纳米粒的形成机制:
6、通过搅拌技术,由于白蛋白内部具有氨基等官能团和疏水结合位点,所选用的卟啉化类药物、不饱和脂肪酸类药物-胱胺和sso作为疏水小分子,将会与白蛋白分子中的疏水位点靠近最终形成一个以铁死亡相关药物为核心的白蛋白纳米颗粒,白蛋白分子的亲水基团暴露在水溶液中;与此同时,由于卟啉化类药物、不饱和脂肪酸类药物-胱胺和sso分子中存在多个基团,包括羧基和双键,以及疏水作用力能够与白蛋白分子形成一个紧密的纳米粒。
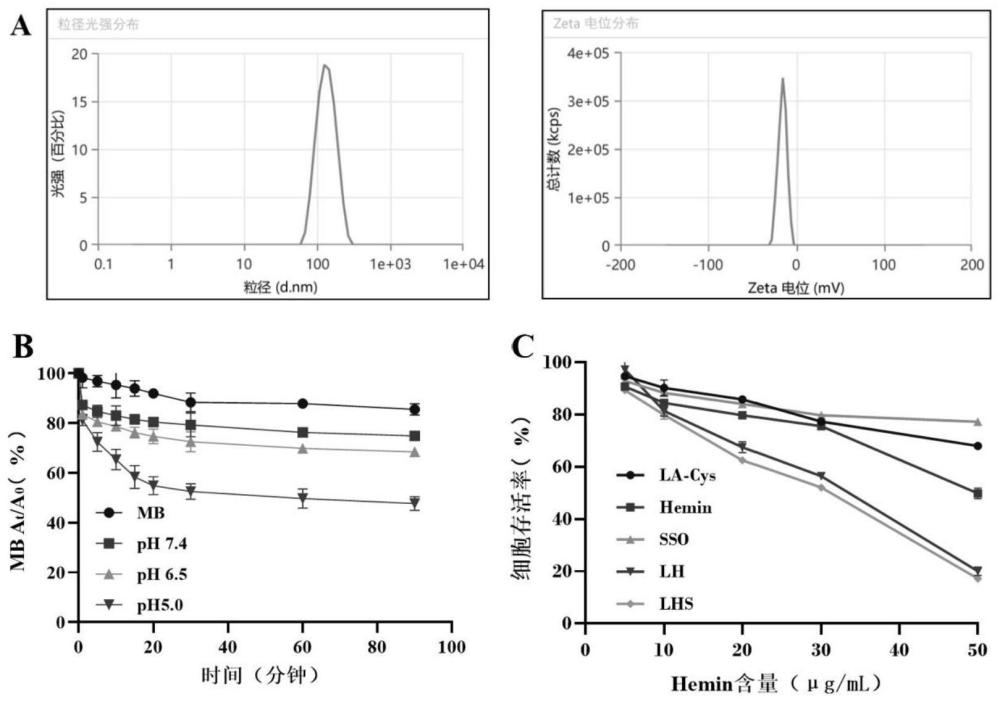
7、进一步的,所述白蛋白纳米粒的大小均一,粒径为100~200nm,zeta电位在-5~-30mv。
8、本发明的第二个技术目的是提供一种如上所述包载铁死亡相关药物的白蛋白纳米粒的制备方法,包括以下步骤:
9、1)配制体积质量浓度为0.1~10mg/ml的白蛋白水溶液得到溶液a:
10、2)以有机化合物作为溶剂配制体积质量浓度为1~20mg/ml的卟啉化类药物的溶液得到溶液b,以有机化合物作为溶剂配制体积质量浓度为4~40mg/ml的不饱和脂肪酸类药物-胱胺的溶液得到溶液c,以有机化合物作为溶剂配制体积质量浓度为0.5~15mg/ml的磺基琥珀酰亚胺油酸酯sso的溶液得到溶液d;
11、3)将无菌双蒸水和所述溶液a混合,500~1000rpm搅拌5~20min,得到溶液e;将所述溶液b、溶液c和溶液d混合,超声5~10min,得到溶液f;随后将所述溶液f滴加到所述溶液e中混合,500~1000rpm搅拌5~20min,室温静置10~30min,得到溶液g;
12、4)将所述溶液g转移至3500kd以上的透析袋中,用超纯水透析24-72h除去游离药物及有机溶剂,即得到所述的包载铁死亡相关药物的白蛋白纳米颗粒。
13、可选地,所述卟啉化类药物为血红素、二氢卟吩中的一种或两种组合,所述的卟啉化类药物、不饱和脂肪酸类药物-胱胺和sso的溶剂为甲苯、二甲苯、二甲基亚砜、四氢呋喃、氯苯中的一种或几种组合。
14、可选地,所述不饱和脂肪酸类药物包括油酸、亚油酸、亚麻酸中的一种或几种组合,且所述不饱和脂肪酸类药物-胱胺中亚油酸-胱胺的制备方法,包括以下步骤:
15、将亚油酸和催化剂4-(4,6-二甲氧基三嗪)-4-甲基吗啉盐酸盐溶于有机溶剂中得到溶液1;胱胺溶于有机溶剂中得到溶液2;将溶液2滴加到溶液1中加热反应得反应液,将反应液加入硅胶粉旋干后,以二氯甲烷和甲醇混合溶剂为洗脱剂经硅胶柱层析分离纯化,得到亚油酸-胱胺;
16、所述的有机溶剂为超干吡啶、超干n,n-二甲基甲酰胺、超干二氯甲烷、乙酸乙酯中的一种或几种组合。
17、可选地,所述的卟啉化类药物、不饱和脂肪酸类药物-胱胺和sso的摩尔比为4:1:1~1:4:1。
18、本发明的第三个技术目的是提供由上所述的包载铁死亡相关药物的白蛋白纳米粒在药物制剂中的应用。
19、具体地,本发明所述包载铁死亡相关药物的白蛋白纳米粒在抗三阴性乳腺癌药物中的应用。
20、经由上述的技术方案可知,本发明发现了多模式铁死亡在联合免疫治疗肿瘤方面具有协同作用,从效果来看,三种游离药物组的抑瘤效果均不如纳米粒组,含或不含sso的制剂组对于免疫表现出不同的作用效果,含sso组拥有强大的免疫效果和抗肿瘤作用;而且,本发明首次发现四种铁死亡相关药物能与白蛋白无需合成自组装形成大小均一的纳米粒。
21、与现有技术相比,本发明的有益效果是:
22、(1)本发明利用绿色制剂方法,制备工艺简单,易于放大生产。
23、(2)本发明形成的纳米粒粒径小而均一,且具有一定的靶向性,有利于纳米粒富集于肿瘤部位;且较大的载药量和安全的载体,有利于减少纳米粒的不良反应和毒性。
24、(3)本发明任意单一游离药物组与制剂组对比,制剂组具有显著细胞摄取和诱导细胞凋亡的能力;且本发明制备的绿色纳米粒在体内外均具有良好的抗肿瘤能力。
25、综上所述,本发明公开的绿色纳米粒通过绿色无合成的制备工艺,有效减弱纳米粒的毒性,提高其生物安全性。通过体内外的抗肿瘤研究表明,该纳米粒在铁死亡方面具有强大作用,实现多模式调控铁死亡治疗肿瘤。
- 还没有人留言评论。精彩留言会获得点赞!