用于选择性捕获和识别糖肽的磁性纳米纤维基两性离子亲水性材料的制作方法
本发明涉及一种用于选择性捕获和识别糖肽的磁性纳米纤维基两性离子亲水性材料,属于生化分析技术领域。
背景技术:
蛋白质/肽,糖类,核酸等作为必需和重要的生物成分,介导了大多数基本的生物过程,如细胞通讯、免疫反应和酶促反应。由于复杂的成分和严重的干扰,目标生物大分子的检测和表征是一项巨大的挑战,特别是对于低丰度的分析物。因此,样品制备是分析过程中不可或缺的一步。开发用于选择性分离和预浓缩目标生物大分子的亲和材料是减少杂质干扰和提高检测灵敏度的有效方法。迄今为止,已开发出多种材料,包括二氧化硅,介孔二氧化硅,磁性纳米颗粒,au纳米颗粒,聚合物,氧化石墨烯,金属有机骨架和多孔有机骨架,用于生物大分子提取。但用于高选择性捕获和鉴定靶生物大分子的亲和材料的设计和合成仍然是一个重要的研究课题。
糖蛋白参与多种生物过程,也是一些疾病的生物标志物。对糖蛋白的综合鉴定,不仅可以了解其生理过程,而且有利于生物标志物的发现。目前流行的基于质谱的糖肽组学分析方法包括蛋白质酶解、糖肽富集和质谱鉴定。基于糖肽和非糖肽之间的结构差异,已经引入了包括凝集素、肼珠、硼酸和亲水性吸附剂等几种亲和材料来识别和分离来自生物体中丰富的糖肽与非糖肽。相比之下,亲水相互作用分离方法具有富集效率高、聚糖特异性广、聚糖成分不可逆变化等优点。
许多亲水材料已被提出用于糖肽的富集和鉴定。值得注意的是,各种亲水材料已经与磁性纳米粒子结合在一起,以实现磁响应能力,使分离过程简单,高效。
然而,这些亲水性材料的合成通常需要复杂的合成程序、多步骤的功能化以及较长的孵育时间。这种繁琐的过程大大增大的分析方法的成本,极大地限制了它们在实际样品中的应用。因此,需要挖掘更多具有丰富结构特征的亲水性材料,以实现糖肽的简单高效富集。
技术实现要素:
本发明针对上述问题,从而提出了一种用于选择性捕获和识别糖肽的磁性纳米纤维基两性离子亲水性材料,具有良好的亲水性、丰富的两性离子谷胱甘肽分子、强磁响应性的特点,在糖肽富集方面具有更好的特异性和效率。
具体的技术方案如下:
用于选择性捕获和识别糖肽的磁性纳米纤维基两性离子亲水性材料,利用羟基磷灰石纳米纤维作为载体来固定fe3o4纳米颗粒和au纳米颗粒,通过两性离子三肽l-谷胱甘肽中的硫醇基团与au和fe3o4之间的亲和作用进行表面修饰,形成mhn/au-gsh纳米纤维。
进一步的,mhn/au-gsh纳米纤维的制备方法如下:
s1:将2.0g羟基磷灰石纳米纤维和0.75g乙酰丙酮铁分散在400ml三甘醇中得到混合物;
s2:将混合物转移到1l高压釜中,并在220℃下反应12小时,用水和乙醇清洗后,得到固定fe3o4纳米颗粒的纳米纤维产物mhn;
s3:将0.5g制备的mhn和25ml四氯金酸酸三水合物加入1l去离子水中得到悬浮液;
s4:将悬浮液在25℃下搅拌12小时,加入50mg硼氢化钠,并搅拌30分钟,得到同时固定fe3o4纳米颗粒和au纳米颗粒的纳米纤维产物mhn/au;
s5:用去离子水清洗后,0.5gmhn/au产物分散在含有2g谷胱甘肽的水溶液中;在50℃下搅拌10小时,得到mhn/au-gsh纳米纤维。
进一步的,s3中的四氯金酸三水合物的浓度为2mg/ml。
进一步的,mhn/au-gsh纳米纤维用于糖肽的富集和鉴定。
进一步的,mhn/au-gsh纳米纤维可用于对人免疫球蛋白、鸡抗生物素蛋白或牛血清白蛋白进行电离飞行时间质谱分析前的预处理;具体步骤如下:
s1:用胰蛋白酶消化人免疫球蛋白、鸡抗生物素蛋白或牛血清白蛋白;
s2:将400μg的mhn/au-gsh纳米纤维和2.5μg人免疫球蛋白消化物、鸡抗生物素蛋白消化物或牛血清蛋白消化物加入到400μl缓冲液中,在25℃下温育15分钟;
s3:将材料磁分离并用2×400μl缓冲液清洗后,加入20μl洗脱液以洗脱捕获糖肽;
s4:取1μl的洗脱液和1μl的dhb沉积在maldi板上,进行maldi-tofms分析;
在上述的预处理过程中,缓冲液为acn-h2o-tfa,92:7.9:0.1,v/v/v;洗脱液为acn-h2o,30:70,v/v;dhb的浓度为25mg/ml。
进一步的,mhn/au-gsh纳米纤维可用于对人血清进行nano-lc-ms/ms分析前的预处理;具体步骤如下:
s1:胰蛋白酶消化人血清;
s2:将2mg的mhn/au-gsh纳米纤维与5μl人血清消化物一起加入1ml缓冲液中孵育30分钟;
s3:加入2×100μl洗脱液,并将获得的洗脱液冻干;
s4:将冻干的样品重新溶解在100μl25mmol·l-1碳酸氢钠溶液中,加入pngasef,并在37℃下孵育过夜;
s5:将溶液再次冻干后进行nano-lc-ms/ms分析;
在上述的预处理过程中,缓冲液为acn-h2o-tfa,92:7.9:0.1,v/v/v;洗脱液为acn-h2o,30:70,v/v。
本发明的有益效果为:
本发明的mhn/au-gsh聚集了纳米纤维的一维结构特征,谷胱甘肽的优异的亲水性和fe3o4的强磁响应能力于一体,在糖肽富集方面显现出选择性高,检测灵敏度高,结合能力强,回收效率好等优异的特点。此外,通过富集来自人血清的低丰度糖肽证明了mhn/au-gsh纳米纤维用于糖蛋白质组分析的实际潜力。这项工作为开发新的亲水性纳米纤维及其在生物医学领域的应用提供了一条途径;
本发明的mhn/au-gsh纳米纤维对糖肽的检测灵敏度(2fmol)高,回收率(89.65%)好,结合能力强(100mg/g),富集选择性高(1:100)。
附图说明
图1为mhn/au-gsh纳米纤维的合成工艺图。
图2为hn的tem显微照片(1)。
图3为hn的tem显微照片(2)。
图4为mhn的tem显微照片(1)。
图5为mhn的tem显微照片(2)。
图6为mhn/au纳米纤维的tem显微照片(1)。
图7为mhn/au纳米纤维的tem显微照片(2)。
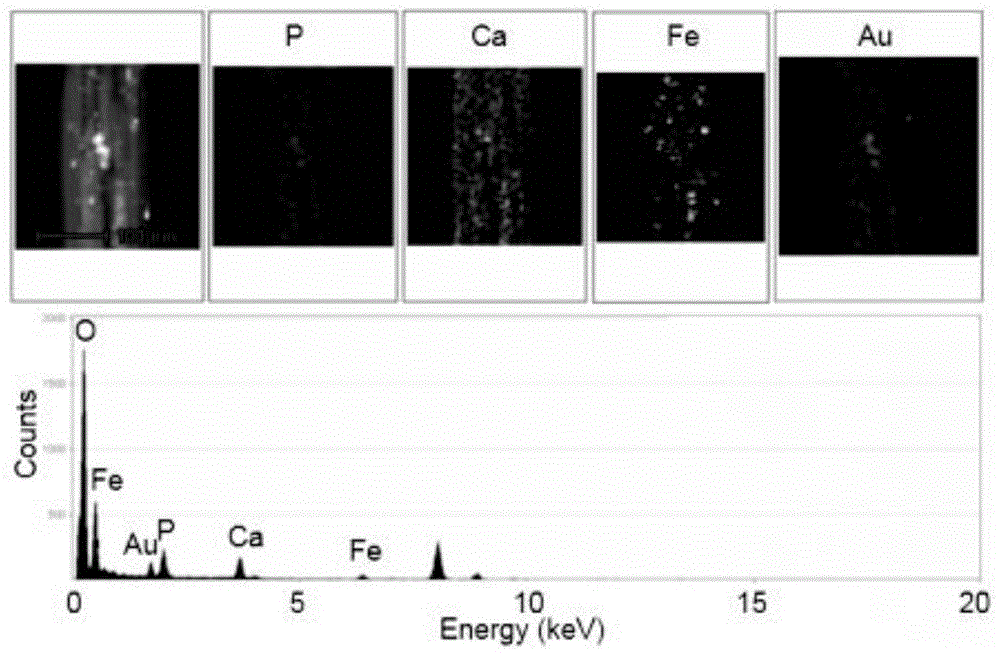
图8为制备的mhn/au纳米纤维的能量色散谱(eds)元素分布图。
图9为傅里叶变换红外(ftir)光谱分析结果图;其中,(i)mhn/au、(ii)mhn/au-gsh、(iii)gsh。
图10为xrd分析结果图;其中,(i)hn、(ii)mhn、(iii)mhn/au。
图11为mhn和mhn/au-gsh的磁滞回线曲线;其中,(i)mhn、(ii)mhn/au-gsh。
图12为直接分析0.4pmol人igg消化物的maldi-tofms谱图。
图13为富含mhn/au-gsh纳米纤维的maldi-tofms谱图。
图14为富含mhn-gsh纳米纤维的maldi-tofms谱图。
图15为富含hn/au-gsh纳米纤维的maldi-tofms谱图。
图16为由商业两性离子亲水材料富集的maldi-tofms谱图。
图17为通过mhn/au-gsh纳米纤维富集并通过pngasef进行去糖基化的maldi-tofms谱图。
图18为0.25pmol鸡抗生物素蛋白消化物直接分析的maldi-tofms谱图。
图19为由mhn/au-gsh纳米纤维富集的maldi-tofms谱图。
图20为20mmol的人igg消化后的mhn/au-gsh纳米纤维富集后的maldi-tofms谱图。
图21为2mfmol的人igg消化后的mhn/au-gsh纳米纤维富集后的maldi-tofms谱图。
图22为20fmol的人igg消化后,用商业两性离子亲水材料富集后的maldi-tofms谱图。
图23为2fmol的人igg消化后,用商业两性离子亲水材料富集后的maldi-tofms谱图。
图24为直接分析含有人igg消化物和bsa消化物的肽混合物的maldi-tofms谱图。
图25为由mhn/au-gsh纳米纤维富集后的含有人igg消化物和bsa消化物的肽混合物的maldi-tofms谱图。
图26为以1:100的质量比mhn/au-gsh纳米纤维富集后的含有人igg消化物和bsa消化物的肽混合物的maldi-tofms谱图。在图12-图26中,糖肽峰用符号“*”标记。
具体实施方式
为使本发明的技术方案更加清晰明确,下面对本发明进行进一步描述,任何对本发明技术方案的技术特征进行等价替换和常规推理得出的方案均落入本发明保护范围。
一种用于选择性捕获和识别糖肽的磁性纳米纤维基两性离子亲水性材料,利用羟基磷灰石纳米纤维作为载体来固定fe3o4纳米颗粒和au纳米颗粒,通过两性离子三肽l-谷胱甘肽中的硫醇基团与au和fe3o4之间的亲和作用进行表面修饰,形成mhn/au-gsh纳米纤维。
进一步的,mhn/au-gsh纳米纤维的制备方法如下:
s1:将2.0g羟基磷灰石纳米纤维和0.75g乙酰丙酮铁分散在400ml三甘醇中得到混合物;
s2:将混合物转移到1l高压釜中,并在220℃下反应12小时,用水和乙醇清洗后,得到固定fe3o4纳米颗粒的纳米纤维产物mhn;
s3:将0.5g制备的mhn和25ml四氯金酸三水合物加入1l去离子水中得到悬浮液;
s4:将悬浮液在25℃下搅拌12小时,加入50mg硼氢化钠,并搅拌30分钟,得到同时固定fe3o4纳米颗粒和au纳米颗粒的纳米纤维产物mhn/au;
s5:用去离子水清洗后,将0.5gmhn/au产物分散在含有2g谷胱甘肽的水溶液中;在50℃下搅拌10小时,得到mhn/au-gsh纳米纤维。
进一步的,s3中的四氯金酸三水合物的浓度为2mg/ml。
进一步的,mhn/au-gsh纳米纤维用于糖肽的富集和鉴定。
进一步的,hn/au-gsh纳米纤维可用于对人免疫球蛋白、鸡抗生物素蛋白或牛血清白蛋白进行电离飞行时间质谱分析前的预处理;具体步骤如下:
s1:用胰蛋白酶消化人免疫球蛋白、鸡抗生物素蛋白或牛血清白蛋白;
s2:将400μg的mhn/au-gsh纳米纤维和2.5μg人免疫球蛋白消化物、鸡抗生物素蛋白消化物或牛血清蛋白消化物加入到400μl缓冲液中,在25℃下温育15分钟;
s3:将材料磁分离并用2×400μl缓冲液清洗后,加入20μl洗脱液以洗脱捕获糖肽;
s4:取1μl的洗脱液和1μl的dhb沉积在maldi板上,进行maldi-tofms分析;
在上述的预处理过程中,缓冲液为acn-h2o-tfa,92:7.9:0.1,v/v/v;洗脱液为acn-h2o,30:70,v/v;dhb的浓度为25mg/ml。
进一步的,mhn/au-gsh纳米纤维可用于对人血清进行nano-lc-ms/ms分析前的预处理;具体步骤如下:
s1:胰蛋白酶消化人血清;
s2:将2mg的mhn/au-gsh纳米纤维与5μl人血清消化物一起加入1ml缓冲液中孵育30分钟;
s3:加入2×100μl洗脱液,并将获得的洗脱液冻干;
s4:将冻干的样品重新溶解在100μl25mmol·l-1碳酸氢钠溶液中,加入pngasef,并在37℃下孵育过夜;
s5:将溶液再次冻干后进行nano-lc-ms/ms分析;
在上述的预处理过程中,缓冲液为acn-h2o-tfa,92:7.9:0.1,v/v/v;洗脱液为acn-h2o,30:70,v/v。
为了进一步理解本发明,下面结合实施例对本发明提供的技术方案进行详细说明,本发明的保护范围不受以下实施例的限制。
mhn/au-gsh纳米纤维的表征
磁性纳米纤维基两性离子亲水材料(mhn/au-gsh纳米纤维)的合成方法在图1中给出。简单地说,采用溶剂热反应法合成一维羟基磷灰石纳米纤维(hn)并作为修饰fe3o4纳米粒子和au纳米颗粒的载体。随后,谷胱甘肽(gsh)中的巯基与au和fe3o4纳米颗粒发生反应,使得谷胱甘肽在磁性纳米纤维上的固定。mhn/au-gsh纳米纤维具有纳米纤维、磁响应能力和亲水性谷胱甘肽基团的特点,作为吸附剂,可在质谱糖肽组学研究的样品制备过程中,对糖肽进行了特异性捕获。
图2、图3、图4、图5、图6、图7显示了所制备的hn,mhn和mhn/au纳米纤维的形态。hn由具有明显一维特征的羟基磷灰石纳米线组成,包括10-20nm的纳米尺寸直径,高纵横比,并且自组装成纳米纤维(图2,图3)。与hn的光滑表面相比,在mhn上装饰了大量平均直径为约12nm的小纳米颗粒(图4,图5)。此外,将au纳米粒子在mhn上固定后,在mhn表面出现了更多的小纳米粒子,形成mhn/au纳米纤维。根据x射线衍射(xrd)分析结果,用scherrer方程计算了修饰金纳米粒子的平均粒径约为11.6nm。此外,利用能量色散谱(eds)元素分布图研究了来自mhn/au纳米纤维的p,ca,fe和au的空间元素分布。如图8所示,这四种元素信号均匀定位,进一步证实了信号峰,揭示了fe3o4和au纳米颗粒在mhn/au纳米纤维中的成功固定。
用傅里叶变换红外(ftir)光谱分析证实谷胱甘肽的修饰。在图9中,羟基(3573cm-1),po43-基团(1093,1031,962,605和565cm-1)的吸收峰,在mhn/au的红外光谱中观察到吸附水(3436和1633cm-1)。565cm-1处的吸收峰与fe3o4(560cm-1)的特征吸收峰重叠。此外,图9中清楚地发现了属于谷胱甘肽的指纹峰。这些结果证明了谷胱甘肽成功固定在fe3o4和au的纳米纤维上。
此外,还对其结构进行了xrd分析。在图10中,hn的特征峰与羟基磷灰石的分析结果一致。相比之下,在35.5°处标记出黑色符号‘*’的衍射峰的强度相对提高是由于mhnx射线衍射图中fe3o4的磁性成分所致。此外,在mhn/au纳米纤维的xrd图谱中,在38.3°处有一个黑色符号‘#’的新峰属于au。
如图11所示,确定了mhn和mhn/au-gsh的磁滞回线曲线,表明这两种材料具有超磁特征。测得mhn和mhn/au-gsh的饱和磁化强度值分别为6.76和5.51emu·g-1。尽管最终的纳米纤维具有相对低的饱和磁化强度值,但已经足够使该纳米纤维从水溶液中快速磁分离。
用标准糖蛋白消化法测定mhn/au-gsh纳米纤维的糖肽富集性能
使用人的免疫球蛋白igg胰蛋白酶消化物作为模型样品来研究所制备的mhn/au-gsh纳米纤维的糖肽富集性能。如图12所示,在未富集的人igg消化物中没有观察到任何糖肽峰。然而,在用mhn/au-gsh纳米纤维富集后,具有强信号强度的糖肽峰在质谱中占主导地位,并且几乎没有任何非糖肽峰的干扰(图13)。我们总共对21个糖肽进行检测和鉴定。此外,以mhn-gsh纳米纤维、非磁性纳米纤维(hn/au-gsh)和商用zic-hilic材料作为对照组。在图14,图15和图16中,分别只有17,20和18个糖肽峰被检测到。经mhn/au-gsh纳米纤维富集后,鉴定的糖肽峰的信号强度和信噪比(s/n)明显高于对照材料处理后的信号强度和信噪比(s/n)比。例如,经mhn/au-gsh、mhn-gsh、hn/au-gsh和商品zic-hilic材料富集后测得的糖肽峰在质荷比为2764.1处的s/n比值分别为810.7、464.7、564.5和492.6。结果表明,mhn/au-gsh的富集性能优于mhn-gsh、hn/au-gsh和商用zic-hilic材料。此外,捕获的糖肽被pngasef(糖酰胺酶)去糖基化。在图17中,所有检测到的糖肽峰消失,仅剩下两种主要的脱酰胺基肽(eeqfn#stfr,eeqyn#styr),这表明图13中所有观察到的峰都与n键糖肽有关。独特的一维结构,丰富的两性离子基团和强磁响应性有助于提供优异的富集性能。这些结果均证实,所制备的mhn/au-gsh纳米纤维对糖肽具有高的富集特异性和效率。
此外,还采用鸡抗生物素蛋白的胰蛋白酶消化物。鸡抗生物素蛋白消化物的质谱如图18所示,由于同时存在大量的非糖肽,因此观察到8个具有低信号强度和s/n比的糖肽峰。重要的是,在使用mhn/au-gsh纳米纤维的选择性富集过程后,质谱(图19)中14个糖肽峰受到影响,具有改善的信号强度和s/n比。这些分析结果证明了制备的mhn/au-gsh纳米纤维对普遍的糖肽富集具有高选择性和效率。
测定了制备的mhn/au-gsh纳米纤维对糖肽的检测灵敏度。如图20所示,在富集过程后,在20fmol的人免疫球蛋白igg消化物中明显观察到12个糖肽峰。当人类igg消化量低至2fmol时(图21),仍然可以观察出四个糖肽峰,最高s/n比为22.8。mhn/au-gsh纳米纤维对糖肽的检测灵敏度可以认为是2fmol。为了比较,还测试了商业亲水材料的检测灵敏度。当人igg消化量为20fmol时并用商业亲水材料富集后,仅能检测到8个糖肽峰(图22)。而当人igg消化量仅为2fmol时(图23),未能观察到糖肽峰。本次研究的mhn/au-gsh纳米纤维对丰富的低丰度糖肽具有较高的检测灵敏度,其性能优于cs@pgma@ida-ti4+(45fmol)、go-fe3o4/sio2/aunws/l-半胱氨酸(10fmol)、mos2/au-np-l-半胱氨酸(10fmol)和fe3o4@tppa这几种亲水性材料。
根据先前文献,用同位素二甲基标记法对6种从人igg中释放的靶向糖肽的富集回收率进行了评价。实现的平均富集回收率为89.65%。与以往报道过的resin@polysaccharide(73%)、go/fe3o4/au/peg(59.2%)、fe3o4@mps@pmac(82%)、mil-101(nh2)@au-cysteine(80%)和resin/au-cysteine(79%)这几种亲水性材料相比,制备的mhn/au-gsh纳米纤维具有更好的捕获能力。
与此同时我们也对确mhn/au-gsh纳米纤维的结合能力进行了测定。将固定质量的人igg消化物(3μg)与一定质量的mhn/au-gsh一起温育。一段时间后进行检测,当mhn/au-gsh的使用质量为30μg时,六种所选糖肽的信号强度达到最大值。mhn/au-gsh纳米纤维对糖肽的结合容量可达到100mg·g-1。这可能是由于两性离子亲水性基团丰富,糖肽与mhn/au-gsh纳米纤维之间具有较强的多价亲水性相互作用所致。实验结果表明mhn/au-gsh纳米纤维的结合能力强于fe3o4@csmcncs(17.5mg/g)、fe3o4-da-maltose(43mg/g)和fe3o4@pgma@au-l-cysteine(75mg/g)。
进一步研究了mhn/au-gsh纳米纤维的富集选择性。如图24所示,直接分析含有人igg消化物和bsa消化物的多肽混合物,我们发现非糖肽峰在质谱上占主导地位,并且没有明确鉴定出糖肽峰。然而,在使用mhn/au-gsh纳米纤维的富集后,非糖肽明显消失,检测到的19和17种糖肽的信号强度明显改善(图25和图26),这为mhn/au-gsh纳米纤维对糖肽的富集提供了更多的证据。
选择性富集和鉴定人血清中的糖肽
人血清作为典型的临床标本,潜在的诊断疾病的生物标志物引起了广泛关注。受mhn/au-gsh纳米纤维在糖肽富集方面的优势证实,按照蛋白质酶解,mhn/au-gsh纳米纤维糖肽富集,pngasef去糖基化和质谱鉴定的方案分析人血清糖蛋白。结果,仅通过1μl人血清的三次独立分析,共鉴定出104种糖蛋白中的246种糖肽。相比之下,商业两性离子亲水材料仅鉴定了来自69种糖蛋白的162种糖肽。这些亲和材料的结构差异有助于它们在糖肽富集中的不同能力。这些结果表明,所制备的mhn/au-gsh纳米纤维在捕获低丰度糖肽方面具有高特异性和高效率,并且在研究复杂生物标本的糖蛋白质组方面有巨大的潜力。
在本实施例中的实验方法,如无特殊说明,均为常规方法。本实施例中所用的实验材料如无特殊说明,均为市场购买得到。
用透射电子显微镜(feitecnaig2f20,usa)获得透射电子显微镜(tem)图像和能量色散光谱(eds)元素映射。使用thermonicolet380傅里叶变换红外光谱仪(nicolet,wisconsin,usa)得到红外光谱。使用x射线衍射仪(rigakud/max2550v,cukα辐射,
- 还没有人留言评论。精彩留言会获得点赞!