一种基于血管化螺旋形人工肌肉驱动的仿生微夹钳的制作方法
[0001]
本发明涉及一种基于血管化螺旋形人工肌肉驱动的仿生微夹钳,属于人工微钳装置技术领域。
背景技术:
[0002]
微型钳子是自然界虾类、蟹类、蝎类等生物常见的结构之一,亿万年的进化让上述生物的微型钳子具备目前人工系统所无法比拟的优势,如体积微小却具有高能量转换效率等。目前人工微钳装置虽然具有较高的操作精度,但内部运行机制仍以纯机械电子方式为主,这种机械电子方式需要的外围辅助设备复杂,同时占用空间较大,能量转换效率低,从而无法实现整体装置的微型化。
[0003]
为了进一步提升机械电子式微钳的能量转化效率,同时实现人工微钳的微型仿生构造,目前热点关注类生命钳子装置的研究。类生命微钳装置是指将生物细胞驱动与传统机电微钳有机融合,形成一种真正微型化的新型镊钳装置。目前微钳的类生命化方法主要是基于肌细胞三维组装形成肌肉组织,通过肌肉组织的主动或被动刺激跳动来实现生物驱动钳状机构的开关/闭合控制。通过引入肌肉细胞,可以有效提升人工钳子的能量转化效率,极大缩小外围辅助设备的复杂度和体积,实现人工钳子的微型化。
[0004]
目前用于微钳装置驱动的人工肌肉组织主要是通过生物材料包裹肌肉细胞,并在对生物材料施加一定拉力的培养环境下,实现肌肉细胞的线性化排列,形成生物材料/肌细胞混合的人工肌肉环。然而,肌肉细胞的存活需要充足的营养物质供应,当细胞周围包裹的生物材料厚度超过300微米时,就需要提供营养物质交换的通道。但现有的类生命微钳的人工肌肉环由于缺乏类似人体的血管供养结构,导致无法实现肌细胞的长期生命维持。同时,由于供养系统的缺乏,也无法实现仿生类生命微镊钳的在空气环境中的长时间工作。
技术实现要素:
[0005]
针对现有生物驱动微夹钳缺乏细胞营养供应系统,无法在空气环境中长期工作的问题,本发明提供了一种基于血管化螺旋形人工肌肉驱动的微夹钳。所述装置通过螺旋形排列的微流道为骨骼肌细胞群进行灌流供养,并通过电刺激螺旋形线性排列的骨骼肌细胞群舒张/收缩,带动仿生微夹持机构开启/闭合。
[0006]
为实现上述目的,本发明的技术方案如下:
[0007]
一种基于血管化人工肌肉驱动的仿生微夹钳,包括仿生微夹持机构、血管化螺旋形人工肌肉、电极组件、凹型基座和细胞培养液;
[0008]
所述仿生微夹持机构为对称一体化结构,由u型段和仿生微钳臂段组成,所述u型段底部固定在凹型基座的凹型槽内,仿生微钳臂段由u型段的顶部延伸而出;u型段的两侧对称开有凹槽;
[0009]
所述仿生微钳臂段内侧设有仿锹甲上颚的尖锐微突起,外侧沿竖直方向向外倾斜;
[0010]
所述血管化螺旋形人工肌肉为微纤维自u型段两侧凹槽的一端缠绕至另一端而形成的空心长方体框结构;所述微纤维的材质为水凝胶材料,微纤维内沿长度方向设有生物微纤维和微流道;所述生物微纤维内包裹有骨骼肌细胞,所述生物微纤维的材质为能使得骨骼肌细胞粘附增殖的生物材料;
[0011]
所述电极组件为所述骨骼肌细胞提供电压;
[0012]
使用时,所述细胞培养液由所述微纤维的一端注入,另一端流出。
[0013]
优选的,所述仿生微夹持机构的材质为su-8光交联材料。
[0014]
优选的,所述仿生微夹持机构的厚度为0.4毫米~0.7毫米;所述u型段凹槽的长度为4毫米~5毫米,凹槽深度范围为0.2毫米~0.4毫米。
[0015]
优选的,仿生微钳臂段外侧沿竖直方向向外倾斜角度为3度~10度。
[0016]
优选的,所述微纤维横截面呈圆形,直径为0.35毫米~0.5毫米;所述微流道横截面呈圆形,直径为0.05微米~0.08微米。
[0017]
优选的,所述微纤维材料为海藻酸钙水凝胶。
[0018]
优选的,所述生物微纤维材质为胶原蛋白。
[0019]
优选的,所述电极组件为所述骨骼肌细胞提供峰值为2伏特,频率为0.1hz~10hz的输入电压。
[0020]
优选的,凹型基座内与所述凹槽相对的位置处分别设有电极安装孔;所述电极组件包括电极片、电源和固定板,所述电极片放置在所述电极安装孔内,所述电极片通过导线与电源连接后通过外侧的固定板固定;
[0021]
优选的,所述固定板的材质为su-8光交联材料。
[0022]
有益效果:
[0023]
本发明装置可以实现一种仿生“锹甲”雄虫的上颚的类生命微夹钳装置的构建,首先,所构建的微夹钳具有血管化的供养系统,可以实现人工肌肉组织在空气中的长期活性保持,从而所构建的类生命微仿生装置可以脱离液体环境,实现在空气环境中的长期作业。其次,基于人工肌肉组织驱动的夹钳装置可以有效实现夹钳的微型化,使得仿生夹钳从整体尺寸上更加仿生微小的昆虫结构,从而为后续仿昆虫机器人的小型化提供基础。再次,本发明所涉及的结构尺寸的设计,可以保证血管化螺旋形人工肌肉产生足够的收缩力,驱动微夹钳产生收缩动作;同时可以保证微血管化流道始终保持通畅,不会因肌肉收缩产生坍塌。
附图说明
[0024]
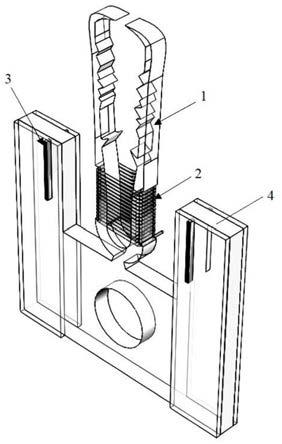
图1-4是本发明所述仿生微夹钳的结构示意图。
[0025]
图5是本发明所述仿生微夹钳中仿生微夹持机构的示意图。
[0026]
图6-8是本发明所述仿生微夹钳中血管化螺旋形人工肌肉的示意图。
[0027]
其中,1-仿生微夹持机构,2-血管化螺旋形人工肌肉,3-电极组件,4-凹型基座,5-细胞培养液,11-u型段,12-仿生微钳臂段,21-微纤维,31-电极片,32-电源,33-固定板,41-电极安装孔,42安装通孔,111-凹槽,211-生物微纤维,212-微流道。
具体实施方式
[0028]
下面结合具体实施例对本发明作进一步详细的说明。
[0029]
如图1-8所示,一种基于血管化人工肌肉驱动的仿生微夹钳,包括仿生微夹持机构1、血管化螺旋形人工肌肉2、电极组件3、凹型基座4和细胞培养液5;
[0030]
所述仿生微夹持机构1为对称一体化结构,由u型段11和仿生微钳臂段12组成,所述u型段11底部固定在凹型基座3的凹型槽内,仿生微钳臂段12由u型段11的顶部延伸而出;u型段11的两侧对称开有凹槽111;
[0031]
所述仿生微钳臂段12内侧设有仿锹甲上颚的尖锐微突起,外侧沿竖直方向向外倾斜;
[0032]
所述血管化螺旋形人工肌肉2为微纤维21自u型段11两侧凹槽111的一端缠绕至另一端而形成的空心长方体框结构;所述微纤维21的材质为水凝胶材料,微纤维21内沿长度方向设有生物微纤维211和微流道212;所述生物微纤维211内包裹有骨骼肌细胞,所述生物微纤维211的材质为能使得骨骼肌细胞粘附增殖的生物材料;
[0033]
所述电极组件3为所述骨骼肌细胞提供电压;
[0034]
使用时,所述细胞培养液5由所述微纤维21的一端注入,另一端流出。
[0035]
所述仿生微夹持机构1的材质为su-8光交联材料。所述仿生微夹持机构1的厚度一致,厚度范围为0.4毫米~0.7毫米。
[0036]
所述u型段11的底部为半圆形环结构,环内侧半径范围为0.6毫米~0.85毫米,环的宽度(外径减内径的尺寸)为0.5毫米~0.9毫米。从半圆形环结构双端,延伸出u型段11的双臂,双臂长度为5毫米,双臂的形状对称,宽度不严格均匀,宽度范围为0.5毫米~0.9毫米。在双臂外侧有一对矩形凹槽,凹槽起始侧边为半圆形环结构的端面,凹槽底面平行于微夹持装置中心轴线,长度为4毫米~5毫米,凹槽深度范围为0.2毫米~0.4毫米。
[0037]
所述仿生微钳臂段12是两组对称细杆状结构,从u型段11前端开始逐渐变细的臂结构。在仿生微钳臂段12内侧有尖锐微突起模仿锹甲上颚的突起。仿生微钳臂段12的双钳臂对称地向u型段11双臂的外侧倾斜,倾斜夹角范围为3度~10度。
[0038]
所述血管化螺旋形人工肌肉2外形是一个空心的水凝胶长方体框,水凝胶长方体框由包裹着骨骼肌细胞的生物微纤维211和微流道212的微纤维21螺旋形排列而成。
[0039]
所述微纤维21横截面呈圆形,直径为0.35毫米~0.5毫米;所述生物微纤维211横截面呈近似圆形,直径为100微米~160微米;所述微流道212横截面呈圆形,直径为0.05微米~0.08微米。
[0040]
所述微纤维21的材质为水凝胶材料,生物微纤维211的材质为能使得骨骼肌细胞粘附增殖的生物材料。优选的,所述微纤维21材料为海藻酸钙水凝胶,所述生物微纤维211材质为胶原蛋白。
[0041]
所述微纤维21为单根连续结构,呈现矩形螺旋状排列,形成空心的水凝胶长方体框。该长方体框的矩形横截面的外侧长度与外侧宽度分别对应于u型段11的凹槽111部位的横截面的长度与宽度,长方体框的高度,对应于凹槽11的底面的长度。整个长方体框分层套在凹槽11内。
[0042]
所述微纤维21横截面呈圆形,直径为0.35毫米~0.5毫米。微纤维21内部包裹微流道212与使得细胞粘附伸展的生物微纤维211,生物微纤维211中包裹着骨骼肌细胞。微流道
212和生物微纤维211都沿着微纤维21的轴线方向呈螺旋形排列分布。
[0043]
所述微流道212横截面呈圆形,直径范围为0.05微米~0.08微米。微流道212一端为注入端,注入端可通过微移液管与灌流系统相连,将细胞培养液5注射到微纤维21内,培养液将沿着螺旋形微流道212流动,并从微纤维21的另一端流出。
[0044]
所述生物微纤维211横截面呈近似圆形,直径范围为100微米~160微米,骨骼肌细胞沿着生物微纤维211轴线定向分布,形成螺旋形排列的肌细胞束。
[0045]
所述凹型基座4内与所述凹槽111相对的位置处分别设有电极安装孔41;所述电极组件3包括电极片31、电源32和固定板33,所述电极片31放置在所述电极安装孔41内,所述电极片31通过导线与电源32连接后通过外侧的固定板33固定;所述电极装置3中固定板33使得两个电极片31分别放置于螺旋形人工肌肉2的两侧,与凹槽11底面平行。两个电极片31分别通过导线与电源32相连,为骨骼肌细胞提供峰值为2伏特,频率为0.1hz~10hz的输入电压,刺激螺旋形人工肌肉组织按照相同频率收缩与舒张。
[0046]
所述固定板33的材质为su-8光交联材料。
[0047]
实施例1
[0048]
一种基于血管化人工肌肉驱动的仿生微夹钳,包括仿生微夹持机构1、血管化螺旋形人工肌肉2、电极组件3、凹型基座4和细胞培养液5;
[0049]
所述仿生微夹持机构1所使用的材料为su-8(3050),通过标准软光刻工艺将厚度为500微米的su-8(3050)层,按照微夹持机构二维平面内形状固化在薄玻璃上(厚度:0.1毫米)。随后将薄玻璃剥离,就可形成三维的仿生微夹持机构1。
[0050]
所述仿生微夹持机构1由u型段11和仿生微钳臂段12组成,u型段11的底部为半圆形环结构,环内侧半径为750微米,环宽(外径减内径的尺寸)为700微米。从半圆形环两端,分别延伸出双臂,双臂形状对称,臂的宽度为50微米,双臂外侧有凹槽111,凹槽111长度为5毫米,深度为200微米。凹槽111起始侧边为半圆环结构的端面,凹槽111底面平行于所述仿生微夹持机构1的中心轴线。所述仿生微钳臂段12是从u型段11的双臂前端延伸的细杆状结构,在杆内侧随机分布尖锐微突起。所述仿生微钳臂段12向u型段11的臂外侧倾斜,倾斜角度为3度。仿生微钳臂在微夹持机构径向方向的投影长度为1500微米,在轴向方向的投影长度为6毫米。
[0051]
所述凹型基座4通过梯形结构与u型段11底部相连。梯形结构的上底长度为500微米,下底长度为900微米。下底与凹型基座4相连,凹型基座4中间有一圆形安装通孔42,孔的直径为4毫米。在凹型基座4的双臂结构上分别有一个矩形电极安装孔41,电极安装孔41的宽度为0.5毫米,长度为5毫米,电极安装孔41上下两个宽边的延长线分别与凹槽上下侧边重合。两个矩形通孔的形状相同,位置相对于所述仿生微夹持机构1的中心轴线对称,两孔长轴之间的垂直距离为6毫米。
[0052]
所述血管化螺旋形人工肌肉2由螺旋形排列的微纤维21组装,微纤维21内部包裹沿着微纤维轴线并列排列的微流道212与生物微纤维211,同时,生物微纤维211中包裹着沿着生物材料轴线分布的骨骼肌细胞。
[0053]
所述微纤维21是基于1.7%w/v海藻酸溶液,2毫克/毫升胶原蛋白溶液,2%w/v透明质酸(hyaluronic acid)和1%w/v氯化钙溶液通过湿法纺织制备而成。
[0054]
具体的湿法纺织方法操作过程为:
[0055]
(1)将一个双针管不锈钢针嘴(针管内径为80微米,外径为120微米),嵌套进一个单管不锈钢针嘴(针管内径为350微米,外径为550微米)内,两针嘴之间用环氧树脂密封固定。同时,将单管不锈钢钢针嘴的单管套入一段长度为3厘米的透明玻璃管的一端,用弹性胶带固定单管针嘴和玻璃管。玻璃管的另一端插入一个微移液管尖端内部,微移液管尖端注射孔的直径为350微米,组成一个同轴微流道装置。
[0056]
(2)将胶原蛋白溶液和透明质酸溶液注入双针管不锈钢针嘴,胶原蛋白溶液从双针管中的一个针管流出,而透明质酸溶液从另外一个针管流出。将海藻酸溶液注入单针管不锈钢针嘴,从单针管流出。三种溶液在玻璃管内部形成海藻酸溶液流包裹胶原蛋白溶液流和透明质酸溶液流的嵌套式层流结构,通过调节各溶液的注入流速,可以对胶原蛋白溶液流和透明质酸溶液流的流体直径进行调节。
[0057]
(3)嵌套式层流通过微移液管尖端注射孔注射入氯化钙溶液,外层的海藻酸溶液立刻固化形成直径为400微米的海藻酸钙水凝胶纤维。随后,将海藻酸钙水凝胶纤维放入37度细胞培养液中静置2小时,包裹在海藻酸钙水凝胶纤维中的胶原蛋白溶液固化,形成直径为160微米的胶原蛋白微纤维,而透明质酸溶液仍保持液体状态,从而在海藻酸钙微纤维内部,形成直径为70微米的微流道。
[0058]
具体的微纤维21螺旋形排列形成血管化螺旋形人工肌肉2组织的操作过程为:
[0059]
(1)用直径为500微米的铁丝围绕形成矩形框,矩形框的长度为1厘米,宽度为2毫米。未被围绕的铁丝从矩形框的一角处被拉直,同时,被拉直的未被围绕的铁丝被同轴地固定在直流电机的旋转轴上。电机的旋转轴向水平面上方倾斜5度夹角。
[0060]
(2)将微纤维的一端从培养液中提起,通过直径为2毫米的磁铁将微纤维被提起的一端固定在矩形框的一条边上,随后,通过电机旋转将微纤维不断拉出水面,微纤维可以自发地在矩形框表面形成螺旋形缠绕排列。
[0061]
(3)电机旋转轴旋转12圈,在矩形框表面形成12匝被缠绕的微纤维。随后,通过塑料微针头将被缠绕的微纤维之间的间隔压紧,形成连续的螺旋状结构,并通过喷雾器先后在螺旋状结构表面喷洒1%w/v氯化钙溶液和0.5%w/v海藻酸溶液,将被缠绕的微纤维彼此固定,形成水凝胶长方框
[0062]
(4)将水凝胶长方框从矩形框中取下,长方框两端各保留一端未被缠绕的微纤维,放入培养液中,培养12天,使包裹在胶原蛋白中的骨骼肌细胞形成螺旋形的细胞束,之后通过更换成无血清的培养液,将螺旋形细胞束分化成所述的血管化螺旋形人工肌肉组织。
[0063]
所述血管化螺旋形人工肌肉组织在取出培养液之后,在包含0.5%w/v氯化钙溶液的培养液中浸泡5分钟,之后从仿生微夹持机构的顶端套入机构凹槽位置。
[0064]
使用显微镜,将微移液枪头(型号:20微升,eppendorf north america,inc,usa),枪头的内径为30微米,外径为50微米,从所述的人工肌肉组织中未被缠绕的微纤维一端的微流道处插入。微纤维和被插入的微移液枪头之间通过生物胶水固定。随后,微移液枪头的另一端与注射泵相连,培养液以300微升/小时的速度注入微纤维,注入的微纤维将从所述人工肌肉组织的另一端被排出。
[0065]
所述电极片31为两块矩形铜片,铜片长度为4.8毫米,宽度0.4毫米,厚度为1毫米。铜片被分别插入凹型基座4的电极安装孔41内,同时,分别在被插入铜片的上部与下部同时套入一片带有相同矩形安装孔,厚度为300微米,形状与安装基座突出双臂一致的固定板
43,所述固定板43为su-8薄片,通过胶水相连,从而将铜片固定在电极安装孔41内。两个铜片通过导线分别连接到电源32的正负极,通过输入电压为2伏特,频率为1赫兹的变化电压,人工肌肉就可以驱动仿生微夹持机构实现闭合夹紧/张开舒张的夹钳动作。
[0066]
综上所述,发明包括但不限于以上实施例,凡是在本发明的精神和原则之下进行的任何等同替换或局部改进,都将视为在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1