固定化微生物降解有机磷的方法及其微型化装置和应用与流程
本发明属于酶学或微生物学装置技术领域,主要研究固定化微生物降解有机磷的方法,特别是聚磷菌胞外酶降解有机磷农药的方法,并涉及微型化装置构建,该微型化装置适用于检测环境水土壤各种有机磷农药的残留量。
背景内容
随着有机磷农药的使用,水体降解有机磷的速率极低,水体中磷的含量超标,长期下来会造成水体富营养化以及生物毒性,测定环境中的有机磷磷成了一个重要的课题,现阶段对有机磷农药的广泛使用的测定方法有气相色谱法和酶抑制法(如乙酰胆碱酯酶抑制)。因为简便性,通常蔬菜水果等样品现场测定基本上利用后者,该方法属利用生物传感器原理(张强.2013.有机磷农药快速检测方法研究综述.广东化工;jiangetal.silvernanoparticlesmodifiedtwo-dimensionaltransitionmetalcarbidesasnanocarrierstofabricateacetycholinesterase-basedelectrochemicalbiosensor,chemicalengineeringjournal2018,339,547;luetal.bimetallicpd@aunanorodsbasedultrasensitiveacetylcholinesterasebiosensorfordeterminationoforganophosphatepesticides,sensorsandactuatorsb2018,255,2575.)。以上列出的文献,尽管酶的固定方法以及检测方法不同,但原理上都利用乙酰胆碱酯酶抑制法。该方法的缺点主要有酶的活性稳定性以及其他样品中抑制酶活性的干扰。
技术实现要素:
发明目的:为解决上述技术问题,本发明提供了一种固定化微生物降解有机磷的方法。本发明通过具体研究了聚磷菌的生长曲线,形状观察,降解最终产物及中间体的紫外光谱,酶的特性研究等等得到了聚磷菌降解有机磷的最佳条件。
本发明还提供了有机磷农药微生物全细胞微型化装置,即微生物全细胞有机磷传感器。针对酶抑制法的选择性、稳定性差,以及对微量存在的环境样品的低浓度缺点,本发明利用聚磷菌开发了微生物全细胞有机磷传感器,该传感器解决了酶抑制法基础的生物传感器的诸多缺点,结合聚磷菌自身好氧吸磷生物富集作用和厌氧释磷特性,既提高了稳定性和选择性,又提高了灵敏度,以致对所需检测器的要求比较低,无需特别的前处理过程,传感器可多次反复利用。
本发明还要解决的技术问题是提供了该微型化装置的应用。
技术方案:为达到上述发明目的,本发明技术方案如下:一种固定化微生物降解有机磷的方法,所述方法包括以下步骤:
1)微生物的培养:微生物在含磷培养液中培养获得稳定期的菌体混合液;
2)微生物的固定化:将固定凝胶体与菌体混合液用针形滴管滴入到3-4%cacl2溶液中,固定化7-8h,滤出颗粒,洗净即得固定化的微生物;
3)有机磷的降解:将固定化的微生物加入到有机磷溶液中反应即可。
其中,所述微生物为解磷菌或聚磷菌中的一种或两种。
其中,所述步骤2)的固定凝胶体为海藻酸钠、丙烯酸或二氧化硅中的一种。
其中,所述步骤3)的具体步骤如下:将固定化微生物加入有机磷水溶液和乙酸得到混合液,在好氧条件下培养,然后转移至厌氧条件下放置,最后离心取上清液即可。
其中,所述步骤3)有机磷溶液为甲胺磷,浓度为0.002mg/l~2mg/l。
其中,所述步骤3)混合液的ph6.8~8.8。
其中,所述步骤3)好氧条件下反应温度为15~25℃。
其中,所述步骤3)中还加入乙酸,所述乙酸与有机磷溶液的体积比为1:250~1:1000。
本发明内容还包括有机磷农药微生物全细胞微型化装置,所述微型化装置包括pdms上板、pdms下板以及中间的空腔;所述pdms上板设有聚磷菌培养液进口、上板氮气进口、上板废液及氮气出口;所述pdms下板设有下板废液及氮气出口、下板氮气进口、离子强度调节液进口、磷酸氢根离子选择电极和参比电极;所述空腔中设有纳米孔氧化铝膜,纳米孔氧化铝膜上涂有所述的固定化微生物。
本发明的有机磷农药微生物全细胞微型化装置中采用的固定化微生物是固定化聚磷菌,该固定化聚磷菌的厚度为0.5~1mm。具体采用海藻酸钠为聚磷菌凝胶支持体,利用停流技术,通过电位测定法测定有机磷降解最终产物—正磷酸根来决定样品中有机磷残留量。
其中,所述磷酸氢根离子选择电极为钼磷酸氢根离子选择性电极。
本发明研究了聚磷菌降解有机磷农药(甲胺磷)的最佳条件。研究聚磷菌在不同的温度、ph、乙酸的含量条件,以及不同的好氧时间和厌氧时间下,通过液相色谱测得甲胺磷的降解动力学曲线,得出聚磷菌在最佳时间段好氧吸收有机磷;通过钼酸铵分光光度法和离子色谱法测磷酸根离子的含量,得出聚磷菌在最佳时间段厌氧释放出磷酸根。
本发明内容还包括有机磷农药微生物全细胞微型化装置在降解和/或检测环境水土壤有机磷农药中的应用。
本发明内容还包括将固定化微生物降解有机磷的方法运用到有机磷农药微生物全细胞微型化装置中进行降解和检测农药中的有机磷。
有益效果:相对于现有技术,本发明具备以下优点:
本发明通过实验研究得到了一种固定化微生物降解有机磷的方法,该方法能有效降解有机磷,特别是采用固定化聚磷菌能有效降解甲胺磷。本发明还提供了有机磷农药微生物全细胞微型化装置,利用固定化微生物与传感器结合,将甲胺磷有机磷农药的降解和最后磷酸根的检测融合为一体,具有高效检测的特点,富集后的聚磷菌固定在微流控芯片上,可以重复使用4到5次。甲胺磷农药降解时间相对较短,一般是聚磷菌好氧吸磷1小时,厌氧释磷20分钟,利用钼电极磷酸根选择性电极测磷酸根的电位需要3到5分钟,所以整个有机磷农药的降解与检测控制在1.5小时内,时间短,效率高。
附图说明
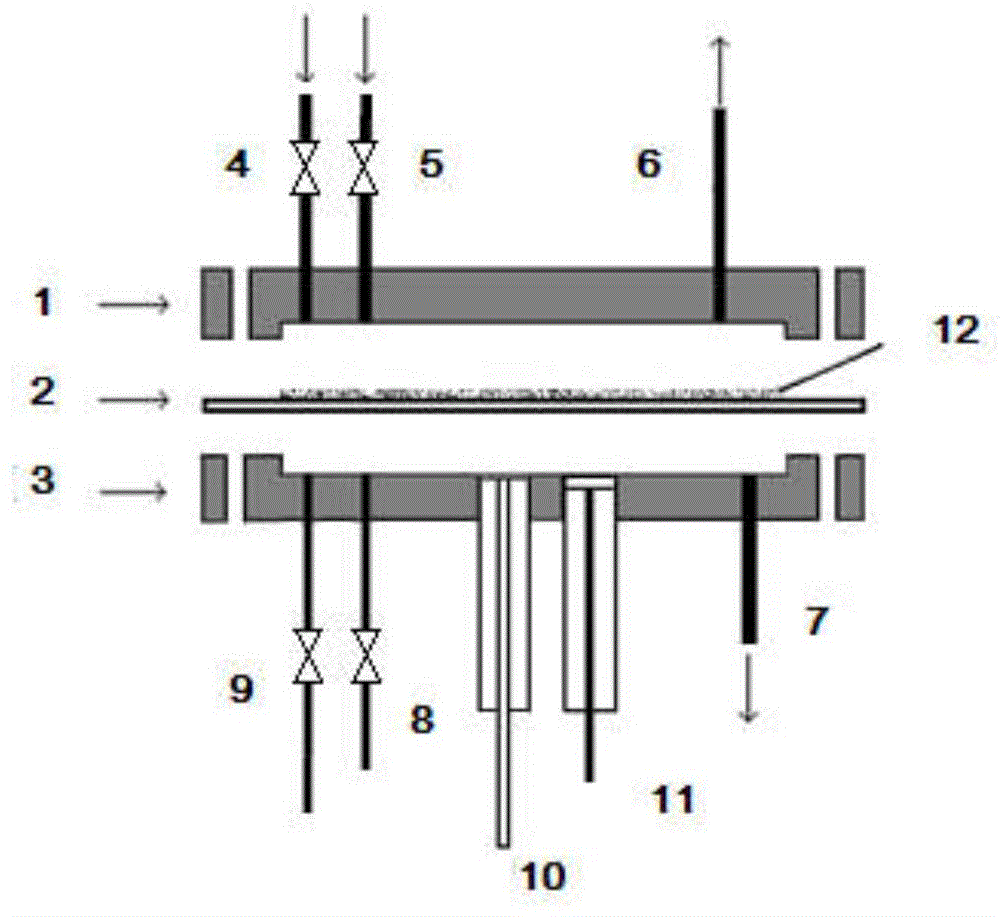
图1、有机磷农药微生物全细胞微型化装置示意图;1、传感器pdms主体上板,2、纳米孔氧化铝膜,3、传感器pdms主体下板,4、聚磷菌培养液进口及控制阀,5、上板氮气进口及控制阀,6、上板废液及氮气出口,7、下板废液及氮气出口,8、下板氮气进口及控制阀,9、离子强度调节液进口及控制阀,10、钼磷酸氢根离子选择性电极,11.ag/agcl参比电极,12.海藻酸钠包埋聚磷菌;
图2、本发明实验技术路线图;
图3、聚磷菌生长曲线图;
图4、光学显微镜下观察的聚磷菌;
图5、多聚磷酸盐的染色,左图为不添加甲胺磷,右图为添加甲胺磷;
图6、磷酸氢根离子选择性钼电极感应图;
图7、乙酸含量(左)、ph(中)、温度(右)对有机磷农药降解的影响图;
图8、不同条件下聚磷菌胞外酶的紫外-可见光谱图;
图9、有机磷与聚磷菌胞外酶混合10min后(上图)以及20min后(下图)紫外可见峰图。
具体实施方式
下面结合附图和具体实例,进一步阐明本发明,应理解这些实例仅用于说明本发明而不用于限制本发明的范围,在阅读了本发明之后,本领域技术人员对本发明的各种等价形式的修改均落于本申请所附权利要求所限定的范围。
实施例1聚磷菌gp44的特性研究以及条件的优化
本实施例包括培养液配方,聚磷菌生长曲线,形状观察,降解最终产物及中间体的紫外光谱,酶的特性研究,传感器各种最佳条件的选择(包括碳源,酸度,温度,溶解氧等),实样测定以及抑制法测定结果的比较等。实验中使用的聚磷菌菌株gp44来源于巢湖和南淝河底泥中分离筛选出,为属肠杆菌科中的克雷伯氏菌属土生克雷伯氏菌(k.terrigena)(一株聚磷菌gp44的筛选、鉴定及其聚磷特性研究土壤,2009,41(5):757-763),由安徽全民环保科技有限公司提供。
1、培养液的配制
含磷培养液:丁二酸钠:8g、硫酸铵:0.5g、磷酸氢二钾:0.25g、七水硫酸镁:0.125g、氯化钠:0.125g、七水硫酸亚铁:0.0025g、四水硫酸锰:0.0025g、去离子水:1l
无磷培养液:丁二酸钠:8g、硫酸铵:0.5g、七水硫酸镁:0.125g、氯化钠:0.125g、七水硫酸亚铁:0.0025g、四水硫酸锰:0.0025g、去离子水:1l
固体培养液:丁二酸钠:8g、硫酸铵:0.5g、磷酸氢二钾:0.25g、七水硫酸镁:0.125g、氯化钠:0.125g、七水硫酸亚铁:0.0025g、四水硫酸锰:0.0025g、去离子水:1l、琼脂:20g
2、聚磷菌gp44生长情况的研究
将聚磷菌gp44菌种培养在配制的含磷培养液中于250ml的三角瓶中,将三角瓶置于条件为温度为21℃,转速为120r/min的摇床上,有氧条件下培养,每隔一小时取出菌液,在600nm处用uv-2450紫外可见分光光度计测吸光度。得出聚磷菌生长期间的稳定期。后续实验所用菌液均处于稳定期。以时间为横坐标,吸光度为纵坐标,得到聚磷菌的生长曲线。该生长曲线参见图3。
3、聚磷菌gp44的形态
使用1000倍的油镜观察聚磷菌gp44有杆状、球状,其中杆状菌较多。为了说明聚磷菌对有机磷农药的降解能力,需要得出一个菌株的吸磷能力。故采用血小球计数法测得1ml菌液里大约含有105个细菌。参见图4。
4、多聚磷酸盐的染色
分别对不添加甲胺磷的处于稳定期菌液和添加0.2mg/l的甲胺磷20min后的菌液进行离心,取出聚磷菌gp44,置于载玻片上,分别滴加5滴dapi染液,染色10min,流水冲去染液,滤纸吸除多余水分,在1000倍的显微镜油镜下观察,得到添加甲胺磷后的细菌体内的颜色较不添加甲胺磷的菌体内颜色深,颜色为绿色。参见图5。
5、磷酸根离子的检测
取9ml处于稳定期的菌液,加入1ml的浓度为2mg/l的甲胺磷水溶液,在好氧条件下培养1hr,然后转移至厌氧条件下放置30min。最后在温度为21℃,转速为9000r/min条件下离心15min,取上清液。实验中采用多种方法测正磷酸盐。
①钼酸铵分光光度法
取5ml上清液定容至30ml。加0.5ml的坑坏血酸,30s后加1ml的钼酸盐溶液,室温下15min后在700nm处测吸光度。
②钼电极-磷酸根离子选择性电极
电极采用钼电极(表面为圆形,r=2.5mm)与参比电极ag/agcl组成。(无磷培养液厌氧后离心)聚磷菌培养液与甲胺磷发生反应后的ph在7.5左右,故测其磷酸氢根离子的含量。每次实验前都必须将钼电极的表面磨光滑,然后做磷酸氢根的标准曲线,最后再测实样。
配置无磷培养液,分别取9ml的无磷培养液,向其加入1ml浓度分别为10-5、10-4、10-3、10-2、10-1mol/l的磷酸氢二钾,得到不同浓度磷酸根的培养液,ph在7到9之间。将参比电极(ag/agcl)与钼电极一起插到溶液中反应1min,后读数。
从实验结果得出,参见图6,钼电极测磷酸氢根的检测范围为10-5-10-1mol/l。
6、聚磷菌降解甲胺磷的影响因素
实验调查了温度、ph、乙酸的量对聚磷菌降解甲胺磷的条件。在聚磷菌与甲胺磷的量一定时,通过改变菌液的温度、ph、乙酸的量测定聚磷菌好氧吸磷厌氧释磷后的磷酸盐的量来找出最佳降解条件,实验结果如下:
①乙酸的量的影响
取五份9ml的含磷培养液,分别加入1ml2mg/l的甲胺磷水溶液。每份溶液里分别加入0、10、20、30、40μl乙酸,在20℃下好氧1hr后9000r/min离心5min。向溶液中加入4ml的50g/l的过硫酸钾,在120℃下消解30min后冷却至室温,定容到30ml。加0.5ml的抗坏血酸,30s后加1ml的钼酸盐溶液,室温下15min后在700nm处测吸光度。
参见图7,通过实验分析得出当加入乙酸的量为20μl时会提高聚磷菌降解甲胺磷的量,乙酸的量大于20μl后,对降解的效率不会有明显的提高。
②ph的影响
取七份9ml的含磷培养液,分别加入1ml2mg/l的甲胺磷水溶液。将每份溶液的ph分别调为6.8、7.0、7.2、7.5、8.0、8.4、8.8,在20℃下好氧1hr后9000r/min离心5min。向溶液中加入4ml的50g/l的过硫酸钾,在120℃下消解30min后冷却至室温,定容到30ml。加0.5ml的坑坏血酸,30s后加1ml的钼酸盐溶液,室温下15min后在700nm处测吸光度。
参见图7,实验结果表明聚磷菌降解甲胺磷时的ph为7.2时,降解效率最高,这与聚磷菌培养液的ph一致。
③温度的影响
取三份9ml的含磷培养液,分别加入1ml2mg/l的甲胺磷水溶液。分别在15、20、25℃下好氧培养1hr后,于9000r/min离心5min。向溶液中加入4ml的50g/l的过硫酸钾,在120℃下消解30min后冷却至室温,定容到30ml。加0.5ml的坑坏血酸,30s后加1ml的钼酸盐溶液,室温下15min后在700nm处测吸光度。
参见图7,实验结果表明聚磷菌在20℃下降解甲胺磷的效率最高,这与聚磷菌培养时的温度21℃很相近。
综上所得,聚磷菌gp44降解甲胺磷的最佳条件是:温度20℃、ph为7.2、乙酸的量为20μl(总体积是10ml)。
7、酶的紫外可见吸收光谱
微生物在降解有机磷农药的原理是聚磷菌产生的酶对有机磷农药起降解反应,实验中制备了4种样品,分别是无磷培养液(对照组)、900μl聚磷菌含磷培养液与100μl甲胺磷的混合0min后、900μl聚磷菌含磷培养液与100μl甲胺磷的混合20min后、20ml聚磷菌含磷培养液。将这4份溶液分别用紫外可见分光光度计测其光谱,图8是4种溶液的光谱图。
通过图8可以得出在270nm左右处有峰,可以推断聚磷菌微生物产生的酶释放到细菌体外,且胞外酶浓度随降解反应时间而降低。
8、酶的活性
取5ml浓度分别为0.025、0.25、2.5mmol/l的对硝基苯磷酸二钠作为底物加到玻璃瓶中,加入1ml浓度为100mmol/l的tris缓冲液,最终体系ph为8.4,在不同的玻璃瓶中加入购买的碱性磷酸酶(阿拉丁公司购买)和聚磷菌中提取的包外酶,反应6小时,分别在1小时、3小时、6小时后在410nm处测吸光度。
通过计算得出碱性磷酸酶活性的最大反应速率vmax=2.518×10-4μmol.ml-1.min-1,米氏常数km=39.1μmol/l。根据公式michaelis-menten方程v=2.518×10-4(s)/(0.039+(s),其中(s)是底物对硝基苯磷酸二钠的浓度。
9、甲胺磷降解中间产物的研究
取两份9ml的含磷培养液,分别加入1ml0.125mg/l的甲胺磷水溶液。在20℃下好氧培养,一份是培养10min,一份是培养20min培养后两者皆于9000r/min离心15min。取上清液。将上清液通过0.45-μm滤头过滤,将其保存。将上清液用液相色谱测量,条件为条件为流动相水:甲醇=98:2,流速为0.7ml/min,进样量为10μl,柱温为25℃。
通过测定好氧条件下不同时间下甲胺磷的含量,发现液相色谱图(参见图9)上出现未知峰,峰的位置在甲胺磷峰前方,表明未知物比甲胺磷更亲水,随着时间的延长,这个峰在20min后消失,推测被聚磷菌吸收到体内。
10、聚磷菌的重复利用
取20ml的聚磷菌培养液于离心机中9000r/min离心30min。去掉上清液,加入300μl的无磷培养液和34μl的0.1mg/l的甲胺磷水溶液,好氧1hr。然后通入氮气2min,无氧培养30min。10000r/min离心取出上清液,标记为第一次。在离心后的细菌沉淀中加入300μl的无磷培养液和34μl的0.1mg/l的甲胺磷水溶液,好氧1小时。然后通入氮气2min,无氧培养30min。10000r/min离心取出上清液,标记为第二次。重复上述过程至第六次。用事先校准过的钼电极测6次上清液的电位。具体数据如表1:
表1聚磷菌的重复利用特性
在第六次离心后的聚磷菌中加入20ml的含磷培养液中,培养24hr,然后于离心机中9000r/min离心30min。去掉上清液,加入300μl的无磷培养液和34μl的0.1mg/l的甲胺磷水溶液,好氧1hr。用事先校准过的钼电极测上清液的电位。最终上清液中电位是116mv。
11、微生物法结合钼磷酸根离子选择性电极检测和吸光度检测法结果比较
为验证离子选择性电极检测法,在体外,按如下样品准备过程后,分别利用两种检测法测定结果。详细测定步骤如下:2份9ml的聚磷菌含磷培养液,9000r/min离心15min。去掉上清液,每份加入9ml的无磷培养液。然后在2份中加入1ml的实样。加标实验过程如下:分别加入0.9ml的实样与100μl浓度为0.2mg/l的甲胺磷溶液,好氧培养1hr,然后在每个样品中持续通入n22min,厌氧条件下30min后,10000r/min离心5min后,取上清液,从样品中取5ml,用水定容到30ml。加0.5ml的坑坏血酸,30s后加1ml的钼酸盐溶液,室温下15min后在700nm处测吸光度。另从另一份上清液中各取2ml,将钼电极与参比电极插入溶液中,3min后读取数据。
通过两种方法分别对湖水和桃子表皮的有机磷农药进行测量,通过钼电极法得出湖水中的有机磷浓度在检测限以下,桃子表皮样品有机磷浓度为0.0348mg/l;通过钼酸盐分光光度法测得湖水中的有机磷含量为0.01mg/l,桃子表皮样上有机磷的浓度为0.0219mg/l。两种方法所测出的结果大致在同一个数量级,说明钼磷酸根离子选择性电极可以替代吸光度法用于该微生物传感器的检测。
实施例2微生物固定化条件下有机磷降解
1、聚磷菌gp44的培养:聚磷菌gp44在含磷培养液中培养获得稳定期的菌体混合液;
2、微生物的固定化(聚磷菌的包埋):
将0.4g海藻酸钠加热溶于水后冷却,将海藻酸钠溶液与实施例1培养的2ml稳定生长的聚磷菌gp44细胞混合均匀,使海藻酸钠最终浓度为4%。将海藻酸钠与菌体混合液用针形滴管滴入到4%的cacl2溶液中,固定化8h。滤出颗粒,颗粒大小为2-3mm的均匀小球,用生理盐水洗净,备用。聚磷菌小球平铺在多孔氧化铝载体膜上获得包埋后的聚磷菌,聚磷菌的个数约为7.77×104个/珠。
3、有机磷的降解及钼酸铵分光光度法检测:将包埋后的聚磷菌加入1ml2mg/l甲胺磷水溶液和20μl乙酸得到混合液,ph为7.2,在20℃下好氧1hr后9000r/min离心5min。向溶液中加入4ml的50g/l的过硫酸钾,在120℃下消解30min后冷却至室温,定容到30ml。加0.5ml的抗坏血酸,30s后加1ml的钼酸盐溶液,室温下15min后在700nm处测吸光度。
对聚磷菌包埋前后对测定桃子表皮有机磷的结果为0.0219mg/l(包埋)0.0251mg/l(未包埋),两种检测方法得出的结果不存在显著性差异。这说明采用海藻酸钠为包埋固定剂包埋后的聚磷菌仍可以正常释放胞外酶。
实施例3有机磷农药微生物全细胞微型化装置
1、装置构成
装置构成如图1。装置主体采用pdms上板浇筑体1和pdms上下板浇筑体3,上下腔体容积为100μl。图1中磷酸氢根离子选择性钼电极10和ag/agcl参比电极11密封插入到pdms下板腔体。聚磷菌培养液进口4和电位检测离子强度调节剂进口9通过用300μm打孔器打孔后,密封插入ptfe微管形成。上板氮气进口5和下板氮气进口8也利用300μm打孔器打孔,密封插入ptfe微管形成。上板废液及氮气出口6和下板废液及氮气出口7也是由300μm打孔器打孔,密封插入ptfe微管形成。pdms上下板间配置多孔氧化铝支持膜2,膜上涂有海藻酸钠包埋聚磷菌12(厚约0.5-1mm)。
2、聚二甲基硅氧烷(pdms)微型化芯片的制作
ⅰ)利用coredraw画图软件,画出图1的芯片结构,并打印在菲林(委托制版公司)上,做光刻掩膜;
ⅱ)配胶:打开天平称胶。pdmsa胶:b胶=10:1。a胶与b胶的比越大配出来的胶越软;
ⅲ)匀胶:打开真空脱泡搅拌机,放入称好的胶,抽真空将胶搅拌混合;
ⅳ)锡纸铺平于皿内,放入硅片模具,将硅片轻轻压实后倒胶,务必使硅片上的胶无气泡;
ⅴ)干燥:80℃恒温干燥箱内干燥约60min;
ⅵ)剥胶:稍冷却后撕下锡纸,将固化后的pdms与硅片分离,小心揭下pdms,注意不要损坏硅片;
ⅶ)切割:用切割刀沿着芯片外框小心切割,注意切割整齐;
ⅷ)打孔:用打孔器打孔,制作溶液、氮气进出口、插入电极口以及废液废气进出口;
ⅸ)组装(见下面组装顺序)
3、组装顺序
在多孔氧化铝板上浇注已培养好的100μl实施例2最佳制备的海藻酸钠-聚磷菌胶体(聚磷菌要处在其生长曲线的稳定期),再利用夹具将pdms上下板(如图1形式)固定。
4、工作原理及流程
本微生物传感器利用停流技术来完成对有机磷的降解、吸磷、释磷以及检测,具体步骤为:
ⅰ)打开聚磷菌培养液进口4的阀门注入有机磷样品(ph7.2)100μl,使样品中的有机磷降解形成正磷酸根,并被聚磷菌吸入到细胞内(此时下腔体无液体溶液)。
ⅱ)等待30min后,打开上板氮气进口5的阀门注入氮气,将有机磷样品从上板废液及氮气出口6排净,关闭上板氮气进口5的阀门。
ⅲ)打开下板电位检测用离子强度调节剂进口9的阀门注入电位检测用离子强度调节剂(脱氧、氮气饱和溶液),注满下腔体,使聚磷菌释磷(此时,上腔体无溶液,氮气氛围),等待30min。
ⅳ)立即读出电极电位,并此值代入到通过同上方法已得到的标准曲线线性方程中,计算出有机磷浓度。
实施例4微型化装置的应用
1、样品准备
本实验共准备四个实样,分别是扬州大学扬子津校区朗月湖水,采集后先用定性滤纸过滤,再用0.45-μm的滤头过滤。朗月湖旁草坪上采摘67.3573g的草,用300ml的氯化钠洗脱20min后经0.45-μm注射器滤头过滤。桃子和西红柿用150ml的氯化钠洗脱20min后经0.45-μm注射器滤头过滤。以上两种样品贴标签置于冰箱冷藏保存。
2、实样测定
ⅰ)乙酰胆碱酶抑制法
称取一定量的甲胺磷,配制成浓度分别为2mg/l、1mg/l、0.2mg/l、0.02mg/l、0.002mg/l的甲胺磷水溶液。乙酰胆碱试剂盒购买于南京百思一基生物公司。实验中所用到的乙酰胆碱、乙酰胆碱酶、显色液、抑制剂、透明剂均在试剂盒中,用时参照试剂盒说明书。具体过程是1ml的甲胺磷和0.5ml的乙酰胆碱、0.5ml的显色液以及0.1ml的乙酰胆碱酶混合在一起,用ph计每隔30s读一次数,测定时间为6min,测定次数为12次。反应结束后立即加入30μl的抑制剂和100μl的透明剂,常温下静置15min,然后在412nm处测吸光度。
ⅱ)本发明的有机磷农药微生物全细胞微型化装置检测方法
将实施例3制备的有机磷农药微生物全细胞微型化装置进行以下实验。称取一定量的甲胺磷,配制成浓度分别为2mg/l、1mg/l、0.2mg/l、0.02mg/l、0.002mg/l的甲胺磷水溶液。按实施例3工作流程进行如下分析过程。打开聚磷菌培养液进口4的阀门依次流动注入上述有机磷标准品(ph7.2),与包埋的聚磷菌接触;关闭阀门。等待30min后打开上板氮气进口5的阀门注入氮气将有机磷样品从上板废液及氮气出口6排净,关闭上板氮气进口5的阀门。打开下板电位检测用离子强度调节剂进口9的阀门注入电位检测用离子强度调节剂,注满下腔体后关闭阀门,等待30min后,读出磷酸根离子选择性电极电位。重复以上步骤,利用已知浓度的有机磷标准样品,建立标准曲线并以此计算出样品中的有机磷浓度。
3、为验证本装置得出的有机磷测定结果,与酶抑制法进行了比较,测定结果如表2。通过对两种不同的实样测定,发现两种分析方法在加标样品的结果大体上一致,说明本方法可以替代乙酰胆碱酶抑制法用于农产品有机磷残留测定。未加标的西红柿及桃子样品测定结果表明聚磷菌法的灵明度显然优于乙酰胆碱酶抑制法,其原因主要有聚磷菌法自身具有对磷酸根的富集特性,其富集倍数与微型化检测池体积有关系。
表2实样测定结果
4、本发明聚磷菌全细胞传感器法分析特性
本发明聚磷菌全细胞传感器法检测线性范围为0.002mg/l~2mg/l(r=0.998),检测极限浓度为0.0002mg/l。
聚磷菌的重复利用特性如表1,聚磷菌可以重复利用3次。重复利用3次后的聚磷菌经再次培养24hr还可以重复利用3次。实样测定方法重现性如表3。
乙酰胆碱酶抑制法的重复利用性因为酶容易失效,往往用于一次性测定,很难重复利用,而本专利方法可以多次利用,替代价格昂贵的酶采用廉价的聚磷菌,成本低。本方法样品不需要前处理(只需粗略过滤),体现了全细胞微生物传感器的优点特点。所需分析时间,经粗略优化,现阶段约需1小时(包括解磷、吸磷、释磷)(聚磷菌的提前培养除外),有望应用到现场检测。
表3实样测试重现性(聚磷菌微生物传感器法)
- 还没有人留言评论。精彩留言会获得点赞!