管腔脏器模型单元以及管腔脏器模型单元的制造方法与流程
本发明涉及在对管腔脏器的治疗的训练等中使用的管腔脏器模型单元以及管腔脏器模型单元的制造方法。
背景技术:
以往,已知对血管等管腔脏器中产生的病变部从管腔内进行治疗。例如,近年来,为了防止脑动脉瘤的破裂于未然,不进行开颅手术而进行阻碍血液从血管内流入脑动脉瘤内的治疗的情况正在增加。作为从血管内进行的治疗之一的线圈栓塞术,向大腿动脉插入导管,从血管内接近病变部,通过导管向脑动脉瘤内留置铂制的线圈。由此,能够阻碍血液向脑动脉瘤内的流入,防止破裂于未然。
在进行血管内治疗的情况下,如果医师的熟练度低,则在到达病变部之前,有可能使导线以及导管与血管壁抵接而损伤血管。另外,在进行线圈栓塞术的情况下,如果医师的熟练度低,则有时在瘤内线圈偏置地留置、颈部的血流不会被充分地阻碍,从而无法充分得到治疗的效果。通常,为了提高医师的熟练度,考虑积累实际的患者治疗的经验,但也已知有使用模拟再现血管的血管模型来进行训练。
作为在医师的训练中使用的血管模型,例如在专利文献1中提出了具有模拟血管流路的导管模拟器。在专利文献1的导管模拟器中,在由pva(聚乙烯醇)的水性凝胶构成的薄板上形成有模拟血管的模拟血管流路。
现有技术文献
专利文献
专利文献1:日本特开2014-92683号公报
技术实现要素:
发明要解决的课题
不仅在上述那样的医师的训练中,而且在用于新的与血管内治疗相关的治疗方法或医疗设备的开发时的安全性或有效性评价的实验中,也有效地使用血管模型。这样,在使用血管模型进行训练或者实验的情况下,优选能够对医师的熟练度或治疗的效果定量化地进行评价。
因此,本发明是鉴于上述现有技术中的课题而完成的,其目的在于,提供一种能够使医师的熟练度或治疗的效果定量化的管腔脏器模型单元以及管腔脏器模型单元的制造方法。
用于解决课题的技术方案
本发明的管腔脏器模型单元具备:基座,具有凹部;管腔脏器模型,配置于凹部;填充材料,填充于凹部;以及传感器,进行与管腔脏器模型相关的测量。
另外,本发明的管腔脏器模型单元的制造方法包括:层叠聚乙烯醇和牺牲材料,形成管腔脏器模型和基座的步骤;在层叠聚乙烯醇和牺牲材料的中途对传感器进行定位的步骤;去除牺牲材料的步骤;以及在去除牺牲材料而形成的凹部中填充填充材料的步骤。
发明效果
如上所述,根据本发明,通过具备进行与管腔脏器模型相关的测量的传感器,能够对使用了管腔脏器模型单元的医师的熟练度或治疗的效果定量化地进行评价。
附图说明
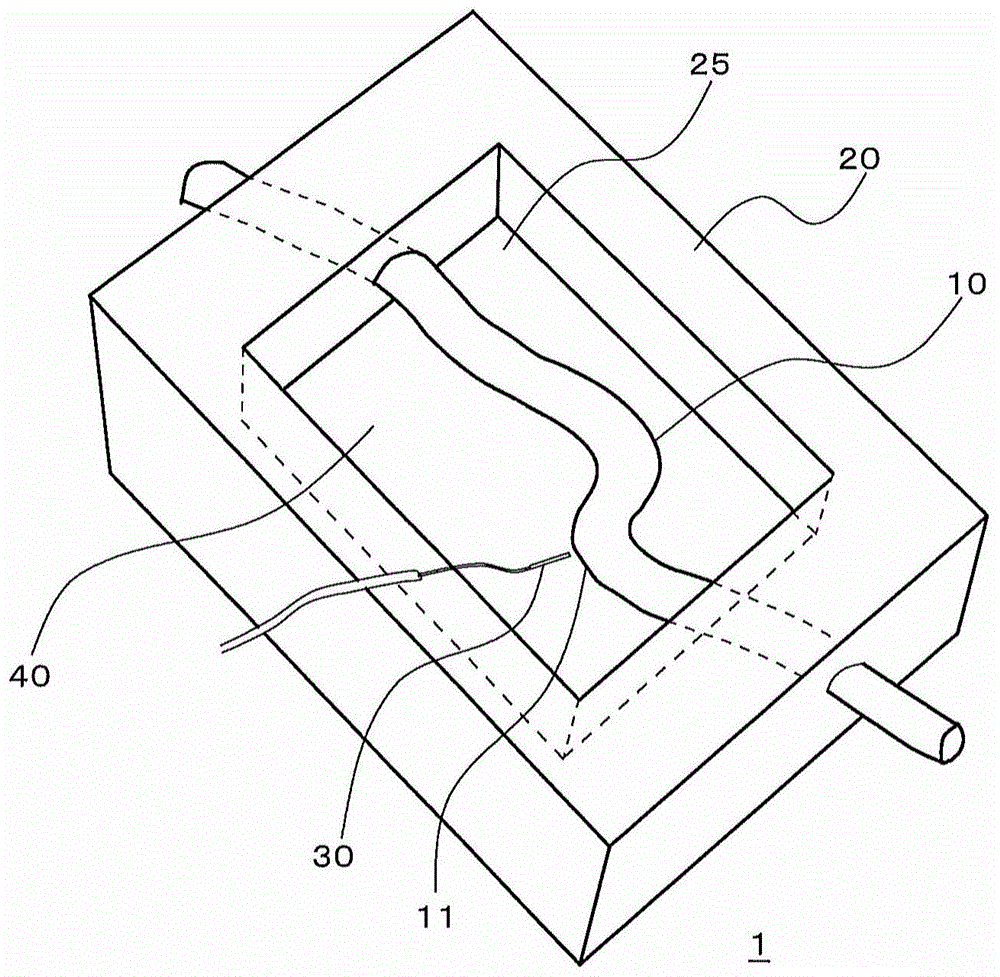
图1是实施方式1中的血管模型单元的立体图。
图2是实施方式1中的血管模型单元的剖视示意图。
图3是实施方式1中的位移传感器的立体图。
图4是位移传感器的第1配线侧的端面图。
图5是位移传感器的第2配线侧的端面图。
图6是说明实施方式1中的位移传感器的制造方法的图。
图7是说明实施方式1中的位移传感器的制造方法的图。
图8是说明基于位移传感器的血管模型的测量位置的图。
图9是使用了实施方式1的血管模型单元的测量系统的概略结构图。
图10(a)是导管未被插入血管模型的状态下的位移传感器的测量结果的一例,(b)是血管模型的弯曲部的内壁被导管按压的状态下的位移传感器的测量结果的一例。
图11表示具备多个位移传感器的血管模型单元的变形例的图。
图12表示具备多个位移传感器的血管模型单元的变形例的图。
图13是表示实施方式1中的血管模型单元的制造方法的流程的剖视示意图。
图14是表示实施方式1的变形例中的血管模型单元的制造方法的流程的剖视示意图。
图15是表示实施方式1的另一变形例中的血管模型单元的制造方法的流程的剖视示意图。
图16是实施方式2的血管模型单元的剖视示意图。
图17是放大了实施方式2的血管模型的瘤状部的周边的剖视示意图。
图18是表示实施方式2中的压力传感器的结构的图。
图19是使用了实施方式2的血管模型单元的测量系统的概略结构图。
图20是表示第1压力传感器的测量结果的一例的图。
图21是表示第2压力传感器的测量结果的一例的图。
图22是表示实施方式2中的血管模型单元的制造方法的流程的剖视示意图。
图23是表示实施方式2的变形例中的血管模型单元的制造方法的流程的剖视示意图。
图24是实施方式3中的血管模型单元的立体图。
图25是实施方式4中的血管模型单元的立体图。
具体实施方式
以下,对本发明的实施方式所涉及的管腔脏器模型单元以及管腔脏器模型单元的生成方法进行说明。在以下的实施方式中,作为管腔脏器的一例,对模拟再现血管的血管模型单元以及血管模型单元的制造方法进行说明。
实施方式1
图1是实施方式1中的血管模型单元1的立体图,图2是实施方式1中的血管模型单元1的剖视示意图。如图1以及图2所示,血管模型单元1具有长方体形状,具备血管模型10、基座20以及位移传感器30。另外,在基座20上形成有凹部25,在凹部25中填充有填充材料40。
血管模型10是模拟地再现血管的构件。在本实施方式中,为了再现颈动脉以及大脑动脉,血管模型10的形状以及壁厚与颈动脉以及大脑动脉相同。另外,本实施方式的血管模型10由pva(聚乙烯醇)的水性凝胶构成。通过由pva构成血管模型10,能够再现血管内壁的摩擦、血管壁的硬度以及血管的形状。另外,血管模型10的pva的浓度为10~20wt%,优选为17wt%。而且,如图1所示,血管模型10具有用于再现血管的弯部的弯曲部11。
基座20支承血管模型10以及位移传感器30,具有长方体形状。与血管模型10相同,基座20由浓度为10~20wt%、优选为17wt%的pva构成。在基座20的中央形成有长方体形状的凹部25,在凹部25内填充有填充材料40。填充材料40再现血管的周围组织,是水或pva。在使用pva作为填充材料40的情况下,使用比血管模型10柔软的、例如浓度为2~10wt%、优选为5wt%的pva。如图1以及图2所示,血管模型10的弯曲部11以及位移传感器30在凹部25内配置于填充材料40中。
位移传感器30测量血管模型10的位移。在本实施方式中,使用超声波传感器作为位移传感器30。图3是本实施方式中的位移传感器30的立体图。如图3所示,位移传感器30由传感器部310和配线部320构成。传感器部310具备超声波振子311、覆盖超声波振子311的第1电极312及第2电极313、和背衬314。
超声波振子311发送超声波,接收其反射波,例如是具有比pzt(锆钛酸铅)高的机电耦合的pmt-pt(镁铌酸·钛酸铅)的压电单晶。超声波振子311的厚度约为96μm,宽度w约为1.0mm,长度l约为0.5mm。
第1电极312及第2电极313是以cr(铬)为基底而在其上形成有au(金)的au/cr电极,以覆盖超声波振子311的前后的方式配置。背衬314是使超声波振子311的不需要的振动衰减,缩短超声波的脉冲宽度的减振材料,由将环氧树脂和钨粉末混合而成的材料构成。背衬314的厚度t为比超声波的波长长约1.3mm。
配线部320具备膜321、形成在膜321上的第1电极焊盘322及第1配线323、以及第2电极焊盘324及第2配线325。另外,配线部320具备将第1配线323与第1电极312连接的第1导电材料326、将第2配线325与第2电极313连接的第2导电材料327、以及配置在第1电极312与第2电极313之间,将第1电极312与第2电极313绝缘的绝缘材料328。另外,在第1电极焊盘322及第2电极焊盘324上分别锡焊有未图示的同轴电缆。
膜321为聚酰亚胺膜,厚度约为25μm,长度约为30mm。位移传感器30通过使用具有柔软性的聚酰亚胺膜,位移传感器30的定位变得容易。第1电极焊盘322、第1配线323、第2电极焊盘324以及第2配线325是形成在膜321上的铜箔。第1导电材料326和第2导电材料327由导电性的环氧树脂构成,绝缘材料328由绝缘性的环氧树脂构成。此外,上述的位移传感器30的各部分的材质以及尺寸是一例,并不限定于此。另外,图3的位移传感器30构成为使超声波振子311在前后方向上振动,从前面发送超声波,但并不限定于此。例如,也可以构成为使超声波振子311在上下方向上振动,从上表面发送超声波。
图4是位移传感器30的第1配线323侧的端面图,图5是位移传感器30的第2配线325侧的端面图。如图4所示,第1电极312从超声波振子311的前表面延伸到背衬314的底面,经由第1导电材料326与第1配线323以及第1电极焊盘322连接。另外,如图5所示,第2电极313从超声波振子311的后表面延伸到背衬314的上表面,经由第2导电材料327与第2配线325和第2电极焊盘324连接。
图6和图7是说明本实施方式中的位移传感器30的制造方法的图。如图6所示,首先,在连续形成有多个第1电极焊盘322、第1配线323、第2电极焊盘324以及第2配线325的膜321上粘贴长条的超声波振子311、第1电极312、第2电极313、背衬314、第1导电材料326以及绝缘材料328。而且,如图7所示,在将第2导电材料327分别粘接于第2配线325之后,切出长条状而形成一个位移传感器30。通过这样制造位移传感器30,制造效率提高。
通常,在将导管插入血管内时,在熟练度低的医师的情况下,在血管的弯部等弯曲部,有时会将导管碰撞到血管壁。因此,本实施方式的位移传感器30测量血管模型10的弯曲部11的位移。图8是说明位移传感器30对血管模型10的测量位置的图。如图8所示,位移传感器30在血管模型10的弯曲部11的外侧与弯曲部11分离地配置。弯曲部11与位移传感器30中的超声波振子311的距离例如为1mm~15mm。这样,通过使用超声波传感器作为位移传感器30,能够将位移传感器30与血管模型10分离地配置。由此,与在血管模型10上粘贴接触式的位移传感器的情况相比,能够不对血管模型10的物性造成影响地测量位移。另外,位移传感器30被配置成,弯曲部11的第1外壁11a和与传感器部310的前端面垂直的面形成的角度α为90度。由此,反射强度变大,能够准确地测量反射回波。
位移传感器30相对于弯曲部11发送超声波,接收来自弯曲部11的第1外壁11a、第1内壁11b、第2内壁11c以及第2外壁11d的反射回波。然后,基于接收到的反射回波,能够算出位移传感器30与第1外壁11a、第1内壁11b、第2内壁11c以及第2外壁11d的距离。
图9是使用了本实施方式的血管模型单元1的测量系统100的概略结构图。如图9所示,测量系统100具备:血管模型单元1;与血管模型单元1的血管模型10的入口侧连接的插入配管201;与血管模型10的出口侧连接的第1配管202;储存在血管模型10内循环的水的储水部203;以及连接储水部203和插入配管201的第2配管204。在此,通过将插入配管201的长度设为设想了导管200从腿的根部的大腿动脉插入的情况的长度,能够再现操作性。另外,测量系统100具备:控制在血管模型10内流动的水的流量的泵205;测量血管模型10的入口侧的水压的入口传感器206;测量血管模型10的出口侧的水压的出口传感器207;与位移传感器30连接,进行超声波的发送和接收的脉冲接收器301;以及显示测量结果的示波器302。
在进行测量系统100中的测量时,通过泵205,使储水部203的水按照第2配管204、插入配管201、血管模型10以及第1配管202的顺序循环。此时的水压基于入口传感器206及出口传感器207的测量结果而被控制成与血压大致相同。需要说明的是,为了将由pva构成的血管模型单元1保持为冷却的状态,可以在低温环境下进行测量,或者使循环的水的温度为低温。然后,由位移传感器30测量从插入配管201的端部插入的导管200通过血管模型10内时的位移。
图10(a)是在血管模型10中未插入导管200的状态下的位移传感器30的测量结果的一例,图10(b)是血管模型10的弯曲部11的内壁被导管200按压的状态下的位移传感器30的测量结果的一例。如图10(a)和图10(b)所示,通过来自弯曲部11的第1外壁11a和第1内壁11b的反射回波变化,可知弯曲部11产生了位移。另外,能够使用位移后的变化时间δt,从下式(1)求出血管模型10的位移量δl。
δl=(δt×c)/2···(1)
此外,式(1)的“c”是水中的声速,设为约1500m/s。
例如,在相对于位移前的信号的位移后的变化时间δt为0.114μs的情况下,可知血管模型10的位移量δl为0.086mm。
这样,通过测量血管模型10的位移,不仅能够将医师的感觉还能够将实际施加于血管的负荷作为位移量进行定量化。由此,能够客观地确认医师的熟练度的评价或治疗的效果。例如,在位移量比规定的基准值大的情况下,作为医师的熟练度低,能够进一步继续训练。另外,通过使用血管模型10进行手术前的模拟,实际测量施加于血管的负荷,能够客观地提出安全性更高的治疗法。
另外,血管模型单元1也可以具备多个位移传感器30。图11以及图12是表示具备多个位移传感器30的血管模型单元1的变形例的图。例如,如图11所示,也可以在多个弯曲部11分别设置位移传感器30。或者,也可以在弯曲部11的凹侧或弯曲部11以外的部位设置位移传感器30,测量各部的位移。另外,如图12所示,也可以在血管模型10的周向上设置多个位移传感器30。通过这样构成,能够测量导管200在血管模型10内碰撞的方向等。特别是在血管模型10中,通过在认为重要之处设置多个位移传感器30,能够详细地掌握血管模型10如何位移。
接着,对本实施方式的血管模型单元1的制造方法进行说明。图13是表示本实施方式中的血管模型单元1的制造方法的流程的剖视示意图。本实施方式的血管模型单元1使用3d打印机,通过层叠成为血管模型10以及基座20的材料的浓度约17wt%的pva和牺牲材料4来制造。作为牺牲材料4,可使用蜡、柠檬烯、聚乙二醇(peg)或溶于水的pva等。
首先,在箱形状的型箱3中层叠pva(s1),在其之上层叠牺牲材料4作为用于形成血管模型10的框架(s2)。另外,pva在排出时被加热以具有流动性,注入到牺牲材料4之间,被牺牲材料4包围,从而变形被阻碍。然后,在血管模型10的测量位置配置位移传感器30(s3)。此时,如图13所示,通过由牺牲材料4限制位移传感器30的前端面的位置,位移传感器30的定位变得容易。详细而言,通过将位移传感器30的前端面与牺牲材料4抵接地配置,能够将位移传感器30与血管模型10的距离以及位移传感器30的角度设为规定的距离及角度。之后,重复进行pva与牺牲材料4的层叠(s4~s7),形成血管模型10。然后,去除牺牲材料4(s8),从型箱3取出基座20(s9)。最后,在通过去除牺牲材料4而形成的凹部25中填充填充材料40(s10)。由此,得到血管模型单元1。
这样,通过使用3d打印机使pva和牺牲材料4层叠,能够容易地制造血管模型单元1。特别是在具备多个位移传感器30的情况下,通过在pva和牺牲材料4的层叠的中途使用牺牲材料4配置位移传感器30,各位移传感器30的定位变得容易。另外,通过使用3d打印机,还能够再现复杂形状的血管及血管的挠曲等。由此,也能够制作再现了患者的血管的血管模型单元1,能够实现定制(tailor-made)医疗。
另外,在图13的例子中,采用了将牺牲材料4全部去除的结构,但并不限定于此。例如,也可以残留用于位移传感器30的定位的牺牲材料作为支承材料6。图14是表示实施方式1的变形例中的血管模型单元1的制造方法的流程的剖视示意图。如图14所示,在血管模型单元1的制造过程中,配置用于支承位移传感器30的支承材料6(s21)。然后,在支承材料6上配置位移传感器30(s22)。支承材料6使用与牺牲材料4不同的材料。例如,支承材料6是浓度约为17wt%的pva。
之后,层叠pva和牺牲材料4,去除牺牲材料4(s23)。此时,如图14所示,支承材料6仍然残留,位移传感器30由支承材料6支承。然后,向凹部25填充填充材料40,完成血管模型单元1(s24)。此外,也可以形成为设置不仅支承位移传感器30还支承血管模型10的支承材料6的结构。即,本变形例的血管模型单元1具备血管模型10、基座20、位移传感器30、填充材料40以及支承血管模型10或者位移传感器30的支承材料6。由此,能够抑制位移传感器30的位置偏移以及由该位置偏移引起的测量误差的产生、或者血管模型10的变形等。
图15是表示实施方式1的另一变形例中的血管模型单元1的制造方法的流程的剖视示意图。在图15中,示出具备从下方支承血管模型10以及位移传感器30的支承材料6的血管模型单元1的制造方法。如图15所示,在层叠于型箱3中的pva之上,层叠作为用于形成血管模型10的框架的牺牲材料4、支承位移传感器30的支承材料6a及支承血管模型10的支承材料6b(s210)。然后,在支承材料6a上配置位移传感器30,在支承材料6b上形成血管模型10(s220)。
之后,层叠pva和牺牲材料4,去除牺牲材料4(s230)。此时,如图15所示,支承材料6a以及6b仍然残留,血管模型10以及位移传感器30被支承材料6a以及6b从下方支承。然后,在凹部25中填充填充材料40,完成血管模型单元1(s240)。
实施方式2
接着,对本发明的实施方式2进行说明。在本实施方式中,在血管模型的形状以及代替位移传感器30而具备压力传感器这一点上,与实施方式1不同。血管模型单元的其他结构与实施方式1相同,标注相同的附图标记。
图16是本实施方式的血管模型单元1a的剖视示意图。本实施方式的血管模型单元1a用于阻碍血液流入脑动脉瘤内的线圈栓塞术的训练或实验等。如图16所示,本实施方式的血管模型单元1a的血管模型10a具有用于再现脑动脉瘤的瘤状部12。瘤状部12是中空的,具有直径约为6mm的球体形状。另外,本实施方式的血管模型单元1a具备用于测量瘤状部12内的压力的第1压力传感器50a以及第2压力传感器50b、分别供第1压力传感器50a以及第2压力传感器50b插入的第1管51a以及第2管51b、以及用于去除存积在瘤状部12内的空气的空气排出用管60。
图17是将血管模型10a的瘤状部12的周边放大了的剖视示意图。如图17所示,第1管51a以及第2管51b被配置成,一方的端部贯穿瘤状部12的壁并向内侧突出。在此,若第1管51a以及第2管51b的突出量大,则在瘤状部12的内部产生紊流,或者与导管200等碰撞。另一方面,在第1管51a以及第2管51b未到达瘤状部12的内壁的情况下,无法通过第1压力传感器50a以及第2压力传感器50b而准确地测量瘤状部12内的压力。因此,考虑到这些情况,第1压力传感器50a和第2压力传感器50b的突出量为0~约0.5mm。第1管51a以及第2管51b是薄壁的聚合物管,在本实施方式中,使用内径约200μm、外径约240μm的聚酰亚胺管。
第1压力传感器50a及第2压力传感器50b分别从第1管51a及第2管51b的另一方的端部插入。并且,在插入有第1压力传感器50a以及第2压力传感器50b的状态下,通过利用热粘合剂52对第1管51a以及第2管51b的另一方的端部进行密封,从而能够固定第1压力传感器50a以及第2压力传感器50b,并且防止来自瘤状部12内的漏水。另外,通过使用热粘合剂52,能够自由地插拔第1压力传感器50a和第2压力传感器50b。另外,在瘤状部12中进行线圈栓塞术的情况下,第1压力传感器50a和第2压力传感器50b配置在线圈难以进入的部位、或者想要可靠地堵塞的部位。
另外,空气排出用管60与第1管51a以及第2管51b同样地,被设置成一方的端部贯穿瘤状部12的壁。空气排出用管60是薄壁的聚合物管,在本实施方式中,使用内径约800μm的聚酰亚胺管。空气排出用管60的另一方的端部由热粘合剂61密封,在需要排出空气的情况下开放。空气排出用管60在瘤状部12以及血管模型10a的其他的部位,只要配置于空气容易积存的部位即可。
本实施方式的第1压力传感器50a和第2压力传感器50b是光纤压力传感器。图18是示出本实施方式中的第1压力传感器50a的构造的图。第2压力传感器50b的结构与第1压力传感器50a相同。如图18所示,第1压力传感器50a由受压部510和光纤部520构成。光纤部520由包层直径125μm、芯直径50μm的缓变折射率多模式(グレーデッドインデックスマルチモード)的光纤521、和形成于光纤521的前端的铬(cr)薄膜的半透半反镜522构成。受压部510是具有直径120μm的圆筒形状的传感器芯片,与光纤部520的端面接合。受压部510具备由于压力而挠曲的隔膜部511、铝(al)的全反射镜512、使全反射镜512平坦化而支承的台面部513、以及间隔部514,构成法布里-珀罗型的干涉仪。此外,为了抑制来自隔膜部511的侧面的负荷,也可以用聚酰亚胺管保护前端部。此外,上述的第1压力传感器50a、第1管51a、第2管51b以及空气排出用管60的材质以及尺寸是一例,并不限定于此。
图19是使用了本实施方式的血管模型单元1a的测量系统100a的概略结构图。如图19所示,本实施方式的测量系统100a具备血管模型单元1a、与实施方式1同样的插入配管201、第1配管202、储水部203、第2配管204、泵205、入口传感器206以及出口传感器207。测量系统100a还具备与第1压力传感器50a及第2压力传感器50b连接的光源501、光纤耦合器502、分光计503和pc等终端装置504。
在进行测量系统100a中的测量时,与实施方式1同样地,通过泵205,使储水部203的水按照第2配管204、插入配管201、血管模型10及第1配管202的顺序循环。此时的水压基于入口传感器206及出口传感器207的测量结果而被控制成与血压大致相同。然后,从插入配管201的端部插入导管200,在血管模型10a的瘤状部12内留置线圈。此时的瘤状部12内的压力由第1压力传感器50a和第2压力传感器50b测量。
具体而言,从光源501向第1压力传感器50a及第2压力传感器50b供给白色光。供给至第1压力传感器50a及第2压力传感器50b的光在半透半反镜522与全反射镜512之间进行多重反射。在此,在第1压力传感器50a以及第2压力传感器50b中,作为受压面的隔膜部511根据来自外部的压力而挠曲,半透半反镜522与全反射镜512之间的距离(腔室长度)发生变化。由此,来自两镜的反射光的光路差发生变化。来自第1压力传感器50a和第2压力传感器50b的反射光通过光纤耦合器502被送到分光计503,通过分光计503光学地检测反射光的光路差的变化。然后,在终端装置504中,算出与分光结果对应的压力,并显示测量结果。
图20是表示第1压力传感器50a的测量结果的一例的图,图21是表示第2压力传感器50b的测量结果的一例的图。图20以及图21的横轴表示在血管模型10a内循环的水的流量,纵轴表示作为第1压力传感器50a以及第2压力传感器50b各自的测量结果的压力值。图20和图21表示瘤状部12未被塞住的状态和由4根线圈塞住的状态的测量结果。如图20以及图21所示可知,在第1压力传感器50a以及第2压力传感器50b这两者中,与瘤状部12未被塞住的状态相比,瘤状部12被塞住的状态存在倾斜度变小的倾向。由此,可以说通过用线圈塞住瘤状部12,脑动脉瘤内的压力的增加相对于在血管模型10a内循环的水的流量增加变得缓慢。一般认为这是因为,线圈起到减振器的作用,通过线圈的根数增加,线圈的作为减振器的影响变大。
另外,从图20和图21可知,即使在将4根线圈作为柱塞的状态下,也不能充分塞住瘤状部12。而且,根据图20和图21的测量结果的不同可知,虽然在配置有第2压力传感器50b的部位具有栓塞效果,但在配置有第1压力传感器50a的部位没有栓塞效果,线圈有可能产生偏置。
这样,在本实施方式中,通过测量再现了动脉瘤的血管模型10a的瘤状部12内的压力,能够对瘤状部12内的状态进行定量化。而且,能够根据瘤状部12内的状态,评价医师的熟练度或栓塞治疗的效果。此外,在上述中,构成为具备两个压力传感器,但压力传感器的数量也可以是一个或三个以上。另外,不仅能够有助于动脉瘤的线圈栓塞术,还能够有助于在动脉瘤的颈部载置支架的治疗、或者脑动静脉畸形(avm)的栓塞治疗等各种医疗设备开发时的安全性或有效性试验。
而且,也可以在血管模型10a的瘤状部12以外的部位设置压力传感器。另外,通过将第1管51a以及第2管51b视为血管,通过第1压力传感器50a以及第2压力传感器50b来测量流入第1管51a以及第2管51b内的水的压力,从而能够模拟从粗的血管向细的血管流动的血液的压力。
接着,对本实施方式的血管模型单元1a的制造方法进行说明。本实施方式的血管模型单元1a与实施方式1同样地,使用3d打印机,通过层叠作为血管模型10a以及基座20的材料的pva和牺牲材料4来制造。
图22是表示本实施方式中的血管模型单元1a的制造方法的流程的剖视示意图。在本实施方式中,血管模型10a以及基座20的制造方法也与实施方式1相同。在图22中,对与实施方式1的不同点即第1压力传感器50a的安装进行说明。首先,在本实施方式中,形成具有孔53的牺牲材料4(s31、s32)。然后,将第1管51a插入孔53(s33)。此时,通过使第1管51a与血管模型10a的内腔的牺牲材料4抵接,能够限制第1管51a的突出量。然后,去除牺牲材料4(s34),向凹部25填充填充材料40,向第1管51a插入第1压力传感器50a(s35)。此外,第2管51b及空气排出用管60也与第1管51a同样地安装。由此,得到血管模型单元1a。
另外,第1压力传感器50a的安装并不限定于图22的例子。图23是表示本实施方式的变形例中的血管模型单元1a的制造方法的流程的剖视示意图。在本变形例中,首先,与实施方式1同样地,通过层叠pva以及牺牲材料4并去除牺牲材料4,从而形成血管模型10a以及基座20,并向凹部25填充填充材料40(s41)。然后,在第1压力传感器50a的安装位置,利用针等形成孔54(s42)。孔54以贯穿填充材料40以及血管模型10a的上壁的方式形成。
然后,将第1管51a插入孔54,利用粘合剂55密封孔54与第1管51a的间隙以防止漏水(s43)。最后,通过将第1压力传感器50a插入第1管51a,得到血管模型单元1a(s44)。例如,在制造血管模型单元1a之后想要追加压力传感器的情况等,能够如本变形例那样地追加。
另外,第1管51a、第2管51b或空气排出用管60不是必须的结构,能够省略。在该情况下,也可以将第1压力传感器50a及第2压力传感器50b直接配置在瘤状部12内。另外,也可以在实施方式1的血管模型单元1设置空气排出用管60。
实施方式3
接着,对本发明的实施方式3进行说明。本实施方式的血管模型单元1b是组合了实施方式1以及实施方式2的结构。图24是本实施方式中的血管模型单元1b的立体图。如图24所示,本实施方式的血管模型单元1b的血管模型10b具有弯曲部11以及瘤状部12。另外,本实施方式的血管模型单元1b具备用于测量弯曲部11的位移的位移传感器30、和用于测量瘤状部12内的压力的第1压力传感器50a及第2压力传感器50b。
血管模型单元1b的其他结构、以及位移传感器30和第1压力传感器50a及第2压力传感器50b的结构与实施方式1以及实施方式2相同。
根据本实施方式,能够测量血管模型单元1b的位移以及内压,能够有助于针对多个治疗的训练及其评价以及医疗设备开发时的安全性或者有效性试验。
实施方式4
接着,对本发明的实施方式4进行说明。本实施方式的血管模型单元1c在基座20的结构上与实施方式1不同。图25是本实施方式中的血管模型单元1c的立体图。如图25所示,本实施方式的血管模型单元1c具备由丙烯酸形成的箱形状的基部20a。在基座20a的内部填充有填充材料40,配置有血管模型10以及位移传感器30。
根据本实施方式,通过基座使用丙烯酸,能够抑制血管模型单元1c的变形。
以上是本发明的实施方式的说明,但本发明并不限定于上述实施方式的结构,在其技术思想的范围内能够进行各种变形或组合。例如,在上述实施方式中,作为管腔脏器,以血管为例进行了说明,但本发明也能够应用于胆管等其他管腔脏器的模型单元。另外,位移传感器30并不限定于超声波传感器,也可以使用光学式传感器等。另外,第1压力传感器50a和第2压力传感器50b并不限定于光纤压力传感器,也可以使用利用了电气特性的压力传感器等。并且,也可以为了测量血管模型10中的弯曲部11以外的任意部分的位移而适当配置任意数量的位移传感器30。另外,也可以将任意数量的压力传感器配置于血管模型10的瘤状部12以外的任意部分且需要确认压力的部分。另外,也可以在血管模型10内的空气积存的部位适当设置任意数量的空气排出用管60。
而且,也可以使用作为超声波传感器的位移传感器30来测量血管模型10内的流量。在该情况下,使包含模仿红血球的粉末在内的流体在血管模型10内循环。然后,基于位移传感器30的测量结果,求出血管模型10内的流体所包含的粉末的速度,能够根据血管模型10的截面积求出流量。另外,在上述例子中,将血管模型10作为测量对象,但不需要将其限定于血管,能够应用于管腔脏器模型,在该情况下,能够将位移传感器30(超声波传感器)用于在管腔脏器模型的内部流动的液体的流量的测量。而且,该粉末也并不限定于模仿红血球。
另外,上述实施方式中的血管模型单元的制造方法是一例,本发明的血管模型单元也可以通过其他方法来制造。
附图标记的说明
1、1a、1b、1c血管模型单元、3型箱、4牺牲材料、6支承材料、10、10a、10b血管模型、11弯曲部、11a第1外壁、11b第1内壁、11c第2内壁、11d第2外壁、12瘤状部、20、20a基座、25凹部、30位移传感器、40填充材料、50a第1压力传感器、50b第2压力传感器、51a第1管、51b第2管、52热粘合剂、53、54孔、55粘合剂、60空气排出用管、61热粘合剂、100、100a测量系统、200导管、201插入配管、202第1配管、203储水部、204第2配管、205泵、206入口传感器、207出口传感器、301脉冲接收器、302示波器、310传感器部、311超声波振子、312第1电极、313第2电极、314背衬、320配线部、321膜、322第1电极焊盘、323第1配线、324第2电极焊盘、325第2配线、326第1导电材料、327第2导电材料、328绝缘材料、501光源、502光纤耦合器、503分光计、504终端装置、510受压部、511隔膜部、512全反射镜、513台面部、514间隔部、520光纤部、521光纤、522半透半反镜。
- 还没有人留言评论。精彩留言会获得点赞!