提高β型钛合金硬度及生物相容性的方法及β型钛合金与流程
本发明涉及合金加工技术领域,具体涉及一种提高β型钛合金硬度及生物相容性的方法。
背景技术:
目前临床上应用最广泛的纯钛由于和自然骨相比具有较大的弹性模量,因而植入人体后将承受更大的应力作用,而骨由于长期不能受到力的刺激而不利于新骨的形成与生长,这种现象称为应力屏蔽效应。为了尽量的避免应力屏蔽效应的发生,生物材料研究者们近年来不断的开发新型的β型钛合金去替代临床上医用的纯钛,因为β型钛合金具有更小的更接近骨的弹性模量,因而能更好的避免应力屏蔽效应的发生。基于上述研究背景,一种新型的β型钛合金ti-nb-sn-zr-mo被开发出来,并受到研究者们的广泛关注。
然而,由于铸造ti-nb-sn-zr-mo钛合金硬度往往较小,在作为关节替代材料植入时会由于耐磨性不好而产生磨屑,引发体内炎症,导致种植体失效脱落。
技术实现要素:
本发明所要解决的问题在于铸造ti-nb-sn-zr-mo钛合金硬度较小,在作为关节替代材料植入时会由于耐磨性不好而产生磨屑,引发体内炎症,导致种植体失效脱落。
本发明是采用以下技术方案解决上述技术问题的:
本发明提供一种提高β型钛合金硬度及生物相容性的方法,包括以下步骤:
(1)将铸造ti-nb-sn-zr-mo钛合金样板放置在真空管式炉中,并通惰性气体保护;
(2)将管式炉的温度升温至730-850℃,保温;
(3)关闭管式炉让钛合金样板随炉冷却至室温;
(4)重新打开管式炉,并通氩气保护,升温至400-480℃并保温;
(5)关闭管式炉,并将钛合金样板取出并置于空气中冷却。
优选的,所述步骤(1)中的惰性气体为氩气、氦气、氖气中的一种。
优选的,所述步骤(2)中管式炉的升温速率为10-20℃/min。
优选的,所述步骤(2)中的保温时间为2h。
优选的,所述步骤(4)中管式炉的升温速率为10-20℃/min。
优选的,所述步骤(4)中的保温时间为8h。
优选的,所述ti-nb-sn-zr-mo钛合金样板的尺寸为100mm×100mm×5mm。
优选的,一种提高β型钛合金硬度及生物相容性的方法,包括以下步骤:
(1)将尺寸为100mm×100mm×5mm的铸造ti-nb-sn-zr-mo钛合金样板放置在真空管式炉中,并通氩气保护;
(2)将管式炉的温度制度设定为以20℃/min的升温速率升至800℃;
(3)在800℃温度时保温2h;
(4)关闭管式炉让钛合金样板随炉冷却至室温;
(5)重新打开管式炉,并通氩气保护,以10℃/min的升温速率升温至420℃,并保温8h;
(6)关闭管式炉,并将钛合金样板快速取出置于空气中冷却。
本发明还提供一种由上述方法处理后的β型钛合金。
本发明的有益效果在于:
(1)铸造ti-nb-sn-zr-mo钛合金由单一的β相组成且晶粒尺寸很大处于微米级,其维氏显微硬度为264±12hv0.02,成骨细胞在其表面培养2h后呈圆球形,成骨细胞在其表面培养7d及14d后碱式磷酸酶(alp)活性相对较低;而热处理后的ti-nb-sn-zr-mo钛合金由α+β两相组成,热处理致使析出的α相以40nm左右的鹅卵石状镶嵌在β相基体中,其维氏硬度增大为478±19hv0.02,成骨细胞在其表面培养2h后呈拉长的扁平状,形成较明显的细胞质厚边,而成骨细胞在其表面培养7d及14d后碱式磷酸酶(alp)活性明显提高;
(2)热处理方法可以使β型ti-nb-sn-zr-mo钛合金表面的硬度提高81%,且能提高成骨细胞的黏附及骨向分化,为开发出性能更加优异的钛基种植体提供了理论依据。
附图说明
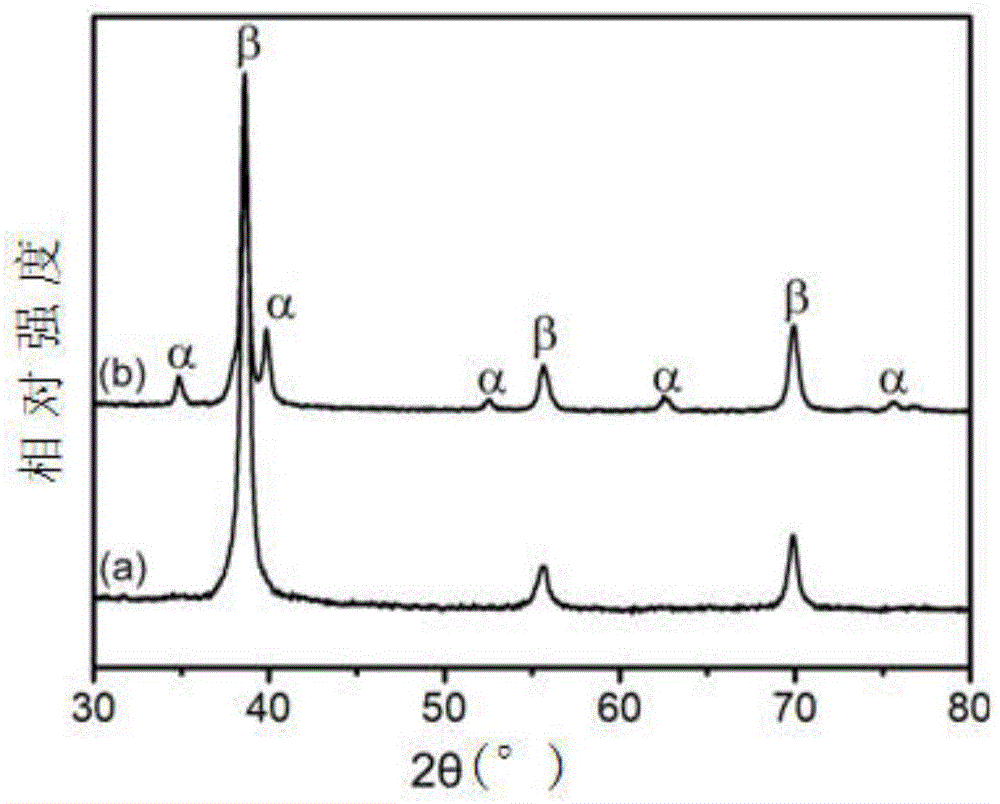
图1为本发明实施例中热处理后(b)和热处理前(a)的ti-nb-sn-zr-mo钛合金的xrd谱线图;
图2为本发明实施例中热处理前的ti-nb-sn-zr-mo钛合金的微观组织结构图;
图3为本发明实施例中热处理后的ti-nb-sn-zr-mo钛合金的微观组织结构图;
图4为本发明实施例中成骨细胞在热处理前的ti-nb-sn-zr-mo钛合金样品表面培养2h后的形态图;
图5为本发明实施例中成骨细胞在热处理后的ti-nb-sn-zr-mo钛合金样品表面培养2h后的形态图;
图6为热处理前后ti-nb-sn-zr-mo钛合金样品表面的成骨细胞在孵化7及14天后胞内的alp活性图。
具体实施方式
以下将结合说明书附图和实施例对本发明做进一步详细说明。
下述实施例中所用的试验材料和试剂等,如无特殊说明,均可从商业途径获得。
对比例1
(1)将尺寸为100mm×100mm×5mm的铸造ti-nb-sn-zr-mo钛合金样板放置在真空管式炉中,并通氩气保护;
(2)将管式炉的温度制度设定为以20℃/min的升温速率升温至800℃;
(3)在800℃温度时保温2h;
(4)关闭管式炉让钛合金样板随炉冷却至室温。
测试:将热处理前后的两种钛合金样板(铸造板;铸造板+热处理)经100#,400#,800#,2500#砂纸打磨抛光至镜面并切割为1mm×1mm×5mm的小方块作为样品进行显微硬度测试;将小方块样品经紫外光照后置于24孔细胞培养板中进行成骨细胞共培养实验。
对比例2
(1)将尺寸为100mm×100mm×5mm的铸造ti-nb-sn-zr-mo钛合金样板放置在真空管式炉中,并通氩气保护;
(2)将管式炉的温度制度设定为以20℃/min的升温速率升温至800℃;
(3)在800℃温度时保温2h;
(4)关闭管式炉让钛合金样板随炉冷却至室温;
(5)重新打开管式炉,并通氩气保护,以10℃/min的升温速率升温至270℃,并保温8h;
(6)关闭管式炉,并将钛合金样板快速取出置于空气中冷却。
测试:将热处理前后的两种钛合金样板(铸造板;铸造板+热处理)经100#,400#,800#,2500#砂纸打磨抛光至镜面并切割为1mm×1mm×5mm的小方块作为样品进行显微硬度测试;将小方块样品经紫外光照后置于24孔细胞培养板中进行成骨细胞共培养实验。
对比例3
(1)将尺寸为100mm×100mm×5mm的铸造ti-nb-sn-zr-mo钛合金样板放置在真空管式炉中,并通氩气保护;
(2)将管式炉的温度制度设定为以20℃/min的升温速率升温至800℃;
(3)在800℃温度时保温2h;
(4)关闭管式炉让钛合金样板随炉冷却至室温;
(5)重新打开管式炉,并通氩气保护,以10℃/min的升温速率升温至570℃,并保温8h;
(6)关闭管式炉,并将钛合金样板快速取出置于空气中冷却。
测试:将热处理前后的两种钛合金样板(铸造板;铸造板+热处理)经100#,400#,800#,2500#砂纸打磨抛光至镜面并切割为1mm×1mm×5mm的小方块作为样品进行显微硬度测试;将小方块样品经紫外光照后置于24孔细胞培养板中进行成骨细胞共培养实验。
实施例1
(1)将尺寸为100mm×100mm×5mm的铸造ti-nb-sn-zr-mo钛合金样板放置在真空管式炉中,并通氩气保护;
(2)将管式炉的温度制度设定为以20℃/min的升温速率升至800℃;
(3)在800℃温度时保温2h;
(4)关闭管式炉让钛合金样板随炉冷却至室温;
(5)重新打开管式炉,并通氩气保护,以10℃/min的升温速率升温至420℃,并保温8h;
(6)关闭管式炉,并将钛合金样板快速取出置于空气中冷却。
测试:将热处理前后的两种钛合金样板(铸造板;铸造板+热处理)经100#,400#,800#,2500#砂纸打磨抛光至镜面并切割为1mm×1mm×5mm的小方块作为样品进行显微硬度测试;将小方块样品经紫外光照后置于24孔细胞培养板中进行成骨细胞共培养实验。
硬度测试:采用mvs-1000jmt2型维氏显微硬度计测量样品表面的硬度,加载载荷为20g,载荷保持时间为5s,每种状态的样品表面选择5个点进行测试,最终硬度取平均值;
细胞形态观察及alp活性测试:
(1)将热处理前后两种状态的样品经过灭菌后,放入24孔板中,每种状态样品三组平行试样;
(2)将人的成骨细胞(hfob1.19)以105/well的密度种植在每孔中,放入培养箱中培养至2h时取出,用pbs轻柔漂洗三次转移至新孔后,每孔加入300μl2.5%的戊二醛在4℃下固定1h,吸弃戊二醛后依次在30%、50%、70%、90%、95%及100%梯度酒精中脱水10min,放入真空干燥箱后隔夜,喷金处理后,置于jsm-6700f型场发射扫描电镜下观察细胞形态;
(3)将培养至7d及14d的24孔细胞培养板取出,吸弃培养液,用磷酸盐(pbs)缓冲液清洗三遍将样品转移至新的空孔中,每孔加入100μlripa裂解液,加入苯甲基磺酰氟(pmsf)保持蛋白稳定,离心后收集上层清液;
(4)依照humanalpelisakit(r&dcompany)操作,将提取的上层清液加入到已包被alp抗体的孔板中;
(5)于酶联免疫检测仪下,在450nm波长下检测反应液的od值,其中*代表和热处理前的样品比较有显著性差异。
测定结果:
表1为热处理前和热处理后ti-nb-sn-zr-mo钛合金表面的显微硬度
由表1可以看出,对比例1、对比例2、对比例3中热处理后样品硬度值与热处理前没有显著性差异;而实施例1中其维氏硬度增大为478±19hv0.02,使β型ti-nb-sn-zr-mo钛合金表面的硬度提高81%。
同时根据测定结果,对比例1在2h、7d及14d时对成骨细胞黏附及骨向分化的作用效果与热处理前相比作用效果相近,对比例2、对比例3在2h、7d及14d时对成骨细胞黏附及骨向分化的作用效果与热处理前相比没有显著性差异。
图1为本实施例中热处理后(b)和热处理前(a)的ti-nb-sn-zr-mo钛合金的xrd谱线;图2为本实施例中热处理前的ti-nb-sn-zr-mo钛合金的微观组织结构,可以看出其表面的晶粒为微米级的纯β-ti,图3为本实施例中热处理后的ti-nb-sn-zr-mo钛合金的微观组织结构,可以看出鹅卵石状的α相嵌在β-ti中,热处理后的ti-nb-sn-zr-mo钛合金由α+β两相组成,热处理致使析出的α相以40nm左右的鹅卵石状镶嵌在β相基体中;
图4为成骨细胞在热处理前的ti-nb-sn-zr-mo钛合金样品表面培养2h后的形态,图5为成骨细胞在本实施例热处理后的ti-nb-sn-zr-mo钛合金样品表面培养2h后的形态,图6为热处理前后ti-nb-sn-zr-mo钛合金样品表面的成骨细胞在孵化7及14天后胞内的alp活性,可以看出,热处理前成骨细胞在其表面培养2h后呈圆球形,成骨细胞在其表面培养7d及14d后碱式磷酸酶(alp)活性相对较低,通过本实施例热处理后成骨细胞在其表面培养2h后呈拉长的扁平状,形成较明显的细胞质厚边,而成骨细胞在其表面培养7d及14d后碱式磷酸酶(alp)活性明显提高。
实施例2
(1)将尺寸为100mm×100mm×5mm的铸造ti-nb-sn-zr-mo钛合金样板放置在真空管式炉中,并通氩气保护;
(2)将管式炉的温度制度设定为以20℃/min的升温速率升至730℃;
(3)在800℃温度时保温2h;
(4)关闭管式炉让钛合金样板随炉冷却至室温;
(5)重新打开管式炉,并通氩气保护,以10℃/min的升温速率升温至480℃,并保温8h;
(6)关闭管式炉,并将钛合金样板快速取出置于空气中冷却。
以上仅是本发明的优选实施方式,本发明的保护范围并不仅局限于上述实施例,与本发明构思无实质性差异的各种工艺方案均在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!