具有NO催化释放与EPCs捕获功能的生物材料及其制备方法与流程
本发明涉及医疗器械技术领域,且特别涉及具有no催化释放与epcs捕获功能的生物材料及其制备方法。
背景技术:
血管支架的介入式治疗是目前临床上应用最广泛和最有效的治疗心血管疾病的手段,支架植入病变血管时会使导致支架内再狭窄和晚期血栓的发生。健康的血管内皮层是天然的抗凝血组织,具有维持血管正常收缩与舒张,保持血流通畅,抑制血栓形成的作用。因此,理想的血管支架表面应该具有促进正常的内皮细胞层再生的功能,从根本上解决血管内支架再狭窄和晚期血栓的问题。
目前实现支架原位再内皮化的途径主要包括:(1)支架植入前在其表面种植并生长一层内皮细胞(ecs);(2)通过对支架表面进行化学修饰来促进宿主体内正常的ecs向病变血管和支架处迁移、增殖;(3)从循环的血液中捕获epcs到支架表面实现快速原位再内皮化。支架植入前在其表面种植并生长一层内皮细胞(ecs)的技术需要很长的细胞培养周期,并且外源的内皮细胞用于支架的原位再内皮化会引起自身的排斥,所以接受者需永久服用免疫抑制药物。
技术实现要素:
本发明的目的在于提供一种具有no催化释放与epcs捕获功能的生物材料的制备方法,旨在利用无铜催化的点击化学反应引入能催化释放no的生物分子和具有epcs捕获功能的生物分子,形成多功能的生物材料。
本发明的另一目的在于提供一种具有no催化释放与epcs捕获功能的生物材料,其具有no催化释放与epcs捕获功能,能够促进原位再内皮化,避免支架内再狭窄和晚期血栓的发生。
本申请人发现,现有技术在植入上述支架时常常会在支架植入部位产生炎症、凝血、增生等问题,这些问题无法通常常规方式解决,从而导致上述支架难以应用于临床治疗。本申请人经大量研究发现,在具有epcs捕获功能的生物材料上同时引入no释放功能,能够良好地解决上述问题;鉴于此,从而完成了本发明。
本发明解决其技术问题是采用以下技术方案来实现的。
本发明提出了一种具有no催化释放与epcs捕获功能的生物材料的制备方法,包括如下步骤:
在待改性材料表面沉积金属氧化物薄膜,然后将材料浸泡于叠氮化邻酚化合物溶液中,将材料取出后再浸泡于功能化改性溶液中;
其中,功能化改性溶液中含有炔基化的能催化释放no的生物分子和炔基化的具有epcs捕获功能的生物分子。
本发明还提出一种具有no催化释放与epcs捕获功能的生物材料,其包括基底材料,基底材料上依次沉积有金属氧化物、叠氮化邻酚化合物和炔基化的功能生物分子,功能生物分子包括能催化释放no的生物分子和具有epcs捕获功能的生物分子;
更优选地,生物材料由上述制备方法制备而得。
本发明实施例提供一种具有no催化释放与epcs捕获功能的生物材料的制备方法的有益效果是:其通过在待改性材料表面沉积金属氧化物薄膜,然后利用金属氧化物和叠氮化邻酚化合物中的酚羟基进行配位反应,使叠氮化邻酚化合物固定在材料表面,然后利用叠氮基团和环炔基之间发生点击反应实现目标分子的有效接枝,在无需催化剂的条件下仅需一步就能催化释放no的生物分子和具有epcs捕获功能的生物分子同时引入材料表面,实现了材料的多功能化,这种反应条件温和且具有高特异性的点击化学,能够在生物材料制备过程中得到广泛应用。特别是,在具有epcs捕获功能的生物材料上同时引入no释放功能,能够良好地解决生物材料植入时在植入部位产生炎症、凝血、增生等问题,该生物材料能够更好地应用于临床治疗。
本发明还提供了一种具有no催化释放与epcs捕获功能的生物材料,其通过在基底材料表面沉积金属氧化物、叠氮化邻酚化合物和两种炔基化的功能生物分子,使材料同时具备no催化释放与epcs捕获功能,能够提高材料的抗凝血性能,同时还能够抑制平滑肌增生、促支架原位再内皮化、治疗动脉粥样硬化、降低血管内支架再狭窄和晚期血栓率。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
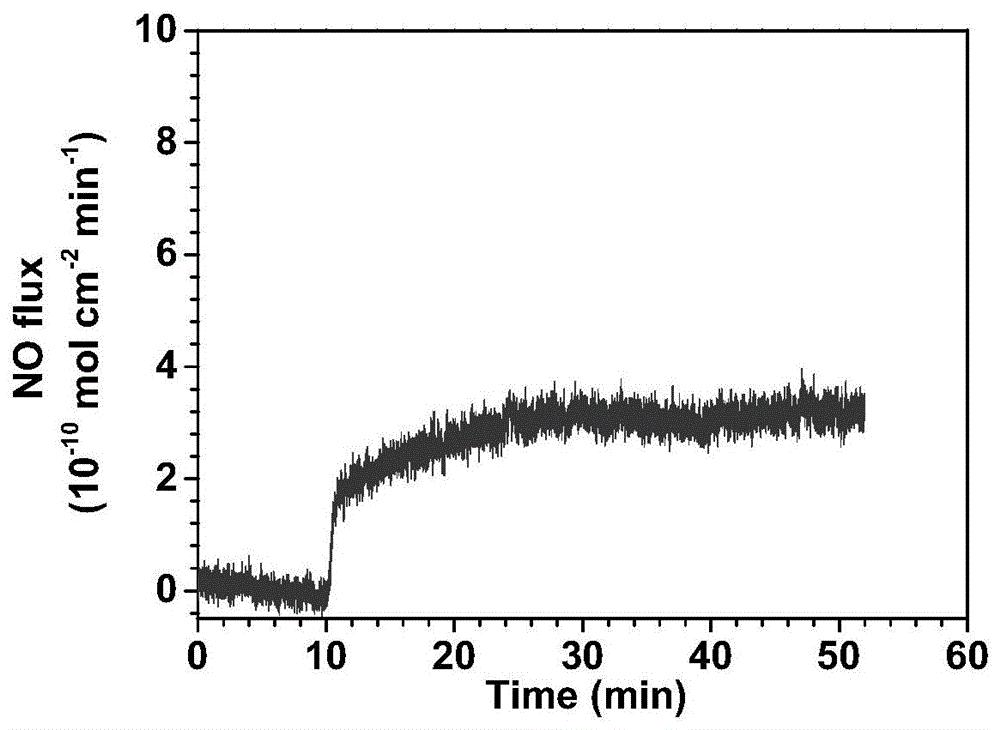
图1为本发明实施例得到的产品一氧化氮释放速率图;
图2为未经改性的材料在内皮祖细胞(epc)半体内捕获实验中的扫描电镜图;
图3为本发明实施例中制备得到的材料在内皮祖细胞(epc)半体内捕获实验中的扫描电镜图;
图4为未经改性的材料植入动物一个月后的扫描电镜图;
图5为本发明实施例中的改性材料植入动物一个月后的扫描电镜图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
下面对本发明实施例提供的具有no催化释放与epcs捕获功能的生物材料及其制备方法进行具体说明。
本发明实施例提供的一种具有no催化释放与epcs捕获功能的生物材料的制备方法,其包括如下步骤:
s1、金属氧化物的沉积
在待改性材料表面沉积金属氧化物薄膜,金属氧化物薄膜的沉积有利于增加材料的强度和生物相容性,同时也有利于叠氮化的邻酚化合物在材料表面的固定。
待改性材料可以为心血管支架、人工血管、骨诱导材料等,在此类材料表面引入功能性生物分子改善其抗凝血性能,使其具备抑制平滑肌增生促进原位再内皮化等性能具有十分广阔的应用空间。
金属氧化物为生物相容性优良的金属氧化物,优选为tio、feo和ago中的一种或多种;采用以上几种金属氧化物沉积在材料表面,能够赋予材料更好的生物相容性,且有利于引入叠氮化邻酚化合物。
优选地,金属氧化物采用磁控溅射的方法沉积,采用磁控溅射的方法操作方便,成膜均匀。在溅射过程中的操作参数大致控制为:沉膜功率为600-800w,沉积时间为8-15mins,膜厚约为50-80nm。在进行溅射沉积之前对材料进行氧等离子体溅射清洗,清洗过程中溅射功率为300-500w,溅射时间为10-20mins。
s2、叠氮化邻酚化合物的沉积
将材料浸泡于叠氮化邻酚化合物溶液中,溶液ph为5-10,优选为6-8。叠氮化邻酚化合物溶液的ph会影响反应速率,ph不宜过高或过低。
具体地,叠氮化邻酚化合物选自叠氮化的邻苯二酚及其衍生物、叠氮化的黄酮类化合物、叠氮化的黄酮醇类化合物和叠氮化的双氢黄酮化合物中的任意一种或多种;优选地,叠氮化邻酚化合物选自叠氮化的多巴、叠氮化的多巴胺、叠氮化的左旋多巴、叠氮化的右旋多巴、叠氮化的没食子酸、叠氮化的单宁酸和叠氮化的白杨素中的一种或多种。叠氮化邻酚化合物选择以上几种能够和金属氧化物配位后固定在材料表面,同时,引入的叠氮基团还有利于与炔基化的生物分子进行点击反应。
需要说明的是,以上几种叠氮化邻酚化合物均购自强耀生物有限公司,如产品名称为04010028714。
优选地,叠氮化邻酚化合物溶液是将叠氮化邻酚化合物充分溶解于缓冲溶液(即第一缓冲液)中;更优选地,缓冲液选自磷酸盐缓冲液、三羟甲基氨基甲烷缓冲液和乙酸-乙酸盐缓冲液中的一种或多种。采用以上几种缓冲液可以更有效地调节反应体系的ph,增加反应的反应速率。
进一步地,叠氮化邻酚化合物溶液的浓度为0.01-10mg/ml,浸泡过程中的反应温度为25-40℃,反应时间12-24h;优选地,叠氮化邻酚化合物溶液的浓度为0.01-1mg/ml,浸泡过程中的反应温度为35-39℃,反应时间12-24h。调控叠氮化邻酚化合物在缓冲液中的浓度能够使叠氮化邻酚化合物在材料表面高效的固定,反应温度的控制主要是为了在保证反应速率的同时避免生物分子的失活。
s3、功能化改性物的沉积
将材料取出后再浸泡于功能化改性溶液中;其中,功能化改性溶液中含有炔基化的能催化释放no的生物分子和炔基化的具有epcs捕获功能的生物分子。通过两种炔基化的功能性生物分子与叠氮化邻酚化合物发生点击反应,将这两种功能化的分子引入材料表面,赋予材料具有no释放和epcs捕获的功能。值得注意的是,本发明实施例中提供的炔基化的功能性生物分子与叠氮化邻酚化合物发生的点击反应是在常温、无铜(ⅰ)催化的条件下完成的,相比于传统的点击反应在一定程度上避免了铜离子可能带来细胞毒性,并且反应更加温和,高效。这是由于环炔分子中具有很大的的环间张力,环间张力的释放驱动了体系的快速反应。
需要补充的是,将表面带有捕获epcs分子涂层的人工血管材料植入体内后,通过捕获患者自身血液中的epcs覆盖到材料表面,在材料表面形成自体内皮组织,它可以防止植入体作为人工表面的识别,避免发生排异反应。
优选地,在将材料从叠氮化邻酚化合物溶液取出后浸泡于功能化改性溶液中之前,将材料用缓冲溶液清洗。
炔基化的能催化释放no的生物分子选自炔基化的二硫键化合物、炔基化的二硒键化合物、炔基化的单硫键化合物和炔基化的单硒键化合物中的任意一种或多种;优选为炔基化的硒代胱胺、炔基化的3,3’-二硒代二丙酸、炔基化的硒代胱氨酸、炔基化的胱氨酸、炔基化的半胱氨酸和炔基化的l-硒代胱胺基乙酸中的一种或多种。发明人发现,此反应体系适合于选择以上几种炔基化的能催化释放no的生物分子,以达到和叠氮化邻酚化合物发生点击反应的目的,在点击反应中反应速率和分子的引入量均较为理想。
炔基化的具有epcs捕获功能的生物分子选自炔基化的特异性抗体、炔基化的特异性多肽、炔基化的寡聚核苷酸和炔基化的适配子,优选为炔基化的cd34抗体、炔基化的vegfr-2抗体、炔基化的redv短肽、炔基化的hboec-特异性多肽中的一种或多种。其中,异性多肽的序列为tpsleqrtvyak-r。发明人发现,对于具有epcs捕获功能的生物分子可以在上述几种生物分子中选择,这几种生物分子具有较好的捕获epcs的能力,能与叠氮化邻酚化合物发生点击反应,在点击反应中反应速率和分子的引入量也较为理想。
需要补充的是,本发明实施例中提供的炔基化的能催化释放no的生物分子和炔基化的具有epcs捕获功能的生物分子均购自强耀生物有限公司,如产品名称为04010032507、04010030935。
材料在功能化改性溶液中的反应过程中,溶液ph为5-10,优选为6-8,反应的ph是影响反应速率的重要因素,将其控制在5-10能够使功能化生物分子更好地接枝,控制在6-8为宜,如控制在7、7.4等。
优选地,功能化改性溶液是将炔基化的能催化释放no的生物分子和炔基化的具有epcs捕获功能的生物分子充分溶解于缓冲液(即第二缓冲液)混合;更优选地,缓冲液选自磷酸盐缓冲液、三羟甲基氨基甲烷缓冲液和乙酸-乙酸盐缓冲液中的一种或多种。采用以上几种缓冲液可以更有效地调节反应体系的ph,增加反应的反应速率。
优选地,功能化改性溶液中还包括有机助溶剂,有机助溶剂选自二甲基亚砜、乙腈、四氢呋喃、丙酮、吡啶和丙烯腈中的任意一种或几种。当炔基化的生物分子不能完全溶解于缓冲溶液时,需要引入有机溶剂进行助溶。
炔基化的能催化释放no的生物分子和炔基化的具有epcs捕获功能的生物分子的浓度均为0.01-10mg/ml,浸泡过程中的反应温度为25-40℃,反应时间12-24h。优选地,炔基化的能催化释放no的生物分子和炔基化的具有epcs捕获功能的生物分子的浓度均为0.01-1mg/ml,浸泡过程中的反应温度为35-39℃,反应时间12-24h。反应体系中两种生物分子的反应浓度会影响反应速率,二者的浓度过低会使生物分子的引入量不理想,浓度过高会造成生物分子原料的浪费。反应温度对于反应速率影响更为显著,反应温度控制在35-39℃为宜,如36℃、37℃、38℃等,反应温度过低反应速率不理想,反应温度过高会导致多肽失活。
本发明实施例还提供了一种具有no催化释放与epcs捕获功能的生物材料,其包括基底材料,基底材料上依次沉积有金属氧化物、叠氮化邻酚化合物和炔基化的功能生物分子,功能生物分子包括能催化释放no的生物分子和具有epcs捕获功能的生物分子。叠氮化邻酚化合物与金属氧化物是配位键结合,键合稳定;叠氮化邻酚化合物与两种炔基化生物分子之间是发生点击反应结合。该材料同时具备no催化释放和epcs捕获功能,应用本发明制备的多功能表面可应用于心血管支架、人工血管、骨诱导材料等。
优选地,该生物材料由上述具有no催化释放与epcs捕获功能的生物材料的制备方法制备而得。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
本实施例提供一种具有no催化释放与epcs捕获功能的生物材料的制备方法,其包括以下步骤:
采用磁控溅射的方法在钴镍裸支架表面沉积一层tio薄膜,沉膜功率为600w,沉积时间为8mins,膜厚约为50nm。
用经n2除氧30mins后,ph约为5的pbs缓冲液作为溶剂,配置成浓度为0.01mg/mlac-(dopa)-gly-(dopa)-lys(peg5-azido)-(dopa)-gly-(dopa)(简写为((dopa)4-n3),下同)的反应溶液,将支架浸没在该溶液中,于无氧、25℃条件下反应12h。
将炔基化的硒代胱按(dbco-seca)和psleqrtvyakggggc-dbco(简写为dbco-peptide,下同)以0.01mg/ml的浓度分别溶解在体积比为pbs(ph=5):dmso=3:1的溶液中,将上述所得支架浸没在dbco-seca和dbco-peptide的混合溶液中,在25℃条件下反应12h。用去离子清洗三次,吹干得到具有no催化释放与epcs捕获功能的支架。
实施例2
本实施例提供一种具有no催化释放与epcs捕获功能的生物材料的制备方法,其包括以下步骤:
将450℃热处理后的钛箔用氧等离子体溅射清洗,溅射功率为300w,溅射时间为10mins。采用磁控溅射的方法在材料表面沉积一层tio薄膜,沉膜功率为600w,沉积时间为8mins,膜厚约为50nm。
用经n2除氧30mins后,ph约为5的pbs缓冲液作为溶剂,配置成浓度为0.01mg/mlac-(dopa)-gly-(dopa)-lys(peg5-azido)-(dopa)-gly-(dopa)(简写为((dopa)4-n3),下同)的反应溶液,将支架浸没在该溶液中,于无氧、25℃条件下反应12h。
将炔基化的硒代胱按(dbco-seca)和psleqrtvyakggggc-dbco(简写为dbco-peptide,下同)以0.01mg/ml的浓度分别溶解在体积比为pbs(ph=5):丙烯腈=3:1的溶液中,将上述所得支架浸没在dbco-seca和dbco-peptide的混合溶液中,在25℃条件下反应12h。用去离子清洗三次,吹干得到具有no催化释放与epcs捕获功能的支架。
实施例3
本实施例提供一种具有no催化释放与epcs捕获功能的生物材料的制备方法,其包括以下步骤:
将不锈钢金属裸支架经溅射功率为500w,溅射时间为20mins的氧等离子体溅射清洗后,采用磁控溅射的方法在不锈钢支架表面沉积一层feo薄膜,沉膜功率为800w,沉积时间为15mins,膜厚约为80nm。
用经n2除氧30mins后,ph约为10的pbs缓冲液作为溶剂,配置成浓度为5mg/mlac-(dopa)-gly-(dopa)-lys(peg5-azido)-(dopa)-gly-(dopa)(简写为((dopa)4-n3),下同)的反应溶液,将支架浸没在该溶液中,于无氧、40℃条件下反应24h。
将炔基化的硒代胱按(dbco-seca)和psleqrtvyakggggc-dbco(简写为dbco-peptide,下同)以10mg/ml的浓度分别溶解在体积比为pbs(ph=10):丙酮=4:1的溶液中,将上述所得支架浸没在dbco-seca和dbco-peptide的混合溶液中,在40℃条件下反应24h。用去离子清洗三次,吹干得到具有no催化释放与epcs捕获功能的支架。
实施例4
本实施例提供一种具有no催化释放与epcs捕获功能的生物材料的制备方法,其包括以下步骤:
将钴镍金属裸支架经溅射功率为400w,溅射时间为15mins的氧等离子体溅射清洗后,采用磁控溅射的方法在钴镍裸支架表面沉积一层ago薄膜,沉膜功率为700w,沉积时间为10mins,膜厚约为60nm。
用经n2除氧30mins后,ph约为6的乙酸-乙酸盐缓冲液作为溶剂,配置成浓度为0.1mg/mlac-(dopa)-gly-(dopa)-lys(peg5-azido)-(dopa)-gly-(dopa)(简写为((dopa)4-n3),下同)的反应溶液,将支架浸没在该溶液中,于无氧、35℃条件下反应15h。
将炔基化的硒代胱按(dbco-seca)和psleqrtvyakggggc-dbco(简写为dbco-peptide,下同)以0.1mg/ml的浓度分别溶解在体积比为pbs(ph=6):乙腈=3:1的溶液中,将上述所得支架浸没在dbco-seca和dbco-peptide的混合溶液中,在35℃条件下反应15h。用去离子清洗三次,吹干得到具有no催化释放与epcs捕获功能的支架。
实施例5
本实施例提供一种具有no催化释放与epcs捕获功能的生物材料的制备方法,其包括以下步骤:
将钴镍金属裸支架经溅射功率为400w,溅射时间为15mins的氧等离子体溅射清洗后,采用磁控溅射的方法在钴镍裸支架表面沉积一层ago薄膜,沉膜功率为700w,沉积时间为10mins,膜厚约为60nm。
用经n2除氧30mins后,ph约为8的三羟甲基氨基甲烷缓冲液作为溶剂,配置成浓度为5mg/mlac-(dopa)-gly-(dopa)-lys(peg5-azido)-(dopa)-gly-(dopa)(简写为((dopa)4-n3),下同)的反应溶液,将支架浸没在该溶液中,于无氧、39℃条件下反应20h。
将炔基化的硒代胱按(dbco-seca)和psleqrtvyakggggc-dbco(简写为dbco-peptide,下同)以5mg/ml的浓度分别溶解在体积比为pbs(ph=8):dmso=3:1的溶液中,将上述所得支架浸没在dbco-seca和dbco-peptide的混合溶液中,在39℃条件下反应20h。用去离子清洗三次,吹干得到具有no催化释放与epcs捕获功能的支架。
实施例6
本实施例提供一种具有no催化释放与epcs捕获功能的生物材料的制备方法,其包括以下步骤:
将钴镍金属裸支架经溅射功率为400w,溅射时间为15mins的氧等离子体溅射清洗后,采用磁控溅射的方法在钴镍裸支架表面沉积一层ago薄膜,沉膜功率为700w,沉积时间为10mins,膜厚约为60nm。
用经n2除氧30mins后,ph约为7的三羟甲基氨基甲烷缓冲液作为溶剂,配置成浓度为0.1mg/mlac-(dopa)-gly-(dopa)-lys(peg5-azido)-(dopa)-gly-(dopa)(简写为((dopa)4-n3),下同)的反应溶液,将支架浸没在该溶液中,于无氧、37℃条件下反应15h。
将炔基化的硒代胱按(dbco-seca)和psleqrtvyakggggc-dbco(简写为dbco-peptide,下同)以0.1mg/ml的浓度分别溶解在体积比为pbs(ph=7):dmso=3:1的溶液中,将上述所得支架浸没在dbco-seca和dbco-peptide的混合溶液中,在37℃条件下反应15h。用去离子清洗三次,吹干得到具有no催化释放与epcs捕获功能的支架。
实施例7
本实施例提供一种具有no催化释放与epcs捕获功能的生物材料的制备方法,其具体步骤与实施例6大致相同,不同之处在于:叠氮化邻酚化合物为叠氮化的多巴,炔基化的能催化释放no的生物分子为炔基化的硒代胱氨酸,炔基化的具有epcs捕获功能的生物分子为炔基化的cd34抗体。
实施例8
本实施例提供一种具有no催化释放与epcs捕获功能的生物材料的制备方法,其具体步骤与实施例6大致相同,不同之处在于:叠氮化邻酚化合物为叠氮化的没食子酸,炔基化的能催化释放no的生物分子为炔基化的l-硒代胱胺基乙酸,炔基化的具有epcs捕获功能的生物分子为炔基化的vegfr-2抗体。
实施例9
本实施例提供一种具有no催化释放与epcs捕获功能的生物材料的制备方法,其具体步骤与实施例6大致相同,不同之处在于:叠氮化邻酚化合物为叠氮化的白杨素,炔基化的能催化释放no的生物分子为炔基化的胱氨酸,炔基化的具有epcs捕获功能的生物分子为炔基化的redv短肽。
实施例10
本实施例提供一种具有no催化释放与epcs捕获功能的生物材料的制备方法,其具体步骤与实施例6大致相同,不同之处在于:叠氮化邻酚化合物为叠氮化的单宁酸,炔基化的能催化释放no的生物分子为炔基化的l-硒代胱胺基乙酸,炔基化的具有epcs捕获功能的生物分子为炔基化的寡聚核苷酸。
实施例11
本实施例提供一种具有no催化释放与epcs捕获功能的生物材料的制备方法,具体步骤如下:
采用磁控溅射的方法在钴镍裸支架表面沉积一层tio薄膜,沉膜功率为600w,沉积时间为8mins,膜厚约为50nm。
用经n2除氧30mins后,ph约为7.4的pbs缓冲液作为溶剂,配置成浓度为0.1mg/mlac-(dopa)-gly-(dopa)-lys(peg5-azido)-(dopa)-gly-(dopa)(简写为((dopa)4-n3),下同)的反应溶液,将支架浸没在该溶液中,于无氧、37℃条件下反应24h。
将炔基化的硒代胱按(dbco-seca)和psleqrtvyakggggc-dbco(简写为dbco-peptide,下同)以0.01mg/ml的浓度分别溶解在体积比为pbs(ph=5):dmso=3:1的溶液中,将上述所得支架浸没在dbco-seca和dbco-peptide的混合溶液中,在37℃条件下反应24h。用去离子清洗三次,吹干得到具有no催化释放与epcs捕获功能的支架。
以上实施例中,(dopa)4-n3、炔基化的硒代胱按和dbco-peptide的结构如下:
未给出结构式的其他原料也为市购原料,叠氮化的分子与炔基化分子均购自强耀生物有限公司。
试验例1
测试实施例11中制备得到的改性材料的一氧化氮释放速率,采用no化学发光分析仪进行测试,结果见图1。
由图1可知,待基线跑平10mins后,迅速将改性材料浸没于no催化释放检测的溶液中,no释放速率明显升高并在一段时间内保持稳。表明能催化释放no的生物分子有效的接枝在样品表面,并保持了良好的生物活性。
试验例2
测试实施例6中得到改性样品的epc捕获的能力,并与改性之前的样品进行对照,结果见图2和图3(图2为对照组,图3为实施例6)。测试方法:epc半体内捕获实验(实验前注射药物,进行为期一周的epcs动员)。
由图2可知,相比于对照组改性样品表面有较多的epcs黏附。说明表面接枝的多肽分子改性样品具有良好的epc捕获的能力。
试验例3
将实施例6中得到样品和改性前的样品植入动物一个月后进行扫面电镜观察,结果如图4和图5所示(图4为对照组,图5为实施例6)。
由图3可知,实施例6中得到的改性产品植入动物体内一个月后,样品表面覆盖的ec细胞更为均一和致密,对照组表面有一些类似纤维和血栓的物质形成。表面通过该本发明实施例的方法制备的支架具有快速再原位再内皮化的功能。
综上所述,本发明提供的一种具有no催化释放与epcs捕获功能的生物材料的制备方法,其通过在待改性材料表面沉积金属氧化物薄膜,然后利用金属氧化物和叠氮化邻酚化合物中的酚羟基进行配位,使叠氮化邻酚化合物固定在材料表面,然后利用叠氮基团和环炔基之间发生点击反应实现目标分子的有效接枝,在无需催化剂的条件下将能催化释放no的生物分子和具有epcs捕获功能的生物分子引入材料表面,实现了材料的多功能化。
本发明还提供了一种具有no催化释放与epcs捕获功能的生物材料,其通过在基底材料表面沉积金属氧化物、叠氮化邻酚化合物和两种炔基化的功能生物分子,使材料同时具备no催化释放与epcs捕获功能。
以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!