近红外/pH双响应的载碘钛合金植入物及其制备方法
近红外/ph双响应的载碘钛合金植入物及其制备方法
技术领域
1.本发明涉及骨科、口腔颌面外科、神经外科植入物技术领域,具体地说,涉及一种近红外/ph双响应的兼具抗菌、促成骨分化的载碘钛合金植入物及其制备方法。
背景技术:
2.随着近十年骨科内植入器械的使用增加,内植入假体感染成为一个日益严峻的临床问题。一旦感染发生,往往意味着至少数月的治疗周期以及极大的二次翻修手术,这将会对患者本人及家庭造成很大的痛苦和负担。保留关节假体前提下的清创与抗生素治疗(dair)被认为是治疗假体感染的首选措施。然而复杂的清创环境、耐药菌的产生以及保留的假体表面的细菌残留,都为早期感染治疗失败埋下了隐患。因而,赋予内植物假体自身抗菌特性,不失为一种抵抗假体感染的非抗生素解决方案。
3.目前,研究者们已经开发了一系列抗菌材料,赋予医疗内植入物不依赖于抗生素的抗菌性能。这些材料的配方通常涉及掺入金属元素,肽或聚合物等。利用这些材料本身具有的特性,可以直接造成细胞物理损伤抑或特异性地中断细菌的生理过程,例如dna复制,细胞膜通透性等。例如,利用银离子会破坏细菌细胞膜并消除接触细菌的性能对材料进行改性,进而构建具备抑菌性能的医用内植入材料。尽管这些策略在对抗细菌感染方面已显示出令人鼓舞的功效,并在很大程度上避免了抗生素的滥用,另一方面,主要缺点在于引入这类金属元素改性内植入物为一个相对较新领域的探索,这意味着在认证和监管方面以及寻找最佳治疗窗口方面存在困难,并且很难兼具有效的抗菌性能而没有细胞毒性作用,这在很大程度上限制了它们的临床应用。因此,寻找更加强大且相对安全的涂层改性是十分有必要的。
4.聚维酮碘是临床上使用最广泛的消毒剂。碘是一种与能量代谢和神经发育有关的微量营养素,在使用聚维酮碘来对抗病原菌入侵时起着关键作用。碘/碘化合物可以有效地杀死细菌,并通过破坏细胞亚结构并干扰遗传物质的表达来根除已建立的生物膜。迄今为止,尚无碘诱导耐药菌的临床病例报道,这使碘成为替代抗生素的杰出候选药物。尽管数百年来碘被广泛用作消毒剂,但很少有研究报道使用碘来对抗骨科植入物在体内的感染。有研究表明将碘类消毒剂内用可显著增强这些内植入系统的抗菌性能。然而,由于碘在溶液中的难溶以不稳定的特性,利用碘溶液在钛表面上的简单物理吸收会造成有限的碘负载,碘释放就无法控制等缺陷。并且由于碘趋于升华成碘蒸气,这使得该方法在生理条件下易对周围组织产生伤害。因此,实现碘在内植物材料上的成功改性还需要的新思路与方法。
5.近年来,金属有机骨架(mof)引起了研究者的极大关注,因为有序的金属纳米结构提供了超大的表面积,高负载能力,清晰的多孔结构以及可控的降解行为。通过选择合适的有机配体和反应条件,材料表面形成的mof结构可以作为载药和控释载体,促进各种医学应用。尤其是,由于mof具有与成分/结构相关的特征,包括具有细菌活性的响应性降解,活性氧种类的产生以及负载其他抗菌剂的能力,因此mof具有对抗细菌感染的巨大潜力。除这些优点外,zif
‑
8在抗菌领域还有其特殊的优势,原因是它的光催化效率高,对细菌感染涉及
的酸性ph值具有响应性,细胞毒性低等。可以想象到,在pji的背景下,zif
‑
8可能成为基于mof的抗菌表面修饰的极佳候选者。此外,zif
‑
8材料对于碘单质具有极其强大的吸附性能,这也使得其作为载碘的表面修饰材料。
6.在本发明中,我们通过构建兼具近红外/ph双响应的“爆发”碘释放以及zif
‑
8光动力效应的复合涂层。通过首先通过原位水热处理将zif
‑
8固定在微弧氧化钛表面上,然后利用zif
‑
8涂层的高吸收能力,采用气相沉积工艺将碘加载到zif
‑
8上,从而构建了这种双响应控制系统。该系统受到酸性或一定时间的近红外照射刺激后,装载在zif
‑
8上的碘就会因为zif
‑
8载体的降解而引发其“触发爆发”的迅速释放,进而发挥碘的强大抑菌效果。我们证明,当该材料体系暴露于感染环境及nir激发状态时,该改性材料在体外和体内均表现出明显提升的抗菌性能。此外,通过使用nir激光作为碘传递的“开关”,成功实现了碘的触发释放,这充分解决了先前方法碘固定的弱点。此外,这种系统还能诱导人间充质干细胞的成骨分化,赋予材料兼具抗菌、促成骨分化的特性。
技术实现要素:
7.为了解决假体易被细菌感染的问题,本发明提供一种近红外/ph双响应的兼具抗菌、促成骨分化的载碘钛合金植入物体系及其制备方法。
8.为了实现上述目的,本发明的技术方案如下:
9.本发明提供一种近红外/ph双响应的载碘钛合金植入物,所述近红外/ph双响应的载碘钛合金植入物是以表面微弧氧化形成的具有多孔结构钛合金基材为基体,通过水热反应在基体的表面及孔道内部引入沸石咪唑酯骨架结构(zif
‑
8)纳米颗粒涂层,采用气相沉积的方法,在涂层上吸附碘蒸气,最后通过高温高压蒸汽处理去杂,最终获得稳定的载碘涂层体系。
10.具体地,所述近红外/ph双响应的载碘钛合金植入物按如下方法制备:
11.(a)钛合金基材经预处理后,浸入电解池中进行电化学处理3
‑
30min(优选5min),得到含涂层的钛合金基材(多孔薄膜结构);所述的电化学处理为阳极氧化或微弧氧化,维持电压在100
‑
500v(优选150v),电流频率为200
‑
1000hz(优选1000hz),所述电解池中电解液温度在10
‑
50℃(优选30
‑
50℃),所述电解池为酸性电解池或者碱性电解池(优选酸性电解池);
12.利用上述微弧氧化的电化学手段处理而得到的基体薄膜孔径在2
‑
10μm,密度在10000孔/mm2以及上,厚度在50
‑
80μm范围的基体涂层。
13.(b)将步骤(a)所得的含涂层的钛合金基材浸没于反应液中,置于聚四氟乙烯内胆的反应釜内经高温反应炉120
‑
150℃处理6
‑
10小时(优选120℃处理6小时),经纯水冲洗三遍,置于60
‑
150℃烘箱烘干(以去除材料表面残余液体,优选60℃),得到zif
‑
8纳米颗粒涂层的钛合金基材;所述反应液为硝酸锌水溶液与2
‑
甲基咪唑水溶液配制而成,所述硝酸锌水溶液所含的硝酸锌与2
‑
甲基咪唑水溶液所含2
‑
甲基咪唑的物质的量之比为1:1
‑
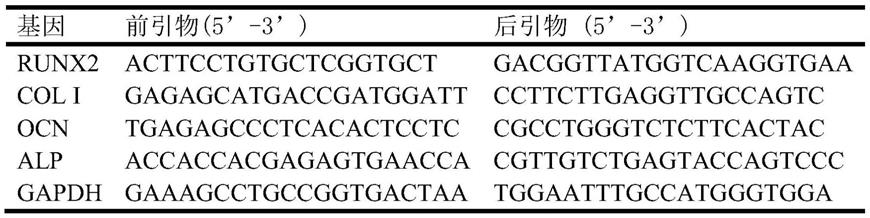
80(优选1:80);所述硝酸锌水溶液所含的硝酸锌的质量为所述反应液的0.5wt%
‑
2.0wt%(优选0.67%);
14.(c)步骤(b)所得的zif
‑
8纳米颗粒涂层的钛合金基材与单质碘互无接触地置入密闭的反应容器内(进行碘蒸气沉积处理);40
‑
70℃条件下加热1
‑
6小时(优选60℃加热3小
时);取出用纯水冲洗3遍(去除表面未吸附碘单质);进行灭菌处理,得到所述近红外/ph双响应的载碘钛合金植入物;所述单质碘的质量不少于6mg/ml所述反应容器容积,但不能多到与zif
‑
8纳米颗粒涂层的钛合金基材接触。
15.进一步,步骤(a)中所述的预处理主要为除杂步骤,其操作流程为:将钛合金基材依次经丙酮、乙二醇、超纯水洗去杂质,再酸洗除杂,最后超声清洗后取出。
16.步骤(a)中所述预处理过程中,丙酮质量浓度为≥99.5%,乙二醇质量浓度为≥99.5%。
17.步骤(a)中所述酸洗过程中所用溶液由以下质量浓度的各组分组成:0.8~2%hf,5.2~5.44%hno3,1.275%h3po4,溶剂为水,酸洗时间为5
‑
25min(优选15min);
18.步骤(a)中钛合金基材固定在阳极侧(以钛合金挂钩支具或网篮固定),阴极为纯钛板或铅板。
19.步骤(a)中所述超声清洗为将酸洗后的钛合金基材置于超纯水中清洗5min/次,循环3次。
20.优选地,步骤(a)中所述酸性电解池以硫酸(终浓度35g/l)
‑
磷酸(终浓度25g/l)
‑
过氧化氢(终浓度10g/l)
‑
水体系作为电解液,所述碱性电解池以氢氧化钾(终浓度165g/l)
‑
氟化钾(终浓度35g/l)
‑
磷酸钠(终浓度35g/l)
‑
氢氧化铝(终浓度35g/l)
‑
水体系作为电解液。
21.进一步优选的,步骤(b)中所述硝酸锌水溶液与2
‑
甲基咪唑水溶液的体积比为1:10,所述硝酸锌水溶液由质量比为169:1155的六水合硝酸锌与纯水配制而成,所述2
‑
甲基咪唑水溶液由质量比为1093:385的2
‑
甲基咪唑与纯水配制而成。
22.进一步,步骤(c)中所述灭菌处理为:将所述碘蒸气沉积处理后的钛合金基材放入高压蒸汽灭菌锅,在121℃,103.4kpa条件下处理20
‑
30分钟(优选20分钟)。
23.本发明的载碘钛合金涂层体系可用于制备骨科、口腔颌面外科、神经外科植入物,具体例如:钛合金外固定架骨钉、人工关节假体、肿瘤型假体、个性化增材制造(3d打印)钛合金系列关节假体等。
24.本发明载碘钛合金涂层具有近红外/ph双重调控下的抗感染特性以及促进成骨分化的特点,所制备的载碘体系涂层内的在弱酸性/酸性(ph=6.0及以下)或近红外光长时间激发(时间在10分钟及以上)下能够诱发碘的释放量明显上升,进而呈现材料抑菌特性从而达到材料抗菌性能可控的效果。所述抗感染主要针对骨科感染常见菌,包括革兰氏阳性菌和革兰氏阴性菌,其中革兰氏阳性菌包括金黄色葡萄球菌、耐药金黄色葡萄球菌、表皮葡萄球菌及耐药表皮葡萄球菌等。
25.与现有技术相比,本发明的有益效果在于:
26.1、本发明使用碘涂层对钛合金植入物进行修饰,得到的载碘钛合金植入物不仅具有抗感染的功能,还具有促进骨髓间充质干细胞成骨分化。其中涂层的抑菌特性受到近红外/ph双重调控。本发明可有效改善目前钛合金植入物应用于骨科、口腔颌面外科以及神经外科临床的不足,降低其植入体内后的术后早期感染的发生率及引发植入物松动等相关并发症。
27.2、本发明是利用zif
‑
8这类材料对于碘的超强吸附性能,同时利用气相沉积的原理,在zif
‑
8涂层上稳定装载碘单质。被zif
‑
8装载结合的碘单质具备性质稳定,能够耐受高
温处理,并且释放速率可调控的优势,获得的载碘钛合金植入物在抗菌、促成骨分化方面的效果十分显著。
附图说明
28.图1实施例1中材料进行电子显微镜观察微弧氧化后表面(mao)均匀的多孔结构;zif
‑
8涂层(mao+z)及载碘zif
‑
8涂层(mao+zi)表面结构结果。
29.图2实施例1中材料x射线衍射(xrd)结果。
30.图3实施例1中材料傅立叶变换红外吸收光谱(ftir)结果。
31.图4实施例1中材料截面能谱分析(edxs)提示碘被结合于zif
‑
8涂层(锌涂层)比例尺=100μm。
32.图5实施例1中材料材料在高压灭菌后的碘装载量以及zif
‑
8涂层及碘在不同ph环境中的的降解与释放速率。(a)为两种基底材料载碘高温除杂后载碘量;(b)为碘元素释放量;(c)为锌元素释放量
33.图6实施例1中材料涂层在有无近红外刺激下的碘释放速率变化。
34.图7实施例1中材料涂层体外抑菌性能检测。
35.图8实施例1中材料图层体外细胞毒性检测。
36.图9实施例1中材料涂层体外骨诱导分化实验,hbmsc细胞成骨相关基因表达。
37.图10实施例2中材料体内动物成骨修复实验micro
‑
ct结果。
38.图11对比例中不同工艺载碘前后涂层电子显微镜观察结果。
具体实施方案
39.下面结合附图通过具体实施例对本发明作进一步的说明,但本发明的保护范围并不仅限于此。
40.实施例1载碘钛合金薄片的制备
41.1.钛片表面多孔基体薄膜的构建
42.粗糙度ra在0
‑
0.4μm,大小为8
×8×
2mm的带孔钛合金基材(由浙江科惠医疗器械股份有限公司提供,带孔是为了方便支架支撑基材,令金属片正反两面都与反应液充分接触)依次经丙酮(≥99.5%)、乙二醇(≥99.5%)、超纯水等预处理,再将材料置入含hf(≥40%,20ml/l)、hno3(65.0~68.0%,80ml/l)、h3po4(85%,15ml/l)的溶液体系中酸洗15min,最后超声清洗3次,吹干。
43.将上述处理后的钛合金材料进行微弧氧化操作,其具体步骤如下:将95.0~98.0wt%硫酸(国药集团化学试剂有限公司,cas#7664
‑
93
‑
9)140ml,85wt%的磷酸(aladdin,cas#7664
‑
38
‑
2)100ml,30
‑
31%过氧化氢(aladdin,cas#7722
‑
84
‑
1)40ml溶于水中配成总量为4l的电解液,再将材料固定于阳极侧钛合金挂钩上,阴极为厚度为3mm的纯钛板,阳极侧与阴极侧之间的距离为10
‑
20cm,上述的反应条件为:电压150v,频率1000hz,水温控制在30
‑
50℃,反应时间为5min;最后将完成氧化操作的样品置于水溶液中超声浸洗3min,清洗操作重复3次。
44.2.在基体薄膜上引入zif
‑
8涂层
45.配置反应液。首先配制2.3ml水溶解0.338g六水合硝酸锌(1.1mmol)的反应液a和
23.1ml水溶解6.558g2
‑
甲基咪唑(80mmol)的反应液b。待a、b反应液均完全溶解后,将a缓慢滴加入在磁力搅拌状态下的溶液b,充分搅拌10min至混合液呈乳白色。将混合液转移至50ml聚四氟乙烯内胆的高压反应釜内。
46.选取大小合适的聚四氟乙烯支撑架,于其上均匀安放经步骤1处理后的基材9枚,浸没于反应釜的混合液内。
47.反应釜置于120℃烘箱内6小时,取出。基材经纯水冲洗3遍,置于60℃烘箱内烘干。
48.3.碘蒸气沉积及高温除杂
49.将步骤2处理后的每片材料与约15mg的单质碘颗粒置入容量为2ml的密闭的反应容器内,保持无接触状态;将密闭容器放入60度烘箱加热3小时。随后,取出材料,并用纯水冲洗3遍。最后,将该类碘蒸气沉积处理后的材料放入高压蒸汽灭菌锅,在121℃,103.4kpa条件下处理20分钟,去除表面未吸附碘单质及完成灭菌流程。
50.4.载碘钛合金涂层体系的表面形貌及结构
51.图1将材料进行电子显微镜观察,可见:微弧氧化后表面(mao)均匀的多孔结构;zif
‑
8涂层(mao+z)修饰表面均匀颗粒晶体修饰;载碘zif
‑
8涂层(mao+zi)表面晶体在吸附碘后由长短有序结构变为短序列结构。图2通过将材料送检xrd提示mao+z表面zif
‑
8结构的形成;mao+zi表面载碘后晶体发生形变,特征峰消失。图3ftir提示在载碘前后的材料(mao+z及mao+zi)zif
‑
8涂层均稳定存在。图4edxs提示碘被结合于zif
‑
8涂层(含锌涂层)。微弧氧化基体薄膜厚度约80μm。
52.5.载碘钛合金涂层体系的耐高温特性。
53.图5.a表明相比于单纯多孔结构的涂层,经过高温高压蒸气灭菌后的mao+zi仍能稳定结合部分碘。其操作步骤为:取单纯微弧氧化的材料与引入zif
‑
8涂层的材料经上述步骤3处理后用30wt%的硝酸在超声清洗机中浸洗材料,浸洗液通过电感耦合等离子质谱仪(icp
‑
ms)来检测其碘元素的浓度。
54.6.载碘钛合金涂层体系的ph调控碘释放特性。
55.图5.b与c表示mao+zi涂层材料碘元素与锌元素在酸性和中性环境中的释放情况。其操作步骤为:取mao+zi涂层材料片分别完全浸没于ph=6.0和ph=7.4的2ml sbf溶液中,在特定的时间点(3小时,6小时,12小时,1天,2天,3天,6天,9天)完全更换浸泡液。将所收集的浸出液通过icp
‑
ms来检测其锌元素及碘元素的浓度。
56.7.载碘钛合金涂层体系的近红外调控碘释放特性。
57.首先,将mao+zi材料片浸入2ml sbf中1小时以保证离子开始稳定释放。然后,依次进行0/10min近红外照射和30min静置处理。期间每20分钟彻底更换一次溶液。以上40分钟的时间作为一个周期。碘的释放速率由下式计算:
58.碘释放速率=碘浓度(μg/ml)/取样频率时间(20分钟)
×
100%
59.图6实施例1中材料涂层在有无近红外刺激下的碘释放速率变化。
60.8.载碘钛合金涂层体外抑菌试验
61.载碘钛合金植入物的抑菌实验:本发明的抑菌检测采用金黄色葡萄球菌(atcc 25923)作为实验细菌,上述操作中的mao钛片和mao+zi钛片,将两组钛片消毒后置于24孔板中,每组设3个复孔。将金黄色葡萄球菌(atcc 25923)菌液(约2
‑5×
106cfu/ml)按每孔100μl分别接种于上述各组钛片上放置于37℃,恒湿的环境下静态培养18h。无菌pbs洗脱钛片表
面黏附的细菌,将洗脱液等比例稀释至适当浓度,然后行琼脂糖凝胶培养皿涂板,培养箱内37℃下培养24h后菌落计数拍照。
62.图7为不同材料涂层体外抑菌性能检测。
63.9.载碘钛合金涂层体外细胞毒性实验
64.本研究应用人来源的骨髓间充质干细胞(hbmscs)作为实验细胞,但不仅限于hbmscs,其他种属的各类细胞均适用于本研究。
65.采用cck
‑
8检测试剂盒(日本,dojindo)检测细胞毒性。将500μl的hbmscs以5
×
104细胞/孔的方式接种到48孔板上,孵育3和7天。在第3天和第7天的时间点,废弃培养基后,用pbs轻度冲洗3次。每孔加入220μl培养液与cck
‑
8试剂盒(v/v=10:1)的混合溶液。最终,在37℃孵育2h后,在波长为450nm处,检测其吸光度(od)。
66.图8为不同材料图层体外细胞毒性检测。
67.10.载碘钛合金涂层体外骨诱导分化实验
68.选取各组钛片,直径20mm,高度2mm。湿热法消毒后置于6孔板中,每组设3个复孔。将hbmscs细胞悬液(1.0
×
105/孔)按每孔5ml分别接种于材料表面。此步骤所用的培养基为成骨分化诱导培养基(含10%胎牛血清,1%谷氨酰胺和1%β
‑
甘油磷酸酯钠,400μl抗坏血酸和20μl地塞米松,赛业(广州)生物公司)。培养液每两天换液一次。在7天与14天,用rnaiso plus(takara公司)提取不同样本表面粘附的hbmscs总rna,用primescript tm rt试剂盒(ezbioscience公司)逆转录rna。采用两步法进行循环扩增。其参数为:逆转录样本在95℃保持30s,然后开始95℃保持5s和60℃保持30s的循环共42次。不同基因的引物序列见表1。以gadph作为内部参考系。
69.表1
[0070][0071]
图9为两组钛片表面细胞培养后的成骨相关基因表达水平的变化。研究可得该载碘涂层体系相较于单纯微弧氧化表面能更好地诱导hbmscs的成骨分化。
[0072]
实施例2载碘钛合金钛棒的制备
[0073]
1.钛片表面多孔基体薄膜的构建
[0074]
采用直径1.2mm,长度为10mm的钛合金棒基材(由浙江科惠医疗器械股份有限公司提供)依次经丙酮(≥99.5%)、乙二醇(≥99.5%)、超纯水等预处理,再将材料置入含hf(≥40%,20ml/l)、hno3(65.0~68.0%,80ml/l)、h3po4(85%,15ml/l)的溶液体系中酸洗15min,最后超声清洗3次,吹干。
[0075]
将上述处理后的钛合金材料进行微弧氧化操作,其具体步骤如下:将95.0~98.0wt%硫酸(国药集团化学试剂有限公司,cas#7664
‑
93
‑
9)140ml,85wt%的磷酸(aladdin,cas#7664
‑
38
‑
2)100ml,30
‑
31%过氧化氢(aladdin,cas#7722
‑
84
‑
1)40ml溶于水中配成总量为4l的电解液,再将材料放在与阳极相连的钛合金网篮内,阴极为厚度为3mm的
纯钛板,阳极侧与阴极侧之间的距离为10
‑
20cm,上述的反应条件为:电压150v,频率1000hz,水温控制在30
‑
50℃,反应时间为5min;最后将完成氧化操作的样品置于水溶液中超声浸洗3min,清洗操作重复3次。
[0076]
2.在基体薄膜上引入zif
‑
8涂层
[0077]
配置反应液。首先配置2.3ml水溶解0.338g六水合硝酸锌的反应液a和23.1ml水溶解6.558g的反应液b。待a、b反应液均完全溶解后,将a缓慢滴加入在磁力搅拌状态下的溶液b,充分搅拌10min至混合液呈乳白色。将混合液转移至50ml聚四氟乙烯内胆的高压反应釜内。
[0078]
选取放入18根经步骤1处理的钛棒,浸没于反应釜的混合液内。
[0079]
反应釜置于120℃烘箱内6小时,取出。基材经纯水冲洗3遍,置于60℃烘箱内烘干。
[0080]
3.碘蒸气沉积及高温除杂
[0081]
将步骤2处理后的材料与过量的单质碘颗粒(浓度≥6mg/ml)置入密闭的反应容器内,保持无接触状态;将密闭容器放入60度烘箱加热3小时。随后,取出材料,并用纯水冲洗3遍。最后,将该类碘蒸气沉积处理后的材料放入高压蒸汽灭菌锅,在121℃,103.4kpa条件下处理20分钟,去除表面未吸附碘单质及完成灭菌流程。
[0082]
4.载碘涂层材料体内骨整合效果
[0083]
选取8周龄雄性sd大鼠腹腔注射1.5wt%戊巴比妥钠全麻,局部盐酸利多卡因麻醉。这些大鼠被随机分为四组。备皮,暴露胫骨,在胫骨近端置入各组钛棒。术后28、56d,每组3只大鼠注射过量水合氯醛处死。用4%多聚甲醛固定胫骨。标本送micro
‑
ct检测。
[0084]
图10实施例2中材料体内动物成骨修复实验micro
‑
ct结果。
[0085]
对比例
[0086]
目前已有报道的在钛合金材料表面zif
‑
8涂层多采用以在碱热处理的表面进行水热处理的方法进行。此方法为获得碱热处理的钛金属表面,而进行了如下处理:用丙酮和去离子水分别对tc4合金进行3次超声清洗,制备碱性加热钛(aht)。然后,用4wt%氢氟酸蚀刻2分钟,然后用去离子水冲洗,以完全去除杂质。清洗后,材料被浸泡在teflon
‑
lined高压釜包含浓度为5mol/l的氢氧化钠溶液中,加热到60℃24h。冷却后在室温下对钛板用去离子水冲洗三次,再于37℃温度下反应24小时。最后,在高温炉中以5℃/min的升温速率对制备好的平板进行加热,并在600℃下保温1小时。
[0087]
然而对于在碱热处理后的表面我们发现其涂层结合强度较差,载碘及除杂处理后电镜提示其表面zif
‑
8纳米颗粒绝大部分均已消失(图11)。本发明利用钛合金表面微弧氧化形成的多孔结构为基体,通过水热反应在集体的表面及孔道内部引入沸石咪唑酯骨架结构(zif
‑
8)纳米颗粒涂层,采用气相沉积的方法,在涂层上吸附碘蒸气,最后通过高温高压蒸汽处理去杂,最终获得稳定的载碘涂层体系。不仅保障了表面装载的碘的稳定性,同时发设计了装载成分的可控释放,有利于医疗器械临床转化的实验验证,搭建由实验室向临床导向的桥梁。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1