硫酸烧渣制备高纯氯化铁铵的方法与流程
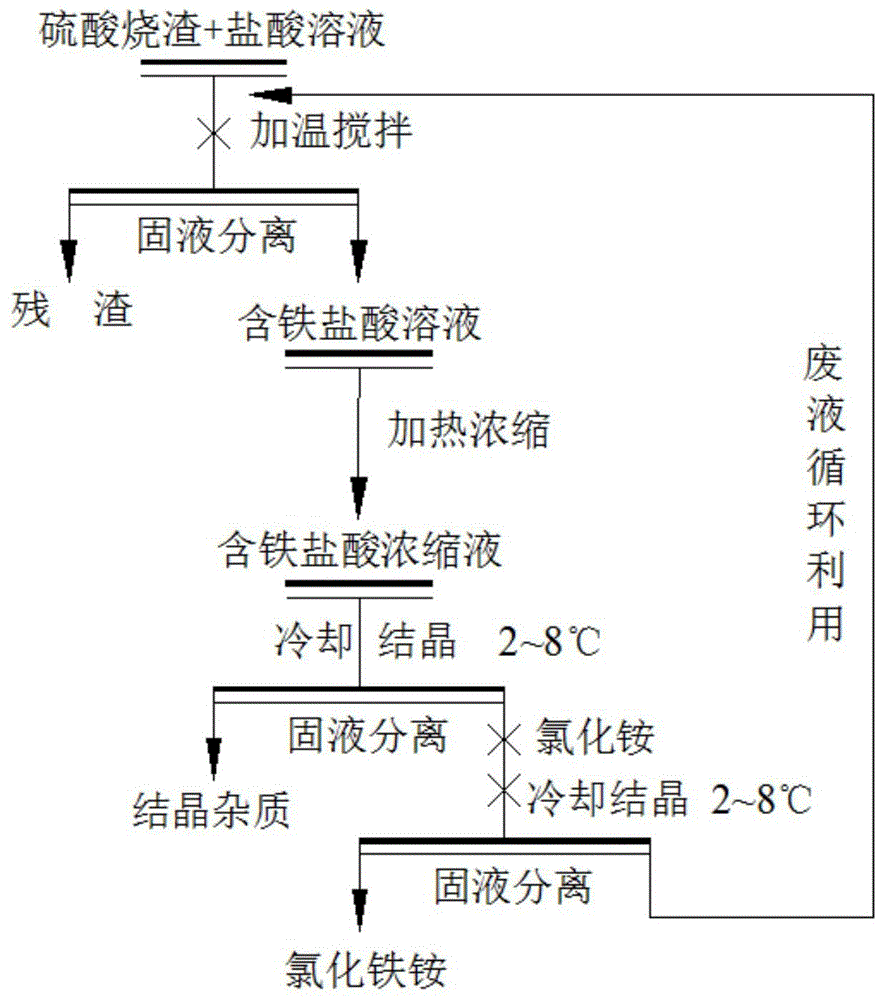
本发明属于无机化工硫酸行业废弃烧渣治理和利用
技术领域:
,涉及一种用硫酸烧渣制备高纯氯化铁铵的方法。
背景技术:
:硫酸烧渣是硫酸工业或黄金冶炼工业产生的废渣,其主要特点为:大多硫酸烧渣中铁含量较高,并主要以赤铁矿的形式存在;硫酸烧渣中脉石以石英为主,其与有价金属矿物的共存结构复杂。近年来随着金矿处理量的增加,硫酸烧渣的排放量也相应增加,对环境的危害也逐渐增大,因此如何能将硫酸烧渣进行二次回收利用,不仅可以给企业及社会带来良好的经济效益和环境效益,而且还有利于环境保护与生态环境建设。国内外对硫酸烧渣进行资源化的研究较多,主要分为以下六类:硫酸烧渣制作建筑材料;硫酸烧渣生产铁系染料;硫酸烧渣制备铁盐;硫酸烧渣用作废水净化剂;硫酸烧渣作为炼铁原料;从硫酸烧渣中回收有色金属及贵金属。公开号为cn102153152a的发明专利公布了一种用化学法制备硫酸烧渣为氯化物的方法,得到了氯化铁、氯化铝、氯化镁、氯化钙晶体。公开号为cn101817563a的发明专利公布了一种采用硫铁矿烧渣制备高纯硫酸亚铁的工艺,得到了高纯硫酸亚铁产品。公开号为cn107739816a的发明专利公布了一种硫酸烧渣制备铁粉的方法,得到了适用于增加钛白白度的铁粉。申请号为200510030016.8的发明专利公开了一种含硫金精矿的方法酸化焙烧渣制备铁红的方法,得到了符合颜料需求的铁红。未见用硫酸烧渣制备氯化铁铵的相关报道。技术实现要素:本发明的目的在于提供一种硫酸烧渣制备高纯氯化铁铵的方法,以解决硫酸烧渣排放后危害环境的问题和硫酸烧渣减量化、资源化的问题。本发明所采用的技术方案是,硫酸烧渣制备高纯氯化铁铵的方法,具体步骤如下:步骤s1、将硫酸烧渣与盐酸溶液以一定质量比混合;步骤s2、加温搅拌;步骤s3、过滤得到含氯化铁的盐酸溶液;步骤s4、对含氯化铁的盐酸溶液进行加热浓缩,得到含氯化铁的盐酸浓缩液;步骤s5、对含氯化铁的盐酸浓缩液进行冷却结晶,并过滤出结晶的杂质;步骤s6、向步骤s5所得滤液中添加一定量的氯化铵,搅拌加热至溶解;步骤s7、再次进行冷却结晶,得到氯化铁铵晶体;步骤s8、过滤得到高纯氯化铁铵;步骤s9、将步骤s8所得废液返回至步骤s1,进行循环利用。进一步的,所述步骤s1中硫酸烧渣的tfe含量为30~50%,盐酸溶液质量浓度为40~50%,硫酸烧渣与盐酸溶液的质量比为1:15~1:8。进一步的,所述步骤s2中搅拌温度为80~95℃,搅拌时间为30~50min。进一步的,所述步骤s4中含氯化铁的盐酸浓缩液体积是浓缩前含氯化铁的盐酸溶液体积的1/8~1/3。进一步的,所述步骤s5和步骤s7中冷却结晶温度相同,且该冷却结晶温度为2~8℃。进一步的,所述步骤s6中氯化铵用量为硫酸烧渣重量的60~85%。进一步的,所述过滤均采用耐腐蚀真空陶瓷过滤机进行。进一步的,所述步骤s4加热浓缩温度为60~80℃。进一步的,所述步骤s6搅拌速度为500~2000r/min。进一步的,所述步骤s7得到的氯化铁铵纯度达到化学纯级别。本发明的有益效果是,提出一种硫酸烧渣的新用途,提供了一种氯化铁铵的制备原料,对硫酸烧渣进行二次回收利用,将硫酸烧渣废弃物制备成高附加值的氯化铁铵,且氯化铁铵符合分析纯产品的纯度,有效解决了硫酸烧渣减量化、资源化的问题和硫酸烧渣排放后危害环境的问题。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。图1为本发明一种用硫酸烧渣制备高纯氯化铁铵的方法的工艺流程图;图2为本发明所得氯化铁铵的xrd图。具体实施方式下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。硫酸烧渣制备高纯氯化铁铵的方法,包括如下步骤:步骤s1、将tfe含量为30~50%硫酸烧渣与质量浓度为40~50%的盐酸溶液以1:15~1:8的质量比混合;硫酸烧渣与盐酸溶液质量比越小,矿浆(硫酸烧渣与盐酸溶液的混合溶液)浓度就越小,反应时间就会越短,另外若原料中铁含量较大,适当减小硫酸烧渣与盐酸溶液质量比,增加盐酸质量浓度,有利于增加反应速率、提高铁的回收率。步骤s2、加温搅拌,搅拌温度为80~95℃,搅拌时间为30~50min。温度越高,反应速率越快,相应的可以缩短搅拌时间,反之,则需要适当增加反应时间。步骤s3、过滤得到含氯化铁的盐酸溶液;步骤s4、对步骤s3所得含氯化铁的盐酸溶液进行加热浓缩,得到含氯化铁的盐酸浓缩液;加热后有水蒸气挥发,溶液浓度提高,浓度越高,越有利于杂质的结晶析出。含氯化铁的盐酸浓缩液体积是浓缩前原溶液的1/8~1/3,即含氯化铁的盐酸浓缩液体积是含氯化铁的盐酸溶液体积的1/8~1/3。浓缩液越浓,即含氯化铁的盐酸浓缩液体积越小,越有利于结晶除杂,但是浓缩液过浓,不但不利于结晶除杂,而且还会增加能耗成本。步骤s5、对步骤s4所得含氯化铁的盐酸浓缩液进行冷却结晶,过滤出杂质;步骤s6、添加一定量的氯化铵,搅拌加热至溶解;氯化铵用量为硫酸烧渣重量的60~85%,溶液中不仅氯化铁消耗氯化铵,其它物质也存在消耗氯化铵的可能性,如果不存在杂质,则可以用化学反应方程式计算,但溶液中往往存在杂质,杂质的种类、数量都存在一定的变化,因此不同的原料消耗氯化铵的量也将有所波动,需通过详细的试验进行评判。原料中铁含量越高,为了保证铁元素充分进行化学反应,氯化铵用量也会越高,以提高铁的回收率。步骤s7、以步骤s4的冷却结晶温度再次进行冷却结晶,得到氯化铁铵晶体;步骤s8、过滤得到高纯氯化铁铵;步骤s9、将步骤s8所得废液返回至步骤s1,进行循环利用。所述步骤s5、s7中冷却结晶温度为2~8℃。冷却温度越低,结晶速率越快,降低冷却温度,有利于提高生产效率,但是生产成本也会相应增加。温度越低,氯化铁铵的溶解度越低,越容易结晶析出,但温度过低,生产成本会增加,因此在保证结晶效率的前提下还需要尽量降低生产成本。本发明第一次过滤是为了过滤出不溶的物质,得到含氯化铁的盐酸溶液;第二次过滤是为了过滤容易结晶的杂质,提高最终产品纯度;第三次过滤是为了得到氯化铁铵固体。因此需要三次过滤,如果合并一起过滤,将会严重影响产品质量。结晶前冷却是因为,高温下氯化铁铵的溶解度较高,不提前冷却降温会降低结晶率,降低fe的回收率,降低氯化铁铵的纯度。本发明采用耐腐蚀真空陶瓷过滤机进行过滤工作。本发明集化工、环保、矿业、材料等专业技术于一体,具有较强的综合性。本发明的难点是:①对含氯化铁的盐酸溶液进行浓缩,浓溶液有利于杂质的结晶析出,若浓缩后的浓度控制不当,则杂质结晶不完全,影响最终产品纯度;②本发明氯化铁铵溶液的结晶温度控制在2~8℃,故先对含氯化铁的盐酸浓缩液于2~8℃下进行冷却结晶析出杂质,与步骤s7控制在同一个范围内,冷冻结晶即能够保证杂质充分析出,既能保障产品纯度,又能加快结晶速率;③氯化铵的用量确定较为复杂,首先需要对硫酸烧渣的化学成分进行分析,粗略确定氯化铵的用量范围,由于硫酸烧渣的成分不同,杂质成分也不同,若氯化铁铵的用量不当,则很难制备出分析纯度的氯化铁铵产品。本发明控制含氯化铁的盐酸浓缩液体积为浓缩前的1/8~1/3,并在加入氯化铵制备氯化铁铵前进行冷却结晶吸杂,且冷却温度与后期的冷却结晶得到氯化铁铵的温度相同,保证结晶所得氯化铁铵的纯度和fe的回收率。本发明的高纯产品达到化学纯级别,其中,一级是优级纯,二级是分析纯,三级是化学纯。实施例1硫酸烧渣样品来自河南某黄金冶炼厂,对样品进行成分分析,分析结果见表1,样品中主要元素为fe和si,tfe含量为37.88%,sio2含量为32.61%。表1样品成分分析结果元素类别tfesio2al2o3caosna2o其它含量/%37.8832.613.972.041.681.8519.97采用该硫酸烧渣样品制备氯化铁铵,工艺流程图如图1,包括如下步骤:步骤s1、将硫酸烧渣与盐酸溶液以1:15的质量比混合,盐酸质量浓度为40%;步骤s2、加温搅拌,搅拌温度为80℃,搅拌时间为50min;步骤s3、用耐腐蚀真空陶瓷过滤机过滤得到含氯化铁的盐酸溶液;步骤s4、对步骤s3所得含氯化铁的盐酸溶液进行加热浓缩,加热温度为60℃,得到含氯化铁的盐酸浓缩液,含氯化铁的盐酸浓缩液体积为浓缩前含氯化铁的盐酸溶液体积的1/8;步骤s5、对步骤s4所得含氯化铁的盐酸浓缩液于8℃下进行冷却结晶,用耐腐蚀真空陶瓷过滤机过滤出杂质;步骤s6、添加用量为硫酸烧渣重量的85%的氯化铵,搅拌加热至溶解,搅拌速度为500r/min;步骤s7、于8℃下冷却结晶出氯化铁铵晶体;步骤s8、用耐腐蚀真空陶瓷过滤机过滤得到高纯氯化铁铵;经耐腐蚀真空陶瓷过滤机过滤,滤饼(氯化铁铵)在滤盘表面,通过刮板挂掉收集即可得到氯化铁铵,液体则进入滤盘内部孔中,收集后即可得到废液;步骤s9、将步骤s8所得废液返回至步骤s1,进行循环利用。本实施例所得到的氯化铁铵中tfe含量为19.45%,氯化铁铵中铁的理论含量19.48%,即得纯度为99.85%(符合分析纯产品纯度),fe回收率为90.38%。实施例2对实施例1中的硫酸烧渣样品进行制备氯化铁铵,工艺流程图如图1,包括如下步骤:步骤s1、将硫酸烧渣与盐酸溶液以一定的质量比混合,二者质量比为1:8,盐酸质量浓度为50%;步骤s2、加温搅拌,搅拌温度为95℃,搅拌时间为30min;步骤s3、用耐腐蚀真空陶瓷过滤机过滤得到含氯化铁的盐酸溶液;步骤s4、对步骤s3所得含氯化铁的盐酸溶液进行加热浓缩,加热温度为60℃,得到含氯化铁的盐酸浓缩液,浓缩液体积为原溶液体积的1/3;步骤s5、对步骤s4所得含氯化铁的盐酸浓缩液于8℃下进行冷却结晶,用耐腐蚀真空陶瓷过滤机过滤出杂质;步骤s6、添加用量为硫酸烧渣重量的60%的氯化铵,搅拌加热至溶解,搅拌速度为500r/min;步骤s7、于8℃下冷却结晶出氯化铁铵晶体;步骤s8、用耐腐蚀真空陶瓷过滤机过滤得到高纯氯化铁铵产品;步骤s9、将步骤s8所得废液返回至步骤s1,进行循环利用。本实施例所得到的氯化铁铵产品中tfe含量为19.39%,即纯度为99.54%(符合化学纯产品纯度),fe回收率为86.47%。实施例3对实施例1中的硫酸烧渣样品进行制备氯化铁铵,工艺流程图如图1,包括如下步骤:步骤s1、将硫酸烧渣与盐酸溶液以一定的质量比混合,二者质量比为1:10,盐酸质量浓度为45%;步骤s2、加温搅拌,搅拌温度为90℃,搅拌时间为40min;步骤s3、用耐腐蚀真空陶瓷过滤机过滤得到含氯化铁的盐酸溶液;步骤s4、对步骤s3所得含氯化铁的盐酸溶液进行加热浓缩,加热温度为70℃,得到含氯化铁的盐酸浓缩液,浓缩液体积为原溶液体积的1/5;步骤s5、对步骤s4所得含氯化铁的盐酸浓缩液于5℃下进行冷却结晶,用耐腐蚀真空陶瓷过滤机过滤出杂质;步骤s6、添加用量为硫酸烧渣重量的60%的氯化铵,搅拌加热至溶解,搅拌速度为1000r/min;步骤s7、于5℃下冷却结晶出氯化铁铵晶体;步骤s8、用耐腐蚀真空陶瓷过滤机过滤得到高纯氯化铁铵产品;步骤s9、将步骤s8所得废液返回至步骤s1,进行循环利用。本实施例所得到的氯化铁铵产品中tfe含量为19.45%,即纯度为99.85%(符合分析纯产品纯度),fe回收率为92.41%。实施例4对实施例1中的硫酸烧渣样品进行制备氯化铁铵,工艺流程图如图1,包括如下步骤:步骤s1、将硫酸烧渣与盐酸溶液以一定的质量比混合,二者质量比为1:10,盐酸质量浓度为50%;步骤s2、加温搅拌,搅拌温度为95℃,搅拌时间为30min;步骤s3、用耐腐蚀真空陶瓷过滤机过滤得到含氯化铁的盐酸溶液;步骤s4、对步骤s3所得含氯化铁的盐酸溶液进行加热浓缩,加热温度为70℃,得到含氯化铁的盐酸浓缩液,浓缩液体积为原溶液体积的1/5;步骤s5、对步骤s4所得含氯化铁的盐酸浓缩液于5℃下进行冷却结晶,用耐腐蚀真空陶瓷过滤机过滤出杂质;步骤s6、添加用量为硫酸烧渣重量的60%的氯化铵,搅拌加热至溶解,搅拌速度为1500r/min;步骤s7、于5℃下冷却结晶出氯化铁铵晶体;步骤s8、用耐腐蚀真空陶瓷过滤机过滤得到高纯氯化铁铵产品;步骤s9、将步骤s8所得废液返回至步骤s1,进行循环利用。本实施例所得到的氯化铁铵产品中tfe含量为19.44%,即纯度为99.79%(符合分析纯产品纯度),fe回收率为92.28%。实施例5对实施例1中的硫酸烧渣样品进行制备氯化铁铵,工艺流程图如图1,包括如下步骤:步骤s1、将硫酸烧渣与盐酸溶液以一定的质量比混合,二者质量比为1:10,盐酸质量浓度为50%;步骤s2、加温搅拌,搅拌温度为95℃,搅拌时间为30min;步骤s3、用耐腐蚀真空陶瓷过滤机过滤得到含氯化铁的盐酸溶液;步骤s4、对步骤s3所得含氯化铁的盐酸溶液进行加热浓缩,加热温度为80℃,得到含氯化铁的盐酸浓缩液,浓缩液体积为原溶液体积的1/5;步骤s5、对步骤s4所得含氯化铁的盐酸浓缩液于5℃下进行冷却结晶,用耐腐蚀真空陶瓷过滤机过滤出杂质;步骤s6、添加用量为硫酸烧渣重量的70%的氯化铵,搅拌加热至溶解,搅拌速度为2000r/min;步骤s7、于5℃下冷却结晶出氯化铁铵晶体;步骤s8、用耐腐蚀真空陶瓷过滤机过滤得到高纯氯化铁铵产品;步骤s9、将步骤s8所得废液返回至步骤s1,进行循环利用。本实施例所得到的氯化铁铵产品中tfe含量为19.44%,即纯度为99.79%(符合分析纯产品纯度),fe回收率为93.21%。实施例6对实施例1中的硫酸烧渣样品进行制备氯化铁铵,工艺流程图如图1,包括如下步骤:步骤s1、将硫酸烧渣与盐酸溶液以一定的质量比混合,二者质量比为1:10,盐酸质量浓度为45%;步骤s2、加温搅拌,搅拌温度为85℃,搅拌时间为30min;步骤s3、用耐腐蚀真空陶瓷过滤机过滤得到含氯化铁的盐酸溶液;步骤s4、对步骤s3所得含氯化铁的盐酸溶液进行加热浓缩,加热温度为80℃,得到含氯化铁的盐酸浓缩液,浓缩液体积为原溶液体积的1/5;步骤s5、对步骤s4所得含氯化铁的盐酸浓缩液于2℃下进行冷却结晶,用耐腐蚀真空陶瓷过滤机过滤出杂质;步骤s6、添加用量为硫酸烧渣重量的60%的氯化铵,搅拌加热至溶解,搅拌速度为2000r/min;步骤s7、于2℃下冷却结晶出氯化铁铵晶体;步骤s8、用耐腐蚀真空陶瓷过滤机过滤得到高纯氯化铁铵产品;步骤s9、将步骤s8所得废液返回至步骤s1,进行循环利用。本实施例所得到的氯化铁铵产品中tfe含量为19.39%,即纯度为99.54%(符合化学纯产品纯度),fe回收率为90.12%。实施例7硫酸烧渣样品来自河南某黄金冶炼厂,对样品进行成分分析,分析结果见表2,样品中主要元素为fe和si,tfe含量为30.00%,sio2含量为37.54%。表2样品成分分析结果元素类别tfesio2al2o3caosna2o其它含量/%30.0037.545.861.543.870.5620.63采用该硫酸烧渣样品制备氯化铁铵,工艺流程图如图1,包括如下步骤:步骤s1、将硫酸烧渣与盐酸溶液以一定的质量比混合,二者质量比为1:10,盐酸质量浓度为50%;步骤s2、加温搅拌,搅拌温度为95℃,搅拌时间为30min;步骤s3、用耐腐蚀真空陶瓷过滤机过滤得到含氯化铁的盐酸溶液;步骤s4、对步骤s3所得含氯化铁的盐酸溶液进行加热浓缩,加热温度为80℃,得到含氯化铁的盐酸浓缩液,浓缩液体积为原溶液体积的1/5;步骤s5、对步骤s4所得含氯化铁的盐酸浓缩液于5℃下进行冷却结晶,用耐腐蚀真空陶瓷过滤机过滤出杂质;步骤s6、添加用量为硫酸烧渣重量的70%的氯化铵,搅拌加热至溶解,搅拌速度为2000r/min;步骤s7、于5℃下冷却结晶出氯化铁铵晶体;步骤s8、用耐腐蚀真空陶瓷过滤机过滤得到高纯氯化铁铵产品;步骤s9、将步骤s8所得废液返回至步骤s1,进行循环利用。本实施例所得到的氯化铁铵产品中tfe含量为19.43%,即纯度为99.74%(符合分析纯产品纯度),fe回收率为95.54%。实施例8硫酸烧渣样品来自河南某黄金冶炼厂,对样品进行成分分析,分析结果见表3,样品中主要元素为fe和si,tfe含量为50.00%,sio2含量为18.23%。表3样品成分分析结果元素类别tfesio2al2o3caosna2o其它含量/%50.0018.232.560.891.351.0225.95采用该硫酸烧渣样品制备氯化铁铵,工艺流程图如图1,包括如下步骤:步骤s1、将硫酸烧渣与盐酸溶液以一定的质量比混合,二者质量比为1:10,盐酸质量浓度为50%;步骤s2、加温搅拌,搅拌温度为95℃,搅拌时间为30min;步骤s3、用耐腐蚀真空陶瓷过滤机过滤得到含氯化铁的盐酸溶液;步骤s4、对步骤s3所得含氯化铁的盐酸溶液进行加热浓缩,加热温度为80℃,得到含氯化铁的盐酸浓缩液,浓缩液体积为原溶液体积的1/5;步骤s5、对步骤s4所得含氯化铁的盐酸浓缩液于5℃下进行冷却结晶,用耐腐蚀真空陶瓷过滤机过滤出杂质;步骤s6、添加用量为硫酸烧渣重量的70%的氯化铵,搅拌加热至溶解,搅拌速度为2000r/min;步骤s7、于5℃下冷却结晶出氯化铁铵晶体;步骤s8、用耐腐蚀真空陶瓷过滤机过滤得到高纯氯化铁铵产品;步骤s9、将步骤s8所得废液返回至步骤s1,进行循环利用。本实施例所得到的氯化铁铵产品中tfe含量为19.46%,即纯度为99.90%(符合分析纯产品纯度),fe回收率为86.46%。实施例8中tfe含量高于实施例5,因此在相同的浸出工艺参数下,尤其是盐酸量相比,实施例5更充分,因此实施例5中的铁反应更充分,实施例5中铁的回收率较高;另外,由于实施例8中tfe含量高于实施例5,因此实施例8浸出液浓缩液中氯化铁的摩尔量高于实施例5,当添加同样用量的氯化铵,则实施例8浸出液浓缩液中氯化铁不能完全反应,因此不利于提高实施例8的铁回收率,但是由于氯化铵并不过量,因此氯化铵也不会结晶析出,所以实施例8氯化铵晶体对氯化铁铵的纯度影响较小,实施例8中氯化铁铵的纯度会相对偏高。实施例5与实施例4相比,氯化铵加入量提升,但两者纯度相同,实施例5的回收率却高于实施例4,这是因为一定试验范围内,虽然增加氯化铵的用量对提高氯化铁铵纯度不利,但是增加氯化铵的同时,氯化铁铵的生成量也是增加的,因此小幅度增加氯化铵用量,并不会降低纯度,反而增加了铁的回收率,即增加的氯化铵,均参与了反应,并无剩余氯化铵在后续结晶而影响氯化铁铵的纯度。实施例4与实施例3相比,盐酸浓度提升,并且加热搅拌温度也有所提升,如果在相同的反应时间内,实施例4的浸出率应高于实施例3,及实施例中4的铁与盐酸反应更加充分,但是事实上,实施例4的加热搅拌时间是小于实施例3中的,因此实施例中4的铁与盐酸反应不一定较实施例3更加充分。实施例1和实施例3在对同一硫酸烧渣的处理中,盐酸浓度和氯化铵加入量、冷却结晶温度均不同,但其纯度相同,回收率不同,实施例1与实施例3对比,液固比不同、盐酸浓度不同、时间不同、温度不同、浓缩后的浓度不同,氯化铵的添加量也不同,多重因素的影响导致回收率存在偏差,至于纯度相同,有的因素对提高纯度有利,有的条件对提高纯度不利,但均不是绝对的,整个实验过程,纯度波动范围较小,多重因素的变化致使纯度出现一致。需要说明的是,液固比越大越有利于提高回收率,但浓缩后的浓度不一定合适;盐酸浓度越高越有利于铁的浸出并提高回收率,但浓度过高则不利;延长搅拌时间有利于铁的充分浸出,提高回收率,但会增加浸出成本;温度越高越有利于铁的浸出,同样的条件,温度越高,铁的回收率就越高,但当回收率达到极限时,则不一定能够得到预测的结果;浓缩后,溶液中氯化铁的浓度越高,对结晶越有利,但是浓度过高则对纯度和铁的回收率均不利;氯化铵的添加量过多过少均不利,过多则纯度会受到影响,过低则铁的回收率不理想。实施例5为本发明的较佳实施例,其所得氯化铁铵的xrd图谱如图2所示,其谱线单一,均为氯化铁铵的特征峰,即可说明本发明所得氯化铁铵纯度较高。在能够达到产品质量要求的前提下,回收率越高越理想,但也需要考虑到成本的问题,则实施例1~6中,纯度均能满足化学纯级别(99.5以上纯度为化学纯),因此回收率较高的实施例5较佳,对于实施例7,回收率较高是酸过量程度较大导致的,实施例8回收率较低,是酸量不充分导致的,如果实施例8把液固比提上去,同样也可以获得较高的回收率。试验范围内固液比越小、盐酸浓度越大、搅拌温度越高、搅拌时间越长越有利于铁的浸出,也就越有利于提高铁元素的回收率;浓缩液越浓,越有利于氯化铁铵的结晶,也就越有利于铁的回收率,但是增加浓缩液浓度,也会有增加杂质的风险;结晶杂质时的温度越低,杂质结晶越充分,越有利于提高氯化铁铵纯度;氯化铵用量不够,则其与氯化铁反应不充分,铁的回收率会偏低,反之,氯化铁铵用量过度,则最终氯化铁铵结晶时,会有氯化铵晶体析出,影响产品纯度;氯化铁铵结晶时,温度越低,氯化铁铵的溶解度越低,越容易结晶析出,越有利于铁的回收。本发明制备所得氯化铁铵可用作有机合成的催化剂,以及用于照相、制版和印染业等方面。以上所述仅为本发明的较佳实施例而已,并非用于限定本发明的保护范围。凡在本发明的精神和原则之内所作的任何修改、等同替换、改进等,均包含在本发明的保护范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1