氧气发生器以及调节氧气发生器的氧气产生速率的方法与流程
本发明涉及氧气发生器、以调节方式产生氧气的方法和装置。
背景技术:
没有氧气,人类就不能存在。然而,在许多环境中,氧气供应不足或者存在涉及缺氧的紧急情况的风险,例如在sar(搜索和救援)应用中,在潜艇中,在矿井中,在太空舱中,以及在飞机中。空气压力随着飞行高度的增加而降低,并且在许多航空器特别是远程航空器的巡航高度上,不再能够为人类提供足够的氧气。因此,航空器机舱被加压以确保足够的氧气供应。在航空器机舱突然减压的情况下,必须能够获得氧气面罩,该氧气面罩向机组人员和乘客供给氧气,直到航空器到达可获得足够氧气的飞行高度。
由这些应急系统提供的氧气典型由所谓的“氯酸盐蜡烛”(chloratecandles)或“氧烛”(oxygencandles)产生。这些化学氧气发生器含有氯酸盐或高氯酸盐作为氧源,以及各种添加剂如燃料、催化剂、粘合剂和缓和剂。氯酸盐蜡烛通常呈圆柱形棒的形式,即它们具有类似于蜡烛的形状。例如,在wo97/43210中公开了氯酸盐蜡烛。
已知的氯酸盐蜡烛需要高温,在所述高温下发生氧气产生。即,在氯酸盐蜡烛中,分解反应需要约350℃的温度来引发,并且在450-700℃的温度下释放氧气。因此,需要氯酸盐蜡烛的有效隔热,从而导致重量和尺寸代价。此外,氯酸盐和高氯酸盐的分解往往会产生有毒的副产品,特别是氯气,必须将其从氧气流中除去,因此额外增加了尺寸和重量。此外,还存在系统故障的风险。在氯酸盐蜡烛中,反应区通常为液体,即在燃点处开始时,存在穿过该蜡烛的液体区。在另外的固体蜡烛内的液体区使蜡烛显著失稳,使得机械冲击或甚至轻微的振动可能导致蜡烛部分的分离,从而中断热传递以及中止氯酸盐或高氯酸盐的分解。在这种情况下,氧气的产生可能中断,尽管仍然非常需要氧气。
不同类型的化学氧气发生器使用过氧化物作为氧源,例如过碳酸钠、过硼酸钠、或过氧化氢的脲加合物。过氧化物的分解产生氧气,并且可通过使过氧化物化合物与适当的酶或过渡金属催化剂接触来启动分解反应。此类型的化学氧气发生器公开于us2035896、wo86/02063、jps61227903、和de19602149中。
许多已知的过氧化物基氧气发生器使用水来提供过氧化物和催化剂之间的接触。遗憾的是,水在0℃时冻结,因此在0℃以下不能产生氧气,而一些应急系统必须在0℃以下运行。而且,过氧化物在水溶液中的分解可导致反应混合物的剧烈冒泡。因此,含有过氧化物基氧气产生组合物的氧气发生装置必须具有复杂的结构。
ep3323782a1中公开了一种新概念。该文献公开了从离子液体中的过氧化物产生氧气的组合物和方法。该组合物包含至少一种氧源、至少一种离子液体、和至少一种金属氧化物化合物,其中该氧源包含过氧化物化合物,该离子液体至少在-10℃至+50℃的温度范围内为液态,并且该金属氧化物化合物是一种单一金属的氧化物或者是两种或更多种不同金属的氧化物,所述金属选自元素周期表第2-14族的金属。
离子液体的使用提供明显的优点。离子液体是环保的化合物。它们在宽广的温度范围内为液体,并且表现出低至不存在的蒸气压。而且,此类液体是不易燃的,并且甚至可用作阻燃剂,这使得它们对于在飞机上的使用极具吸引力。它们的许多其它性能可通过改变其分子结构来改变。它们的高热容量使得它们能够将来自过氧化物分解为氧气的反应热消散。
ep3323782a1中公开的组合物在宽广的温度范围内(也包括低于冰点的温度)可靠且连续地产生可呼吸的氧气。产生的氧气处于低温,例如低于150℃或甚至更低。其典型不含有毒成分或其它有害成分,如氯气或一氧化碳。这些组合物能够在延长时段内并且以大的流速产生氧气,并且能够在需要时立即产生氧气。
然而,上述所有氧气产生组合物的共同之处在于它们以特定系统固有的流速产生氧气。氧气流速既不会增加也不会降低,并且一旦氧源的分解反应启动,就不能使其停止,直至所有氧源分解。因此,可能存在于短时间内产生过多的氧气(即氧源分解过快)的情况,以及增加的氧气流速为有利的情况。
此外,产生氧气的组合物并不是以恒定流速产生氧气。而是,在过氧化物分解反应的过程中,氧气流速要么增加要么降低要么波动。在要求基本上恒定的氧气流速的所有应用中这是不利的,例如在意图向患有肺病的患者供给氧气的医疗系统中,或者在意图向处在缺乏可呼吸氧气的环境中的人提供可呼吸氧气的供氧系统中,例如在太空舱或潜水艇中。在此类环境中,要求以基本上恒定的流速以及在延长的时间段内供氧。
为上述现有技术的至少一些问题提供解决方案并且提供可改变氧气产生速率(即增加或减少氧气流速)的氧气发生器将是有益的。提供一种可在不需要氧气时停止氧气产生并且在需要氧气时重新开始氧气产生的氧气发生器也是有益的。
此外,如果该氧气发生器能够在宽广的温度范围内(并且优选包括低于冰点的温度)可靠且连续地产生可呼吸的氧气,将是有益的。产生的氧气应处于低温,例如低于150℃或甚至更低。理想地,氧气应不含毒性成分或其它有害成分,例如氯气或一氧化碳。如果该氧气发生器能够在延长的时间段内并且以大的流速并且优选在需要时立即产生氧气也是有益的。
此外,如果氧气发生器能够以基本上恒定的流速自动地提供氧气,即不从系统外部影响该氧气发生系统,将是有益的。
技术实现要素:
本发明的示例性实施方案包括一种氧气发生器,该氧气发生器包含产生氧气的组合物,该组合物包含氧源、催化剂、离子液体和碱性化合物(若离子液体为酸性时),至少一个具有芯壳结构的调节压块(tunercompact),所述芯壳结构包括芯和一个或多个壳层,其中第一壳层完全包围芯,并且每个另外的壳层完全包围下方的壳层,所述芯和一个或多个壳层中的至少一个由选自催化剂、酸性化合物或碱性化合物的化合物组成或者包含选自催化剂、酸性化合物或碱性化合物的化合物,其中不包括在芯内或在同一壳层内的包含酸性化合物和碱性化合物两者的混合物或者包含酸性化合物和催化剂两者的混合物,并且所述芯和一个或多个壳层在与产生氧气的组合物接触时能够分解或溶解或崩解,并且此外其中所述氧源包括过氧化物化合物,该离子液体至少在-10℃至+50℃的温度范围内为液态,并且该催化剂是金属氧化物化合物和/或金属盐,其中该金属氧化物化合物是单一金属的氧化物或者是两种或更多种不同金属的氧化物,所述金属选自元素周期表第2-14族的金属,并且其中该金属盐包含一种单一金属或者两种或更多种不同金属,和有机阴离子和/或无机阴离子。
本发明的另外示例性实施方案包括一种调节产生氧气的组合物的氧气产生速率的方法,该方法包括提供氧源,提供离子液体,提供催化剂,提供至少一个具有芯壳结构的调节压块,所述芯壳结构包括芯以及一个或多个壳层,其中第一壳层完全包围所述芯,并且每个另外的壳层完全包围下方的壳层,所述芯和一个或多个壳层中的至少一个由选自过氧化物分解催化剂、酸性化合物或碱性化合物的化合物组成或者包含选自过氧化物分解催化剂、酸性化合物或碱性化合物的化合物,其中不包括在芯内或在同一壳层内的包含酸性化合物和碱性化合物两者的混合物或者包含酸性化合物和催化剂两者的混合物,并且所述芯和一个或多个壳层在与氧源、离子液体和过氧化物分解催化剂接触时能够分解或溶解或崩解,从而通过使氧源、离子液体和过氧化物分解催化剂接触而产生氧气,或者如果离子液体为酸性液体的话,通过使氧源、离子液体和过氧化物分解催化剂与碱性化合物接触而产生氧气,以及使至少一个调节压块与氧源、离子液体、催化剂和(若存在时的)碱性化合物接触,从而释放包含在调节压块中的化合物,其中最外壳层中包含的化合物首先被释放,并且芯中包含的化合物最后被释放,其中该氧源包含过氧化物化合物,该离子液体至少在-10℃至+50℃的温度范围内为液态,该金属氧化物化合物是单一金属的氧化物或者是两种或更多种不同金属的氧化物,所述金属选自元素周期表第2-14族的金属,并且金属盐包含一种单一金属或者两种或更多种不同金属,和有机阴离子和/或无机阴离子。
本发明的另外示例性实施方案包括以调节方式产生氧气的装置,该装置包括:反应室,其容纳用于产生氧气的组合物和至少一个调节压块,该组合物包含由氧源、过氧化物分解催化剂、离子液体和碱性化合物(若离子液体为酸性液体时)组成的成分组合,该调节压块具有包括芯和一个或多个壳层的芯壳结构,其中第一壳层完全包围芯,并且每个另外的壳层完全包围下方的壳层,所述芯和一个或多个壳层中的至少一个由选自过氧化物分解催化剂、酸性化合物或碱性化合物的化合物组成或者包含选自过氧化物分解催化剂、酸性化合物或碱性化合物的化合物,其中不包括在芯内或在同一壳层内包含酸性化合物和碱性化合物两者的混合物或者包含酸性化合物和催化剂两者的混合物,并且所述芯和一个或多个壳层在与产生氧气的组合物接触时能够分解或溶解或崩解,用于保持氧源、过氧化物分解催化剂和离子液体中的至少一个与其余成分物理分离的设备,和(若调节压块的最外壳层可溶于离子液体)用于保持调节压块与离子液体物理分离的设备,或者若离子液体为酸性液体,用于保持碱性化合物与离子液体物理分离的装置,和(若调节压块的最外壳层可溶于离子液体中)用于保持调节压块与离子液体物理分离的设备,用于建立氧源、过氧化物分解催化剂、离子液体、至少一个调节压块和(若存在时)碱性化合物的物理接触的设备,以及可使氧气离开反应室的设备,其中该氧源包含过氧化物化合物,该离子液体至少在-10℃至+50℃的温度范围内为液态,该金属氧化物化合物是单一金属的氧化物或者是两种或更多种不同金属的氧化物,所述金属选自元素周期表第2-14族的金属,并且该金属盐包括一种单一金属或者两种或更多种不同金属,和有机阴离子和/或无机阴离子。
本文要求保护的发明构思的技术实施方式包括:一种氧气发生器,该氧气发生器包括产生氧气的组合物和具有芯壳结构的调节压块,一种调节氧气发生器的氧气产生速率的方法,以及一种以调节方式产生氧气的装置。
在本发明的方法中,由产生氧气的组合物产生氧气,并且根据氧气产生速率是否应降低、增加、停止、或停止和重新开始,通过添加释放酸性化合物或碱性化合物和/或过氧化物分解催化剂的调节压块来调节氧气产生速率。
可以容易地理解,不管考虑本发明的哪种技术实施方式,产生氧气的组合物的成分都是相同的。因此,为特定实施方式提供的任何公开内容,例如组合物、氧气发生器、方法或装置,类似地适用于本发明的其它实施方式。
在本发明的意义上的产生氧气的组合物、氧气发生器、调节氧气产生速率的方法、和以调节方式产生氧气的装置是用于产生氧气的组合物、发生器、方法或装置,而产生氧气作为副反应产物的任何组合物、发生器、方法或装置都不构成本发明意义上的组合物、发生器、方法或装置。
根据本发明示例性实施方案的产生氧气的组合物包含至少以下成分:作为氧源的过氧化物化合物,作为引发氧气释放反应的催化剂的金属氧化物化合物,和离子液体,其作为提供氧源和催化剂之间的接触以及用于消散过氧化物分解反应期间产生的热量的载体。若离子液体是酸性的,则产生氧气的组合物还含有用于中和酸性液体的碱性化合物。
根据本发明的另外示例性实施方案的产生氧气的组合物包含至少以下成分:作为氧源的过氧化物化合物,作为引发氧气释放反应的催化剂的金属盐,和离子液体,其作为提供氧源和催化剂之间接触以及用于消散过氧化物分解反应期间产生的热量的载体。再次,若离子液体是酸性的,则产生氧气的组合物还含有碱性化合物。
在示例性实施方案中,金属盐可溶于离子液体中。术语“可溶”是指特定的氧气产生组合物的金属盐的基本上全部量能够溶解在该特定组合物中使用的所述量的离子液体中。氧源:离子液体:金属盐的比率可变化,然而,由于空间限制以及出于经济原因,将离子液体的量保持合理地小是有利的。因此,对于本发明的目的,“可溶”是指至少10nmol(纳摩尔)金属盐在1g离子液体中的溶解度。在另外的示例性实施方案中,金属盐仅部分可溶或不可溶于离子液体中。典型地,该金属盐催化剂具有至少一些溶解度,即部分可溶。
金属氧化物催化剂至多为部分可溶的,即溶解度小于10nmol/1g离子液体,或不可溶,即溶解度小于0.1nmol金属氧化物/1g离子液体。
过氧化物化合物如过氧化氢加成物化合物可通过以与金属盐在水溶液中类似的方式使它们与金属盐或金属氧化物化合物接触而在离子液体中分解,但没有通过水溶液中的金属盐催化的反应的缺点。本发明的示例性组合物不含任何水。特别地,离子液体中的过氧化物化合物的分解在低温下产生可呼吸的氧气,并且不需要用于氧气产生装置的庞大热绝缘。
这可归因于使用离子液体作为提供氧源和催化剂之间接触的介质。
离子液体是液态的盐。因此,在不分解或蒸发的情况下熔化的任何盐产生离子液体。有时,认为低于水的沸点时为液体的盐是离子液体。技术上关注的特别是在相对低的温度下例如在室温或甚至低于室温下为液态的那些离子液体。
当至少在-10℃至+50℃的温度范围(在105pa的标准压力下)离子化合物为液态时,认为该离子化合物是离子液体。示例性的离子液体至少在-30℃至+70℃为液态,并且另外的示例性离子液体在甚至更宽的温度范围(例如-70℃至+150℃)内为液态。
通过改变化学结构,可改变离子液体的性质并使其适应特定的需要。典型地,离子液体是热稳定的,具有宽的液体区域、高的热容量并且几乎没有蒸气压。它们大多数是不可燃的。它们甚至可用作阻燃剂。参考us2011/0073331a1,其公开了离子液体阻燃剂,并引用了公开制备方法的文献(0127段)。
如上所述,本发明中使用的离子液体应在低温下(例如低至-10℃,或低至-30℃或甚至更低)为液态。此类离子液体是由有机阳离子和有机阴离子或无机阴离子组成的盐,并且阳离子和阴离子都是庞大的(bulky)。在示例性实施方案中,它们庞大且不对称。作为一般规则,熔化温度随着阳离子和阴离子的庞大程度增加和对称性降低而降低。非常庞大和不对称的阳离子和阴离子的组合在低至-120℃的温度下可能不会冻结。在-70℃及以上为液体的许多离子液体是可获得的。
合适的阳离子是例如咪唑鎓、吡咯烷鎓、铵、吡啶鎓、吡唑鎓、哌啶鎓、鏻和锍阳离子。阳离子可具有取代基或可不具有取代基。特别地,阳离子可具有一个或多个取代基,例如烷基侧链,如甲基、乙基或丁基侧链。取代基可以是对称的或不对称的。
合适的阴离子包括:例如,二甲基磷酸根、甲基硫酸根、乙基硫酸根、三氟甲基磺酸根、双(三氟甲基磺酰基)酰亚胺、氯离子、溴离子、碘离子、四氟硼酸根、六氟磷酸根、乙酸根和丁-3-烯酸根。在“小”阴离子如氯离子、溴离子和碘离子的情况下,可选择特别庞大的阳离子,以提供期望的低温流动性。
一些示例性离子液体为
-1-丁基-3-甲基咪唑鎓二甲基磷酸盐([bmim][po4me2]),
-1,3-二甲基咪唑鎓二甲基磷酸盐([mmim][po4me2]),
-1-丁基-3-甲基咪唑鎓乙酸盐([bmim][oac]),
-1-乙基-3-甲基咪唑鎓甲基硫酸盐([emim][etso4]),
-丁-3-烯酸四乙铵([net4][but-3-enoat]),
-1,3-二甲基咪唑鎓甲基硫酸盐([mmim][meso4]),
-1-丁基-3-甲基咪唑鎓甲基硫酸盐([bmim][meso4]),
-1,1-丁基甲基吡咯烷鎓双(三氟甲基磺酰基)酰亚胺([bmpyrr][tfsi],
-丁基三甲基铵双(三氟甲基磺酰基)酰亚胺([me3bun][tfsi]),
-1-丁基-3-甲基咪唑鎓三氟甲磺酸盐([bmim][otf]),
-1-乙基-3-甲基咪唑鎓乙酸盐([emim][oac]),
-精氨酸四丁基铵([tba][arg]),
-三甲基铵丙烷磺酸硫酸氢盐([tmpsa][hso4]),
-1-(4-磺丁基)-3-甲基咪唑鎓硫酸氢盐([sbmim][hso4]),
-甲磺酸二乙基甲基铵([net2meh][meso3]),和
-1-乙基-3-甲基咪唑鎓硫酸氢盐([emim][hso4])。
[net4][丁-3-烯酸根]、[emim][oac]和[tba][arg]为碱性离子液体,和[tmpsa][hso4]、[sbmim][hso4]、[net2meh][meso3]和[emim][hso4]为酸性离子液体。
另外的离子液体可在“neueanwendungenfürionischeflüssigkeitenindertechnikundmedizintechnik”(newapplicationsforionicliquidsintechnologyandmedicaltechnology),dissertationbyf.stein,universityofrostock,germany,2014,第43页中找到。
然而,本文中可使用的离子液体没有特别限制。只要求它们在期望的温度范围内是液体并且稳定(即它们不分解)。当然,该离子液体不应与氧气生成组合物和调节压块的任何成分反应。该离子液体可以单独使用,或者两种或更多种组合使用。因此,在示例性实施方案中,本发明使用含有一种或多种离子液体并且任选地含有另外的添加剂的离子液体配制物,所述另外的添加剂不会有害地干扰过氧化物分解反应。
作为氧源,使用过氧化物化合物,特别是固体过氧化氢加成化合物。固体过氧化氢加成化合物构成液体过氧化氢的合适且稳定的替代物,易于储存,长期稳定并且使用安全。示例性的氧源是:碱金属的过碳酸盐,例如过碳酸钠(na2co3x1.5h2o2);碱金属的过硼酸盐,例如过硼酸钠(nabo3x4h2o,nabo3xh2o);和脲过氧化氢(uhp)。在uhp中,脲和过氧化氢以约1:1的摩尔比存在。
过氧化物化合物没有特别限制,只要它们在通常的储存条件下是稳定的。示例性的过氧化物化合物在高温下也是稳定的,例如在火附近。过氧化物化合物可溶于或部分溶于或不溶于离子液体中。过氧化物化合物可单独使用,或者两种或更多种组合使用,即作为氧源配制物,任选地含有不会有害干扰过氧化物分解反应的另外添加剂。
在示例性实施方案中,过氧化物化合物的分解反应由金属氧化物化合物催化。合适的金属氧化物化合物是例如已知会在水溶液中催化过氧化物分解的那些。
一般而言,在包含离子液体的组合物中催化过氧化物分解的金属氧化物化合物是一种单一金属的氧化物或者是两种或更多种不同金属的氧化物。所述金属选自元素周期表第2-14族的元素。元素周期表有18个族(参见:pureandappliedchemistry,vol.60,3,431-436页)。
在示例性实施方案中,金属氧化物化合物是属于元素周期表第四周期的一种或多种金属的氧化物。在替代实施方案中,金属氧化物化合物是除了属于第四周期的一种或多种金属之外还包含属于第二和/或第三和/或第五和/或第六周期的一种或多种金属的氧化物。
在另外的示例性实施方案中,该金属氧化物化合物是属于周期表的第五和/或第六周期的一种或多种金属的氧化物。
在所有实施方案中,每种金属可以按一种单一氧化态或按不同的氧化态存在。
金属氧化物化合物可以单独使用,或者两种或更多种不同金属氧化物化合物组合使用,即可使用金属氧化物配制物,该配制物包含一种或多种金属氧化物化合物,以及任选地包含不会有害干扰过氧化物分解反应的另外添加剂。
许多金属氧化物化合物是过渡金属氧化物。
此类过渡金属氧化物可含有一种过渡金属,也可含有两种或更多种不同过渡金属。每种过渡金属可以按单一氧化态存在或者按不同氧化态存在。此外,该过渡金属氧化物可含有一种或多种非过渡金属。该过渡金属氧化物可单独使用,或以两种或更多种不同的过渡金属氧化物组合使用。
示例性过渡金属氧化物催化剂包括锰、钴、铬、银和铜的氧化物,以及铁和另一种过渡金属(如钴、铜、镍或锰)的混合氧化物,锰和另一种过渡金属(如钴、镍或铜)的混合氧化物,以及含有镍和钴的混合氧化物。
关于结构类型,可具体提及尖晶石型氧化物、钛铁矿型氧化物、和钙钛矿型氧化物。
作为催化过氧化物分解反应的示例性化合物,可提及:氧化锰(iv)(mno2)、氧化钴(ii,iii)(co3o4)、氧化铬(vi)(cro3)、氧化银(i)(ag2o)、氧化铁(ii,iii)(fe3o4)和氧化铜(ii)(cuo),以及尖晶石型混合金属氧化物如钴铁氧化物(coxfe3-xo4,其中0≤x≤3),例如cofe2o4、co1.5fe1.5o4和co2feo4,铜铁氧化物(cuxfe3-xo4,其中0≤x≤3),例如cufe2o4,镍铁氧化物(nixfe3-xo4,其中0≤x≤3),锰铁氧化物(mnxfe3-xo4,其中0≤x≤3),铜锰氧化物,例如cu1.5mn1.5o4,钴锰氧化物,例如co2mno4,镍钴氧化物,例如nico2o4,以及钛铁矿型氧化物如镍锰氧化物,例如nimno3,或含有多于两种过渡金属的氧化物,例如lafexni1-xo3,其中0≤x≤1,或laxsr1-xmno3,其中0≤x≤1。
如本文所理解的,过渡金属是具有不完整d-壳层或者可形成具有不完整d-壳层的离子的那些元素,包括镧系元素和锕系元素。不言而喻,只能使用与过氧化氢发生氧化还原反应的氧化物。例如,氧化锌不能用作催化剂,尽管锌构成过渡金属。然而,强调金属氧化物化合物不限于过渡金属氧化物。相反,该金属氧化物化合物可为主族金属的氧化物,例如pbo2,或主族金属与过渡金属组合的氧化物,例如la0.5sr0.5mno3。
在另外的示例性实施方案中,过氧化物化合物的分解反应是受金属盐催化。该金属盐包含一种单一金属或者两种或更多种不同金属,以及有机阴离子和/或无机阴离子。
在示例性实施方案中,该金属盐可溶于离子液体中,并且在另外的示例性实施方案中,该金属盐不溶于或部分溶于离子液体中。选择金属盐和离子液体使得所需量的金属盐完全溶解于所需量的离子液体中,这提供了能够以一种单一均质组分的形式提供金属盐和离子液体的优势。溶液是稳定的,并且即使在长期储存期间也不会发生沉淀。以均质溶液的形式提供金属盐和离子液体简化了氧气发生装置的设计,导致催化剂和离子液体的混合物的更高活性,并且进而减少了所需的催化剂的量。与含有悬浮形式的催化剂的组合物相比,另外的优点是组合物的延长的保存期。
金属盐在离子液体中的溶解行为至少大致类似于在水中的溶解行为。因此,如果需要易溶的催化剂,可使用已知易溶于水的金属盐,以及如果需要难溶的催化剂,可使用已知难溶于水的金属盐。
关于无机阴离子,已知诸如氯离子、硫酸根、碳酸根、氢氧根、和硝酸根的阴离子提供水溶性,并且关于有机阴离子,已知诸如螯合剂(即与金属形成配位络合物的阴离子)的阴离子提供水溶性。
因此,在示例性实施方案中,金属盐是选自氯化物、硫酸盐、碳酸盐、氢氧化物和硝酸盐中的至少一种。具有这些无机阴离子的金属盐通常可很好地溶解于许多离子液体中。
在另外的示例性实施方案中,金属盐是选自乙酸盐、乙酰丙酮化物、草酸盐、酒石酸盐、和柠檬酸盐中的至少一种。具有这些螯合有机阴离子的金属盐通常很好地溶于许多离子液体中。
在另外的示例性实施方案中,一部分有机阴离子或无机阴离子被氧阴离子取代,从而产生混合催化剂,即包含氧化阴离子和无机阴离子或有机阴离子的金属化合物,或甚至包含氧化阴离子、无机阴离子和有机阴离子的金属化合物。
在示例性实施方案中,该金属盐含有一种单一金属,任选以不同的氧化态,该金属选自元素周期表第5-14族和第4-6周期的金属。元素周期表有18个族和7个周期(参见:pureandappliedchemistry,1988,vol.60,no.3,431-436页)。
在另外的示例性实施方案中,该金属盐包含至少两种不同的金属,其中至少一种金属选自元素周期表第5-14族和第4-6周期的金属。
该金属盐可单独使用或者以两种或更多种不同的金属盐组合使用。所述盐可具有不同的阳离子、或不同的阴离子、或者既不同的阳离子又不同的阴离子。可以按金属盐配制物的形式提供金属盐,即催化剂可为一种单一金属盐或者两种金属盐的组合,以及任选地也可包含不会有害干扰过氧化物分解反应的添加剂。
该金属盐包含至少一种金属,该金属的氧化态允许与过氧化氢的反应,在含水反应介质中呈现碱性条件,即在催化反应期间金属经历的氧化态转变的氧化还原电位必须允许与过氧化氢的反应。
示例性的金属盐催化剂包括钒、铬、锰、铁、钴、铜、钼、钌、铱和铅的盐。示例性的氧化态是:对于钒为+2、对于铬为+3和+6、对于锰为+2和+3、对于铁为+2和+3、对于钴为+2、对于铜为+1和+2、对于钼为+6、对于钌为+3、对于铱为+3、以及对于铅为+2和+4。
作为催化过氧化物分解反应的示例性无机盐,可提及:pbcl2、crcl3、cocl2、coco3、coso4、ircl3、mncl2、vcl2、kcr(so4)2、fecl3、cucl2、和它们各自的水合物。
作为催化过氧化物分解反应的示例性有机盐,可提及:mn(oac)2、mn(oac)3、mn(acac)2、mn(草酸根)、pb(acac)2、pb(oac)2、pb3(柠檬酸根)2、pb(酒石酸根)、co(oac)2、moo2(acac)2、ru(acac)3和它们各自的水合物。oac表示乙酸根,acac表示乙酰丙酮基。
上面列出的无机盐和有机盐在许多离子液体中构成活性催化剂。
产生氧气的组合物可包含约10-80重量%的一种或多种氧源,约20-80重量%的一种或多种离子液体,和大于0至约15重量%的一种或多种金属盐催化剂或者大于0至约20重量%的一种或多种金属氧化物催化剂。在示例性实施方案中,氧源或氧源混合物占组合物的50-70重量%,离子液体或离子液体混合物占组合物的30-60重量%,以及催化剂或催化剂混合物占组合物的大于0至约10重量%。在一些实施方案中,氧源可占组合物的至多98重量%,其中离子液体和催化剂的存在量各自低至约1重量%。任选地,可存在另外的成分,例如二氧化硅(作为散热体)、自由基清除剂如间苯二酚、2-甲基对苯二酚、丁香酚、苯酚、和4-丙基苯酚,所有这些都降低过氧化物的分解速率。在一些实施方案中,此类另外成分的量不超过组合物的约20重量%。所有成分一起加起来达到100重量%。
在酸性离子液体的情形中,示例性组合物还包含碱性化合物。以至少足以中和离子液体的量加入碱性化合物。组合物的剩余成分的量按比例减少。
在本文的上下文中,术语“组合物”包括其中组合物的所有成分混合(即彼此接触)的实施方案,以及其中成分不彼此接触(即物理分离)的实施方案,或其中至少并非所有成分彼此接触的实施方案。必须考虑的是,包含离子液体、溶解或分散在其中的过氧化物化合物、以及催化剂的混合物是不稳定的。更确切地,一旦催化剂与离子液体中的过氧化物化合物接触,或者至少在此后不久,过氧化物化合物的分解就启动。因此,产生氧气的组合物的成分必须储存在催化剂不能引发过氧化物化合物释放氧气的条件下。这可通过如下方式来实现:以“成套零件(kitofparts)”的形式提供产生氧气的组合物,即作为至少两种组分的组合,这两种组分包括至少一种氧源、至少一种离子液体、和至少一种催化剂化合物。在所述至少两种组分中,三种成分(氧源、离子液体、和催化剂)中的至少一种不与所述产生氧气的组合物的其它成分接触。
例如,组合物可包含第一组分和第二组分,第一组分包含氧源和催化剂,第二组分包含离子液体。
当离子液体具有酸性质或当离子液体含有具有酸性质的化合物时,情况有所不同。
发明人发现过氧化物分解反应不在酸性环境中进行。因此,在含有酸性离子液体的产生氧气的组合物中,过氧化物、催化剂和离子液体不需要被物理分离地储存,而是可彼此接触,例如,混合。本发明人还发现,在包含酸性离子液体的产生氧气的组合物中,可通过向离子液体、催化剂和过氧化物中加入碱性化合物来开始过氧化物分解反应。
在示例性实施方案中,氧气发生器包含产生氧气的组合物和至少一个调节压块。调节压块被设计为用于调节过氧化物分解的速度,即根据需要调节氧气流速。
在示例性实施方案中,调节压块包含能够增加或降低过氧化物分解的速度或甚至使过氧化物分解停止的化合物。此类化合物是例如酸性化合物(酸)、碱性化合物(碱)、和额外量的催化剂。酸性化合物降低催化剂的活性,因此降低过氧化物分解的速度或甚至使过氧化物分解停止,这取决于所用酸的类型和量。碱性化合物提高催化剂的活性,因此提高过氧化物分解的速度。同样,添加额外的催化剂增加过氧化物分解的速度。
在示例性实施方案中,调节压块的组成和结构允许在过氧化物分解反应的期望点释放该化合物或这些化合物中的若干,从而允许使具有本质上递减氧气流速的系统的氧气流速增加,或者使具有本质上递增氧气流速的系统的氧气流速降低,从而导致两种系统的流速更恒定。这种调节是在过氧化物分解反应期间自动实现的,无需任何监测,更不用操作员的任何监管干预。
该结构为芯壳结构,即芯完全被壳包围。该第一(最内)壳层可被完全包围第一壳层的第二壳层覆盖,第二壳层可被完全包围第二壳层的第三壳层覆盖,如此类推。因此,层状结构最终以芯构成最内层,并且最外壳层具有暴露表面。
在示例性实施方案中,芯和壳层中的至少一个包含选自过氧化物分解催化剂、酸性化合物和碱性化合物的至少一种化合物。
在示例性实施方案中,在与产生氧气的组合物接触时每层以任何其它方式溶解或分解或崩解。最外壳层首先崩解并释放其中所含的任何化合物和添加剂。一旦其被去除,接下来的下方壳层暴露并开始崩解,并释放其中所含的任何化合物和添加剂。一旦其被去除,接下来的下方壳层暴露并释放其中所包含的任何化合物和添加剂,如此类推,直到最后芯层暴露并崩解和释放其中所含的任何化合物和添加剂。
虽然理论上壳层的数目不受限制,但示例性的调节压块仅具有一层或两层壳层。
每个调节压块层的组成适于在与产生氧气的组合物接触时以任何其它方式分解或溶解或崩解。
在示例性实施方案中,调节压块层(芯或壳层)由过氧化物化合物组成或者包含过氧化物化合物。在与产生氧气的组合物接触时,调节压块层的过氧化物参与氧气产生反应并分解,从而释放其中所含的任何化合物和添加剂。若其中不含催化剂、酸性化合物或碱性化合物,则分解调节压块层的过氧化物所需的时间构成了时间跨度,其中氧气生成组合物的过氧化物的分解在不受此化合物影响的情况下进行。
在另一个示例性实施方案中,调节压块层(芯或壳层)由非活性(惰性)化合物组成或者包含非活性(惰性)化合物,该化合物在与产生氧气的组合物接触时溶解或溶胀。“非活性”或“惰性”是指化合物不会对过氧化物分解反应造成任何影响。溶解非活性化合物去除相应的调节压块层。也可使用不可溶的但在离子液体中可溶胀的非活性化合物。此类化合物导致各个调节压块层的破裂和最终崩解。
作为示例性的非活性化合物,可提及乙酸钠、氯化钠、硫酸钠和硝酸钠,它们易溶解在离子液体中。
当非活性调节压块层分别溶解或崩解时,其中所含的任何化合物和添加剂被释放。如果其中不含催化剂、酸性化合物或碱性化合物,则溶解或崩解各个调节压块层所需的时间构成了其中产生氧气的组合物的过氧化物的分解在不受此化合物影响的情况下进行的时间跨度。
在另外的示例性实施方案中,调节压块层可仅由过氧化物分解催化剂、酸性化合物或碱性化合物组成,条件是其分别可溶于或至少部分可溶于产生氧气的组合物中或产生氧气的组合物的离子液体中。
此类化合物的实例是可溶或部分可溶的酸、可溶或部分可溶的碱、以及可溶或部分可溶的作为催化剂的金属盐。也可使用不可溶的化合物(即不溶于各自的离子液体),例如金属氧化物催化剂,但其典型与可溶或部分可溶的化合物组合使用。否则,当完全不可溶的化合物形成最外调节压块层时,在过氧化物分解反应停止时,其不能重新开始。
在示例性实施方案中,适用于调节压块的过氧化物化合物与如上文参照产生氧气的组合物所述的相同,并且适用于调节压块的催化剂与如上文参照产生氧气的组合物所述的相同。
根据示例性实施方案的酸性化合物是有机酸和酸性盐。可使用在标准条件下为固体的任何有机酸或酸性盐。有机酸的实例为琥珀酸、柠檬酸和苯甲酸,以及酸性盐的实例为硫酸氢钠和磷酸二氢钾。
在分别与产生氧气的组合物或其中所含的离子液体接触时溶解的酸性化合物也可作为包含它的各个调节压块层的崩解剂。
根据示例性实施方案的碱性化合物是在标准条件下为固体的氢氧化物、碱性盐、碱性氧化物和有机碱。示例性的碱为氢氧化物例如氢氧化钠、氢氧化钾和氢氧化钙,碱性盐例如磷酸钾、乙酸钠、过碳酸钠、碳酸钾,和氧化物如氧化钙。
分别可溶于或至少部分可溶于产生氧气的组合物或其中所含的离子液体的碱性化合物可充当包含它们的各个调节压块层的崩解剂。
在示例性实施方案中,芯和/或一个或多个壳层包含不影响过氧化物分解反应的至少一种助剂(添加剂)。作为助剂,可提及消泡剂如石蜡和吸水物质如氧化硅。
示例性调节压块和调节压块组合示于图1-5中,示例性氧气发生装置示于图6-8中。
示例性的产生氧气的方法包括提供氧源,提供离子液体(中性或碱性),提供金属氧化物化合物和/或金属盐,其中该氧源为过氧化物化合物,该离子液体至少在-10℃至+50℃的温度范围内为液态,该金属氧化物化合物是一种单一金属的氧化物或者是两种或更多种不同金属的氧化物,所述金属选自元素周期表第2-14族的金属,该金属盐包括一种单一金属或者两种或更多种不同金属,和有机阴离子和/或无机阴离子,以及使氧源、离子液体、和金属氧化物化合物和/或金属盐接触。
根据示例性实施方案,提供催化剂和离子液体作为第一组分,提供氧源作为第二组分,并且接触步骤包括混合第一组分和第二组分。
根据另外的示例性实施方案,提供氧源和催化剂作为第一组分,提供离子液体作为第二组分,并且接触步骤包括混合第一组分和第二组分。
当作为一种单一组分(即以混合状态)提供氧源和催化剂时,氧源和催化剂两者应在混合之前彻底干燥。否则,氧源会不经意地分解。在不存在任何媒介物时,例如水或离子液体,固体氧源和固体催化剂构成长期稳定的混合物。
如果离子液体为酸性离子液体,则示例性的产生氧气的方法包括提供氧源,提供酸性离子液体,提供金属氧化物化合物和/或金属盐,以及提供碱性化合物。该方法基本上如上文关于中性和碱性离子液体所述,然而,通过使氧源、酸性离子液体、过氧化物分解催化剂和碱性化合物接触来进行产生氧气的步骤。
在上述的产生氧气的方法中,以特定的产生速率产生氧气并且持续特定的时间。通过适当地选择成分的类型和数量、过氧化物化合物的表面积,以及通过将过氧化物化合物或者过氧化物化合物和催化剂的混合物压缩成粉末压块,可在一定程度上影响产生速率和时间。压实压力越高,所得粉末压块的压实程度越高。高的压实压力延迟反应的开始并且延长氧气产生的时间。然而,具有特定的成分组合和任选特定压实程度的每种氧气产生组合物以该特定组合所固有的速率产生氧气。不可能影响运行中的分解反应。
本发明提供在释放全部量的氧气之前停止过氧化物分解反应的可能性。作为替代,可不停止氧气产生,而是仅减少氧气生产。这些效果可通过添加酸性化合物来实现,从而使反应混合物呈酸性。根据示例性实施方案,提供酸性化合物作为调节压块的芯层或内壳层的成分。在除去外壳层之后,包含酸性化合物的层暴露并释放该酸性化合物。在释放酸性化合物时可立即观察到氧气产生的中断或减速。通过适当地选择调节压块外层的厚度和/或压实压力,酸性化合物在产生氧气的组合物的分解反应的所需点处自动释放。
本发明还提供提高运行中的分解反应的氧气产生速率的可能性。可通过向产生氧气的组合物中加入碱性化合物(使反应混合物呈碱性)或额外量的催化剂来实现这种效果。根据示例性实施方案,提供碱性化合物或者额外量的催化剂作为调节压块的芯层或内壳层的成分。在去除一个或多个外壳层之后,包含碱性化合物或额外量催化剂的层分别暴露并释放碱性化合物或额外量的催化剂。通过适当地选择外壳层的厚度和/或调节压块的压实压力,在产生氧气的组合物的分解反应的所需点处自动释放碱性化合物或额外量的催化剂。
在本发明的示例性实施方案中,产生氧气的组合物的氧气产生可被中断,并且在稍后的时间再次重新开始。可通过将酸性化合物(先)和碱性化合物(后)两者加入产生氧气的组合物中来实现这样的中断和重新开始。提供酸性化合物作为第一调节压块(或多个第一调节压块)的芯层或内壳层的成分,以及提供碱性化合物作为第二调节压块(或多个第二调节压块)的芯层或内壳层的成分。第一调节压块和第二调节压块的外壳层的组成和/或厚度和/或压实程度使得确保包含碱性化合物的层比包含酸性化合物的层更迟暴露。因此,首先释放酸性化合物,使反应混合物呈酸性,并且氧气产生中断,但在稍后的时间点,包含碱性化合物的层暴露,从而释放碱性化合物。结果,使反应混合物呈碱性,并且氧气产生再次开始。
因此,根据示例性实施方案,可以使氧气产生速率适合于特定需要。甚至有可能完全停止氧气产生,并在所需的时间间隔后使其再次重新开始。
在本发明的上下文中,如果液体或反应混合物的ph在6.5-7.3的范围内,则认为其是中性的。在ph为6.5-7.3的离子液体中(因为它们含有本质上在该范围内的ph的离子液体,或者因为它们含有ph在不同范围内的离子液体,但是已通过分别添加酸性化合物或碱性化合物调节ph),过氧化物分解进行缓慢但完全。
在本发明的上下文中,如果液体或反应混合物的ph在低于6.5的范围内,则认为其是酸性的。在ph低于6.5的离子液体中(因为它们含有本质上ph低于6.5的离子液体,或者因为它们包含具有不同ph的离子液体,但是已通过添加酸性化合物调节ph),过氧化物分解反应比ph为6.5或以上时进行地得更慢。ph值越低,分解反应越慢,并且越来越多的过氧化物化合物保持为未分解的残留物。过氧化物分解根本不进行的确切ph值取决于离子液体、过氧化物和催化剂的类型,并且可通过一些常规实验容易地找到每个特定体系的该确切ph值。
在本发明的上下文中,如果液体或反应混合物的ph在高于7.3的范围内,则认为其是碱性的。在ph高于7.3的离子液体中(因为它们含有本质上ph高于7.3的离子液体,或者因为它们包含具有不同ph的离子液体,但是已通过添加碱性化合物调节ph),过氧化物分解反应比ph为7.3或以下时进行得更快。ph值越高,过氧化物分解得越快,即过氧化物完全分解所需的时间段越短。同样,反应速度根据离子液体、过氧化物和分解催化剂的类型而略微改变,但是可通过一些常规实验容易地找到特定系统的期望反应速度。
在本文中,离子液体或反应混合物的ph值是在20℃下在离子液体的100mm水溶液(蒸馏水)中测定。可根据需要通过分别添加酸或碱(例如1mhcl或1mnaoh)来调节ph值。
调节氧气发生器的氧气产生速率的示例性方法包括提供氧源,提供离子液体(中性或碱性),提供催化剂,和提供调节压块,通过使氧源、离子液体和催化剂接触来产生氧气,和通过使调节压块与氧源、离子液体和催化剂接触来调整氧气产生速率。调节压块具有芯壳结构,该芯壳结构在芯内和/或一个或多个壳层内包含选自过氧化物分解催化剂、酸性化合物或碱性化合物的至少一种化合物。在调节压块与产生氧气的组合物接触时,调节压块在从外到内进行的过程中破坏,从而逐步释放形成壳层和芯的化合物。
如果离子液体是酸性液体,则除氧源、酸性离子液体和催化剂之外还提供碱性化合物,并且通过使氧源、酸性离子液体、过氧化物分解催化剂和碱性化合物接触来产生氧气。
在上述调节方法中,氧源、离子液体、催化剂、碱性化合物和调节压块的成分如上所述。
在示例性方法中,调节氧气产生速率包括通过使在其层中包含酸性化合物的调节压块与氧源、离子液体和催化剂接触来降低氧气产生速率或停止氧气产生。
在另一示例性方法中,调节氧气产生速率包括通过使在其层中包含碱性化合物和/或催化剂的调节压块与氧源、离子液体和催化剂接触来提高氧气产生速率。
在另一示例性方法中,调节氧气产生速率包括减少氧气产生或中断氧气产生,并且在特定时间间隔之后,通过接触在其一个层中包含酸性化合物并且在其另一层中还包含碱性化合物的调节压块来加速氧气产生或重新开始氧气产生,其中与包含酸性化合物、氧源、离子液体和催化剂的层相比,包含碱性化合物的层是相对内层。通过两个调节压块(一个包含酸性化合物,另一个包含碱性化合物)的组合实现相同的效果,其中调节压块被结构化使得在释放该酸性化合物之后的期望时间释放该碱性化合物。
根据另外的示例性方法,通过使氧源、离子液体和催化剂与调节压块接触来逐步进行氧气产生的加速和/或减缓,所述调节压块在其若干层中具有酸性化合物或者在其若干层中具有碱性化合物或额外量的催化剂。在示例性实施方案中,包含影响过氧化物分解反应的化合物的层被不含影响过氧化物分解反应的化合物的层分离,或者被不含与相邻层相同的影响过氧化物分解反应的相同化合物的层分离。
在同一层中包括具有相反效果的化合物没有意义。因此,在芯层内或在壳层之一内具有包含酸性化合物和碱性化合物的混合物、或者包含酸性化合物和催化剂的混合物的调节压块,不构成本发明的一部分。
本发明提供以期望的预定方式影响运行中的过氧化物分解反应的可能性,其不需要对运行中的分解反应进行任何监测。然而,可以按与调节压块不同的方式影响过氧化物分解反应或启动过氧化物分解反应。例如,每当根据本发明的氧气发生器的使用者认为合适时,例如因为产生的氧气量被认为不足或充裕时,或者因为应使已经停止的分解反应再次启动时,可从外部环境引入另外的过氧化物分解催化剂、碱性化合物或酸性化合物。
以调节方式产生氧气的示例性装置特别适于容纳至少一个调节压块,以及适于以物理分离的状态容纳产生氧气的组合物的成分,以及适于在期望产生氧气时建立氧源、催化剂、离子液体和调节压块的物理接触。如果离子液体为酸性,则产生氧气的组合物还包含用于启动分解反应的碱性化合物。在这种情况下,氧源、催化剂和离子液体不需要以物理分离的状态容纳,然而,碱性化合物必须与离子液体物理分离。在这种情况下,示例性的产生氧气装置适于建立氧源、催化剂、调节压块、酸性离子液体和碱性化合物的物理接触。此外,如果调节压块的最外壳层可溶于或部分可溶于离子液体中,则该装置必须适于保持调节压块与离子液体物理分离,并且适于建立调节压块和产生氧气的组合物的成分的物理接触。
用于以物理分离状态容纳产生氧气的组合物的成分并且在期望产氧气时使它们物理接触的装置描述于ep3323782a1,特别是[0053]-[0057]和[0105]-[0136]段中,并且示于ep3323782a1的图18-22中。通过引用将各公开内容并入本文。此装置适于执行本发明的方法,并且此装置的示例性修改在本文图7和8中示出,并参照图7和8在本文中进行描述。
在示例性实施方案中,上述离子液体用作分散剂或溶剂,并且作为上述氧气发生器中的散热体。
所公开的发生器、方法和装置可利用上文关于组合物描述的任何材料,反之亦然。
本文对“包含”的所有提及应理解为涵盖“包括”和“含有”以及“由......组成”和“基本上由......组成”。
术语“a”表示“至少一”。
附图说明
通过以下非限制性实施例参照附图进一步说明本发明,其中:
图1-5是示意性说明根据本发明的调节压块的示例性实施方案的截面图,
图6-8是示意性说明根据本发明以调节方式产生氧气的装置的示例性实施方案的截面图,
图9和10是说明通过在[emim][oac]中的mn(oac)2*4h2o来自uhp的氧气释放的曲线图,其受提供不同量乙酸锰作为额外催化剂的调节压块的影响,
图11和12是说明通过在[emim][oac]中的mn(oac)2*4h2o来自uhp的氧气释放的曲线图,其受具有琥珀酸芯的调节压块的影响,
图13和14是说明通过在[mmim][po4me2]中的mno2来自uhp的氧气释放的曲线图,其受提供mn(oac)2*4h2o作为额外催化剂的调节压块的影响,
图15和16是说明通过在[emim][oac]中的mn(oac)2*4h2o来自uhp的氧气释放的曲线图,其受提供不同量碳酸钠的调节压块的影响,
在图9-16中,氧气流速和体积分别相对于运行时间绘图,其中运行时间是在接触氧源、离子液体、催化剂和调节压块的时间点启动运行的时间。“体积”是释放的氧气总体积。
具体实施方式
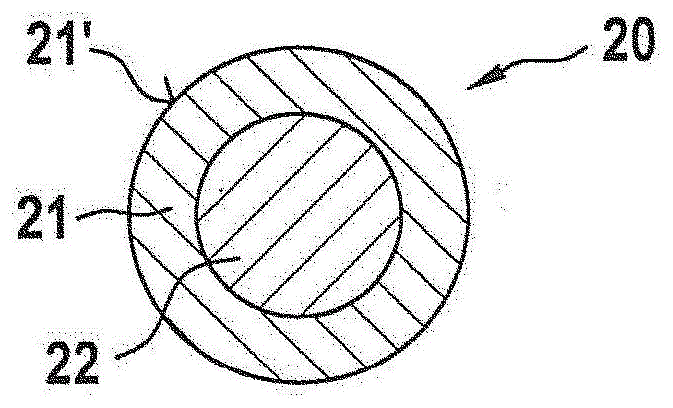
图1示出调节压块20,其包括两层:芯层22和一个壳层21。壳层21具有暴露表面21'。在图1的示例性实施方案中,壳层21由固体过氧化物组成,且芯层22由固体酸组成。当与产生氧气的混合组合物接触时,壳层21的过氧化物在表面21'处开始分解,并且分解进行直至达到芯层22。在该特定时刻,芯层22的酸被释放,并且根据释放的酸量,分解反应停止或减速。
图2示出调节压块25,其包括两层:芯层27和一个壳层26。壳层26具有暴露表面26'。在图2的示例性实施方案中,壳层26由非活性盐组成,即不影响过氧化物分解反应的盐,其可溶于产生氧气的组合物的离子液体中。芯层27由催化剂组成。
当与产生氧气的混合组合物接触时,壳层26的可溶盐开始在表面26'处溶解,并且溶解进行直至达到芯层27。在该特定时刻,芯层27中包含的催化剂被释放,并且分解反应加速。
图3示出调节压块30,其包括三层:芯层33、第一(内)壳层32、和第二(外)壳层31。壳层31具有暴露表面31'。在图3的示例性实施方案中,第二壳层31由固体过氧化物组成,第一壳层32由固体酸和固体过氧化物的混合物组成,且芯层33由固体碱组成。
当与产生氧气的混合组合物接触时,第二壳层31的过氧化物在表面31'处开始分解,并且分解进行直至到达第一壳层32。在该特定时刻,其中含有的酸被释放,并且分解反应减速,并且在释放足够的酸之后最终停止。当第一壳层32的分解由于酸的浸出而进行时,额外的过氧化物被释放,因此增加了可用于分解的过氧化物的量。在第一壳层32完全去除之后,暴露出芯层33。在该特定时刻,包含在芯层33中的碱性化合物被释放,并且过氧化物分解反应重新开始。随着反应混合物的碱度的增加,分解反应加速。
图4示出调节压块35,其包括三层:芯层38,第一壳层37和第二壳层36。第二壳层36具有暴露表面36'。在图4的示例性实施方案中,芯层38由碱性化合物和过氧化物的混合物组成,第一壳层37由固体酸组成,第二壳层36由催化剂和过氧化物的混合物组成。
当与产生氧气的混合组合物接触时,第二壳层36的过氧化物在表面36'处开始分解,并且分解进行直至到达第一壳层37。第二壳层36的分解释放出额外催化剂用于加速过氧化物分解反应。当第二壳层36已完全被除去时,第一壳层37的酸被释放,并且分解反应减速,最后停止。一旦第一壳层37的所有酸已溶解,芯38就暴露于产生氧气的组合物,并且其中包含的碱性化合物被释放,从而一旦达到足够的碱性ph,氧气产生反应再次重新开始。芯38提供额外的过氧化物用于氧气产生反应中的分解。
图5示出调节压块组合,其包括第一调节压块40和第二调节压块45。第一调节压块40包括两层:芯层42和一个壳层41。壳层41具有暴露表面41'。第二调节压块45也包括两层:芯层47和一个壳层46。壳层46具有暴露表面46'。
在图5的示例性实施方案中,壳层41由过氧化物和催化剂的混合物组成,并且芯层42由酸组成。壳层46也由过氧化物和可溶催化剂的混合物组成,并且芯层47由碱性化合物组成。
壳层41和46具有相同的组成,但厚度变化很大,即壳层46的厚度是壳层41的约三倍。因此,当调节压块40,45与产生氧气的混合组合物接触时,两个壳层41,46同时开始分解,但壳层41的去除比壳层46快得多。一旦壳层41已被除去,芯层42的酸就被释放,且氧气产生反应减速并最终停止。然而,壳层46仍与离子液体接触,并且其中包含的催化剂缓慢溶解,从而最终除去壳层46,并暴露芯层47。当芯层47暴露时,其中包含的碱性化合物被释放,并且氧气产生反应再次启动。
虽然图1-5示出基本上球形的调节压块,但应强调的是,调节压块的形状不以任何方式受限制。例如,也可考虑椭球或棒等形状。
在下文中,描述了示例性的产生氧气装置,假设其中包含的离子液体为中性或碱性的离子液体。
图6示出以调节方式产生氧气的示例性装置1,该装置具有一个单独的反应室2,用于存储产生氧气的组合物和调节压块25。在该单个反应室2中,产生氧气的组合物中的至少一种成分必须被封闭在容器中,以避免与反应室中容纳的组合物的其余成分接触。另外,如果调节压块的最外壳层可溶或部分可溶于离子液体中,则调节压块必须与离子液体保持分离。在图6所示的实施方案中,两个容器5,6被设置在反应室中。容器5包含氧源7和分解催化剂9的紧密混合物,例如以粉末形式或压缩成丸粒,以完全干燥的状态。容器6包含中性或碱性的离子液体8。调节压块25不包含在任何容器中。调节压块25具有如上参照图2所述的结构和组成。在替代的示例性实施方案中,催化剂9可分散或溶解在离子液体8中,而不是与过氧化物7混合。
在应当产生氧气的情况下,容器5和6分别被破坏装置18破坏。在图6中,破坏装置18具有板的形式,然而,用于破坏所述容器的设备不限于板,并且其它设备是本领域技术人员已知的,例如撞针或栅格。可通过弹簧19或其它激活机构来实现板18的移动。在产氧装置的存储期间,弹簧19处于张紧状态并且将板18保持在远离容器5,6的位置。一旦通过合适的触发机构(未示出)释放张力,弹簧19使板18移向容器5,6,并且板18破坏容器5,6。该触发器可例如将氧气面罩拉向飞机上的乘客。另一示例性触发机构是感测低氧条件的氧传感器。
容器5,6和板18由保证容器5,6在被板18击打时破坏或破裂的材料制成。示例性材料是塑料箔或玻璃(用于容器5,6),以及较厚的塑料材料或金属(用于板18)。
容器5,6的破坏引起过氧化物、离子液体和催化剂的混合,并引发氧气产生。其还引发调节压块25的壳层26的溶解。过氧化物分解反应的速度趋于随着运行时间的增加而降低,但这种现象被在壳层26完全溶解之后从调节压块25的芯层27释放额外的催化剂而抵消。产生的氧气通过提供在反应室2中的开口而离开反应室。在所示实施方案中,用透气膜16密封所述开口。所述开口可处于与图6中所示不同的位置,或者可以存在多于一个开口。
在示例性实施方案中,在本文所述的装置中产生的氧气可穿过本领域已知的过滤器或其它净化设备。所述装置可配备有此类设备。
氧气产生反应是仅略微放热的过程,并且在低温下进行,即低于150℃,或甚至低于120℃或低于100℃。因此,反应室2不需要耐高温,并且可由轻质、低熔点材料如塑料制成。此外,不需要任何庞大的绝缘。在必须节省重量和/或空间受限的所有情况下这是特别有利的,例如应安装在航空器中的氧气面罩的情形中。
图7示出以调节方式产生氧气的另一示例性装置1。该装置类似于图6中所示的装置,但没有容器5。因此,氧源和催化剂“自由地”容纳在反应室2中。在该示例性实施方案中,提供氧源和产生氧气的组合物的催化剂作为调节压块的成分。在图7所示的实施方案中,使用如参照图5所述的第一调节压块40和第二调节压块45的组合。存在许多第二调节压块45(未填充的圆),其在壳层46内提供与所需分解催化剂组合的大量氧源,但只有一个第一调节压块40(填充的圆)。
容器6的破坏引起第一调节压块40、第二调节压块45以及中性或碱性离子液体8的混合,并通过使壳层41和46中包含的过氧化物分解来引发氧气产生。在壳层41的过氧化物分解之后,如果已释放足够的酸以使反应混合物呈酸性,则通过芯层42的酸停止氧气产生。然而,壳层46中包含的催化剂在离子液体中的溶解继续并导致壳层46的崩解。除去壳层46后,构成芯层47的碱性化合物暴露并重新开始过氧化物分解反应。
用于以调节方式产生氧气的另外的示例性装置示于图8中。图8中所示的装置1类似于图7中所示的装置,但是配备有注射装置11。开口17流体连接反应室2的内部空间和注射装置11的内部空间。
注射装置11包括容器12、滑杆13和长钉14。长钉14由固定装置15保持就位。容器12由易于破裂的材料制成,例如由塑料箔制成的袋。容器12含有碱性化合物。
在图8所示的示例性实施方案中,可以按与制动装置18类似的方式驱动滑杆13。一旦被驱动,滑杆13将容器12推向长钉14,容器12破裂,并且通过开口17将碱性化合物注入反应室2中。
反应室2含有容器6,其容纳催化剂9在中性或碱性离子液体8中的溶液。如参照图1所述的由过氧化物化合物(阴影圆)和调节压块20(未填充圆)组成的粉末压块10“自由地”包含在反应室2内。
破坏装置18的驱动启动了反应室2中的过氧化物分解反应。粉末压块10的过氧化物以及调节压块20的壳层21内包含的过氧化物都被分解,从而产生氧气,直到壳层21的过氧化物用完为止。当芯层22的酸性化合物暴露时,氧气产生停止。由于氧气发生器中缺少碱性化合物,其在稍后的时间点暴露,因此氧气产生将不会重新开始。然而,通过驱动注射装置11的滑杆13,可在任意时间点重新开始氧气产生。滑杆13的驱动引起容器12中包含的碱性化合物注入反应室2,这再次引起氧气产生的重新开始,其持续直至粉末压块10中包含的所有过氧化物化合物已分解。
可修改图6-8中所示的装置以便与酸性离子液体一起使用。如果调节压块具有不溶于离子液体的外壳层,则可省略容器6和破坏装置18,19,并且该装置可配备有包含用于启动分解反应的碱性化合物的(其它)注入装置11。如果外壳层至少部分可溶于相应的离子液体中,则必须防止调节压块和离子液体的接触,例如,通过将离子液体包封在容器6中。
在显示氧气释放的所有曲线图中,释放的氧气体积和氧气流速分别相对于运行时间绘图,其中运行时间是在接触氧源、离子液体、催化剂和粉末压块的时间点开始运行的时间。“体积”是释放的氧气总体积。在整个实验中,在实施例1-4的每个实验中,用鼓式气量计测量每个分解反应释放的氧气流速(l/h)和氧气体积(l)。
实施例1
实施例1包括实验1-3。在每个实验中,将脲过氧化氢(uhp;以每片重1g的片剂形式)装入玻璃烧瓶中。向其中加入mn(oac)2*4h2o在[emim][oac]中的溶液(0.15mol%,以uhp中包含的h2o2计)。
此外,在每个实验中,在分解反应开始之前,将粉末压块(压块直径:32mm,压实压力:70-80mpa)加入玻璃烧瓶中。在每个实验中,关闭烧瓶,并用鼓式气量计测量氧气流速和从组合物中释放的氧气总体积。
在实验2中,使用一种具有如图2所示的芯壳结构的粉末(调节)压块。该调节压块具有由1gmn(oac)2*4h2o组成的芯(直径:20mm)和由5gnaoac组成的壳。
在实验3中,将与实验2中相同的两个调节压块加入烧瓶中。
在实验1中,将一个由5gnaoac组成的粉末(对比)压块加入烧瓶中。
实验中使用的化合物的各自量、释放的氧气总体积以及至氧源完全分解的反应时间示于表1中。
表1
结果示于图9(释放的氧气体积)和图10(氧气流速)中。在图中,线1表示实验1中释放的氧气体积/氧气流速,线2表示实验2中释放的氧气体积/氧气流速,线3表示实验3中释放的氧气体积/氧气流速。
实施例1证明,与实验1相比,在实验2和3中氧源的分解在一定运行时间后加速。这种效果可归因于在催化剂芯周围的非活性乙酸钠壳溶解后从调节压块释放出额外的催化剂(乙酸锰)。
实施例2
实施例2包括实验1和2。在每个实验中,将uhp(以每片重1g的片剂形式)装入玻璃烧瓶中。向其中加入mn(oac)2*4h2o(0.17mol%,以uhp中包含的h2o2计)在[emim][oac]中的溶液。
此外,在每个实验中,将粉末压块(压块直径:32mm,压实压力:70-80mpa)加入玻璃烧瓶中。在每个实验中,关闭烧瓶,并用鼓式气量计测量氧气流速和从组合物释放的氧气总体积。
在实验2中,在分解反应开始之前,将具有如图1所示的芯壳结构的两个粉末(调节)压块加入uhp中。每个调节压块具有由5g琥珀酸组成的芯(直径20mm)和由uhp组成的壳。此外,在分解反应开始之前,将一个由uhp组成的粉末压块加入玻璃烧瓶中的uhp中。
在实验1中,将由10guhp组成的三个粉末(对比)压块加入烧瓶中。
实验中使用的化合物的各自量、释放的氧气总体积、和由于氧源分解所致的氧气产生时间段示于表2中。
表2
结果示于图11(释放的氧气体积)和图12(氧气流速)中。在图中,线1表示实验1中释放的氧气体积/氧气流速,线2表示实验2中释放的氧气体积/氧气流速。
实施例2证明,在实验2中,氧源的分解在一定运行时间后终止,而在实验1中,氧源的分解仍然进行。这种效果可归因于在琥珀酸芯周围的uhp壳分解之后从调节压块释放出琥珀酸。琥珀酸的释放导致氧源的不完全分解,即在玻璃烧瓶中仍然存在未分解的uhp。
实施例3
实施例3包括实验1和2。在每个实验中,将uhp(以每片重1g的片剂形式)装入玻璃烧瓶中。此外,在每个实验中,将粉末压块(压块直径:32mm,压实压力:70-80mpa)装入玻璃烧瓶中。向其中加入mno2(3mol%,以uhp中包含的h2o2计)在[mmim][po4me2]中的分散体。然后,在每个实验中,关闭烧瓶,并用鼓式气量计测量氧气流速和从组合物释放的氧气总体积。
在实验2中,使用具有如图2所示的芯壳结构的一个粉末(调节)压块。该调节压块具有由1gmn(oac)2*4h2o组成的芯(直径20mm)和由5gnaoac组成的壳。
在实验1中,使用由5gnaoac组成的一个粉末(对比)压块。
实验中使用的化合物的各自量、释放的氧气总体积以及至氧源完全分解的反应时间示于表3中。
表3
结果示于图13(释放的氧气体积)和图14(氧气流速)中。在该图中,线1表示实验1中释放的氧气体积/氧气流速,线2表示实验2中释放的氧气体积/氧气流速。
实施例3证明,与实验1相比而言,在实验2中氧源的分解在一定运行时间后加速。这种效果可归因于在催化剂芯周围的非活性乙酸钠壳溶解后从调节压块释放出额外的催化剂(乙酸锰)。
实施例4
实施例4包括实验1-4。在每个实验中,将uhp(以每片重1g的片剂形式)装入玻璃烧瓶中。另外,在每个实验中,将粉末压块(压块直径:32mm,压实压力:70-80mpa)装入玻璃烧瓶中。向其中加入mn(oac)2*4h2o(0.15mol%,以uhp中包含的h2o2计)在[emim][oac]中的溶液。然后,在每个实验中,关闭烧瓶,并用鼓式气量计测量氧气流速和分解释放的氧气体积。
在实验2中,使用四个粉末压块、两个调节压块和两个比较压块。调节压块具有类似于图2所示结构的芯壳结构,但以碱性化合物作为芯。芯直径为20mm,芯材料为碳酸钠(2g),壳材料为乙酸钠(5g)。比较压块各自由5g乙酸钠制成。
在实验3中,使用具有类似于图2所示结构的芯壳结构的四个调节压块。调节压块与实验2中的相同,即芯材料是2g碳酸钠,并且壳材料是5g乙酸钠。
在实验1中,使用由5gnaoac组成的四个粉末(比较)压块。
表4中示出在实验中使用的化合物的各自量以及在35分钟运行时间之后释放的氧气总体积。
表4
结果示于图15(释放的氧气体积)和图16(氧气流速)中。在图中,线1表示实验1中释放的氧气体积/氧气流速,线2表示实验2中释放的氧气体积/氧气流速,以及线3表示实验3中释放的氧气体积/氧气流速。
实施例4证明,与实验1相比而言,在实验2和3中氧源的分解在一定运行时间后加速。这种效果可归因于在碳酸钠芯周围的非活性乙酸钠壳溶解后从调节压块中释放出碱碳酸钠。在实验3中,加速比实验2中更显著,因为在实验3中释放出更多的碳酸钠碱。
根据本发明产生的氧气是纯的并且在低温下。此外,由于能够加速或减缓分解反应的化合物的受控释放的可能性,与现有技术的氧气发生器相比,能够以显著更恒定的流速并且在更长的时间内提供氧气。本文公开的组合物、方法和装置对于需要恒定的氧气流量和/或在延长的时间段内的氧气流量的应用是理想的,例如,对于为患者提供氧气的医疗系统,对于采矿、潜艇和太空飞行应用,对于便携式焊接装置、控制喷嘴和其它技术应用,以及对于诸如在飞机、在自救器和在循环呼吸器中的常规应用。
虽然已经参照示例性实施方案描述了本发明,但是本领域技术人员将理解,在不脱离本发明的范围的情况下,可进行各种改变以及可用等效物替换其要素。另外,在不脱离本发明的实质范围的情况下,可进行许多修改以使特定情况或材料适应本发明的教导。因此,意图是本发明不限于所公开的特定实施方案,而是本发明将包括落入所附权利要求书范围内的所有实施方案。
- 还没有人留言评论。精彩留言会获得点赞!