解淀粉芽孢杆菌YA289及其降解得到的氨基酸肥料
本发明涉及微生物降解和应用
技术领域:
,更具体地,涉及解淀粉芽孢杆菌ya289及其降解得到的氨基酸肥料。
背景技术:
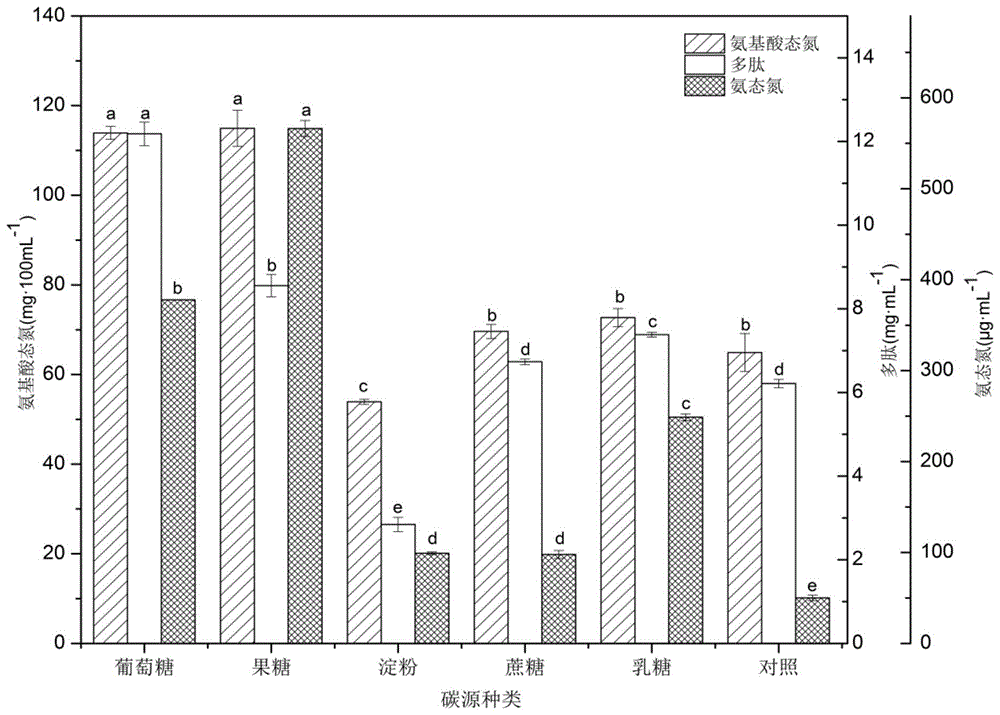
:南美白对虾因其肉质鲜美、营养价值高等优点,逐步成为我国主要的对虾养殖品种,养殖量可占总对虾养殖量的70%以上。而我国南美白对虾的加工方式一般采用除去虾头、虾壳等冷冻虾仁方式来出口,在生产过程中可产生大约45%的废弃物。这些废弃物通常含有蛋白质、虾青素等营养物质,处理不当既污染环境又浪费资源。微生物发酵法利用了微生物的代谢作用,不仅能改变蛋白质的品质,还能产生易于消化利用的短肽、氨基酸等物质,使加工废弃物转化成高附加值的发酵产品。氨基酸态氮可以快速检测食品中蛋白质的水解程度,其和多肽的量可以共同作为观测虾头发酵后蛋白质水解情况的指标。同时富含有机物的下脚料等在发酵过程中有机物易在降解过程中产生恶臭气体,包括nh3、硫化物、胺类等臭气以及n2o等温室气体,这些气体的产生导致环境的污染和产品品质的下降。技术实现要素:本发明为了克服现有技术中缺乏微生物降解对虾下脚料制备氨基酸态氮丰富且气味宜人的生物肥料的方法的缺陷,本发明的首要目的是提供筛选得到的优势菌株解淀粉芽孢杆菌ya289在制备氨基酸生物肥料中的应用。本发明的第二个目的是提供一种氨基酸生物肥料的制备方法。本发明的目的通过以下技术方案实现:解淀粉芽孢杆菌ya289在制备氨基酸生物肥料中的应用。本发明研究发现解淀粉芽孢杆菌ya289发酵蛋白质丰富的原料,可以显著提高氨基酸态氮和多肽的含量,并同时显著减少氨态氮的生成量,从而避免了发酵后的臭味。本发明所用的解淀粉芽孢杆菌ya289序列已上传ncbi,其登录号为:gca_000196735.1。优选的,解淀粉芽孢杆菌ya289用于提高生物肥料中氨基酸态氮和多肽的含量,减少氨态氮的含量。因此,优选的,本发明还提供解淀粉芽孢杆菌ya289在降低氨基酸生物肥料中氨态氮含量的应用。本发明还提供一种氨基酸生物肥料,该生物肥料由解淀粉芽孢杆菌ya289发酵对虾下脚料得到。具体的,这里的对虾下脚料主要是虾头。优选的,解淀粉芽孢杆菌ya289发酵过程为:将解淀粉芽孢杆菌ya289的菌悬液接种于灭菌对虾下脚料培养基中,摇床培养发酵即可。所述灭菌对虾下脚料培养基由对虾下脚料和水混合制得。更优选的,所述解淀粉芽孢杆菌ya289发酵的条件为:料液比1:7,nacl添加量5g/l,接种量5%,ph6.2,转速180rpm,37℃,36h。与现有技术相比,本发明具有以下有益效果:本发明研究发现优势菌株解淀粉芽孢杆菌ya289用于发酵对虾下脚料,发酵过程中氮素的损失主要是通过nh3的挥发,nh3挥发损失的氮占总氮量的19%~42%。因此通过检测发酵液的氨态氮含量变化来反映氮源的变化。本研究结果显示在最佳优化工艺的条件下氨基酸态氮、多肽含量分别比优化前提高了142.4%、13.14%,氨态氮含量比优化前减少了1.5%,无明显的不愉快气味。制备得到的氨基酸肥料可以被植物吸收利用,用其制作成氨基酸液体肥料,可提高农作物的产量和品质,降低农药残留等。附图说明图1为不同碳源对发酵样品氨基酸态氮、多肽和氨态氮的含量的影响;图2为不同氮源对发酵样品氨基酸态氮、多肽和氨态氮的含量的影响;图3为不同nacl添加量对发酵样品氨基酸态氮、多肽和氨态氮的含量的影响;图4为菌液不同接种量对发酵样品氨基酸态氮、多肽和氨态氮的含量的影响;图5为培养基不同ph值对发酵样品氨基酸态氮、多肽和氨态氮的含量的影响;图6为不同料液比对发酵样品氨基酸态氮、多肽和氨态氮的含量的影响;图7为不同发酵时间对发酵样品氨基酸态氮、多肽和氨态氮的含量的影响;图8为不同发酵温度对发酵样品氨基酸态氮、多肽和氨态氮的含量的影响;图9为发酵不同转速对发酵样品氨基酸态氮、多肽和氨态氮的含量的影响。具体实施方式下面对本发明的具体实施方式作进一步说明。在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。此外,下面所描述的本发明各个实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互组合。下述实验例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。实施例1解淀粉芽孢杆菌ya289的活化与菌悬液的制备(1)菌种的活化将解淀粉芽孢杆菌ya289接种于isp2平板,平板置于37℃培养箱培养24h。(2)菌悬液的制备取1环活化后的菌体接种于装有100mllb液体培养基的250ml三角瓶中,于37℃、200rpm条件下培养24h,取处于对数生长期的培养液离心(4000r/min,10min)。收集菌体后在0.9%的无菌生理盐水中重悬并调整菌悬液od600在0.7左右。(3)发酵将上述菌悬液取适量接入到含100ml灭菌虾头培养基(虾头:水=1:8)的250ml三角瓶中,于摇床中培养,培养条件为自然初始ph、温度37℃、发酵时间48h、转速为200rpm。(4)单因素实验按照表1的条件进行发酵,取发酵液离心(10000r/min,5min)后,取出测定各个发酵样品的氨基酸态氮、多肽和氨态氮的含量。表1一、氨基酸态氮含量的测定(gb5009.235-2016)1、标准曲线的制作精密吸取氨氮标准使用溶液0ml、0.05ml、0.1ml、0.2ml、0.4ml、0.6ml、0.8ml、1.0ml分别于10ml比色管中。向各比色管分别加入4ml乙酸钠-乙酸缓冲溶液(ph4.8)及4ml显色剂,用水稀释至刻度,混匀。置于100℃水浴中加热15min,取出,水浴冷却至室温后,移入1cm比色皿内,以零管为参比,于波长400nm处测量吸光度,绘制标准曲线或计算线性回归方程。2、试样的测定首先将待测样品稀释至合适倍数,混匀备用。精密吸取2ml试样稀释溶液于10ml比色管中。加入4ml乙酸钠-乙酸缓冲溶液(ph4.8)及4ml显色剂,用水稀释至刻度,混匀。置于100℃水浴中加热15min,取出,水浴冷却至室温后,移入1cm比色皿内,以零管为参比,于波长400nm处测量吸光度。测定结果与标准曲线比较定量或代入线性回归方程求出相应的氮含量,再乘以样品在整个过程中的稀释倍数,最终结果折算成氮含量单位为g/l。二、多肽含量的测定1、标准曲线的制作按表2在试管中加入一定量的20mg·ml-1牛血清蛋白溶液,其中不足1ml的用蒸馏水补至1ml,以1ml的蒸馏水为空白,最后向各试管中加入的双缩脲试剂4ml,充分混匀,室温下反应30min,然后用酶标仪在540nm处测其吸光值,绘制标准曲线。表2标准曲线的制定2、试样的测定取1ml发酵上清液,加入10%三氯乙酸1ml,混匀,静置10min,5000r/min离心15min,取1ml上清液于另一试管中,再加入4ml双缩脲试剂,混匀后室温下静置30min,在540nm处测定吸光值,以加1ml蒸馏水和4ml双缩脲试剂作空白,测定吸光值。与标准曲线比较定量,换算得出发酵上清液中多肽浓度。三、氨态氮含量的测定1、标准曲线的制作按照表3依次加入各种试剂,充分混合后,放入37℃水浴显色20min,取出后用水冷却至室温,在637nm下测定其吸光值。表3标准曲线的制定管号溶液a/ml标准液/μl水/μl溶液b/ml050100515109052520805353070545406055550505656040575703058580205959010510510005氨态氮标准液:精确称取0.2358g硫酸氨溶于水,定容至100ml,即为原液,其含氨态氮质量浓度为500mg·l-1;精确吸取1ml原液稀释至10ml,即为标准液,其含氨态氮质量浓度为50mg·l-1。溶液a:精确称取5.00g苯酚,溶于400ml水,加入2.0ml的亚硝基铁氰化钠溶液(1.25%),定容至500ml。溶液b:称取2.50gnaoh、2.0g柠檬酸三钠和3.5mlnaclo溶于400ml水中,并定容至500ml。2、试样的测定取适量样品(含氮量在0.50~5.0μg),其他操作同标准曲线。测定结果与标准曲线比较定量或代入线性回归方程求出相应的氨态氮含量。四、实验结果1、plackett-burman试验设计按照表4进行plackett-burman试验设计,分别进行实验,结果如表5所示。表4表5表6注:*显著水平(p<0.05);**极显著水平(p<0.01)由表6的结果可知,选择a、d、f、g为主要的影响因素进行正交实验。2、正交实验设计按照表7的正交实验设计进行实验,实验结果具体如表8和表9所示。表7水平a料液比dphf温度(℃)g时间(h)166.23124277.23436388.23748表8表9氨基酸态氮多肽氨态氮a2d1f3g25.62070.33573.7235a2d3f3g23.57540.30263.0977a3d1f3g25.68610.107074.1846优化前2.31920.29673.7785由图1和图2可知外加碳源和氮源使氨基酸态氮含量增加不明显,且氨态氮含量较高,因此从节约成本的角度选择不另外添加碳源和氮源。结合表8和表9的结果,选择组合a2d1f3g2,在选择的工艺条件(料液比1:7,nacl添加量5g/l,接种量5%,ph6.2,转速180rpm,37℃,36h)下,氨基酸态氮、多肽的含量分别比优化前提高了142.4%、13.14%,氮态氮含量减少了1.5%。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1