生物分子的纯化的制作方法
本申请要求提交日期为2012年6月29日的美国临时专利申请第61/666,521号、提交日期为2012年6月29日的美国临时专利申请第No.61/666,561、提交日期为2012年6月29日的美国临时专利申请第61/666,329号以及提交日期为2012年7月2日的欧洲专利申请EP12004909.3的优先权,各自整体援引加入本文。
技术领域:
本发明提供用于纯化包括治疗抗体和包含Fc的蛋白在内的生物分子的创造性和高效的方法和系统。
背景技术:
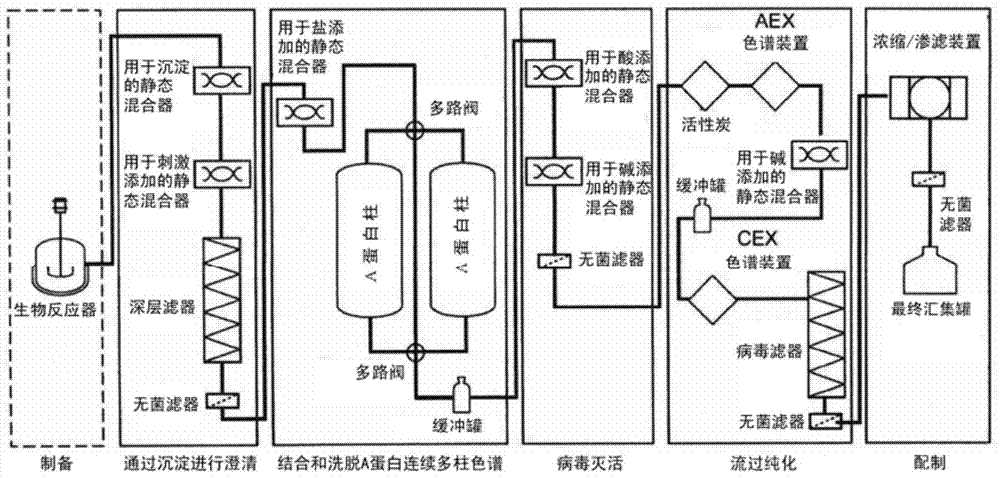
:生物分子,例如包括抗体、肽或激素在内的治疗蛋白的高效和经济的大规模生产对于生物技术和制药工业是越来越重要的考虑因素。一般来说,纯化过程相当复杂和昂贵,并且包括许多不同步骤。通常,利用细胞培养方法产生蛋白,例如,利用重组工程化以产生所关注的蛋白的哺乳动物或细菌细胞系。一般来说,靶蛋白表达之后,其与一种或多种杂质如宿主细胞蛋白、培养基组分和核酸的分离提出了艰巨的挑战。如果治疗蛋白是用于人,则这样的分离和纯化尤其重要,并且必须由监管机构如食品和药物管理局(FDA)批准。现在用于纯化蛋白的常规方法通常至少包括以下步骤:(a)用于去除细胞和细胞碎片的澄清步骤,例如利用差速离心和/或过滤;以及(b)一个或多个下游色谱步骤以分离所关注的蛋白与澄清的细胞培养进料中的各种杂质。虽然发酵和细胞培养过程可以以分批或补料分批模式或者连续(例如连续灌注过程的形式)运行,下游纯化过程通常作为批过程(常常甚至物理和逻辑分离)运行。在每个加工步骤之间,通常将样品储存在盛放或汇集罐(pooltank)或者储液器中以改变溶液条件,以便使其适合下一加工步骤。结果,需要大容器以储存中间产物。这导致高成本以及非常有限的制造灵活性和机动性。此外,进行许多分离批加工步骤是劳动力和成本密集以及耗时的。在单克隆抗体的情况下,纯化方法的行业标准通常包括“模板化”方法,其包括几个单元操作。单元操作之一是纯化步骤,其采用称作A蛋白、分离自金黄色葡萄球菌(Staphylococcusaureus)并结合抗体的Fc区的亲和配体。额外的单元操作通常与A蛋白单元操作联用,并且大部分生物制药公司采用使用单元操作非常相似的方法模板,而单元操作的顺序可以有一些变化。现在工业中使用的示例性模板化方法在图1中示出。这个模板的关键方面是细胞收获步骤,其通常包括使用离心以从细胞培养液去除细胞和细胞碎片,然后进行深层过滤。细胞收获步骤之后通常是A蛋白亲和纯化步骤,然后是病毒灭活。病毒灭活之后通常是一个或多个色谱步骤,也称作抛光步骤,其通常包括一个或多个阳离子交换色谱和/或阴离子交换色谱和/或疏水相互作用色谱和/或混合模式色谱和/或羟基磷灰石色谱。抛光步骤之后是病毒过滤和超滤/渗滤,这完成模板化方法。参见例如,Shuklaetal.,J.ChromatographyB.,848(2007)28-39;Liuetal.,MAbs,2010:Sep-Oct2(5):480-499。一般来说,在中间体汇集罐中收集过滤操作的流出液和色谱操作的洗脱物并经常储存过夜,直至下一单元操作。完成这个过程所需要的时间可以长达4-7天。本发明提供改良的模板化方法,其克服目前工业使用的模板化方法的几个缺点。技术实现要素:本发明提供方法和系统,其提供优于现在工业中使用的典型模板化方法的几个优势。本文所述的模板化方法和系统包括以连续或半连续方式连接的单元操作,并且排除了通常使用储存罐的某些单元操作之间对汇集罐(也称作储存罐)的需要。或者,仅采用缓冲罐。由于某些加工步骤的特定组合,本文所述的方法和系统需要比工业中使用的典型方法更少的步骤,并且还显著地减少总纯化过程的时间而对产物收率没有不利影响。在本发明的一方面,提供从样品纯化靶分子的方法。在一些实施方案中,这样的方法包括以下步骤:(a)提供包含靶分子以及一种或多种杂质的样品;(b)将至少一种沉淀剂添加至所述样品并去除一种或多种杂质,从而回收澄清的样品;(c)使来自步骤(b)的澄清的样品进行包含至少两个分离单元的结合和洗脱色谱步骤,每个分离单元包含相同的介质,从而获得包含所述靶分子的洗脱物;以及(d)使所述洗脱物进行流过纯化,所述流过纯化包括使用两种或更多种介质;其中至少两个步骤在它们的至少一部分持续时间中同时进行,并且其中所述方法包含单一的结合和洗脱色谱步骤。在一些实施方案中,在整个方法中液体的流动是连续的,即所述方法为连续方法。在一些实施方案中,所述方法在上文的步骤(c)和(d)之间包括病毒灭活步骤。如本文所述,病毒灭活步骤包括使用选自酸、去污剂、溶剂的病毒灭活剂和温度变化。在一些实施方案中,病毒灭活步骤采用一个或多个在线(in-line)静态混合器。在其他实施方案中,病毒灭活步骤包括使用一个或多个缓冲罐。在一些实施方案中,靶分子为抗体,例如单克隆抗体或多克隆抗体。在一些实施方案中,本文所述方法中采用的沉淀剂为刺激响应性聚合物。优选的刺激响应性聚合物为改性的聚烯丙基胺聚合物,其对磷酸盐刺激响应。其他示例性沉淀剂包括但不限于例如酸、辛酸、絮凝剂和盐。在一些实施方案中,添加沉淀剂之后采用一个或多个深层滤器去除杂质。在其他实施方案中,采用离心去除一种或多种杂质。沉淀并去除一种或多种杂质之后,使澄清的样品进行单一的结合和洗脱色谱步骤,例如上文提到的步骤(c),其通常采用至少两个分离单元。在一些实施方案中,结合和洗脱色谱步骤采用连续多柱色谱(CMC)。在一优选实施方案中,结合和洗脱色谱步骤为亲和色谱步骤(例如,A蛋白亲和色谱)。在其他实施方案中,结合和洗脱色谱步骤包括使用阳离子交换(CEX)结合和洗脱色谱步骤或者混合模式色谱步骤。在一些实施方案中,结合和洗脱色谱步骤(例如,A蛋白亲和色谱)在装载步骤中采用添加剂,从而导致减少或消除使用的中间洗涤步骤的数量。示例性添加剂包括盐、去污剂、表面活性剂和聚合物。在一些实施方案中,添加剂为盐(例如,0.5MNaCl)。在一些实施方案中,起始样品为细胞培养物。这样的样品可以在生物反应器中提供。在一些实施方案中,样品在除生物反应器以外的容器中提供,例如,如本文所述,可以在进行纯化过程之前将其从生物反应器转移至另一容器。在一些实施方案,将上文步骤(b)中使用的沉淀剂直接添加至包含细胞培养物的生物反应器中。在其他实施方案中,将沉淀剂添加至除生物反应器以外的容器,其中所述容器包含含有靶分子的样品。在一些实施方案中,利用静态混合器添加沉淀剂。在一些优选实施方案中,本文所述的方法包括流过纯化过程操作,其采用两种或更多种选自以下的介质:活性炭、阴离子交换色谱介质和阳离子交换色谱介质。在一些实施方案中,这样的流过纯化操作额外地包括病毒过滤步骤,其采用病毒过滤膜。本文所述的方法避免需要在各个加工步骤之间使用汇集罐。在一些实施方案中,本发明的方法包括使用一个或多个缓冲罐。本文所述的方法可以额外地包括配制步骤。在一些实施方案中,这样的配制步骤包括渗滤、浓缩和灭菌。如上文所述,本文所述的方法包括流过纯化操作,其通常采用两种或更多种介质。在一些实施方案中,本文所述方法中使用的流过纯化过程操作包括以下步骤,其中所有步骤均以流过模式进行:(a)使来自A蛋白色谱柱的洗脱物与活性炭接触;(b)使来自步骤(a)的流过样品与阴离子交换色谱介质接触;(c)使来自步骤(b)的流过样品与阳离子交换色谱介质接触;以及(d)获得来自步骤(c)的包含靶分子的流过样品,其中步骤(d)之后,过样品中一种或多种杂质的水平低于步骤(a)中洗脱物中的水平。上文所述的步骤(a)-(c)可以以任何顺序进行。在一些实施方案中,流过纯化步骤还包括病毒过滤步骤,其中来自步骤(c)的流过样品直接流入病毒过滤步骤。在一些实施方案中,在步骤(b)和步骤(c)之间需要溶液改变,其中溶液改变采用在线静态混合器和/或缓冲罐以改变pH。在一些实施方案中,整个流过纯化操作采用单一的滑道。在一些实施方案中,在使洗脱物与活性炭接触之前使来自A蛋白色谱步骤的洗脱物进行病毒灭活步骤。在本文所述的一具体实施方案中,提供一种从样品纯化靶分子的方法,其中所述方法包括以下步骤:(a)提供包含细胞培养物的生物反应器;(b)将沉淀剂添加至所述生物反应器并去除一种或多种杂质,从而获得澄清的样品;(c)使所述澄清的样品进行采用至少两个分离单元的A蛋白亲和色谱步骤,从而获得洗脱物;(d)利用在线静态混合器或缓冲罐使来自步骤(c)的洗脱物接受病毒灭活剂;(e)使病毒灭活之后的洗脱物与流过纯化操作接触,所述纯化操作包括使洗脱物以流过模式与活性炭接触,然后与阴离子交换色谱介质接触,然后与在线静态混合器和/或缓冲罐接触以改变pH,然后与阳离子交换色谱介质接触,然后与病毒过滤介质接触;以及(f)将来自步骤(d)的流过样品以期望的浓度配制于期望缓冲液中,其中加工步骤连接以互相流体连通,从而样品可以连续地从一个加工步骤流至下一个加工步骤,并且其中至少两个加工步骤(b)-(f)在它们的至少一部分持续时间中同时进行。在本文所述的一些实施方案中,提供一种从样品纯化靶分子的方法,其中所述方法包括以下步骤:(a)提供包含细胞培养物的生物反应器;(b)将沉淀剂添加至所述生物反应器并去除一种或多种杂质,从而获得澄清的样品;(c)将一种或多种选自以下的添加剂添加至所述澄清的样品:盐、去污剂、表面活性剂和聚合物;(d)使所述澄清的样品进行采用至少两个分离单元的A蛋白亲和色谱步骤,从而获得洗脱物;(e)利用在线静态混合器或缓冲罐使来自步骤(d)的洗脱物接受病毒灭活剂;(f)使病毒灭活之后的洗脱物与流过纯化操作接触,所述纯化操作包括使洗脱物以流过模式与活性炭接触,然后与阴离子交换色谱介质接触,然后与在线静态混合器和/或缓冲罐接触以改变pH,然后与阳离子交换色谱介质接触,然后与病毒过滤介质接触;以及(g)将来自步骤(f)的流过样品以期望的浓度配制于期望缓冲液中,其中加工步骤连接以互相流体连通,从而样品可以连续地从一个加工步骤流至下一个加工步骤,并且其中至少两个加工步骤(b)-(g)在它们的至少一部分持续时间中同时进行。在一些实施方案中,步骤(c)中的添加剂为0.5MNaCl。如本文所述,本文还提供用于纯化方法的系统。在一些实施方案中,系统包括:(a)生物反应器;(b)包含一个或多个深层滤器的过滤装置;(c)一个结合和洗脱色谱设备;以及(d)包含至少一个流过阴离子交换装置的流过纯化系统,其中在过程运行期间液体连续地流过(a)-(d)中的装置,其中所述装置连接以互相液体连通。在一些实施方案中,系统中的各种装置之间有连接管路。装置在线连接,从而系统中的每个装置与系统中该装置之前和之后的装置流体连通。在一些实施方案中,本发明的系统中使用的生物反应器为抛弃式或一次性生物反应器。在一些实施方案中,系统封闭在无菌环境中。在一些实施方案中,结合和洗脱色谱设备包括至少两个分离单元,每个单元包含相同的色谱介质,例如A蛋白亲和介质。在一具体实施方案中,A蛋白介质包含偶联至刚性亲水性聚乙烯醚聚合物介质的A蛋白配体。在其他实施方案中,A蛋白配体偶联至琼脂糖或可控多孔玻璃。A蛋白配体可以基于天然存在的来自金黄色葡萄球菌的A蛋白的结构域,或者是天然存在的结构域的变体或片段。在一具体实施方案中,A蛋白配体源自金黄色葡萄球菌A蛋白的C结构域。在其他实施方案中,结合和洗脱色谱设备包括至少三个分离单元。所述分离单元连接以互相流体连通,从而液体可以从一个分离单元流至下一个。在其他实施方案中,结合和洗脱色谱步骤在装载步骤期间于澄清的细胞培养物中采用添加剂,其中包含添加剂减少或消除洗脱步骤之前对一个或多个洗涤步骤的需要。在一些实施方案中,流过纯化系统额外地包含活性炭装置和阳离子交换(CEX)流过色谱装置。在一些实施方案中,流过纯化系统还包含病毒过滤装置。在一些实施方案中,整个流过纯化系统采用单一的滑道。附图说明图1为工业中使用的常规纯化方法的示意图。图2是如本文所述的示例性纯化方法的示意图。所示的纯化方法使用生物反应器用于细胞培养,然后进行以下加工步骤:澄清;A蛋白结合和洗脱色谱(捕获);病毒灭活;流过纯化;以及配制。如图所示,每个加工步骤采用一种或多种装置,用来达到加工步骤的预期结果。如图所示,澄清采用沉淀和深层过滤;利用连续多柱色谱(CMC)进行A蛋白结合和洗脱色谱;病毒灭活采用两个在线静态混合器;流过纯化采用活性炭(AC),然后是阴离子交换(AEX)色谱,然后利用在线静态混合器和缓冲罐进行pH改变,然后流过阳离子交换(CEX)色谱和病毒过滤;而配制采用渗滤/浓缩切向流过滤装置,然后进行无菌过滤。在整个过程中还采用一个或多个无菌滤器。图3为示出实验结果的图,所述实验测量图2中方法的澄清步骤期间使用的每个深层滤器(第一和第二)和无菌滤器的压力。X-轴表示滤器负荷(L/m2),顶部的X-轴指无菌滤器的负荷,而底部的X-轴指两个深层滤器的负荷;并且Y-轴表示以psi计的压力。图4为示出实验结果的图,所述实验测量开始装载在A蛋白连续多柱色谱(CMC)上之前,深层过滤之后HCP和MAb的突破。X-轴表示深层滤器负荷(L/m2),左边的Y-轴表示MAb浓度(mg/mL),而右边的Y-轴表示HCP浓度(μg/mL)。图5是如实施例3进一步描述的流过纯化加工步骤的示意图。图6为示出实验结果的图,所述实验测量深层滤器、活性炭和病毒过滤之后的压力特征谱。Y-轴表示压力(psi),而X-轴表示以小时计的时间。图7为示出实验结果的图,所述实验测量AEX装载之后的HCP突破。Y-轴表示HCP浓度(ppm)而X-轴表示AEX装载(kg/L)。图8为示出实验结果的图,所述实验测量流过纯化操作期间MAb聚集体的去除作为病毒过滤装置装载的函数。X-轴表示病毒过滤装载(kg/m2),而Y-轴表示病毒过滤之后样品中MAb聚集体的百分比。图9为示出实验结果的图,所述实验测量流过纯化操作期间活性炭之后和病毒过滤之前的压力特征谱。X-轴表示以小时计的时间,而Y-轴表示以psi计的压力。图10为示出实验结果的图,所述实验测量pH和电导率特征谱,其中在活性炭之前和在CEX流过装置之前测量pH,并且在CEX流过装置之前测量电导率。左边的Y-轴表示pH,右边的Y-轴表示电导率(mS/cm),而X-轴表示以小时计的时间。图11是利用CMC(其采用两个分离单元)的未处理的澄清MAb04的A蛋白捕获的色谱图。图12是利用CMC(其采用两个分离单元)的智能聚合物澄清的MAb04的A蛋白捕获的色谱图。图13是利用CMC(其采用两个分离单元)的辛酸澄清的MAb04的A蛋白捕获的色谱图。图14为示出实验结果的图,所述实验研究作为流过纯化操作的部分,停留时间对利用活性炭和阴离子交换色谱(AEX)装置去除HCP的影响。Y-轴表示HCP浓度(ppm),而X-轴表示AEX装载(kg/L)。图15为示出实验结果的图,所述实验测量在流过纯化操作中于流过阴离子交换色谱和阳离子交换色谱步骤之间使用缓冲罐之后对pH峰的影响。X-轴表示pH,而Y-轴表示以小时计的时间。图16是用于证实以连续方式运行流过纯化操作对产物纯度没有不利影响的实验设置的示意图描述。图17为示出实验结果的图,所述实验研究以连续方式和分批模式使用病毒过滤装置之后,病毒过滤之后的压力特征谱。Y-轴表示以psi计的压力,而X-轴表示以小时计的加工时间。图18为示出实验结果的图,所述实验研究流速对病毒过滤装置的生产量的影响。Y-轴表示压降(psi),而X-轴表示病毒过滤装置的生产量(kg/m2)。图19示出批#1712的MAb5在pH5.0和3分钟停留时间下的色谱图。如图19所示,大部分的产物在流过中收集,并且这通过蛋白UV痕迹相对快速的突破显示。带峰大小一般基于条件和装载的总质量变化,但是其相对富集95.6%的聚集体物质,相比之下装载材料仅具有5.5%聚集体。图20为示出来自用刺激响应性聚合物和/或NaCl处理的细胞培养物的A蛋白纯化色谱图的洗脱(120至130ml之间的第一峰)和再生(140ml左右)峰的图。还示出没有任何处理的对照。X-轴表示通过A蛋白柱的体积,而Y-轴表示在280nm波长处的吸光度。图21为示出HCPLRV作为A蛋白色谱期间中间洗涤或装载步骤中使用的NaCl浓度的函数的条形图。X-轴表示以摩尔(M)计的NaCl浓度,而Y-轴表示HCPLRV。图22为示出产物(MAb)回收百分比作为A蛋白色谱期间中间洗涤或装载步骤中使用的NaCl浓度的函数的条形图。X-轴表示以M计的NaCl浓度,而Y-轴表示Mab回收百分比。图23为示出HCP浓度(以百万分数(ppm)计)作为A蛋白色谱期间中间洗涤或装载步骤中包括的添加剂的函数的条形图。X-轴表示包括的添加剂,而Y-轴表示以ppm计的HCP浓度。图24为示出HCPLRV作为A蛋白色谱期间中间洗涤步骤或装载步骤中包括的添加剂的函数的条形图。X-表示包括的添加剂,而Y-表示HCPLRV。图25为示出添加剂洗脱混合物体积比对照洗脱混合物体积的比例作为A蛋白色谱期间中间洗涤步骤或装载步骤中包括的添加剂的函数的条形图。X-表示包括的添加剂,而Y-轴表示添加剂洗脱混合物体积比对照洗脱混合物体积的比例。具体实施方式本发明提供方法和系统,其克服与工业中用于纯化生物分子如抗体的典型模板化方法相关的几个缺点。如上文所讨论的,用于纯化生物分子的典型模板化方法包括许多不同步骤,包括一个或多个色谱步骤,需要在步骤之间使用盛放或汇集罐以及花费几个小时至几天来完成。已有一些努力以摆脱典型模板化方法。例如,PCT专利公开号WO2012/014183讨论了蛋白纯化的方法,其中将两个或更多个色谱分离模式在线组合。此外,美国专利公开号2008/0269468讨论了将连续灌注发酵系统与连续颗粒去除系统和连续纯化系统组合,其中将混合物通过整个过程的流速基本上保持恒定。此外,PCT公开号WO2012/051147讨论了蛋白纯化的方法,但是看来并未描述连续或半连续方法。最后,PCT公开号WO2012/078677描述了制备生物分子的连续方法;但是,看来依赖于利用多阀阵列。此外,上述PCT公开也并未教导或建议使用本文所述的所有加工步骤。例如,看来并未教导或建议流过纯化操作,其包括多个流过步骤,包括例如使用流过活性炭装置、流过AEX介质、流过CEX介质和流过病毒滤器。事实上,PCT公开号WO2012/078677并未教导或建议以流过模式进行的阳离子交换色谱步骤。最后,上述PCT也未描述如本文所述的方法,使用单一的结合和洗脱色谱步骤且可以以最小干预成功进行的连续方法。因此,虽然看来具有以连续模式进行的纯化方法是可取的,但是难以实现高效的连续方法,这是由于与连接几个单独的单元操作以连续或甚至半连续模式用最小干预(例如,较少的溶液调整(例如,pH和/或电导率的改变))运行相关的复杂性。但是,本发明能够确切地实现这些。本发明还提供优于现在工业中使用的常规方法的其他优势,例如,减少加工步骤的数量以及避免需要在加工步骤之间使用大汇集罐用于溶液调整。在本文所述的方法和系统的情况下,不需要进行大体积稀释以改变电导率,从而避免需要在加工步骤之间使用大汇集罐。此外,在一些实施方案中,与本领域使用的常规方法相比,本文所述的方法和系统采用较少的控制/监测设备(也称作“滑道”),其通常与每个单一的加工步骤相关。在一些实施方案中,本发明还提供这样的方法,其在A蛋白色谱的装载步骤期间包括添加剂,通过从装载步骤直接进行至洗脱步骤或者通过减少装载步骤和洗脱步骤之间洗涤步骤的数量,使得减少或消除一个或多个中间洗涤步骤,但不牺牲产物纯度。虽然美国专利公开号20130096284讨论了在装载至A蛋白色谱柱上的样品中包括氨基酸或盐,但上述公开看来并未教导或建议如本文所述,以多柱连续或半连续模式使用这样的A蛋白色谱步骤。取而代之,其讨论了以分批、单柱模式进行A蛋白步骤。本发明证实甚至在消除或减少A蛋白色谱步骤期间进行的洗涤步骤的数量时,仍观察到杂质如HCP水平的降低,不牺牲产物纯度。为了可以更容易地理解本发明,首先定义某些术语。额外的定义在整个详细说明书中示出。定义在详细描述本发明之前,应当理解本发明并不限于具体组合物或加工步骤,因此可以变化。必须注意,当用于本说明书和所附权利要求时,除非上下文另有明确规定,单数形式“a”、“an”和“the”包括复数指称。因此,例如,所指的“配体”包括多个配体,并且所指的“抗体”包括多个抗体等。除非另有定义,本文所用的所有技术和科学术语均具有与本发明所涉及领域的技术人员通常理解的相同的含义。为了如本文所述的发明的目的定义以下术语。如本文所用,术语“靶分子”或“靶化合物”指利用本发明所述的方法或系统从样品中的一种或多种杂质分离、分开或纯化的任何分子、物质或化合物或者它们的混合物。在各种实施方案中,靶分子为生物分子,例如一种蛋白或者两种或更多种蛋白的混合物。在一具体实施方案中,靶分子为包含Fc-区的蛋白如抗体。术语“抗体”指具有特异性地结合抗原的能力的蛋白。通常,抗体具有基本的由两条重链和两条轻链组成的4-多肽链结构,所述链例如通过链间二硫键来稳定。抗体可以是单克隆或多克隆的,并且可以以单体或聚合物形式存在,例如以五聚体形式存在的IgM抗体和/或以单体、二聚体或多聚体形式存在的IgA抗体。抗体还可以包括多特异性抗体(例如,双特异性抗体),以及抗体片段,只要它们保留,或者修饰以包含配体特异性结合结构域。术语“片段”指包含比完整或完全抗体或抗体链少的氨基酸残基的部分(part)或部分(portion)抗体或抗体链。可以通过化学或酶促处理完整或完全抗体或抗体链来获得片段。还可以通过重组方式获得片段。当重组制备时,片段可以单独表达,或者作为称为融合蛋白的较大蛋白的部分来表达。示例性片段包括Fab、Fab'、F(ab')2、Fc和/或Fv片段。在一些实施方案中,包含Fc-区的蛋白为重组蛋白,其包括融合至另一多肽或其片段的免疫球蛋白的Fc区。示例性多肽包括例如肾素;生长激素,包括人生长激素和牛生长激素;生长激素释放因子;甲状旁腺激素;促甲状腺激素;脂蛋白;α-1-抗胰蛋白酶;胰岛素α-链;胰岛素β-链;胰岛素原;促卵泡激素;降钙素;黄体生成素;胰高血糖素;凝血因子如因子VIIIC、因子IX、组织因子和血管性血友病因子;抗凝血因子如C蛋白;心钠素;肺表面活性剂;纤溶酶原激活物,如尿激酶或者人尿或组织型纤溶酶原激活物(t-PA);铃蟾肽;凝血酶;造血生长因子;肿瘤坏死因子-α和-β;脑啡肽酶;RANTES(调节激活正常T-细胞表达和分泌因子);人巨噬细胞炎性蛋白(MIP-1-α);血清白蛋白如人血清白蛋白;苗勒氏抑制物质;松弛素α-链;松弛素β-链;松弛素原;小鼠促性腺激素相关肽;微生物蛋白,如β-内酰胺酶;DNase;IgE;细胞毒性T-淋巴细胞相关抗原(CTLA)(例如,CTLA-4);抑制素;激活蛋白;血管内皮生长因子(VEGF);激素或生长因子的受体;A蛋白或D蛋白;类风湿因子;神经营养因子如骨源性神经营养因子(BDNF),神经营养蛋白-3、-4、-5或-6(NT-3、NT-4、NT-5或NT-6),或者神经生长因子如NGF-β.;血小板衍生生长因子(PDGF);成纤维细胞生长因子如αFGF和βFGF;表皮生长因子(EGF);转化生长因子(TGF)如TGF-α和TGF-β,包括TGF-βl、TGF-β2、TGF-β3、TGFβ4或TGF-β5;胰岛素样生长因子-I和-II(IGF-I和IGF-II);des(1-3)-IGF-I(脑IGF-I),胰岛素样生长因子结合蛋白(IGFBP);CD蛋白如CD3、CD4、CD8、CD19、CD20、CD34和CD40;促红细胞生成素;骨诱导因子;免疫毒素;骨形态发生蛋白(BMP);干扰素如干扰素-α、-β和-γ;集落刺激因子(CSF),例如M-CSF、GM-CSF和G-CSF;白介素(IL),例如IL-I至IL-IO;超氧化物歧化酶;T-细胞受体;表面膜蛋白;衰变加速因子;病毒抗原,例如部分AIDS包膜;转运蛋白;归巢受体;地址素;调节蛋白;整联蛋白如CDlIa、CDlIb、CDlIc、CD18、ICAM、VLA-4和VCAM;肿瘤相关抗原如HER2、HER3或HER4受体;以及任何上文所列的多肽的片段和/或变体。此外,可以利用本文所述的方法纯化的抗体可以特异性地结合至任何上文所列的多肽。如本文所用,并且除非另有说明,术语“样品”指包含靶分子的任何组合物或混合物。样品可以源自生物或其他来源。生物来源包括真核和原核来源,例如植物和动物细胞、组织和器官。样品还可以包括发现与靶分子混合的稀释剂、缓冲剂、去污剂以及污染物质、碎片等。样品可以是“部分纯化的”(即,已进行一个或多个纯化步骤,如过滤步骤),或者可以直接获得自产生靶分子的宿主细胞或生物(例如,样品可以包含收获的细胞培养液)。在一些实施方案中,样品为细胞培养物进料。如本文所用,术语“杂质”或“污染物”指任何外源或有害分子,包括生物大分子如DNA、RNA,一种或多种宿主细胞蛋白,内毒素,脂质以及一种或多种添加剂,其可以存在于包含利用本发明的方法分离自一种或多种外源或有害分子的靶分子的样品中。此外,这类杂质可以包括用于在本发明的方法之前进行的步骤的任何试剂。杂质的性质可以是可溶性的或不溶性的。如本文所用,术语“不溶性杂质”指包含靶分子的样品中存在的任何不期望的或有害的实体,其中所述实体为悬浮颗粒或固体。示例性不溶性杂质包括全细胞、细胞片段和细胞碎片。如本文所用,术语“可溶性杂质”指包含靶分子的样品中存在的任何不期望的或有害的实体,其中所述实体不是不溶性杂质。示例性可溶性杂质包括宿主细胞蛋白(HCP)、DNA、RNA、病毒、内毒素、细胞培养基组分、脂质等。术语“中国仓鼠卵巢细胞蛋白”和“CHOP”在本文中可交换地用来指源自中国仓鼠卵巢(“CHO”)细胞培养物的宿主细胞蛋白(“HCP”)的混合物。HCP或CHOP一般作为杂质存在于细胞培养基或裂解物中(例如,收获的包含靶分子如CHO细胞中表达的抗体或免疫粘附素的细胞培养液(“HCCF”))。包含靶分子的混合物中存在的CHOP的量提供靶分子纯度的度量。HCP或CHOP包括但不限于宿主细胞如CHO宿主细胞表达的所关注的蛋白。通常,蛋白混合物中CHOP的量以相对于混合物中靶分子的量的百万分比表示。应当理解当宿主细胞为另一细胞类型时,例如除CHO之外的哺乳动物细胞、大肠杆菌(E.coli)、酵母、昆虫细胞或植物细胞,HCP指在该宿主细胞的裂解物中发现的除靶蛋白之外的蛋白。术语“百万分数”或“ppm”在本文中可交换地用来指利用本文所述的方法纯化的靶分子的纯度的度量。单位ppm指以纳克/毫克计的HCP或CHOP的量每以毫克/毫升计的靶分子(即,(CHOPng/mL)/(靶分子mg/mL),其中靶分子和HCP在溶液中)。如本文所用,术语纯化“(purifying)”、“纯化(purification)”、“分开(separate)”、“分开(separating)”、“分开(separation)”、“分离(isolate)”、“分离(isolating)”或“分离(isolation)”指增加来自包含靶分子以及一种或多种杂质的样品的靶分子的纯度。通常,通过从样品去除(完全或部分)至少一种杂质来增加靶分子的纯度。如本文所用,术语“结合和洗脱模式”以及“结合和洗脱方法”指分离技术,其中样品中包含的至少一种靶分子(例如,包含Fc区的蛋白)结合至合适的树脂或介质(例如,亲和色谱介质或阳离子交换色谱介质)并且随后洗脱。在本文中可交换使用的术语“流过(flow-through)方法”、“流过模式”和“流过操作”指分离技术,其中生物药物制剂中包含的至少一种靶分子(例如,包含Fc-区的蛋白或抗体)与一种或多种杂质预期流过材料,所述材料通常结合一种或多种杂质,其中靶分子通常不结合(即,流过)。在本文中可交换使用的术语“加工步骤”或“单元操作”指在纯化过程中使用一种或多种方法或装置以实现某种结果。可以在本文所述的方法和系统中采用的加工步骤或单元操作的实例包括但不限于澄清、结合和洗脱色谱、病毒灭活、流过纯化(包括以流过模式使用两种或更多种选自以下的介质:活性炭、阴离子交换和阳离子交换)以及配制。应当理解每个加工步骤或单元操作可以采用一个以上的步骤或方法或装置以实现该加工步骤或单元操作的预期结果。例如,在一些实施方案中,如本文所述,澄清步骤和/或流过纯化操作可以采用一个以上的步骤或方法或装置以完成该加工步骤或单元操作。在一些实施方案中,用来进行加工步骤或单元操作的一种或多种装置是一次性使用的装置,并且可以去除和/或置换而不必置换方法中的任何其他装置或甚至不必终止方法运行。如本文所用,术语“系统”一般指整个纯化方法的物理形式,如本文所述,其包括两个或更多个装置以进行加工步骤或单元操作。在一些实施方案中,系统封闭在无菌环境中。如本文所用,术语“分离单元”指设备或装置,其可以用于结合和洗脱色谱分离或者流过步骤或者过滤步骤。例如,分离单元可以是装有吸附剂基质的色谱柱或色谱筒,或者包含具有适当功能性的介质的色谱装置。在本文所述的方法和系统的一些实施方案中,在采用两个或更多个分离单元的纯化方法中使用单一的结合和洗脱色谱步骤。在一优选实施方案中,两个或更多个分离单元包括相同介质。在各种实施方案中,本文所述的方法和系统避免必须使用汇集罐,从而显著减少运行纯化过程的总时间以及系统占用的总物理空间。因此,在本发明的各种实施方案中,来自一个加工步骤(或单元操作)的产出是方法中下一步骤(或单元操作)的输入,并且直接和连续地流入下一加工步骤(或单元操作),不需要从加工步骤收集整个产出。如本文所用,术语“汇集罐”指任何容器、器皿、贮液器、罐或袋,其一般在加工步骤之间使用,并且具有的大小/体积使得能够收集来自加工步骤的整个体积的产出。汇集罐可以用于盛放或储存或操作来自加工步骤的整个体积的产出的溶液条件。在本发明的各种实施方案中,本文所述的方法和系统避免需要使用一个或多个汇集罐。在一些实施方案中,本文所述的方法和步骤可以在整个纯化过程中使用一个或多个缓冲罐。如本文所用,术语“缓冲罐”指在加工步骤之间或加工步骤内(例如,当单一的加工操作包括一个以上的步骤时)使用的任何容器或器皿或袋;其中来自一个步骤的产出流过缓冲罐至下一步。因此,缓冲罐不同于汇集罐,其并不意图盛放或收集来自步骤的整个体积的产出;而是取而代之使得来自一个步骤的产出能够连续流至下一步。在一些实施方案中,在本文所述的两个加工步骤之间或加工步骤(例如,流过纯化操作)内使用的缓冲罐的体积不超过来自加工步骤的产出的整个体积的25%。在另一实施方案中,缓冲罐的体积不超过来自加工步骤的产出的整个体积的10%。在一些其他实施方案中,缓冲罐的体积少于生物反应器中细胞培养物的整个体积的35%、或者少于30%、或者少于25%、或者少于20%、或者少于15%、或者少于10%,所述生物反应器中的细胞培养物构成纯化靶分子的起始原料。如本文所用,术语“连续方法”指纯化靶分子的方法,其包括两个或更多个加工步骤(或单元操作),从而来自一个加工步骤的产出直接流入方法中的下一加工步骤,没有中断和/或不需要在进行下一加工步骤之前收集来自加工步骤的整个体积的产出。在一优选实施方案中,两个或更多个加工步骤可以在它们的至少一部分持续时间中同时进行。换句话说,在连续方法的情况下,如本文所述,不必在下一加工步骤开始之前完成加工步骤,但是一部分样品通常移动通过加工步骤。术语“连续方法”还用于加工操作内的步骤,在这种情况下,在包括多个步骤的加工操作进行期间,样品连续流过进行加工操作所需的多个步骤。本文所述的这样的加工操作的一个实例是流过纯化操作,其包括以连续方式进行的多个步骤,并且采用流过活性炭、流过AEX介质、流过CEX介质和流过病毒过滤中的两个或更多个。在一实施方案中,流过纯化操作按照以下顺序进行:活性炭,然后是AEX介质,然后是CEX介质,然后是病毒过滤。但是,应当理解活性炭、AEX介质和CEX介质可以以任何顺序使用。因此,在一些实施方案中,AEX之后为活性炭,然后是CEX介质;或者可选地,CEX之后为活性炭,然后是AEX介质。在其他实施方案中,活性炭之后为CEX介质,然后是AEX介质。在其他实施方案中,AEX介质之后为CEX介质,然后是活性炭;或者可选地,CEX介质之后为AEX介质,然后是活性炭。如本文所述,连续方法还包括这样的方法,其中任何单一的加工步骤中流体物质的输入或输出是不连续或间断的。这样的方法也可以称作“半连续”方法。例如,在本发明的一些实施方案中,加工步骤(例如,结合和洗脱色谱步骤)中的输入可以连续装载;但是输出可以间歇地收集,其中纯化过程中的其他加工步骤是连续的。因此,在一些实施方案中,本文所述的方法和系统包括至少一个以间歇方式操作的单元操作,而方法或系统中的其他单元操作可以以连续方式操作。术语“连接的方法”指用于纯化靶分子的方法,其中所述方法包括两个或更多个加工步骤(或单元操作),其连接以互相直接流体连通,从而流体材料连续流过方法中的加工步骤,并且在方法的普通操作期间同时与两个或更多个加工步骤接触。应当理解有时,方法中的至少一个加工步骤可以通过屏障如处于关闭位置的阀暂时从其他加工步骤分离。这种单独加工步骤的暂时分离可以是必需的,例如在加工启动或关闭期间或者在去除/置换单独单元操作期间。术语“连接的方法”还用于加工操作内的步骤,其连接以互相流体连通,例如,当加工操作需要进行几个步骤以达到预期的操作结果时(例如,用于本文所述的方法的流过纯化操作)。如本文所用,术语“流体连通”指两个加工步骤之间流体材料的流动或者加工操作的加工步骤之间流体材料的流动,其中加工步骤通过任何合适的方式(例如,连接管路或缓冲罐)连接,从而使得流体能够从一个加工步骤流至另一加工步骤。在一些实施方案中,两个单元操作之间的连接管路可以被一个或多个阀中断以控制流体流过连接管路。连接管路可以为管、软管、管道、渠道的形式,或者使得液体能够在两个加工步骤之间流动的一些其他方式。如本文所用,术语“澄清(clarify)”、“澄清(clarification)”和“澄清步骤”指用于去除悬浮的颗粒和或胶体的加工步骤,从而减少包含靶分子的溶液的浊度,如测量的以NTU(比浊法浊度单位)计的。澄清可以通过各种方式实现,包括离心或过滤。离心可以以分批或连续模式进行,而过滤可以以正常流动(例如深层过滤)或切向流模式进行。在现在工业中使用的方法中,离心之后通常是深层过滤,以去除离心尚未去除的不溶性杂质。此外,可以使用增加澄清效率的方法,例如沉淀。杂质的沉淀可以通过各种方式进行,例如通过絮凝、pH调节(酸沉淀)、温度变化、由于刺激响应性聚合物或小分子的相改变或者这些方法的任何组合。在本文所述的一些实施方案中,澄清包括离心、过滤、深层过滤和沉淀中的两种或更多种的任何组合。在一些实施方案中,本文所述的方法和系统避免需要离心。如本文所用,术语“沉淀(precipitate)”、“沉淀(precipitating)”或“沉淀(precipitation)”指用于澄清的方法,其中改变不期望的杂质的特性,从而它们可以更容易地从可溶性靶分子分离。这通常通过形成包含不期望的杂质的大团聚颗粒和/或不溶性复合物来完成。这些颗粒具有这样的特性(例如密度或大小),从而它们可以更容易地例如通过过滤或离心从包含可溶性靶分子的液相分离。在某些情况下,引起相分离,从而可以更容易地从可溶性靶分子分离不期望的杂质。通过相改变沉淀可以通过添加沉淀剂如聚合物或小分子来实现。在一具体实施方案中,沉淀剂为刺激响应性聚合物,也称为智能聚合物。在本文所述的一些实施方案中,沉淀剂或沉淀试剂为絮凝剂。如本文所用,絮凝是一种进行沉淀的方式,其中性能通常取决于所用的絮凝剂浓度(“剂量依赖性”)。典型的絮凝剂是与带相反电荷的杂质络合的聚电解质,例如聚阳离子。在本文所述的一些实施方案中,澄清采用将沉淀剂添加至包含靶分子以及一种或多种杂质的样品。在某些情况下,溶液条件(例如温度、pH、盐度)的改变可以用来起始沉淀,例如在刺激响应性聚合物的情况下。随后去除包含一种或多种杂质以及沉淀剂的沉淀的物质,从而回收液相中的靶分子,然后通常使液体进行进一步的加工步骤以进一步纯化靶分子。沉淀可以在包含表达待纯化的靶分子的细胞培养物的生物反应器中直接进行,其中将沉淀剂直接添加至生物反应器。或者,可以在单独的容器中将沉淀剂添加至细胞培养物,所述细胞培养物通常包含靶分子。在一些实施方案中,利用静态混合器添加沉淀剂。在沉淀剂为刺激响应性聚合物的情况下,可以利用静态混合器添加聚合物及其响应的刺激。本领域技术人员已知许多方法去除沉淀的物质,例如离心、过滤或沉降或者它们的任何组合。如本文所用,术语“沉降”指沉淀过程,其中沉淀的物质在重力的影响下迁移至容器的底部。沉降之后可以倒出或过滤液相或上清。在本文中可交换使用时,术语“刺激(stimulus)”或“刺激(stimuli)”是指环境中的物理或化学改变,其导致刺激响应性聚合物的应答。因此,这类聚合物对刺激应答,而刺激导致聚合物溶解性的改变。本文所用的一种或多种聚合物应答的刺激的实例包括但不限于例如温度的改变、电导率的改变和/或pH的改变。在一些实施方案中,刺激包括向样品添加络合剂或络合形成盐。在各种实施方案中,一般在向样品添加聚合物之后添加刺激。然而,也可以在向样品添加聚合物期间或之前添加刺激。如本文所用,术语“刺激响应性聚合物”是在添加刺激后表现出物理和/或化学特性改变的聚合物或共聚物。典型的刺激应答是聚合物溶解性的改变。例如,聚合物聚(N-异丙基丙烯酰胺)在低于约35℃的温度下是水溶性的,但是在约35℃的温度下变得不溶于水。在一具体实施方案中,刺激响应性聚合物为改性的聚烯丙基胺(PAA)聚合物,其对多价离子刺激(例如,磷酸盐刺激)应答。关于这种聚合物的进一步的细节可以例如在美国公开号20110313066中找到,其整体援引加入本文。在一些实施方案中,使细胞培养物进行深层过滤以去除一种或多种杂质。如本文所用,术语“深层滤器”或“深层过滤”指能够在整个滤器介质中保留颗粒物质的滤器。在本文所述的一些实施方案中,在澄清加工步骤中使用一个或多个深层滤器。在一些实施方案中,澄清使得去除样品中的可溶性和/或不溶性杂质,所述杂质以后可能污染纯化过程中的加工步骤使用的滤器或装置,从而使得整个纯化过程更经济。在本文所述的各种实施方案中,蛋白纯化过程中包括一个或多个色谱步骤。术语“色谱”指任何种类的技术,其通过差异吸附至介质来从混合物中存在的其他分子分离所关注的分析物(例如,靶分子)。通常,作为在移动相的影响下,或者在结合和洗脱过程中,混合物中不同分子迁移通过静止介质的速率的差异的结果,靶分子从其他分子分离。如本文所用,术语“基质”指任何种类的颗粒吸附剂、珠、树脂或其他固相(例如,膜、无纺布、整体柱等),其通常具有附着至它的官能团或配体。具有附着至它的配体或官能团的基质称作“介质”,在分离过程中,其用作吸附剂以从混合物中存在的其他分子(例如,一种或多种杂质)分离靶分子(例如,包含Fc区的蛋白如免疫球蛋白),或者可选地,用作筛以基于大小分离分子(例如,在病毒过滤膜的情况下)。用于形成基质的材料的实例包括多糖(例如琼脂糖和纤维素);以及其他机械稳定的物质如二氧化硅(例如可控多孔玻璃)、聚(苯乙烯二乙烯基)苯、聚丙烯酰胺、陶瓷颗粒以及任何上述材料的衍生物。在一具体实施方案中,刚性亲水性聚乙烯醚聚合物用作基质。某些介质可以不含配体。可以用于本文所述的方法的不含配体的介质的实例包括但不限于活性炭、羟基磷灰石、二氧化硅等。如本文所用,术语“配体”指连接至基质并决定所述基质的结合特性的官能团。“配体”的实例包括但不限于离子交换基团、疏水相互作用基团、亲水相互作用基团、嗜硫相互作用基团、金属亲和基团、亲和基团、生物亲和基团以及混合模式基团(上述基团的组合)。可以使用的其他示例性配体包括但不限于强阳离子交换基团,如磺丙基、磺酸;强阴离子交换基团,如三甲基氯化铵;弱阳离子交换基团,如羧酸;弱阴离子交换基团,如N5N二乙基氨基或DEAE;疏水相互作用基团,如苯基、丁基、丙基、己基;以及亲和基团,如A蛋白、G蛋白和L蛋白。在一具体实施方案中,用于本文所述的方法和系统的配体包括一个或多个A结构域或者其功能变体或片段,如美国专利公开号201002218442和20130046056所述,两者援引加入本文,其涉及基于B、Z或C结构域的野生型多聚体形式或者A蛋白结构域的多聚体变体(例如,B、Z或C结构域五聚体)的配体。本文所述的配体还表现出减少的Fab结合。术语“亲和色谱”指蛋白分离技术,其中靶分子(例如,所关注的包含Fc区的蛋白或抗体)特异性地结合至配体,所述配体是靶分子特异性的。这样的配体一般共价连接至合适的色谱基质材料,并且在溶液接触色谱基质时对于溶液中的靶分子是可接近的。在一具体实施方案中,配体为A蛋白或其功能变体,固定在刚性亲水性聚乙烯醚聚合物基质上。靶分子一般在色谱步骤期间保留其对配体的特异性结合亲和性,而混合物中的其他溶质和/或蛋白不明显地或特异性地结合至配体。靶分子对固定的配体的结合允许污染的蛋白和杂质通过色谱基质,而靶分子仍然特异性地结合至固相材料上固定的配体。然后将特异性结合的靶分子在合适的条件(例如,低pH、高pH、高盐、竞争配体等)下以其活性形式从固定的配体移除,并且使其通过具有洗脱缓冲液的色谱柱,基本上不含较早允许通过柱的污染的蛋白和杂质。应当理解任何合适的配体均可以用于纯化其相应的特异性结合蛋白,例如抗体。在本发明的一些实施方案中,A蛋白用作配体用于纯化包含Fc区的靶蛋白。从靶分子(例如,包含Fc-区的蛋白)的配体(例如,基于A蛋白)洗脱的条件可以由本领域技术人员容易地确定。在一些实施方案中,G蛋白或L蛋白或者其功能变体可以用作配体。在一些实施方案中,采用配体如A蛋白的方法使用5-9的pH范围用于结合至包含Fc-区的蛋白,然后洗涤或重新平衡配体/靶分子缀合物,然后用包含至少一种盐的具有大约或低于4的pH的缓冲液洗脱。术语“A蛋白”和“ProtA”在本文中可交换使用,并且涵盖从其天然来源回收的A蛋白,合成制备的A蛋白(例如,通过肽合成或通过重组技术),以及保留结合具有CH2/CH3区如Fc区的蛋白的能力的变体。A蛋白可以商购自Repligen,GE或Fermatech。一般将A蛋白固定在色谱基质上。用于本发明的方法和系统的A蛋白的功能衍生物、片段或变体的特征在于对小鼠IgG2a或人IgGl的Fc区至少K=I08M的结合常数,并且优选K=I09M。在本发明的上下文中,具有这样的结合常数值的相互作用柔性称为“高亲和结合”。在一些实施方案中,这类A蛋白的功能衍生物或变体包含至少部分野生型A蛋白的功能IgG结合结构域,选自天然结构域E、D、A、B、C或其工程化突变体,其保留IgG结合功能性。而且,工程化以允许单点连接至固体支持物的A蛋白衍生物或变体也可以用于要求保护的方法的亲和色谱步骤。单点连接一般表示蛋白部分通过单一的共价键连接至A蛋白亲和色谱的色谱支持材料。这样的单点连接还可以通过使用合适的反应残基来进行,将所述反应残基放置在暴露的氨基酸位置,即在环中,接近N-端或C-端或者在蛋白折叠的外周上。合适的反应基团例如巯基或氨基官能。在一些实施方案中,变体的A蛋白衍生物通过多点连接连接至合适的色谱基质。如本文所用,术语“亲和色谱基质”指携带适合亲和色谱的配体的色谱基质。通常配体(例如,A蛋白或者其功能变体或片段)共价连接至色谱基质材料,并且在溶液接触色谱介质时对于靶分子是可接近的。亲和色谱介质的一个实例是A蛋白介质。亲和色谱介质通常基于锁/钥匙机制如抗原/抗体或酶/受体结合以高特异性结合靶分子。携带A蛋白配体的亲和介质的实例包括A蛋白SEPHAROSETM和在本文所述的方法和系统中,亲和色谱步骤可以在整个纯化过程中用作单一的结合和洗脱色谱步骤。在一具体实施方案中,基于A蛋白的配体连接至刚性亲水性聚乙烯醚聚合物基质。在其他实施方案中,这样的配体连接至琼脂糖或可控多孔玻璃。如本文所用,术语“离子交换”和“离子交换色谱”指这样的色谱过程,其中混合物中所关注的溶质或分析物(例如,纯化的靶分子)与连接(例如通过共价连接)至固相离子交换材料的带电荷的化合物相互作用,从而所关注的溶质或分析物非特异性地与带电荷的化合物相互作用,比与混合物中的溶质杂质或污染物相互作用多或少。混合物中的污染溶质比所关注的溶质更快或更慢从离子交换材料的柱洗脱,或者相对于所关注的溶质结合至树脂或从树脂排除。“离子交换色谱”具体包括阳离子交换、阴离子交换和混合模式离子交换色谱。例如,阳离子交换色谱可以结合靶分子(例如,包含Fc区的靶蛋白),然后洗脱(例如,利用阳离子交换结合和洗脱色谱或"CEX"),或者可以主要结合杂质,而靶分子“流过”柱(阳离子交换流过色谱FT-CEX)。阴离子交换色谱可以结合靶分子(例如,包含Fc区的靶蛋白),然后洗脱,或者可以主要结合杂质,而靶分子“流过”柱,也称为负色谱。在一些实施方案中,并且如本文所示的实施例所证实的,以流过模式进行阴离子交换色谱步骤。术语“离子交换介质”指带负电荷(即,阳离子交换介质)或带正电荷(即,阴离子交换介质)的介质。电荷可以通过将一种或多种带电荷的配体例如通过共价键连接至基质来提供。可选地或额外地,电荷可以是基质的固有特性(例如,在二氧化硅的情况下,其具有总体负电荷)。在本文中术语“阴离子交换介质”指带正电荷的介质,例如具有连接至基质的一种或多种带正电荷的配体,如季氨基。可商购的阴离子交换介质包括DEAE纤维素、QAESEPHADEXTM和FASTQSEPHAROSETM(GEHealthcare)。可以用于本文所述的方法和系统的其他示例性材料是EMDTMAE、EMDTMAEhighcap、Q和EMDDEAE(EMDMillipore)。术语“阳离子交换介质”指带负电荷的介质,并且其具有游离的阳离子用于与介质的固相接触的水溶液中的阳离子交换。连接至固相以形成阳离子交换介质的带负电荷的配体可以是例如羧酸盐或磺酸盐。可商购的阳离子交换介质包括羧基-甲基-纤维素、固定在琼脂糖上的磺丙基(SP)(例如,SP-SEPHAROSEFASTFLOWTM或SP-SEPHAROSEHIGHPERFORMANCETM,来自GEHealthcare)以及固定在琼脂糖上的磺酰基(例如来自GEHealthcare的S-SEPHAROSEFASTFLOWTM)。优选EMDSO3、EMDSEHighcap、S和EMDCOO(EMDMillipore)。如本文所用,术语“混合模式色谱”或“多模型色谱”指这样的方法,其采用携带至少两种不同类型的官能团的色谱静止相,每种官能团均能够与所关注的分子相互作用。混合模式色谱一般采用具有一种以上与靶蛋白和/或杂质的相互作用模式的配体。所述配体通常包括至少两个不同但协同的与待结合的物质相互作用的位点。例如,这些位点之一可以与所关注的物质具有电荷-电荷类型相互作用,而另一位点可以与所关注的物质具有电子受体-供体类型相互作用和/或疏水和/或亲水相互作用。电子供体-受体相互作用类型包括氢键、π-π、阳离子-π、电荷转移、偶极子-偶极子以及诱导的偶极子相互作用。通常,基于相互作用总和的差异,可以在一定范围的条件下分离靶蛋白以及一种或多种杂质。术语“混合模式离子交换介质”或“混合模式介质”指用阳离子和/或阴离子和疏水部分共价修饰的介质。可商购的混合模式离子交换介质是BAKERBONDABXTM(J.T.Baker,Phillipsburg,N.J.),其包含弱阳离子交换基团、低浓度的阴离子交换基团以及连接至硅胶固相支持基质的疏水配体。混合模式阳离子交换材料通常具有阳离子交换和疏水部分。合适的混合模式阳离子交换材料为MMC(GEHealthcare)和HCX(EMDMillipore)。混合模式阴离子交换材料通常具有阴离子交换和疏水部分。合适的混合模式阴离子交换材料为Adhere(GEHealthcare)。如本文所用,术语“疏水相互作用色谱”或“HIC”指一种分离分子的方法,其基于所述分子的疏水性,即它们从水性溶液吸附至疏水表面的能力。HIC通常通过特别设计的HIC树脂来与反相(RP)色谱区分,所述HIC树脂与RP树脂相比通常具有较低的疏水性或疏水配体密度。HIC色谱通常依赖于溶质分子表面上的疏水基团的差异。这些疏水基团倾向于结合至不溶性基质表面上的疏水基团。因为HIC采用比反相液相色谱更多极性、更少变性的环境,所以其对于蛋白纯化变得越来越受欢迎,常与离子交换或凝胶过滤色谱组合。如本文所用,术语“突破”指将包含靶分子的样品装载至填充色谱柱或分离单元期间,靶分子第一次在来自柱或分离单元的产出中出现时的时间点。换句话说,术语“突破”是靶分子的损失开始的时间点。“缓冲液”是通过其酸-碱缀合组分的作用抗pH变化的溶液。可以例如根据期望的缓冲液pH采用的各种缓冲液描述于:Buffers.AGuideforthePreparationandUseofBuffersinBiologicalSystems,Gueffroy,D.,ed.CalbiochemCorporation(1975)。缓冲液的非限制性实例包括MES、MOPS、MOPSO、Tris、HEPES、磷酸盐、乙酸盐、柠檬酸盐、琥珀酸盐和铵盐,以及这些的组合。当将样品“装载”至包含合适的介质的装置或柱或分离单元时,缓冲液用来将包含靶分子以及一种或多种杂质的样品装载至所述装置或柱或分离单元。在结合和洗脱模式中,缓冲液具有这样的电导率和/或pH,从而靶分子结合至介质,而在理想情况下所有杂质均不结合并流过柱。然而,在流过模式中,缓冲液用来将包含靶分子以及一种或多种杂质的样品装载至柱或装置或分离单元,其中缓冲液具有这样的电导率和/或pH,从而靶分子不结合至介质并流过,而在理想情况下所有或大部分杂质结合至介质。如本文所用,术语“添加剂”指在将样品装载至色谱基质之前或在装载步骤期间添加至包含靶蛋白的样品的任何物质,其中所述物质的添加消除一个或多个洗涤步骤,或者减少洗涤步骤的数量,所述洗涤步骤设计用于杂质去除,在装载步骤之后和靶蛋白的洗脱之前使用。可以在装载之前或期间将单一物质添加至样品,或者物质的数量可以超过一种。示例性添加剂包括但不限于盐、聚合物、表面活性剂或去污剂、溶剂、离液剂以及它们的任何组合。在一具体实施方案中,这样的添加剂为氯化钠盐。在一具体实施方案中,静态混合器用于使来自澄清步骤的产出与添加剂接触,其中静态混合器的使用显著减少时间,因此允许澄清步骤简化连接至A蛋白色谱步骤。术语“重新平衡”指在装载靶分子之前使用缓冲液以重新条件处理(re-condition)介质。用于装载的相同缓冲液可以用于重新平衡。术语“洗涤(wash)”或“洗涤(washing)”色谱介质指使适当的液体如缓冲液通过或流过介质。通常洗涤用来在洗脱靶分子之前从介质去除弱结合的污染物和/或在装载之前去除不结合或弱结合的靶分子。在一些实施方案中,洗涤缓冲液不同于装载缓冲液。在其他实施方案中,洗涤缓冲液和装载缓冲液是相同的。在一具体实施方案中,通过改变样品装载的条件在纯化过程中消除洗涤步骤或者减少洗涤步骤的数量。在一些实施方案中,用于本文所述方法的洗涤步骤采用具有20mS/cm或更少的电导率的缓冲液,因此不同于通常用于杂质去除的缓冲液,因为那些缓冲液通常具有大于20mS/cm的电导率。术语“电导率”指水溶液在两个电极之间传导电流的能力。在溶液中,电流通过离子转运流动。因此,随着水溶液中存在的离子量的增加,溶液会具有较高的电导率。测量电导率的单位为豪西门子(milliSeimens)每厘米(mS/cm或mS),并且可以利用可商购的电导率计(例如,由Orion销售)进行测量。溶液的电导率可以通过改变其中离子的浓度来改变。例如,可以改变溶液中缓冲剂的浓度和/或盐(例如NaCl或KCl)的浓度以获得期望的电导率。在一些实施方案中,修改各种缓冲液的盐浓度以获得期望的电导率。在一些实施方案中,在其中将一种或多种添加剂添加至样品装载的方法中,如果随后使用一个或多个洗涤步骤,则这类洗涤步骤采用具有约20mS/cm或更少的电导率的缓冲液。术语“洗脱(elute)”或“洗脱(eluting)”或“洗脱(elution)”指通过使用或改变某些溶液条件来从色谱介质去除分子(例如,所关注的多肽或杂质),通过使用或改变某些溶液条件,缓冲液(称作“洗脱缓冲液”)与所关注的分子竞争色谱树脂上的配体位点。非限制性实例是通过改变离子交换材料周围缓冲液的离子强度来从离子交换树脂洗脱分子,从而缓冲液与所述分子竞争离子交换材料上带电荷的位点。在一些实施方案中,洗脱缓冲液具有低pH(例如,具有在约2至约5的范围中的pH,或者从约3至约4),并且这破坏配体(例如,A蛋白)和靶蛋白之间的相互作用。示例性洗脱缓冲液包括磷酸盐、乙酸盐、柠檬酸盐和铵缓冲液,以及这些的组合。在一些实施方案中,可以使用具有高pH(例如,约9或更高的pH)的洗脱缓冲液。洗脱缓冲液还可以包含额外的化合物如MgCl2(2mM)用于促进洗脱。在期望病毒灭活(VI)的情况下,病毒灭活缓冲液可以用来在洗脱靶分子之前灭活某些病毒。在这样的情况下,通常,病毒灭活缓冲液不同于装载缓冲液,因为其可以包含去污剂/多种去污剂,或者具有不同的特性(pH/电导率/盐以及它们的量)。在一些实施方案中,在结合和洗脱色谱步骤之前进行病毒灭活。在一些实施方案中,在从结合和洗脱色谱步骤洗脱期间或之后进行病毒灭活。在一些实施方案中,利用静态混合器在线进行病毒灭活。在其他实施方案中,病毒灭活步骤采用一个或多个缓冲罐。如本文所用,术语“生物反应器”指支持生物活性环境的任何制造或设计的装置或系统。在某些情况下,生物反应器是其中进行细胞培养过程的容器。这样的过程可以是需氧的或厌氧的。常用的生物反应器通常是圆柱形的,大小从升到立方米,并且常由不锈钢制成。在本文所述的一些实施方案中,生物反应器由除钢以为的材料制成,并且是一次性或单次使用的。考虑生物反应器的总体积可以是从100mL到高达10,000升或更多的任何体积,这取决于具体过程。在本文所述方法和系统的一些实施方案中,将生物反应器连接至单元操作如深层滤器。在本文所述的一些实施方案中,生物反应器用于细胞培养以及沉淀,其中可以将沉淀剂直接加入生物反应器,从而沉淀一种或多种杂质。在本文中可交换使用时,术语“活性炭(activecarbon)”或“活性炭(activatedcarbon)”指已进行一种方法以增加其孔结构的碳质材料。活性炭是具有非常高表面积的多孔固体。它们可以源自各种来源,包括煤炭、木材、椰壳、果壳和泥炭。可以利用在受控气氛下物理活化(包括加热)或者利用强酸、碱或氧化剂化学活化来从这些材料制备活性炭。活化过程产生具有高表面积的多孔结构,这赋予活性炭高的杂质去除能力。可以修改活化过程以控制表面的酸性。在本文所述的一些实施方案中,活性炭用于流过纯化步骤,其通常在结合和洗脱色谱步骤或病毒灭活步骤之后,所述病毒灭活步骤依次在结合和洗脱色谱步骤之后。在一些实施方案中,将活性炭掺入例如柱或一些其他合适的装置中的纤维素介质内。术语“静态混合器”指用于混合两种流体物质,通常为液体的装置。该装置一般由圆柱形(管)外壳中所含的混合器元件组成。总系统设计并入将两个液流递送入静态混合器的方法。当流通过混合器时,非移动元件连续混合物质。完全混合取决于许多变量,包括流体的特性、管的内径、混合器元件的数量和它们的设计等。在本文所述的一些实施方案中,在整个纯化过程或系统中使用一个或多个静态混合器。在一具体实施方案中,静态混合器用于使来自结合和洗脱色谱步骤的产出与病毒灭活剂(例如,酸或任何其他合适的病毒灭活剂)接触,其中静态混合器的使用显著减少时间,否则会需要时间以完成有效的病毒灭活。本发明的方法如上文所讨论的,本发明提供新的和改良的方法用于从包含靶分子以及一种或多种杂质的样品(例如,细胞培养进料)纯化靶分子。本文所述的方法相对于本领域使用的现有方法是巨大改进,因为它们减少方法运行所需要的总时间(相对于几天,12-24小时);相对于最常规的方法,包括较少的步骤;由于具有较少单元操作而减少方法的总物理空间,并且比常规方法更容易执行。此外,在一些实施方案中,本发明的方法采用可以抛弃的装置。本发明的方法包括几个加工步骤或单元操作,其旨在获得期望的结果,其中加工步骤(或单元操作)连接,从而互相流体连通,并且两个或更多个加工步骤可以在每个加工步骤的至少一部分持续时间中同时进行。换句话说,使用者不必等待加工步骤完成,然后执行下一加工步骤,而是使用者可以开始方法运行,从而包含靶分子的液体样品连续或半连续地流过加工步骤,获得纯化的靶分子。因此,通常使包含靶分子的样品在任何给定时间与方法中的一个以上加工步骤或单元操作接触。每个加工步骤(或单元操作)可以包括一种或多种装置或方法以完成加工步骤。本文所述的方法不同于工业中使用的常规方法,因为它们避免需要在使产出进行下一加工步骤之前使用汇集罐用于盛放、稀释、操作以及有时储存来自加工步骤的产出。相比之下,本文所述的方法使得样品的任何操作能够在线(例如,使用静态混合器),或者在加工步骤之间或有时在加工操作内(例如,当加工操作采用一种以上方法或装置时)采用缓冲罐(其通常不超过来自加工步骤的产出的总体积的10%或20%或25%),从而显著减少进行所述方法的总时间以及用于进行所述方法的总系统的物理空间。在一优选实施方案中,本文所述的方法不使用汇集罐而仅使用缓冲罐,所述缓冲罐具有少于来自前一步骤的产出体积的25%,优选少于10%的体积。本文所述的方法包括至少3个加工步骤-澄清、结合和洗脱色谱以及流过纯化。通常,澄清是第一个步骤,然后是结合和洗脱色谱,然后是流过纯化操作。所述方法可以包括额外的加工步骤,包括但不限于病毒灭活和配制。本文所述方法的一个重要方面是无论步骤的数量,所述方法仅包括一个结合和洗脱色谱步骤。如本文所述,以连续或半连续方式进行各种加工步骤。以下是如本文所述,可以在连续或半连续方法中使用的加工步骤的实例。应当理解可以使用下文所示的加工步骤的任何组合。换句话说,下文表I中步骤1下的任何加工步骤可以与步骤2下的任何加工步骤和/或步骤3下的任何加工步骤等组合。还应当理解本说明书中其他地方描述的额外的加工步骤可以与下文表I中描述的一个或多个加工步骤组合或代替其使用。表I各种加工步骤(或单元操作)在下文中更详细描述。纯化过程的起始材料通常是包含纯化的靶分子的样品。通常,使用产生靶分子的细胞培养物。但是,也可以使用除细胞培养物以外的样品。示例性样品包括但不限于转基因哺乳动物细胞培养物、非转基因哺乳动物细胞培养物、细菌细胞培养物、组织培养物、微生物发酵批次、植物提取物、生物燃料、海水培养物、淡水培养物、废水培养物、处理的污水、未处理的污水、奶、血液以及它们的组合。一般来说,除了靶分子,样品包含各种杂质。这类杂质包括培养基组分、细胞、细胞碎片、核酸、宿主细胞蛋白、病毒、内毒素等。澄清本文所述方法和系统中的第一加工步骤(或单元操作)通常是澄清。澄清旨在从靶分子分离一种或多种可溶性和/或不溶性杂质。在一些实施方案中,从样品去除不溶性杂质如细胞和细胞碎片,使得在溶液中包含靶分子以及其他可溶性杂质的澄清流体。通常在包括捕获期望的靶分子的步骤之前进行澄清。澄清的另一关键方面是去除样品中的可溶性和/或不溶性杂质,所述杂质后来可以导致纯化过程中无菌滤器的污染,从而使得总纯化过程更经济。如现在工业中使用的,澄清一般包括去除细胞和/或细胞碎片,并且通常包括离心作为第一步骤,然后是深层过滤。参见例如,Shuklaetal.,J.ChromatographyB,848(2007):28-39;Liuetal.,MAbs,2(5):480-499(2010)。在本文所述的一些优选实施方案中,澄清避免需要离心。例如,在一些实施方案中,当生物反应器中的细胞培养物样品的起始体积少于2000升,或少于1000升或少于500升时,可以使细胞培养物样品单独进行深层过滤,或者进行沉降和深层过滤,不需要离心。在一些优选实施方案中,在深层过滤之前使用沉淀增加通量,因此可以不需要离心而加工的样品体积的量也增加。换句话说,在某些情况下,如果通过单独深层过滤可以加工1000升样品,通过组合深层过滤与沉淀,使用者可能能够加工几乎该量的两倍,即2000升。深层滤器通常用来去除一种或多种不溶性杂质。深层滤器是这样的滤器,其使用多孔过滤介质以将颗粒保留在整个介质中,而不是仅在介质的表面上。在一些优选实施方案中,深层滤器用于澄清,其能够以约10升/m2/hr-约100升/m2/hr的流速过滤具有约0.5μm-约200μm的粒径分布的细胞碎片和颗粒物质。已发现如果多孔深层滤器是各向异性的(即孔径逐渐减小),则颗粒杂质的主要去除可以获得特别好的结果。在一些优选实施方案中,孔具有>约25μm的标称孔径评级。在一些优选实施方案中,深层滤器包含至少2层无纺布的分级层,其中分级层具有约0.3cm-约3cm的总厚度。在一些实施方案中,深层滤器配置于装置中,所述装置能够以约10升/m2/hr-约100升/m2/hr的流速过滤包含具有约0.5μm-200μm的粒径分布的颗粒的高固体进料直至跨膜压(TMP)达到20psi。在一些实施方案中,深层滤器包含无纺布、纤维素和硅藻土的分级层的复合物。无纺布包含聚丙烯、聚乙烯、聚酯、尼龙或它们的混合物。示例性深层滤器及其使用方法可以在援引加入本文的美国专利公开号20130012689中找到,其特别可用于过滤包含具有约0.5μm-200μm的大小分布的颗粒的样品。因此,在一些实施方案中,澄清步骤中使用的深层滤器包括开放分级层,允许进料流中较大的颗粒穿入滤器的深层,并且捕获在滤器的孔内,而不是收集在表面上。分级深层滤器的开放顶层使得能够捕获较大的颗粒,而底层使得能够捕获较小的残余聚集颗粒。分级深层滤器的各种优点包括较高的通量、保留较大的固体以及消除团块形成的问题。如上文所讨论的,在一些实施方案中,澄清包括在沉淀之后使用深层过滤。沉淀可以采用酸沉淀、使用刺激响应性聚合物、絮凝或沉降以及实现沉淀的其他合适的方式/试剂。因此,在一些实施方案中,在深层过滤之前将沉淀剂如刺激响应性聚合物添加至样品以沉淀一种或多种可溶性和/或不溶性杂质。沉淀的其他方法包括但不限于使用短链脂肪酸如辛酸、使用絮凝剂、改变溶液条件(例如,温度、pH、盐度)以及酸沉淀。例如,已报道在温和的酸性条件下,添加短链脂肪酸如辛酸通常沉淀非IgG蛋白,而IgG不沉淀。如本文所用,絮凝是一种进行沉淀的方式,其中沉淀通常取决于所用的絮凝剂浓度(即,是“剂量依赖性的”)。典型的絮凝剂是与带相反电荷的杂质络合的聚电解质,例如聚阳离子。因为细胞/蛋白上的电荷与聚合物(例如聚电解质)上的电荷之间的相互作用,絮凝剂一般沉淀细胞、细胞碎片和蛋白,从而产生不溶性复合物。在絮凝中使用聚电解质聚合物以纯化蛋白在本领域中是公认的(参见例如,国际PCT专利申请号WO2008/091740,援引加入本文)。通过絮凝剂沉淀可以用广泛的聚合物完成,唯一需要的一般特征是聚合物必须与所关注的物质(例如,靶分子或杂质)具有一定水平的相互作用。示例性絮凝剂包括聚合物如壳聚糖和多糖。絮凝还可以通过导致pH改变的化学处理或通过添加表面活性剂来完成。本领域技术人员已知许多方法去除沉淀的物质,例如离心、深层过滤、过滤或沉降或者它们的任何组合。沉降之后可以倒出或过滤液相或上清。在一些优选的实施方案,刺激响应性聚合物用于沉淀一种或多种杂质。这类刺激响应性聚合物的实例可以在美国公开号20090036651、20100267933和20110313066中找到,每个整体援引加入本文。刺激响应性聚合物一般在某套方法条件如pH、温度和/或盐浓度下于基于水性的溶剂中可溶,并且这类条件中的一种或多种改变时变得不溶,随后沉淀出来。示例性刺激响应性聚合物包括但不限于聚烯丙基胺、用苄基修饰的聚烯丙基胺或者聚乙烯基胺和用苄基修饰的聚乙烯基胺,其中刺激为磷酸盐或柠檬酸盐。在一些实施方案中,利用静态混合器连续添加刺激响应性聚合物。在其他实施方案中,利用静态混合器添加聚合物及其响应的刺激。在一些实施方案中,小分子用于沉淀一种或多种杂质,特别是不溶性杂质。在一些实施方案中,用于本文所述的方法的小分子是非极性和阳离子的,例如PCT公开号WO2013028334所述,其援引加入本文。可以用于澄清的示例性小分子包括但不限于单烷基三甲基铵盐(非限制性实例包括十六烷基三甲基溴化铵或十六烷基三甲基氯化铵、十四烷基三甲基溴化铵或十四烷基三甲基氯化铵、烷基三甲基氯化铵、烷基芳基三甲基氯化铵、十二烷基三甲基溴化铵或十二烷基三甲基氯化铵、十二烷基二甲基-2-苯氧基乙基溴化铵、十六烷基胺氯化物或溴化物、十二烷基胺或氯化物、以及十六烷基二甲基乙基溴化铵或十六烷基二甲基乙基氯化铵)、单烷基二甲基苄基铵盐(非限制性实例包括烷基二甲基苄基氯化铵和苄索氯铵)、二烷基二甲基铵盐(非限制性实例包括溴化度米芬、二癸基二甲基卤化铵(溴化物和氯化物盐)以及辛基十二烷基二甲基氯化铵或辛基十二烷基二甲基溴化铵)、杂芳基铵盐(非限制性实例包括十六烷基吡啶鎓卤化物(氯化物或溴化物盐)以及十六烷基吡啶溴化物或氯化物、顺式-异构体1-[3-氯烯丙基]-3,5,7-三氮杂-1-氮鎓金刚烷、烷基-异喹啉溴化物、以及烷基二甲基萘基甲基氯化铵)、多取代的季铵盐(非限制性实例包括烷基二甲基苄基糖精铵和烷基二甲基乙基苄基环己基氨基磺酸铵)、以及双-季铵盐(非限制性实例包括1,10-双(2-甲基-4-氨基喹啉氯化物)-癸烷、1,6-双{1-甲基-3-(2,2,6-三甲基环己基)-丙基二甲基氯化铵己烷或曲比氯铵,以及BuckmanBrochures称作CDQ的bis-quat)。在一特别优选的实施方案中,小分子为苄索氯铵(BZC)。在一些实施方案中,直接在生物反应器中进行澄清。换句话说,可以将沉淀剂如刺激响应性聚合物直接添加至包含表达靶分子的细胞培养物的生物反应器中,从而沉淀细胞和细胞碎片,并且靶分子保留在作为沉淀结果获得的液相中。在一些优选实施方案中,使液相进一步进行深层过滤。还可以使液相进行离心、过滤、沉降或它们的组合。在其他实施方案中,将刺激响应性聚合物添加至容器,所述容器包含细胞培养物且不同于生物反应器。因此,如本文所用,术语“容器”指不同于用于培养细胞的生物反应器的容器。在一些实施方案中,在离心之前将刺激响应性聚合物添加至样品,并且离心之后是深层过滤。在这样的方法中,离心之后所需的深层滤器的大小/体积小于不存在刺激响应性聚合物时所需的大小/体积。在一些实施方案中,向澄清的细胞培养物进料进一步提供带电荷的氟碳化合物组合物(CFC),以便进一步去除宿主细胞蛋白(HCP),如2013年3月18日提交的PCT申请号PCT/US2013/32768(内部参考号MCA-1303PCT)所述,其描述CFC修饰的膜用于去除HCP。还可以在纯化过程的其他加工步骤之后使用CFC修饰的膜,例如在A蛋白结合和洗脱色谱步骤之后或者在流过纯化加工步骤之后或者在阴离子交换色谱步骤(其为流过纯化加工步骤的一部分)之后。通常使澄清的样品进行结合和洗脱色谱步骤。结合和洗脱色谱在本文所述的各种实施方案中,所述方法和系统仅包括单一的结合和洗脱色谱加工步骤用于捕获,其通常在澄清之后。结合和洗脱色谱旨在结合靶分子,而一种或多种杂质流过(也称作“捕获步骤”)。随后将结合的靶分子洗脱,并且可以使来自结合和洗脱色谱步骤的洗脱物或产出进行进一步的纯化步骤。结合和洗脱色谱可以采用单一的分离单元或者两个或三个或更多个分离单元。在本文所述的各种实施方案中,使用的结合和洗脱色谱为亲和结合和洗脱色谱或者阳离子交换结合和洗脱色谱或者混合模式结合和洗脱色谱。通常,结合和洗脱色谱采用旨在结合靶分子的介质。在一些优选实施方案中,结合和洗脱色谱为亲和色谱。可以用于亲和色谱的合适的色谱介质包括但不限于具有A蛋白、G蛋白或L蛋白官能团的介质(例如,HighCapacity(EMDMillipore),UltraPlus(EMDMillipore),MabCaptureTMA(LifeTechnologies),(NovaSep),ProteinACeramic(PallCorporation),ToyopearlAF-rProteinA-650F(Tosoh),Sure(GEHealthcare))。合适的介质通常包装在色谱柱或装置中。在一具体实施方案中,亲和色谱介质包括偶联至亲水刚性性聚乙烯醚聚合物介质的基于A蛋白的配体。在本发明的一些实施方案中,结合和洗脱色谱过程采用连续多柱色谱,也称作CMC。在连续色谱中,通常以这样的排列连接几个相同的柱,所述排列允许系列和/或平行操作柱,这取决于方法要求。因此,所有柱可以同时运行,或者可以在它们的操作中间歇重叠。在过程运行期间每个柱通常装载、洗脱并再生几次。与其中单个色谱循环是基于几个连续步骤如装载、洗涤、洗脱和再生的常规色谱相比,在基于多个相同柱的连续色谱的情况下,所有这些步骤可以在不同柱上进行。因此,连续色谱操作可以实现色谱树脂的更好利用和减少的缓冲液要求,这有益于方法经济。连续结合和洗脱色谱还包括模拟移动床(SMB)色谱。在一些优选实施方案中,结合和洗脱色谱采用使用两个分离单元的CMC。在一些其他优选实施方案中,结合和洗脱色谱采用使用两个或三个或更多个分离单元的CMC。在CMC的情况下,样品的装载通常是连续的;但是,洗脱是间歇或不连续的(即,CMC的性质是半连续的)。在一些优选实施方案中,CMC采用3个分离单元,每个包含相同的色谱介质,并且连接所述分离单元,从而液体可以从一个分离单元流至下一分离单元,并且从最后的分离单元流至第一分离单元,在使得靶分子能够结合至分离单元的pH和电导率下将样品装载至第一分离单元,并且至少部分装载时间与连续分离单元的装载重叠,两个分离单元流体连通,从而使得不结合至第一分离单元的任何靶分子能够装载以结合至下一分离单元。不同的分离单元可以在所述方法的不同阶段和任何给定时间;即,当装载一个分离单元时,下一分离单元可以进行洗涤、洗脱、重新平衡等。而且,当第一分离单元进行洗涤、洗脱、重新平衡步骤时,连续的分离单元进行装载步骤等,从而样品连续流过分离单元且具有800cm/h以上的速度,并且分离单元的色谱介质包含具有40-200μm直径的颗粒且孔径在50nm-200nm的范围中。在一些实施方案中,每个分离单元包括亲和色谱介质如基于A蛋白的介质。在其他实施方案中,每个分离单元包括离子交换介质(例如,阳离子交换色谱介质)或混合模式色谱介质。如本文所述,可以在结合和洗脱色谱加工步骤中使用的示例性连续色谱方法可以例如在欧洲专利申请号EP11008021.5和EP12002828.7中找到,两者援引加入本文。在一些实施方案中,分离单元以环行方式连接,也称作模拟移动床。例如,在某些情况下,至少3个分离单元连成一圈,并且样品的装载从一个分离单元顺序转移至下一个,例如欧洲专利号2040811所述,其援引加入本文。已发现以半连续或连续模式运行结合和洗脱色谱使得能够使用减少体积的亲和介质,多达常规方法中使用体积的90%。此外,可以使用具有减少直径的分离单元,与分批方法相比三分之一和五分之一之间。在特定批次的靶分子的加工内,例如在是治疗候选物的靶分子的批量生产期间,分离单元可以重新使用多次。在一些实施方案中,用样品装载的分离单元在装载时间的整个持续期间与另一分离单元流体连通。在其他实施方案中,装载的分离单元仅在装载时间的部分持续时间与另一分离单元流体连通。在一些实施方案中,两个分离单元仅在装载时间的后半个持续时间流体连通。在分批色谱模式中,通常在过量靶分子饱和分离单元之前停止分离单元(例如,色谱柱)的装载。相反,如本文所述的方法和系统所用,在CMC结合和洗脱色谱加工步骤的情况下,分离单元的装载不必停止,因为两个分离单元之间流体连通,不结合至一个分离单元的靶分子移动至下一分离单元,其中一个分离单元的出口与第二分离单元的入口相连等等。应当理解本领域技术人员可以容易地确定在装载步骤期间,不结合至装载的分离单元的靶分子的量足够高,从而装载的分离单元的出口需要连接至另一分离单元的入口。已发现如果分离单元包含具有40-200μm的颗粒直径和50-200nm的孔径的介质,则这个实施方案特别有效。用这样的介质,装载进料可以以800cm/h以上的速度连续运行。进一步的细节可以在2012年4月23日提交的EP12002828.7中找到。在一些实施方案中,洗涤的分离单元或多个分离单元的出口与先前的分离单元流体连通,从而所述洗涤去除的靶分子不会丢失,而是装载至先前的分离单元。已发现通过在结合和洗脱色谱期间对样品装载使用某些添加剂可以显著降低包含靶分子的洗脱混合物中最终的杂质(例如,HCP)水平。事实上,在装载之前或样品装载期间向样品添加某些添加剂可以避免需要使用通常设计以增加杂质清除的特定洗涤步骤。换句话说,通过在装载之前或样品装载期间包括某些添加剂来减少通常使用的洗涤步骤的数量。在连续色谱的上下文中,要求已完成装载步骤并移动至随后区域的A蛋白柱在期望的时间内完成所有必需步骤,从而该柱准备好接受新鲜的装载溶液,例如本文所述,可以在欧洲专利申请号EP11008021.5和EP12002828.7中找到,两者援引加入本文。完成所有必需步骤所需的时间取决于柱必须经过以准备好再次装载的步骤或区域的数量。通过减少或消除步骤,如中间洗涤,使得能够对高滴度(靶蛋白浓度)应用连续色谱,其中预期装载阶段更短,并且简化连续色谱期间所有滴度条件所需的时间。可以用来减少或消除一个或多个中间洗涤步骤的示例性添加剂包括但不限于盐、聚合物、表面活性剂或去污剂、溶剂、离液剂以及它们的任何组合。“盐”是通过酸和碱的相互作用形成的化合物。盐的实例包括任何和所有氯化物盐、硫酸盐、磷酸盐、乙酸盐和/或柠檬酸盐,例如,氯化钠、硫酸铵、氯化铵、氯化钾、乙酸钠。在一具体实施方案中,盐为NaCl(例如,添加至0.5MNaCl的终浓度)。术语“疏水性盐”指具有疏水组分的特定盐类型,例如烷基胺;四甲基氯化铵(TMAC)、四乙基氯化铵(TEAC)、四丙基氯化铵和四丁基氯化铵。如本文所用,“聚合物”是通过两个或更多个单体的共价键形成的分子,其中所述单体不是氨基酸残基。聚合物的实例包括聚乙二醇(PEG)、丙二醇以及乙二醇和丙二醇的共聚物(例如,Pluronics、PF68等)。在一具体实施方案中,聚合物为PEG。术语“去污剂”指表面活性剂,离子和非离子的,例如聚山梨酯(例如,聚山梨酯20或80);泊洛沙姆(例如,泊洛沙姆188);Triton;十二烷基硫酸钠(sodiumdodecylsulfate)(SDS);十二烷基硫酸钠(sodiumlaurylsulfate);辛基糖苷钠;月桂基-、肉豆蔻基-、linoleyl-或硬脂酰基-磺基甜菜碱;(更多去污剂参见US6870034B2)。在一具体实施方案中,去污剂为聚山梨酯,如聚山梨酯20(Tween20)。术语“溶剂”指能够溶解或分散一种或多种其他物质以提供溶液的液体物质。在一些实施方案中,溶剂是有机的非极性溶剂如乙醇、甲醇、异丙醇、乙腈、己二醇、丙二醇和2,2-硫二甘醇。术语“离液盐”指已知破坏分子间水结构的盐。这样的盐的实例为尿素和盐酸胍。在一些实施方案中,利用一个或多个静态混合器将一种或多种添加剂连续地与澄清的细胞培养物混合。因此,在一些实施方案中,在蛋白纯化过程中,澄清的细胞培养物样品连续地流至A蛋白色谱步骤,其中在装载至A蛋白色谱基质之前,将如本文所述的一种或多种添加剂连续地与澄清的细胞培养物混合。病毒灭活在本文所述的方法和系统的一些实施方案中,结合和洗脱色谱之后是病毒灭活(VI)。应当理解病毒灭活可以不必进行,但认为是任选存在的。优选地,使来自结合和洗脱色谱的产出或洗脱物进行病毒灭活。病毒灭活使得病毒失活或不能感染,这非常重要,特别是在靶分子旨在用于治疗用途的情况下。许多病毒包含可以通过化学改变灭活的脂质或蛋白包衣。不是简单地使病毒失活,一些病毒灭活方法能够使病毒完全变性。灭活病毒的方法是本领域技术人员公知的。一些更广泛使用的病毒灭活方法包括例如使用以下一种或多种:溶剂/去污剂灭活(例如用TritonX100);巴氏灭菌(加热);酸性pH灭活;以及紫外线(UV)灭活。可以组合这些方法中的两种或更多种;例如,在升高的温度下进行酸性pH灭活。为了确保完全和有效的病毒灭活,通常在延长的时间中于不停搅拌下进行病毒灭活以确保病毒灭活剂与样品的适当混合。例如,在现在工业中使用的许多大规模方法中,将来自捕获步骤的产出或洗脱物收集在汇集罐中并使其在延长的时间(例如,>1-2小时,通常之后储存过夜)中进行病毒灭活。在本文所述的各种实施方案中,通过进行在线病毒灭活或者通过采用缓冲罐代替汇集罐用于这个步骤,病毒灭活所需的时间显著减少。可以用于本文所述方法的病毒灭活技术的实例可以例如在PCT专利申请号PCT/US2013/45677(内部参考号P12/098PCT)中找到。在一些优选实施方案中,病毒灭活采用酸性pH,其中使来自结合和洗脱色谱的产出在线暴露于酸性pH用于病毒灭活。用于病毒灭活的pH通常低于5.0,或者优选3.0-4.0。在一些实施方案中,pH为约3.6或更低。利用在线方法的病毒灭活所用的持续时间可以从10分钟或更少、5分钟或更少、3分钟或更少、2分钟或更少至约1分钟或更少。在缓冲罐的情况下,灭活所需要的时间通常少于1小时,或者优选少于30分钟。在本文所述的一些实施方案中,将合适的病毒灭活剂在线引入结合和洗脱色谱与过程中的下一单元操作(例如,流过纯化)之间的管或连接管路,其中优选地,所述管或连接管路包含静态混合器,其确保在产出进行下一单元操作之前,来自结合和洗脱色谱加工步骤的产出与病毒灭活剂适当混合。通常,来自结合和洗脱色谱的产出以一定的流速流过静态混合器,这确保与病毒灭活剂的最小接触时间。可以通过使用一定长度和/或直径的静态混合器来调整接触时间。在一些实施方案中,在暴露于酸一定时间之后,将碱或合适的缓冲液额外地引入管或连接管路,从而使样品的pH至下一步骤的合适pH,其中pH对靶分子无害。因此,在一些优选实施方案中,通过静态混合器用混合依次实现暴露于低pH以及碱性缓冲液。在一些实施方案中,代替在线静态混合器,或者除了在线静态混合器,缓冲罐用于用病毒灭活剂处理来自结合和洗脱色谱的产出,其中缓冲罐的体积不超过来自结合和洗脱色谱的产出的总体积的25%,或者不超过15%或不超过来自结合和洗脱色谱的产出的体积的10%。因为缓冲罐的体积显著少于典型的汇集罐的体积,可以实现样品与病毒灭活剂的更有效混合。在一些实施方案中,可以通过在结合和洗脱色谱期间改变pH来实现病毒灭活,而不必改变来自结合和洗脱色谱的产出的pH。在本文所述的一些实施方案中,使样品进行流过纯化过程,然后进行病毒灭活。在一些实施方案中,在病毒灭活之后和流过纯化之前可以包括过滤步骤。这样的步骤可以是可取的,特别是在病毒灭活之后观察到样品混浊的情况下。这样的过滤步骤可以采用微孔滤器或深层滤器。然而,在其中病毒灭活步骤任选存在的方法中,来自结合和洗脱色谱的产出可以直接进行流过纯化。流过纯化在本文所述的各种实施方案中,使来自结合和洗脱色谱的产出直接或在病毒灭活之后进行流过纯化操作。在一些实施方案中,本文所述的方法和系统中使用的流过纯化操作采用两个或更多个加工步骤或装置或方法用于完成流过纯化,其旨在去除来自结合和洗脱色谱的产出中存在的一种或多种杂质,有或无病毒灭活。在一些优选实施方案中,如本文所述的流过纯化操作包括以流过模式进行的以下步骤中的一个或多个:活性炭;阴离子交换色谱;阳离子交换色谱;混合模式色谱,疏水相互作用色谱和病毒过滤,或者它们的组合。在一些实施方案中,在这些步骤中的两个或更多个之间可以使用一个或多个阀、在线静态混合器和/或缓冲罐,以便改变溶液条件。其中一个或多个可以用来完成流过纯化的各种步骤在下文中更详细描述。如本文所述,在一些实施方案中,在一些优选实施方案中,流过纯化采用至少一个流过阴离子交换色谱(AEX)步骤,其中仍保留在包含靶分子的样品中的一种或多种杂质结合阴离子交换色谱介质,而靶分子流过。在一些实施方案中,可以使用流过混合模式色谱或流过疏水相互作用色谱代替流过阴离子交换色谱,或者除了流过阴离子交换色谱,可以使用流过混合模式色谱或流过疏水相互作用色谱。可以用于AEX色谱的示例性阴离子交换介质包括但不限于例如那些基于季铵离子的介质,以及弱阴离子交换剂,例如那些基于伯胺、仲胺和叔胺的介质。合适的阴离子交换介质的额外实例是可获得自GEHealthcareBio-SciencesAB的Q可获得自EMDChemicals的FractogelTMAE和EshmunoQ、可获得自PallCorp.的Q、可获得自SartoriusStedim的Q以及可获得自EMDMillipore的ChromaSorbTM装置。介质可以为颗粒、膜、多孔材料或整体材料的形式。在优选的实施方案中,介质是基于基质的膜,也称作膜吸附剂。膜吸附剂优选为通过本领域公知的相分离方法制备的多孔膜片。参见,例如,ZemanLJ,ZydneyAL,MicrofiltrationandUltrafiltration:PrinciplesandApplications,NewYork:MarcelDekker,1996。中空纤维和管状膜也是可接受的基质。膜吸附剂通常具有0.5-5mm的床高。膜可以制备自本领域已知的广泛的聚合物材料,包括聚烯烃如聚乙烯和聚丙烯、聚偏氟乙烯、聚酰胺、聚四氟乙烯、纤维素类、聚砜、聚丙烯腈等。为了赋予阴离子交换特性,通常通过包被、接枝、吸附和等离子体引发的修饰用合适的单体和/或聚合物修饰膜的表面。在一些实施方案中,用于流过阴离子交换的阴离子介质是基于膜的介质,其具有用交联聚合物包被的表面,所述交联聚合物具有连接的伯胺基团如聚烯丙基胺或质子化的聚烯丙基胺。额外的合适的介质可以在例如援引加入本文的美国专利号8,137,561中找到,其描述多孔色谱或吸附介质,所述介质具有在多孔、自我支持的底物上形成的聚合物包衣和包括这样的介质的阴离子交换剂,以及利用这样的介质纯化靶分子的使用方法。这样的介质特别适合以良好整合入现有下游纯化过程的方式从制备的靶分子如单克隆抗体稳健去除低水平杂质。典型的杂质包括DNA、内毒素、HCP和病毒。这类介质在高盐浓度和高电导率下功能良好(高亲和力),甚至在这类条件下有效去除病毒。获得高结合能力而不牺牲装置通透性。事实上,根据包衣特性,可以实现大于约5mg/mL、或者大于约25mg/mL、或者大于约35-40mg/mL的核酸结合能力。阴离子交换吸附剂的量比用于可比的基于珠的方法的量少很多。在一些实施方案中,将具有阴离子交换功能性的膜包裹在合适的多层装置中,只要均匀流过整堆膜。所述装置可以是一次性的或可重复使用的,并且可以由膜制造商预装或由最终使用者装配。装置外壳材料包括热塑性树脂如聚丙烯、聚乙烯、聚砜、聚偏氟乙烯等;热固性树脂如丙烯酸、硅酮和环氧树脂;以及金属如不锈钢。膜可以永久结合至装置外壳,例如通过使用粘合剂或热结合,或者通过压缩和小心放置的垫片固定在位置中。在一些优选实施方案中,在比靶蛋白的等电点低至少0.5-1.0单位的溶液pH值下使用阴离子交换吸附装置。阴离子交换吸附装置的优选pH范围是约6-约8。合适的盐浓度范围是0-500mM,更优选10-200mM。在一些实施方案中,流过纯化可以采用额外的步骤。例如,在一优选实施方案中,除了阴离子交换色谱(AEX),使用一个或多个额外的流过步骤。额外的流过步骤包括,例如混合模式色谱、阳离子交换色谱、疏水相互作用色谱、活性炭、大小排阻或它们的组合。流过纯化中可以包括的额外的步骤包括例如在阴离子交换色谱之前或在阴离子交换色谱(和/或一种或多种模式和HIC)之后使用活性炭。在一些实施方案中,将活性炭掺入例如柱或装置中的纤维素介质中。或者,可以将活性炭与阴离子交换介质组合(例如,在柱或筒中),从而进一步从包含靶分子的样品去除一种或多种杂质。柱或筒也可以是一次性的,例如Pod。介质可以为颗粒、膜、纤维多孔材料或整体材料的形式。在活性炭的情况下,可以将其浸入多孔材料,例如多孔纤维材料。已发现流过阴离子交换色谱之前的流过活性炭步骤特别适合去除宿主细胞蛋白和浸出的A蛋白。其还能够从细胞培养基去除大量潜在的杂质,例如激素、表面活性剂、抗生素和消泡化合物。此外,已发现包含活性炭的装置降低样品中的浊度水平,例如A蛋白洗脱部分的pH升高期间产生的。关于碳质材料、活性炭以及它们在流过纯化方法中的用途的进一步细节可以在PCT公开号WO2013/028330中找到,其援引加入本文。如上文所讨论的,在本文所述的方法和系统中使用的流过纯化操作可以包括一个以上流过步骤。在优选的实施方案中,流过纯化还包括一个或多个额外的流过步骤,例如用于聚集体去除和病毒过滤。在一些实施方案中,在正常流动过滤模式的操作中使样品通过吸附深层滤器,或者带电荷或修饰的微孔层或多层,用于聚集体去除。可以用于聚集体去除的流过步骤的实例可以在例如美国专利号7,118,675和7,465,397中找到,其援引加入本文。因此,在一些实施方案中,可以使用去除蛋白聚集体和病毒颗粒的两步过滤方法,其中将样品通过一层或多层吸附深层滤器、带电荷或表面修饰的多孔膜、或者小床色谱介质过滤以产生不含蛋白聚集体的样品。如下文更详细描述的,这之后可以使用超滤膜用于病毒过滤。用于病毒过滤的超滤膜通常称作纳滤膜。在一些实施方案中,额外的流过步骤采用阳离子交换色谱(CEX)介质。关于阳离子交换流过装置以及它们在流过纯化方法中的用途的进一步细节可以在美国专利申请号13/783,941(内部参考号MCA-1423)中找到,其援引加入本文。因此,在一些实施方案中,在阴离子交换色谱步骤之后使用的阳离子交换色谱介质采用密度为1-30mM的包含一个或多个阳离子交换结合基团的固体支持物。相对于单体,这类固体支持物能够以大于约10的选择性结合蛋白聚集体。在一些实施方案中,带负电荷的过滤介质可以用于去除蛋白聚集体,例如,包含用带负电荷的聚合的交联丙烯酰胺烷基包衣包被的多孔基质,在暴露于电子束且化学聚合自由基引发剂不存在时在基质表面上原位聚合,其中所述包衣形成自具有一个或多个带负电荷的垂饰基团的可聚合的丙烯酰胺烷基单体和丙烯酰胺交联剂。关于这类过滤介质的额外的细节可以例如在PCT公开号WO2010/098867中找到,其援引加入本文。使用流过阳离子交换步骤(CEX)可能需要降低溶液pH以增加对杂质如抗体聚集体的亲和力和容量。这样的pH降低可以通过简单的在线添加合适的包含酸的溶液进行,通过三通阀、T-类型连接器、静态混合器或本领域公知的其他合适的装置。此外,小的缓冲容器可以用来提供额外的混合和采样机会。可以为袋、容器或罐形式的缓冲容器的体积通常远小于用流过设置加工的流体的体积,例如不超过流体体积的10%。在一些实施方案中,阳离子交换介质去除蛋白聚集体和/或作用为病毒过滤膜的预滤器,其通常在阳离子交换色谱之后使用。在另一实施方案中,可以利用包含磷酸钙盐的复合过滤材料去除蛋白聚集体。合适的磷酸钙盐为无水磷酸二钙、脱水磷酸二钙、磷酸三钙和磷酸四钙。在另一实施方案中,磷酸钙盐为羟基磷灰石。通常在将样品装载至这类装置之前调整溶液条件,特别是磷酸盐离子的浓度和离子强度。关于利用包含磷酸钙盐的复合过滤材料以流过模式去除蛋白聚集体的进一步细节可以在WO2011156073A1中找到,其援引加入本文。整个流过纯化操作(如本文所述,包括阴离子交换色谱步骤以及一个或多个额外的步骤)连续地进行,在流过加工步骤之间不使用汇集罐。在一些实施方案中,流过纯化过程额外地包括病毒过滤。但是,病毒过滤是任选存在的,并且可以不必总是使用。在一些实施方案中,病毒过滤包括基于大小排阻的过滤,也称作筛选。对于病毒去除,通常使样品通过超滤滤器,所述超滤滤器保留病毒而靶分子通过。根据IUPAC,超滤是“压力驱动的基于膜的分离方法,其中排斥小于0.1μm和大于约2nm的颗粒和溶解的大分子”。(IUPAC,在PureAppl.Chem.,1996,68,1479中发表的“Terminologyformembranesandmembraneprocesses”)。通常特异性地设计用于这个步骤的超滤膜以去除病毒。与用于蛋白浓缩和缓冲液交换的超滤膜相反,这些膜通常特征不在于分子量截止,而是典型地保留病毒颗粒。病毒保留表示为对数减少值(LRV),其简单地为标准化测试中进料和滤液中病毒颗粒的比例的Log10。病毒过滤在纯化过程中的使用可以在例如Meltzer,T.,andJornitz,M.,eds.,“FiltrationandPurificationintheBiopharmaceuticalIndustry”,2nded.,InformaHealthcare,2008,Chapter20中找到。病毒保留膜可以制备为平板形式,例如来自EMDMilliporeCorporation的Pro、来自PallCorporation的VFGradeDV20、来自SartoriusStedimBiotech的CPV,或者中空纤维模式,例如来自AsahiKaseiMedicalCo的PlanovaTM20N。它们可以为单层或多层产品,并且可以通过本领域已知的许多膜制备方法之一制备。对于不对称的复合病毒保留膜,可以获得特别有益的通量保留的组合,如美国公开号20120076934A1所述,其援引加入本文。在一具体实施方案中,流过纯化操作包括至少一个活性炭步骤、一个阴离子交换色谱步骤、一个阳离子交换色谱步骤和一个病毒过滤步骤。病毒过滤之后,可以使包含靶分子的样品进行一个或多个额外的配制/浓缩步骤。额外的加工步骤如上文所述,在一些实施方案中,病毒过滤之后使样品进行一个或多个额外的加工步骤。在一些实施方案中,所述一个或多个额外的步骤包括配制,其可以采用渗滤/浓缩,然后进行无菌过滤。在一些实施方案中,使包含靶分子的样品进行渗滤,其通常以切向流过滤(TFF)模式采用超滤膜。在切向流过滤(TFF)的情况下,将流体沿滤器介质的表面切向泵过。应用的压力用来迫使一部分流体通过滤器介质至滤液侧。渗滤使得用期望的缓冲液置换包含靶分子的流体用于靶分子的配制。渗滤之后通常是利用相同膜进行的浓缩靶分子的步骤。在另一实施方案中,单通切向流过滤(SPTFF)可以用于浓缩/渗滤。SPTFF模块包括系列连接的多个超滤装置。单一通过SPTFF模块之后靶蛋白足够浓缩/渗滤,不需要截留环和泵,使得能够连续操作。更多信息可以在2011年春季的美国化学学会会议报告的HerbLutz等人的题为“单通TFF”的报告中找到。渗滤/浓缩之后,使样品进行无菌过滤步骤用于储存或任何其他用途。通常利用正常流过滤(NFF)进行无菌过滤,其中在施用的压力下流体流的方向与滤器介质(例如膜)垂直。本发明的系统本发明还提供用于纯化靶分子的系统,其中所述系统包括互相连接以流体连通的两个或更多个单元操作,从而以连续或半连续方式进行纯化靶分子的方法。每个单元操作可以采用一个或多个装置以达到该单元操作的预期目的。因此,在一些实施方案中,本文所述的系统包括几个装置,连接所述装置以使得纯化过程能够以连续或半连续方式运行。不希望受到理论的束缚,考虑系统可以封闭在密闭的无菌环境中,从而以无菌方式进行整个纯化过程。在各种实施方案中,系统中的第一个装置是包含起始材料的生物反应器,例如表达待纯化的蛋白的培养细胞。生物反应器可以是任何类型的生物反应器,如分批或补料分批生物反应器,或者连续生物反应器如连续灌注发酵生物反应器。生物反应器可以由任何合适的材料制备,并且可以是任何大小。典型的材料为不锈钢或塑料。在一优选实施方案中,生物反应器是一次性的生物反应器,例如柔性的可折叠袋,设计为一次性使用。澄清可以直接在生物反应器中进行,或者可选地,生物反应器可以简单地用于培养细胞,而澄清在不同的容器中进行。在另一实施方案中,细胞培养物简单地流过深层过滤装置以去除一种或多种杂质。因此,在一些优选实施方案中,生物反应器与用于进行深层过滤的装置流体连通。用于进行澄清的装置(例如,深层过滤装置)一般与利用结合和洗脱色谱进行捕获的装置(例如,包含两个或更多个分离单元的连续多柱色谱装置)连接以流体连通。在一些实施方案中,将用于结合和洗脱色谱的装置与用于进行流过纯化的单元操作连接以流体连通,所述单元操作可以包括一个以上装置/步骤。在一些实施方案中,在用于结合和洗脱色谱的装置与用于流过纯化的第一装置之间包括在线静态混合器或缓冲罐。在一些实施方案中,流过纯化操作包括一个以上装置,例如活性炭装置,然后是AEX色谱装置,然后是用于改变pH的在线静态混合器和/或缓冲罐,然后是CEX色谱装置,然后是病毒过滤装置。装置一般可以是任何合适的形式,例如柱或筒。系统中最后的单元操作可以包括一个或多个装置用于完成配制,所述配制包括渗滤/浓缩和无菌过滤。通常,每个装置包括至少一个入口和至少一个出口,从而使得来自一个装置的输出能够与系统中的连续装置的入口流体连通。在现在工业使用的大部分方法和系统中,纯化方法中使用的每个装置均采用加工设备单元,也称为“滑道”,其通常包括必要的泵、阀、传感器和装置支持物。通常,至少一个滑道与每个装置相关。在本文所述的一些实施方案中,整个纯化过程中使用的滑道的数目减少。例如,在一些实施方案中,仅一个滑道用来进行整个流过纯化操作,其可以包括多个装置,例如活性炭装置,阴离子交换色谱装置,阳离子交换色谱装置和病毒过滤装置,连同溶液条件改变所需的任何设备。因此,在一些实施方案中,单一的滑道可以用于流过纯化中的所有前述步骤。在一些实施方案中,各种装置之间的流体连通是连续的;其中流体直接流过所有装置,没有中断。在其他实施方案中,在各种装置之间可以包括一个或多个阀、传感器、检测器、缓冲罐以及用于任何连续溶液改变的设备,从而暂时中断流体流过系统,如果需要,例如置换/去除特定装置。在一些实施方案中,各种装置之间包括一个或多个缓冲罐。在一些实施方案中,不超过3个和不超过2个缓冲罐存在于整个系统中。位于不同装置之间的缓冲罐具有来自两个装置的第一个的产出的整个体积的不超过25%,并且优选不超过10%。在一些优选实施方案中,本文所述的系统包括一个或多个静态混合器用于缓冲液交换和/或连续稀释。在一些实施方案中,系统还包括一个或多个传感器和/或探针用于控制和/或监测系统内的一个或多个过程参数,例如温度、压力、pH、电导率、溶解氧(DO)、溶解二氧化碳(DCO2)、混合速率、流速、产物参数。在某些情况下,传感器还可以是光学传感器。在一些实施方案中,过程控制可以以不损害系统的无菌性的方式实现。在一些实施方案中,传感器和/或探针可以连接至传感器电子模块,其输出可以发送至端子板(terminalboard)和/或继电器盒。传感操作的结果可以输入至计算机实施的控制系统(例如,计算机)用于计算和控制各种参数(例如,温度和重量/体积测量、纯度)以及用于显示和用户界面。这样的控制系统还可以包括电子、机械和/或气动系统的组合以控制过程参数。应当理解控制系统可以进行其他功能,并且本发明并不限于具有任何特定功能或功能集。通过以下实施例进一步说明本发明,所述实施例不应当理解为限制性的。本申请中引用的所有参考文献、专利和公开的专利申请的内容以及图均援引加入本文。实施例实施例1:纯化单克隆抗体的方法在这个代表性实施例中,利用连续方式的纯化方法完成单克隆抗体的纯化,其中以连续操作的方式连接各种单元操作。示例性方法在图2中示出。下文所述的代表性实施例包括以所列顺序进行的以下步骤:利用深层过滤澄清;使用一个或多个在线静态混合器以改变溶液条件;利用连续多柱色谱的A蛋白结合和洗脱色谱,其采用两个分离单元;产出的pH调节,其利用一个或多个静态混合器;以及流过纯化,其采用深层过滤,然后是活性炭,然后是阴离子交换色谱,然后利用静态混合器进行pH调节,然后是阳离子交换色谱,然后是病毒过滤。在这个实施例中,在补料分批生物反应器中产生基于CHO的单克隆抗体(MAb05)。将约5.5L细胞培养物用0.054m2D0HC(EMDMillipore)初步深层滤器加工,然后用0.054m2X0HC(EMDMillipore)第二深层滤器进一步澄清,其中两者均以10LMH通量加工,使得装载为约100L/m2。使来自深层过滤的流出物与5MNaCl溶液以1:10比例接触,然后通过静态混合器混合,然后通过无菌滤器。在每个深层滤器之前和无菌滤器之后监测压力(图3)。静态混合器之后,使溶液通过SHC无菌滤器(EMDMillipore)至3200L/m2的最终装载。将来自无菌滤器的流出物引向缓冲罐,用传感器监测所述缓冲罐以确定过滤的量。在A蛋白连续多柱色谱(CMC)上的每个装载循环之前收集1mL样品(图4)。在缓冲罐中加工并收集约70mL细胞培养物之后,将澄清的溶液同时装载入下一步用于A蛋白捕获。A蛋白捕获由在改良的AktaExplorer100上运行的两个A蛋白柱组成。A蛋白柱具有10mL的ProSepUltraPlusProteinA介质,装入1.6cmIDVantage-L(EMDMillipore)色谱柱至10.25和10.85cm的床高。将柱用1XPBS,0.5MNaCl平衡5个柱体积(所有柱体积均基于最小的柱)。在整个运行中,设置装载流速以具有~1分钟的装载停留时间。在初始装载期间,将两个柱连续放置,其中将主柱的流出物直接装载至第二个柱,直至达到特定装载体积。在特定装载体积通过柱之后,终止进料,并且使2个柱体积(CV)的平衡缓冲液通过主柱至第二个柱。然后放置主柱以进行洗涤、洗脱、清洁和重新平衡,同时装载第二个柱作为主柱。第一个柱重新平衡之后,将该柱移至第二位置以与新的主柱顺序放置。重复这个系列事件,将原来的主位置柱装载至设定体积之后,每个柱占据主位置。将第一个柱装载总计3次,并且将第二个柱装载2次。将来自每个柱的洗脱物收集入烧杯混合,利用UV触发器控制洗脱的开始和结束时间。收集并混合最初的两次洗脱物之后,将溶液泵入缓冲罐,与tris的2M溶液混合,并且通过两个静态混合器加工以将pH增加至pH8.0,其中静态混合器之后立即测量所得溶液的pH。然后通过A1HC深层滤器(EMDMillipore)加工pH已调节的溶液,之后是装有活性炭的1cmIDOmnifit柱。然后使来自活性炭柱的洗脱物连续通过阴离子交换色谱装置(例如,ChromaSorbTM)(EMDMillipore))至4kg的MAb/LChromaSorbTM的装载。然后将来自ChromaSorbTM阴离子交换剂的流出物与1M乙酸混合,然后通过静态混合器加工以将pH降低至pH5.5。然后使来自静态混合器的pH已调节的溶液流过用作前置滤器的阳离子交换色谱装置,然后利用Pro膜(EMDMillipore)的病毒过滤。将来自病毒滤器的洗脱物引至汇集罐并采样。这个纯化方法提供满足所有纯化目标的终溶液,具体地HCP<1ppm,聚集体<1%,对于整个过程mAb05回收率>60%。实施例2:纯化单克隆抗体的方法在这个代表性实施例中,利用纯化方法完成单克隆抗体的纯化,其中以下文所述的顺序连接各种单元操作。下文所述的代表性实施例包括以所列顺序进行的以下步骤:利用刺激响应性聚合物澄清,然后进行离心;使上清与盐接触;利用连续多柱色谱的A蛋白结合和洗脱色谱,其采用两个分离单元;产出的pH调节,其利用一个或多个静态混合器;以及流过纯化,其采用深层过滤,然后是活性炭,然后是阴离子交换色谱,然后利用静态混合器进行pH调节,然后是阳离子交换色谱,然后是病毒过滤。在这个实施例中,在补料分批生物反应器中产生基于CHO的单克隆抗体(MAb05)。使总计7升的细胞培养物与刺激响应性聚合物(改性的聚烯丙基胺;对盐添加响应)的溶液接触至0.2%v/v的最终聚合物浓度。将细胞培养物与刺激响应性聚合物溶液混合约10分钟。添加约175mL的2MK2HPO4溶液,并且将细胞培养物混合额外的10分钟。然后通过添加2Mtris碱使pH升高至7.0并混合15分钟。然后将溶液以2L等分试样于4,500xg离心10分钟,并且将上清倒出并保留。弃去固体。将细胞培养物上清混合,然后与5MNaCl以1:10比例以分批模式混合,连续搅拌。在这个点测量溶液的最终电导率,为55±5mS/cm。将所得的溶液通过0.22μmExpressSHCfilter(EMDMillipore)无菌过滤。无菌过滤的溶液是A蛋白色谱的装载材料。A蛋白捕获步骤由在改良的AktaExplorer100上运行的两个A蛋白柱组成。A蛋白柱具有10mL的ProSepUltraPlusProteinA介质,装入1.6cmIDVantage-L(EMDMillipore)色谱柱至10.25和10.85cm的床高。将柱用1XPBS,0.5MNaCl平衡5个柱体积,CV(所有柱体积均基于最小的柱)。在整个运行中,设置装载流速以具有约1分钟的装载停留时间。在初始装载期间,将两个柱连续放置,其中将主柱的流出物直接装载至第二个柱,直至达到特定装载体积。在特定装载体积通过柱之后,终止进料,并且使2个CV的平衡缓冲液通过主柱至第二个柱。然后放置主柱以进行洗涤、洗脱、清洁和重新平衡,同时装载第二个柱作为主柱。第一个柱重新平衡之后,将该柱移至第二位置以与新的主柱顺序放置。重复这个系列事件,将原来的主位置柱装载至设定体积之后,每个柱占据主位置。将每个柱装载总计7次。用部分收集器收集来自每个柱的洗脱物,利用UV触发器以控制洗脱的开始时间并收集至约3.5CV的恒定体积。流过纯化包括6个主要步骤:深层滤器;活性炭;阴离子交换色谱;在线pH调节;阳离子交换色谱;以及病毒过滤。图5说明这些步骤连接的顺序。示意图中还示出必需的泵和传感器,例如压力、电导率和UV的传感器。将所有装置在不同的位置单独湿润,然后如图5所示进行装配。根据制造商的方案或如本文所述将装置湿润并预处理。简单地说,将深层滤器(A1HC)用100L/m2的水然后5体积的平衡缓冲液1(EB1:用1MTris-碱,pH11调整至pH7.5的A蛋白洗脱缓冲液)冲洗。将10mL活性炭装入2.5cmIDOmnifit柱。将该柱用10CV水冲洗,然后用EB1平衡直至pH稳定在pH7.5。将1.2mL阴离子交换膜(7层)堆入47mm直径的Swinex装置。将该装置用水以12.5CV/min湿润至少10min,然后5个装置体积(DV)的EB1。具有12个元件的一次性螺旋静态混合器(KofloCorporation,Cary,IL)用来进行在线pH调整。将3层阳离子交换色谱装置(0.12mL膜体积)用10DV水湿润,然后5DV的平衡缓冲液2(EB2:利用1M乙酸调整至pH5.0的EB1)。将该装置用5DV的EB2+1MNaCl进一步处理,然后用5DV的EB2平衡。将3.1cm2Pro病毒过滤装置用加压30psi的湿润至少10分钟。然后每分钟监测流速,直至流速连续3分钟保持恒定。将所有装置湿润并平衡之后,将它们如图5所示连接。使EB1运行通过整个系统,直至所有压力读数和pH读数稳定。平衡之后,使进料(即,调整至pH7.5的A蛋白洗脱物)进行流过纯化。在运行期间,在缓冲罐之前和Pro之后收集样品以监测MAb浓度和杂质水平(例如,HCP、DNA、渗出的A蛋白和聚集体)。将进料加工之后,将系统用3个装置体积的EB1冲洗以回收仍保留在各种装置以及装置之间的连接管路中任何MAb。图6示出流过纯化中深层滤器、活性炭和Pro之后的压力读数。一般来说,压力的增加表示过滤柱的污染。值得注意的是,由于活性炭之前使用的深层滤器,活性炭柱受到相当保护以防任何沉淀。Pro压力随时间缓慢增加,但是低于操作最大限度(50psi)。阴离子交换色谱装置之后测量的作为时间函数的HCP突破低于10ppm的目标。Pro混合物中的最终HCP为<1ppm(表1)。洗脱部分中的平均渗出的A蛋白为32ppm。Pro混合物中渗出的A蛋白为4ppm。聚集体从1%减少至0.4%。来自实验的结果在下文表II中总结。表II实施例3:分批A蛋白色谱之后的流过纯化方法在这个代表性实验中,利用流过纯化进一步纯化以前通过分批A蛋白纯化的单克隆抗体溶液以满足最终纯化和收率目标。这通过以流过方式进行以下步骤来完成:活性炭;阴离子交换色谱;在线pH改变;阳离子交换色谱和病毒过滤。安装、平衡和运行与实施例2相似,除了一些小的修改。起始材料是来自分批A蛋白方法的A蛋白洗脱物。具体地,为这个运行加工的MAb进料是流速0.6mL/min的102mL的13.5mg/mLMAb05。在这个研究中不使用深层滤器,因为在进行流过纯化之前将进料通过无菌的0.22μm滤器过滤。使用2.5mL活性炭柱,其对应0.55kg/L的装载。将2个阴离子交换色谱装置(0.2和0.12mL)顺序连接以获得4.3kg/L的装载。将2个1.2mL阳离子交换色谱装置(每个装置上7层膜)平行连接以处理聚集体。阳离子交换色谱装置上的MAb装载为约570mg/mL。3.1cm2Pro装置用于病毒过滤。阴离子交换色谱装置之后作为时间函数的HCP突破低于10ppm的目标(图7)。Pro混合物中的最终HCP为<1ppm(表2)。通过阳离子交换色谱装置将聚集体从5%减少至1.1%(图8)。来自实验的结果在下文表III中总结。表III图9示出活性炭和Pro之前的压力读数。一般来说,增加的压力表明滤器污染。在这种情况下,在活性炭的情况下压力有中等(约5psi)增加。Pro压力随时间缓慢增加,但是低于操作最大限度(50psi)。如图10所示,调节之后的pH保持在pH4.9的靶设置点,除了开始期间。通过在在线pH调节之后和泵至阳离子交换色谱装置之前使用缓冲罐可以减少pH峰值。实施例4:连接至A蛋白色谱的澄清在这个代表性实施例中,将澄清以连续方式连接至A蛋白色谱。在这个实验中,用于深层过滤的流速是由深层过滤之后的A蛋白色谱所用的停留时间决定的。这个代表性实施例中使用的流速比常规深层过滤中使用的慢,导致A蛋白色谱之后回收的产出中较高的HCP去除。获得单克隆抗体(MAb04)细胞培养物进料并分为3个相等部分。利用D0HC和X0HC初步和第二深层滤器(EMDMillipore)以1:1的滤器面积比例和100升/m2/小时(LMH)的流速将第一部分(表IV中的样品#1)澄清,其为标准澄清方法中使用的典型通量。测试流出物的MAb浓度和HCP量。也用相同类型和比例的滤器将细胞培养物进料的第二部分(样品#2)澄清,除了10LMH的流速。这个流速是基于澄清之后的A蛋白色谱柱的6分钟停留时间。在两种情况下,加工相同量的材料,对应于约100L/m2的通量,并且以相同方式处理两个样品。使两个澄清的细胞培养物流体进行A蛋白结合和洗脱色谱,获得表IV中的样品#3和#4,其中分别进行澄清和A蛋白色谱(即,不连接)。与较慢流速相关的样品#4丢失,因此不能分析。通过这样的装配加工第三部分的细胞培养物进料(样品#5),所述装配将两个深层滤器的流出物连续装载至A蛋白色谱柱(即,其中澄清和A蛋白色谱连接)。使用与上文相同的色谱条件。测试所有A蛋白洗脱物的MAb浓度和HCP量。在样品#5的情况下,A蛋白色谱的6分钟停留时间决定澄清的流速为约10LMH。所有结果如表IV所示。结果显示慢澄清之后HCP水平低2x(即,样品#2相对于样品#1)。由于样品(即,样品#4)丢失,未报道A蛋白色谱之后相应样品的直接比较。与样品#5相关的结果相对于样品#3的比较表明,以连续和连接的方式进行澄清和A蛋白色谱与分别运行澄清和A蛋白色谱时的纯度相比,提供MAb纯度的8X提高。比较估计的LRV值证明该差异。表IV实施例5:利用刺激响应性聚合物澄清在这个代表性实验中,利用两种不同方法使用刺激响应性聚合物进行澄清。在一种方法中,将刺激响应性聚合物直接添加至包含表达靶分子的细胞培养物的生物反应器(其可以为一次性使用或抛弃式生物反应器)中。在第二种方法中,将细胞培养物泵出生物反应器,并且利用一个或多个在线静态混合物使其与刺激响应性聚合物接触。在涉及直接在生物反应器中进行澄清的方法的情况下,将60mL的10wt%刺激响应性聚合物添加至包含细胞培养物的3L抛弃式生物反应器中并混合至少5分钟。将75mL的2MK2HPO4添加至生物反应器中并混合至少5分钟。在搅拌的同时将2MTris碱添加至生物反应器中,以便将pH增加至7-7.3之间(约50-100mL)。允许溶液混合至少1分钟,然后泵出生物反应器并以100LMH的速度直接装载至深层滤器以去除沉淀。在涉及使用在线静态混合器的方法的情况下,以93.5LMH的速度将细胞培养物泵出生物反应器至阀或连接器,在这里其与流速1.9LMH的刺激响应性聚合物流接触。然后合并的流流入适当大小的在线静态混合器以提供高效混合。然后流流入第二阀或连接器,在这里其与流速2.3LMH的聚合物的刺激接触。合并的流流入适当大小的第二静态混合器以提供高效混合。然后流流入第三阀或连接器,在这里其与流速约2.3LMH的2MTris碱流接触(调整tris的流动以维持合并的流的pH为7-7.3)。合并的流流入适当大小的第三静态混合器以提供高效混合。然后将这个流直接装载在一个或多个深层滤器上以去除沉淀。应当注意不同的进料可能对pH更敏感,或者可能与不同的刺激相应聚合物相互作用。通过具有在生物反应器中、在线或者两者的组合处理进料的能力可以最大化收率。如本文所述,使用刺激响应性聚合物导致在澄清步骤之后的结合和洗脱色谱加工步骤(例如,A蛋白色谱步骤)中更好的表现。此外,观察到这个代表性实施例中描述的方法使得相对于不包括使用刺激响应性聚合物的澄清方案,下一结合和洗脱色谱步骤的色谱循环数量增加。最后,当在结合和洗脱步骤的上游使用刺激响应性聚合物时,结合和洗脱色谱步骤之后获得的洗脱物看来在pH改变时表现出较少浊度产生。实施例6:利用沉淀澄清对A蛋白色谱的洗脱性能的影响在这个代表性实验中,研究在产生MAb04的基于CHO的细胞培养物上进行的澄清的类型对A蛋白色谱的洗脱性能的影响。将单一批次的细胞培养物平均分为3个等分试样。利用辛酸使一个等分试样进行澄清;利用刺激响应性聚合物(即,改性的聚烯丙基胺)使另一等分试样进行澄清;而第三等分试样未处理。用辛酸或刺激响应性聚合物沉淀之后,利用离心去除固体。在混合与两个处理的培养物相同量的时间之后,将未处理的细胞培养物也离心。使用之前全部无菌过滤。对于每个澄清的溶液,测量溶液的电导率并用5MNaCl调整,直至电导率达到约54mS/cm。对于所有溶液,添加的NaCl的平均浓度为约0.5M。在装载至不同的A蛋白色谱柱之前将较高电导率的细胞培养物溶液无菌过滤。为了对每个进料溶液进行A蛋白色谱,用ProSepUltraPlus介质填充3个柱,在10mm内径的OmniFit柱中,一个柱具有4mL填充介质,而另外两个均具有4.24mL填充介质。对于4mL和4.24mL柱,柱床高分别为5.1和5.4cm。所有色谱实验均在Explorer100(辛酸和刺激响应性聚合物处理的)或Avant25(未处理的)上进行。在第一次装载之前,将每个柱用至少5个柱体积(CV)的0.15M磷酸洗涤。利用相同的基本程序进行所有色谱运行。将柱用5CV的1XTBS+0.5MNaCl平衡,然后装载至~30g的MAb04每升包装介质。用2CV的平衡缓冲液将装载溶液冲掉,然后用25mMTrispH7.0进行4CV洗涤。柱洗涤之后,用5CV的25mM甘氨酸HCl、25mM乙酸pH2.5将产物从柱洗脱。利用系统的部分收集器收集洗脱物,利用UV触发器控制收集开始,并且收集4CV的恒定体积。将柱用4CV的0.15M磷酸清洁,然后是用平衡缓冲液的10CV的重新平衡步骤。不同澄清样品的A蛋白纯化进行12(未处理的)和9(辛酸和刺激响应性聚合物处理的)个连续循环。图11、12和13示出所有实验的重叠色谱,在每种情况下顺序示出装载、洗脱和清洁峰。显然没有刺激响应性聚合物处理的洗脱峰与来自刺激响应性聚合物处理的细胞培养物的洗脱峰相比具有可见和显著的拖尾,表明在未使用刺激响应性聚合物时较低效率的洗脱。此外,与未处理的细胞培养物相比,刺激响应性聚合物处理的细胞培养物的装载溶液的吸光度明显较低,其中吸光度减少0.4-0.5吸光度单位(AU),表明对柱较低的杂质挑战。洗脱之后,使两组样品的pH升高至5.0,然后进一步升高至pH7.5。在pH5.0下,没有可见的溶液混浊。但是,在pH7.5下,所有洗脱样品均表现出升高水平的浊度,未处理的样品有显著较高水平(99-644NTU),而刺激响应性聚合物处理的洗脱混合物浊度范围为69.5-151NTU,这相对于未处理的样品显著较低。实施例7:利用活性炭从亲和捕获洗脱物同时去除可溶性和不溶性杂质在这个代表性实验中,证实在与纤维素介质包装时,活性炭能够从来自A蛋白结合和洗脱色谱步骤(即,捕获步骤)的洗脱物去除不溶性(即,颗粒)以及可溶性杂质。在现在工业中使用的许多常规方法中,A蛋白亲和捕获步骤之后常使用深层滤器以在下一步骤之前去除不溶性杂质(即,颗粒),下一步骤通常是阳离子交换结合和洗脱色谱步骤。在本文所述的方法中,避免在A蛋白结合和洗脱色谱之后使用深层滤器。值得注意的是,通过在A蛋白结合和洗脱色谱步骤之后使用活性炭,不仅避免需要阳离子交换结合和洗脱色谱步骤,而且还避免需要使用深层滤器。这提供许多优点,包括例如由于消除通常使用的步骤,所以减少总成本、加工时间以及总物理空间。如本文所证实的,使用活性炭使得同时去除可溶性杂质(例如,HCP)以及不溶性杂质(例如,颗粒)。使单克隆抗体MAb04的细胞培养物进行A蛋白亲和色谱,并且通过逐滴添加1.0MTris碱,将洗脱混合物的pH从pH4.8调整至pH7.5,以便改变溶液条件适合方法中的下一步骤。但是,升高溶液的pH增加浊度,在这种情况下测量为28.7NTU。在下文中这种溶液称作MAb04A蛋白洗脱物。切割直径5/8英寸且厚度5mm的活性炭-纤维素介质片的圆形切片并小心地装载至15mm直径色谱柱(SKU:006BCC-25-15-AF,DibaIndustries,Inc,Danbury,CT06810USA)以获得0.89mL的柱体积。将柱用25mMTrispH7冲洗。使约40mL混浊的MAb04A蛋白洗脱物以0.20mL/min的流速通过柱,导致4.5分钟的停留时间。收集4个10mL部分。评价每个单独的部分以及由全部4个部分组成的合并混合物的浊度并分析HCP和MAb的浓度。利用来自CygnusTechnologies,Southport,NC,USA的目录号F550的可商购的ELISA试剂盒,按照试剂盒制造商的方案进行HCP分析。利用装有AA蛋白分析柱的AgilentHPLC系统测量MAb浓度。结果如表V所总结。结果显示活性炭对于从A蛋白洗脱物同时去除不溶性杂质(即,颗粒物质)以及可溶性杂质(即,HCP)出人意料地有效。A蛋白洗脱物的浊度从28.7NTU减少至9.9NTU,而HCP的浓度从758ppm减少至104ppm。这个结果证实在与纤维素介质包装时,活性炭可以用于去除可溶性以及不溶性杂质。表V实施例8:停留时间对通过活性炭去除杂质的影响在这个代表性实验中,证实如本文所述,在连续方法中使用活性炭时,相对于不以连续方式使用时,其获得更大的杂质去除。值得注意的是,如本文所述,在连续方法中采用活性炭时,其中活性炭通常与上游的A蛋白结合和洗脱色谱步骤以及下游的阴离子交换色谱介质流体连通,样品以相对于活性炭作为独立操作单独使用时较慢的流速(即,具有较长的停留时间)流过活性炭。在这个实施例中,使A蛋白纯化的MAb04洗脱物进一步以4种不同流速进行流过纯化步骤,所述流过纯化步骤采用系列配置的活性炭(AC)和阴离子交换色谱膜装置(例如,ChromaSorbTM装置)。进料中的抗体浓度确定为7.5g/L;HCP浓度确定为296ppm。在pH7.0下进行实验。NucharHD级的活性炭获得自MeadWestVaco。将其装在玻璃Omnifit柱中至0.8mL的床体积。将具有膜体积0.08mL的阴离子交换色谱装置与AC柱系列连接。选择流速,从而AC上的停留时间(RT)为1、2、4或10分钟。对于4个不同运行(即,具有上文所述的4种不同停留时间),将AC和阴离子交换色谱装置上装载的MAb分别维持恒定在0.5kg/L和5kg/L。收集来自阴离子交换色谱装置的突破的样品并分析MAb和HCP浓度。上文提到的在AC上4种不同停留时间的作为阴离子交换色谱装置上装载的MAb的函数的HCP的突破如图14所示。如图14所证实的,在AC上较低的流速(即,较长的停留时间)在相同MAb装载下提供较好的纯度。或者,在较慢流速下可以用较小体积的AC和阴离子交换色谱装置获得相同纯度。例如,可以利用2kg/L装载在阴离子交换色谱装置上(和0.2kg/L在AC上),以1分钟停留时间操作获得~1ppmHCP的靶纯度。值得注意的是,在以10min的较长停留时间(即,较慢流速)操作,在阴离子交换色谱装置上5kg/L的显著较高装载(以及AC上0.5kg/L)时,可以获得相同纯度。这个发现突出了潜在的经济优势,在降低流速时,使用较少的消耗性纯化材料以获得相同纯度。实施例9:在流过纯化加工步骤中使用缓冲罐的优点在这个代表性实验中,证实了如本文所述,在流过纯化加工步骤中使用缓冲罐的一个或多个优点。通常,阳离子交换流过色谱要求样品在约5的pH下。因此,在进行流过纯化时,当样品从阴离子交换色谱步骤流至阳离子交换色谱步骤时,样品的pH必须从约中性pH改变至约pH5.0。虽然pH的改变可以通过使用在线静态混合器来完成,但是这个实施例证实额外地使用缓冲罐是有利的。因此,样品的流动如下:阴离子交换色谱步骤至在线静态混合器至缓冲罐至阳离子交换色谱步骤。观察到如果仅在线静态混合器用于在阴离子交换和阳离子交换流过色谱步骤之间改变pH条件,如利用pH探针测量的,看到突然增加(即,峰)。应当理解由于样品的组成和添加以改变pH的缓冲液的组成的化学差异,所以观察到pH峰。这种pH峰是不期望的,因为其使得样品加工时间比最佳结果所需的时间高。如图15所示,这个实施例证实通过在在线静态混合器之后和样品接触阳离子交换色谱步骤之前使用缓冲罐可以减少或消除这种pH峰。如图15所示,不使用缓冲罐时,观察到约pH6.5的pH峰。但是,如本文所述,当使用缓冲罐时,pH降至低于pH5.3,这接近随后的阳离子交换色谱步骤的期望pH。实施例10:以连续方式运行流过纯化加工步骤对产物纯度没有不利影响在这个代表性实验中,证实以连续方式运行流过纯化方法对产物纯度没有不利影响。换句话说,通过比较来自以连续方式运行的流过纯化加工步骤的产物纯度与其中单独步骤分别进行的产物纯度,证实对产物纯度没有不利影响。这个实施例证实通过将活性炭和阴离子交换色谱装置(例如,ChromaSorbTM)与作用为病毒预滤器的阳离子交换色谱装置和病毒过滤装置系列连接,并且连续地操作整个流过纯化加工步骤,与活性炭和阴离子交换色谱装置与阳离子交换色谱装置和病毒过滤装置分离时相比,获得相似能力的病毒滤器。这个实验的实验设置如图16所示。图16中的选项1指连续方法,其中将来自缓冲罐的样品(阴离子交换色谱装置之后存在)直接进料至阳离子交换色谱装置,然后是病毒过滤装置。图16中的选项2指分批方法,其中在活性炭和阴离子交换色谱装置之后将样品混合,并且在一段时间之后,将其通过阳离子交换色谱装置和病毒过滤装置进行加工。在这个实验中,起始样品为A蛋白结合和洗脱色谱洗脱物,其具有250ppm的HCP浓度。观察到活性炭和阴离子交换色谱装置之后,HCP水平降低至约4ppm。在分批方法(选项2)的情况下,观察到病毒过滤之后的最终HCP浓度为1ppm左右;而在连续方法(选项1)的情况下,病毒过滤之后的HCP浓度为约2ppm,两者均接近利用本领域已知的方法和本文所述的那些方法如实施例7所述的测定可以定量的下限。这个结果表明以连续方式进行流过纯化加工步骤中的所有步骤获得这样的产物纯度,其与作为独立操作进行一个或多个步骤时相当。此外,注意到如图17所示,两种方法的压力特征谱也非常相似。实施例11:停留时间对病毒过滤膜性能的影响在这个代表性实验中,研究了停留时间对病毒过滤性能的影响。观察到在流过纯化加工步骤期间,较低的通过阳离子交换色谱步骤和病毒过滤步骤的流速获得较高的病毒滤器通量。将如美国专利申请号13/783,941(内部参考号MCA-1423)所述的具有膜面积3.1cm2和膜体积0.12mL的三层阳离子交换色谱装置与具有3.1cm2的膜面积的病毒过滤装置系列连接。将20mM乙酸钠、pH5.0缓冲液中的约3mg/mL多克隆人IgG(Seracare)通过这两个连接的装置进行加工。以两种不同流速100和200LMH进行实验。将0.22μm无菌滤器置于阳离子交换色谱装置和病毒过滤装置之间。压力传感器用于测量在不同流速下穿过组件的压力。正常情况下,约50psi的压力是病毒过滤膜污染或堵塞的指示。如图18所示,当以较低流速(即,100LMH)进行实验时,相对于以较高流速(即,200LMH)加工样品时,通过病毒过滤膜可以加工更多样品体积(即,更高通量)。这可以归因于样品在阳离子交换色谱装置中较长的停留时间,这可以实现高分子量IgG聚集体结合的提高,从而防止病毒滤器的早期堵塞。实施例12利用AMPS/DMAM接枝共聚物修饰的强阳离子交换(CEX)树脂以各种停留时间从MAb进料去除聚集体在250mL玻璃瓶中,添加64ml的ToyopearlHW75-F色谱树脂的湿饼。然后,将115g的5M氢氧化钠、18.75g的硫酸钠和4mL的烯丙基缩水甘油醚(AGE)添加至包含树脂的瓶中。然后将瓶置于杂交仪中在50℃下过夜,以中速旋转。第二天,将树脂在烧结玻璃滤器组件(EMDMilliporeCorporation,Billerica,MA)中滤干,并且将湿饼用甲醇洗涤,然后用去离子水漂洗。在玻璃小瓶中,添加10mL的AGE活化树脂的湿饼。向玻璃小瓶添加0.2g的过硫酸铵、0.3g的AMPS、1.2g的DMAM和48g的去离子水,并且将小瓶加热至60℃维持16小时。第二天,将树脂在烧结玻璃滤器组件(EMDMilliporeCorporation,Billerica,MA)中滤干,并且将湿饼用甲醇和去离子水的溶液洗涤,将树脂标记为Lot#1712。将标记为Lot#1712的树脂装在内径6.6mm的色谱柱中至3cm的床高,获得约1mL包装的树脂床。装备AKTAExplorer100(色谱系统)并用缓冲液平衡,所述缓冲液适合筛选这些柱用于流过色谱。将包含树脂样品的色谱柱装至具有平衡缓冲液的色谱系统。原料为IgG1(MAb5)原料,其利用UltraPlus亲和色谱介质纯化,并且用2MTris碱将其调整至pH5.0。将A蛋白混合物的终浓度稀释至4mg/mL,包含5.5%聚集的产物以及约3.2mS/cm的电导率。以1、3或6分钟的停留时间装载树脂,并且装载至144mg/mL的装载密度。3分钟停留时间的带峰部分包含95.6%聚集体,表明对聚集物质的高水平的选择性。结果在下文的表VI中示出。表VI示出在6、3或1分钟停留时间下,具有pH5.0的MAb5的Lot#1712的单体和聚集体的保留。如表VI所示,平均而言,对于测试的所有停留时间,与聚集的物质相比,可以相对早地以接近进料浓度的浓度收集单体物质,这表明选择性相对来说对流速不敏感。表VI如图19所示,在流过中收集大部分的产物,并且这通过蛋白UV痕迹相对快速的突破来指示。带峰大小一般基于条件和装载的总质量变化,但是其相对富集95.6%的聚集体物质,相比之下装载材料仅具有5.5%聚集体。实施例13利用AMPS/DMAM接枝共聚物修饰的阳离子交换(CEX)有翼的纤维从Mab进料去除聚集体在这个代表性实验中,阳离子交换的有翼纤维用作固体支持物。在1L玻璃瓶中,将20g的干尼龙多叶或有翼纤维与400g的4M氢氧化钠、24g的硫酸钠和160mL的烯丙基缩水甘油醚(AGE)合并。然后将瓶置于杂交仪中在50℃下过夜,以中速旋转。第二天,将纤维在烧结玻璃滤器组件中过滤,然后将纤维用甲醇洗涤并用Milli-Q水漂洗。一天后,将纤维用水洗涤,然后用甲醇洗涤,然后再次用水洗涤,抽吸至干饼并在真空烘箱中于50℃下干燥1天。将所得的样品标记为样品#1635。在3个不同玻璃小瓶中,将2克样品#1635的干饼、AGE活化的纤维称出并添加至玻璃小瓶用于通过接枝额外修饰。以表VII指定的量向玻璃小瓶添加过硫酸铵、AMPS、DMAM和去离子水,并且将小瓶加热至60℃维持16小时,同时连续旋转。第二天,将纤维样品在烧结玻璃滤器组件中过滤,并且将湿饼用去离子水溶液洗涤。将包含纤维的小瓶标记为Lot#1635-1、1635-2和1635-5。然后,将Lot#1635-5滴定小离子容量,据发现其为约28μmol/mL。然后认为样品#1635-1和#1635-2也具有少于28μmol/mL的小离子容量。表VII成分#1635-1#1635-2#1635-5纤维(g)2.02.02.0过硫酸铵(g)0.180.180.18AMPS(g)0.480.600.72DMAM(g)0.480.600.72水(g)28.8628.6228.38将所得的改性的有翼纤维Lot#1635-1、#1635-2、#1635-5装在内径6.6mm的色谱柱中至3cm的床高,获得约1mL包装的纤维床。装备AKTAExplorer100(色谱系统)并用缓冲液平衡,所述缓冲液适合筛选这些柱用于流过色谱。将包含有翼纤维样品的色谱柱装至具有平衡缓冲液的色谱系统。原料为IgG1(MAb5)原料,其利用A蛋白亲和色谱介质纯化,并且用2MTris碱将其调整至pH5.0。A蛋白混合物的终浓度为4mg/mL,并且包含5.5%聚集或HMW产物。这是与实施例12中使用的相同的原料。将装有纤维Lot#1635-1和Lot#1635-2的纤维直接装载至64mg/mL的质量负载,并且将装有纤维Lot1635-5的柱装载至80mg/mL的质量负载。结果在下文的表VIII中示出。表VIII*N/A=不适用实施例14:刺激响应性聚合物澄清以及将NaCl添加至澄清的细胞培养物对A蛋白洗脱混合物纯度的联合效应在这个代表性实验中,利用深层过滤或沉淀步骤,特别地利用刺激响应性聚合物(即,改性的聚烯丙基胺)将MAb04细胞培养液澄清。将所得的澄清的溶液装载至包含UltraPlus树脂的柱,或者在装载至该柱之前添加NaCl至0.5MNaCl的终浓度。在NaCl添加不存在的情况下,在装载之前将柱用1XTBS平衡,而有NaCl时,平衡缓冲液为1XTBS,0.5MNaCl。将所有柱装载至约30g的MAb04每升树脂,然后用平衡缓冲液洗涤2CV,之后用25mMTrispH7.0进行3CV洗涤。将结合的MAb04用25mM甘氨酸HCl、25mM乙酸pH2.5溶液洗脱,然后在用适当的平衡缓冲液重新平衡之前用5CV的0.15M磷酸pH1.6清洁。图20示出洗脱和清洁峰的重叠,其中产生自刺激响应性聚合物处理的细胞培养物的洗脱峰显示更清晰的尾和减少的清洁峰。在NaCl的存在下,用刺激响应性聚合物处理的细胞培养物装载期间,清洁峰进一步减少,从而表明树脂上较低水平的强结合杂质。实施例15中间洗涤步骤期间不同NaCl浓度的效应与装载溶液中存在的0.5MNaCl的效应的比较在这个代表性实验中,将中间洗涤步骤期间不同NaCl浓度对通过A蛋白色谱获得的单克隆抗体(MAb)洗脱混合物纯度的影响直接与在装载至A蛋白色谱柱的样品中具有0.5MNaCl的影响进行比较。UltraPlusA蛋白介质的5mL柱获得为预装柱。利用Explorer色谱系统进行所有色谱运行,所有步骤流速均为1.7mL/min(~3分钟停留时间)。相同的柱用于所有实验。对于第一组实验,其中中间洗涤中存在NaCl,色谱步骤采用1XTBS进行5个柱体积平衡,然后装载300mL包含浓度约0.57g/L的靶蛋白(称作MAb05)的澄清细胞培养物。细胞培养物装载之后,将柱用10mL平衡缓冲液冲洗以去除任何未结合的产物、杂质和其他细胞培养物组分。然后将柱用5个柱体积的25mMtris,pH7.0(还包括0.5MNaCl)洗涤。随后将柱用5个柱体积的没有NaCl的25mMTris,pH7.0洗涤。利用包含25mM乙酸和25mM甘氨酸HCl的pH2.5的缓冲液用5个柱体积以上从柱洗脱产物蛋白(MAb05)。随后将柱用5个柱体积的0.15M磷酸清洁,然后是利用平衡缓冲液的10个柱体积再生步骤。进行相同运行,其中第一洗涤期间的NaCl浓度在0、1.5和2M之间变化。利用相同的柱进行下一实验,方案有以下改变。将装载的细胞培养物样品与一定体积的5MNaCl混合,从而澄清的细胞培养物中的最终NaCl浓度为0.5MNaCl。修改平衡缓冲液以在1XTBS溶液中包括0.5MNaCl。将柱用333mL澄清的细胞培养物装载,存在0.5MNaCl以保持靶蛋白(MAb05)的恒定质量装载。如以前所述进行中间洗涤,其中整个使用总计10个柱体积的25mMTris,pH7.0。洗脱和清洁步骤以及缓冲液与上文所述相同。表IX提供每个实验进行的步骤的简短总结,在进行潜在改变时显示用于每个步骤的缓冲液和体积。表IX测量装载培养物和洗脱混合物的样品的MAb05浓度和HCP浓度。图21显示HCPLRV作为中间洗涤步骤或装载步骤中使用的NaCl浓度的函数。该图说明与向中间洗涤步骤添加不同浓度的NaCl相比,在装载阶段期间,当平衡缓冲液和澄清的细胞培养物中存在0.5MNaCl时HCP去除(纯化)水平提高。结果还提供测量的基于ng的HCP/mg的MAb05的以百万分比(ppm)计的HCP浓度,显示为相应条内的数字。此外,图22示出与装载的质量相比,洗脱混合物中回收的%MAb05,其中清楚观察到中间洗涤步骤期间存在2MNaCl时,发生产物的显著损失。实施例16基于期间包括添加剂的A蛋白纯化步骤完成的产物纯化的比较在这个代表性实验中,在通过仅中间洗涤中存在添加剂的A蛋白色谱完成的纯化与用平衡缓冲液和装载的细胞培养物样品中的添加剂完成的纯化之间进行直接比较。UltraPlusA蛋白介质的5mL柱获得为预装柱。利用Avant色谱系统进行所有色谱运行,所有步骤流速均为1.7mL/min(~3分钟停留时间)。相同的柱用于所有实验。对于所有洗涤实验,应用上文实施例15中所述的方法,其中用规定浓度的添加剂代替NaCl。使用的添加剂和浓度在表X中提供。表X图23示出对于每种添加剂,无论其存在于第一中间洗涤步骤中或者平衡缓冲液和细胞培养物样品中,产物洗脱混合物中剩余的HCP浓度。当盐存在于装载阶段时,添加不同的盐(NaCl、硫酸铵或TMAC)显示最低的HCP水平。图24示出作为所用添加剂的函数的HCP的LRV(相对于装载HCP浓度)以及期间使用添加剂的纯化步骤。这个图再次说明在减少HCP浓度,即增加HCPLRV方面,盐最有效。如证实的,当与仅中间洗涤中存在的相同添加剂相比时,装载溶液中添加剂的存在表现出提高的杂质清除。表XI和XII总结了图23和24中说明的数值结果,表XI示出装载步骤中存在添加剂时的数据,而表XII示出仅在中间洗涤期间存在添加剂时的数据。表XI表XII图25说明取决于添加剂性质的相对洗脱混合物体积的实例以及期间包括添加剂的色谱步骤。该图显示当添加剂洗脱混合物体积比对照洗脱混合物体积(即,其中不存在添加剂)的比例大于100%时,添加剂洗脱混合物体积超过对照洗脱体积。相反地,少于100%的值表明添加剂洗脱混合物体积相对于对照洗脱混合物体积减少。这个图进一步证实添加剂对洗脱混合物体积的影响。优选少于100%的值。综合图23、24和25中提供的信息与表XI和XII中的数值,最佳进行条件的顺序为装载中的TMAC>洗涤中的TMAC>装载中的硫酸铵>装载中的NaCl>洗涤中的硫酸铵。这里提供的顺序是基于具有首要重要性的HCPLRV,然后是产物回收。如果以ppm计的HCP浓度具有首要重要性,则顺序略微改变为装载中的TMAC>洗涤中的TMAC>装载中的NaCl>装载中的硫酸铵>洗涤中的硫酸铵。根据本说明书内引用的参考文献的教导最全面地理解本说明书,所述参考文献援引加入本文。本说明书内的实施方案提供本发明中的实施方案的说明,并且不应当理解为限制其范围。技术人员容易地认识到本发明涵盖许多其他实施方案。所有出版物和发明均整体援引加入本文。如果援引加入的材料与本说明书矛盾或不一致,则本说明书会取代任何这样的材料。本文中任何参考文献的引用不是承认这类参考文献是本发明的现有技术。除非另有说明,本说明书(包括权利要求书)中使用的所有表示成分、细胞培养、处理条件等的量的数字应当理解为在所有条件下受到术语“约”的修饰。因此,除非另有相反的说明,数值参数为近似值,并且可以根据通过本发明试图获得的期望特性而变化。除非另有说明,一系列元素之前的术语“至少”应当理解为指该系列中的每个元素。本领域技术人员会认识到或者能够利用不超过常规实验确定本文所述的本发明的具体实施方案的许多等同物。所附权利要求书意图涵盖这类等同物。本领域技术人员会清楚,可以进行本发明的许多修改和变化而不背离其精神和范围。本文所述的具体实施方案仅通过实例的方式提供,并不意味着以任何方式限制。本发明的真正范围和精神通过所附权利要求书示出,说明书和实施例仅认为是示例性的。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1