IL-18结合分子的制作方法
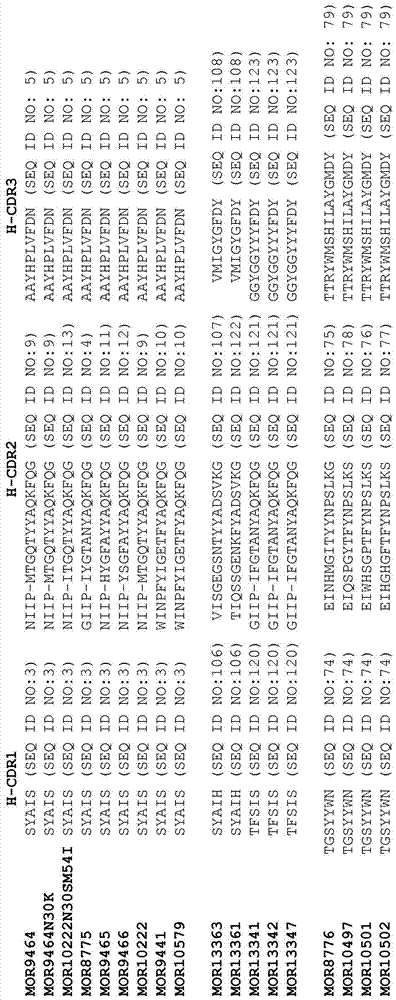
本发明涉及结合分子,更具体地涉及免疫球蛋白,如抗体或其片段,其与细胞因子白细胞介素-18(IL-18)结合,但不结合与白细胞介素18结合蛋白(IL-18BP)内源性抑制剂复合的IL-18。本发明还涉及编码所述结合分子的多核苷酸、包含所述结合分子的药物组合物、使用所述结合分子治疗和/或预防疾病的方法以及用于检测和/或测量未结合IL-18BP的IL-18的存在和/或量的方法。本发明的其它方面、目的和优点将从下面的描述中显而易见。发明背景白细胞介素18(IL-18)最初于1989年被描述为干扰素γ诱导因子(IGIF)。IL-18与IL-1家族相关并且结构上与IL-1β相关(OkamuraH等人(1995)Nature;378:88-91)。IL-18主要是由巨噬细胞和T细胞产生为前体蛋白质(pro-IL-18)并在胱天蛋白酶-1裂解后作为活性蛋白质分泌(DinarelloCA等人(1999)JAllergyClinImmunol;103:11-24)。在正常生理学下,IL-18与IL-12协同,与诸如脂多糖(LPS)的微生物产物感染后的细胞介导的免疫的诱导相关联(SarenevaT等人(2000)JImmunol;165(4):1933-8)。IL-18刺激后,自然杀伤(NK)细胞和T细胞释放细胞因子干扰素-γ(INF-γ),它在活化巨噬细胞和其它细胞中起重要作用。除了诱导干扰素γ的能力外,IL-18还具有多种功能。这些生物学性质包括活化NF-κB、Fas配体表达、CC和CXC趋化因子两者的诱导和增加的有能力的人免疫缺陷病毒的生产。由于IL-18在T细胞和巨噬细胞中诱导INF-γ产生的能力,它在Th1型免疫应答中起重要作用,并参与先天性和获得性免疫两者。IL-18以高亲和性结合IL-18受体(IL-18R),这种分别由基因IL18R1和IL18RAP编码的α和β链的异聚复合物,并通过其传递信号(TorigoeK等人(1997)JBiolChem;272(41):25737-42)。IL-18的生物活性被IL-18结合蛋白(IL18BP),这种天然存在且高度特异的抑制剂负调控。此可溶性蛋白与游离的IL-18形成复合物防止其与IL-18受体相互作用,从而中和并抑制其生物活性(DinarelloCA(2000)AnnRheumDis;59Suppl1:i17-20)。IL-18BP是以高亲和性结合IL-18的组成型分泌蛋白质。IL-18BP的可变mRNA剪接变体得到四个同种型。重要的'a'同种型相比IL-18以超过20倍摩尔存在于健康人的血清中(Dinarello和Kaplanski(2005)ExpertRevClinImmunol,1(4),619-632)。除了它的生理作用,IL-18已显示出介导多种自身免疫和炎性疾病。已证明了在若干自身免疫疾病如克罗恩病、牛皮癣、类风湿性关节炎、多发性硬化和心血管疾病中,IL-18表达被上调(Braddock等人(2004)ExpertOpinBiolTher;4(6):847-860)。在某些炎症性疾病,如慢性阻塞性肺疾病(COPD)(Imaoka等人(2008)EurRespir;J31:287-297),特发性肺纤维化(IPF)(Kitasato等人(2004)AmJRespCellMolBiol;31:619-625),巨噬细胞活化综合征(MAS)(Dinarello和Kaplanski(2005)ExpertRevClinImmunol;1(4):619-632),成人发作斯蒂尔病(Still’sdisease)(AOSD)(ArletJB等人(2006)AnnRheumDis65(12):1596-601)和系统性幼年特发性关节炎(SJIA)(Akashi等人(1994)BrJHaematol;87(2):243-50)中,IL-18也上调。最近的研究表明了在遗传和获得性形式的噬血细胞性淋巴组织细胞增多症(HLH)两者中的高量IL-18和IFN-γ。HLH的特征在于活化的分泌大量炎性细胞因子的淋巴细胞和组织细胞(JankaGE等人(2007)EurJPaediatr;166:95-109)和在于受损的NK细胞和细胞毒性T细胞功能。最重要的是,已经表明,这两种形式的特征在于IL-18的失调(Mazodier等人(2005)Immunobiology106(10):3483-89)。开发用于被天然抑制剂调控的靶标(如IL-18)的治疗分子会是非常具有挑战性的。增加量的全身或局部的总IL-18的存在并不总是反映生物活性蛋白(没有IL-18BP的IL-18)的水平。虽然结合游离的IL-18和与IL-18BP复合的IL-18两者的治疗化合物潜在地能够中和IL-18的活性,但相比于能选择性地只结合具有生物活性的游离IL-18,会需要更大剂量。需要以高剂量施用的治疗性化合物会导致更明显的副作用,或成为免疫原性的。高剂量也转化为高的生产成本。当结合IL18BP时会竞争IL-18的治疗化合物可能扰乱存在于患有表征为IL-18失调的疾病/病症的患者中的游离/活性IL-18和IL-18BP结合/失活IL-18的微妙的平衡。最后,在没有能够检测和/或测量无IL-18BP的IL-18作为总IL-18的组分的诊断工具时,调查表征为游离IL-18失调的疾病将是非常困难的。发明概述在一个方面,本发明因此提供了特异性结合IL-18的结合分子,其中所述结合分子不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且其中所述结合分子不是IL-18BP。在此方面的一个实施方式中,结合分子结合于IL-18上的IL-18表位(如参照SEQIDNO:1所限定),其中所述表位包括氨基酸Arg140和Glu152。在此方面的另一实施方式中,所述表位还可以包括氨基酸Gln92、Pro93、Gly95、Pro143、Glu157或Glu177中的任何一种或多种。在此方面的又另一实施方式中,表位可还包括氨基酸Lys89、Arg94、Met96、Phe138、Ser141、Gly144、His145、Asp146、Gln150或Leu180中的任何一种或多种。在此方面的另一实施方式中,当IL-18BP结合到IL-18时,结合分子不与IL-18BP竞争结合IL-18。在此方面的另一实施方式中,结合分子选自:分离的抗体、分离的抗体的片段、单可变结构域抗体、双特异性或多特异性抗体、多价抗体、双重可变结构域抗体、免疫缀合物、纤连蛋白分子、adnectin、DARPin、avimer、affibody、抗运载蛋白(anticalin)、affilin、蛋白质表位模拟物或其组合。在此方面的另一实施方式中,结合分子结合IL-18,其中IL-18包括SEQIDNO:1或SEQIDNO:2的氨基酸37至氨基酸193。在此方面的另一实施方式中,结合分子抑制IL-18依赖性干扰素γ(IFN-γ)的生产。在此方面的另一实施方式中,结合分子以100pM或更小的KD结合IL-18。在此方面的另一实施方式中,根据本发明的结合分子是分离的全长人、人源化或嵌合抗体或其片段,优选分离的全长人类抗体。在此方面的另一实施方式中,结合分子是抗体片段或单可变结构域抗体,优选Fab、Fab'、F(ab')2、scFv、dAb或VHH。在此方面的另一实施方式中,结合分子是分离的双特异性抗体或其片段,其包括对IL-18的第一特异性和对诸如IL-12或IL-1β的另一多肽的第二特异性。在此方面的又另一实施方式中,结合分子是分离的抗体,其包括突变的或化学修饰的氨基酸Fc区,其中所述突变的或化学修饰的氨基酸Fc区相比于野生型Fc区防止或减小ADCC活性和/或增加半寿期。优选地,突变的或化学修饰的氨基酸Fc区是沉默的IgG1Fc区。在另一实施方式中,当本发明的结合分子是结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的分离的抗体或其片段时,所述分离的抗体或其片段包括:i.重链可变区H-CDR1,包括SEQIDNO:3或其保守变体和ii.重链可变区H-CDR2,包括SEQIDNO:4或SEQIDNO:9或SEQIDNO:10或SEQIDNO:11或SEQIDNO:12或SEQIDNO:13或其保守变体和iii.重链可变区H-CDR3,包括SEQIDNO:5或其保守变体和iv.轻链可变区L-CDR1,包括SEQIDNO:6或其保守变体和v.轻链可变区L-CDR2,包括SEQIDNO:7或其保守变体和vi.轻链可变区L-CDR3,包括SEQIDNO:8或其保守变体。优选地,所述抗体或其片段包括:包括SEQIDNO:9或SEQIDNO:13的重链可变区H-CDR2。在另一实施方式中,当本发明的结合分子是结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的分离的抗体或其片段时,所述分离的抗体或其片段包括:包括SEQIDNO:16或SEQIDNO:20或其保守变体的轻链可变结构域。在另一实施方式中,当本发明的结合分子是结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的分离的抗体或其片段时,所述分离的抗体或其片段包括:i.重链可变结构域,包括SEQIDNO:14或SEQIDNO:22或SEQIDNO:25或SEQIDNO:28或SEQIDNO:31或SEQIDNO:34或其保守变体和轻链可变结构域,包括SEQIDNO:16或其保守变体或ii.重链可变结构域,包括SEQIDNO:18或SEQIDNO:37或SEQIDNO:40或其保守变体和轻链可变结构域,包括SEQIDNO:20或其保守变体。优选地,重链可变结构域包括SEQIDNO:14或其保守变体并且轻链可变结构域包括SEQIDNO:16或其保守变体,以及任选地,参照SEQIDNO:14的位置30的氨基酸赖氨酸(Lys;K)被选自天冬酰胺(Asn;N)、或丝氨酸(Ser;S)或苏氨酸(Thr;T)或丙氨酸(Ala;A)或谷氨酸(Glu;E)或组氨酸(His;H)或亮氨酸(Leu;L)或谷氨酰胺(Gln,Q)或精氨酸(Arg;R)或缬氨酸(Val;V)或酪氨酸(Tyr;Y)或异亮氨酸(Ile;I)的氨基酸取代。在另一实施方式中,当本发明的结合分子是结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的分离的抗体或其片段时,所述分离的抗体或其片段包括:包括SEQIDNO:18或其保守变体的重链可变结构域以及包括SEQIDNO:20或其保守变体的轻链可变结构域。在另一实施方式中,当本发明的结合分子是结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的分离的抗体时,所述分离的抗体或其片段包括:i.包括SEQIDNO:43或SEQIDNO:47或SEQIDNO:50或SEQIDNO:56或其保守变体的重链和包括SEQIDNO:45或其保守变体的轻链或ii.包括SEQIDNO:53或SEQIDNO:100或SEQIDNO:158或其保守变体的重链和包括SEQIDNO:160或其保守变体的轻链。在另一实施方式中,当本发明的结合分子是结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的分离的抗体时,所述分离的抗体或其片段包括:i.包括SEQIDNO:43或其保守变体的重链和包括SEQIDNO:45或其保守变体的轻链或ii.包括SEQIDNO:158或其保守变体的重链和包括SEQIDNO:160或其保守变体的轻链。在另一实施方式中,当本发明的结合分子是结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的分离的抗体或其片段时,所述分离的抗体或其片段包括:i.重链可变区H-CDR1,包括SEQIDNO:74或其保守变体和ii.重链可变区H-CDR2,包括SEQIDNO:75或SEQIDNO:76或SEQIDNO:77或SEQIDNO:78或其保守变体和iii.重链可变区H-CDR3,包括SEQIDNO:79或其保守变体和iv.轻链可变区L-CDR1,包括SEQIDNO:80或其保守变体和v.轻链可变区L-CDR2,包括SEQIDNO:81或其保守变体和vi.轻链可变区L-CDR3,包括SEQIDNO:82或其保守变体。在另一实施方式中,当本发明的结合分子是结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的分离的抗体或其片段时,所述分离的抗体或其片段包括:包括SEQIDNO:85或其保守变体的轻链可变结构域和包括SEQIDNO:83或SEQIDNO:87或SEQIDNO:90或SEQIDNO:93或其保守变体的重链可变结构域。在另一实施方式中,当本发明的结合分子是结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的分离的抗体时,所述分离的抗体包括:包括SEQIDNO:96或SEQIDNO:103或其保守变体的重链和包括SEQIDNO:98或其保守变体的轻链。在另一实施方式中,当本发明的结合分子是结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的分离的抗体或其片段时,所述分离的抗体或其片段包括:i.重链可变区H-CDR1,包括SEQIDNO:106或其保守变体和ii.重链可变区H-CDR2,包括SEQIDNO:107或SEQIDNO:122或其保守变体和iii.重链可变区H-CDR3,包括SEQIDNO:108或其保守变体和iv.轻链可变区L-CDR1,包括SEQIDNO:109或其保守变体和v.轻链可变区L-CDR2,包括SEQIDNO:110或其保守变体和vi.轻链可变区L-CDR3,包括SEQIDNO:111或SEQIDNO:126或其保守变体。在另一实施方式中,当本发明的结合分子是结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的分离的抗体或其片段时,所述分离的抗体或其片段包括:i.重链可变区H-CDR1,包括SEQIDNO:106或其保守变体和ii.重链可变区H-CDR2,包括SEQIDNO:107或其保守变体和iii.重链可变区H-CDR3,包括SEQIDNO:108或其保守变体和iv.轻链可变区L-CDR1,包括SEQIDNO:109或其保守变体和v.轻链可变区L-CDR2,包括SEQIDNO:110或其保守变体和vi.轻链可变区L-CDR3,包括SEQIDNO:111或其保守变体。在另一实施方式中,当本发明的结合分子是结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的分离的抗体或其片段时,所述分离的抗体或其片段包括:i.包括SEQIDNO:112或其保守变体的重链可变结构域和包括SEQIDNO:114或其保守变体的轻链可变结构域或ii.包括SEQIDNO:138或其保守变体的重链可变结构域和包括SEQIDNO:140或其保守变体的轻链可变结构域。在另一实施方式中,当本发明的结合分子是结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的分离的抗体或其片段时,所述分离的抗体或其片段包括:i.包括SEQIDNO:116或其保守变体的重链和包括SEQIDNO:118或其保守变体的轻链或ii.包括SEQIDNO:142或其保守变体的重链和包括SEQIDNO:144或其保守变体的轻链。在另一实施方式中,当本发明的结合分子是结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的分离的抗体或其片段时,所述分离的抗体或其片段包括:i.重链可变区H-CDR1,包括SEQIDNO:120或其保守变体和ii.重链可变区H-CDR2,包括SEQIDNO:121或其保守变体和iii.重链可变区H-CDR3,包括SEQIDNO:123或其保守变体和iv.轻链可变区L-CDR1,包括SEQIDNO:124或其保守变体和v.轻链可变区L-CDR2,包括SEQIDNO:125或其保守变体和vi.轻链可变区L-CDR3,包括SEQIDNO:127或SEQIDNO:128或SEQIDNO:129或其保守变体。在另一实施方式中,当本发明的结合分子是结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的分离的抗体或其片段时,所述分离的抗体或其片段包括:包括SEQIDNO:130或其保守变体的重链可变结构域和包括SEQIDNO:132或SEQIDNO:147或SEQIDNO:153或其保守变体的轻链可变结构域。在另一实施方式中,当本发明的结合分子是结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的分离的抗体时,所述分离的抗体包括:包括SEQIDNO:134或其保守变体的重链和包括SEQIDNO:136或SEQIDNO:150或SEQIDNO:156或其保守变体的轻链。在另一个方面,提供了编码根据本发明的结合分子的分离的多核苷酸。在此稍后方面的一个实施方式中,根据本发明的分离的多核苷酸编码重链可变结构域,其中所述多核苷酸:i.与SEQIDNO:15或SEQIDNO:19或SEQIDNO:23或SEQIDNO:26或SEQIDNO:29或SEQIDNO:32或SEQIDNO:35或SEQIDNO:38或SEQIDNO:41或SEQIDNO:84或SEQIDNO:88或SEQIDNO:91或SEQIDNO:94或SEQIDNO:113或SEQIDNO:131或SEQIDNO:139或SEQIDNO:146或SEQIDNO:152至少90%相同;或ii.包括SEQIDNO:15或SEQIDNO:19或SEQIDNO:23或SEQIDNO:26或SEQIDNO:29或SEQIDNO:32或SEQIDNO:35或SEQIDNO:38或SEQIDNO:41或SEQIDNO:84或SEQIDNO:88或SEQIDNO:91或SEQIDNO:94或SEQIDNO:113或SEQIDNO:131或SEQIDNO:139或SEQIDNO:146或SEQIDNO:152;或iii.基本上由SEQIDNO:15或SEQIDNO:19或SEQIDNO:23或SEQIDNO:26或SEQIDNO:29或SEQIDNO:32或SEQIDNO:35或SEQIDNO:38或SEQIDNO:41或SEQIDNO:84或SEQIDNO:88或SEQIDNO:91或SEQIDNO:94或SEQIDNO:113或SEQIDNO:131或SEQIDNO:139或SEQIDNO:146或SEQIDNO:152组成。在此方面的另一实施方式中,根据本发明的分离的多核苷酸编码轻链可变结构域,其中所述多核苷酸:i.与SEQIDNO:17或SEQIDNO:21或SEQIDNO:24或SEQIDNO:27或SEQIDNO:30或SEQIDNO:33或SEQIDNO:36或SEQIDNO:39或SEQIDNO:42或SEQIDNO:86或SEQIDNO:89或SEQIDNO:92或SEQIDNO:95或SEQIDNO:115或SEQIDNO:133或SEQIDNO:141或SEQIDNO:148或SEQIDNO:154至少90%相同;或ii.包括SEQIDNO:17或SEQIDNO:21或SEQIDNO:24或SEQIDNO:27或SEQIDNO:30或SEQIDNO:33或SEQIDNO:36或SEQIDNO:39或SEQIDNO:42或SEQIDNO:86或SEQIDNO:89或SEQIDNO:92或SEQIDNO:95或SEQIDNO:115或SEQIDNO:133或SEQIDNO:141或SEQIDNO:148或SEQIDNO:154;或iii.基本上由SEQIDNO:17或SEQIDNO:21或SEQIDNO:24或SEQIDNO:27或SEQIDNO:30或SEQIDNO:33或SEQIDNO:36或SEQIDNO:39或SEQIDNO:42或SEQIDNO:86或SEQIDNO:89或SEQIDNO:92或SEQIDNO:95或SEQIDNO:115或SEQIDNO:133或SEQIDNO:141或SEQIDNO:148或SEQIDNO:154组成。在此方面的另一实施方式中,根据本发明的分离的多核苷酸编码重链,其中所述多核苷酸:i.与SEQIDNO:44或SEQIDNO:48或SEQIDNO:51或SEQIDNO:54或SEQIDNO:57或SEQIDNO:97或SEQIDNO:101或SEQIDNO:104或SEQIDNO:117或SEQIDNO:135或SEQIDNO:143或SEQIDNO:149或SEQIDNO:155或SEQIDNO:159至少90%相同;或ii.包括SEQIDNO:44或SEQIDNO:48或SEQIDNO:51或SEQIDNO:54或SEQIDNO:57或SEQIDNO:97或SEQIDNO:101或SEQIDNO:104或SEQIDNO:117或SEQIDNO:135或SEQIDNO:143或SEQIDNO:149或SEQIDNO:155或SEQIDNO:159;或iii.基本上由SEQIDNO:44或SEQIDNO:48或SEQIDNO:51或SEQIDNO:54或SEQIDNO:57或SEQIDNO:97或SEQIDNO:101或SEQIDNO:104或SEQIDNO:117或SEQIDNO:135或SEQIDNO:143或SEQIDNO:149或SEQIDNO:155或SEQIDNO:159组成。在此方面的另一实施方式中,根据本发明的分离的多核苷酸编码轻链,其中所述多核苷酸:i.与SEQIDNO:46或SEQIDNO:49或SEQIDNO:52或SEQIDNO:55或SEQIDNO:58或SEQIDNO:99或SEQIDNO:102或SEQIDNO:105或SEQIDNO:119或SEQIDNO:137或SEQIDNO:145或SEQIDNO:151或SEQIDNO:157或SEQIDNO:161至少90%相同;或ii.包括SEQIDNO:46或SEQIDNO:49或SEQIDNO:52或SEQIDNO:55或SEQIDNO:58或SEQIDNO:99或SEQIDNO:102或SEQIDNO:105或SEQIDNO:119或SEQIDNO:137或SEQIDNO:145或SEQIDNO:151或SEQIDNO:157或SEQIDNO:161;或iii.基本上由SEQIDNO:46或SEQIDNO:49或SEQIDNO:52或SEQIDNO:55或SEQIDNO:58或SEQIDNO:99或SEQIDNO:102或SEQIDNO:105或SEQIDNO:119或SEQIDNO:137或SEQIDNO:145或SEQIDNO:151或SEQIDNO:157或SEQIDNO:161组成。在此方面的另一个方面,提供克隆或表达载体,其包括如本文所主张的一种或多种多核苷酸。在一个实施方式中,根据本发明的克隆或表达载体包括选自SEQIDNO:44或SEQIDNO:48或SEQIDNO:51或SEQIDNO:54或SEQIDNO:57或SEQIDNO:101或SEQIDNO:159或SEQIDNO:97或SEQIDNO:104或SEQIDNO:117或SEQIDNO:143或SEQIDNO:135或SEQIDNO:149或SEQIDNO:155或SEQIDNO:46或SEQIDNO:49或SEQIDNO:52或SEQIDNO:55或SEQIDNO:58或SEQIDNO:102或SEQIDNO:161或SEQIDNO:99或SEQIDNO:105或SEQIDNO:119或SEQIDNO:145或SEQIDNO:137或SEQIDNO:151或SEQIDNO:157中的至少一种多核苷酸。本发明还提供包括如本文所主张的一种或多种克隆或表达载体的宿主细胞。在本发明的另一方面,提供包括如本文所主张的一种或多种多核苷酸的稳定转化或转染的宿主细胞。本发明进一步提供生产结合分子的方法,该方法包括在适宜生产结合分子的条件下培养如本文所主张的宿主细胞。在另一个方面,本发明进一步提供药物组合物,其包括药物运载体和结合分子或分离的抗体或其片段,所述结合分子或分离的抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物并且其中所述结合分子不是IL-18BP。优选地,根据本发明的药物组合物是静脉内、可吸入或皮下给药的形式。本发明进一步提供结合分子或包括所述结合分子的药物组合物,其用于治疗,所述结合分子结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且其中所述结合分子不是IL-18BP。在本发明的另一个方面,提供了结合分子或包括所述结合分子的药物组合物,其用于在哺乳动物患者中治疗和/或预防肉状瘤病,特别是肺肉状瘤病、噬血细胞性淋巴组织细胞增多症(HLH)、家族性噬血细胞性淋巴组织细胞增生症(FHL)和其它免疫缺陷综合征、巨细胞关节炎(GCA)、慢性阻塞性肺疾病(COPD)、成人发作斯蒂尔病(AOSD)、系统性幼年特发性关节炎(SJIA)、重度哮喘、葡萄膜炎、地图样萎缩、1型糖尿病、2型糖尿病或动脉粥样硬化以及其任何组合,所述结合分子结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且其中所述结合分子不是IL-18BP。在本发明的另一个方面,提供了在哺乳动物患者中治疗和/或预防肉状瘤病,特别是肺肉状瘤病、噬血细胞性淋巴组织细胞增多症(HLH)、家族性噬血细胞性淋巴组织细胞增生症(FHL)和其它免疫缺陷综合征、巨细胞关节炎(GCA)、慢性阻塞性肺疾病(COPD)、成人发作斯蒂尔病(AOSD)、系统性幼年特发性关节炎(SJIA)、重度哮喘、葡萄膜炎、地图样萎缩、1型糖尿病、2型糖尿病或动脉硬化症以及其任何组合的方法,所述方法包括给予哺乳动物患者治疗有效量的结合分子或包括所述结合分子的药物组合物,所述结合分子结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且其中所述结合分子不是IL-18BP。在本发明的又一方面,提供了结合分子或包括所述结合分子的药物组合物在制造用于哺乳动物患者治疗和/或预防肉状瘤病,特别是肺肉状瘤病、噬血细胞性淋巴组织细胞增多症(HLH)、家族性噬血细胞性淋巴组织细胞增生症(FHL)和其它免疫缺陷综合症的制造结合分子、巨细胞性关节炎(GCA)、慢性阻塞性肺疾病(COPD)、成人发作斯蒂尔病(AOSD)、系统性幼年特发性关节炎(SJIA)、重度哮喘、葡萄膜炎、地图样萎缩、1型糖尿病、2型糖尿病或动脉粥样硬化和它们的任何组合的药物中的用途,所述结合分子结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且其中所述结合分子不是IL-18BP。在根据本发明的用途的一个实施方式中,哺乳动物患者是人类患者。在另一方面,提供了包括IL-18和结合分子的复合物,所述结合分子结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且其中根据本发明的结合分子不是IL-18BP。在另一方面,本发明提供了结合分子或分离的抗体或其片段,其用于诊断或用于诊断试剂盒,所述结合分子或分离的抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且其中所述结合分子不是IL-18BP。在又一方面,本发明提供了结合分子或分离的抗体或其片段,其用于诊断或用于检测和/或测量样品中游离IL-18(即,未结合于IL-18BP的IL-18)的存在和/或量,所述结合分子或分离的抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且其中所述结合分子不是IL-18BP。在本发明的再一方面,提供了用于检测和/或测量样品中游离IL-18(即,未结合于IL-18BP的IL-18)的存在和/或量的方法,其中所述样品任选地是人类样本,其中所述方法包括用所述样品接触结合分子或分离的抗体或其片段,所述结合分子或分离的抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且其中所述结合分子不是IL-18BP。在此方面的一个实施方式中,所述样品是人血。在另一方面,本发明进一步提供了诊断试剂盒,包括结合分子或分离的抗体或其片段和/或包括IL-18和所述结合分子的复合物,所述结合分子或分离的抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物且其中所述结合分子不是IL-18BP,其中所述试剂盒任选地包括第一对照化合物。在此方面的一个实施方式中,第一对照化合物是游离IL-18且试剂盒任选地包括是鼠抗体125-2H的第二对照化合物。在本发明的另一个方面,提供了医疗或诊断设备,包括结合分子或分离的抗体或其片段和/或包括IL-18和所述结合分子的复合物,所述结合分子或分离的抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且其中所述结合分子不是IL-18BP。附图简要说明图1:本文举例说明的抗体的重链可变区的CDR。图2:本文举例说明的抗体的轻链可变区的CDR。图3(A-D):本发明的抗IL-18抗体及其片段对于LPS/IL-12诱导的从PBMC释放IFN-γ(通过天然IL-18刺激)的影响。数据显示了从个体供体的新鲜分离的人PBMC中释放天然IL-18-诱导的IFN-γ的浓度依赖性抑制,其中每个数据点代表来自n=4个孔的平均值±SEM。天然IL-18被LPS/IL-12处理所刺激并且虚线表示IL-18依赖性的程度,如通过人IL-18BPa-Fc的最大效力所测定。图4(A-B):本发明的抗IL-18抗体及其片段对重组IL-18诱导的从PBMC释放IFN-γ的影响。数据示出了从代表性的个体供体的新鲜分离的人PBMC中释放重组人IL-18(1nM)-诱导的IFN-γ的浓度依赖性抑制,其中每个数据点代表来自n=4个孔的平均值±SEM。图5(A-C):本发明的抗IL-18抗体及其片段对人IL-18诱导的从KG-1细胞释放IFN-γ的影响。数据示出了从KG-1细胞释放重组人IL-18(1nM)-诱导的IFN-γ的浓度依赖性抑制,其中每个数据点代表来自n=4个孔的平均值±SEM。图6(A-C):本发明的抗IL-18抗体及其片段对食蟹猴IL-18诱导的从KG-1细胞释放IFN-γ的影响。数据示出了从KG-1细胞释放重组食蟹猴IL-18(0.2nM)-诱导的IFN-γ的浓度依赖性抑制,其中每个数据点代表来自n=4个孔的平均值±SEM。图7(A-E):本发明的抗IL-18抗体及其片段对LPS/IL-12诱导的人IL-18(天然IL-18的刺激)和随后干扰素IFN-γ在人全血中的释放的影响。图8(A-E):本发明的抗IL-18抗体及其片段对在人全血中的人IL-18-诱导的IFN-γ释放的影响。数据示出了从取自个体供体的全血释放重组人IL-18-诱导的IFN-γ的浓度依赖性抑制,其中每个数据点代表来自n=4个孔的平均值±SEM。图9(A-B):抗IL-18抗体及片段与IL-18/IL-18BP复合物的结合。(A)亲本MOR08775和MOR08776不识别IL-18/IL-18BP复合物。在该实验中,用生物素化的IL-18/IL-18BP复合物孵育MOR08775和MOR08776。(B)以与A)所示相似的方式进行实验,只是使用未生物素化的人IL-18。MOR03207是抗溶菌酶抗体而125-2H是结合IL-18/IL-18BP复合物的抗IL-18小鼠IgG。图10:对于抗IL-18抗体MOR8775、MOR8776(A))和对于抗体MOR9464、MOR9464_N30K、MOR10222_N30S_M54I和MOR14431(B)的表位分箱,黑色格填充表示竞争相似表位的抗体,而没有格填充表示无竞争。图11(A-B):A)叠加到在IL-1β/IL-1R复合物的结构上产生的IL-18/IL-18Rα模型上的IL-1β/IL-1R复合物的结构。所有的结构被表示为带状。IL-18和IL-1β的结构已被用于叠加。B)在IL-1β/IL-1R复合物的结构上产生的IL-18/IL-18Rα复合物的模型。IL-18Rα(以表面图示出)包括三个免疫球蛋白样结构域D1、D2和D3。在IL-18(以带状图示出)上的位点1和2是IL-18Rα结合位点。位点3是IL-18Rβ结合位点。图12:结合在IL-18上的相关氨基酸的比较。1)参照SEQIDNO:1的IL-18的序列,从氨基酸37至193。2)来自Kim等人,(2000)ProcNatlAcadSci;97(3):1190-1195(IL-18BP及其与人IL-18的复合物建模)。3)来自Krumm等人l,(2008)ProcNatlAcadSci;,2008105(52):,20711-2071552,表1。4)来自Kato等人,(2003)NatureStruct.Biol.2003;,10(11):,966-971;参与IL-18Rα结合的残基。5)对于结合到IL-18的MOR9464的H/DxMS结果。图13:人IL-18(以Cα跟踪和溶剂可及表面示出)和MOR9464_N30K(以卡通图示出)之间的复合物的三维结构的整体视图。图14:(A)成熟的人和食蟹猴IL-18的序列(从氨基酸37至193)的序列比对;(B)在两个物种中不同的6个氨基酸的空间填充表示。E177是在抗体复合物界面存在的唯一一个。IL-18以Cα跟踪和溶剂可及表面示出而MOR9464_N30K以卡通图示出。图15:叠加到在IL-1β/IL-1R复合物的结构上产生的IL-18/IL-18Rα复合物的模型上的IL18/MOR9464_N30K复合物的带状图。IL-18Rα结构以表面图示出而MOR9464_N30K重和轻链分别是黑色和浅灰色。图16:结合至来自痘病毒(左)的IL-18BP和结合至MOR9464_N30K抗体片段(右)的人IL-18的带状图和它们的叠加(中心)。重叠是基于IL-18结构。IL-18以Cα跟踪和溶剂可及表面示出而MOR9464_N30K和来自痘病毒的IL-18BP以卡通图示出。图17:结合至MOR9464_N30K抗体片段(右)和结合至鼠125-2H抗体片段(右)的人IL-18的带状图和它们的叠加(中心)。重叠是基于IL-18结构。IL-18以Cα跟踪和溶剂可及表面示出而MOR9464_N30K和125-2H以卡通图示出。图18:结合至覆盖到来自痘病毒的IL-18BP所结合的IL-18的125-2H的人IL-18的带状图。重叠是基于IL-18结构。IL-18以Cα跟踪和溶剂可及表面示出而MOR9464_N30K、125-2H和来自痘病毒的IL-18BP以卡通图示出。图19:结合至MOR9464_N30K抗体片段的人IL-18的带状图,其表位和互补位的残基以棒图所绘示,显示与MOR9464_N30K的位置30的氨基酸赖氨酸的特异性相互作用。发明详细描述1.定义为了解释本说明书,将应用下面的定义并且只要合适,那么以单数使用的术语也包括复数,反之亦然。另外的定义在整个详细描述中阐明。术语“IL-18”是IL-18多肽、白细胞介素-18多肽、IFN-γ诱导因子或干扰素-γ诱导因子或IFN-γ诱导因子的同义词。术语“IL-18”是指包括SEQIDNO:1的氨基酸37到193的人IL-18。贯穿本说明书,术语IL-18可互换地包括pro-IL-18(成熟IL-18在蛋白酶切割之前的前体)和成熟IL-18(蛋白酶切割后),除非指定了意指pro-或成熟形式。术语cmIL-18是指食蟹猴IL-18,包括SEQIDNO:2的氨基酸37至193。术语“抗体”是指完整的免疫球蛋白或其功能片段。天然存在的抗体通常包括四聚体,其通常是由至少两条重(H)链和至少两条轻(L)链组成。每条重链由重链可变区(本文缩写为VH)和重链恒定区组成,所述重链恒定区通常是由三个结构域(CH1、CH2和CH3)组成。重链可以是任何同种型,包括IgG(IgG1、IgG2、IgG3和IgG4亚型),IgA(IgA1和IgA2亚型),IgM和IgE。每条轻链由轻链可变区(本文缩写为VL)和轻链恒定区(CL)组成。轻链包括κ链和λ链。重和轻链可变区通常负责抗原识别,而重链和轻链恒定区可以介导免疫球蛋白对宿主组织或因子,包括免疫系统的多种细胞(例如,效应细胞)和经典补体系统的第一组分(Clq)的结合。VH和VL区可以进一步细分成高变区,称为互补决定区(CDR),散布有更保守的称为框架区(FR)的区域。每个VH和VL由三个CDR和四个FR组成,从氨基末端到羧基末端按以下顺序排列:FR1,CDR1,FR2,CDR2,FR3,CDR3,FR4。重链和轻链的可变区含有与抗原相互作用的结合结构域。如本文所用的,术语抗体的“抗原结合部分”(或简称为“抗原部分”)是指保留对IL-18的特异性结合能力的抗体的全长或一个或多个片段。已经显示,抗体的抗原结合功能可以由全长抗体的片段来执行。术语抗体的“抗原结合部分”内所涵盖的结合片段的实例包括Fab片段,由VL、VH、CL和CH1结构域组成的单价片段;F(ab)2片段,包括由在铰链区的二硫桥连接的两个Fab片段的二价片段;由VH和CH1结构域组成的Fd片段;由抗体单臂的VL和VH结构域组成的Fv片段;由VH结构域组成的dAb片段(Ward等人,(1989)Nature;341:544-546);和分离的互补决定区(CDR)。此外,尽管Fv片段的两个结构域VL和VH由单独的基因编码,可以使用重组方法通过柔性接头将它们接合,所述接头使它们能够制备为单个蛋白质链,其中VL和VH区配对以形成单价分子(称为单链Fv(scFv);参见例如,Bird等人,(1988)Science242:423-426;和Huston等人,(1988)ProcNatlAcadSc;.85:5879-5883)。此类单链抗体也旨在涵盖在术语抗体的“抗原结合部分”内。这些抗体片段是使用本领域技术人员公知的那些常规技术获得,并且就以与完整抗体相同的方式利用筛选所述片段。术语“分离的”在整个本说明书中意指存在于与其可能天然存在的环境不同的物理环境下的免疫球蛋白、抗体或多核苷酸,视具体情况而定。然而,特异性结合IL18多肽的分离的抗体可以与其他抗原,如来自其它物种的IL18(例如食蟹猴(cm)IL-18)有交叉反应性。此外,分离的抗体可以基本上不含其他细胞材料和/或化学物质。贯穿本说明书中,互补决定区(“CDR”)是根据Kabat定义来定义,除非指定CDR是根据Chothia定义或由这两个定义一起定义。Kabat定义是编号抗体的残基的标准,并且它通常用于鉴定CDR区(Kabat等人,(1991),第5版,NIH出版号91-3242)。Chothia定义与Kabat定义是类似的,但它考虑了某些结构环的位置(Chothia等人,(1987)J.Mol.Biol.,196:901-17;Al-Lazikani等人,(1997)J.Mol.Biol.273:927-948)。按照惯例,在重链中的CDR区通常称为H-CDR1、H-CDR2和H-CDR3而在轻链中的为L-CDR1、LCDR2和L-CDR3。它们从氨基末端至羧基末端方向顺序编号。如本文所用的,术语“单克隆抗体”或“单克隆抗体组合物”是指单分子组合物的抗体分子的制剂。单克隆抗体组合物对特定表位显示出单一的结合特异性和亲和力。如本文所用的,术语“人类抗体”旨在包括具有可变区的抗体,其中框架区和CDR区均来自人来源的序列。此外,如果抗体含有恒定区,所述恒定区也来自此类人序列,例如人种系序列,或人种系序列或含有来自人框架序列分析得到的共有框架序列的抗体的突变的形式,例如,如Knappik等人所述,(2000)JMolBiol;296:57-86)。本发明的人类抗体可包括不是由人序列编码的氨基酸残基(例如,通过随机的或在体外位点特异性诱变或通过体内体细胞突变引入的突变)。然而,如本文所用的术语“人类抗体”旨在不包括其中来自另一哺乳动物物种例如小鼠的种系的CDR序列已被移植到人框架序列的抗体。术语“人单克隆抗体”是指具有可变区的显示单一结合特异性的抗体,所述可变区中框架区和CDR区均来自人序列。如本文所用的,术语“重组人类抗体”包括通过重组方法制备、表达、产生或分离的所有人类抗体,如从人免疫球蛋白基因的转基因或转染色体动物(例如,小鼠)或从该基因制备的杂交瘤分离的抗体;从转化的表达该人类抗体的宿主细胞(例如,由转染瘤)分离的抗体,从重组的组合人类抗体文库中分离的抗体,和通过涉及到剪接人免疫球蛋白基因的所有或一部分的任何其它方法制备、表达、产生或分离的抗体。这种重组人类抗体具有其中框架区和CDR区源于人种系免疫球蛋白序列的可变区。然而,在某些实施方式中,可以将这类重组人类抗体进行体外诱变(或在使用人Ig序列的转基因动物时,进行体内体细胞诱变),因此,所述重组抗体的VH和VL区的氨基酸序列是这样的序列:尽管所述序列源于并相关于人种系VH和VL序列,但是它可能并非天然体内存在于人类抗体种系库中。短语“识别抗原的抗体”和“对抗原特异的抗体”在本文中与术语“特异性结合抗原的抗体”可互换使用。如本文所用的,“特异性结合IL-18”的结合分子旨在是指以100nM或更小,10nM或更小,1nM或更小的KD结合人IL-18的结合分子。“与除了IL-18以外的抗原交叉反应的结合分子旨在是指以100nM或更小,10nM或更小,1nM或更小的KD结合该抗原的结合分子。“不与特定抗原交叉反应”的结合分子旨在是指在标准结合检测法中呈现基本上检测不到的对这些蛋白质结合的结合分子。如本文所用的,术语“拮抗剂”旨在是指在人细胞检测法(如在人血细胞中的IL-18依赖性的干扰素-γ(IFN-γ)的生产检测法)中在IL-18存在下抑制IL-18依赖性信号传导活性的结合分子。在人血细胞中的IL-18依赖性的IFN-γ生产检测法的实例在以下实例中更详细地说明。如本文所用的,具有“无激动活性”的抗体旨在是指在基于细胞的检测法如人血细胞IFN-γ生产检测法中,在IL-18不存在和/或存在下并不显著增加IL-18依赖性信号传导活性的结合分子。此类检测法在下面的实例中更详细地说明。如本文所用的,术语“Kassoc”或“Ka”旨在是指特定结合分子-抗原相互作用的结合速率,而如本文所用的术语“Kdis”或“Kd”旨在是指特定结合分子-抗原相互作用的解离速率。如本文所用的术语“KD”旨在是指解离常数,它是由Kd与Ka(即Kd/Ka)的比率得到的,并且表示为摩尔浓度(M)。可以使用本领域确立的方法测定抗体的KD值。用于测定抗体的KD的方法是通过使用表面等离子体共振,如系统。如本文所用,“亲和力”是指在单个抗原位点处结合分子与抗原之间相互作用的强度。如本文所用,术语抗体的“高亲和力”是指对靶抗原具有1nM或更小的KD的抗体。如本文所用,术语“对象”包括任何人或非人动物。术语“非人动物”包括所有脊椎动物,例如,哺乳动物和非哺乳动物,如非人灵长类、绵羊、狗、猫、马、牛、鸡、两栖动物、爬行动物等。如本文所用,术语“优化的核苷酸序列”意指核苷酸序列已被改变以使用在生产细胞或生物,通常是真核细胞例如,巴斯德毕赤酵母的细胞,中国仓鼠卵巢细胞(CHO)或人细胞中优选的密码子编码氨基酸序列。优化的核苷酸序列被改造以完全保持最初由起始的核苷酸序列(其也被称为“亲本”序列)所编码的氨基酸序列。本文优化的序列已经被改造以具有在CHO哺乳动物细胞中优选的密码子;然而本文还设想这些序列在其它真核细胞中的优化的表达。术语“同一性”是指至少两种不同序列之间的相似性,这种同一性可以表示为百分比同一性,并通过标准比对算法确定,例如,BasicLocalAlignmentTool(BLAST)(Altshul等人,(1990)JMoIBiol;215:403-410);Needleman等人的算法,(1970)JMoIBiol;48:444-453或Meyers等人的算法(1988)ComputApplBiosci;4:11-17)。一组参数可以是BLOSUM62评分矩阵,空位罚分为12,空位延伸罚分为4,和移框空位罚分为5。两个氨基酸或核苷酸序列之间的同一性百分比也可以使用E.Meyers和W.Miller,(1989)CABIOS;4(1):1-17)的算法确定,其已被并入ALIGN程序(2.0版),使用PAM120权重残基表,空位长度罚分为12和空位罚分为4。同一性百分比通常通过比较相似长度的序列来计算。术语“免疫应答”是指例如,淋巴细胞、抗原呈递细胞、吞噬细胞、粒细胞和上述细胞或肝脏产生的可溶性大分子(包括抗体、细胞因子和补体)的作用,其导致选择性损害、破坏或从人体清除侵入性病原体、受病原体感染的细胞或组织、癌性细胞,或者,在自身免疫或病理炎症的情况下,正常人细胞或组织。“信号转导途径”或“信号传导活性”是指通常由蛋白质-蛋白质相互作用,如生长因子与受体结合引发的,从而导致信号从细胞的一个部分传输到细胞的另一部分的生物化学因果关系。通常,传输包括在引起信号转导的一系列反应中的一种或多种蛋白上的一个或多个酪氨酸、丝氨酸或苏氨酸残基的特异磷酸化。倒数第二个过程一般包括核事件,导致基因表达的改变。术语“中和”及其语法变体意指贯穿本说明书,靶标的生物活性在结合蛋白或抗体存在下完全或部分地被降低,视情况而定。术语“核酸”或“多核苷酸”是指单链或双链形式的脱氧核糖核酸(DNA)或核糖核酸(RNA)及其聚合物。除非特别限定,该术语包括含有与参照的核酸具有相似的结合特性的天然存在的核苷酸的已知类似物并与天然存在的核苷酸以类似方式代谢的核酸。除非另外指出,特定的核酸序列还隐含地涵盖其保守修饰的变体(例如,简并密码子取代)、等位基因、直向同源物、SNP、和互补序列以及明确指明的序列。具体而言,简并密码子取代可通过产生其中一个或多个所选(或所有)密码子的第三位置被混合碱基和/或脱氧肌苷残基取代的序列来实现(Batzer等人,NucleicAcidRes.19:5081(1991);Ohtsuka等人,J.Biol.Chem.260:2605-2608(1985);和Rossolini等人,Mol.Cell.Probes8:91-98(1994))在“多核苷酸”或“核酸”中的核苷酸可以包括修饰,包括碱基修饰如溴尿苷和肌苷衍生物,核糖修饰如硫代磷酸酯,二硫代磷酸酯,硒代磷酸酯(phosphoroselenoate),二硒代磷酸酯,phosphoroanilothioate,phosphoraniladate和磷酰胺。术语“载体”意指任何分子或实体(例如,核酸、质粒、噬菌体或病毒),其适合于转化或转染宿主细胞并含有核酸序列,所述核酸序列指引和/或控制(连同宿主细胞)与其有效连接的一种或多种异源编码区的表达。编码结合分子、抗体或其片段的序列的“保守变体”是指包括保守的氨基酸修饰的序列。“保守的氨基酸修饰”旨在是指不显著影响或改变含有该氨基酸序列的抗体的结合特征的氨基酸修饰。这样的保守修饰包括氨基酸取代、添加和缺失。保守的氨基酸取代是其中氨基酸残基被具有相似侧链的氨基酸残基取代的那些。具有相似侧链的氨基酸残基家族在本领域中已经定义。这些家族包括具有碱性侧链(例如,赖氨酸、精氨酸、组氨酸),酸性侧链(例如,天冬氨酸、谷氨酸),不带电荷的极性侧链(例如,甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸、色氨酸),非极性侧链(例如,丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸),β-分支侧链(例如,苏氨酸、缬氨酸、异亮氨酸)和芳香族侧链(例如,酪氨酸、苯丙氨酸、色氨酸、组氨酸)的氨基酸。可以通过本领域中已知的标准技术如定点诱变和PCR介导的诱变将修饰引入到本发明的结合蛋白中。保守的氨基酸取代也可包括通常通过化学肽合成而不是通过在生物系统中合成而掺入的非天然存在的氨基酸残基。非天然存在的氨基酸包括,但不限于,肽模拟的、反转的或倒置形式的氨基酸实体。术语“表位”是由免疫系统如抗体或其片段识别的抗原的一部分。在本说明书中,术语“表位”对于构象表位和线性表位两者互换使用。构象表位是由抗原的氨基酸序列的不连续区段组成,而线性表位由来自抗原的氨基酸的连续序列构成。术语“治疗”、“治疗”、“治疗”、“防止”、“预防”或“预防”包括治疗性治疗、预防性治疗和降低对象将要产生病症或其他风险因素的应用。治疗不需要完全治愈病症,而且包括症状或潜在的风险因素的降低。2.结合分子如本文所用的,术语“结合分子”意指特异性结合IL-18多肽的任何蛋白质或肽。“结合分子”包括,但不限于,抗体及其片段,如免疫功能性片段。如本文所用的术语抗体或免疫球蛋白链的“免疫功能性片段”是一类结合蛋白,其包括抗体的一部分(无论该部分是如何获得或合成的),所述抗体的一部分至少缺乏一些存在于全长链中的氨基酸但仍然能够特异性结合IL-18多肽。这样的片段是有生物活性的因为它们结合IL-18多肽。“结合分子”是指特异性结合IL-18多肽,以及可能另外中和IL-18多肽与IL-18受体的相互作用的蛋白质。如本文所用的术语“结合分子”也排除了天然存在的IL-18结合蛋白和分离的IL-18BP,例如在WO2001/085201中描述。本发明的结合分子特异性地结合IL-18,其中所述结合分子不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且其中所述结合分子不是IL-18BP。如本文所用的,术语“不结合IL-18/IL-18结合蛋白(IL-18BP)复合物”旨在是指以1×10-5M或更高的KD结合IL-18/IL-18结合蛋白(IL-18BP)复合物的结合分子。一种评估结合分子是否结合IL-18但不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的方法在本文中示例第9部分所描述。在本发明的另一个方面,结合分子特异性地结合IL-18,其中当IL-18BP被结合到IL-18时,所述结合分子不与IL-18结合蛋白(IL-18BP)竞争结合IL-18。术语“竞争”,“竞争”和“交叉竞争”及其语法变体在本文可互换使用,意指当IL-18BP已经结合到IL-18时,结合分子与IL-18BP竞争结合IL-18的能力。在这个意义上本发明的结合分子,如抗体或其片段不进行竞争。结合分子之间的竞争是通过这样的检测法来确定,其中在IL-18结合于IL-18BP时检测结合分子特异性结合IL-18。为避免任何疑问,如果结合分子可以从IL-18/IL-18BP复合物替换IL18,那么该结合分子与IL-18BP竞争结合IL-18。根据本发明的结合分子不是IL-18BP,无论是分离的或天然存在的IL-18BP。结合分子可选自以下支架:抗体、抗体片段、单可变结构域抗体、双特异性或多特异性抗体、多价抗体、双重可变结构域抗体、免疫缀合物、纤连蛋白分子、adnectin、DARPin、avimer、affibody、抗运载蛋白、affilin、蛋白质表位模拟物或其组合以及如下文所述。优选地IL-18包括SEQIDNO:1(人IL-18)或SEQIDNO:2(食蟹猴IL-18)的从氨基酸37至氨基酸193。IL-18BP结构的特征为单个Ig样结构域并与具有Ig样结构的细胞因子受体的细胞外区段类似。人IL-18BP已被鉴定出四个不同的同种型。IL-18BP同种型a(IL-18BPa)显示出对IL-18最大的亲和力,具有快结合速率,慢解离速率和399pM的解离常数(KD)。IL-18BP同种型c(IL-18BPc)共享IL-18BPa的Ig结构域除了C-末端的最后29个氨基酸外。IL-18BPc的KD比IL-18BPa小10倍(2.94nM)。然而,IL-18BPa和IL-18BPc在2摩尔过量时中和IL-18>95%。IL-18BP同种型b和d缺乏完整的Ig结构域以及缺乏结合或中和IL-18的能力。鼠IL-18BP已知有两个同种型,c和d同种型,具有相同的Ig结构域,并且在2摩尔过量时也中和>95%的鼠IL-18。然而,与人IL-18BPa有着共同的C-末端基序的鼠IL-18BPd也中和人IL-18(Kim等人(2000)ProcNatlAcadSci,97(3):1190-1195)。贯穿本说明书,术语“IL-18BP”是指每种同种型的人、鼠或病毒的IL-18结合蛋白,无论是天然存在的、分离的或改造的,如,在WO2001/085201中公开的IL-18BP,其描述了IL-18BP类似物(“muteins”)其中一个或多个氨基酸被插入、被不同的保守取代替换或被删除,IL-18BP融合蛋白(例如IL-18BP和免疫球蛋白重链区或Fc的融合蛋白)和功能性衍生物如PEG化的IL-18BP。在一个实施方式中,根据本发明的结合分子,其结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且其中所述结合分子不是IL-18BP,其中所述结合分子与如参照SEQIDNO:1所限定的IL-18上的IL-18表位结合,其中所述表位:a.包括在参照SEQIDNO:1所限定的IL-18的下述氨基酸中:i.氨基酸41和42和氨基酸87至97;或ii.氨基酸138至160;或iii.氨基酸177至181;或iv.氨基酸41和42,氨基酸87至97,氨基酸138至160和氨基酸177至181;或v.氨基酸41,42,87;89;90;或vi.氨基酸93,94;95,96;或vii.氨基酸140;141;150;177;或viii.氨基酸92;93;94;138;140;152;157;或ix.氨基酸142;143;150;152;或x.氨基酸143;144;145;177;180;或xi.氨基酸41,42,87;89;90;93,94;95,96;140;141;150;177;或xii.氨基酸92;93;94;138;140;142;143;144;145;150;152;157;177;180;或xiii.氨基酸41;42,87;89;90;92;93,94;95,96;138;140;141;142;143;144;145;150;152;157;177;180;或b.包括在a)中列出的组(i)至(xiii)任一项所限定的氨基酸中的至少一、二、三、四个;或c.包括如在a)中列出的组(iv)至(xii)任一项所限定的氨基酸。在另一实施方式中,根据本发明的结合分子,其结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且其中所述结合分子不是IL-18BP,其中所述结合分子与如参照SEQIDNO:1所限定的IL-18上的IL-18表位结合,其中该表位包括氨基酸Arg140和Glu152。在一个实施方式中,表位还包括氨基酸Gln92、Pro93、Gly95、Pro143、Glu157或Glu177中的任何一种或多种。在另一实施方式中,表位还包括氨基酸Lys89、Arg94、Met96、Phe138、Ser141、Gly144、His145、Asp146、Gln150或Leu180中的任何一种或多种。在本发明的一个实施方式中,结合分子特异性地结合IL-18,其中所述结合分子不结合IL-18/IL-18结合蛋白同种型a或同种型c(IL-18BPa或IL-18BPc)复合物,其中所述结合分子选自:抗体、抗体片段、单可变结构域抗体、双特异性或多特异性抗体、多价抗体、双重可变结构域抗体、免疫缀合物、纤连蛋白分子、adnectin、DARPin、avimer、affibody、抗运载蛋白、affilin、蛋白质表位模拟物或其组合。优选地IL-18包括SEQIDNO:1(人IL-18)或SEQIDNO:2(食蟹猴IL-18)的氨基酸37至氨基酸193。更优选地结合分子是抗体或其片段。在另一实施方式中,根据本发明的结合分子,其结合IL-18且不结合IL-18/IL-18结合蛋白同种型a或同种型c(IL-18BPa或IL-18BPc)复合物,并且其中所述结合分子不是IL-18BP,其中所述结合分子与如参照SEQIDNO:1所限定的IL-18上的IL-18表位结合,其中该表位包括氨基酸Arg140和Glu152。在一个实施方式中,表位还包括氨基酸Gln92、Pro93、Gly95、Pro143、Glu157或Glu177中的任何一种或多种,并且其中所述结合分子选自:抗体、抗体片段、单可变结构域抗体、双特异性或多特异性抗体、多价抗体、双重可变结构域抗体、免疫缀合物、纤连蛋白分子、adnectin、DARPin、avimer、affibody、抗运载蛋白、affilin、蛋白质表位模拟物或其组合。在另一实施方式中,根据本发明的结合分子,其结合IL-18且不结合IL-18/IL-18的结合蛋白同种型a或同种型c(IL-18BPa或IL-18BPc)复合物,并且其中所述结合分子不是IL-18BP,其中所述结合分子与如参照SEQIDNO:1所限定的IL-18上的IL-18表位结合,其中该表位包括氨基酸Arg140和Glu152,并且其中所述结合分子是抗体或其片段。在本实施方式中,表位可进一步包括氨基酸Gln92、Pro93、Gly95、Pro143、Glu157或Glu177中的任何一种或多种。本发明的结合分子能够抑制一种或多种IL-18生物活性,如Th1调节;Th2调节,NK-调节,嗜中性粒细胞调节,单核细胞-巨噬细胞谱系调节,嗜酸性粒细胞调节,B细胞调节,细胞因子调节,趋化因子调节;粘附分子调节和细胞募集调节。在一个实施方式中,本发明的结合分子抑制IL-18依赖性干扰素γ(IFN-γ)的生产,优选在KG-1细胞中。在本发明的另一实施方式中,在本文下面实例中限定的检测法中,结合分子以10nM或更低或1nM或更低或100pM或更低的IC50抑制KG-1细胞中IL-18依赖性干扰素γ(IFN-γ)生产。在本文下面实例中限定的检测法中,特异性结合IL-18的本发明的结合分子具有10nM或更小的解离常数(KD)。在一个实施方式中,KD为1nM或更小。在另一实施方式中,结合分子具有100pM或更小的KD并且该结合分子是抗体或其片段。根据本发明的结合分子可以是结晶的结合分子,优选受控释放的结晶的结合分子和/或无运载体。在一个实施方式中,结晶的结合分子是抗体或其片段。在另一实施方式中,结晶的结合分子在体内比可溶性对应物具有更大的半寿期,并在结晶后保留其生物学功能。根据本发明的结合分子还可以是包括结合分子和IL-18的复合物的一部分。优选地结合分子是与IL-18复合的抗体或其片段。最后,根据本发明的结合分子还可以与鼠抗体125-2H竞争结合人IL-18。2)抗体根据本发明的结合分子包括如按下文所述分离和结构表征的且在图1和2所示的抗体或其片段。2.1)人类抗体如本文所用的,人类抗体或其片段包括重链或轻链可变区或全长重链或轻链,所述重链或轻链可变区或全长重链或轻链是特定种系序列的“产物”或“来自”该特定种系序列如果该抗体的可变区或全长链是从使用人种系免疫球蛋白基因的系统得到的。此类系统包括用目的抗原免疫携带人免疫球蛋白基因的转基因小鼠或者用目的抗原筛选在噬菌体上展示的人免疫球蛋白基因文库。为人种系免疫球蛋白序列的“产物”或者“来自”所述序列的人类抗体或其片段可以如下鉴定:通过比较人类抗体的氨基酸序列与人种系免疫球蛋白的氨基酸序列并选择序列与人类抗体的序列最接近(即,最大的%同一性)的人种系免疫球蛋白序列。为人种系免疫球蛋白序列的“产物”或者“来自”所述序列的人类抗体可以相比种系序列含有氨基酸差异,由于例如天然存在的体细胞突变或者有意引入位点定向突变。然而,所选的人类抗体通常与人种系免疫球蛋白基因编码的氨基酸序列在氨基酸序列上至少90%相同并且含有这样的氨基酸残基,所述氨基酸残基当与其他物种的种系免疫球蛋白氨基酸序列(例如,鼠种系序列)比较时,将所述人类抗体鉴定为人的。在一些情况中,人类抗体可以在氨基酸序列上与种系免疫球蛋白基因编码的氨基酸序列至少60%、70%、80%、90%、或至少95%、或甚至至少96%、97%、98%、或99%相同。通常,来自特别的人种系序列的人类抗体将显示出与人种系免疫球蛋白基因编码的氨基酸序列不超过10个氨基酸差异。在一些情况中,人类抗体可以显示出与种系免疫球蛋白基因编码的氨基酸序列不超过5个,或甚至不超过4、3、2或1个氨基酸差异。人类抗体可通过本领域技术人员公知的许多方法来生产。人类抗体可以通过使用人骨髓瘤或小鼠-人杂交骨髓瘤细胞系的杂交瘤方法来制造(Kozbor,JImmunol;(1984)133:3001;Brodeur,MonoclonalIsolatedAntibodyProductionTechniquesandApplications,第51-63页,MarcelDekkerInc,1987)。备选的方法包括使用噬菌体文库或转基因小鼠,这两者均利用人可变区库(WinterG;(1994)AnnuRevImmunol12:433-455,GreenLL,(1999)JImmunolMethods231:11-23)。几个转基因小鼠品系现在是可获得的,其中它们的小鼠免疫球蛋白基因座已经用人免疫球蛋白基因区段替换(TomizukaK,(2000)ProcNatlAcadSci,97:722-727;FishwildDM(1996)NatureBiotechnol14:845-851;MendezMJ,(1997)NatureGenetics15:146-156)。在抗原攻击时,这种小鼠能够产生人类抗体库,从中可以选择目的抗体。特别注意的是TrimeraTM系统(ErenR等人,(1998)Immunology93:154-161),其中人类淋巴细胞被移植到经照射的小鼠中,选择的淋巴细胞分离的抗体系统(SelectedLymphocyteIsolatedantibodySystem)(SLAM,Babcook等人,ProcNatlAcadSci(1996)93:7843-7848),其中人类(或其他物种)淋巴细胞被有效地穿过大量集中的体外分离的抗体产生过程,随后是去卷积、限制稀释和选择过程,以及XenomouseIITM(AbgenixInc)。可选择的方法可从利用MorphodomaTM技术的MorphotekInc获得。噬菌体展示技术可以用于生产人类抗体及其片段,(McCafferty;(1990)Nature,348:552-553和GriffithsAD等人(1994)EMBO13:3245-3260)。依据这种技术,分离的抗体可变结构域基因按照框架被克隆到丝状噬菌体例如M13或fd的主要和次要外壳蛋白基因中,并在噬菌体粒子的表面上被呈现(通常借助于辅助噬菌体)为功能分离的抗体片段。基于分离的抗体的功能性质的选择导致编码展现那些性质的分离的抗体的基因的选择。噬菌体展示技术可以用于从文库中选择抗原特异性抗体,所述文库从取自罹患疾病或病症的个体或备选地取自未免疫的人类供体的人类B细胞制成(Marks;JMolBio(1991)222:581-591)。当期望完整的人类分离的抗体包含Fc结构域时,需要将来自噬菌体展示的片段再克隆到包含期望的恒定区的哺乳动物表达载体中并建立稳定的表达细胞系。亲合成熟的技术(Marks;JMolBio(1991)222:581-591)可以用于提供结合亲和性,其中通过用天然存在的变体顺序替换H和L链可变区并在改善的结合亲和性的基础上选择来改善原始人类分离的抗体的亲和性。这种技术的变体例如“表位印记”现在也是可获得的(WO93/06213;Waterhouse;NuclAcidsRes(1993)21:2265-2266)。本发明的多种(枚举)实施方式在本文中进行描述。应当认识到,在每个实施方式中指明的特征可以与其他指明的特征组合,以提供本发明的进一步的实施方式。实施方式1:结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的结合分子,其中所述结合分子是分离的人类抗体或其片段;优选分离的人单克隆抗体或其片段。实施方式2:根据实施方式1的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段与参照SEQIDNO:1所限定的IL-18上的IL-18表位结合,其中所述表位:a.包括在如参照SEQIDNO:1所限定的IL-18的以下氨基酸中:i.氨基酸41和42和氨基酸87至97;或ii.氨基酸138至160;或iii.氨基酸177至181;或iv.氨基酸41和42,氨基酸87至97,氨基酸138至160和氨基酸177至181;或v.氨基酸41,42,87;89;90;或vi.氨基酸93,94;95,96;或vii.氨基酸140;141;150;177;或viii.氨基酸92;93;94;138;140;152;157;或ix.氨基酸142;143;150;152;或x.氨基酸143;144;145;177;180;或xi.氨基酸41,42,87;89;90;93,94;95,96;140;141;150;177;或xii.氨基酸92;93;94;138;140;142;143;144;145;150;152;157;177;180;或xiii.氨基酸41;42,87;89;90;92;93,94;95,96;138;140;141;142;143;144;145;150;152;157;177;180;或b.包括如在a)中列出的组(i)至(xiii)任一项所限定的氨基酸中的至少一、二、三、四个;或c.包括如在a)中列出的组(iv)至(xii)任一项所限定的氨基酸。实施方式3:根据实施方式1的分离的人类抗体或其片段,其与参照SEQIDNO:1所限定的IL-18上的IL-18表位结合,其中该表位包括氨基酸Arg140和Glu152。实施方式4:根据实施方式3的分离的人类抗体或其片段,其中所述表位还包括氨基酸Gln92、Pro93、Gly95、Pro143、Glu157或Glu177中的任何一种或多种。实施方式5:根据实施方式3和4的分离的人类抗体或其片段,其中所述表位还包括氨基酸Lys89、Arg94、Met96、Phe138、Ser141、Gly144、His145、Asp146、Gln150或Leu180中的任何一种或多种。实施方式6:根据任一前述实施方式的分离的人类抗体或其片段,其中IL-18包括SEQIDNO:1或SEQIDNO:2的氨基酸37至氨基酸193。实施方式7:根据任何前述实施方式的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段抑制IL-18依赖性干扰素γ(IFN-γ)的生产。实施方式8:根据任一前述实施方式的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段以100pM或更小的KD结合IL-18。实施方式9:根据任一前述实施方式的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段进一步与鼠抗体125-2H竞争结合IL-18。实施方式10:根据任一前述实施方式的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:包括SEQIDNO:3或其保守变体的重链可变区H-CDR1和包括SEQIDNO:4或SEQIDNO:9或SEQIDNO:10或SEQIDNO:11或SEQIDNO:12或SEQIDNO:13或其保守变体的重链可变区H-CDR2和包括SEQIDNO:5或其保守变体的重链可变区H-CDR3以及包括SEQIDNO:6或其保守变体的轻链可变区L-CDR1和包括SEQIDNO:7或其保守变体的轻链可变区L-CDR2和包括SEQIDNO:8或其保守变体的轻链可变区L-CDR3。实施方式11:根据实施方式10的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:包括SEQIDNO:3或其保守变体的重链可变区H-CDR1和包括SEQIDNO:4或其保守变体的重链可变区H-CDR2和包括SEQIDNO:5或其保守变体的重链可变区H-CDR3以及包括SEQIDNO:6或其保守变体的轻链可变区L-CDR1和包括SEQIDNO:7或其保守变体的轻链可变区L-CDR2和包括SEQID:8或其保守变体的轻链可变区L-CDR3。实施方式12:根据实施方式11的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:包括SEQIDNO:3或其保守变体的重链可变区H-CDR1和包括SEQIDNO:4或其保守变体的重链可变区H-CDR2和包括SEQIDNO:5或其保守变体的重链可变区H-CDR3以及包括SEQIDNO:6或其保守变体的轻链可变区L-CDR1和包括SEQIDNO:7或其保守变体的轻链可变区L-CDR2和包括SEQIDNO:8或其保守变体的轻链可变区L-CDR3,并且其中所述分离的人类抗体或其片段与鼠抗体125-2H竞争结合IL-18。实施方式13:根据实施方式10的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:包括SEQIDNO:3或其保守变体的重链可变区H-CDR1和包括SEQIDNO:9或其保守变体的重链可变区H-CDR2和包括SEQIDNO:5或其保守变体的重链可变区H-CDR3以及包括SEQIDNO:6或其保守变体的轻链可变区L-CDR1和包括SEQIDNO:7或其保守变体的轻链可变区L-CDR2和包括SEQID:8或其保守变体的轻链可变区L-CDR3。实施方式14:根据实施方式13的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:包括SEQIDNO:3或其保守变体的重链可变区H-CDR1和包括SEQIDNO:9或其保守变体的重链可变区H-CDR2和包括SEQIDNO:5或其保守变体的重链可变区H-CDR3以及包括SEQIDNO:6或其保守变体的轻链可变区L-CDR1和包括SEQIDNO:7或其保守变体的轻链可变区L-CDR2和包括SEQIDNO:8或其保守变体的轻链可变区L-CDR3,并且其中所述分离的人类抗体或其片段与鼠抗体125-2H竞争结合IL-18。实施方式15:根据实施方式13或14的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且所述抗体或其片段结合在参照SEQIDNO:1所限定的IL-18上的包括Arg140和Glu152的表位,其中所述分离的抗体或其片段包括:i.包括SEQIDNO:3或其保守变体的重链可变区H-CDR1和ii.包括SEQIDNO:9或其保守变体的重链可变区H-CDR2和iii.包括SEQIDNO:5或其保守变体的重链可变区H-CDR3和iv.包括SEQIDNO:6或其保守变体的轻链可变区L-CDR1和v.包括SEQIDNO:7或其保守变体的轻链可变区L-CDR2和vi.包括SEQIDNO:8或其保守变体的轻链可变区L-CDR3。优选地这种分离的人类抗体是分离的全长人的抗体或其片段,更优选地分离的全长人单克隆抗体或其片段。实施方式16:根据实施方式10的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:包括SEQIDNO:3或其保守变体的重链可变区H-CDR1和包括SEQIDNO:10或其保守变体的重链可变区H-CDR2和包括SEQIDNO:5或其保守变体的重链可变区H-CDR3以及包括SEQIDNO:6或其保守变体的轻链可变区L-CDR1和包括SEQIDNO:7或其保守变体的轻链可变区L-CDR2和包括SEQID:8或其保守变体的轻链可变区L-CDR3。实施方式17:根据实施方式10的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:包括SEQIDNO:3或其保守变体的重链可变区H-CDR1和包括SEQIDNO:11或其保守变体的重链可变区H-CDR2和包括SEQIDNO:5或其保守变体的重链可变区H-CDR3以及包括SEQIDNO:6或其保守变体的轻链可变区L-CDR1和包括SEQIDNO:7或其保守变体的轻链可变区L-CDR2和包括SEQID:8或其保守变体的轻链可变区L-CDR3。实施方式18:根据实施方式10的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:包括SEQIDNO:3或其保守变体的重链可变区H-CDR1和包括SEQIDNO:12或其保守变体的重链可变区H-CDR2和包括SEQIDNO:5或其保守变体和的重链可变区H-CDR3以及包括SEQIDNO:6或其保守变体的轻链可变区L-CDR1和包括SEQIDNO:7或其保守变体的轻链可变区L-CDR2和包括SEQID:8或其保守变体的轻链可变区L-CDR3。实施方式19:根据实施方式10的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:包括SEQIDNO:3或其保守变体的重链可变区H-CDR1和包括SEQIDNO:13或其保守变体的重链可变区H-CDR2和包括SEQIDNO:5或其保守变体的重链可变区H-CDR3以及包括SEQIDNO:6或其保守变体的轻链可变区L-CDR1和包括SEQIDNO:7或其保守变体的轻链可变区L-CDR2和包括SEQID:8或其保守变体的轻链可变区L-CDR3。实施方式20:根据实施方式19的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:包括SEQIDNO:3或其保守变体的重链可变区H-CDR1和包括SEQIDNO:13或其保守变体的重链可变区H-CDR2和包括SEQIDNO:5或其保守变体的重链可变区H-CDR3以及包括SEQIDNO:6或其保守变体的轻链可变区L-CDR1和包括SEQIDNO:7或其保守变体的轻链可变区L-CDR2和包括SEQIDNO:8或其保守变体的轻链可变区L-CDR3,并且其中所述分离的人类抗体或其片段与鼠抗体125-2H竞争结合IL-18。实施方式21:根据实施方式19或20的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物并且所述抗体或其片段结合在参照SEQIDNO:1所限定的IL-18上的包括Arg140和Glu152的表位,其中所述分离的抗体或其片段包括:i.包括SEQIDNO:3或其保守变体的重链可变区H-CDR1和ii.包括SEQIDNO:13或其保守变体的重链可变区H-CDR2和iii.包括SEQIDNO:5或其保守变体的重链可变区H-CDR3和iv.包括SEQIDNO:6或其保守变体的轻链可变区L-CDR1和v.包括SEQIDNO:7或其保守变体的轻链可变区L-CDR2和vi.包括SEQIDNO:8或其保守变体的轻链可变区L-CDR3。优选地这种分离的人类抗体是分离的全长人抗体或其片段,更优选分离的全长人单克隆抗体或其片段。实施方式22:根据实施方式1至9中任一项的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:包括SEQIDNO:74或其保守变体的重链可变区H-CDR1和包括SEQIDNO:75或SEQIDNO:76或SEQIDNO:77或SEQIDNO:78或其保守变体的重链可变区H-CDR2和包括SEQIDNO:79或其保守变体的重链可变区H-CDR3以及包括SEQIDNO:80或其保守变体的轻链可变区L-CDR1和包括SEQIDNO:81或其保守变体的轻链可变区L-CDR2和包括SEQIDNO:82或其保守变体的轻链可变区L-CDR3。实施方式23:根据实施方式22的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:包括SEQIDNO:74或其保守变体的重链可变区H-CDR1和包括SEQIDNO:75或其保守变体的重链可变区H-CDR2和包括SEQIDNO:79或其保守变体的重链可变区H-CDR3以及包括SEQIDNO:80或其保守变体的轻链可变区L-CDR1和包括SEQIDNO:81或其保守变体的轻链可变区L-CDR2和包括SEQID:82或其保守变体的轻链可变区L-CDR3。实施方式24:根据实施方式22的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:包括SEQIDNO:74或其保守变体的重链可变区H-CDR1和包括SEQIDNO:76或其保守变体的重链可变区H-CDR2和包括SEQIDNO:79或其保守变体的重链可变区H-CDR3以及包括SEQIDNO:80或其保守变体的轻链可变区L-CDR1和包括SEQIDNO:81或其保守变体的轻链可变区L-CDR2和包括SEQID:82或其保守变体的轻链可变区L-CDR3。实施方式25:根据实施方式22的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:包括SEQIDNO:74或其保守变体的重链可变区H-CDR1和包括SEQIDNO:77或其保守变体的重链可变区H-CDR2和包括SEQIDNO:79或其保守变体的重链可变区H-CDR3以及包括SEQIDNO:80或其保守变体的轻链可变区L-CDR1和包括SEQIDNO:81或其保守变体的轻链可变区L-CDR2和包括SEQID:82或其保守变体的轻链可变区L-CDR3。实施方式26:根据实施方式22的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:包括SEQIDNO:74或其保守变体的重链可变区H-CDR1和包括SEQIDNO:78或其保守变体的重链可变区H-CDR2和包括SEQIDNO:79或其保守变体的重链可变区H-CDR3以及包括SEQIDNO:80或其保守变体的轻链可变区L-CDR1和包括SEQIDNO:81或其保守变体的轻链可变区L-CDR2和包括SEQID:82或其保守变体的轻链可变区L-CDR3。实施方式27:根据实施方式1至9中任一项的分离的人类抗体或其片段方法,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:包括SEQIDNO:106或其保守变体的重链可变区H-CDR1和包括SEQIDNO:107或SEQIDNO:122或其保守变体的重链可变区H-CDR2和包括SEQIDNO:108或其保守变体的重链可变区H-CDR3以及包括SEQIDNO:109或其保守变体的轻链可变区L-CDR1和包括SEQIDNO:110或其保守变体的轻链可变区L-CDR2和包括SEQIDNO:111或SEQIDNO:126或其保守变体的轻链可变区L-CDR3。实施方式28:根据实施方式27的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:包括SEQIDNO:106或其保守变体的重链可变区H-CDR1和包括SEQIDNO:107或其保守变体的重链可变区H-CDR2和包括SEQIDNO:108或其保守变体的重链可变区H-CDR3以及包括SEQIDNO:109或其保守变体的轻链可变区L-CDR1和包括SEQIDNO:110或其保守变体的轻链可变区L-CDR2和包括SEQID:111或其保守变体的轻链可变区L-CDR3。优选地这种分离的人类抗体或其片段是分离的全长人抗体或其片段,更优选分离的全长人单克隆抗体或其片段。实施方式29:根据实施方式1至9中任一项的分离的人类抗体或其片段方法,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:包括SEQIDNO:106或其保守变体的重链可变区H-CDR1和包括SEQIDNO:122或其保守变体的重链可变区H-CDR2和包括SEQIDNO:108或其保守变体的重链可变区H-CDR3以及包括SEQIDNO:109或其保守变体的轻链可变区L-CDR1和包括SEQIDNO:110或其保守变体的轻链可变区L-CDR2和包括SEQIDNO:126或其保守变体的轻链可变区L-CDR3。实施方式30:根据实施方式1至9中任一项的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并包括:包括SEQIDNO:120或其保守变体的重链可变区H-CDR1和包括SEQIDNO:121或其保守变体的重链可变区H-CDR2和包括SEQIDNO:123或其保守变体的重链可变区H-CDR3以及包括SEQIDNO:124或其保守变体的轻链可变区L-CDR1和包括SEQIDNO:125或其保守变体的轻链可变区L-CDR2和包括SEQIDNO:127或SEQIDNO:128或SEQIDNO:129或其保守变体的轻链可变区L-CDR3。实施方式31:根据实施方式30的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:包括SEQIDNO:120或其保守变体的重链可变区H-CDR1,包括SEQIDNO:121或其保守变体的重链可变区H-CDR2和包括SEQIDNO:123或其保守变体的重链可变区H-CDR3以及包括SEQIDNO:124或其保守变体的轻链可变区L-CDR1和包括SEQIDNO:125或其保守变体的轻链可变区L-CDR2和包括SEQID:127或其保守变体的轻链可变区L-CDR3。实施方式32:根据实施方式30的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:包括SEQIDNO:120或其保守变体的重链可变区H-CDR1和包括SEQIDNO:121或其保守变体的重链可变区H-CDR2和包括SEQIDNO:123或其保守变体的重链可变区H-CDR3以及包括SEQIDNO:124或其保守变体的轻链可变区L-CDR1和包括SEQIDNO:125或其保守变体的轻链可变区L-CDR2和包括SEQID:128或其保守变体的轻链可变区L-CDR3。实施方式33:根据实施方式30的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:包括SEQIDNO:120或其保守变体的重链可变区H-CDR1和包括SEQIDNO:121或其保守变体的重链可变区H-CDR2和包括SEQIDNO:123或其保守变体的重链可变区H-CDR3以及包括SEQIDNO:124或其保守变体的轻链可变区L-CDR1和包括SEQIDNO:125或其保守变体的轻链可变区L-CDR2和包括SEQID:129或其保守变体的轻链可变区L-CDR3。上文所述的CDR区是使用Kabat体系来描述(Kabat,E.A.,等人,1991SequencesofProteinsofImmunologicalInterest,第5版,U.S.DepartmentofHealthandHumanServices,NIH出版号91-3242)。在本发明的一些其它实施方式中,人类抗体或其片段包括使用Chothia定义(Chothia等人,(1987)JMolBiol196:901-17)所描述的CDR区。实施方式34:根据实施方式1至9中任一项的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:包括SEQIDNO:59或SEQIDNO:65或SEQIDNO:66或其保守变体的重链可变区H-CDR1和包括SEQIDNO:60或SEQIDNO:67或其保守变体的重链可变区H-CDR2和包括SEQIDNO:61或其保守变体的重链可变区H-CDR3以及包括SEQIDNO:62或其保守变体的轻链可变区L-CDR1和包括SEQIDNO:63或其保守变体的轻链可变区L-CDR2和包括SEQIDNO:64或其保守变体的轻链可变区L-CDR3。实施方式35:根据实施方式34的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:包括SEQIDNO:59或其保守变体的重链可变区H-CDR1和包括SEQIDNO:60或其保守变体的重链可变区H-CDR2和包括SEQIDNO:61或其保守变体的重链可变区H-CDR3和以及包括SEQIDNO:62或其保守变体的轻链可变区L-CDR1和包括SEQIDNO:63或其保守变体的轻链可变区L-CDR2和包括SEQID:64或其保守变体的轻链可变区L-CDR3。实施方式36:根据实施方式35的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段与鼠抗体125-2H竞争结合IL-18。实施方式37:根据实施方式34的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:包括SEQIDNO:65或其保守变体的重链可变区H-CDR1和包括SEQIDNO:60或其保守变体的重链可变区H-CDR2和包括SEQIDNO:61或其保守变体的重链可变区H-CDR3以及包括SEQIDNO:62或其保守变体的轻链可变区L-CDR1和包括SEQIDNO:63或其保守变体的轻链可变区L-CDR2和包括SEQID:64或其保守变体的轻链可变区L-CDR3。实施方式38:根据实施方式37的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段与鼠抗体125-2H竞争结合IL-18。实施方式39:根据实施方式34的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:包括SEQIDNO:66或其保守变体的重链可变区H-CDR1和包括SEQIDNO:67或其保守变体的重链可变区H-CDR2和包括SEQIDNO:61或其保守变体的重链可变区H-CDR3以及包括SEQIDNO:62或其保守变体的轻链可变区L-CDR1和包括SEQIDNO:63或其保守变体的轻链可变区L-CDR2和包括SEQID:64或其保守变体的轻链可变区L-CDR3。实施方式40:根据实施方式39的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段与鼠抗体125-2H竞争结合IL-18。实施方式41:根据实施方式34的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:包括SEQIDNO:68或其保守变体的重链可变区H-CDR1和包括SEQIDNO:69或其保守变体的重链可变区H-CDR2和包括SEQIDNO:70或其保守变体的重链可变区H-CDR3以及包括SEQIDNO:71或其保守变体的轻链可变区L-CDR1和包括SEQIDNO:72或其保守变体的轻链可变区L-CDR2和包括SEQID:73或其保守变体的轻链可变区L-CDR3。实施方式42:根据实施方式1至9中任一项的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并包括:包括SEQIDNO:162或其保守变体的重链可变区H-CDR1和包括SEQIDNO:163或其保守变体的重链可变区H-CDR2和包括SEQIDNO:164或其保守变体的重链可变区H-CDR3以及包括SEQIDNO:165或其保守变体的轻链可变区L-CDR1和包括SEQIDNO:166或其保守变体的轻链可变区L-CDR2和包括SEQIDNO:167或其保守变体的轻链可变区L-CDR3。根据Kabat定义,如以上所讨论的,在重链可变结构域(VH)中CDR氨基酸残基编号为31-35(H-CDR1)、50-65(H-CDR2)和95-102(H-CDR3);而在轻链可变结构域(VL)中CDR氨基酸残基编号为24-34(L-CDR1)、50-56(L-CDR2)和89-97(L-CDR3)。根据Chothia,在VH中CDR氨基酸编号为26-32(H-CDR1)、52-56(H-CDR2)和95-102(H-CDR3);而在VL中氨基酸残基编号为26-32(L-CDR1)、50-52(L-CDR2)和91-96(L-CDR3)。通过结合Kabat和Chothia这两种CDR定义,并考虑插入更长的环,CDR由人VH中的氨基酸残基26-35(H-CDR1)、50-65(H-CDR2)和95-102(H-CDR3)和人VL中的氨基酸残基24-34(L-CDR1)、50-56(L-CDR2)和89-97(L-CDR3)组成。实施方式43:根据实施方式1至9中任一项的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:包括SEQIDNO:14或其保守变体的重链可变区(VH)和包括SEQIDNO:16或其保守变体的轻链可变区(VL),并且其中所述重链可变区(VH)包括:i.对应于SEQIDNO:14的氨基酸26到35的重链可变区H-CDR1;和ii.对应于SEQIDNO:14的氨基酸50至66的重链可变区H-CDR2;和iii.对应于SEQIDNO:14的氨基酸99到108的重链可变区H-CDR3;且其中所述轻链可变区(VL)包括:iv.对应于SEQIDNO:16的氨基酸23到35的轻链可变区L-CDR1;和v.对应于SEQIDNO:16的氨基酸51到57的轻链可变区L-CDR2;和vi.对应于SEQIDNO:16的氨基酸90至100的轻链可变区L-CDR3。实施方式44:根据实施方式43的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且其中分离的人类抗体或其片段与鼠抗体125-2H竞争结合IL-18。实施方式45:根据实施方式43或44的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物并且该抗体或其片段结合参照SEQIDNO:1所限定的IL-18上的包括Arg140和Glu152的表位,任选地表位还包括氨基酸Lys89、Gln92、Pro93、Arg94、Gly95、Met96、Phe138、Ser141、Pro143、Gly144、Glu157、Glu177或Leu180中的任何一种或多种,优选地表位进一步包括氨基酸Lys89、Gln92、Pro93、Arg94、Gly95、Met96、Phe138、Ser141、Pro143、Gly144、Glu157、Glu177和Leu180。实施方式46:根据实施方式1至9中任一项的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:包括SEQIDNO:18或其保守变体的重链可变区(VH)和包括SEQIDNO:20或其保守变体的轻链可变区(VL),并且其中所述重链可变区(VH)包括:i.对应于SEQIDNO:18的氨基酸26到35的重链可变区H-CDR1;和ii.对应于SEQIDNO:18的氨基酸50至66的重链可变区H-CDR2;和iii.对应于SEQIDNO:18的氨基酸99到108的重链可变区H-CDR3;且其中所述轻链可变区(VL)包括:iv.对应于SEQIDNO:20的氨基酸23到35的轻链可变区L-CDR1;和v.对应于SEQIDNO:20的氨基酸51到57的轻链可变区L-CDR2;和vi.对应于SEQIDNO:20的氨基酸90至100的轻链可变区L-CDR3。实施方式47:根据实施方式46的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且其中分离的人类抗体或其片段与鼠抗体125-2H竞争结合IL-18。实施方式48:根据实施方式46或47的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物并且该抗体或其片段结合参照SEQIDNO:1所限定的IL-18上的包括Arg140和Glu152的表位。鉴于这些人类抗体各自可以结合IL18并且该抗原结合特异性主要是由CDR1、2和3区提供的,H-CDR1、2和3序列和L-CDR1、2和3序列可以是“混合并匹配的”(即来自不同的人类抗体的CDR可以混合并匹配,含有H-CDR1、2和3组和L-CDR1、2和3组的每种抗体产生本发明的其它抗IL18结合分子。此类“混合并匹配的”抗体的IL18结合可使用实施例中的结合检测法(例如,ELISA)来检测。当VHCDR序列混合并匹配时,来自特定VH序列的CDR1、CDR2和/或CDR3序列应替换为结构上相似的(一个或多个)CDR序列。同样地,当VLCDR序列被混合并匹配时,来自特定VL序列的CDR1、CDR2和/或CDR3序列应替换为结构上相似的(一个或多个)CDR序列。对本领域技术人员显而易见的是新的VH和VL序列可以通过用来自本文显示用于本发明的人类抗体的CDR序列的结构相似的序列取代一种或多种VH和/或VLCDR区序列来创造(图1和2)。在另一个方面,本发明提供了分离的人类抗体,其结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物并包括选自SEQIDNO:14、18、22、25、28、31、34、37、40、83、87、90、93、112、130和138所示序列的VH氨基酸序列,和选自SEQIDNO:16、20、85、114、132、140、147和153所示序列的VL氨基酸序列。本发明的其它抗体包括已经通过氨基酸缺失、插入或取代被突变,但与上述序列中描述的CDR区在CDR区中具有至少60、70、80、90或95%同一性的氨基酸。在一些实施方式中,它包括突变体氨基酸序列,其中与上述序列中描述的CDR区相比,在CDR区中不超过1、2、3、4或5个氨基酸已经通过氨基酸缺失、插入或取代发生突变。实施方式49:根据实施方式中1至9任一项的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:选自SEQIDNO:28所示序列或其保守变体的重链可变区(VH)氨基酸序列和选自SEQIDNO:16所示序列或其保守变体的轻链可变区(VL)氨基酸序列。实施方式50:根据实施方式49的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:选自SEQIDNO:28所示序列或其保守变体的重链可变区(VH)氨基酸序列和选自SEQIDNO:16所示序列或其保守变体的轻链可变区(VL)氨基酸序列,其中参照SEQIDNO:28的位置30处的氨基酸天冬酰胺(Asn;N)被选自赖氨酸(Lys;K)或丝氨酸(Ser;S)或苏氨酸(Thr;T)或丙氨酸(Ala;A)或谷氨酸(Glu;E)或组氨酸(His;H)或亮氨酸(Leu;L)或谷氨酰胺(Gln,Q)或精氨酸(Arg;R)或缬氨酸(Val;V)或酪氨酸(Tyr;Y)或异亮氨酸(Ile;I)或甘氨酸(Gly;G)的氨基酸取代。实施方式51:根据实施方式49或50的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物且其中所述分离的人类抗体或其片段与鼠抗体125-2H竞争结合IL-18。实施方式52:根据实施方式49至51中任一项的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且该抗体或其片段结合参照SEQIDNO:1所限定的IL-18上的包括Arg140和Glu152的表位,任选地表位还包括氨基酸Lys89、Gln92、Pro93、Arg94、Gly95、Met96、Phe138、Ser141、Pro143、Gly144、Glu157、Glu177或Leu180中的任何一种或多种,优选地表位进一步包括氨基酸Lys89、Gln92、Pro93、Arg94、Gly95、Met96、Phe138、Ser141、Pro143、Gly144、Glu157、Glu177和Leu180。实施方式53:根据实施方式1至9中任一项的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:选自SEQIDNO:14所示序列或其保守变体的重链可变区(VH)氨基酸序列和选自SEQIDNO:16所示序列或其保守变体的轻链可变区(VL)氨基酸序列。实施方式54:根据实施方式53的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且其中分离的人类抗体或其片段与鼠抗体125-2H竞争结合IL-18。实施方式55:根据实施方式53至55中任一项的分离的人类抗体或其片段,其中该分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且抗体或其片段结合参照SEQIDNO:1所限定的IL-18上的包括Arg140和Glu152的表位,任选地表位还包括氨基酸Lys89、Gln92、Pro93、Arg94、Gly95、Met96、Phe138、Ser141、Pro143、Gly144、Glu157、Glu177或Leu180中的任何一种或多种,优选表位进一步包括氨基酸Lys89、Gln92、Pro93、Arg94、Gly95、Met96、Phe138、Ser141、Pro143、Gly144、Glu157、Glu177和Leu180。实施方式56:根据实施方式53的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括:选自SEQIDNO:14所示序列或其保守变体的重链可变区(VH)氨基酸序列和选自SEQIDNO:16所示序列或其保守变体的轻链可变区(VL)氨基酸序列,其中参照SEQIDNO:14的位置30处的氨基酸赖氨酸(Lys;K)被选自天冬酰胺(Asn;N),或丝氨酸(Ser;S)或苏氨酸(Thr;T)或丙氨酸(Ala;A)或谷氨酸(Glu;E)或组氨酸(His;H)或亮氨酸(Leu;L)或谷氨酰胺(Gln,Q)或精氨酸(Arg;R)或缬氨酸(Val;V)或酪氨酸(Tyr;Y)或异亮氨酸(Ile;I)或甘氨酸(Gly;G)的氨基酸取代。实施方式57:根据实施方式56的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且其中分离的人类抗体或其片段与鼠抗体125-2H竞争结合IL-18。实施方式58:该根据实施方式55或57中任一项的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且该抗体或其片段结合参照SEQIDNO:1所限定的IL-18上的包括Arg140和Glu152的表位,任选地表位还包括氨基酸Lys89、Gln92、Pro93、Arg94、Gly95、Met96、Phe138、Ser141、Pro143、Gly144、Glu157、Glu177或Leu180中的任何一种或多种,优选表位进一步包括氨基酸Lys89、Gln92、Pro93、Arg94、Gly95、Met96、Phe138、Ser141、Pro143、Gly144、Glu157、Glu177和Leu180。实施方式59:根据实施方式1至9中任一项的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括选自SEQIDNO:18所示序列或其保守变体的重链可变区(VH)氨基酸序列和选自SEQIDNO:20所示序列或其保守变体的轻链可变区(VL)氨基酸序列。实施方式60:根据实施方式59的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且其中分离的人类抗体或其片段与鼠抗体125-2H竞争结合IL-18。实施方式61:根据实施方式59或60中任一项的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且抗体或其片段结合参照SEQIDNO:1所限定的IL-18上的包括Arg140和Glu152的表位,任选地表位还包括氨基酸Lys89、Gln92、Pro93、Arg94、Gly95、Met96、Phe138、Ser141、Pro143、Gly144、Glu157、Glu177或Leu180中的任何一种或多种,优选地表位进一步包括氨基酸Lys89、Gln92、Pro93、Arg94、Gly95、Met96、Phe138、Ser141、Pro143、Gly144、Glu157、Glu177和Leu180。实施方式62:根据实施方式1至9中任一项的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括选自SEQIDNO:40所示序列或其保守变体的重链可变区(VH)氨基酸序列和选自SEQIDNO:20所示序列或其保守变体的轻链可变区(VL)氨基酸序列。实施方式63:根据实施方式62的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括选自SEQIDNO:40所示序列或其保守变体的重链可变区(VH)氨基酸序列和选自SEQIDNO:20所示序列或其保守变体的轻链可变区(VL)氨基酸序列,其中i.参照SEQIDNO:40在位置1的氨基酸谷氨酸(Glu;E)被氨基酸谷氨酰胺(Gln;Q)取代和ii.其中参照SEQIDNO:40在位置30的氨基酸天冬酰胺(Asn;N)被选自丝氨酸(Ser;S)或苏氨酸(Thr;T)或天冬氨酸(ASP;D)的氨基酸取代。实施方式64:根据实施方式63的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括选自SEQIDNO:40所示序列或其保守变体的重链可变区(VH)氨基酸序列和选自SEQIDNO:20所示序列或其保守变体的轻链可变区(VL)氨基酸序列,其中i.参照SEQIDNO:40在位置1的氨基酸谷氨酸(Glu;E)被氨基酸谷氨酰胺(Gln;Q)取代和ii.其中参照SEQIDNO:40在位置30的氨基酸天冬酰胺(Asn;N)被选自丝氨酸(Ser;S)或苏氨酸(Thr;T)或天冬氨酸(ASP;D)的氨基酸取代和iii.其中参照SEQIDNO:40在位置54的氨基酸甲硫氨酸(Met;M)被选自酪氨酸(Tyr;Y)或天冬酰胺(Asn;N)或异亮氨酸(Ile;I)的氨基酸取代。实施方式65:根据实施方式62至64的分离的人类抗体或其片段,其中分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物且其中所述分离的人类抗体或其片段与鼠抗体125-2H竞争结合IL-18。实施方式66:根据实施方式65至66中任一项的分离的人类抗体或其片段,其中分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且该抗体或其片段结合参照SEQIDNO:1所限定的IL-18上的包括Arg140和Glu152的表位,任选地表位还包括氨基酸Lys89、Gln92、Pro93、Arg94、Gly95、Met96、Phe138、Ser141、Pro143、Gly144、Glu157、Glu177或Leu180中的任何一种或多种,优选地表位进一步包括氨基酸Lys89、Gln92、Pro93、Arg94、Gly95、Met96、Phe138、Ser141、Pro143、Gly144、Glu157、Glu177和Leu180。实施方式67:根据实施方式62的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括选自SEQIDNO:40所示序列或其保守变体的重链可变区(VH)氨基酸序列和选自SEQIDNO:20所示序列或其保守变体的轻链可变区(VL)氨基酸序列,其中i.参照SEQIDNO:40在位置1的氨基酸谷氨酸(Glu;E)被氨基酸谷氨酰胺(Gln;Q)取代和ii.其中参照SEQIDNO:40在位置31的氨基酸丝氨酸(Ser;S)被选自苏氨酸(Thr;T)或天冬酰胺(Asn;N)或丙氨酸(Ala;A)的氨基酸取代。实施方式68:根据实施方式67的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括选自SEQIDNO:40所示序列或其保守变体的重链可变区(VH)氨基酸序列和选自SEQIDNO:20所示序列或其保守变体的轻链可变区(VL)氨基酸序列,其中i.参照SEQIDNO:40在位置1的氨基酸谷氨酸(Glu;E)被氨基酸谷氨酰胺(Gln;Q)取代;和ii.其中参照SEQIDNO:40在位置31的氨基酸丝氨酸(Ser;S)被选自苏氨酸(Thr;T)或天冬酰胺(Asn;N)或丙氨酸(Ala;A)的氨基酸取代。iii.其中参照SEQIDNO:40在位置54的氨基酸甲硫氨酸(Met;M)被选自酪氨酸(Tyr;Y)或天冬酰胺(Asn;N)或异亮氨酸(Ile;I)的氨基酸取代。实施方式69:根据实施方式67或68的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物且其中所述分离的人类抗体或其片段与鼠抗体125-2H竞争结合IL-18。实施方式70:根据实施方式67至69中任一项的分离的人类抗体或其片段,其中该分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且该抗体或其片段结合参照SEQIDNO:1所限定的IL-18上的包括Arg140和Glu152的表位,任选地表位还包括氨基酸Lys89、Gln92、Pro93、Arg94、Gly95、Met96、Phe138、Ser141、Pro143、Gly144、Glu157、Glu177或Leu180中的任何一种或多种,优选地表位进一步包括氨基酸Lys89、Gln92、Pro93、Arg94、Gly95、Met96、Phe138、Ser141、Pro143、Gly144、Glu157、Glu177和Leu180。实施方式72:根据实施方式1至9中任一项的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物并且包括选自SEQIDNO:22或SEQIDNO:25SEQIDNO:28或SEQIDNO:31或SEQIDNO:34所示序列或其保守变体的重链可变区(VH)氨基酸序列和选自SEQIDNO:16所示序列或其保守变体的轻链可变区(VL)氨基酸序列。实施方式73:根据实施方式1至9中任一项的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物并且包括选自SEQIDNO:37所示序列的重链可变区(VH)氨基酸序列和选自SEQIDNO:20所示序列或其保守变体的轻链可变区(VL)氨基酸序列。实施方式74:根据实施方式1至9中任一项的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括选自SEQIDNO:43、47、50、53、56、96、100、103、116、134、142和158所示序列或其保守变体的VH氨基酸序列;以及选自SEQIDNO:45、98、118、136、144、150、156和160所示序列或其保守变体的VL氨基酸序列。实施方式75:根据实施方式1至9中任一项的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括选自SEQIDNO:43所示序列或其保守变体的VH氨基酸序列和选自SEQIDNO:45所示序列或其保守变体的VL氨基酸序列。实施方式76:根据实施方式75的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且其中分离的人类抗体或其片段与鼠抗体125-2H竞争结合IL-18。实施方式77:根据实施方式75或76中任一项的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且该抗体或其片段结合参照SEQIDNO:1所限定的IL-18上的包括Arg140和Glu152的表位,任选地表位还包括氨基酸Lys89、Gln92、Pro93、Arg94、Gly95、Met96、Phe138、Ser141、Pro143、Gly144、Glu157、Glu177或Leu180中的任何一种或多种,优选地表位进一步包括氨基酸Lys89、Gln92、Pro93、Arg94、Gly95、Met96、Phe138、Ser141、Pro143、Gly144、Glu157、Glu177和Leu180。实施方式78:根据实施方式1至9中任一项的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括选自SEQIDNO:158所示序列或其保守变体的VH氨基酸序列和选自SEQIDNO:160所示序列或其保守变体的VL氨基酸序列。实施方式79:根据实施方式78的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且其中分离的人类抗体或其片段与鼠抗体125-2H竞争结合IL-18。实施方式80:根据实施方式78或79中任一项的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且该抗体或其片段结合参照SEQIDNO:1所限定的IL-18上的包括Arg140和Glu152的表位,任选地表位还包括氨基酸Lys89、Gln92、Pro93、Arg94、Gly95、Met96、Phe138、Ser141、Pro143、Gly144、Glu157、Glu177或Leu180中的任何一种或多种,优选地表位进一步包括氨基酸Lys89、Gln92、Pro93、Arg94、Gly95、Met96、Phe138、Ser141、Pro143、Gly144、Glu157、Glu177和Leu180。实施方式81:根据实施方式1至9中任一项的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括选自SEQIDNO:47或SEQIDNO:50或SEQIDNO:56所示序列或其保守变体的VH氨基酸序列和选自SEQIDNO:45所示序列或其保守变体的VL氨基酸序列。实施方式82:根据实施方式1至9中任一项的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物并且包括选自SEQIDNO:53或SEQIDNO:100所示序列或其保守变体的VH氨基酸序列和选自SEQIDNO:160所示序列或其保守变体的VL氨基酸序列。实施方式83:根据实施方式81或82的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物且其中所述分离的人类抗体或其片段与鼠抗体125-2H竞争结合IL-18。实施方式84:根据实施方式81至83中任一项的分离的人类抗体或其片段,其中该分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且该抗体或其片段结合参照SEQIDNO:1所限定的IL-18上的包括Arg140和Glu152的表位,任选地表位还包括氨基酸Lys89、Gln92、Pro93、Arg94、Gly95、Met96、Phe138、Ser141、Pro143、Gly144、Glu157、Glu177或Leu180中的任何一种或多种,优选地表位进一步包括氨基酸Lys89、Gln92、Pro93、Arg94、Gly95、Met96、Phe138、Ser141、Pro143、Gly144、Glu157、Glu177和Leu180。实施方式85:根据实施方式1至9中任一项的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括选自SEQIDNO:96或SEQIDNO:103所示序列或其保守变体的VH氨基酸序列和选自SEQIDNO:98所示序列或其保守变体的VL氨基酸序列。实施方式86:根据实施方式1至9中任一项的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括选自SEQIDNO:116所示序列或其保守变体的VH氨基酸序列和选自SEQIDNO:118所示序列或其保守变体的VL氨基酸序列。实施方式87:根据实施方式1至9中任一项的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括选自SEQIDNO:142所示序列或其保守变体的VH氨基酸序列和选自SEQIDNO:144所示序列或其保守变体的VL氨基酸序列。实施方式88:根据实施方式1至9中任一项的分离的人类抗体或其片段,其中所述分离的人类抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且包括选自SEQIDNO:134所示序列或其保守变体的VH氨基酸序列和选自SEQIDNO:136或SEQIDNO:150或SEQIDNO:156所示序列或其保守变体的VL氨基酸序列。2.2)人源化或嵌合抗体本文所公开的发明的明显的替代是使用人源化的或嵌合的抗体代替人类抗体。在人类疾病或病症的治疗中使用完整的非人类抗体夹带了现在公认的潜在的免疫原性问题。也就是,患者的免疫系统可能将非人类完整的分离的抗体识别为非自身的并产生抗体反应。这在向人类患者多次施用非人类的分离的抗体时尤其明显。多年来已经开发了多种技术来克服这些难题,通常涉及降低完整的分离的抗体中非人类免疫原性特征而保持相对容易地从免疫的动物,例如小鼠、大鼠或兔获得非人类抗体。广义上两种方法已经用于实现这一点。第一种是嵌合(有时称作“chimaeric”)抗体,其一般包括融合到人类恒定区的非人类(例如,啮齿动物如小鼠)可变结构域。由于分离的抗体的抗原结合位点定位于可变区之内,嵌合的分离的抗体保持了它对抗原的结合亲和性,但是获得了人类恒定区的效应子功能,因而能够执行效应子功能,例如上文中所述的。嵌合抗体通常是使用重组DNA方法产生。编码抗体的DNA(例如,cDNA)使用常规过程(例如,通过使用寡核苷酸探针,其能够特异性地结合编码本发明的分离的抗体的重和轻链的基因)来分离和测序。杂交瘤细胞充当这种DNA的典型来源。一旦被分离,将DNA放入表达载体中,然后将表达载体转染入宿主细胞,例如否则不产生免疫球蛋白的大肠杆菌、COS细胞、CHO细胞或骨髓瘤细胞,以获得分离的抗体的合成。可以通过用人类L和H链的编码序列取代相应的非人类(例如,鼠)H和L恒定区修饰DNA(Morrison;PNAS81,6851(1984))。第二种方法涉及人源化抗体生产,其中分离的抗体的非人类内容通过使可变区人源化来降低。人源化的两种技术已经变得流行。第一种是通过CDR移植来人源化。CDR构造靠近分离的抗体的N-末端的环,在此它们形成装配在框架区提供的支架中的表面。分离的抗体的抗原结合特异性主要由拓扑图和由它的CDR表面的化学特性决定。这些特征转而由单独的CDR的构象、CDR的相对分布以及包含CDR的残基的侧链的性质和分布来决定。免疫原性的大的降低可以通过仅仅移植非人类(例如,鼠)抗体(“供体”抗体)的CDR到人类框架(“接受体框架”)和恒定区中来实现(Jones等人(1986)Nature321:522-525和VerhoeyenM等人(1988)Science239:1534-1536)。然而,CDR移植本身可能不会产生抗原结合性质的完全保留,并且经常发现的是,如果要恢复显著的抗原结合亲和性,供体分离的抗体的某些框架残基需要被保留(有时称为“回复突变”)在人源化化合物中((QueenC等人,(1989)ProcNatlAcadSci86:10029-10033,Co,M等人(1991)Nature351,501-502)。在这种情况中,从数据库中选择显示出与非人类供体分离的抗体的最大序列同源性的人类可变区以提供人类框架(FR)。人类FR的选择可以从人类共有的或单独的人类抗体来进行。必要时,来自供体分离的抗体的关键残基被替换到人类接受体框架中以保留CDR构象。分离的抗体的计算机建模可以用于帮助鉴定这种结构上重要的残基。或者,人源化可以通过“饰面”(veneering)过程来实现。独特的人类和鼠免疫球蛋白重链和轻链可变区的统计分析揭示了,暴露的残基的确切模式在人类和鼠抗体中是不同的,并且大多数的单独表面位置具有对少数不同残基的强的偏好性(PadlanEA,等人;(1991)MolImmunol28:489-498和PedersenJT等人(1994)JMolBiol235:959-973)。因而,有可能通过替换其框架区中与在人类抗体中通常发现的不同的暴露的残基来降低非人类Fv的免疫原性。因为蛋白质抗原性可能与表面可接近性相关,表面残基的替换可能足以使小鼠可变区对于人类免疫系统成为“看不见的”(还参见MarkGE等人(1994)于HandbookofExperimentalPharmacology第113卷:ThepharmacologyofmonoclonalAntibodies,Springer-Verlag,第105-134页)。这种人源化的过程被称为“饰面”,因为仅仅是分离的抗体的表面改变,支持性残基保持未被干扰。2.3)分离的抗体片段和单可变结构域抗体在本发明的另一实施方式中,结合分子是抗体片段或单可变结构域抗体,其结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物。优选地,结合分子是Fab、Fab'、F(ab')2、Fv、scFv、dAb或VHH。通常地,这些片段是通过由例如木瓜蛋白酶消化来蛋白水解消化完整抗体所产生的(参见例如WO94/29348),但也可以直接从重组转化的宿主细胞产生。此外,分离的抗体片段可以使用如下所述的多种改造技术来产生。Fv片段的两条链似乎比Fab片段具有更低的相互作用能量。为了稳定VH和VL结构域的缔合,它们已与肽(Bird等人,(1988)Science,242:423-426,Huston等人,(1998)PNAS,85:5879-5883),二硫桥(Glockshuber等人,(1990)Biochemistry,29:1362-1367)以及“结入孔(knobinhole)”突变(Zhu等人(1997),ProteinSci,6:781-788)相连。scFv片段可以通过本领域技术人员公知的方法来生产(Whitlow等人(1991),MethodscompanionMethodsEnzymol,2:97-105和Huston等人(1993)IntRevImmunol10:195-217)。scFv可在细菌细胞如大肠杆菌中生产,但更优选在真核细胞中生产。scFv的一个缺点是产物的单价性,这就排除了由于多价结合造成的提高的亲和力,以及它们的短半寿期。克服这些问题的尝试包括通过化学偶联(Adams等人(1993)CanRes53:4026-4034和McCartney等人(1995)ProteinEng,8:301-314)或者通过自发位点特异性二聚化含有未配对的C末端半胱氨酸残基的scFv(Kipriyanov等人(1995)Cell.Biophys26:187-204)从含有额外的C末端半胱氨酸的scFv生产的二价(scFv')2。或者,可以通过缩短肽接头到3和12个残基之间来形成“双抗体”从而强制scFv形成多聚体(Holliger等人PNAS(1993),90:6444-6448)。更进一步缩小接头能导致scFv三聚体(“三抗体”,参见Kortt等人(1997)ProteinEng,10:423-433)和四聚体(‘四抗体’,LeGall等人(1999)FEBSLett,453:164-168)。二价scFv化合物的构建也可以通过与蛋白质二聚化基序基因融合来形成“微型抗体”(Pack等人(1992)Biochemistry31:1579-1584)和“微小体(minibody)”(Hu等人(1996),CancerRes.56:3055-3061)而实现。ScFv-sc-Fv串联物((scFv)2)也可以通过由第三肽接头连接两个scFv单元产生(参见Kurucz等人(1995)JImmunol,154:4576-4582)。双特异性双抗体可以通过两个单链融合产物的非共价缔合来产生,所述单链融合产物由通过由短接头连接到另一个分离的抗体的VL结构域的来自一个分离的抗体的VH结构域组成,(参见Kipriyanov等人(1998),IntJCan77:763-772)。这种双特异性双抗体的稳定性可以通过导入上文描述的二硫桥或“结入孔”突变,或通过形成单链双抗体(ScDb)来增强,其中两个杂交的scFv片段通过肽接头连接(参见Kontermann等人(1999)JImmunolMethods226:179-188)。通过,例如将scFv片段融合到IgG化合物的CH3结构域,或通过绞链区融合到Fab片段,可以获得四价的双特异性化合物,(参见Coloma等人(1997)NatureBiotechnol,15:159-163)。或者,通过双特异性单链双抗体的融合已经创建了四价的双特异性化合物(参见Alt等人(1999)FEBSLett454:90-94)。较小的四价双特异性化合物也可以通过scFv-scFv串联物使用含有螺旋-环-螺旋基序的接头(DiBiminiantibodies,参见Muller等人(1998)FEBSLett432,45-49),或包含处于防止分子内配对的取向的四个分离的抗体可变结构域(VH和VL)的单链化合物的二聚化作用(串联双抗体,参见Kipriyanov等人,(1999)J.Mol.Biol.293,41-56)来形成。双特异性F(ab')2片段可以通过Fab'片段的化学偶联或通过经由亮氨酸拉链结构的异二聚化来创建(参见Shalaby等人(1992)JExpMed175:217-225和Kostelny等人(1992),JImmunol148:1547-1553)。术语“单可变结构域抗体”是指独立于不同的V区或结构域特异性地结合抗原或表位的抗体可变结构域(VH、VHH、VL)。单可变结构域抗体可以以具有其他,不同可变区或可变结构域的形式(例如,同聚物或异多聚物)存在,其中所述其他可变区或结构域不是该单可变结构域对抗原结合所必需的(即其中所述单结构域抗体独立于其他可变结构域结合抗原)。“结构域抗体”或“dAb”与如本文所使用的术语能够结合抗原的“单可变结构域抗体”是相同的。单可变结构域抗体可以是人类抗体可变结构域,但也包括来自其他物种的单抗体可变结构域,如啮齿动物(例如,如WO00/29004所述)、护士鲨和骆驼科VHHdAb。骆驼科VHH是来源于包括骆驼、美洲驼、羊驼、单峰驼和原驼的物种的单可变结构域多肽,其产生天然缺乏轻链的重链抗体。这样的VHH结构域可以根据本领域中可用的标准技术进行人源化,并且这样的结构域仍然被认为是根据本发明的“结构域抗体”。如本文所用的“VH”包括骆驼科VHH结构域。2.4)同源的抗体或其片段和保守变体在本发明的另一实施方式中,结合分子是抗体或其片段,其具有可变区重和轻链氨基酸序列或与本文所述的抗体的氨基酸序列同源的重和轻链氨基酸序列,并且其中所述同源抗体或其片段保留了根据本发明的结合分子的期望的功能性质。例如,本发明提供了包括VH和VL的分离的抗体或其片段,其中:VH与选自由SEQIDNO:14;18;22;25;28;31;34;37;40;83;87;90;93;112;130或138组成的组的氨基酸序列至少80%、或至少90%是相同的;VL与选自由SEQIDNO:16;20;85;114;132;140;147或153组成的组的氨基酸序列至少80%、或至少90%是相同的,其中所述同源抗体特异性结合IL18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物。同源抗体可以展现出至少一种额外的功能性质如抑制IL18结合IL18R或抑制IL18依赖性的IFN-γ生产。在其他实施方式中,VH和/或VL氨基酸序列可以与上面提出的序列50%、60%、70%、80%、90%、95%、96%、97%、98%或99%相同。在其他实施方式中,VH和/或VL氨基酸序列可以是除了在不超过1、2、3、4或5个氨基酸位置的氨基酸取代以外都是相同的。VH和VL区分别与SEQIDNO:14;18;22;25;28;31;34;37;40;83;87;90;93;112;130或138和SEQIDNO:16;20;85;114;132;140;147或153的VH和VL区具有高(即,80%或更大)同一性的抗体,可通过分别诱变(例如,定点或PCR介导的诱变)编码SEQIDNO:15;19;23;26;29;32;35;38;41;84;88;91;94;113;131;139;146或152和17;21;24;27;30;33;36;39;42;86;89;92;95;115;133;141;148或154的核酸分子,随后使用本文所述的功能检测法测试所编码的改变的抗体的保留的功能(即,上面提出的功能)来获得。同源抗体可以是例如,人类抗体、人源化抗体或嵌合抗体。优选地抗体是全长人类沉默的IgG1抗体。如本文所用的,两个序列之间的同一性百分比是序列共有的相同位置的数目的函数(即,%同一性=相同位置#/总位置#×100),考虑需要被引入用于两个序列的最佳比对的空位数以及每个空位的长度。序列的比较以及两个序列之间同一性百分比的确定可以使用数学算法来实现,如下所述。两个氨基酸序列之间的同一性百分比可以通过使用E.Meyers和W.Miller,(1988)Comput.Appl.Biosci4:11-17的算法来确定,该算法被整合到ALIGN程序(2.0版),使用PAM120权重残基表,缺口长度罚分为12以及空位罚分为4。或者,两个氨基酸序列之间的同一性百分比可以使用Needleman和Wunsch(1970)JMolBiol48:444-453的算法来确定,该算法被整合到GCG软件包的GAP程序中(可获自http://www.gcg.com),使用Blossom62矩阵或PAM250矩阵,以及空位权重为16、14、12、10、8、6、或4和长度权重为1、2、3、4、5、或6。2.5)双重可变结构域抗体双重可变结构域(DVD)抗体包括两个或更多个抗原结合位点,且是四价或多价抗体,例如二价和四价。多价抗体是特别改造成具有两个或更多个抗原结合位点,而且一般不是天然存在的抗体。DVD抗体可能能够结合两种或更多种相关或不相关的靶标。这样的DVD抗体可以是单特异性的,即能够结合一种抗原,或多特异性的,即能够结合两种或更多种抗原。在一些实施方式中,DVD抗体包括两条重链和两条轻链。每条重链和轻链包括两个抗原结合位点。每个结合位点包括重链可变结构域和轻链可变结构域,每个抗原结合位点具有参与抗原结合的总共6个CDR。在一个实施方式中,本发明的结合分子是双重可变结构域(DVD)抗体,其结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物。特别地,根据本发明的双重可变结构域抗体能够结合IL-18和第二靶标。第二靶标可以选自IL-1、IL-6、IL-8、IL-11、IL-12、IL-17、IL-25、IL-33、IL-1β、TNFα/β和IFN-γ。2.6)双特异性和多特异性分子和抗体在一个实施方式中,本发明的结合分子是分离的双特异性抗体或其片段,其包括对IL-18的第一特异性和对另一多肽如IL-12的第二特异性;其中所述双特异性抗体不结合IL-18/IL-18结合蛋白(IL-18BP)复合物。特别地,根据本发明的双特异性抗体能够结合IL-18和第二靶标。第二靶标可以选自IL-1、IL-6、IL-8、IL-11、IL-12、IL-17、IL-25、IL-33、IL-1β、TNFα/β和IFN-γ。在又另一个方面,本发明提供了结合分子,其是分离的多特异性抗体或其片段,其包括对IL-18的第一特异性、对另一多肽如IL-12的第二特异性和对另一多肽的至少第三特异性,其中所述多特异性抗体不结合IL-18/IL-18结合蛋白(IL-18BP)复合物。特别地,根据本发明的多特异性抗体能够结合IL-18、第二和第三靶标。第二和第三靶标可以选自IL-1、IL-6、IL-8、IL-11、IL-12、IL-17、IL-25、IL-33、IL-1β、TNFα/β和IFN-γ。双特异性分离的抗体是对至少两种不同表位具有结合特异性的分离的抗体。制备这种抗体的方法是本领域已知的。传统上,基于两个免疫球蛋白H链-L链对的共表达重组生产双特异性抗体,其中两条H链具有不同的结合特异性(参见Millstein等人,(1983)Nature305:537-539,WO93/08829和Traunecker等人,(1991)EMBO10:3655-3659)。因为H和L链的随机分配,产生了十种不同的分离的抗体结构的潜在混合物,其中只有一种具有所期望的结合特异性。替代方法涉及融合具有所期望的结合特异性的可变结构域与包括至少部分铰链区、CH2和CH3区的重链恒定区。优选使包含轻链结合所需的CH1区存在于至少一种融合物中。将编码这些融合物以及L链(如果需要的话)的DNA插入到单独的表达载体中,然后共转染到合适的宿主生物体中。但将两条或所有三条链的编码序列插入到一个表达载体中也是可能的。在一种优选的方法中,双特异性分离的抗体是由在一条臂上具有第一结合特异性的H链和在另一个臂上提供第二结合特异性的H-L链对组成的,参见WO94/04690。还参见Suresh等人,MethodsinEnzymology121,210,1986。本发明的双特异性和多特异性抗体可被衍生化或连接到另一个功能性分子,例如另一种肽或蛋白质(例如,另一种抗体或受体的配体),以产生结合至少两个不同结合位点或靶分子的双特异性分子。本发明的抗体实际上可以被衍生化或连接到一个以上的其他功能性分子以产生结合超过两个不同的结合位点和/或靶分子的多特异性分子;这样的多特异性分子也意欲涵盖在如本文所用的术语“双特异性分子”中。为了产生本发明的双特异性分子,本发明的抗体可以功能性连接(例如,通过化学偶联、基因融合、非共价缔合或其他方式)至一个或多个其他结合分子,例如另一抗体、抗体片段、肽或结合模拟物,从而产生双特异性分子。在一个实施方式中,本发明的双特异性分子包括作为结合特异性的至少一种抗体或其抗体片段,包括,例如,Fab、Fab'、F(ab')2、Fv或单链Fv。所述抗体也可以是轻链或重链二聚体,或其任何最小片段,例如Fv或单链构建体,如Ladner等人美国专利号4,946,778所述。可以在本发明的双特异性分子中使用的其他抗体是鼠的、嵌合的和人源化的单克隆抗体。本发明的双特异性和多特异性分子可以使用本领域中已知的方法,通过缀合组分结合特异性来制备。例如,可以单独生成双特异性分子的每一种结合特异性,然后彼此缀合。当结合特异性是蛋白质或肽时,多种偶联剂或交联剂可用于共价缀合。交联剂的实例包括蛋白A、碳二亚胺、N-琥珀酰亚胺基-S-乙酰基-硫代乙酸酯(SATA)、5,5'-二硫代双(2-硝基苯甲酸)(DTNB)、邻亚苯基马来酰亚胺(oPDM)、N-琥珀酰亚胺基-3-(2-吡啶基二硫代)丙酸酯(SPDP)和磺基琥珀酰亚胺4-(N-马来酰亚胺甲基)环己烷-1-羧酸酯(磺基-SMCC)(参见例如,Karpovsky等人(1984)JExpMed;160:1686;Liu,MA等人(1985)ProcNatlAcadSciUSA;82:8648)。其他方法包括Paulus(1985)BehringInstMitt;78:118-132;Brennan等人(1985)Science;229:81-83)和Glennie等人(1987)JImmunol;139:2367-2375所述的那些。缀合剂是SATA和磺基-SMCC,两者都可从PierceChemicalCo.(Rockford,IL)获得。当结合特异性是抗体时,它们可通过两个重链的C末端铰链区的巯基键合来缀合。在一个具体的实施方式中,在缀合前修饰铰链区以包括奇数个巯基残基,例如一个。或者,两种结合特异性可以被编码在同一载体中并在相同的宿主细胞中表达和装配。当双特异性分子是mAbxmAb、mAbxFabFabxF(ab')2或配体xFab融合蛋白时,这个方法是特别有用的。本发明的双特异性分子可以是包括一个单链抗体和结合决定簇的单链分子,或是包括两个结合决定簇的单链双特异性分子。双特异性分子可包括至少两个单链分子。用于制备双特异性分子的方法描述于例如美国专利号5,260,203;美国专利号5,455,030;美国专利号4,881,175;美国专利号5,132,405;美国专利号5,091,513;美国专利号5,476,786;美国专利号5,013,653;美国专利号5,258,498;和美国专利号5,482,858。双特异性分子与其特异性靶标的结合可以通过,例如酶联免疫吸附检测法(ELISA)、放射免疫检测法(RIA)、FACS分析、生物检测法(例如,生长抑制)或Western印迹检测法来确认。这些检测法中每个通常通过使用对目的复合物特异性的经标记的试剂(例如,抗体)来检测具有特定目的的蛋白质-抗体复合物的存在。2.7)多价抗体在另一个方面,本发明提供多价抗体,其包括至少两个相同或不同的本发明的结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的抗体的抗原结合部分。在一个实施方式中,多价抗体提供本文中所描述的抗体的至少两个、三个或四个抗原结合部分。抗原结合部分可以通过蛋白质融合或共价或非共价键连接到一起。或者,已为双特异性分子描述过连接方法。四价化合物可例如通过交联本发明的抗体与结合本发明抗体的恒定区(例如Fc或铰链区)的抗体来获得。2.8)免疫缀合物在另一实施方式中,本发明的结合分子是结合IL-18但不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的抗体或其片段,其中所述抗体或其片段缀合到治疗部分,如细胞毒素、药物(如免疫抑制剂)或放射毒素。此类缀合物在本文中被称为“免疫缀合物”。包括一种或多种细胞毒素的免疫缀合物被称为“免疫毒素”。细胞毒素或细胞毒性剂包括任何对细胞有害(例如,杀死细胞)的活性剂。实例包括紫杉醇、细胞松弛素B、短杆菌肽D、溴化乙锭、吐根碱、丝裂霉素、依托泊苷、替尼泊苷、长春新碱、长春碱、t.秋水仙碱、阿霉素、柔红霉素、二羟基炭疽菌素二酮、米托蒽醌、光神霉素、放线菌素D、1-去氢睾酮、糖皮质激素、普鲁卡因、丁卡因、利多卡因、普萘洛尔和嘌呤霉素及其类似物或同源物。治疗剂还包括,例如,抗代谢物(例如,甲氨蝶呤,6-巯基嘌呤,6-硫鸟嘌呤,阿糖胞苷,5-氟尿嘧啶达卡巴嗪)、消融剂(例如氮芥,塞替派苯丁酸氮芥,马法兰,卡莫司汀(BSNU)和洛莫司汀(CCNU)、环磷酰胺、白消安、二溴甘露醇、链脲霉素、丝裂霉素C和顺-二氯二胺铂(II)(DDP)顺铂、蒽环类抗生素(例如,柔红霉素(以前称为道诺霉素)和阿霉素)、抗生素(例如,放线菌素D(以前称为放线菌素),博来霉素,光神霉素,和氨茴霉素(AMC)),以及抗有丝分裂剂(例如,长春新碱和长春碱)。其它可缀合至本发明抗体的治疗性细胞毒素的实例包括多卡米星、刺孢霉素美登素和奥里斯他汀及它们的衍生物。加利车霉素抗体缀合物的实例是可商购的(MylotargTM;惠氏)。可以使用本领域可用的接头技术将细胞毒素缀合到本发明的抗体。已被用于将细胞毒素缀合到抗体的接头类型的实例包括,但不限于腙、硫醚、酯、二硫化物和含肽接头。接头可以选择,例如,对于在溶酶体区室中的低pH值的切割敏感的或对于蛋白酶,如在肿瘤组织中优先表达的蛋白酶,如组织蛋白酶(例如,组织蛋白酶B、C、D)的切割敏感的。对于细胞毒素、接头的类型,以及将治疗剂缀合到抗体的方法的进一步讨论也参见Saito,G等人(2003)AdvDrugDelivRev;55:199-215;Trail,PA等人(2003)CancerImmunolImmunother;52:328-337;Payne,G(2003)CancerCell;3:207-212;Allen,TM(2002)NatRevCancer;2:750-763;Pastan,I和Kreitman,RJ(2002)CurrOpinInvestigDrugs;3:1089-1091;Senter,PD和Springer,CJ(2001)AdvDrugDelivRev;53:247-264。本发明的抗体也可以缀合至放射性同位素以产生细胞毒性放射性药物,也称为放射性免疫缀合物。可缀合至抗体用于诊断或治疗使用的放射性同位素的例子包括但不限于,碘131、铟111、钇90和镥177。本领域已经建立了制备放射性免疫缀合物的方法。放射性免疫缀合物的实例是可商购的,包括ZevalinTM(DECPharmaceuticals)和BexxarTM(CorixaPharmaceuticals),并且类似的方法可用于使用本发明的抗体制备放射性免疫缀合物。本发明的抗体缀合物可用于修饰给定的生物学反应,并且药物部分不被解释为限于经典的化学治疗剂。例如,药物部分可以是具有所需生物活性的蛋白质或多肽。此类蛋白质可以包括例如,酶促活性毒素或其活性片段,如相思豆毒蛋白、蓖麻毒蛋白A、假单胞菌外毒素或白喉毒素;或生长因子。将此类治疗性部分缀合到抗体的技术是公知的,参见,例如,Amon等人"MonoclonalAntibodiesForImmunotargetingOfDrugsInCancerTherapy",于MonoclonalAntibodiesAndCancerTherapy,Reisfeld等人(编辑),第243-56页(AlanR.Liss,Inc.1985);Hellstrom等人"AntibodiesForDrugDelivery",ControlledDrugDelivery(第2版),Robinson等人(编辑),第623-53页(MarcelDekker,Inc.1987);Thorpe,"AntibodyCarriersOfCytotoxicAgentsInCancerTherapy:AReview",MonoclonalAntibodies'84:BiologicalAndClinicalApplications,Pinchera等人(编辑),第475-506页(1985);"Analysis,Results,AndFutureProspectiveOfTheTherapeuticUseOfRadiolabeledAntibodyInCancerTherapy",MonoclonalAntibodiesForCancerDetectionAndTherapy,Baldwin等人(编辑),第303-16页(AcademicPress1985)和Thorpe等人,"ThePreparationAndCytotoxicPropertiesOfAntibody-ToxinConjugates",(1982)ImmunolRev;62:119-58。2.9)异源缀合抗体异源缀合抗体也构成本发明的实施方式。异源缀合抗体是由使用任何方便的交联方法形成的两个共价连接的抗体组成,其中至少所连接的抗体是根据本发明的结合IL-18但不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的抗体。参见,例如,US4,676,980。2.10)框架改造本发明的经改造的抗体包括这样的抗体,其中已经对VH和/或VL内的框架残基进行修饰以例如改善抗体的性质。通常,进行此类框架修饰以降低抗体的免疫原性。例如,一种方法是将一个或多个框架残基“回复突变”成对应的种系序列。更特别地,已经经历体细胞突变的抗体可以含有与该抗体所来源的种系序列不同的框架残基。通过比较抗体框架序列与该抗体所来源的种系序列可以鉴定此类残基。为了使框架区序列回复到它们的种系构型,可以例如通过位点定向诱变或PCR介导的诱变将体细胞突变“回复突变”成种系序列。此类“回复突变”抗体也意在被本发明包括。另一类型的框架修饰涉及突变框架区内,或者甚至一个或多个CDR区内的一个或多个残基,以除去T细胞表位,从而降低抗体的潜在免疫原性。该方法也称作“去免疫”并且在Carr等人的美国专利公布号20030153043中进一步详细描述。2.11)其他修饰除了在框架或CDR区内进行的修饰外,或替代所述修饰,可以改造本发明的抗体以包括Fc区内的修饰,通常改变抗体的一种或多种功能性质,如血清半寿期、补体固定、Fc受体结合,和/或抗原依赖性细胞毒性。此外,本发明的抗体可以被化学修饰(例如,一个或多个化学部分可以连接到抗体)或经修饰而改变它的糖基化,再次改变该抗体的一种或多种功能性质。这些实施方案的每一个都在下面详细描述。Fc区内的残基编号为Kabat的EU索引编号。在一个实施方案中,修饰CH1的铰链区使得改变,例如,增加或减少铰链区中半胱氨酸残基的数目。该方法在Bodmer等人的美国专利号5,677,425中进一步描述。改变CH1的铰链区中的半胱氨酸残基数目以例如帮助轻链和重链的装配或增加或降低抗体的稳定性。在另一实施方案中,将抗体的Fc铰链区突变以降低该抗体的生物学半寿期。更具体地,将一个或多个氨基酸突变导入Fc-铰链片段的CH2-CH3结构域界面区,使得该抗体相对于天然Fc铰链结构域SpA结合具有受损的葡萄球菌蛋白A(SpA)结合。该方法在Ward等人的美国专利号6,165,745中进一步详细描述。在另一实施方案中,修饰抗体以增加其生物学半寿期。多种方法是可能的。例如,可以导入一个或多个下面的突变:T252L、T254S、T256F,如Ward的美国专利号6,277,375所述。备选地,为了延长生物学半寿期,可以在CH1或CL区内改变抗体以含有从IgG的Fc区的CH2结构域的两个环得到的补救受体结合表位,如Presta等人的美国专利号5,869,046和6,121,022中描述。在其他实施方案中,通过将至少一个氨基酸残基用不同的氨基酸残基替换改变Fc区以改变抗体的效应子功能。例如,一个或多个氨基酸可以用不同的氨基酸残基替换,使得该抗体对于效应子配体具有改变的亲和力但是保留亲本抗体的抗原结合能力。亲和力改变的效应子配体可以是例如,Fc受体或补体的C1组分。该方法在Winter等人的美国专利号5,624,821和5,648,260中进一步详述。在另一实施方案中,选自氨基酸残基的一个或多个氨基酸可以用不同氨基酸残基替换使得该抗体具有改变的C1q结合和/或减小或消除的补体依赖性细胞毒性(CDC)。该方法在Idusogie等人的美国专利号6,194,551中进一步详述。在另一实施方案中,改变一个或多个氨基酸残基从而改变该抗体固定补体的能力。该方法在Bodmer等人的PCT公布WO94/29351中进一步描述。在另一实施方案中,通过修饰一个或多个氨基酸修饰Fc区以增加该抗体介导抗体依赖性细胞毒性(ADCC)的能力和/或增加抗体对Fcγ受体的亲和力。该方法在Presta的PCT公布号WO00/42072中进一步描述。此外,已经对人IgG1上的FcγRl、FcγRII、FcγRIII和FcRn的结合位点作图并且已经描述了具有提高的结合的变体(见Shields,R.L.等人,(2001)J.Biol.Chem.276:6591-6604)。在某些实施方式中,使用IgG1同种型的Fc结构域。在一些特定的实施方式中,使用IgG1Fc片段的突变体变体,例如沉默的IgG1Fc,其降低或者消除融合多肽介导抗体依赖型细胞毒性(ADCC)和/或结合Fcγ受体的能力。其中在氨基酸位置234和235的亮氨酸被丙氨酸替换的IgG1同种型沉默突变体的实例描述于Hezareh等人,J.Virol(2001);75(24):12161-8。在某些实施方式中,Fc结构域是防止Fc结构域的位置297的糖基化的突变体。例如,Fc结构域在位置297含有天冬酰胺残基的氨基酸取代。这种氨基酸取代的实例是N297被甘氨酸或丙氨酸替换。在另一实施方案中,修饰抗体的糖基化。例如,可以制备无糖基化抗体(即,缺少糖基化的抗体)。可以改变糖基化以例如,增加抗体对抗原的亲和力。此类糖类修饰可以通过例如改变抗体序列内一个或多个糖基化位点完成。例如,可以进行一个或多个氨基酸取代,其导致去除一个或多个可变区框架糖基化位点,从而去除该位点的糖基化。此类无糖基化可以增加抗体对抗原的亲和力。这种方法在Co等人的美国专利号5,714,350和6,350,861中进一步详细描述。额外或备选地,可以制备具有改变类型的糖基化的抗体,如具有减少量的岩藻糖残基的低岩藻糖基化抗体或者具有增加的等分GlcNac结构的抗体。已经表明此类改变的糖基化模式增加抗体的ADCC能力。通过例如在具有改变的糖基化机制的宿主细胞中表达抗体完成此类糖类修饰。具有改变的糖基化机制的细胞已经在本领域中描述并且可以用作宿主细胞,在其中表达本发明的重组抗体从而产生具有改变的糖基化的抗体。例如,Hang等人的EP1,176,195描述了具有功能被破坏的FUT8基因的细胞系,所述FUT8基因编码岩藻糖基转移酶,使得在这种细胞系中表达的抗体显示出低岩藻糖化。因此,在一个实施方式中,本发明的抗体是通过在展现低岩藻糖模式的细胞系中,例如具有编码岩藻糖基转移酶的FUT8基因的缺陷表达的哺乳动物细胞系重组表达来生产的。Presta的PCT公开WO03/035835描述了变体CHO细胞系Lecl3细胞,其将岩藻糖附着到Asn(297)-连接的糖类的能力降低,也导致在该宿主细胞中表达的抗体的低岩藻糖化(也见Shields,R.L.等人,2002J.Biol.Chem.277:26733-26740)。Umana等人的PCT公开WO99/54342描述了细胞系,其被改造而表达修饰糖蛋白的糖基转移酶(例如,β(1,4)-N乙酰基葡糖胺基转移酶III(GnTIII),使得在该经改造的细胞系中表达的抗体显示出增加的等分GlcNac结构,其导致抗体增加的ADCC活性(也见Umana等人,1999Nat.Biotech.17:176-180)。或者,可以在酵母或丝状真菌中生产本发明的抗体,所述酵母或丝状真菌是对于哺乳动物样糖基化模式进行了改造并且能够生产缺乏岩藻糖作为糖基化模式的抗体。本发明设想的本文抗体的另一种修饰是聚乙二醇化。可以将抗体聚乙二醇化,例如,以延长该抗体的生物学(例如,血清)半寿期。为了聚乙二醇化抗体,通常将该抗体或其片段与聚乙二醇(PEG),如PEG的活性酯或醛衍生物在这样的条件下反应,在所述条件下,一个或多个PEG基团变得附着到抗体或抗体片段。通过用反应性PEG分子(或其类似的反应性水溶性聚合物)进行酰化反应或烷基化反应,可以进行聚乙二醇化。本文所用的术语“聚乙二醇”意在包括任一形式的PEG,其已经被用于衍生其他蛋白质,如单(C1-C10)烷氧基-或芳氧基聚乙二醇或者聚乙二醇-马来酰亚胺。在一些实施方案中,待聚乙二醇化的抗体是无糖基化的抗体。聚乙二醇化蛋白质的方法是本领域已知的,并且可以应用于本发明的抗体。见例如,Nishimura等人的EP0154316和Ishikawa等人的EP0401384。本发明考虑的抗体的另一种修饰是至少本发明的抗体的抗原结合区与血清蛋白,如人血清白蛋白或其片段的缀合物或融合蛋白,以增加所得分子的半寿期。这样的方法例如在Ballance等人EP0322094中描述。3.抗原结合结构域移植到替代的框架或支架中可以采用各种各样的抗体/免疫球蛋白框架或支架,只要所得多肽包括特异性结合IL18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物且其中结合分子不是IL-18BP的至少一个结合区。这样的框架或支架包括人类免疫球蛋白的五个主要的独特型或其片段(如在本文其它地方公开的那些),并且包括其它动物物种的免疫球蛋白,优选具有人源化的方面。在此方面,尤其感兴趣的是单重链抗体例如在骆驼中鉴定的那些。新颖的框架、支架和片段被本领域技术人员不断地发现和开发。3.1)非免疫球蛋白框架可以采用已知的或未来的非免疫球蛋白框架和支架,只要它们包括对于IL-18特异的且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物并且其中结合分子不是IL-18BP的结合区。这样的化合物在本文中被称为“包括靶特异性结合区的多肽”。已知的非免疫球蛋白框架或支架包括,但不限于,adnectin(-CompoundTherapeutics,Inc.,Waltham,MA)、DARPin、avimer、(AffibodyAG,Sweden)、anticalin(PierisProteolabAG,Freising,Germany)、(γ-晶体蛋白或泛素;ScilProteinsGmbH,Halle,Germany)和蛋白质表位模拟物(PEM;Ltd,Allschwil,Switzerland)。3.2)纤连蛋白分子和adnectin在本发明的一个方面,结合分子是纤连蛋白分子。纤连蛋白分子具有优选基于纤连蛋白III型结构域的支架(例如,纤连蛋白III型的第十模块(10Fn3结构域))。在一个实施方式中,结合分子是adnectin纤连蛋白III型结构域具有7或8个β链,其分布在两个β片层之间,本身相对于彼此包装以形成蛋白质的核心,并进一步含有将β链彼此相连并暴露于溶剂的环(类似于CDR)。在β片层夹心的每个边缘存在至少三个这样的环,其中边缘是蛋白质垂直于β链的方向上的边界(US6,818,418)。这些基于纤连蛋白的支架不是免疫球蛋白,尽管整体折叠与最小功能性抗体片段,重链的可变区密切相关,其包括在骆驼和美洲驼IgG中的整个抗原识别单元。由于这种结构,非免疫球蛋白抗体模拟在本质和亲和力上与抗体相似的抗原结合性质。这些支架可在体外在环随机化和改组策略中使用,其与体内的抗体亲和力成熟过程相类似。这些基于纤连蛋白的分子可以用作支架,其中可以使用标准克隆技术用本发明的CDR取代分子的环区。因此,在一个实施方式中,结合分子是结合(例如特异地结合)IL18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的纤连蛋白的分子。在另一实施方式中,结合分子是结合(例如特异地结合)IL18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的adnectin。3.3)DARPin该技术是基于使用具有锚蛋白来源的重复模块作为支架的蛋白质,所述支架用于承载可用于结合到不同靶标的可变区。所述锚蛋白重复模块是33个氨基酸的多肽,由两个反平行的α螺旋和β转角组成。可变区的结合主要通过使用核糖体展示来优化。因此,在一个实施方式中,结合分子是结合(例如特异地结合)IL18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的锚蛋白/DARPin。3.4)AvimerAvimer源自含天然A-结构域的蛋白质例如LRP-1。这些结构域本质上用于蛋白质-蛋白质相互作用并且在人类中,超过250种蛋白质在结构上基于A结构域。Avimer由通过氨基酸接头连接的许多不同的“A-结构域”单体(2-10)组成。可以使用例如在US20040175756;US20050053973;US20050048512;和US20060008844中所述的技术产生结合靶抗原的Avimer。因此,在一个实施方式中,结合分子是结合(例如特异地结合)IL18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的Avimer。3.5)是由基于蛋白A的IgG结合结构域之一的支架的三螺旋束组成的小的简单蛋白质。蛋白A是来自细菌金黄色葡萄球菌的表面蛋白。此支架结构域由58个氨基酸组成,其中13个是随机化的以生成具有大量配体变体的文库(参见例如,US5,831,012)。分子模拟抗体;它们具有6kDa的分子量,相比之下,抗体的分子量是150kDa。尽管其尺寸小,但是分子的结合位点与抗体相似。因此,在一个实施方式中,结合分子是结合(例如特异地结合)IL18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的affibody。3.6)是由PierisProteoLabAG公司开发的产品。它们衍生自脂质运载蛋白,一组广泛的小而稳健的蛋白质,其通常参与化学敏感或不溶化合物的生理运输或存储。几种天然脂质运载蛋白存在于人体组织或体液中。该蛋白质结构使人联想起免疫球蛋白,在刚性框架顶部具有高变环。然而,与抗体或其重组片段相反,脂质运载蛋白由具有160至180个氨基酸残基的单个多肽链组成,只比单个免疫球蛋白结构域略大。构成结合口袋的四个环的组显示出显著的结构弹性并耐受多种侧链。结合位点因此可在专利的过程中改变形状从而以高亲和力和特异性识别不同的形状的规定的靶化合物。已经通过诱变该四个环的组,将脂质运载蛋白家族的一种蛋白质,大菜粉蝶(PierisBrassicae)的后胆色素结合蛋白(BBP)用于开发抗运载蛋白。描述“抗运载蛋白”的专利申请的一个实例是PCTWO199916873。因此,在一个实施方式中,结合分子是结合(例如特异地结合)IL18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的抗运载蛋白。3.7)分子是针对蛋白质和小分子的特异亲和力所设计的小的非免疫球蛋白蛋白质。新的分子可非常迅速地从两个文库中选择,其中每一个文库都是基于不同的人来源的支架蛋白质。AffilinTM分子不显示对免疫球蛋白蛋白质的任何结构同源性。ScilPoteins采用两种AffilinTM支架,其中一个是γ结晶,人类结构性眼晶状体蛋白质,另一个是“泛素”超家族蛋白质。两种人类支架都非常小,显示出高的温度稳定性和几乎对pH改变和变性剂的抗性。这种高稳定性主要是由于蛋白质的展开的β片层结构。γ结晶衍生的蛋白质的实例描述于WO200104144中而“泛素样”蛋白质的实例描述于WO2004106368中。因此,在一个实施方式中,结合分子是结合(例如特异地结合)IL18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的affilin。3.8)蛋白质表位模拟物蛋白质表位模拟物(PEM)是中等大小的环状、肽样分子(约1-2kDa),其模拟蛋白质的β-发夹二级结构,这种参与蛋白质-蛋白质相互作用的主要二级结构。因此,在一个实施方式中,结合分子是一种结合(例如特异地结合)IL18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的蛋白质表位模拟物。4.编码本发明的结合分子的多核苷酸本发明的另一个方面涉及编码本发明的结合分子的分离的多核苷酸。编码本文所述的分离的人类抗体的重链可变区的多核苷酸示于SEQIDNO:15、19、23、26、29、32、35、38、41、84、88、91、94、113、131、139、146和152。编码本文所述的分离的人类抗体的轻链可变结构域的多核苷酸示于SEQIDNO:17、21、24、27、30、33、36、39、42、86、89、92、95、115、133、141、148和154。编码本发明抗体的其它多核苷酸包括已被突变、但与上述序列还具有至少60%、70、80、90或95%同一性的多核苷酸,例如已经关于在哺乳动物细胞(例如CHO细胞系)中蛋白表达优化的多核苷酸。实施方式89:变体核酸,其中与在上述序列中所描绘的可变区相比,不超过1、2、3、4或5个核苷酸已通过在可变区的核苷酸缺失、插入或取代被改变。实施方式90:编码根据本发明的抗体的重链可变结构域或其片段的分离的多核苷酸,其中所述多核苷酸:a.与SEQIDNO:15或SEQIDNO:19或SEQIDNO:23或SEQIDNO:26或SEQIDNO:29或SEQIDNO:32或SEQIDNO:35或SEQIDNO:38或SEQIDNO:41或SEQIDNO:84或SEQIDNO:88或SEQIDNO:91或SEQIDNO:94或SEQIDNO:113或SEQIDNO:131或SEQIDNO:139或SEQIDNO:146或SEQIDNO:152至少90%相同或b.包括SEQIDNO:15或SEQIDNO:19或SEQIDNO:23或SEQIDNO:26或SEQIDNO:29或SEQIDNO:32或SEQIDNO:35或SEQIDNO:38或SEQIDNO:41或SEQIDNO:84或SEQIDNO:88或SEQIDNO:91或SEQIDNO:94或SEQIDNO:113或SEQIDNO:131或SEQIDNO:139或SEQIDNO:146或SEQIDNO:152或c.基本上由SEQIDNO:15或SEQIDNO:19或SEQIDNO:23或SEQIDNO:26或SEQIDNO:29或SEQIDNO:32或SEQIDNO:35或SEQIDNO:38或SEQIDNO:41或SEQIDNO:84或SEQIDNO:88或SEQIDNO:91或SEQIDNO:94或SEQIDNO:113或SEQIDNO:131或SEQIDNO:139或SEQIDNO:146或SEQIDNO:152组成。实施方式91:编码根据本发明的抗体的轻链可变结构域或其片段的分离的多核苷酸,其中所述多核苷酸:a.与SEQIDNO:17或SEQIDNO:21或SEQIDNO:24或SEQIDNO:27或SEQIDNO:30或SEQIDNO:33或SEQIDNO:36或SEQIDNO:39或SEQIDNO:42或SEQIDNO:86或SEQIDNO:89或SEQIDNO:92或SEQIDNO:95或SEQIDNO:115或SEQIDNO:133或SEQIDNO:141或SEQIDNO:148或SEQIDNO:154至少90%相同或b.包括SEQIDNO:17或SEQIDNO:21或SEQIDNO:24或SEQIDNO:27或SEQIDNO:30或SEQIDNO:33或SEQIDNO:36或SEQIDNO:39或SEQIDNO:42或SEQIDNO:86或SEQIDNO:89或SEQIDNO:92或SEQIDNO:95或SEQIDNO:115或SEQIDNO:133或SEQIDNO:141或SEQIDNO:148或SEQIDNO:154或c.基本上由SEQIDNO:17或SEQIDNO:21或SEQIDNO:24或SEQIDNO:27或SEQIDNO:30或SEQIDNO:33或SEQIDNO:36或SEQIDNO:39或SEQIDNO:42或SEQIDNO:86或SEQIDNO:89或SEQIDNO:92或SEQIDNO:95或SEQIDNO:115或SEQIDNO:133或SEQIDNO:141或SEQIDNO:148或SEQIDNO:154组成。实施方式92:编码根据本发明的抗体的重链的分离的多核苷酸,其中所述多核苷酸:a.与SEQIDNO:44或SEQIDNO:48或SEQIDNO:51或SEQIDNO:54或SEQIDNO:57或SEQIDNO:101或SEQIDNO:159或SEQIDNO:97或SEQIDNO:104或SEQIDNO:117或SEQIDNO:143或SEQIDNO:135或SEQIDNO:149或SEQIDNO:155至少90%相同;或b.包括SEQIDNO:44或SEQIDNO:48或SEQIDNO:51或SEQIDNO:54或SEQIDNO:57或SEQIDNO:101或SEQIDNO:159或SEQIDNO:97或SEQIDNO:104或SEQIDNO:117或SEQIDNO:143或SEQIDNO:135或SEQIDNO:149或SEQIDNO:155;或c.基本上由SEQIDNO:44或SEQIDNO:48或SEQIDNO:51或SEQIDNO:54或SEQIDNO:57或SEQIDNO:101或SEQIDNO:159或SEQIDNO:97或SEQIDNO:104或SEQIDNO:117或SEQIDNO:143或SEQIDNO:135或SEQIDNO:149或SEQIDNO:155组成。实施方式93:编码根据本发明的抗体的轻链的分离的多核苷酸,其中所述多核苷酸:a.与SEQIDNO:46或SEQIDNO:49或SEQIDNO:52或SEQIDNO:55或SEQIDNO:58或SEQIDNO:102或SEQIDNO:161或SEQIDNO:99或SEQIDNO:105或SEQIDNO:119或SEQIDNO:145或SEQIDNO:137或SEQIDNO:151或SEQIDNO:157至少90%相同;或b.包括SEQIDNO:46或SEQIDNO:49或SEQIDNO:52或SEQIDNO:55或SEQIDNO:58或SEQIDNO:102或SEQIDNO:161或SEQIDNO:99或SEQIDNO:105或SEQIDNO:119或SEQIDNO:145或SEQIDNO:137或SEQIDNO:151或SEQIDNO:157;或c.基本上由SEQIDNO:46或SEQIDNO:49或SEQIDNO:52或SEQIDNO:55或SEQIDNO:58或SEQIDNO:102或SEQIDNO:161或SEQIDNO:99或SEQIDNO:105或SEQIDNO:119或SEQIDNO:145或SEQIDNO:137或SEQIDNO:151或SEQIDNO:157组成。多核苷酸可以存在于完整细胞中,在细胞裂解物中,或可以是部分纯化或者基本上纯的形式。当通过标准技术,包括碱/SDS处理、CsCl显带、柱层析、琼脂糖凝胶电泳和其它本领域熟知的技术从其它细胞成分或其它污染物,例如其它细胞核酸或蛋白质,纯化出多核苷酸时,所述多核苷酸是“分离的”或“造成基本上纯的”。参见,F.Ausubel,等人,(1987)CurrentProtocolsinMolecularBiology,GreenePublishingandWileyInterscience,NewYork。本发明的多核苷酸可以是,例如,DNA或RNA,并且可以含有或不含有内含子序列。在一个实施方式中,多核苷酸是cDNA分子。多核苷酸可以存在于载体例如噬菌体展示载体,或者重组质粒载体中。本发明的多核苷酸可以使用标准分子生物学技术获得。对于从杂交瘤(例如,如下面进一步描述的,从携带人免疫球蛋白基因的转基因小鼠制备的杂交瘤)表达的抗体,编码由杂交瘤制备的抗体的轻链和重链的cDNA可以通过标准PCR扩增或cDNA克隆技术获得。对于从免疫球蛋白基因文库获得的抗体(例如,使用噬菌体展示技术),编码抗体的多核苷酸可以从属于文库成员的多种噬菌体克隆回收。一旦获得编码VH和VL区段的DNA片段,这些DNA片段可以进一步通过标准重组DNA技术操纵,例如,以将可变区基因转化为全长抗体链基因、Fab片段基因或scFv基因。在这些操作中,VL或VH编码DNA片段有效连接到另一DNA分子,或者连接到编码另一蛋白质的片段,如抗体恒定区或柔性接头。如在此上下文中使用时,术语“有效连接”旨在意指两个DNA片段以功能性方式连接在一起,例如,使得由两个DNA片段编码的氨基酸序列仍然符合读框,或使得该蛋白质在所希望的启动子控制下表达。通过将编码VH的DNA有效连接至编码重链恒定区(CH1、CH2和CH3)的另一DNA分子,编码VH区的分离的DNA可以转换为全长重链基因。人重链恒定区基因的序列是本领域已知的(参见例如,Kabat,E.A.,等人,(1991)SequencesofProteinsofImmunologicalInterest,第五版,U.S.DepartmentofHealthandHumanServices,NIH出版号91-3242),并且包含这些区域的DNA片段可通过标准PCR扩增获得。重链恒定区可以是IgGl、IgG2、IgG3、IgG4、IgA、IgE、IgM或IgD恒定区。在一些实施方式中,重链恒定区选自IgGl同种型。对于Fab片段重链基因,编码VH的DNA有效连接至仅编码重链CHl恒定区的另一DNA分子。通过将编码VL的DNA有效连接至编码轻链恒定区CL的另一DNA分子,编码VL区的分离DNA可转换为全长轻链基因(以及Fab轻链基因)。人轻链恒定区基因的序列是本领域已知的(参见例如Kabat,E.A.,等人,(1991)SequencesofProteinsofImmunologicalInterest,第五版,U.S.DepartmentofHealthandHumanServices,NIH出版号91-3242),并且包含这些区域的DNA片段可通过标准PCR扩增获得。轻链恒定区可以是κ或λ恒定区。为了创建scFv基因,将编码VH和VL的DNA片段有效连接到另一编码柔性接头例如编码氨基酸序列(Gly4-Ser)3的片段,从而使得VH和VL序列可以表达为连续的单链蛋白,由柔性接头连接VL和VH区(参见例如,Bird等人,1988Science242:423-426;Huston等人,(1988)Proc.Natl.Acad.Sci.USA85:5879-5883;McCafferty等人,(1990)Nature348:552-554)。根据实施方式89至93中任一项的多核苷酸可以以这样的方式体外修饰,即当注射到哺乳动物细胞中时,它防止多核苷酸消化,并允许哺乳动物细胞的翻译机制从被修饰的多核苷酸开始生产抗体(如在Kariko等人的美国专利号8,278,036B2所述)。这种体外合成的修饰的RNA随后可以注射到哺乳动物细胞或进入患者作为基因疗法的一部分。因此,本发明的另一个方面包括诱导哺乳动物细胞产生如本文所述的抗体的方法,该方法包括:使所述哺乳动物细胞与源自根据实施方式89-93中任一项的多核苷酸的体外合成的修饰的RNA接触,其中所述体外合成的修饰的RNA包括如在美国专利号8,278,036B2中描述的一种或多种修饰。5.抗体的生产可以通过多种技术产生单克隆抗体(mAb),所述技术包括常规的单克隆抗体方法,例如,Kohler和Milstein,(1975)Nature256:495的标准体细胞杂交技术。可以使用多种用于产生单克隆抗体的技术,例如,B淋巴细胞的病毒或癌基因转化。免疫方案和分离用于融合的经免疫的脾细胞的技术为本领域所公知。融合配偶体(例如,鼠骨髓瘤细胞)和融合方法同样是众所周知的。本发明的嵌合或人源化的单克隆抗体可以基于如上所述制备的鼠单克隆抗体的序列来制备。用标准的分子生物学技术,编码免疫球蛋白的重和轻链的DNA可以从目标鼠杂交瘤获得,并改造成含有非鼠(例如,人)免疫球蛋白序列。例如,为了产生嵌合抗体,可使用本领域已知的方法将鼠可变区连接到人恒定区(参见例如,Cabilly等人的美国专利4,816,567)。为了创建人源化抗体,可以使用本领域已知的方法将鼠CDR区插入到人框架中。参见例如,Winter的美国专利号5225539,和Queen等人的美国专利号5530101;5585089;5693762和6180370。人单克隆抗体可以用携带部分人免疫系统而不是小鼠系统的转基因或转染色体小鼠来产生。这些转基因和转染色体小鼠包括分别在本文中被称为HuMAb小鼠和KM小鼠的小鼠,它们在本文中统称为“人Ig小鼠”。HuMAb(Medarex公司)含有人免疫球蛋白基因微座位,其编码未重排的人重链(μ和γ)和κ轻链免疫球蛋白序列,以及使内源性μ和κ链座位失活的靶向突变(参见例如,Lonberg等人(1994)Nature;368(6474):856-859)。因此,小鼠展现出降低的小鼠IgM或κ的表达,并且响应于免疫,导入的人重链和轻链转基因经历类别转换和体细胞突变以产生高亲和性人类IgGκ单克隆(Lonberg,N等人(1994),上文;在Lonberg,N(1994)HandbookofExperimentalPharmacology113:49-101;Lonberg,N和Huszar,D(1995)InternRevImmunol;13:65-93和Harding,F和Lonberg,N(1995)AnnNYAcadSci;764:536-546中综述)。制备和使用HuMAb小鼠,以及由这种小鼠携带的基因组修饰进一步描述于:Taylor,L等人;(1992)NuclAcidsRes;20:6287-6295;Chen,J等人(1993)IntImmunol;5:647-656;Tuaillon等人(1993)ProcNatlAcadSciUSA;94:3720-3724;Choi等人(1993)NatureGen;4:117-123;Chen,J等人(1993)EMBOJ;12:821-830;Tuaillon等人(1994)JImmunol;152:2912-2920;Taylor,L等人(1994)IntImmuno;6:579-591;和Fishwild,D等人(1996)NatureBiotech;14:845-851,所有这些文献的内容在此特别通过引用整体并入本文。进一步参见均为Lonberg和Kay的美国专利号5,545,806;5,569,825;5,625,126;5,633,425;5,789,650;5,877,397;5,661,016;5,814,318;5,874,299;和5,770,429;Surani等人的美国专利号5,545,807。均为Lonberg和Kay的WO99/45962;PCT公开号WO92103918、WO93/12227、WO94/25585、WO97113852、WO98/24884;和Korman等人的PCT公开号WO01/14424。在一个实施方式中,根据本发明的人类抗体可以通过使用在转基因和转染色体中携带人免疫球蛋白序列的小鼠来产生,例如携带人重链转基因和人轻链转染色体的小鼠。这样的小鼠,在本文中被称为“KM小鼠”,在Ishida等人的PCT公开WO02/43478中详细描述。更进一步地,表达人免疫球蛋白基因的备选的转基因动物体系是本领域中可获得的并且能够用来产生本发明的抗体。例如,可以使用称为Xenomouse(Abgenix公司)的备选的转基因体系。此类小鼠描述于,例如,Kucherlapati等人的美国专利号5,939,598;6,075,181;6,114,598;6,150,584和6,162,963。此外,表达人免疫球蛋白基因的备选的转染色体动物体系在本领域中是可获得的并且可用于产生本发明的抗体。例如,可以使用携带人重链转染色体和人轻链染色体的小鼠,称作“TC小鼠”;此类小鼠描述于Tomizuka等人,2000Proc.Natl.Acad.Sci.USA97:722-727。此外,已在本领域中描述了携带人重链和轻链转染色体的牛(Kuroiwa等人,2002NatureBiotech20:889-894)。本发明的人类重组抗体也可以使用筛选人免疫球蛋白基因文库的噬菌体展示方法来制备。用于分离人类抗体的此类噬菌体展示方法已在现有技术中建立或在下面实例中说明。参见例如:Ladner等人的美国专利号5,223,409;5,403,484;和5,571,698;Dower等人的美国专利号5,427,908和5,580,717;McCafferty等人的美国专利号5,969,108和6,172,197;和Griffiths等人的美国专利号5,885,793;6,521,404;6,544,731;6,555,313;6,582,915和6,593,081。本发明的人单克隆抗体也可以用其中已重构了人类免疫细胞使得可以在免疫时产生人类抗体应答的SCID小鼠来制备。此类小鼠描述于,例如,Wilson等人的美国专利号5,476,996和5,698,767。本发明的抗体还可以使用例如,如本领域公知的重组DNA技术和基因转染方法的组合在宿主细胞中生产(例如,Morrison,S.(1985)Science229:1202)。例如,为了表达抗体或其抗体片段,编码部分或全长轻链和重链的DNA可以通过标准分子生物学技术(例如,PCR扩增或使用表达目标抗体的杂交瘤的cDNA克隆)获得并且DNA可插入到克隆或表达载体中,使得基因有效连接至转录和翻译控制序列。在这样的背景下,术语“有效连接”旨在意指抗体基因连接到载体中使得载体中的转录和翻译控制序列发挥它们调控抗体基因的转录和翻译的预期功能。克隆或表达载体和表达控制序列被选择为与所使用的表达宿主细胞相容。抗体轻链基因和抗体重链基因可以插入到单独的载体中,或者更典型地,两个基因插入相同的表达载体中。抗体基因通过标准方法(例如,在抗体基因片段和载体上连接互补限制性位点,或如果不存在限制位点时进行平末端连接)插入到表达载体中。本文中所描述的抗体的轻链和重链可变区可以通过将它们插入已经编码所需同种型的重链恒定和轻链恒定区的表达载体中,用于创建任何抗体同种型的全长抗体基因,使得VH区段有效连接到载体中的(一个或多个)CH区段以及VL区段有效连接至载体中的CL区段。附加地或备选地,重组表达载体可以编码促进抗体链从宿主细胞分泌的信号肽。抗体链基因可被克隆到载体中使得该信号肽符合读框地连接到抗体链基因的氨基末端。信号肽可以是免疫球蛋白信号肽或异源信号肽(即,来自非免疫球蛋白蛋白质的信号肽)。在一个方面,本发明提供了包括根据本发明的一种或多种多核苷酸的克隆或表达载体。实施方式94:包括选自下述的至少一种多核苷酸的克隆或表达载体:SEQIDNO:44或SEQIDNO:48或SEQIDNO:51或SEQIDNO:54或SEQIDNO:57或SEQIDNO:101或SEQIDNO:159或SEQIDNO:97或SEQIDNO:104或SEQIDNO:117或SEQIDNO:143或SEQIDNO:135或SEQIDNO:149或SEQIDNO:155或SEQIDNO:46或SEQIDNO:49或SEQIDNO:52或SEQIDNO:55或SEQIDNO:58或SEQIDNO:102或SEQIDNO:161或SEQIDNO:99或SEQIDNO:105或SEQIDNO:119或SEQIDNO:145或SEQIDNO:137或SEQIDNO:151或SEQIDNO:157。除了编码抗体链的多核苷酸以外,本发明的克隆或表达载体还携带控制在宿主细胞中抗体链基因表达的调控序列。术语“调控序列”旨在包括启动子、增强子和其他控制抗体链基因转录或翻译的表达控制元件(例如,多腺苷酸化信号)。此类调控序列描述于例如Goeddel(GeneExpressionTechnology.MethodsinEnzymology185,AcademicPress,SanDiego,CA1990)。本领域技术人员应理解,表达载体的设计,包括调控序列的选择,可以依赖于以下因素,如待转化的宿主细胞的选择,所需蛋白质的表达的水平等。用于哺乳动物宿主细胞表达的调控序列包括指导在哺乳动物细胞中高水平的蛋白质表达的病毒元件,如来自巨细胞病毒(CMV)、猿猴病毒40(SV40)、腺病毒(例如,腺病毒主要晚期启动子(AdMLP启动))和多瘤的启动子和/或增强子。或者,可使用非病毒调控序列,如泛素启动子或P-球蛋白启动子。更进一步地,由不同来源的序列组成的调控元件,如SRa启动子系统,其含有来自SV40早期启动子和1型人T细胞白血病病毒的长末端重复的序列(Takebe,Y.等人,1988Mol.Cell.Biol.8:466-472)。此外,本发明的克隆或表达载体可携带额外的序列,例如调控载体在宿主细胞中的复制的序列(例如,复制起点)和选择标记物基因。选择标记物基因便于选择已经导入了载体的宿主细胞(参见,例如,均为Axel等人的美国专利号4,399,216、4,634,665和5,179,017)。例如,通常选择标记物基因对已经导入了载体的宿主细胞赋予对药物例如G418、潮霉素或氨甲喋呤的抗性。选择标记物基因包括二氢叶酸还原酶(DHFR)基因(以甲氨蝶呤选择/扩增用于dhfr-宿主细胞)和neo基因(用于G418选择)。对于轻链和重链的表达,通过标准技术将编码重链和轻链的(一个或多个)表达载体转染到宿主细胞中。多种形式的术语“转染”旨在包括常用于将外源DNA导入原核或真核宿主细胞的多种技术,例如电穿孔、磷酸钙沉淀、DEAE-葡聚糖转染等。在原核或真核宿主细胞中表达本发明的抗体在理论上是可能的。讨论在真核细胞例如哺乳动物宿主细胞、酵母或丝状真菌中的抗体表达是因为这样的真核细胞,尤其是哺乳动物细胞,比原核细胞更可能组装和分泌正确折叠且有免疫学活性的抗体。报道了抗体基因的原核表达对生产高产量的活性抗体是无效的(Boss,M.A.和Wood,C.R.,1985ImmunologyToday6:12-13)。适用于克隆或表达编码本发明抗体的载体的宿主细胞是原核、酵母或高等真核细胞。合适的原核细胞包括真细菌如肠杆菌科如埃希氏菌属例如大肠杆菌(例如ATCC31,446;31,537;27,325)、肠杆菌属、欧文氏菌属、克雷伯氏变形杆菌、沙门氏菌属如鼠伤寒沙门氏菌、沙雷氏菌属如粘质沙雷氏菌和志贺氏菌属、以及杆菌属如枯草芽孢杆菌和地衣芽孢杆菌(参见DD266710)、假单胞菌属如铜绿假单胞菌和链霉菌属。对于酵母或真菌宿主细胞,也可以考虑酿酒酵母、粟酒裂殖酵母、克鲁维酵母属(例如ATCC16,045;12,424;24,178;56,500)、耶氏酵母属(EP402,226)、巴斯德毕赤酵母(EP183070,也参见Peng等人(2004)JBiotechnol;108:185-192)、假丝酵母属、里氏木霉(EP244234)、青霉属、弯颈霉属和曲霉属宿主如构巢曲霉和黑曲霉。虽然本发明特别考虑了原核和酵母宿主细胞,但优选本发明的宿主细胞是高等真核细胞。因此,在一个方面,本发明提供了宿主细胞,其包括含有如本文所述的多核苷酸的一种或多种克隆或表达载体。在另一个方面,本发明提供稳定地转化或转染的宿主细胞,其包括如本文所述的一种或多种多核苷酸。实施方式95:稳定转化的宿主细胞,其包括编码根据实施方式1至88中任一项的分离的抗体或其片段的重链和/或轻链的载体。优选地,这种宿主细胞包括编码轻链的第一载体和编码所述重链的第二载体。合适的高等真核宿主细胞包括哺乳动物细胞例如COS-1(ATCC编号CRL1650)COS-7(ATCCCRL1651),人胚胎肾系293,幼仓鼠肾细胞(BHK)(ATCCCRL.1632),BHK570(ATCC编号:CRL10314),293(ATCCNO.CRL1573),中国仓鼠卵巢细胞CHO(例如CHO-K1,ATCC编号:CCL61,DHFR-CHO细胞系例如DG44(参见Urlaub等人,(1986)SomaticCellMol.Genet.12,555-556)),特别是适合于悬浮培养的那些CHO细胞系,小鼠睾丸支持细胞、猴肾细胞、非洲绿猴肾细胞(ATCCCRL-1587)、HELA细胞、犬肾细胞(ATCCCCL34)、人肺细胞(ATCCCCL75)、HepG2和骨髓瘤或淋巴瘤细胞例如NSO(参见US5807715)、SP2/0、YO。优选地,用于表达本发明的结合分子的哺乳动物宿主细胞包括对于FUT8基因表达缺陷的哺乳动物细胞系,例如在US6946292中所述。转化有编码结合分子的载体的宿主细胞可以通过本领域技术人员公知的任何方法来培养。宿主细胞可以在旋转烧瓶、滚瓶或中空纤维系统中培养,但大规模生产时优选将搅拌罐反应器特别用于悬浮培养物。优选地搅拌罐适于使用例如曝气器、挡板或低剪切叶轮曝气。对于鼓泡塔和气升式反应器,可使用采用空气或氧气泡的直接曝气。当宿主细胞在无血清培养基中培养时,优选地所述培养基补充有细胞保护剂如普朗尼克F-68以帮助防止细胞因曝气过程而损伤。取决于宿主细胞特征,可将微载体用作锚定依赖性的细胞系的生长底物或者细胞可以适合于悬浮培养(这是典型的)。宿主细胞特别是无脊椎动物宿主细胞的培养可以利用多种操作模式,例如补料分批、重复的分批处理(参见Drapeau等人(1994)cytotechnology15:103-109)、延长的分批处理或灌注培养。虽然重组转化的哺乳动物宿主细胞可以在含血清的培养基,如胎牛血清(FCS)中培养,优选的是,这样的宿主细胞在合成的无血清培养基,例如公开于Keen等人(1995)Cytotechnology17:153-163,或可商购的培养基如ProCHO-CDM或UltraCHO(TM)(CambrexNJ,USA)中培养,在必要时补充能量源如葡萄糖和合成的生长因子如重组胰岛素。宿主细胞的无血清培养可能要求那些细胞适合于在无血清条件下生长。一种适应方法是,在含有血清的培养基中培养这种宿主细胞,并反复交换80%的培养基为无血清培养基,以使宿主细胞学会适应无血清条件(参见ScharfenbergK等人(1995)于AnimalCelltechnology:Developmentstowardsthe21stcentury(BeuveryE.G.等人编辑),第619-623页,KluwerAcademic出版社)。可以利用多种技术回收并纯化分泌到培养基中的本发明的结合分子,以提供适于预期用途的纯化程度。例如本发明的分离的抗体用于治疗人类患者的用途通常要求至少95%纯度,更通常98%或99%或更高的纯度(相对于粗糙培养基)。在第一个实例中,使用离心随后用微滤、超滤和/或深度过滤进行上清液的澄清步骤除去来自培养基的细胞碎片。多种其他技术如透析和凝胶电泳和层析技术,如羟基磷灰石(HA),亲和层析(任选地涉及亲和标签系统,如多组氨酸)和/或疏水相互作用层析(HIC,参见US5429746)是可用的。在一个实施方式中,在多个澄清步骤后,使用蛋白A或G亲和层析捕获本发明的抗体接着进行进一步的层析步骤,例如离子交换和/或HA层析,阴离子或阳离子交换,尺寸排阻层析和硫酸铵沉淀。通常,也使用多种病毒清除步骤(例如,使用DV-20过滤器的纳米过滤)。这些多种步骤后,提供包括至少75mg/ml或更大(例如100mg/ml或更大)的本发明的分离的抗体或其抗原结合片段的纯化的(优选单克隆)制剂,并因此形成了本发明的实施方式。合适地这种制剂基本上不含聚集形式的本发明的抗体。细菌系统可用于表达上述的非免疫球蛋白结合分子。细菌系统也特别适合于分离的抗体片段的表达。这样的片段在细胞内或在周质内定位。可以根据本领域技术人员公知的方法提取不溶性周质蛋白质并重折叠以形成活性蛋白质,参见Sanchez等人(1999)J.Biotechnol.72,13-20和CupitPM等人(1999)LettApplMicrobiol,29,273-277。因此,在一个方面,本发明提供生产结合分子的方法,其结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,其中该方法包括在适合于生产结合分子的培养条件下培养宿主细胞,其中所述宿主细胞包括如本文所述的载体。实施方式95:生产根据实施方式1至88中任一项的人类抗体或其片段的方法,其中所述方法包括在适于生产结合分子的条件下培养宿主细胞,其中所述宿主细胞包括本文所述的载体。6.药物组合物本发明提供了包括结合分子和可药用的运载体的药物组合物,其中结合分子结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,且其中所述结合分子不是IL-18BP。实施方式96:包括根据实施方式1至88中任一项的人类抗体或其片段和可药用的运载体的药物组合物。该组合物可以另外含有其它适用于治疗或预防下面指出的人类疾病或病症的治疗剂。药学运载体增强或稳定该组合物,或便于组合物的制备。可药用的运载体包括生理上相容的溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗和吸收延迟剂等。本发明的药物组合物可通过多种本领域已知的方法给药。给药的途径和/或方式取决于所期望的结果而有所不同。优选给药是静脉内、肌肉内、腹膜内或皮下,或给予到目标部位临近。可药用的运载体应适合用于静脉内、肌内、皮下、肠胃外、脊柱或表皮给药(例如,通过注射或灌注)。根据给药的途径,活性化合物(特别是低分子量的化学实体)可以包覆在材料中以保护该化合物免受可能灭活该化合物的酸和其它自然条件的作用。该组合物应该是无菌的并且是流体。例如,可以通过使用包衣如卵磷脂,在分散体的情况下通过维持所需的颗粒大小以及通过使用表面活性剂来保持适当的流动性。在许多情况下,优选在组合物中包括等渗剂,例如糖、多元醇如甘露醇或山梨糖醇、和氯化钠。可注射组合物的长期吸收可通过在组合物中包括延迟吸收的活性剂如,单硬脂酸铝或明胶来实现。本发明的药物组合物可以按照本领域公知方法和常规实践的来制备。参见,例如,Remington:TheScienceandPracticeofPharmacy,MackPublishingCo.,第20版,2000;和SustainedandControlledReleaseDrugDeliverySystems,J.R.Robinson,编辑,MarcelDekker,Inc.,NewYork,1978。药物组合物优选在GMP条件下生产。通常,治疗有效剂量或有效力剂量的本文描述的本发明抗体用在本发明的药物组合物中。它们通常通过本领域技术人员已知的常规方法配制为可药用的剂型。调节剂量方案以提供最佳的期望反应(例如,治疗反应)。例如,可以给予单次团剂,在一段时间内可以给予若干分开的剂量或剂量可以随着治疗情况的紧急程度所示按比例减少或增加。特别有利的是配制成剂量单位形式的肠胃外组合物以易于给药和剂量均匀性。本文使用的剂量单位形式是指适合作为单一剂量用于待治疗的对象的物理上分离的单位;每个单位含有经计算以与所需的药物运载体组合产生期望的治疗效果的预定量的活性化合物。本发明的药物组合物中的活性成分的实际剂量水平可以变化,以便获得可对于实现对特定患者、组合物和给药模式的理想治疗反应有效的而不是对患者有毒的活性成分的量。所选的剂量水平取决于多种药物代谢动力学因素,包括所采用的本发明的特定组合物或其酯、盐或酰胺的活性,给药途径,给药时间,所采用的化合物的特定排泄速率,治疗的持续时间,与所采用的特定组合物组合使用的其他药物、化合物和/或材料,被治疗患者的年龄、性别、体重、状况、一般健康和之前的医疗史以及其他因素。医师可在低于实现所需治疗效果的水平开始在药物组合物中使用的本发明抗体的剂量,并逐步增加剂量直至实现期望的效果。在一般情况下,用于治疗本文所述的纤维化疾病或病症的本发明组合物的有效剂量根据许多不同的因素变化,包括给药手段、靶位点、患者的生理状态、患者是人或动物、给予的其它药物、和治疗是预防性的还是治疗性的。治疗剂量需要被滴定,以优化安全性和效力。对于抗体给药,剂量在约0.0001至100mg/kg,更通常为0.01至5mg/kg宿主体重的范围。例如,剂量可以是1mg/kg体重或10mg/kg体重或在1-10mg/kg的范围之内。示例性治疗方案需要每两周给药一次或每月一次或每3至6个月给药一次。本发明的结合分子,尤其是抗体和其片段,通常是多次施用。单剂量之间的间隔可以是每周、每月或每年。间隔也可以是不规则的,如通过测量患者中治疗性蛋白质的血液水平所指示。在一些方法中,调整剂量以达到1-1000μg/ml的血浆抗体浓度以及在一些方法中25-300μg/ml。或者,本发明的抗体可以作为持续释放的制剂施用,在这种情况下,需要较不频繁的给药。剂量和频率根据抗体在患者中的半寿期变化。通常,人源化抗体显示出比嵌合抗体和非人类抗体更长的半寿期。剂量和给药频率可以根据治疗是预防性的还是治疗性的而改变。在预防性的(预防性)应用中,在长时间段以相对不频繁的间隔给予相对低的剂量。有些患者在余生持续接受治疗。在治疗性应用中,有时需要相对短的时间间隔的相对高的剂量,直到疾病的进展减轻或停止,优选直至患者显示出疾病症状的部分或完全改善。此后,可以对患者给予预防性方案。药物组合物可包括(例如作为其唯一的治疗活性成分)结合分子,其结合(例如特异地结合)IL18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,其中所述结合分子不是IL-18BP,其中所述结合分子选自:分离的抗体、分离的抗体的片段、单可变结构域抗体、双特异性或多特异性抗体、多价抗体、双重可变结构域抗体、免疫缀合物、纤连蛋白分子、adnectin、DARPin、avimer、affibody、抗运载蛋白、affilin、蛋白质表位模拟物或它们的组合,并且其中所述组合物可以进一步包括可药用的运载体。通常,组合物将是静脉内、吸入或皮下给药的形式。在其他实施方式中,组合物可以是冻干形式。优选地,结合分子是如本文所述的抗体,优选单克隆完整抗体(例如人、人源化或嵌合的)或其片段。实施方式97:药物组合物包括(例如,作为其唯一的治疗活性成分)抗体或其片段,所述抗体或其片段结合IL18(例如特异性结合)且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,其中所述抗体包括:(a)SEQIDNO:3的CDRH1;(b)SEQIDNO:9的CDRH2;(c)SEQIDNO:5的CDRH3;(d)SEQIDNO:6的CDRL1;(e)SEQIDNO:7的CDRL2和(f)SEQIDNO:8的CDRL3。实施方式98:根据实施方式97的药物组合物,其中所述抗体与鼠抗体125-2H竞争结合IL-18。实施方式99:药物组合物包括(例如,作为其唯一的治疗活性成分)抗体或其片段,所述抗体或其片段结合IL18(例如特异性结合)且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,其中所述抗体包括;(a)SEQIDNO:3的CDRH1;(b)SEQIDNO:10的CDRH2;(c)SEQIDNO:5的CDRH3;(d)SEQIDNO:6的CDRL1;(e)SEQIDNO:7的CDRL2和(f)SEQIDNO:8的CDRL3。实施方式100:药物组合物包括(例如,作为其唯一的治疗活性成分)抗体或其片段,所述抗体或其片段结合IL18(例如特异性结合)且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,其中所述抗体包括;(a)SEQIDNO:3的CDRH1;(b)SEQIDNO:13的CDRH2;(c)SEQIDNO:5的CDRH3;(d)SEQIDNO:6的CDRL1;(e)SEQIDNO:7的CDRL2和(f)SEQIDNO:8的CDRL3。实施方式101:根据实施方式100的药物组合物,其中所述抗体与鼠抗体125-2H竞争结合IL-18。实施方式102:药物组合物包括(例如,作为其唯一的治疗活性成分)抗体或其片段,所述抗体或其片段结合IL18(例如特异性结合)且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,其中所述抗体包括;(a)SEQIDNO:106的CDRH1;(b)SEQIDNO:107的CDRH2;(c)SEQIDNO:108的CDRH3;(d)SEQIDNO:109的CDRL1;(e)SEQIDNO:110的CDRL2和(f)SEQIDNO:111的CDRL3。实施方式103:药物组合物包括(例如,作为其唯一的治疗活性成分)抗体或其片段,所述抗体或其片段结合IL18(例如特异性结合)且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,其中所述抗体包括;a.SEQIDNO:14的重链可变结构域和SEQIDNO:16的轻链可变结构域或b.SEQIDNO:25的重链可变结构域和SEQIDNO:16的轻链可变结构域或c.SEQIDNO:28的重链可变结构域和SEQIDNO:16的轻链可变结构域或d.SEQIDNO:18的重链可变结构域和SEQIDNO:20的轻链可变结构域或e.SEQIDNO:37的重链可变结构域和SEQIDNO:20的轻链可变结构域或f.SEQIDNO:40的重链可变结构域和SEQIDNO:20的轻链可变结构域或g.SEQIDNO:112的重链可变结构域和SEQIDNO:114的轻链可变结构域。实施方式104:根据实施方式103的药物组合物,其中所述抗体包括SEQIDNO:14的重链可变结构域和SEQIDNO:16的轻链可变结构域或SEQIDNO:18的重链可变结构域和SEQIDNO:20的轻链可变结构域。实施方式105:根据实施方式104的药物组合物,其中所述抗体与鼠抗体125-2H竞争结合IL-18。实施方式106:药物组合物包括(例如,作为其唯一的治疗活性成分)抗体或其片段,所述抗体或其片段结合IL18(例如特异性结合)且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,其中所述抗体包括:a.能够由与编码SEQIDNO:14或18或25或28或37或40或112的分离的多核苷酸具有至少90%同一性(例如,95%或更高,如96%、97%、98%或99%)的分离的多核苷酸编码的重链可变结构域,和b.能够由与编码SEQIDNO:16或20或114的分离的多核苷酸具有至少90%同一性(例如,95%或更高,如96%、97%、98%或99%)的分离的多核苷酸编码的轻链可变结构域。实施方式107:药物组合物包括(例如,作为其唯一的治疗活性成分)抗体或其片段,所述抗体或其片段结合IL18(例如特异性结合)且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,其中所述抗体包括:a.SEQIDNO:43的重链和SEQIDNO:45的轻链可变结构域或b.SEQIDNO:47的重链和SEQIDNO:45的轻链可变结构域或c.SEQIDNO:50的重链和SEQIDNO:45的轻链可变结构域或d.SEQIDNO:53的重链可变结构域和SEQIDNO:160的轻链可变结构域或e.SEQIDNO:100的重链可变结构域和SEQIDNO:160的轻链可变结构域或f.SEQIDNO:158的重链可变结构域和SEQIDNO:160的轻链可变结构域或g.SEQIDNO:116的重链可变结构域和SEQIDNO:118的轻链可变结构域。实施方式108:根据实施方式107的药物组合物,其中所述抗体包括SEQIDNO:43的重链和SEQIDNO:45的轻链可变结构域或SEQIDNO:158的重链可变结构域和SEQIDNO:160的轻链可变结构域。实施方式109:根据实施方式108的药物组合物,其中所述抗体与鼠抗体125-2H竞争结合IL-18。实施方式110:药物组合物包括(例如,作为其唯一的治疗活性成分)抗体或其片段,其结合IL18(例如特异性结合)且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,其中所述抗体包括:a.能够由与编码SEQIDNO:43或47或50或53或100或116或158的的分离的多核苷酸具有至少90%的同一性(例如,95%或更高,如96%、97%、98%或99%)的分离的多核苷酸编码的重链,和b.能够由与编码SEQIDNO:45或160或118的分离的多核苷酸具有至少90%的同一性(例如,95%或更高,如96%、97%、98%或99%)的分离的多核苷酸编码的轻链。7.临床用途已证明了在若干自身免疫、心血管和炎性疾病中,IL-18的表达被上调。因此,本发明的结合分子可以用于治疗,所述结合分子结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且其中所述结合分子不是IL-18BP。实施方式110:根据实施方式1至88中任一项的抗体,其用于治疗。在本发明的一个方面,提供了治疗和/或预防自身免疫疾病,包括类风湿性关节炎(RA),系统性发作幼年关节炎(SOJA),系统性幼年特发性关节炎(SJIA),强直性脊柱炎,自身免疫性内耳疾病(AIED),自身免疫性淋巴增生综合征(ALPS),白塞氏病,伯杰氏病(IgA肾病),大疱性类天疱疮,查格-施特劳斯综合征,结肠炎,克罗恩病(CD),1型糖尿病,2型糖尿病,干燥综合征(SS),移植物抗宿主病(GVHD),肾小球肾炎,狼疮,多发性硬化症(MS),牛皮癣,风湿热,肉状瘤病,硬皮病,成人发作斯蒂尔病(AOSD),系统性红斑狼疮(SLE),溃疡性结肠炎,噬血细胞淋巴组织细胞增生(HLH,又称噬血细胞综合征,巨噬细胞活化综合征),家族性噬血细胞性淋巴组织细胞增生症(FHL)和其他免疫缺陷综合征,巨细胞动脉炎(GCA),冠状动脉疾病(CAD),冠脉血管病变(CV),急性冠脉综合征(ACS),充血性心力衰竭(CHF),动脉粥样硬化,动脉硬化,心肌梗死(MI),心肾综合症(CRS),急性肾损伤(AKI),糖尿病性肾病,胰岛素抵抗,肥胖和代谢综合征(MetS),肺部疾病,包括肺肉状瘤病,特别是肺肉状瘤病肺纤维化,哮喘,尤其是重度哮喘,葡萄膜炎,地图样萎缩慢性阻塞性肺病(COPD),囊性纤维化,成人呼吸窘迫综合征(ARDS),急性肺损伤(ALI),呼吸机诱导的肺损伤(VILI),肺动脉高压(PAH),阿尔兹海默病(AD)和败血症以及它们的任何组合的方法,该方法包括向哺乳动物患者施用治疗有效量的如本文所述的结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物并且其中结合分子不是IL-18BP的结合分子(例如抗体)或药物组合物。实施方式111:治疗和/或预防肉状瘤病,特别是肺肉状瘤病,噬血细胞性淋巴组织细胞增多症(HLH),家族性噬血细胞性淋巴组织细胞增生症(FHL),慢性阻塞性肺疾病(COPD),成人发作斯蒂尔病(AOSD),动脉粥样硬化,系统性幼年特发性关节炎(SJIA),重度哮喘,葡萄膜炎,地图样萎缩,巨细胞关节炎(GCA),1型糖尿病,2型糖尿病及其任何组合的方法,所述方法包括向哺乳动物患者施用治疗有效量的如本文所述的结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物并且其中结合分子不是IL-18BP的结合分子(例如抗体)或药物组合物。实施方式112:结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物并且其中结合分子不是IL-18BP的本发明的结合分子或药物组合物,其用于在哺乳动物患者中治疗和/或预防肉状瘤病,特别是肺肉状瘤病,噬血细胞性淋巴组织细胞增多症(HLH),家族性噬血细胞性淋巴组织细胞增生症(FHL),慢性阻塞性肺疾病(COPD),成人发作斯蒂尔病(AOSD),动脉粥样硬化,系统性幼年特发性关节炎(SJIA),重度哮喘,葡萄膜炎,地图状萎缩,巨细胞性关节炎(GCA),1型糖尿病,2型糖尿病,及其任何组合。实施方式113:治疗和/或预防自身免疫性疾病,包括类风湿关节炎(RA),系统性发作幼年关节炎(SOJA),系统性幼年特发性关节炎(SJIA),强直性脊柱炎,自身免疫性内耳疾病(AIED),自身免疫性淋巴的方法综合症(ALPS),白塞氏病,伯杰氏病(IgA肾病),大疱性类天疱疮,查格-施特劳斯综合征,结肠炎,克罗恩病(CD),1型糖尿病,2型糖尿病,干燥综合征(SS),移植物抗宿主病(GVHD),肾小球肾炎,狼疮,多发性硬化(MS),银屑病,风湿热,肉状瘤病,硬皮病,成人发作斯蒂尔病(AOSD),系统性红斑狼疮(SLE),溃疡性结肠炎,噬血细胞性淋巴组织细胞增多症(HLH,也称为噬血综合征,巨噬细胞活化综合征),家族性噬血细胞性淋巴组织细胞增生症(FHL)和其他免疫缺陷综合征,巨细胞动脉炎(GCA),冠状动脉疾病(CAD),冠脉血管病变(CV),急性冠脉综合征(ACS),充血性心力衰竭(CHF),动脉粥样硬化,动脉硬化,心肌梗死(MI),心肾综合症(CRS),急性肾损伤(AKI),糖尿病性肾病,胰岛素抵抗,肥胖和代谢综合征(MetS),肺部疾病,包括肺肉状瘤病,肺纤维化,哮喘,尤其是严重的哮喘,葡萄膜炎,地图状萎缩,慢性阻塞性肺疾病(COPD),囊性纤维化,成人呼吸窘迫综合征(ARDS)),急性肺损伤(ALI),呼吸机引起的肺损伤(VILI),肺动脉高压(PAH),阿尔兹海默病(AD)和败血症及其任何组合的方法,该方法包括向哺乳动物患者施用治疗有效量的如在实施方式1至88或96至110中任一项所述的结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物的抗体或药物组合物。实施方式114:在哺乳动物患者中治疗和/或预防肉状瘤病,特别是肺肉状瘤病,噬血细胞性淋巴组织细胞增多症(HLH),家族性噬血细胞性淋巴组织细胞增生症(FHL),慢性阻塞性肺疾病(COPD),成人发作斯蒂尔病(AOSD),动脉粥样硬化,系统性幼年特发性关节炎(SJIA),重度哮喘,葡萄膜炎,地图样萎缩,巨细胞关节炎(GCA),1型糖尿病,2型糖尿病及其任何组合的方法,所述方法包括向哺乳动物患者施用治疗有效量的如在实施方式1至88或96至110中任一项所述的结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18,BP)复合物的抗体或药物组合物。实施方式115:如在实施方式1-至88或96至110中任一项所述的结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物并且其中结合分子不是IL-18BP的抗体或药物组合物,其用于在哺乳动物患者中治疗和/或预防肉状瘤病,特别是肺肉状瘤病,噬血细胞性淋巴组织细胞增多症(HLH)家族性噬血细胞性淋巴组织细胞增生症(FHL),慢性阻塞性肺疾病(COPD),成人发作斯蒂尔病(AOSD),动脉粥样硬化,系统性幼年特发性关节炎(SJIA),重度哮喘,葡萄膜炎,地图样萎缩,巨细胞关节炎(GCA),1型糖尿病,2型糖尿病及其任何组合。8.诊断用途和试剂盒如本文所述的结合分子或分离的抗体或其片段的优点之一是它们结合IL-18但不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,并且它们不是IL-18BP。因此,如本文所述的结合分子或分离的抗体或其片段能够只检测未结合IL-18BP的游离IL-18。因为游离IL-18是生物活性分子,立即显而易见的是能够仅识别此类实体的结合分子可允许区分游离IL-18与结合至IL-18BP的无活性的IL-18。此外,因为本发明的结合分子不包括无论是分离的或天然存在的IL-18BP,它们使得本身不仅用作治疗剂而且在许多其他的应用,例如在诊断或诊断试剂盒中用作工具。因此,在另一个方面,本发明提供了如本文所述的结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物并且其中结合分子不是IL-18BP的结合分子或分离的抗体或其片段,其用于诊断或用于诊断试剂盒。如本文所述的结合分子或分离的抗体或其片段可以结合在ELISA检测法、Western印迹等中的检测抗体使用,并且不仅能够用于检测游离IL-18的存在也能测量游离IL-18的量。因此,在另一个方面,本发明提供了结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物并且其中结合分子不是IL-18BP的结合分子或分离的抗体或其片段,其用于诊断或用于检测和/或测量样品中游离IL-18(即,未结合IL-18BP的IL-18)的存在和/或量。在本发明的再一个方面,提供了用于检测和/或测量样品中游离IL-18(即,未结合IL-18BP的IL-18)的存在和/或量的方法,其中样品任选地是人样品,其中该方法包括用所述样品与结合分子或分离的抗体或其片段接触,其结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物并且其中结合分子不是IL-18BP。在本发明的再一个方面,提供了方法,其包括以下步骤:a.将从对象(例如,患有炎症性疾病或病症的对象)获得的样品接触如本文所述的结合分子或分离的抗体或其片段,所述结合分子或分离的抗体或其片段结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物并且其中结合分子不是IL-18BP;b.测量游离IL-18的水平;c.任选地,测量总IL-18和IL-18BP的水平;d.其中步骤b)和c)可以同时或连续或以颠倒的顺序进行(例如步骤b)在步骤c)之前或步骤c)在步骤b)之前)。样品可以是从哺乳动物体内分离的样品,优选来自人体。分离的样品可以是:i.来自可接近的身体部位,例如鼻粘膜、皮肤、结膜、口腔或咽喉、肛门、阴道、尿道、子宫颈;和/或ii.包括流体或半固体(例如身体液体或半固体如排出物、呕吐物、分泌物、排泄物、胃和/或肠汁、痰、血液、血清、血浆、尿液、泪液、滑液、精液、前列腺液、唾液、组织匀浆或粘液);和/或iii.包括固体(例如,粪便、组织或活组织样品);和/或iv.包括培养物(如巨噬细胞培养物);样品可以是人血或人血的一部分,如血浆。分离的样品可以优选地选自人全血、人血单核细胞来源的巨噬细胞和人肺巨噬细胞。在另一个方面,本发明进一步提供诊断试剂盒,所述试剂盒包括结合分子或分离的抗体或其片段(其结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物,其中结合分子不是IL-18BP)和/或包括IL-18和该结合分子的复合物,其中所述试剂盒任选地包括第一对照化合物。对照化合物是将指示诊断试剂盒有效的化合物。对照化合物可以是阳性或阴性的,并且它将验证任何有效的结果。第一对照化合物可以是游离IL-18并且试剂盒任选地可以包含鼠抗体125-2H这种第二对照化合物。在本发明的另一个方面,提供了医疗或诊断设备,其包括结合分子或分离的抗体或其片段(其结合IL-18且不结合IL-18/IL-18结合蛋白(IL-18BP)复合物)和/或包括IL-18以及该结合分子的复合物,其中所述结合分子不是IL-18BP。9.示例本文所列举的本发明的抗体的序列连同序列相关表记载在本说明书的末尾。9.1)材料重组人IL-18(使用由Liu等人(2000)Cytokine12(10):1519-25中描述的方法在大肠杆菌中产生)。重组食蟹猴IL18(使用美国专利号6,432,678中描述的方法在大肠杆菌中产生)重组人TNFα(R&D#210-TA)重组人IL-18结合蛋白-IgG1-Fc(hIL-18BPa-Fc,R&DSystems#119-BP-100)小鼠抗人IL-18IgG1(125-2H;R&DSystems#D044-3)人抗溶菌酶抗体(MOR03207MorphoSys)KG-1细胞系(ATCC#CCL-246)细胞培养基:RPMI1640(Invitrogen#31870),补充有10%胎牛血清(Invitrogen#10108-157),1%L-谷氨酰胺(Invitrogen#25030-03),1%青霉素/链霉素(Invitrogen#15140-148)。平底、组织培养物处理的96孔板(Costar#3596)人类IFN-γDuoSetELISA检测法(R&D#DY285)Maxisorb微滴定板(Sigma#M9410)肝素(Sigma#H3393)重组人IL-12(R&DSystems#219-IL-CF)LPS(Sigma#L4516)Falcon管(Corning#430829)Ficoll-PaqueTMPlus(GEHealthcareLifeSciences#17-1440-02)KG-1细胞以2×105至1×106个活细胞/ml的密度维持在补充有10%FBS、1%L-谷氨酰胺和1%青霉素/链霉素的RPMI1640中。9.2)为功能分析选择的抗体及其片段抗体及其片段是由噬菌体展示产生的。所用的噬菌粒文库是基于概念(Knappik,A.等人(2000)JMolBiol296,57-86)并采用了CysDisplayTM技术用于在噬菌体表面上展示Fab(WO01/05950)。为增加所选择的抗体片段的亲和性和生物活性,通过使用三核苷酸定向诱变的盒式诱变平行优化L-CDR3和H-CDR2区(Virnekas,B等人(1994)NucleicAcidsRes22,5600-5607),同时框架区保持恒定。选择来自不同亲本框架的抗体用于IgG转换和功能表征。这些抗体及其片段示于下表1A中。表1A:为功能分析所选择的IgG和Fab框架MOR08776VL1/VH4MOR10497VL1/VH4MOR10501VL1/VH4MOR10502VL1/VH4MOR8775VL1/VH1MOR9441VL1/VH1MOR9464VL1/VH1MOR9465VL1/VH1框架MOR9466VL1/VH1MOR10579VL1/VH1MOR10222VL1/VH1MOR13363VK1/VH3MOR13361VK1/VH3MOR13341VK1/VH1MOR13342VK1/VH1MOR13347VK1/VH1当在液体制剂中配制时,抗体MOR9464随时间出现效力损失。据推测,分子可能经历影响其效力的一些修饰。MOR9464在高于生理温度的温度下孵育以加速效力损失的出现。通过结合复杂的生物物理技术,包括质谱和反相HPLC,分离了两种不同的、未知的MOR9464形式。当蛋白质在细胞外介质中时,在体外操作和体内循环期间它们会发生许多修饰。无论何种修饰,都可以广泛地影响与基于蛋白质的药物学相关的性质。因此,极为重要的是了解这些修饰的结构-功能关系。胞外修饰是在治疗性蛋白完成信号通路(traffickingpathway),到达细胞表面并且它们被释放到细胞外培养基环境中并在生产期在那里孵育后不久发生的修饰。它们也包括在体外操作,如在合适的缓冲液中纯化和配制,或甚至在体内循环期间发生的修饰(ZhongX.和WrightJ.F.,IntJofCellBiol.,2013,1-19)。蛋白水解加工是最常见的和熟知的胞外修饰,因其产物很容易识别。单个氨基酸残基的氧化可能更难以表征,并且可能涉及甲硫氨酸残基以及色氨酸、半胱氨酸、组氨酸和酪氨酸残基。N-端焦谷氨酸形成也是众所周知的胞外修饰,由此N-端谷氨酰胺或谷氨酸残基可容易地与自己的末端基团环化形成吡咯烷酮羧酸。天冬酰胺和天冬氨酸残基的脱酰胺化或天冬氨酸异构化也是公知的,却尚未得到很好表征的修饰。如果胞外修饰发生在抗体的特定区域,它们可能对抗体的功能特性具有深远的影响,如效力损失。如果修饰发生在CDR中或在非常接近的位置,它可能会影响抗体识别和/或特异性结合其抗原的能力。进行了MOR9464序列的分析以鉴定胞外修饰的潜在位点。生成了表1B中所示的突变体。表2B:MOR9464/MOR10222突变体就在MOR9464的H-CDR1侧翼的天冬酰胺30,与在H-CDR1中的丝氨酸31和H-CDR2的甲硫氨酸54一起被认为是可能的修饰位点。天冬酰胺和谷氨酰胺残基的非酶促脱酰胺成天冬氨酸和谷氨酸通过水解反应发生并且是pH、温度和离子强度依赖性的。它也取决于天冬酰胺和谷氨酰胺残基之前的氨基酸残基,丝氨酸和苏氨酸会增加脱酰胺速率。具有或不具有甲硫氨酸突变的大部分MOR10222_S31X突变体在产生后严重聚集。因此,不再进一步表征这些突变体。9.3)使用溶液平衡滴定(SET)的亲和性测定对于通过溶液平衡滴定(SET)的KD测定,使用抗体的单体级分(通过分析性SEC分析)。基本上按照在文献所述进行在溶液中的亲和性测定(FriguetB等人(1985)JImmunolMethods;77(2):305-19)。为了提高SET方法的灵敏度和精确度,从经典的ELISA转为基于电化学发光(ECL)的技术(HaenelC等人(2005)AnalBiochem;339(1):182-4.)。根据制造商的说明,用MSDSULFO-TAGTMNHS-Ester(MesoScaleDiscovery,Gaithersburg,MD,USA)标记山羊抗-人(Fab)2片段特异性抗体(Dianova)。在聚丙烯微量滴定板和基于磷酸盐的测定缓冲液中进行实验。对未标记的人IL-18系列稀释,起始浓度比预期的KD高至少10倍。使用无抗原的孔来测定Bmax值;使用具有测定缓冲液的孔用于测定背景。加入恒定量的抗体或其片段(例如,在60μl终体积中为10pM终浓度)后,将混合物在室温过夜孵育。所应用的抗体或其片段的浓度与预期的KD相似或比之低。用含有BSA的磷酸缓冲液过夜封闭链霉亲和素MSD板。封闭板后,加入生物素化的人IL-18并在室温下孵育1h。随后将平衡的样品转移到那些平板并在RT孵育短时间。洗涤后,向MSD板中加入MSDSULFO-TAG标记的检测抗体(山羊抗人(Fab)2并在RT孵育短时间。清洗板并添加MSDReadBufferT与表面活性剂后,使用SectorImager6000(MesoScaleDiscovery,Gaithersburg,MD,USA)检测电化学发光信号。用应用定制的拟合模型的XLfit(IDBS)软件评估数据。为测定Fab分子的KD,使用下面的拟合模型(根据Haenel等人,2005)),根据Abraham等人,1996修改):[Fab]t:应用的总Fab浓度x:应用的总可溶性抗原浓度(结合位点)Bmax:没有抗原的Fab的最大信号KD:亲和性原则上,应用相同的方案来测定抗体和片段的KD值,只是具有下列差异:将完整抗体加入到抗原的稀释液系列中,并在室温平衡过夜。接着,按上述处理样品。对于数据评估,即IgG分子的KD测定,使用以下的用于IgG的拟合模型(根据Piehler等人,1997修改):[IgG]:应用的总IgG浓度x:应用的总可溶性抗原浓度(结合位点)Bmax:没有抗原的IgG的最大信号KD:亲和性使用上述的检测条件在溶液中测定抗IL-18抗体或其片段的亲和性,并示于表2A(第2栏)。其中,也检测了来自食蟹猴的IL-18(cmIL-18),得到的KD示于括号内。9.4)抑制IFN-γ从IL-18刺激的人PBMC的释放用标准技术从肝素化的人全血分离新鲜的外周血单核细胞(PBMC)。简言之,将含有肝素(15U/ml)的稀释的血液作为抗凝血剂铺在Ficoll-PaqueTMPlus上并离心(800xg,20分钟,18℃)。从血浆:Ficoll界面收集PBMC并洗涤两次(600xg,10分钟,4℃),然后再重新悬浮于培养基中。将PBMC重悬浮于培养基中并施加到96孔细胞培养板,以得到1.5×106/ml的最终的细胞密度(在200μl的最终测定体积中)。为确保根据本发明的抗体及其片段识别天然IL-18(其可以是糖基化的),用LPS和经由IL-18依赖的自分泌反馈诱导IFN-γ的IL-12刺激PBMC。用3nM人重组IL-18加IL-12(1ng/ml)或LPS(3μg/ml)加IL-12(10ng/ml)刺激细胞以诱导天然IL-18蛋白的分泌(所有终浓度)。在重组人IL-18的情况下,在该测定中将所选择的浓度预先确定为近似EC80。在天然IL-18的情况下,LPS刺激IL-18产生,而IL-12增加IL-18受体的表达(YoshimotoT等人(1998)JImmunol;161(7):3400-7)。在该测定中,通过纳入高特异性蛋白质,IL-18结合蛋白-IgG1Fc(hIL-18BPa-Fc)作为阳性对照(在图3(A-D)中的虚线)来测定IL-18依赖性的程度。为评估其效力和功效,将抗体及其片段与IL-12和LPS(天然条件)或IL-12和IL-18(重组条件)预平衡30分钟,然后以介于0.1和300nM之间的终浓度施加到细胞中。抗溶菌酶对照抗体MOR03207被用作阴性对照。从每个处理组,从n=2-5孔测定平均±SEM值(其中n=3或更大)。处理后将细胞在37℃,5%CO2下孵育24小时,在此时间后通过离心(1200rpm,5min)收集上清液,并储存在-20℃用于随后的分析。使用ELISA按照制造商的说明书评估IFN-γ蛋白水平。所有抗体及其片段剂量依赖性地抑制IFN-γ生产,在最高浓度实现与对于重组IL-18BPa-Fc所见类似的效力水平(表2A第5-6栏,表2B第2栏和图3(A-D),其中IL-18BPa的效力由虚线表示)。对照抗体,MOR03207(抗溶菌酶对照抗体)不抑制IL-18应答。种系抗体(如来自MOR09441的MOR10579和来自MOR09464的MOR10222)没有显著改变它们的中和能力。MOR9464和MOR10222的突变体,特别是MOR9464_N30K和MOR10222_N30S_M54I具有与野生型抗体可比较的中和能力。表2A:IL-18亲和力的KD值和抑制人重组(hr)IL-18(1nM)和天然IL-18诱导的IFN-γ释放的IC50值(nM)N/A=不可得;*人IL-18浓度=[0.5nM];#食蟹猴IL-18浓度=[0.2nM]表2B:抑制人重组(hr)IL-18(1nM),天然IL-18诱导的IFNγ释放的IC50值(nM)(n=2;平均值+/-SD)n=3平均值+/-SEM*n=2,平均值+/-SD9.5)抑制IFN-γ从IL-18刺激的KG-1细胞的释放分析抗IL-18抗体及其片段抑制来自IL-18刺激的KG-1细胞的IFN-γ释放的能力。在不存在拮抗剂时,通过IL-18受体的上调,在共刺激物如TNFα和IL-12的存在下IL-18促进IFN-γ释放的最大刺激(NakamuraS等人(2000)Leukemia;14(6):1052-9)。针对1nM人或食蟹猴IL-18(除非另有指明)评估抗体及片段的抑制性活性,在此基于细胞的系统中预定为EC80。将KG-1细胞重悬浮于培养基中,并应用到96孔细胞培养板以得到0.3×106/ml的最终的细胞密度(在200μl的最终测定体积中)。用1nM人或食蟹猴重组IL-18加TNFα(终浓度20ng/ml)刺激细胞。在此测定法中将所选的重组IL-18的浓度预先确定为近似EC80。为了评估这些抗体的效力和功效,将抗体及其片段与TNFα和IL-18(人或食蟹猴)预平衡30min,然后以介于0.1和300nM之间的终浓度施加到细胞中。抗溶菌酶对照抗体MOR03207被用作阴性对照。从每个处理组,从n=2-5孔来测定平均±SEM值(可获得时)。处理后将细胞在37℃,5%CO2下孵育24小时,在此时间后通过离心(885xg,5min)收集上清液,并储存在-20℃用于随后的分析。使用ELISA按照制造商的说明书评估IFN-γ蛋白水平。所有抗体及其片段剂量依赖性地抑制IFN-γ生产,在最高浓度实现完全抑制。对于亲和性-成熟的抗体,针对0.8nM人IL-18的IC50值范围在0.3-0.8nM,因此代表了1:1摩尔比的抗体:抗原或更好。VH4_3b框架抗体(MOR08776、MOR010501、MOR010502)针对人和食蟹猴IL-18都显示出类似的效力,而VH1A_3框架抗体针对食蟹猴IL-18的效力略低(表2第3和4栏)。对照抗体,MOR03207不抑制IL-18应答。9.6)人全血中的IL-18诱导的IFN-γ释放全血测定法并入内源性的IL-18BP的存在和功能两者,因为IL-18BP主要由脾脏产生并且在健康个体中以约10-20ng/ml的水平全身存在。IL-18BP以高亲和力结合IL-18并中和其活性,并因此可以代表识别这一复合物的可接近的表位的抗体的接收器(sink)。在取自健康志愿者的肝素化的人全血中评估抗IL-18抗体的活性。所有试剂都使用无血清培养基制备成最终所需的浓度的20倍。用7nM的人重组IL-18加IL-12(1ng/mL)或LPS(10μg/mL)加IL-12(10ng/mL)刺激细胞以诱导天然IL-18蛋白的分泌(所有终浓度)。在重组人IL-18的情况下,在该测定法中将所选择的浓度预先确定为近似EC80。在天然IL-18的情况下,LPS刺激IL-18产生,而IL-12增加IL-18受体表达并且通过纳入重组人IL-18结合蛋白-IgG1Fc(hIL-18BPa-Fc)作为阳性对照来测定IL-18依赖性的程度。为了评估这些抗体的效力和功效,将抗IL-18抗体及其片段用相关刺激物预平衡30min然后以0.1和1000nM之间的终浓度施加到细胞中。抗溶菌酶对照抗体MOR03207被用作阴性对照。向96孔组织培养无菌的微量滴定板的每孔中加入30μL刺激物混合物(+/-抗体或片段)然后向每孔中加入170μL肝素化全血使得每孔的最终体积为200μL。然后将板送回湿度培养箱(37℃)。24h后,将板离心(885×g,4℃,5min)并除去上清液,用市售的ELISA试剂盒测定hIFN-γ产生。最终的数据是获自3-5个健康人供体的平均值±平均值的标准差。针对任一刺激物,所有的抗体和片段都剂量依赖性地抑制IFNγ产生。在最高浓度实现了对重组IL-18诱导的应答的完全抑制,而针对LPS/IL-12刺激观察到与对IL-18BPa-Fc类似的功效(表3;图7(A-E)和图8(A-E))。种系MOR09441和MOR09464没有显著改变它们的中和能力。对照抗体MOR03207不抑制IL-18应答。也评估了所选抗体抑制来自食蟹猴的全血中的重组食蟹猴IL-18生物活性(7nM)的能力。MOR09441、MOR09464、MOR09465、MOR09466都剂量依赖性地抑制IFN-γ产生,在最高浓度观察到完全抑制。观察到的IC50值分别为110±36nM、51±8nM、55±3nM、179±30nM。表3:抑制全血中IL-18诱导的IFN-γ释放的IC50值(nM)MOR9464和MOR10222的突变体,特别是MOR9464_N30K和MOR10222_N30S_M54I具有与野生型抗体可比较的中和能力。9.7)抗IL-18抗体与IL-18-IL-18BP复合物的ELISA结合为了确认本文所述的抗-IL18抗体或其片段不识别结合至IL-18BP的IL-18(IL-18/IL-18BP复合物),用摩尔过量的IL-18BP(rhIL-18BP/Fc,R&DSystems,Cat#119)孵育IL-18。如下所述加入抗-IL18抗体及片段并检测与复合物的结合。通常,检测在高浓度的抗IL-18抗体和片段时的信号,其中它们结合与IL-18BP不同的抗原上的可接近的表位(即识别IL-18/IL-1BP复合物)。在第一设置中,对照抗体和抗-IL18抗体和片段用PBST/0.5%BSA稀释,并加入到生物素化的IL-18/IL18-BP复合物中(在RT在聚丙烯板中孵育30分钟并轻轻摇动)。对照抗体MOR03207(抗溶菌酶)作为阴性对照,MOR08741以及鼠125-2H,抗人IL-18小鼠IgG作为阳性对照抗体(它们都识别IL-18/IL-18BP复合物)(ArgiriadiMA等人(2009)JBiolChem;284(36):24478-89)。整个复合物通过生物素部分被捕获到NeutrAvidin板上,该板用1XChemiBlocker-PBS封闭o/n。用PBST洗涤板5次并用20μl/孔的检测抗体抗Fab-AP-山羊抗人IgG孵育1小时,F(ab)2片段特异性(JacksonImmunoResearch,109-055-097,lot:69655)或抗小鼠IgG(全分子)-AP(SIGMA,#A4312)都在0.5%BSA/0.05%吐温20/1×PBS中1:5000稀释。用TBST洗涤板5次,加入20μl的AttoPhos(Roche)溶液(在ddH2O中1:5稀释),并在TecanReader中测量荧光。对于不结合IL-18/IL-18BP复合物的抗IL-18抗体MOR8775和MOR8776,结合信号显著降低或没有观察到信号(图9(A))。相比较而言,在存在小鼠125-2H时观察到强烈的信号,支持了此对照抗体的所报道的结合与IL-18BP的表位不同的表位的能力。类似地,在对照抗体MOR08741存在下观察到剂量依赖的信号。在第二设置中,以相似的方式进行实验,除了使用未生物素化的huIL-18。使用山羊抗huIgG(Fcγ片段特异性的,JacksonImmunoResearch#109-005-098)通过rhIL-18BP/Fc的Fc标签将IL-18/IL-18BP复合物捕获到Maxisorp板。对于对照MOR08741观察到浓度依赖的信号,再次凸显了此抗体识别IL-18/IL-18BP复合物的能力。相比较而言,对MOR09441、MOR09464、MOR09465、MOR09466没有观察到信号,确认它们不结合IL-18/IL-18BP复合物。9.8)抗IL18抗体和片段通过ELISA的表位分箱(binning)对于表位分箱,使用两种设置。对于第一种设置,滴定抗体片段(FabA)并用生物素化的人IL-18孵育。以恒定的抗体B(IgGB)浓度测试FabA。作为阳性对照,以IgG形式分析FabA本身。用Chemiblocker(用PBS以1:1稀释)封闭NeutrAvidin板(ThermoScientificCat#15402),并在室温下孵育2h(或在4℃过夜)。第二天用PBST洗涤板2次并且Fab在含有10nM最终浓度的生物素化的人IL-18的PBS缓冲液中从500nM滴定降到2nM。将抗体片段和生物素化的IL-18的复合物加入到NeutrAvidin板中并孵育1小时。用PBST洗涤3次后,IgGB以20nM加入到NeutrAvidin板的对应孔中。孵育20分钟,并用3×PBST洗涤后,加入在0.5%BSA/0.05%吐温20/1×PBS中1:5000稀释的检测抗体抗Fc-AP-山羊抗人IgG,Fcγ链特异性(JacksonImmunoResearch,109-055-098)和抗小鼠IgG(全分子)-AP(SIGMA,#A4312,批号:067K4863)。用PBST洗涤板5次,加入20μl的AttoPhos溶液(在ddH2O中1:5稀释),并在TecanReader中测量板。以在430nm激发记录在535nm处的荧光发射。通常,只能在IgGB能够结合到抗原上的可接近表位时才能获得信号,其不同于测试的FabA(即结合不同表位的抗体)。相反,对于具有部分重叠或相同表位的抗体,结合信号相比对照显著降低。在Maxisorp板上执行第二ELISA设置。在PBS中包被FabA至不同浓度并在4℃孵育o/n。第二天用PBST洗涤板3次并用5%MPBST(100μL/孔)在室温封闭2小时。在3×PBST洗涤步骤后,以恒定浓度加入人IL-181h。将板用PBST洗涤3次并滴定生物素化的抗体片段(生物素化的FabB)(最大浓为5μg/mL、10μg/mL或20μg/mL)。对于FabA与IL-18和生物素化的FabB的复合物形成,将板孵育1h,随后用PBST洗涤3次并在PBST中1:2000稀释检测抗体ZyMax链霉亲和素碱性磷酸酶(Zymed,Cat.No.43-8322,Lot51102099)并以20μL/孔加入到ELISA板中。用TBST洗涤板5次,加入20μL的AttoPhos(Roche)溶液(在ddH2O中1:5稀释),并在TecanReader中测量板。在这种情况下,对于第一设置,信号只能在生物素化的FabB能够结合到抗原上的可接近表位时才能获得,其不同于测试的FabA(即抗体结合不同的表位)。如图10A所示,抗体MOR8775与鼠抗体125-2H(黑色格填充)竞争而MOR8776不与125-2H竞争结合IL-18(无格填充)。两种抗体都与IL-18BP-Fc竞争结合IL-18(黑色格填充)。MOR8775和MOR8776都不与ABT325抗体竞争(美国专利申请系列号09/780,035和10/988,360)。取决于实验设置,MOR8775和MOR8776彼此竞争(条纹格填充)。在第二组实验中,使用基于表面等离子体共振(SPR)的、实时无标记生物传感器的ProteonXPR36设备,测试在任意抗体IL-18BP-Fc、ABT325和鼠抗体125-2H存在下,抗体MOR9464、MOR9464_N30K、MOR10222_N30S_M54I和MOR13341结合IL-18的能力。在分析前,确认蛋白质的完整性,并通过LC-MS评估浓度。所有抗体和IL18BP-Fc都通过标准胺偶联被固定到GLC传感器芯片的相互作用的点上。在第一步骤中注射IL18作为分析物1,并在第二步骤中注射抗IL18抗体或IL18BPa-Fc作为分析物2。以在10mM醋酸盐缓冲液,pH值4.0中,20μg/mL(抗体)或10μg/mL(IL18BP-Fc)的浓度制备待固定化的配体。将分析物在含0.005%吐温20的PBS缓冲液(TEKNOVA)中稀释,将相同的缓冲溶液作为仪器的运行缓冲液。分析物1(25nM的IL18)以50μL/min的流速注射180秒钟,解离时间60秒。以50μL/min的流速注入分析物2(25nM的IL18BPa-Fc或抗IL18抗体)180秒钟,解离时间180秒。用10mM甘氨酸,pH1.5以100μL/min的流速进行再生20秒。进行两组独立实验。数据评估是基于在注射分析物2时传感图信号是否比分析物1的信号增加。如果该信号增加,结论是固定化的配体和注入的分析物2识别不同表位。如果信号没有增加可以得出结论的两者共享相同或重叠的表位。如图10B所示,抗体MOR9464、MOR9464_N30K、MOR10222_N30S_M54I和MOR13341彼此竞争(黑格填充),与IL-18BP-Fc和鼠抗体125-2H竞争。这些抗体无一与ABT325竞争(白色格填充)。显示出与IL-18BP-Fc和与鼠抗体125-2H双重竞争的抗体如MOR9464_N30K和MOR10222_N30S_M54I表现出不仅具有结合游离IL-18,不结合于天然抑制剂IL-18BP-Fc的优点,而且还表现出具有防止IL-18结合IL-18Rα/β的潜力的优点。如在Wu等人所述(WuC.等人,J.Immunol.2003,170:5571-5577),IL-18Rβ没有表现出单独结合IL-18,而是与IL-18Rα形成功能性的高亲和性受体复合物,其能够响应于IL-18发出信号。生化数据与IL-18上的125-2H的表位作图的结合揭示了人IL-18的C末端17个氨基酸对于通过异源二聚体受体的信号转导是至关重要的。因此,能够在125-2H表位内结合并与IL-18BP相等地竞争结合IL-18的抗体,表现出具有不仅通过阻断结合IL-18Rα还可以通过阻断IL-18结合IL-18Rα/β复合物,来防止IL-18依赖性通路活化的潜力。如在第9.11节显而易见,抗体MOR9464_N30K尤其结合氨基酸Glu177和Leu180,所述氨基酸是在Wu等人所描述的17个氨基酸序列段中。9.9)通过建模的IL-18表位作图使用来自SwissProt条目Q14116的人IL-18搜索在PDB中的结构信息(BermanH.M等人(2000)NuclAcidsRes;28:235-242)。发现了具有代码1J0S(KatoZ等人(2003)NatStructBiol;10:966)、2VXT(ArgiriadiMA等人(2009)JBiolChem;284:24478)和3F62(KrummB等人(2008)ProcNatlAcadSciUSA;105:20711)的三种结构。1J0S是人IL-18的NMR结构。2VXT是在分辨率的经改造的人IL-18与小鼠125-2H抗体片段复合的晶体结构和3F62是在分辨率的经改造的人IL-18与痘病毒IL-18结合蛋白复合的晶体结构。已通过突变分析鉴定了IL-18上的三个结合位点。其中的两个,位点1和2对于结合IL-18Rα是重要的,而第三个位点3对于结合IL-18Rβ是重要的(KatoZ.等人(2003)Nat.Struct.Biol,10:966)。位点2对于结合IL-18BP也是重要的。IL-1β和IL-1R1之间的结构复合物也是可获得的(1ITB,VigersG.P等人(1997)Nature,386:190)。IL-1β和IL-1R1之间的复合物的结构显示了IL-1β具有两个受体的结合位点,位点1和2(图11(A))。因为不可获得IL-18和IL-18Rα之间的复合物的结构,将与IL-1R1复合的IL-1β的晶体结构作为用于蛋白质建模的模板(PDB代码1ITB)。IL-18Rα的模型是通过使用IL-1R1的结构作为模板构建的。IL-18的晶体结构(pdb代码2VXT,ArgiriadiM.A等人(2009)J.Biol.Chem.284:24478)和IL-18Rα的建模的结构在结构上叠加到复合物IL-1β/IL-1R1上并且如此得到的IL-18/IL-18Rα模型进行细化以获得最终的结构模型(图11(B))。MOEv2009.1(ChemicalComputingGroupInc.)是用于建模IL-18和IL-18Rα之间的复合物的软件。通过选择AMBER99力场和默认面板参数使用同源性模型面板来构建IL-18Rα的模型。在MOE中能量最小化面板被用于最终的IL-18/IL-18Rα复合物的细化。人IL-18的整体结构示出了与IL-1β的相似性。特别是,在二级结构元素中IL-18和IL-1βCα原子之间的RMSD(均方根偏差)表明它们是属于同一类结构的相关蛋白质(KatoZ.等人.(2003)Nat.Struct.Biol,10:966)。IL-1β和IL-18之间的结构比较表明,IL-18中的位点1和2对应于IL-1β中的位点1和2。在图11(B)中,位点1和2示出在IL-18和IL-18Rα之间复合物的模型中,也示出位点3。位点3报告为用于IL-18Rβ的相互作用的位点(KatoZ.等人.(2003)Nat.Struct.Biol,10:966)。对于IL-18BP的IL-18结合位点已在一定程度上通过丙氨酸突变,并通过与IL-18复合的痘病毒IL-18BP的X射线晶体结构所鉴定(Krumm等人(2008)ProcNatlAcadSciUSA;105(52):20711-20715)。这个假定的结合位点也相应于已被鉴定为IL-18上位点2的区域,IL-18与IL-18Rα相互作用的两个区域之一。9.10)通过氢/氘交换质谱映射(H/DxMS)制图的IL-18表位使用氢/氘交换质谱来探测人IL-18的对于MOR9464表位有关的信息。H/DxMS制图依赖于“正常”的氢原子和“重”同位素氘之间的质量差异,氘还包括除了存在于正常的氢核的单质子以外的中子。在从水中转移到基于氘的溶剂系统(重水)中时,蛋白质将经历质量增加,因为蛋白质的骨架上的酰胺氢逐渐被氘(氢的更重同位素)核取代。氢/氘交换事件的可能性在很大程度上取决于蛋白结构和溶剂可及性。H/DxMS技术用于测量相对的氢/氘交换并因此蛋白质的结构和溶剂可及性。当蛋白结合配偶结合抗体(例如,抗原/抗体相互作用)时,可以观察其交换速率的实验上可观察到的改变。在复合物形成时排除溶剂的表面区域交换要慢得多。溶剂排除区域对于推导结合位点的位置是有用的。在抗原-抗体相互作用的情况下,氘交换速度的改变可能会突出表位的位置,以及抗体对抗原的结合所引起的任何其它扰动。例如,抗体结合后在给定交换时间由抗原摄入的氘的量的减少可能表示是由于抗体与这一区域的直接结合或者是因抗体结合造成的结构的间接扰动(变构的变化)所引起的保护增加。这两种效应不能很容易地区分,虽然观察到的最强的效果常常归因于直接保护免于抗体。抗体结合后的减少的氘掺入的位置可以由氢/氘交换后目标蛋白的消化(例如,用适当的酶如胃蛋白酶),然后质谱确定相关片段的质量来推导。在氘交换时间为3和25分钟时,通过用95%的氘化的PBS缓冲液稀释IL-18的储备液至83.6%D的浓度,对316pmol的IL-18抗原进行一式三份的对照实验。氘交换用淬灭缓冲液(6M尿素和1MTCEP)淬灭。淬灭后,将小瓶通过在线胃蛋白酶消化/LC-MS分析进行分析。在线胃蛋白酶消化是使用包装成2.0x20mm柱的LifeScience’sPoroszyme固定化的胃蛋白酶来进行并在ThermoC18BioBasic柱(1.0x50mm)上使用快速梯度以100μL/min的流速进行LC分离使得在不到20分钟洗脱所有肽。流动相是标准反相流动相:在水中的0.1%甲酸和在乙腈中的0.1%甲酸。在这些实验中,暴露在IL-18表面上的骨架酰胺氢会掺入氘核。接着,进行一式三份的标记实验。首先,用标准技术将MOR9464抗体固定于蛋白G琼脂糖珠(Thermo22851)。对抗体粒离心以除去PBS溶液。然后向固定化MOR9464抗体中加入200μL冷PBS(pH7.4)和6μL(316pmol)的IL-18并在4℃孵育15min。孵育后,将复合物离心并用200μLPBS洗涤并再次离心。对于氘交换,向抗原-抗体复合物中加入200μL的83.6%氘PBS缓冲液并在4℃下孵育3或25min。然后除去氘缓冲液,并立即加入125μL淬灭缓冲液(如上)。淬灭后,将流出物转移到预冷的HPLC小瓶中,并使用与在对照实验中相同的在线胃蛋白酶消化/LC-MS分析进行分析。存在于抗原-抗体界面中的骨架酰胺将在给定的交换时间掺入相对于对照实验更少的氘核。通过比较标记的和对照实验的H/Dx模式,表位被揭示为在标记实验中免于交换的抗原的那个区域。用MOR9464进行的分析的结果,揭示了在IL-18上三个最显著的保护区。这些是(参照SEQIDNO:1)从氨基酸87至99,从氨基酸119至137,以及从氨基酸138到160,这些区域被显示为包含参与IL-18BP结合的氨基酸(图12)。9.11)IL-18/抗体片段的X射线结构表征通过建模和H/DxMS提供的一般的表位鉴定证实了如本文所述的抗体及其片段识别IL-18上也被IL-18BP识别的区域(图12)。为了鉴定在这些区域中IL-18上的相关的氨基酸,进行IL-18/抗体复合物的X射线结构测定。为了制备抗体片段,将13mg在10mM组氨酸pH5.0中的浓度为18mg/mL的MOR9464_N30K用在100mM的Tris-HClpH7.0,10mM的DTT中的1/300(W/W)木瓜蛋白酶于室温切割200min。用50μM木瓜蛋白酶抑制剂E64终止反应。然后在用20mM磷酸钠缓冲液pH7.0平衡的蛋白A柱中纯化Fab片段。与IL-18复合的Fab的纯化:将1.33倍过量的人IL-18(在PBS中1.6mg)加入到3.2mg的MOR9464_N30K抗体片段(从蛋白A流出物回收)。与MOR9464_N30K抗体片段复合的IL-18通过超滤浓缩,加载到SPX-75尺寸排阻色谱中并在10mM的Tris-盐酸pH7.4,25mMNaCl中等强度洗脱。结晶:将IL-18/MOR9464_N30K抗体片段复合物通过超滤浓缩至11.8mg/mL并通过在96孔板中坐滴式蒸汽扩散进行结晶筛选。实验用Phoenix机器人系统设置,并在19℃储存在RockImager酒店。鉴定出两种晶型(A型和B型)并表征:1)晶型A从0.1M硫酸锂,0.1M的ADApH6.5,12%PEG4,000生长。(冷冻保护剂是存储液与20%的PEG4,000,30%甘油的1:1混合液)2)晶型B从59.5%2-甲基-2,4-戊二醇(MPD),15%甘油,85mM的HEPESpH7.5生长。(不需要冷冻保护剂)。以SwissLightSource,光束线X10SA,用Pilatus像素检测器收集X射线数据。所有衍射图像处理用XDS(版本2010年12月6日),如在APRV中实施。对于晶型A,720张0.25°振荡的图像,每张是采用波长的X射线辐射,以晶体到检测器距离460mm记录。对于晶型B,720张0.25°振荡的图像,每张是采用波长的X射线辐射,以晶体到检测器距离430mm记录。通过用程序Phaser的分子置换,使用PDB条目3GBM.pdb和2VXT.pdb分别作为MOR9464_N30K抗体片段和IL-18分子的起始模型确定晶型A的结构。在3GBM.pdb中的抗体片段的可变区和第一恒定结构域被用作独立的搜索模型。容易地获得了一种IL-18/MOR9464_N30K抗体片段复合物/非对称单位的透明溶液。以相同的方式测定晶型B的结构,但使用衍生自晶型A而非PDB条目的细化的模型。结构精细:通过多循环电子密度图检查和在Coot0.6.2中模型重建来细化结构,随后使用autoBUSTER(1.11.2/buster2.11.2)自动细化。将分子间接触鉴定为NCONT并用AREAIMOL分析包埋的表面,它们都是来自CCP4程序套件(版本6.1.2)。X-射线数据收集和精细统计学示于下表4中。表4:X-射线数据收集和精细统计学在图13中示出了IL-18/MOR9464_N30K片段的复合物的结构的整体视图。一旦形成复合物,在具有IL-18与抗体片段的结合界面处鉴定出IL-18上具有降低的溶剂可及性的36个氨基酸。这些残基是Leu41、Glu42、Met87、Tyr88、Lys89、Asp90、Ser91、Gln92、Pro93、Arg94、Gly95、Met96、Ala97、Phe138、Gln139、Arg140、Ser141、Val142、Pro143、Gly144、His145、Asp146、Asn147、Met149、Gln150、Glu152、Ser153、Ser154、Glu157、Gly158、Phe160、Glu177、Asp178、Glu179、Leu180和Gly181。在复合物界面中所做的相关接触的进一步表征鉴定出Arg140和Glu152是可能对这个特定的复合物形成贡献最大的氨基酸。两个残基都位于结合界面的中心,并对大量的分子间接触有贡献(分别是21和18,使用的截断距离)。Arg140与L-CDR3(Tyr94L)和H-CDR3(Tyr101H,His102H)残基都相互作用。Glu152与L-CDR2Arg51L形成强大的(包埋的)盐桥相互作用并从L-CDR3Tyr94L接受氢键。抗体链中的所有残基按顺序编号,残基编号后的字母L或H分别表示在轻链或是重链中的残基。IL-18/MOR9464_N30K抗体片段复合物的三维结构允许对在人IL-18和食蟹猴IL-18之间的不同的交叉反应性的一些进一步调查。相比于针对人IL-18的2pM,MOR9464_N30K针对猕猴IL-18(20pM)要弱10倍(表2)。食蟹猴IL-18与人IL-18在6个位置不同(人vs猕猴):V47I;S86N;T99A;K115R;F170Y和E177K(图14(A),这些位置中只有谷氨酸177(Glu177;E177)是在IL-18/抗体片段复合物的界面处(图14(B))。因此,值得商榷的是在食蟹猴IL-18的食蟹猴序列中的K177导致对MOR9464_N30K的亲和性下降10倍,如表2A第1栏所示,其中MOR9464_N30K对于人IL-18的KD(SET,pM)是2±1pM,而对于食蟹猴IL-18为20±10pM。为了鉴定MOR9464_N30K抗体片段与IL-18Rα的哪部分竞争,进行了IL-18/MOR9464_N30K抗体片段复合物与IL-18/IL-18Rα复合物的叠加。简言之,IL-18/IL-18Rα复合物中的IL-18和IL-18/MOR9464_N30K复合物中IL-18的结构通过使用在PyMOL中的比对命令而叠加(ThePyMolMolecularGraphicsystem,1.2r3pre版,SchroedingerLLC)。如图15所示,MOR9464_N30K抗体片段似乎与IL-18Rα的Ig-结构域D3竞争结合IL-18。相似地,使用PyMOL(ThePyMOLMolecularGraphicsystem,version1.5.0.,LLC)中的“比对”命令将IL-18/MOR9464_N30K抗体片段复合物的结构叠加到与痘病毒IL-18BP复合的人IL-18的结构上(坐标文件用3F62.pdb)。如图16所示,痘病毒IL-18BP与MOR9464_N30K抗体片段的重链可变结构域冲突并且主要竞争结合IL-18上的氨基酸残基Met87到Met96。这些发现进一步证实了本文所示的生物化学和表位分箱数据并且显示出如本文中所描述的结合分子,特别是抗体及其片段不结合IL-18/IL-18BP复合物。最后,进行与现有技术的鼠抗体125-2H的比较。用在2VXT.pdb文件中找到的125-2H抗体片段的结构进行分析。简言之,使用PyMOL(ThePyMOLMolecularGraphicsystem,version1.5.0.,LLC)中的“比对”命令将与MOR9464_N30K抗体片段复合的IL-18的结构叠加到与125-2HFab复合的IL-18上。如图17所示,MOR9464_N30K抗体片段(叠加的左侧)和125-2H抗体片段(叠加的右侧)在识别IL-18时重叠。然而,125-2H抗体片段不结合由IL-18BP识别的表位,如图18所示,其中125-2H/IL-18复合物与痘病毒IL-18BP/IL复合物重叠。这些数据进一步证实了,关于125-2H的现有技术文献(ArgiriadiM.A等人(2009)J.Biol.Chem.284:24478)以及在本文所示的生物化学和表位分箱数据中鼠抗体125-2H结合IL-18/IL-18BP复合物。最后,如图19所示,在MOR9464_N30K的重链位置30的赖氨酸似乎形成与人IL-18的Asp146和Asn147的静电/极性相互作用,表明赖氨酸30参与了抗体-抗原复合物的形成。因此,明显的是,如在本文的部分9.2中描述,胞外修饰如天冬酰胺脱酰胺可能有助于MOR9464随时间的效力损失。用赖氨酸替换MOR9464_N30K中的天冬酰胺30似乎为MOR9464_N30K提供增加的稳定性。序列关系表序列表SEQIDNO:1MAAEPVEDNCINFVAMKFIDNTLYFIAEDDENLESDYFGKLESKLSVIRNLNDQVLFIDQGNRPLFEDMTDSDCRDNAPRTIFIISMYKDSQPRGMAVTISVKCEKISTLSCENKIISFKEMNPPDNIKDTKSDIIFFQRSVPGHDNKMQFESSSYEGYFLACEKERDLFKLILKKEDELGDRSIMFTVQNEDSEQIDNO:2MAAEPAEDNCINFVAMKPIDSTLYFIAEDDENLESDYFGKLESKLSIIRNLNDQVLFIDQGNRPLFEDMTDSDCRDNAPRTIFIINMYKDSQPRGMAVAISVKCEKISTLSCENRIISFKEMNPPDNIKDTKSDIIFFQRSVPGHDNKMQFESSSYEGYFLACEKERDLYKLILKKKDELGDRSIMFTVQNEDSEQIDNO:3SYAISSEQIDNO:4GIIPIYGTANYAQKFQGSEQIDNO:5AAYHPLVFDNSEQIDNO:6SGSSSNIGNHYVNSEQIDNO:7RNNHRPSSEQIDNO:8QSWDYSGFSTVSEQIDNO:9NIIPMTGQTYYAQKFQGSEQIDNO:10WINPFYIGETFYAQKFQGSEQIDNO:11NIIPHYGFAYYAQKFQGSEQIDNO:12NIIPYSGFAYYAQKFQGSEQIDNO:13NIIPITGQTYYAQKFQGSEQIDNO:14EVQLVQSGAEVKKPGSSVKVSCKASGGTFKSYAISWVRQAPGQGLEWMGNIIPMTGQTYYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCARAAYHPLVFDNWGQGTLVTVSSSEQIDNO:15GAGGTGCAGCTGGTGCAGTCAGGCGCCGAAGTGAAGAAACCCGGCTCTAGCGTGAAAGTCAGCTGTAAAGCTAGTGGCGGCACCTTCAAGTCCTACGCTATTAGCTGGGTCAGACAGGCCCCAGGTCAGGGCCTGGAGTGGATGGGCAATATTATCCCTATGACCGGTCAGACCTACTACGCTCAGAAATTTCAGGGTAGAGTGACTATCACCGCCGACGAGTCTACTAGCACCGCCTATATGGAACTGTCTAGCCTGAGATCAGAGGACACCGCCGTCTACTACTGCGCTAGAGCCGCCTATCACCCCCTGGTGTTCGATAACTGGGGTCAGGGCACCCTGGTCACCGTGTCTAGCSEQIDNO:16DIVLTQPPSVSGAPGQRVTISCSGSSSNIGNHYVNWYQQLPGTAPKLLIYRNNHRPSGVPDRFSGSKSGTSASLAITGLQSEDEADYYCQSWDYSGFSTVFGGGTKLTVLSEQIDNO:17GATATCGTCCTGACTCAGCCCCCTAGCGTCAGCGGCGCTCCCGGTCAGAGAGTGACTATTAGCTGTAGCGGCTCTAGCTCTAATATCGGTAATCACTACGTGAACTGGTATCAGCAGCTGCCCGGCACCGCCCCTAAGCTGCTGATCTATAGAAACAATCACCGGCCTAGCGGCGTGCCCGATAGGTTTAGCGGATCTAAGTCAGGCACTAGCGCTAGTCTGGCTATCACCGGACTGCAGTCAGAGGACGAGGCCGACTACTACTGTCAGTCCTGGGACTATAGCGGCTTTAGCACCGTGTTCGGCGGAGGCACTAAGCTGACCGTGCTGSEQIDNO:18QVQLVQSGAEVKKPGSSVKVSCKASGGTFSSYAISWVRQAPGQGLEWMGNIIPITGQTYYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCARAAYHPLVFDNWGQGTLVTVSSSEQIDNO:19CAGGTGCAGCTGGTGCAGTCAGGCGCCGAAGTGAAGAAACCCGGCTCTAGCGTGAAAGTCAGCTGTAAAGCTAGTGGCGGCACCTTCTCTAGCTACGCTATTAGCTGGGTCAGACAGGCCCCAGGTCAGGGCCTGGAGTGGATGGGCAATATTATCCCTATCACCGGTCAGACCTACTACGCTCAGAAATTTCAGGGTAGAGTGACTATCACCGCCGACGAGTCTACTAGCACCGCCTATATGGAACTGTCTAGCCTGAGATCAGAGGACACCGCCGTCTACTACTGCGCTAGAGCCGCCTATCACCCCCTGGTGTTCGATAACTGGGGTCAGGGCACCCTGGTCACCGTGTCTAGCSEQIDNO:20QSVLTQPPSASGTPGQRVTISCSGSSSNIGNHYVNWYQQLPGTAPKLLIYRNNHRPSGVPDRFSGSKSGTSASLAISGLQSEDEADYYCQSWDYSGFSTVFGGGTKLTVLSEQIDNO:21CAGTCAGTCCTGACTCAGCCCCCTAGCGCTAGTGGCACCCCTGGTCAGAGAGTGACTATTAGCTGTAGCGGCTCTAGCTCTAATATCGGTAATCACTACGTGAACTGGTATCAGCAGCTGCCCGGCACCGCCCCTAAGCTGCTGATCTATAGAAACAATCACCGGCCTAGCGGCGTGCCCGATAGGTTTAGCGGATCTAAGTCAGGGACTAGCGCTAGTCTGGCTATTAGCGGCCTGCAGTCAGAGGACGAGGCCGACTACTACTGTCAGTCCTGGGACTATAGCGGCTTTAGCACCGTGTTCGGCGGAGGCACTAAGCTGACCGTGCTGSEQIDNO:22QVQLVQSGAEVKKPGSSVKVSCKASGGTFNSYAISWVRQAPGQGLEWMGGIIPIYGTANYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCARAAYHPLVFDNWGQGTLVTVSSSEQIDNO:23CAGGTGCAATTGGTTCAGTCTGGCGCGGAAGTGAAAAAACCGGGCAGCAGCGTGAAAGTGAGCTGCAAAGCCTCCGGAGGCACTTTTAATTCTTATGCTATTTCTTGGGTGCGCCAAGCCCCTGGGCAGGGTCTCGAGTGGATGGGCGGTATCATTCCGATTTATGGCACTGCGAATTACGCGCAGAAGTTTCAGGGCCGGGTGACCATTACCGCGGATGAAAGCACCAGCACCGCGTATATGGAACTGAGCAGCCTGCGTAGCGAAGATACGGCCGTGTATTATTGCGCGCGTGCTGCTTATCATCCTCTTGTTTTTGATAATTGGGGCCAAGGCACCCTGGTGACGGTTAGCTCASEQIDNO:24GATATCGTGCTGACCCAGCCGCCTTCAGTGAGTGGCGCACCAGGTCAGCGTGTGACCATCTCGTGTAGCGGCAGCAGCAGCAACATTGGTAATCATTATGTGAATTGGTACCAGCAGTTGCCCGGGACGGCGCCGAAACTTCTGATTTATCGTAATAATCATCGTCCCTCAGGCGTGCCGGATCGTTTTAGCGGATCCAAAAGCGGCACCAGCGCGAGCCTTGCGATTACGGGCCTGCAAAGCGAAGACGAAGCGGATTATTATTGCCAGTCTTGGGATTATTCTGGTTTTTCTACTGTGTTTGGCGGCGGCACGAAGTTAACCGTCCTASEQIDNO:25EVQLVQSGAEVKKPGSSVKVSCKASGGTFNSYAISWVRQAPGQGLEWMGWINPFYIGETFYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCARAAYHPLVFDNWGQGTLVTVSSSEQIDNO:26GAGGTGCAGCTGGTGCAGTCTGGCGCTGAGGTGAAGAAGCCTGGCTCCTCCGTCAAGGTGTCCTGCAAGGCCTCCGGCGGCACCTTCAACTCCTACGCTATCTCTTGGGTGCGCCAGGCTCCCGGACAGGGCCTGGAGTGGATGGGCTGGATCAACCCTTTCTACATCGGCGAGACATTCTACGCCCAGAAGTTCCAGGGCAGAGTCACCATCACCGCCGACGAGTCCACCTCCACCGCCTACATGGAGCTGTCCTCCCTGCGGTCAGAGGACACCGCCGTGTACTACTGCGCCAGGGCCGCCTACCACCCTCTGGTGTTCGACAACTGGGGCCAGGGCACCCTGGTGACCGTGTCCTCCSEQIDNO:27GATATCGTGCTGACCCAGCCTCCTTCTGTGTCTGGCGCCCCTGGCCAGAGAGTGACCATCTCCTGCTCTGGCTCCTCCTCCAATATCGGCAACCACTACGTGAACTGGTATCAGCAGCTGCCCGGAACCGCCCCTAAGCTGCTGATCTACCGGAACAACCACCGGCCTTCCGGCGTGCCCGACCGGTTCTCCGGCTCCAAGTCTGGCACCTCTGCCTCCCTGGCCATCACCGGCCTGCAGTCCGAGGACGAGGCCGACTACTACTGCCAGTCCTGGGACTACTCCGGCTTCTCAACCGTGTTCGGCGGAGGCACCAAGCTGACCGTGCTGSEQIDNO:28EVQLVQSGAEVKKPGSSVKVSCKASGGTFNSYAISWVRQAPGQGLEWMGNIIPMTGQTYYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCARAAYHPLVFDNWGQGTLVTVSSSEQIDNO:29GAGGTGCAGCTGGTGCAGTCTGGCGCTGAGGTGAAGAAGCCTGGCTCCTCCGTCAAGGTGTCCTGCAAGGCCTCCGGCGGCACCTTCAACTCCTACGCTATCTCTTGGGTGCGCCAGGCTCCCGGACAGGGCCTGGAGTGGATGGGCAACATCATCCCTATGACCGGCCAGACCTACTACGCCCAGAAGTTCCAGGGCAGAGTCACCATCACCGCCGACGAGTCCACCTCCACCGCCTACATGGAGCTGTCCTCCCTGCGGTCAGAGGACACCGCCGTGTACTACTGCGCCAGGGCCGCCTACCACCCTCTGGTGTTCGACAACTGGGGCCAGGGCACCCTGGTGACCGTGTCCTCCSEQIDNO:30GACATCGTGCTGACACAGCCTCCCTCTGTGTCTGGCGCCCCTGGCCAGAGAGTGACCATCTCCTGCTCTGGCTCCTCCTCCAATATCGGCAACCACTACGTGAACTGGTATCAGCAGCTGCCCGGAACCGCCCCTAAGCTGCTGATCTACCGGAACAACCACCGGCCTTCCGGCGTGCCCGACCGGTTCTCCGGCTCCAAGTCTGGCACCTCTGCCTCCCTGGCCATCACCGGCCTGCAGTCAGAGGACGAGGCCGACTACTACTGCCAGTCCTGGGACTACTCCGGCTTCTCCACCGTGTTCGGCGGAGGCACCAAGCTGACCGTGCTGSEQIDNO:31EVQLVQSGAEVKKPGSSVKVSCKASGGTFNSYAISWVRQAPGQGLEWMGNIIPHYGFAYYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCARAAYHPLVFDNWGQGTLVTVSSSEQIDNO:32GAGGTGCAATTGGTTCAGTCTGGCGCGGAAGTGAAAAAACCGGGCAGCAGCGTGAAAGTGAGCTGCAAAGCCTCCGGAGGCACTTTTAATTCTTATGCTATTTCTTGGGTGCGCCAAGCCCCTGGGCAGGGTCTCGAGTGGATGGGCAATATTATTCCTCATTATGGTTTTGCTTATTATGCTCAGAAGTTTCAGGGTCGGGTGACCATTACCGCGGATGAAAGCACCAGCACCGCGTATATGGAACTGAGCAGCCTGCGTAGCGAAGATACGGCCGTGTATTATTGCGCGCGTGCTGCTTATCATCCTCTTGTTTTTGATAATTGGGGCCAAGGCACCCTGGTGACGGTTAGCTCASEQIDNO:33GATATCGTGCTGACCCAGCCGCCTTCAGTGAGTGGCGCACCAGGTCAGCGTGTGACCATCTCGTGTAGCGGCAGCAGCAGCAACATTGGTAATCATTATGTGAATTGGTACCAGCAGTTGCCCGGGACGGCGCCGAAACTTCTGATTTATCGTAATAATCATCGTCCCTCAGGCGTGCCGGATCGTTTTAGCGGATCCAAAAGCGGCACCAGCGCGAGCCTTGCGATTACGGGCCTGCAAAGCGAAGACGAAGCGGATTATTATTGCCAGTCTTGGGATTATTCTGGTTTTTCTACTGTGTTTGGCGGCGGCACGAAGTTAACCGTCCTASEQIDNO:34EVQLVQSGAEVKKPGSSVKVSCKASGGTFNSYAISWVRQAPGQGLEWMGNIIPYSGFAYYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCARAAYHPLVFDNWGQGTLVTVSSSEQIDNO:35GAGGTGCAATTGGTTCAGTCTGGCGCGGAAGTGAAAAAACCGGGCAGCAGCGTGAAAGTGAGCTGCAAAGCCTCCGGAGGCACTTTTAATTCTTATGCTATTTCTTGGGTGCGCCAAGCCCCTGGGCAGGGTCTCGAGTGGATGGGCAATATTATTCCTTATTCTGGTTTTGCTTATTATGCTCAGAAGTTTCAGGGTCGGGTGACCATTACCGCGGATGAAAGCACCAGCACCGCGTATATGGAACTGAGCAGCCTGCGTAGCGAAGATACGGCCGTGTATTATTGCGCGCGTGCTGCTTATCATCCTCTTGTTTTTGATAATTGGGGCCAAGGCACCCTGGTGACGGTTAGCTCASEQIDNO:36GATATCGTGCTGACCCAGCCGCCTTCAGTGAGTGGCGCACCAGGTCAGCGTGTGACCATCTCGTGTAGCGGCAGCAGCAGCAACATTGGTAATCATTATGTGAATTGGTACCAGCAGTTGCCCGGGACGGCGCCGAAACTTCTGATTTATCGTAATAATCATCGTCCCTCAGGCGTGCCGGATCGTTTTAGCGGATCCAAAAGCGGCACCAGCGCGAGCCTTGCGATTACGGGCCTGCAAAGCGAAGACGAAGCGGATTATTATTGCCAGTCTTGGGATTATTCTGGTTTTTCTACTGTGTTTGGCGGCGGCACGAAGTTAACCGTCCTASEQIDNO:37EVQLVQSGAEVKKPGSSVKVSCKASGGTFNSYAISWVRQAPGQGLEWMGWINPFYIGETFYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCARAAYHPLVFDNWGQGTLVTVSSSEQIDNO:38GAGGTGCAGCTGGTGCAGTCTGGCGCTGAGGTGAAGAAGCCTGGCTCCTCCGTCAAGGTGTCCTGCAAGGCCTCCGGCGGCACCTTCAACTCCTACGCTATCTCTTGGGTGCGCCAGGCTCCCGGACAGGGCCTGGAGTGGATGGGCTGGATCAACCCTTTCTACATCGGCGAGACATTCTACGCCCAGAAGTTCCAGGGCAGAGTCACCATCACCGCCGACGAGTCCACCTCCACCGCCTACATGGAGCTGTCCTCCCTGCGGTCAGAGGACACCGCCGTGTACTACTGCGCCAGGGCCGCCTACCACCCTCTGGTGTTCGACAACTGGGGCCAGGGCACCCTGGTGACCGTGTCCTCCSEQIDNO:39CAGTCCGTGCTGACCCAGCCTCCTTCTGCCTCTGGCACCCCTGGCCAGAGAGTGACCATCTCCTGCTCTGGCTCCTCCTCCAATATCGGCAACCACTACGTGAACTGGTATCAGCAGCTGCCCGGAACCGCCCCTAAGCTGCTGATCTACCGGAACAACCACCGGCCTTCCGGCGTGCCCGACCGGTTCTCCGGCTCCAAGTCTGGCACCTCCGCCTCCCTGGCCATCTCTGGCCTGCAGTCAGAGGACGAGGCCGACTACTACTGCCAGTCCTGGGACTACTCCGGCTTCTCCACCGTGTTCGGCGGAGGCACCAAGCTGACCGTGCTGSEQIDNO:40EVQLVQSGAEVKKPGSSVKVSCKASGGTFNSYAISWVRQAPGQGLEWMGNIIPMTGQTYYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCARAAYHPLVFDNWGQGTLVTVSSSEQIDNO:41GAGGTGCAGCTGGTGCAGTCTGGCGCCGAGGTGAAGAAGCCTGGCTCCTCCGTCAAGGTGTCCTGCAAGGCCTCCGGCGGCACCTTCAACTCCTACGCCATCTCTTGGGTGCGCCAGGCTCCTGGACAGGGCCTGGAGTGGATGGGCAACATCATCCCTATGACCGGCCAGACCTACTACGCCCAGAAGTTCCAGGGCAGAGTCACCATCACCGCCGACGAGTCCACCTCCACCGCCTACATGGAGCTGTCCTCCCTGCGGTCAGAGGACACCGCCGTGTACTACTGCGCCAGGGCCGCCTACCACCCTCTGGTGTTCGACAACTGGGGCCAGGGCACCCTGGTGACCGTGTCCTCCSEQIDNO:42CAGTCCGTGCTGACCCAGCCTCCTTCTGCCTCTGGCACCCCTGGCCAGAGAGTGACCATCTCCTGCTCTGGCTCCTCCTCCAATATCGGCAACCACTACGTGAACTGGTATCAGCAGCTGCCCGGAACCGCCCCTAAGCTGCTGATCTACCGGAACAACCACCGGCCTTCCGGCGTGCCCGACCGGTTCTCCGGCTCCAAGTCTGGCACCTCCGCCTCCCTGGCCATCTCTGGCCTGCAGTCAGAGGACGAGGCCGACTACTACTGCCAGTCCTGGGACTACTCCGGCTTCTCCACCGTGTTCGGCGGAGGCACCAAGCTGACCGTGCTGSEQIDNO:43EVQLVQSGAEVKKPGSSVKVSCKASGGTFKSYAISWVRQAPGQGLEWMGNIIPMTGQTYYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCARAAYHPLVFDNWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGKSEQIDNO:44GAGGTGCAGCTGGTGCAGTCAGGCGCCGAAGTGAAGAAACCCGGCTCTAGCGTGAAAGTCAGCTGTAAAGCTAGTGGCGGCACCTTCAAGTCCTACGCTATTAGCTGGGTCAGACAGGCCCCAGGTCAGGGCCTGGAGTGGATGGGCAATATTATCCCTATGACCGGTCAGACCTACTACGCTCAGAAATTTCAGGGTAGAGTGACTATCACCGCCGACGAGTCTACTAGCACCGCCTATATGGAACTGTCTAGCCTGAGATCAGAGGACACCGCCGTCTACTACTGCGCTAGAGCCGCCTATCACCCCCTGGTGTTCGATAACTGGGGTCAGGGCACCCTGGTCACCGTGTCTAGCGCTAGCACTAAGGGCCCCTCCGTGTTCCCTCTGGCCCCTTCCAGCAAGTCTACCTCCGGCGGCACAGCTGCTCTGGGCTGCCTGGTCAAGGACTACTTCCCTGAGCCTGTGACAGTGTCCTGGAACTCTGGCGCCCTGACCTCTGGCGTGCACACCTTCCCTGCCGTGCTGCAGTCCTCCGGCCTGTACTCCCTGTCCTCCGTGGTCACAGTGCCTTCAAGCAGCCTGGGCACCCAGACCTATATCTGCAACGTGAACCACAAGCCTTCCAACACCAAGGTGGACAAGCGGGTGGAGCCTAAGTCCTGCGACAAGACCCACACCTGTCCTCCCTGCCCTGCTCCTGAAGCTGCTGGCGGCCCTTCTGTGTTCCTGTTCCCTCCAAAGCCCAAGGACACCCTGATGATCTCCCGGACCCCTGAAGTGACCTGCGTGGTGGTGGACGTGTCCCACGAGGATCCTGAAGTGAAGTTCAATTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCTCGGGAGGAACAGTACAACTCCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAAGAGTACAAGTGCAAAGTCTCCAACAAGGCCCTGCCTGCCCCTATCGAAAAGACAATCTCCAAGGCCAAGGGCCAGCCTAGGGAACCCCAGGTGTACACCCTGCCACCCAGCCGGGAGGAAATGACCAAGAACCAGGTGTCCCTGACCTGTCTGGTCAAGGGCTTCTACCCTTCCGATATCGCCGTGGAGTGGGAGTCTAACGGCCAGCCTGAGAACAACTACAAGACCACCCCTCCTGTGCTGGACTCCGACGGCTCCTTCTTCCTGTACTCCAAACTGACCGTGGACAAGTCCCGGTGGCAGCAGGGCAACGTGTTCTCCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGTCCCTGTCCCTGTCTCCCGGCAAGSEQIDNO:45DIVLTQPPSVSGAPGQRVTISCSGSSSNIGNHYVNWYQQLPGTAPKLLIYRNNHRPSGVPDRFSGSKSGTSASLAITGLQSEDEADYYCQSWDYSGFSTVFGGGTKLTVLGQPKAAPSVTLFPPSSEELQANKATLVCLISDFYPGAVTVAWKADSSPVKAGVETTTPSKQSNNKYAASSYLSLTPEQWKSHRSYSCQVTHEGSTVEKTVAPTECSSEQIDNO:46GATATCGTCCTGACTCAGCCCCCTAGCGTCAGCGGCGCTCCCGGTCAGAGAGTGACTATTAGCTGTAGCGGCTCTAGCTCTAATATCGGTAATCACTACGTGAACTGGTATCAGCAGCTGCCCGGCACCGCCCCTAAGCTGCTGATCTATAGAAACAATCACCGGCCTAGCGGCGTGCCCGATAGGTTTAGCGGATCTAAGTCAGGCACTAGCGCTAGTCTGGCTATCACCGGACTGCAGTCAGAGGACGAGGCCGACTACTACTGTCAGTCCTGGGACTATAGCGGCTTTAGCACCGTGTTCGGCGGAGGCACTAAGCTGACCGTGCTGGGTCAGCCTAAGGCTGCCCCCAGCGTGACCCTGTTCCCCCCCAGCAGCGAGGAGCTGCAGGCCAACAAGGCCACCCTGGTGTGCCTGATCAGCGACTTCTACCCAGGCGCCGTGACCGTGGCCTGGAAGGCCGACAGCAGCCCCGTGAAGGCCGGCGTGGAGACCACCACCCCCAGCAAGCAGAGCAACAACAAGTACGCCGCCAGCAGCTACCTGAGCCTGACCCCCGAGCAGTGGAAGAGCCACAGGTCCTACAGCTGCCAGGTGACCCACGAGGGCAGCACCGTGGAAAAGACCGTGGCCCCAACCGAGTGCAGCSEQIDNO:47EVQLVQSGAEVKKPGSSVKVSCKASGGTFNSYAISWVRQAPGQGLEWMGNIIPMTGQTYYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCARAAYHPLVFDNWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGKSEQIDNO:48GAGGTGCAGCTGGTGCAGTCTGGCGCTGAGGTGAAGAAGCCTGGCTCCTCCGTCAAGGTGTCCTGCAAGGCCTCCGGCGGCACCTTCAACTCCTACGCTATCTCTTGGGTGCGCCAGGCTCCCGGACAGGGCCTGGAGTGGATGGGCAACATCATCCCTATGACCGGCCAGACCTACTACGCCCAGAAGTTCCAGGGCAGAGTCACCATCACCGCCGACGAGTCCACCTCCACCGCCTACATGGAGCTGTCCTCCCTGCGGTCAGAGGACACCGCCGTGTACTACTGCGCCAGGGCCGCCTACCACCCTCTGGTGTTCGACAACTGGGGCCAGGGCACCCTGGTGACCGTGTCCTCCGCTAGCACCAAGGGCCCCTCCGTGTTCCCTCTGGCCCCTTCCAGCAAGTCTACCTCCGGCGGCACAGCTGCTCTGGGCTGCCTGGTCAAGGACTACTTCCCTGAGCCTGTGACAGTGTCCTGGAACTCTGGCGCCCTGACCTCTGGCGTGCACACCTTCCCTGCCGTGCTGCAGTCCTCCGGCCTGTACTCCCTGTCCTCCGTGGTCACAGTGCCTTCAAGCAGCCTGGGCACCCAGACCTATATCTGCAACGTGAACCACAAGCCTTCCAACACCAAGGTGGACAAGCGGGTGGAGCCTAAGTCCTGCGACAAGACCCACACCTGTCCTCCCTGCCCTGCTCCTGAAGCTGCTGGCGGCCCTTCTGTGTTCCTGTTCCCTCCAAAGCCCAAGGACACCCTGATGATCTCCCGGACCCCTGAAGTGACCTGCGTGGTGGTGGACGTGTCCCACGAGGATCCTGAAGTGAAGTTCAATTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCTCGGGAGGAACAGTACAACTCCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAAGAGTACAAGTGCAAAGTCTCCAACAAGGCCCTGCCTGCCCCTATCGAAAAGACAATCTCCAAGGCCAAGGGCCAGCCTAGGGAACCCCAGGTGTACACCCTGCCACCCAGCCGGGAGGAAATGACCAAGAACCAGGTGTCCCTGACCTGTCTGGTCAAGGGCTTCTACCCTTCCGATATCGCCGTGGAGTGGGAGTCTAACGGCCAGCCTGAGAACAACTACAAGACCACCCCTCCTGTGCTGGACTCCGACGGCTCCTTCTTCCTGTACTCCAAACTGACCGTGGACAAGTCCCGGTGGCAGCAGGGCAACGTGTTCTCCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGTCCCTGTCCCTGTCTCCCGGCAAGSEQIDNO:49GACATCGTGCTGACACAGCCTCCCTCTGTGTCTGGCGCCCCTGGCCAGAGAGTGACCATCTCCTGCTCTGGCTCCTCCTCCAATATCGGCAACCACTACGTGAACTGGTATCAGCAGCTGCCCGGAACCGCCCCTAAGCTGCTGATCTACCGGAACAACCACCGGCCTTCCGGCGTGCCCGACCGGTTCTCCGGCTCCAAGTCTGGCACCTCTGCCTCCCTGGCCATCACCGGCCTGCAGTCAGAGGACGAGGCCGACTACTACTGCCAGTCCTGGGACTACTCCGGCTTCTCCACCGTGTTCGGCGGAGGCACCAAGCTGACCGTGCTGGGACAGCCTAAGGCTGCCCCCAGCGTGACCCTGTTCCCCCCCAGCAGCGAGGAGCTGCAGGCCAACAAGGCCACCCTGGTGTGCCTGATCAGCGACTTCTACCCAGGCGCCGTGACCGTGGCCTGGAAGGCCGACAGCAGCCCCGTGAAGGCCGGCGTGGAGACCACCACCCCCAGCAAGCAGAGCAACAACAAGTACGCCGCCAGCAGCTACCTGAGCCTGACCCCCGAGCAGTGGAAGAGCCACAGGTCCTACAGCTGCCAGGTGACCCACGAGGGCAGCACCGTGGAAAAGACCGTGGCCCCAACCGAGTGCAGCSEQIDNO:50EVQLVQSGAEVKKPGSSVKVSCKASGGTFNSYAISWVRQAPGQGLEWMGWINPFYIGETFYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCARAAYHPLVFDNWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGKSEQIDNO:51GAGGTGCAGCTGGTGCAGTCTGGCGCTGAGGTGAAGAAGCCTGGCTCCTCCGTCAAGGTGTCCTGCAAGGCCTCCGGCGGCACCTTCAACTCCTACGCTATCTCTTGGGTGCGCCAGGCTCCCGGACAGGGCCTGGAGTGGATGGGCTGGATCAACCCTTTCTACATCGGCGAGACATTCTACGCCCAGAAGTTCCAGGGCAGAGTCACCATCACCGCCGACGAGTCCACCTCCACCGCCTACATGGAGCTGTCCTCCCTGCGGTCAGAGGACACCGCCGTGTACTACTGCGCCAGGGCCGCCTACCACCCTCTGGTGTTCGACAACTGGGGCCAGGGCACCCTGGTGACCGTGTCCTCCGCTAGCACCAAGGGCCCCTCCGTGTTCCCTCTGGCCCCTTCCAGCAAGTCTACCTCCGGCGGCACAGCTGCTCTGGGCTGCCTGGTCAAGGACTACTTCCCTGAGCCTGTGACAGTGTCCTGGAACTCTGGCGCCCTGACCTCTGGCGTGCACACCTTCCCTGCCGTGCTGCAGTCCTCCGGCCTGTACTCCCTGTCCTCCGTGGTCACAGTGCCTTCAAGCAGCCTGGGCACCCAGACCTATATCTGCAACGTGAACCACAAGCCTTCCAACACCAAGGTGGACAAGCGGGTGGAGCCTAAGTCCTGCGACAAGACCCACACCTGTCCTCCCTGCCCTGCTCCTGAAGCTGCTGGCGGCCCTTCTGTGTTCCTGTTCCCTCCAAAGCCCAAGGACACCCTGATGATCTCCCGGACCCCTGAAGTGACCTGCGTGGTGGTGGACGTGTCCCACGAGGATCCTGAAGTGAAGTTCAATTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCTCGGGAGGAACAGTACAACTCCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAAGAGTACAAGTGCAAAGTCTCCAACAAGGCCCTGCCTGCCCCTATCGAAAAGACAATCTCCAAGGCCAAGGGCCAGCCTAGGGAACCCCAGGTGTACACCCTGCCACCCAGCCGGGAGGAAATGACCAAGAACCAGGTGTCCCTGACCTGTCTGGTCAAGGGCTTCTACCCTTCCGATATCGCCGTGGAGTGGGAGTCTAACGGCCAGCCTGAGAACAACTACAAGACCACCCCTCCTGTGCTGGACTCCGACGGCTCCTTCTTCCTGTACTCCAAACTGACCGTGGACAAGTCCCGGTGGCAGCAGGGCAACGTGTTCTCCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGTCCCTGTCCCTGTCTCCCGGCAAGSEQIDNO:52GATATCGTGCTGACCCAGCCTCCTTCTGTGTCTGGCGCCCCTGGCCAGAGAGTGACCATCTCCTGCTCTGGCTCCTCCTCCAATATCGGCAACCACTACGTGAACTGGTATCAGCAGCTGCCCGGAACCGCCCCTAAGCTGCTGATCTACCGGAACAACCACCGGCCTTCCGGCGTGCCCGACCGGTTCTCCGGCTCCAAGTCTGGCACCTCTGCCTCCCTGGCCATCACCGGCCTGCAGTCCGAGGACGAGGCCGACTACTACTGCCAGTCCTGGGACTACTCCGGCTTCTCAACCGTGTTCGGCGGAGGCACCAAGCTGACCGTGCTGGGACAGCCTAAGGCTGCCCCCAGCGTGACCCTGTTCCCCCCCAGCAGCGAGGAGCTGCAGGCCAACAAGGCCACCCTGGTGTGCCTGATCAGCGACTTCTACCCAGGCGCCGTGACCGTGGCCTGGAAGGCCGACAGCAGCCCCGTGAAGGCCGGCGTGGAGACCACCACCCCCAGCAAGCAGAGCAACAACAAGTACGCCGCCAGCAGCTACCTGAGCCTGACCCCCGAGCAGTGGAAGAGCCACAGGTCCTACAGCTGCCAGGTGACCCACGAGGGCAGCACCGTGGAAAAGACCGTGGCCCCAACCGAGTGCAGCSEQIDNO:53EVQLVQSGAEVKKPGSSVKVSCKASGGTFNSYAISWVRQAPGQGLEWMGNIIPMTGQTYYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCARAAYHPLVFDNWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGKSEQIDNO:54GAGGTGCAGCTGGTGCAGTCTGGCGCCGAGGTGAAGAAGCCTGGCTCCTCCGTCAAGGTGTCCTGCAAGGCCTCCGGCGGCACCTTCAACTCCTACGCCATCTCTTGGGTGCGCCAGGCTCCTGGACAGGGCCTGGAGTGGATGGGCAACATCATCCCTATGACCGGCCAGACCTACTACGCCCAGAAGTTCCAGGGCAGAGTCACCATCACCGCCGACGAGTCCACCTCCACCGCCTACATGGAGCTGTCCTCCCTGCGGTCAGAGGACACCGCCGTGTACTACTGCGCCAGGGCCGCCTACCACCCTCTGGTGTTCGACAACTGGGGCCAGGGCACCCTGGTGACCGTGTCCTCCGCTAGCACCAAGGGCCCCTCCGTGTTCCCTCTGGCCCCTTCCAGCAAGTCTACCTCCGGCGGCACAGCTGCTCTGGGCTGCCTGGTCAAGGACTACTTCCCTGAGCCTGTGACAGTGTCCTGGAACTCTGGCGCCCTGACCTCTGGCGTGCACACCTTCCCTGCCGTGCTGCAGTCCTCCGGCCTGTACTCCCTGTCCTCCGTGGTCACAGTGCCTTCAAGCAGCCTGGGCACCCAGACCTATATCTGCAACGTGAACCACAAGCCTTCCAACACCAAGGTGGACAAGCGGGTGGAGCCTAAGTCCTGCGACAAGACCCACACCTGTCCTCCCTGCCCTGCTCCTGAAGCTGCTGGCGGCCCTTCTGTGTTCCTGTTCCCTCCAAAGCCCAAGGACACCCTGATGATCTCCCGGACCCCTGAAGTGACCTGCGTGGTGGTGGACGTGTCCCACGAGGATCCTGAAGTGAAGTTCAATTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCTCGGGAGGAACAGTACAACTCCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAAGAGTACAAGTGCAAAGTCTCCAACAAGGCCCTGCCTGCCCCTATCGAAAAGACAATCTCCAAGGCCAAGGGCCAGCCTAGGGAACCCCAGGTGTACACCCTGCCACCCAGCCGGGAGGAAATGACCAAGAACCAGGTGTCCCTGACCTGTCTGGTCAAGGGCTTCTACCCTTCCGATATCGCCGTGGAGTGGGAGTCTAACGGCCAGCCTGAGAACAACTACAAGACCACCCCTCCTGTGCTGGACTCCGACGGCTCCTTCTTCCTGTACTCCAAACTGACCGTGGACAAGTCCCGGTGGCAGCAGGGCAACGTGTTCTCCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGTCCCTGTCCCTGTCTCCCGGCAAGSEQIDNO:55CAGTCCGTGCTGACCCAGCCTCCTTCTGCCTCTGGCACCCCTGGCCAGAGAGTGACCATCTCCTGCTCTGGCTCCTCCTCCAATATCGGCAACCACTACGTGAACTGGTATCAGCAGCTGCCCGGAACCGCCCCTAAGCTGCTGATCTACCGGAACAACCACCGGCCTTCCGGCGTGCCCGACCGGTTCTCCGGCTCCAAGTCTGGCACCTCCGCCTCCCTGGCCATCTCTGGCCTGCAGTCAGAGGACGAGGCCGACTACTACTGCCAGTCCTGGGACTACTCCGGCTTCTCCACCGTGTTCGGCGGAGGCACCAAGCTGACCGTGCTGGGACAGCCTAAGGCTGCCCCCAGCGTGACCCTGTTCCCCCCCAGCAGCGAGGAGCTGCAGGCCAACAAGGCCACCCTGGTGTGCCTGATCAGCGACTTCTACCCAGGCGCCGTGACCGTGGCCTGGAAGGCCGACAGCAGCCCCGTGAAGGCCGGCGTGGAGACCACCACCCCCAGCAAGCAGAGCAACAACAAGTACGCCGCCAGCAGCTACCTGAGCCTGACCCCCGAGCAGTGGAAGAGCCACAGGTCCTACAGCTGCCAGGTGACCCACGAGGGCAGCACCGTGGAAAAGACCGTGGCCCCAACCGAGTGCAGCSEQIDNO:56QVQLVQSGAEVKKPGSSVKVSCKASGGTFNSYAISWVRQAPGQGLEWMGGIIPIYGTANYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCARAAYHPLVFDNWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGKSEQIDNO:57CAGGTGCAATTGGTTCAGTCTGGCGCGGAAGTGAAAAAACCGGGCAGCAGCGTGAAAGTGAGCTGCAAAGCCTCCGGAGGCACTTTTAATTCTTATGCTATTTCTTGGGTGCGCCAAGCCCCTGGGCAGGGTCTCGAGTGGATGGGCGGTATCATTCCGATTTATGGCACTGCGAATTACGCGCAGAAGTTTCAGGGCCGGGTGACCATTACCGCGGATGAAAGCACCAGCACCGCGTATATGGAACTGAGCAGCCTGCGTAGCGAAGATACGGCCGTGTATTATTGCGCGCGTGCTGCTTATCATCCTCTTGTTTTTGATAATTGGGGCCAAGGCACCCTGGTGACGGTTAGCTCAGCCTCCACCAAGGGTCCATCGGTCTTCCCCCTGGCACCCTCCTCCAAGAGCACCTCTGGGGGCACAGCGGCCCTGGGCTGCCTGGTCAAGGACTACTTCCCCGAACCGGTGACGGTGTCGTGGAACTCAGGCGCCCTGACCAGCGGCGTGCACACCTTCCCGGCTGTCCTACAGTCCTCAGGACTCTACTCCCTCAGCAGCGTGGTGACCGTGCCCTCCAGCAGCTTGGGCACCCAGACCTACATCTGCAACGTGAATCACAAGCCCAGCAACACCAAGGTGGACAAGAGAGTTGAGCCCAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGCACCTGAACTCCTGGGGGGACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTGAGCCACGAAGACCCTGAGGTCAAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAGCAGTACAACAGCACGTACCGGGTGGTCAGCGTCCTCACCGTCCTGCACCAGGACTGGCTGAATGGCAAGGAGTACAAGTGCAAGGTCTCCAACAAAGCCCTCCCAGCCCCCATCGAGAAAACCATCTCCAAAGCCAAAGGGCAGCCCCGAGAACCACAGGTGTACACCCTGCCCCCATCCCGGGAGGAGATGACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTATCCCAGCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTACAGCAAGCTCACCGTGGACAAGAGCAGGTGGCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACGCAGAAGAGCCTCTCCCTGTCTCCGGGTAAASEQIDNO:58GATATCGTGCTGACCCAGCCGCCTTCAGTGAGTGGCGCACCAGGTCAGCGTGTGACCATCTCGTGTAGCGGCAGCAGCAGCAACATTGGTAATCATTATGTGAATTGGTACCAGCAGTTGCCCGGGACGGCGCCGAAACTTCTGATTTATCGTAATAATCATCGTCCCTCAGGCGTGCCGGATCGTTTTAGCGGATCCAAAAGCGGCACCAGCGCGAGCCTTGCGATTACGGGCCTGCAAAGCGAAGACGAAGCGGATTATTATTGCCAGTCTTGGGATTATTCTGGTTTTTCTACTGTGTTTGGCGGCGGCACGAAGTTAACCGTCCTAGGTCAGCCCAAGGCTGCCCCCTCGGTCACTCTGTTCCCGCCCTCCTCTGAGGAGCTTCAAGCCAACAAGGCCACACTGGTGTGTCTCATAAGTGACTTCTACCCGGGAGCCGTGACAGTGGCCTGGAAGGCAGATAGCAGCCCCGTCAAGGCGGGAGTGGAGACCACCACACCCTCCAAACAAAGCAACAACAAGTACGCGGCCAGCAGCTATCTGAGCCTGACGCCTGAGCAGTGGAAGTCCCACAGAAGCTACAGCTGCCAGGTCACGCATGAAGGGAGCACCGTGGAGAAGACAGTGGCCCCTACAGAATGTTCASEQIDNO:59GGTFNSYSEQIDNO:60IPMTGQSEQIDNO:61AAYHPLVFDNSEQIDNO:62SSSNIGNHYSEQIDNO:63RNNSEQIDNO:64WDYSGFSTSEQIDNO:65GGTFKSYSEQIDNO:66GGTFSSYSEQIDNO:67IPITGQSEQIDNO:68GFTFSSYSEQIDNO:69SGEGSNSEQIDNO:70VMIGYGFDYSEQIDNO:71SQSIFNYSEQIDNO:72DSSSEQIDNO:73YSGFLFSEQIDNO:74TGSYYWNSEQIDNO:75EINHMGITYYNPSLKGSEQIDNO:76EIWHSGPTFYNPSLKSSEQIDNO:77EIHGHGFTFYNPSLKSSEQIDNO:78EIQSPGYTFYNPSLKSSEQIDNO:79TTRYWMSHILAYGMDYSEQIDNO:80SGSSSNIGNHYVSSEQIDNO:81ANTKRPSSEQIDNO:82SSYDGSQSIVSEQIDNO:83QVQLQESGPGLVKPGETLSLTCTVSGGSISTGSYYWNWIRQAPGKGLEWIGEINHMGITYYNPSLKGRVTISVDTSKNQFSLKLSSVTAEDTAVYYCARTTRYWMSHILAYGMDYWGQGTLVTVSSSEQIDNO:84CAGGTGCAATTGCAAGAAAGTGGTCCGGGCCTGGTGAAACCGGGCGAAACCCTGAGCCTGACCTGCACCGTTTCCGGAGGTAGCATTTCTACTGGTTCTTATTATTGGAATTGGATTCGCCAGGCCCCTGGGAAGGGTCTCGAGTGGATTGGCGAGATCAATCATATGGGCATTACCTATTATAATCCGAGCCTGAAAGGCCGGGTGACCATTAGCGTTGATACTTCGAAAAACCAGTTTAGCCTGAAACTGAGCAGCGTGACGGCGGAAGATACGGCCGTGTATTATTGCGCGCGTACTACTCGTTATTGGATGTCTCATATTCTTGCTTATGGTATGGATTATTGGGGCCAAGGCACCCTGGTGACGGTTAGCTCASEQIDNO:85DIVLTQPPSVSGAPGQRVTISCSGSSSNIGNHYVSWYQQLPGTAPKLLIYANTKRPSGVPDRFSGSKSGTSASLAITGLQSEDEADYYCSSYDGSQSIVFGGGTKLTVLSEQIDNO:86GATATCGTGCTGACCCAGCCGCCTTCAGTGAGTGGCGCACCAGGTCAGCGTGTGACCATCTCGTGTAGCGGCAGCAGCAGCAACATTGGTAATCATTATGTGTCTTGGTACCAGCAGTTGCCCGGGACGGCGCCGAAACTTCTGATTTATGCTAATACTAAGCGTCCCTCAGGCGTGCCGGATCGTTTTAGCGGATCCAAAAGCGGCACCAGCGCGAGCCTTGCGATTACGGGCCTGCAAAGCGAAGACGAAGCGGATTATTATTGCTCTTCTTATGATGGTTCTCAGTCTATTGTGTTTGGCGGCGGCACGAAGTTAACCGTCCTASEQIDNO:87EVQLQESGPGLVKPGETLSLTCTVSGGSISTGSYYWNWIRQAPGKGLEWIGEIQSPGYTFYNPSLKSRVTISVDTSKNQFSLKLSSVTAADTAVYYCARTTRYWMSHILAYGMDYWGQGTLVTVSSSEQIDNO:88GAGGTGCAATTGCAAGAAAGTGGTCCGGGCCTGGTGAAACCGGGCGAAACCCTGAGCCTGACCTGCACCGTTTCCGGAGGTAGCATTTCTACTGGTTCTTATTATTGGAATTGGATTCGCCAGGCCCCTGGGAAGGGTCTCGAGTGGATTGGCGAGATTCAGTCTCCTGGTTATACTTTTTATAATCCTTCTCTTAAGTCTCGGGTGACCATTAGCGTTGATACTTCGAAAAACCAGTTTAGCCTGAAACTGAGCAGCGTGACGGCGGCGGATACGGCCGTGTATTATTGCGCGCGTACTACTCGTTATTGGATGTCTCATATTCTTGCTTATGGTATGGATTATTGGGGCCAAGGCACCCTGGTGACGGTTAGCTCASEQIDNO:89GATATCGTGCTGACCCAGCCGCCTTCAGTGAGTGGCGCACCAGGTCAGCGTGTGACCATCTCGTGTAGCGGCAGCAGCAGCAACATTGGTAATCATTATGTGTCTTGGTACCAGCAGTTGCCCGGGACGGCGCCGAAACTTCTGATTTATGCTAATACTAAGCGTCCCTCAGGCGTGCCGGATCGTTTTAGCGGATCCAAAAGCGGCACCAGCGCGAGCCTTGCGATTACGGGCCTGCAAAGCGAAGACGAAGCGGATTATTATTGCTCTTCTTATGATGGTTCTCAGTCTATTGTGTTTGGCGGCGGCACGAAGTTAACCGTCCTASEQIDNO:9OEVQLQESGPGLVKPGETLSLTCTVSGGSISTGSYYWNWIRQAPGKGLEWIGEIWHSGPTFYNPSLKSRVTISVDTSKNQFSLKLSSVTAADTAVYYCARTTRYWMSHILAYGMDYWGQGTLVTVSSSEQIDNO:91GAGGTGCAATTGCAAGAAAGTGGTCCGGGCCTGGTGAAACCGGGCGAAACCCTGAGCCTGACCTGCACCGTTTCCGGAGGTAGCATTTCTACTGGTTCTTATTATTGGAATTGGATTCGCCAGGCCCCTGGGAAGGGTCTCGAGTGGATTGGCGAGATTTGGCATTCTGGTCCTACTTTTTATAATCCTTCTCTTAAGTCTCGGGTGACCATTAGCGTTGATACTTCGAAAAACCAGTTTAGCCTGAAACTGAGCAGCGTGACGGCGGCGGATACGGCCGTGTATTATTGCGCGCGTACTACTCGTTATTGGATGTCTCATATTCTTGCTTATGGTATGGATTATTGGGGCCAAGGCACCCTGGTGACGGTTAGCTCASEQIDNO:92GATATCGTGCTGACCCAGCCGCCTTCAGTGAGTGGCGCACCAGGTCAGCGTGTGACCATCTCGTGTAGCGGCAGCAGCAGCAACATTGGTAATCATTATGTGTCTTGGTACCAGCAGTTGCCCGGGACGGCGCCGAAACTTCTGATTTATGCTAATACTAAGCGTCCCTCAGGCGTGCCGGATCGTTTTAGCGGATCCAAAAGCGGCACCAGCGCGAGCCTTGCGATTACGGGCCTGCAAAGCGAAGACGAAGCGGATTATTATTGCTCTTCTTATGATGGTTCTCAGTCTATTGTGTTTGGCGGCGGCACGAAGTTAACCGTCCTASEQIDNO:93EVQLQESGPGLVKPGETLSLTCTVSGGSISTGSYYWNWIRQAPGKGLEWIGEIHGHGFTFYNPSLKSRVTISVDTSKNQFSLKLSSVTAADTAVYYCARTTRYWMSHILAYGMDYWGQGTLVTVSSSEQIDNO:94GAGGTGCAATTGCAAGAAAGTGGTCCGGGCCTGGTGAAACCGGGCGAAACCCTGAGCCTGACCTGCACCGTTTCCGGAGGTAGCATTTCTACTGGTTCTTATTATTGGAATTGGATTCGCCAGGCCCCTGGGAAGGGTCTCGAGTGGATTGGCGAGATTCATGGTCATGGTTTTACTTTTTATAATCCTTCTCTTAAGTCTCGGGTGACCATTAGCGTTGATACTTCGAAAAACCAGTTTAGCCTGAAACTGAGCAGCGTGACGGCGGCGGATACGGCCGTGTATTATTGCGCGCGTACTACTCGTTATTGGATGTCTCATATTCTTGCTTATGGTATGGATTATTGGGGCCAAGGCACCCTGGTGACGGTTAGCTCASEQIDNO:95GATATCGTGCTGACCCAGCCGCCTTCAGTGAGTGGCGCACCAGGTCAGCGTGTGACCATCTCGTGTAGCGGCAGCAGCAGCAACATTGGTAATCATTATGTGTCTTGGTACCAGCAGTTGCCCGGGACGGCGCCGAAACTTCTGATTTATGCTAATACTAAGCGTCCCTCAGGCGTGCCGGATCGTTTTAGCGGATCCAAAAGCGGCACCAGCGCGAGCCTTGCGATTACGGGCCTGCAAAGCGAAGACGAAGCGGATTATTATTGCTCTTCTTATGATGGTTCTCAGTCTATTGTGTTTGGCGGCGGCACGAAGTTAACCGTCCTASEQIDNO:96QVQLQESGPGLVKPGETLSLTCTVSGGSISTGSYYWNWIRQAPGKGLEWIGEINHMGITYYNPSLKGRVTISVDTSKNQFSLKLSSVTAEDTAVYYCARTTRYWMSHILAYGMDYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGKSEQIDNO:97CAGGTGCAATTGCAAGAAAGTGGTCCGGGCCTGGTGAAACCGGGCGAAACCCTGAGCCTGACCTGCACCGTTTCCGGAGGTAGCATTTCTACTGGTTCTTATTATTGGAATTGGATTCGCCAGGCCCCTGGGAAGGGTCTCGAGTGGATTGGCGAGATCAATCATATGGGCATTACCTATTATAATCCGAGCCTGAAAGGCCGGGTGACCATTAGCGTTGATACTTCGAAAAACCAGTTTAGCCTGAAACTGAGCAGCGTGACGGCGGAAGATACGGCCGTGTATTATTGCGCGCGTACTACTCGTTATTGGATGTCTCATATTCTTGCTTATGGTATGGATTATTGGGGCCAAGGCACCCTGGTGACGGTTAGCTCAGCCTCCACCAAGGGTCCATCGGTCTTCCCCCTGGCACCCTCCTCCAAGAGCACCTCTGGGGGCACAGCGGCCCTGGGCTGCCTGGTCAAGGACTACTTCCCCGAACCGGTGACGGTGTCGTGGAACTCAGGCGCCCTGACCAGCGGCGTGCACACCTTCCCGGCTGTCCTACAGTCCTCAGGACTCTACTCCCTCAGCAGCGTGGTGACCGTGCCCTCCAGCAGCTTGGGCACCCAGACCTACATCTGCAACGTGAATCACAAGCCCAGCAACACCAAGGTGGACAAGAGAGTTGAGCCCAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGCACCTGAACTCCTGGGGGGACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTGAGCCACGAAGACCCTGAGGTCAAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAGCAGTACAACAGCACGTACCGGGTGGTCAGCGTCCTCACCGTCCTGCACCAGGACTGGCTGAATGGCAAGGAGTACAAGTGCAAGGTCTCCAACAAAGCCCTCCCAGCCCCCATCGAGAAAACCATCTCCAAAGCCAAAGGGCAGCCCCGAGAACCACAGGTGTACACCCTGCCCCCATCCCGGGAGGAGATGACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTATCCCAGCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTACAGCAAGCTCACCGTGGACAAGAGCAGGTGGCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACGCAGAAGAGCCTCTCCCTGTCTCCGGGTAAASEQIDNO:98DIVLTQPPSVSGAPGQRVTISCSGSSSNIGNHYVSWYQQLPGTAPKLLIYANTKRPSGVPDRFSGSKSGTSASLAITGLQSEDEADYYCSSYDGSQSIVFGGGTKLTVLGQPKAAPSVTLFPPSSEELQANKATLVCLISDFYPGAVTVAWKADSSPVKAGVETTTPSKQSNNKYAASSYLSLTPEQWKSHRSYSCQVTHEGSTVEKTVAPTECSSEQIDNO:99GATATCGTGCTGACCCAGCCGCCTTCAGTGAGTGGCGCACCAGGTCAGCGTGTGACCATCTCGTGTAGCGGCAGCAGCAGCAACATTGGTAATCATTATGTGTCTTGGTACCAGCAGTTGCCCGGGACGGCGCCGAAACTTCTGATTTATGCTAATACTAAGCGTCCCTCAGGCGTGCCGGATCGTTTTAGCGGATCCAAAAGCGGCACCAGCGCGAGCCTTGCGATTACGGGCCTGCAAAGCGAAGACGAAGCGGATTATTATTGCTCTTCTTATGATGGTTCTCAGTCTATTGTGTTTGGCGGCGGCACGAAGTTAACCGTCCTAGGTCAGCCCAAGGCTGCCCCCTCGGTCACTCTGTTCCCGCCCTCCTCTGAGGAGCTTCAAGCCAACAAGGCCACACTGGTGTGTCTCATAAGTGACTTCTACCCGGGAGCCGTGACAGTGGCCTGGAAGGCAGATAGCAGCCCCGTCAAGGCGGGAGTGGAGACCACCACACCCTCCAAACAAAGCAACAACAAGTACGCGGCCAGCAGCTATCTGAGCCTGACGCCTGAGCAGTGGAAGTCCCACAGAAGCTACAGCTGCCAGGTCACGCATGAAGGGAGCACCGTGGAGAAGACAGTGGCCCCTACAGAATGTTCASEQIDNO:100EVQLVQSGAEVKKPGSSVKVSCKASGGTFNSYAISWVRQAPGQGLEWMGWINPFYIGETFYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCARAAYHPLVFDNWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGKSEQIDNO:101GAGGTGCAGCTGGTGCAGTCTGGCGCTGAGGTGAAGAAGCCTGGCTCCTCCGTCAAGGTGTCCTGCAAGGCCTCCGGCGGCACCTTCAACTCCTACGCTATCTCTTGGGTGCGCCAGGCTCCCGGACAGGGCCTGGAGTGGATGGGCTGGATCAACCCTTTCTACATCGGCGAGACATTCTACGCCCAGAAGTTCCAGGGCAGAGTCACCATCACCGCCGACGAGTCCACCTCCACCGCCTACATGGAGCTGTCCTCCCTGCGGTCAGAGGACACCGCCGTGTACTACTGCGCCAGGGCCGCCTACCACCCTCTGGTGTTCGACAACTGGGGCCAGGGCACCCTGGTGACCGTGTCCTCCGCTAGCACCAAGGGCCCCTCCGTGTTCCCTCTGGCCCCTTCCAGCAAGTCTACCTCCGGCGGCACAGCTGCTCTGGGCTGCCTGGTCAAGGACTACTTCCCTGAGCCTGTGACAGTGTCCTGGAACTCTGGCGCCCTGACCTCTGGCGTGCACACCTTCCCTGCCGTGCTGCAGTCCTCCGGCCTGTACTCCCTGTCCTCCGTGGTCACAGTGCCTTCAAGCAGCCTGGGCACCCAGACCTATATCTGCAACGTGAACCACAAGCCTTCCAACACCAAGGTGGACAAGCGGGTGGAGCCTAAGTCCTGCGACAAGACCCACACCTGTCCTCCCTGCCCTGCTCCTGAAGCTGCTGGCGGCCCTTCTGTGTTCCTGTTCCCTCCAAAGCCCAAGGACACCCTGATGATCTCCCGGACCCCTGAAGTGACCTGCGTGGTGGTGGACGTGTCCCACGAGGATCCTGAAGTGAAGTTCAATTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCTCGGGAGGAACAGTACAACTCCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAAGAGTACAAGTGCAAAGTCTCCAACAAGGCCCTGCCTGCCCCTATCGAAAAGACAATCTCCAAGGCCAAGGGCCAGCCTAGGGAACCCCAGGTGTACACCCTGCCACCCAGCCGGGAGGAAATGACCAAGAACCAGGTGTCCCTGACCTGTCTGGTCAAGGGCTTCTACCCTTCCGATATCGCCGTGGAGTGGGAGTCTAACGGCCAGCCTGAGAACAACTACAAGACCACCCCTCCTGTGCTGGACTCCGACGGCTCCTTCTTCCTGTACTCCAAACTGACCGTGGACAAGTCCCGGTGGCAGCAGGGCAACGTGTTCTCCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGTCCCTGTCCCTGTCTCCCGGCAAGSEQIDNO:102CAGTCCGTGCTGACCCAGCCTCCTTCTGCCTCTGGCACCCCTGGCCAGAGAGTGACCATCTCCTGCTCTGGCTCCTCCTCCAATATCGGCAACCACTACGTGAACTGGTATCAGCAGCTGCCCGGAACCGCCCCTAAGCTGCTGATCTACCGGAACAACCACCGGCCTTCCGGCGTGCCCGACCGGTTCTCCGGCTCCAAGTCTGGCACCTCCGCCTCCCTGGCCATCTCTGGCCTGCAGTCAGAGGACGAGGCCGACTACTACTGCCAGTCCTGGGACTACTCCGGCTTCTCCACCGTGTTCGGCGGAGGCACCAAGCTGACCGTGCTGGGACAGCCTAAGGCTGCCCCCAGCGTGACCCTGTTCCCCCCCAGCAGCGAGGAGCTGCAGGCCAACAAGGCCACCCTGGTGTGCCTGATCAGCGACTTCTACCCAGGCGCCGTGACCGTGGCCTGGAAGGCCGACAGCAGCCCCGTGAAGGCCGGCGTGGAGACCACCACCCCCAGCAAGCAGAGCAACAACAAGTACGCCGCCAGCAGCTACCTGAGCCTGACCCCCGAGCAGTGGAAGAGCCACAGGTCCTACAGCTGCCAGGTGACCCACGAGGGCAGCACCGTGGAAAAGACCGTGGCCCCAACCGAGTGCAGCSEQIDNO:103EVQLQESGPGLVKPGETLSLTCTVSGGSISTGSYYWNWIRQAPGKGLEWIGEIQSPGYTFYNPSLKSRVTISVDTSKNQFSLKLSSVTAADTAVYYCARTTRYWMSHILAYGMDYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGKSEQIDNO:104GAGGTGCAATTGCAAGAAAGTGGTCCGGGCCTGGTGAAACCGGGCGAAACCCTGAGCCTGACCTGCACCGTTTCCGGAGGTAGCATTTCTACTGGTTCTTATTATTGGAATTGGATTCGCCAGGCCCCTGGGAAGGGTCTCGAGTGGATTGGCGAGATTCAGTCTCCTGGTTATACTTTTTATAATCCTTCTCTTAAGTCTCGGGTGACCATTAGCGTTGATACTTCGAAAAACCAGTTTAGCCTGAAACTGAGCAGCGTGACGGCGGCGGATACGGCCGTGTATTATTGCGCGCGTACTACTCGTTATTGGATGTCTCATATTCTTGCTTATGGTATGGATTATTGGGGCCAAGGCACCCTGGTGACGGTTAGCTCAGCCTCCACCAAGGGTCCATCGGTCTTCCCCCTGGCACCCTCCTCCAAGAGCACCTCTGGGGGCACAGCGGCCCTGGGCTGCCTGGTCAAGGACTACTTCCCCGAACCGGTGACGGTGTCGTGGAACTCAGGCGCCCTGACCAGCGGCGTGCACACCTTCCCGGCTGTCCTACAGTCCTCAGGACTCTACTCCCTCAGCAGCGTGGTGACCGTGCCCTCCAGCAGCTTGGGCACCCAGACCTACATCTGCAACGTGAATCACAAGCCCAGCAACACCAAGGTGGACAAGAGAGTTGAGCCCAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGCACCTGAAGCAGCGGGGGGACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTGAGCCACGAAGACCCTGAGGTCAAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAGCAGTACAACAGCACGTACCGGGTGGTCAGCGTCCTCACCGTCCTGCACCAGGACTGGCTGAATGGCAAGGAGTACAAGTGCAAGGTCTCCAACAAAGCCCTCCCAGCCCCCATCGAGAAAACCATCTCCAAAGCCAAAGGGCAGCCCCGAGAACCACAGGTGTACACCCTGCCCCCATCCCGGGAGGAGATGACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTATCCCAGCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTACAGCAAGCTCACCGTGGACAAGAGCAGGTGGCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACGCAGAAGAGCCTCTCCCTGTCTCCGGGTAAASEQIDNO:105GATATCGTGCTGACCCAGCCGCCTTCAGTGAGTGGCGCACCAGGTCAGCGTGTGACCATCTCGTGTAGCGGCAGCAGCAGCAACATTGGTAATCATTATGTGTCTTGGTACCAGCAGTTGCCCGGGACGGCGCCGAAACTTCTGATTTATGCTAATACTAAGCGTCCCTCAGGCGTGCCGGATCGTTTTAGCGGATCCAAAAGCGGCACCAGCGCGAGCCTTGCGATTACGGGCCTGCAAAGCGAAGACGAAGCGGATTATTATTGCTCTTCTTATGATGGTTCTCAGTCTATTGTGTTTGGCGGCGGCACGAAGTTAACCGTCCTAGGTCAGCCCAAGGCTGCCCCCTCGGTCACTCTGTTCCCGCCCTCCTCTGAGGAGCTTCAAGCCAACAAGGCCACACTGGTGTGTCTCATAAGTGACTTCTACCCGGGAGCCGTGACAGTGGCCTGGAAGGCAGATAGCAGCCCCGTCAAGGCGGGAGTGGAGACCACCACACCCTCCAAACAAAGCAACAACAAGTACGCGGCCAGCAGCTATCTGAGCCTGACGCCTGAGCAGTGGAAGTCCCACAGAAGCTACAGCTGCCAGGTCACGCATGAAGGGAGCACCGTGGAGAAGACAGTGGCCCCTACAGAATGTTCASEQIDNO:106SYAIHSEQIDNO:107VISGEGSNTYYADSVKGSEQIDNO:108VMIGYGFDYSEQIDNO:109RASQSIFNYLNSEQIDNO:110DSSTLQSSEQIDNO:111LQYSGFLFTSEQIDNO:112QVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAIHWVRQAPGKGLEWVSVISGEGSNTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARVMIGYGFDYWGQGTLVTVSSSEQIDNO:113CAGGTGCAGCTGCTGGAATCAGGCGGCGGACTGGTGCAGCCTGGCGGTAGCCTGAGACTGAGCTGCGCTGCTAGTGGCTTCACCTTCTCTAGCTACGCTATTCACTGGGTCAGACAGGCCCCTGGTAAAGGCCTGGAGTGGGTGTCAGTGATTAGCGGCGAGGGCTCTAACACCTACTACGCCGATAGCGTGAAGGGCCGGTTCACTATCTCTAGGGATAACTCTAAGAACACCCTGTACCTGCAGATGAATAGCCTGAGAGCCGAGGACACCGCCGTCTACTACTGCGCTAGAGTGATGATCGGCTACGGCTTCGACTACTGGGGTCAGGGCACCCTGGTCACCGTGTCTAGCSEQIDNO:114DIQMTQSPSSLSASVGDRVTITCRASQSIFNYLNWYQQKPGKAPKLLIYDSSTLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCLQYSGFLFTFGQGTKVEIKSEQIDNO:115GATATTCAGATGACTCAGTCACCTAGTAGCCTGAGCGCTAGTGTGGGCGATAGAGTGACTATCACCTGTAGAGCCTCTCAGTCTATCTTTAACTACCTGAACTGGTATCAGCAGAAGCCCGGTAAAGCCCCTAAGCTGCTGATCTACGACTCTAGCACCCTGCAGTCAGGCGTGCCCTCTAGGTTTAGCGGTAGCGGTAGTGGCACCGACTTCACCCTGACTATCTCTAGCCTGCAGCCCGAGGACTTCGCTACCTACTACTGCCTGCAGTATAGCGGCTTCCTGTTCACCTTCGGTCAGGGCACTAAGGTCGAGATTAAGSEQIDNO:116QVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAIHWVRQAPGKGLEWVSVISGEGSNTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARVMIGYGFDYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGKSEQIDNO:117CAGGTGCAGCTGCTGGAATCAGGCGGCGGACTGGTGCAGCCTGGCGGTAGCCTGAGACTGAGCTGCGCTGCTAGTGGCTTCACCTTCTCTAGCTACGCTATTCACTGGGTCAGACAGGCCCCTGGTAAAGGCCTGGAGTGGGTGTCAGTGATTAGCGGCGAGGGCTCTAACACCTACTACGCCGATAGCGTGAAGGGCCGGTTCACTATCTCTAGGGATAACTCTAAGAACACCCTGTACCTGCAGATGAATAGCCTGAGAGCCGAGGACACCGCCGTCTACTACTGCGCTAGAGTGATGATCGGCTACGGCTTCGACTACTGGGGTCAGGGCACCCTGGTCACCGTGTCTAGCGCTAGCACTAAGGGCCCCTCCGTGTTCCCTCTGGCCCCTTCCAGCAAGTCTACCTCCGGCGGCACAGCTGCTCTGGGCTGCCTGGTCAAGGACTACTTCCCTGAGCCTGTGACAGTGTCCTGGAACTCTGGCGCCCTGACCTCTGGCGTGCACACCTTCCCTGCCGTGCTGCAGTCCTCCGGCCTGTACTCCCTGTCCTCCGTGGTCACAGTGCCTTCAAGCAGCCTGGGCACCCAGACCTATATCTGCAACGTGAACCACAAGCCTTCCAACACCAAGGTGGACAAGCGGGTGGAGCCTAAGTCCTGCGACAAGACCCACACCTGTCCTCCCTGCCCTGCTCCTGAAGCTGCTGGCGGCCCTTCTGTGTTCCTGTTCCCTCCAAAGCCCAAGGACACCCTGATGATCTCCCGGACCCCTGAAGTGACCTGCGTGGTGGTGGACGTGTCCCACGAGGATCCTGAAGTGAAGTTCAATTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCTCGGGAGGAACAGTACAACTCCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAAGAGTACAAGTGCAAAGTCTCCAACAAGGCCCTGCCTGCCCCTATCGAAAAGACAATCTCCAAGGCCAAGGGCCAGCCTAGGGAACCCCAGGTGTACACCCTGCCACCCAGCCGGGAGGAAATGACCAAGAACCAGGTGTCCCTGACCTGTCTGGTCAAGGGCTTCTACCCTTCCGATATCGCCGTGGAGTGGGAGTCTAACGGCCAGCCTGAGAACAACTACAAGACCACCCCTCCTGTGCTGGACTCCGACGGCTCCTTCTTCCTGTACTCCAAACTGACCGTGGACAAGTCCCGGTGGCAGCAGGGCAACGTGTTCTCCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGTCCCTGTCCCTGTCTCCCGGCAAGSEQIDNO:118DIQMTQSPSSLSASVGDRVTITCRASQSIFNYLNWYQQKPGKAPKLLIYDSSTLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCLQYSGFLFTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGECSEQIDNO:119GATATTCAGATGACTCAGTCACCTAGTAGCCTGAGCGCTAGTGTGGGCGATAGAGTGACTATCACCTGTAGAGCCTCTCAGTCTATCTTTAACTACCTGAACTGGTATCAGCAGAAGCCCGGTAAAGCCCCTAAGCTGCTGATCTACGACTCTAGCACCCTGCAGTCAGGCGTGCCCTCTAGGTTTAGCGGTAGCGGTAGTGGCACCGACTTCACCCTGACTATCTCTAGCCTGCAGCCCGAGGACTTCGCTACCTACTACTGCCTGCAGTATAGCGGCTTCCTGTTCACCTTCGGTCAGGGCACTAAGGTCGAGATTAAGCGTACGGTGGCCGCTCCCAGCGTGTTCATCTTCCCCCCCAGCGACGAGCAGCTGAAGAGCGGCACCGCCAGCGTGGTGTGCCTGCTGAACAACTTCTACCCCCGGGAGGCCAAGGTGCAGTGGAAGGTGGACAACGCCCTGCAGAGCGGCAACAGCCAGGAGAGCGTCACCGAGCAGGACAGCAAGGACTCCACCTACAGCCTGAGCAGCACCCTGACCCTGAGCAAGGCCGACTACGAGAAGCATAAGGTGTACGCCTGCGAGGTGACCCACCAGGGCCTGTCCAGCCCCGTGACCAAGAGCTTCAACAGGGGCGAGTGCSEQIDNO:120TFSISSEQIDNO:121GIIPIFGTANYAQKFQGSEQIDNO:122TIQSSGENKFYADSVKGSEQIDNO:123GGYGGYYYFDYSEQIDNO:124RASQSISNRLNSEQIDNO:125KGSTLQSSEQIDNO:126HQYSGLLFTSEQIDNO:127QQHKVWLTTSEQIDNO:128QQHYVWSTTSEQIDNO:129QQHYQWLTTSEQIDNO:130QVQLVQSGAEVKKPGSSVKVSCKASGGTFSTFSISWVRQAPGQGLEWMGGIIPIFGTANYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCARGGYGGYYYFDYWGQGTLVTVSSSEQIDNO:131CAGGTGCAGCTGGTGCAGTCAGGCGCCGAAGTGAAGAAACCCGGCTCTAGCGTGAAAGTCAGCTGTAAAGCTAGTGGCGGCACCTTCAGCACCTTCTCTATTAGCTGGGTCAGACAGGCCCCAGGTCAGGGCCTGGAGTGGATGGGCGGAATTATCCCTATCTTCGGCACCGCTAACTACGCTCAGAAATTTCAGGGTAGAGTGACTATCACCGCCGACGAGTCTACTAGCACCGCCTATATGGAACTGTCTAGCCTGAGATCAGAGGACACCGCCGTCTACTACTGCGCTAGGGGCGGCTACGGCGGCTATTACTACTTCGACTACTGGGGTCAGGGCACCCTGGTCACCGTGTCTAGCSEQIDNO:132DIQMTQSPSSLSASVGDRVTITCRASQSISNRLNWYQQKPGKAPKLLIYKGSTLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQHKVWLTTFGQGTKVEIKSEQIDNO:133GATATTCAGATGACTCAGTCACCTAGTAGCCTGAGCGCTAGTGTGGGCGATAGAGTGACTATCACCTGTAGAGCCTCTCAGTCTATCTCTAATAGGCTGAACTGGTATCAGCAGAAGCCCGGTAAAGCCCCTAAGCTGCTGATCTATAAGGGCTCTACCCTGCAGTCAGGCGTGCCCTCTAGGTTTAGCGGTAGCGGTAGTGGCACCGACTTCACCCTGACTATCTCTAGCCTGCAGCCCGAGGACTTCGCTACCTACTACTGTCAGCAGCACAAAGTGTGGCTGACTACCTTCGGTCAGGGCACTAAGGTCGAGATTAAGSEQIDNO:134QVQLVQSGAEVKKPGSSVKVSCKASGGTFSTFSISWVRQAPGQGLEWMGGIIPIFGTANYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCARGGYGGYYYFDYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGKSEQIDNO:135CAGGTGCAGCTGGTGCAGTCAGGCGCCGAAGTGAAGAAACCCGGCTCTAGCGTGAAAGTCAGCTGTAAAGCTAGTGGCGGCACCTTCAGCACCTTCTCTATTAGCTGGGTCAGACAGGCCCCAGGTCAGGGCCTGGAGTGGATGGGCGGAATTATCCCTATCTTCGGCACCGCTAACTACGCTCAGAAATTTCAGGGTAGAGTGACTATCACCGCCGACGAGTCTACTAGCACCGCCTATATGGAACTGTCTAGCCTGAGATCAGAGGACACCGCCGTCTACTACTGCGCTAGGGGCGGCTACGGCGGCTATTACTACTTCGACTACTGGGGTCAGGGCACCCTGGTCACCGTGTCTAGCGCTAGCACTAAGGGCCCCTCCGTGTTCCCTCTGGCCCCTTCCAGCAAGTCTACCTCCGGCGGCACAGCTGCTCTGGGCTGCCTGGTCAAGGACTACTTCCCTGAGCCTGTGACAGTGTCCTGGAACTCTGGCGCCCTGACCTCTGGCGTGCACACCTTCCCTGCCGTGCTGCAGTCCTCCGGCCTGTACTCCCTGTCCTCCGTGGTCACAGTGCCTTCAAGCAGCCTGGGCACCCAGACCTATATCTGCAACGTGAACCACAAGCCTTCCAACACCAAGGTGGACAAGCGGGTGGAGCCTAAGTCCTGCGACAAGACCCACACCTGTCCTCCCTGCCCTGCTCCTGAAGCTGCTGGCGGCCCTTCTGTGTTCCTGTTCCCTCCAAAGCCCAAGGACACCCTGATGATCTCCCGGACCCCTGAAGTGACCTGCGTGGTGGTGGACGTGTCCCACGAGGATCCTGAAGTGAAGTTCAATTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCTCGGGAGGAACAGTACAACTCCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAAGAGTACAAGTGCAAAGTCTCCAACAAGGCCCTGCCTGCCCCTATCGAAAAGACAATCTCCAAGGCCAAGGGCCAGCCTAGGGAACCCCAGGTGTACACCCTGCCACCCAGCCGGGAGGAAATGACCAAGAACCAGGTGTCCCTGACCTGTCTGGTCAAGGGCTTCTACCCTTCCGATATCGCCGTGGAGTGGGAGTCTAACGGCCAGCCTGAGAACAACTACAAGACCACCCCTCCTGTGCTGGACTCCGACGGCTCCTTCTTCCTGTACTCCAAACTGACCGTGGACAAGTCCCGGTGGCAGCAGGGCAACGTGTTCTCCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGTCCCTGTCCCTGTCTCCCGGCAAGSEQIDNO:136DIQMTQSPSSLSASVGDRVTITCRASQSISNRLNWYQQKPGKAPKLLIYKGSTLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQHKVWLTTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGECSEQIDNO:137GATATTCAGATGACTCAGTCACCTAGTAGCCTGAGCGCTAGTGTGGGCGATAGAGTGACTATCACCTGTAGAGCCTCTCAGTCTATCTCTAATAGGCTGAACTGGTATCAGCAGAAGCCCGGTAAAGCCCCTAAGCTGCTGATCTATAAGGGCTCTACCCTGCAGTCAGGCGTGCCCTCTAGGTTTAGCGGTAGCGGTAGTGGCACCGACTTCACCCTGACTATCTCTAGCCTGCAGCCCGAGGACTTCGCTACCTACTACTGTCAGCAGCACAAAGTGTGGCTGACTACCTTCGGTCAGGGCACTAAGGTCGAGATTAAGCGTACGGTGGCCGCTCCCAGCGTGTTCATCTTCCCCCCCAGCGACGAGCAGCTGAAGAGCGGCACCGCCAGCGTGGTGTGCCTGCTGAACAACTTCTACCCCCGGGAGGCCAAGGTGCAGTGGAAGGTGGACAACGCCCTGCAGAGCGGCAACAGCCAGGAGAGCGTCACCGAGCAGGACAGCAAGGACTCCACCTACAGCCTGAGCAGCACCCTGACCCTGAGCAAGGCCGACTACGAGAAGCATAAGGTGTACGCCTGCGAGGTGACCCACCAGGGCCTGTCCAGCCCCGTGACCAAGAGCTTCAACAGGGGCGAGTGCSEQIDNO:138QVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAIHWVRQAPGKGLEWVSTIQSSGENKFYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARVMIGYGFDYWGQGTLVTVSSSEQIDNO:139CAGGTGCAGCTGCTGGAATCAGGCGGCGGACTGGTGCAGCCTGGCGGTAGCCTGAGACTGAGCTGCGCTGCTAGTGGCTTCACCTTCTCTAGCTACGCTATTCACTGGGTCAGACAGGCCCCTGGTAAAGGCCTGGAGTGGGTCAGCACTATTCAGTCTAGCGGCGAGAACAAGTTCTACGCCGATAGCGTGAAGGGCCGGTTCACTATCTCTAGGGATAACTCTAAGAACACCCTGTACCTGCAGATGAATAGCCTGAGAGCCGAGGACACCGCCGTCTACTACTGCGCTAGAGTGATGATCGGCTACGGCTTCGACTACTGGGGTCAGGGCACCCTGGTCACCGTGTCTAGCSEQIDNO:140DIQMTQSPSSLSASVGDRVTITCRASQSIFNYLNWYQQKPGKAPKLLIYDSSTLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCHQYSGLLFTFGQGTKVEIKSEQIDNO:141GATATTCAGATGACTCAGTCACCTAGTAGCCTGAGCGCTAGTGTGGGCGATAGAGTGACTATCACCTGTAGAGCCTCTCAGTCTATCTTTAACTACCTGAACTGGTATCAGCAGAAGCCCGGTAAAGCCCCTAAGCTGCTGATCTACGACTCTAGCACCCTGCAGTCAGGCGTGCCCTCTAGGTTTAGCGGTAGCGGTAGTGGCACCGACTTCACCCTGACTATCTCTAGCCTGCAGCCCGAGGACTTCGCTACCTACTACTGTCACCAGTATAGCGGCCTGCTGTTCACCTTCGGTCAGGGCACTAAGGTCGAGATTAAGSEQIDNO:142QVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAIHWVRQAPGKGLEWVSTIQSSGENKFYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARVMIGYGFDYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGKSEQIDNO:143CAGGTGCAGCTGCTGGAATCAGGCGGCGGACTGGTGCAGCCTGGCGGTAGCCTGAGACTGAGCTGCGCTGCTAGTGGCTTCACCTTCTCTAGCTACGCTATTCACTGGGTCAGACAGGCCCCTGGTAAAGGCCTGGAGTGGGTCAGCACTATTCAGTCTAGCGGCGAGAACAAGTTCTACGCCGATAGCGTGAAGGGCCGGTTCACTATCTCTAGGGATAACTCTAAGAACACCCTGTACCTGCAGATGAATAGCCTGAGAGCCGAGGACACCGCCGTCTACTACTGCGCTAGAGTGATGATCGGCTACGGCTTCGACTACTGGGGTCAGGGCACCCTGGTCACCGTGTCTAGCGCTAGCACTAAGGGCCCCTCCGTGTTCCCTCTGGCCCCTTCCAGCAAGTCTACCTCCGGCGGCACAGCTGCTCTGGGCTGCCTGGTCAAGGACTACTTCCCTGAGCCTGTGACAGTGTCCTGGAACTCTGGCGCCCTGACCTCTGGCGTGCACACCTTCCCTGCCGTGCTGCAGTCCTCCGGCCTGTACTCCCTGTCCTCCGTGGTCACAGTGCCTTCAAGCAGCCTGGGCACCCAGACCTATATCTGCAACGTGAACCACAAGCCTTCCAACACCAAGGTGGACAAGCGGGTGGAGCCTAAGTCCTGCGACAAGACCCACACCTGTCCTCCCTGCCCTGCTCCTGAAGCTGCTGGCGGCCCTTCTGTGTTCCTGTTCCCTCCAAAGCCCAAGGACACCCTGATGATCTCCCGGACCCCTGAAGTGACCTGCGTGGTGGTGGACGTGTCCCACGAGGATCCTGAAGTGAAGTTCAATTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCTCGGGAGGAACAGTACAACTCCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAAGAGTACAAGTGCAAAGTCTCCAACAAGGCCCTGCCTGCCCCTATCGAAAAGACAATCTCCAAGGCCAAGGGCCAGCCTAGGGAACCCCAGGTGTACACCCTGCCACCCAGCCGGGAGGAAATGACCAAGAACCAGGTGTCCCTGACCTGTCTGGTCAAGGGCTTCTACCCTTCCGATATCGCCGTGGAGTGGGAGTCTAACGGCCAGCCTGAGAACAACTACAAGACCACCCCTCCTGTGCTGGACTCCGACGGCTCCTTCTTCCTGTACTCCAAACTGACCGTGGACAAGTCCCGGTGGCAGCAGGGCAACGTGTTCTCCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGTCCCTGTCCCTGTCTCCCGGCAAGSEQIDNO:144DIQMTQSPSSLSASVGDRVTITCRASQSIFNYLNWYQQKPGKAPKLLIYDSSTLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCHQYSGLLFTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGECSEQIDNO:145GATATTCAGATGACTCAGTCACCTAGTAGCCTGAGCGCTAGTGTGGGCGATAGAGTGACTATCACCTGTAGAGCCTCTCAGTCTATCTTTAACTACCTGAACTGGTATCAGCAGAAGCCCGGTAAAGCCCCTAAGCTGCTGATCTACGACTCTAGCACCCTGCAGTCAGGCGTGCCCTCTAGGTTTAGCGGTAGCGGTAGTGGCACCGACTTCACCCTGACTATCTCTAGCCTGCAGCCCGAGGACTTCGCTACCTACTACTGTCACCAGTATAGCGGCCTGCTGTTCACCTTCGGTCAGGGCACTAAGGTCGAGATTAAGCGTACGGTGGCCGCTCCCAGCGTGTTCATCTTCCCCCCCAGCGACGAGCAGCTGAAGAGCGGCACCGCCAGCGTGGTGTGCCTGCTGAACAACTTCTACCCCCGGGAGGCCAAGGTGCAGTGGAAGGTGGACAACGCCCTGCAGAGCGGCAACAGCCAGGAGAGCGTCACCGAGCAGGACAGCAAGGACTCCACCTACAGCCTGAGCAGCACCCTGACCCTGAGCAAGGCCGACTACGAGAAGCATAAGGTGTACGCCTGCGAGGTGACCCACCAGGGCCTGTCCAGCCCCGTGACCAAGAGCTTCAACAGGGGCGAGTGCSEQIDNO:146CAGGTGCAGCTGGTGCAGTCAGGCGCCGAAGTGAAGAAACCCGGCTCTAGCGTGAAAGTCAGCTGTAAAGCTAGTGGCGGCACCTTCAGCACCTTCTCTATTAGCTGGGTCAGACAGGCCCCAGGTCAGGGCCTGGAGTGGATGGGCGGAATTATCCCTATCTTCGGCACCGCTAACTACGCTCAGAAATTTCAGGGTAGAGTGACTATCACCGCCGACGAGTCTACTAGCACCGCCTATATGGAACTGTCTAGCCTGAGATCAGAGGACACCGCCGTCTACTACTGCGCTAGGGGCGGCTACGGCGGCTATTACTACTTCGACTACTGGGGTCAGGGCACCCTGGTCACCGTGTCTAGCSEQIDNO:147DIQMTQSPSSLSASVGDRVTITCRASQSISNRLNWYQQKPGKAPKLLIYKGSTLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQHYVWSTTFGQGTKVEIKSEQIDNO:148GATATTCAGATGACTCAGTCACCTAGTAGCCTGAGCGCTAGTGTGGGCGATAGAGTGACTATCACCTGTAGAGCCTCTCAGTCTATCTCTAATAGGCTGAACTGGTATCAGCAGAAGCCCGGTAAAGCCCCTAAGCTGCTGATCTATAAGGGCTCTACCCTGCAGTCAGGCGTGCCCTCTAGGTTTAGCGGTAGCGGTAGTGGCACCGACTTCACCCTGACTATCTCTAGCCTGCAGCCCGAGGACTTCGCTACCTACTACTGTCAGCAGCACTACGTGTGGTCTACTACCTTCGGTCAGGGCACTAAGGTCGAGATTAAGSEQIDNO:149CAGGTGCAGCTGGTGCAGTCAGGCGCCGAAGTGAAGAAACCCGGCTCTAGCGTGAAAGTCAGCTGTAAAGCTAGTGGCGGCACCTTCAGCACCTTCTCTATTAGCTGGGTCAGACAGGCCCCAGGTCAGGGCCTGGAGTGGATGGGCGGAATTATCCCTATCTTCGGCACCGCTAACTACGCTCAGAAATTTCAGGGTAGAGTGACTATCACCGCCGACGAGTCTACTAGCACCGCCTATATGGAACTGTCTAGCCTGAGATCAGAGGACACCGCCGTCTACTACTGCGCTAGGGGCGGCTACGGCGGCTATTACTACTTCGACTACTGGGGTCAGGGCACCCTGGTCACCGTGTCTAGCGCTAGCACTAAGGGCCCCTCCGTGTTCCCTCTGGCCCCTTCCAGCAAGTCTACCTCCGGCGGCACAGCTGCTCTGGGCTGCCTGGTCAAGGACTACTTCCCTGAGCCTGTGACAGTGTCCTGGAACTCTGGCGCCCTGACCTCTGGCGTGCACACCTTCCCTGCCGTGCTGCAGTCCTCCGGCCTGTACTCCCTGTCCTCCGTGGTCACAGTGCCTTCAAGCAGCCTGGGCACCCAGACCTATATCTGCAACGTGAACCACAAGCCTTCCAACACCAAGGTGGACAAGCGGGTGGAGCCTAAGTCCTGCGACAAGACCCACACCTGTCCTCCCTGCCCTGCTCCTGAAGCTGCTGGCGGCCCTTCTGTGTTCCTGTTCCCTCCAAAGCCCAAGGACACCCTGATGATCTCCCGGACCCCTGAAGTGACCTGCGTGGTGGTGGACGTGTCCCACGAGGATCCTGAAGTGAAGTTCAATTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCTCGGGAGGAACAGTACAACTCCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAAGAGTACAAGTGCAAAGTCTCCAACAAGGCCCTGCCTGCCCCTATCGAAAAGACAATCTCCAAGGCCAAGGGCCAGCCTAGGGAACCCCAGGTGTACACCCTGCCACCCAGCCGGGAGGAAATGACCAAGAACCAGGTGTCCCTGACCTGTCTGGTCAAGGGCTTCTACCCTTCCGATATCGCCGTGGAGTGGGAGTCTAACGGCCAGCCTGAGAACAACTACAAGACCACCCCTCCTGTGCTGGACTCCGACGGCTCCTTCTTCCTGTACTCCAAACTGACCGTGGACAAGTCCCGGTGGCAGCAGGGCAACGTGTTCTCCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGTCCCTGTCCCTGTCTCCCGGCAAGSEQIDNO:1SODIQMTQSPSSLSASVGDRVTITCRASQSISNRLNWYQQKPGKAPKLLIYKGSTLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQHYVWSTTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGECSEQIDNO:1S1GATATTCAGATGACTCAGTCACCTAGTAGCCTGAGCGCTAGTGTGGGCGATAGAGTGACTATCACCTGTAGAGCCTCTCAGTCTATCTCTAATAGGCTGAACTGGTATCAGCAGAAGCCCGGTAAAGCCCCTAAGCTGCTGATCTATAAGGGCTCTACCCTGCAGTCAGGCGTGCCCTCTAGGTTTAGCGGTAGCGGTAGTGGCACCGACTTCACCCTGACTATCTCTAGCCTGCAGCCCGAGGACTTCGCTACCTACTACTGTCAGCAGCACTACGTGTGGTCTACTACCTTCGGTCAGGGCACTAAGGTCGAGATTAAGCGTACGGTGGCCGCTCCCAGCGTGTTCATCTTCCCCCCCAGCGACGAGCAGCTGAAGAGCGGCACCGCCAGCGTGGTGTGCCTGCTGAACAACTTCTACCCCCGGGAGGCCAAGGTGCAGTGGAAGGTGGACAACGCCCTGCAGAGCGGCAACAGCCAGGAGAGCGTCACCGAGCAGGACAGCAAGGACTCCACCTACAGCCTGAGCAGCACCCTGACCCTGAGCAAGGCCGACTACGAGAAGCATAAGGTGTACGCCTGCGAGGTGACCCACCAGGGCCTGTCCAGCCCCGTGACCAAGAGCTTCAACAGGGGCGAGTGCSEQIDNO:152CAGGTGCAATTGGTGCAGAGCGGTGCCGAAGTGAAAAAACCGGGCAGCAGCGTGAAAGTTAGCTGCAAAGCATCCGGAGGGACGTTTTCTACTTTCTCTATCTCTTGGGTGCGCCAGGCCCCGGGCCAGGGCCTCGAGTGGATGGGCGGTATCATCCCGATCTTCGGCACTGCGAACTACGCCCAGAAATTTCAGGGCCGGGTGACCATTACCGCCGATGAAAGCACCAGCACCGCCTATATGGAACTGAGCAGCCTGCGCAGCGAAGATACGGCCGTGTATTATTGCGCGCGTGGTGGTTACGGTGGTTACTACTACTTCGATTACTGGGGCCAAGGCACCCTGGTGACTGTTAGCTCASEQIDNO:153DIQMTQSPSSLSASVGDRVTITCRASQSISNRLNWYQQKPGKAPKLLIYKGSTLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQHYQWLTTFGQGTKVEIKSEQIDNO:154GATATCCAGATGACCCAGAGCCCGAGCAGCCTGAGCGCCAGCGTGGGCGATCGCGTGACCATTACCTGCAGAGCCAGCCAGTCTATTTCTAACCGTCTGAACTGGTACCAGCAGAAACCGGGCAAAGCGCCGAAACTATTAATCTACAAAGGTTCTACTCTGCAAAGCGGCGTGCCGAGCCGCTTTAGCGGCAGCGGATCCGGCACCGATTTCACCCTGACCATTAGCTCTCTGCAACCGGAAGACTTTGCGACCTATTATTGCCAGCAGCATTACCAGTGGCTGACTACCTTTGGCCAGGGCACGAAAGTTGAAATTAAASEQIDNO:155CAGGTGCAATTGGTGCAGAGCGGTGCCGAAGTGAAAAAACCGGGCAGCAGCGTGAAAGTTAGCTGCAAAGCATCCGGAGGGACGTTTTCTACTTTCTCTATCTCTTGGGTGCGCCAGGCCCCGGGCCAGGGCCTCGAGTGGATGGGCGGTATCATCCCGATCTTCGGCACTGCGAACTACGCCCAGAAATTTCAGGGCCGGGTGACCATTACCGCCGATGAAAGCACCAGCACCGCCTATATGGAACTGAGCAGCCTGCGCAGCGAAGATACGGCCGTGTATTATTGCGCGCGTGGTGGTTACGGTGGTTACTACTACTTCGATTACTGGGGCCAAGGCACCCTGGTGACTGTTAGCTCAGCCTCCACCAAGGGTCCATCGGTCTTCCCCCTGGCACCCTCCTCCAAGAGCACCTCTGGGGGCACAGCGGCCCTGGGCTGCCTGGTCAAGGACTACTTCCCCGAACCGGTGACGGTGTCGTGGAACTCAGGCGCCCTGACCAGCGGCGTGCACACCTTCCCGGCTGTCCTACAGTCCTCAGGACTCTACTCCCTCAGCAGCGTGGTGACCGTGCCCTCCAGCAGCTTGGGCACCCAGACCTACATCTGCAACGTGAATCACAAGCCCAGCAACACCAAGGTGGACAAGAGAGTTGAGCCCAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGCACCTGAAGCAGCGGGGGGACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTGAGCCACGAAGACCCTGAGGTCAAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAGCAGTACAACAGCACGTACCGGGTGGTCAGCGTCCTCACCGTCCTGCACCAGGACTGGCTGAATGGCAAGGAGTACAAGTGCAAGGTCTCCAACAAAGCCCTCCCAGCCCCCATCGAGAAAACCATCTCCAAAGCCAAAGGGCAGCCCCGAGAACCACAGGTGTACACCCTGCCCCCATCCCGGGAGGAGATGACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTATCCCAGCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTACAGCAAGCTCACCGTGGACAAGAGCAGGTGGCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACGCAGAAGAGCCTCTCCCTGTCTCCGGGTAAASEQIDNO:156DIQMTQSPSSLSASVGDRVTITCRASQSISNRLNWYQQKPGKAPKLLIYKGSTLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQHYQWLTTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGECSEQIDNO:157GATATCCAGATGACCCAGAGCCCGAGCAGCCTGAGCGCCAGCGTGGGCGATCGCGTGACCATTACCTGCAGAGCCAGCCAGTCTATTTCTAACCGTCTGAACTGGTACCAGCAGAAACCGGGCAAAGCGCCGAAACTATTAATCTACAAAGGTTCTACTCTGCAAAGCGGCGTGCCGAGCCGCTTTAGCGGCAGCGGATCCGGCACCGATTTCACCCTGACCATTAGCTCTCTGCAACCGGAAGACTTTGCGACCTATTATTGCCAGCAGCATTACCAGTGGCTGACTACCTTTGGCCAGGGCACGAAAGTTGAAATTAAACGTACGGTGGCCGCTCCCAGCGTGTTCATCTTCCCCCCCAGCGACGAGCAGCTGAAGAGCGGCACCGCCAGCGTGGTGTGCCTGCTGAACAACTTCTACCCCCGGGAGGCCAAGGTGCAGTGGAAGGTGGACAACGCCCTGCAGAGCGGCAACAGCCAGGAAAGCGTCACCGAGCAGGACAGCAAGGACTCCACCTACAGCCTGAGCAGCACCCTGACCCTGAGCAAGGCCGACTACGAGAAGCACAAGGTGTACGCCTGCGAGGTGACCCACCAGGGCCTGTCCAGCCCCGTGACCAAGAGCTTCAACCGGGGCGAGTGTSEQIDNO:158QVQLVQSGAEVKKPGSSVKVSCKASGGTFSSYAISWVRQAPGQGLEWMGNIIPITGQTYYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCARAAYHPLVFDNWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGKSEQIDNO:159CAGGTGCAGCTGGTGCAGTCAGGCGCCGAAGTGAAGAAACCCGGCTCTAGCGTGAAAGTCAGCTGTAAAGCTAGTGGCGGCACCTTCTCTAGCTACGCTATTAGCTGGGTCAGACAGGCCCCAGGTCAGGGCCTGGAGTGGATGGGCAATATTATCCCTATCACCGGTCAGACCTACTACGCTCAGAAATTTCAGGGTAGAGTGACTATCACCGCCGACGAGTCTACTAGCACCGCCTATATGGAACTGTCTAGCCTGAGATCAGAGGACACCGCCGTCTACTACTGCGCTAGAGCCGCCTATCACCCCCTGGTGTTCGATAACTGGGGTCAGGGCACCCTGGTCACCGTGTCTAGCGCTAGCACTAAGGGCCCCTCCGTGTTCCCTCTGGCCCCTTCCAGCAAGTCTACCTCCGGCGGCACAGCTGCTCTGGGCTGCCTGGTCAAGGACTACTTCCCTGAGCCTGTGACAGTGTCCTGGAACTCTGGCGCCCTGACCTCTGGCGTGCACACCTTCCCTGCCGTGCTGCAGTCCTCCGGCCTGTACTCCCTGTCCTCCGTGGTCACAGTGCCTTCAAGCAGCCTGGGCACCCAGACCTATATCTGCAACGTGAACCACAAGCCTTCCAACACCAAGGTGGACAAGCGGGTGGAGCCTAAGTCCTGCGACAAGACCCACACCTGTCCTCCCTGCCCTGCTCCTGAAGCTGCTGGCGGCCCTTCTGTGTTCCTGTTCCCTCCAAAGCCCAAGGACACCCTGATGATCTCCCGGACCCCTGAAGTGACCTGCGTGGTGGTGGACGTGTCCCACGAGGATCCTGAAGTGAAGTTCAATTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCTCGGGAGGAACAGTACAACTCCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAAGAGTACAAGTGCAAAGTCTCCAACAAGGCCCTGCCTGCCCCTATCGAAAAGACAATCTCCAAGGCCAAGGGCCAGCCTAGGGAACCCCAGGTGTACACCCTGCCACCCAGCCGGGAGGAAATGACCAAGAACCAGGTGTCCCTGACCTGTCTGGTCAAGGGCTTCTACCCTTCCGATATCGCCGTGGAGTGGGAGTCTAACGGCCAGCCTGAGAACAACTACAAGACCACCCCTCCTGTGCTGGACTCCGACGGCTCCTTCTTCCTGTACTCCAAACTGACCGTGGACAAGTCCCGGTGGCAGCAGGGCAACGTGTTCTCCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGTCCCTGTCCCTGTCTCCCGGCAAGSEQIDNO:160QSVLTQPPSASGTPGQRVTISCSGSSSNIGNHYVNWYQQLPGTAPKLLIYRNNHRPSGVPDRFSGSKSGTSASLAISGLQSEDEADYYCQSWDYSGFSTVFGGGTKLTVLGQPKAAPSVTLFPPSSEELQANKATLVCLISDFYPGAVTVAWKADSSPVKAGVETTTPSKQSNNKYAASSYLSLTPEQWKSHRSYSCQVTHEGSTVEKTVAPTECSSEQIDNO:161CAGTCAGTCCTGACTCAGCCCCCTAGCGCTAGTGGCACCCCTGGTCAGAGAGTGACTATTAGCTGTAGCGGCTCTAGCTCTAATATCGGTAATCACTACGTGAACTGGTATCAGCAGCTGCCCGGCACCGCCCCTAAGCTGCTGATCTATAGAAACAATCACCGGCCTAGCGGCGTGCCCGATAGGTTTAGCGGATCTAAGTCAGGGACTAGCGCTAGTCTGGCTATTAGCGGCCTGCAGTCAGAGGACGAGGCCGACTACTACTGTCAGTCCTGGGACTATAGCGGCTTTAGCACCGTGTTCGGCGGAGGCACTAAGCTGACCGTGCTGGGTCAGCCTAAGGCTGCCCCCAGCGTGACCCTGTTCCCCCCCAGCAGCGAGGAGCTGCAGGCCAACAAGGCCACCCTGGTGTGCCTGATCAGCGACTTCTACCCAGGCGCCGTGACCGTGGCCTGGAAGGCCGACAGCAGCCCCGTGAAGGCCGGCGTGGAGACCACCACCCCCAGCAAGCAGAGCAACAACAAGTACGCCGCCAGCAGCTACCTGAGCCTGACCCCCGAGCAGTGGAAGAGCCACAGGTCCTACAGCTGCCAGGTGACCCACGAGGGCAGCACCGTGGAAAAGACCGTGGCCCCAACCGAGTGCAGCSEQIDNO:162GGSISTGSYSEQIDNO:163QSPGYSEQIDNO:164TTRYWMSHILAYGMDYSEQIDNO:165SSSNIGNHYSEQIDNO:166ANTSEQIDNO:167YDGSQSISEQIDNO:168EVQLQESGPGLVKPGETLSLTCTVSGGSISTGSYYWNWIRQAPGKGLEWIGEIWHSGPTFYNPSLKSRVTISVDTSKNQFSLKLSSVTAADTAVYYCARTTRYWMSHILAYGMDYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGKSEQIDNO:169GAGGTGCAATTGCAAGAAAGTGGTCCGGGCCTGGTGAAACCGGGCGAAACCCTGAGCCTGACCTGCACCGTTTCCGGAGGTAGCATTTCTACTGGTTCTTATTATTGGAATTGGATTCGCCAGGCCCCTGGGAAGGGTCTCGAGTGGATTGGCGAGATTTGGCATTCTGGTCCTACTTTTTATAATCCTTCTCTTAAGTCTCGGGTGACCATTAGCGTTGATACTTCGAAAAACCAGTTTAGCCTGAAACTGAGCAGCGTGACGGCGGCGGATACGGCCGTGTATTATTGCGCGCGTACTACTCGTTATTGGATGTCTCATATTCTTGCTTATGGTATGGATTATTGGGGCCAAGGCACCCTGGTGACGGTTAGCTCAGCCTCCACCAAGGGTCCATCGGTCTTCCCCCTGGCACCCTCCTCCAAGAGCACCTCTGGGGGCACAGCGGCCCTGGGCTGCCTGGTCAAGGACTACTTCCCCGAACCGGTGACGGTGTCGTGGAACTCAGGCGCCCTGACCAGCGGCGTGCACACCTTCCCGGCTGTCCTACAGTCCTCAGGACTCTACTCCCTCAGCAGCGTGGTGACCGTGCCCTCCAGCAGCTTGGGCACCCAGACCTACATCTGCAACGTGAATCACAAGCCCAGCAACACCAAGGTGGACAAGAGAGTTGAGCCCAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGCACCTGAAGCAGCGGGGGGACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTGAGCCACGAAGACCCTGAGGTCAAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAGCAGTACAACAGCACGTACCGGGTGGTCAGCGTCCTCACCGTCCTGCACCAGGACTGGCTGAATGGCAAGGAGTACAAGTGCAAGGTCTCCAACAAAGCCCTCCCAGCCCCCATCGAGAAAACCATCTCCAAAGCCAAAGGGCAGCCCCGAGAACCACAGGTGTACACCCTGCCCCCATCCCGGGAGGAGATGACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTATCCCAGCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTACAGCAAGCTCACCGTGGACAAGAGCAGGTGGCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACGCAGAAGAGCCTCTCCCTGTCTCCGGGTAAASEQIDNO:170DIVLTQPPSVSGAPGQRVTISCSGSSSNIGNHYVSWYQQLPGTAPKLLIYANTKRPSGVPDRFSGSKSGTSASLAITGLQSEDEADYYCSSYDGSQSIVFGGGTKLTVLGQPKAAPSVTLFPPSSEELQANKATLVCLISDFYPGAVTVAWKADSSPVKAGVETTTPSKQSNNKYAASSYLSLTPEQWKSHRSYSCQVTHEGSTVEKTVAPTECSSEQIDNO:171GATATCGTGCTGACCCAGCCGCCTTCAGTGAGTGGCGCACCAGGTCAGCGTGTGACCATCTCGTGTAGCGGCAGCAGCAGCAACATTGGTAATCATTATGTGTCTTGGTACCAGCAGTTGCCCGGGACGGCGCCGAAACTTCTGATTTATGCTAATACTAAGCGTCCCTCAGGCGTGCCGGATCGTTTTAGCGGATCCAAAAGCGGCACCAGCGCGAGCCTTGCGATTACGGGCCTGCAAAGCGAAGACGAAGCGGATTATTATTGCTCTTCTTATGATGGTTCTCAGTCTATTGTGTTTGGCGGCGGCACGAAGTTAACCGTCCTAGGTCAGCCCAAGGCTGCCCCCTCGGTCACTCTGTTCCCGCCCTCCTCTGAGGAGCTTCAAGCCAACAAGGCCACACTGGTGTGTCTCATAAGTGACTTCTACCCGGGAGCCGTGACAGTGGCCTGGAAGGCAGATAGCAGCCCCGTCAAGGCGGGAGTGGAGACCACCACACCCTCCAAACAAAGCAACAACAAGTACGCGGCCAGCAGCTATCTGAGCCTGACGCCTGAGCAGTGGAAGTCCCACAGAAGCTACAGCTGCCAGGTCACGCATGAAGGGAGCACCGTGGAGAAGACAGTGGCCCCTACAGAATGTTCASEQIDNO:172EVQLQESGPGLVKPGETLSLTCTVSGGSISTGSYYWNWIRQAPGKGLEWIGEIHGHGFTFYNPSLKSRVTISVDTSKNQFSLKLSSVTAADTAVYYCARTTRYWMSHILAYGMDYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGKSEQIDNO:173GAGGTGCAATTGCAAGAAAGTGGTCCGGGCCTGGTGAAACCGGGCGAAACCCTGAGCCTGACCTGCACCGTTTCCGGAGGTAGCATTTCTACTGGTTCTTATTATTGGAATTGGATTCGCCAGGCCCCTGGGAAGGGTCTCGAGTGGATTGGCGAGATTCATGGTCATGGTTTTACTTTTTATAATCCTTCTCTTAAGTCTCGGGTGACCATTAGCGTTGATACTTCGAAAAACCAGTTTAGCCTGAAACTGAGCAGCGTGACGGCGGCGGATACGGCCGTGTATTATTGCGCGCGTACTACTCGTTATTGGATGTCTCATATTCTTGCTTATGGTATGGATTATTGGGGCCAAGGCACCCTGGTGACGGTTAGCTCAGCCTCCACCAAGGGTCCATCGGTCTTCCCCCTGGCACCCTCCTCCAAGAGCACCTCTGGGGGCACAGCGGCCCTGGGCTGCCTGGTCAAGGACTACTTCCCCGAACCGGTGACGGTGTCGTGGAACTCAGGCGCCCTGACCAGCGGCGTGCACACCTTCCCGGCTGTCCTACAGTCCTCAGGACTCTACTCCCTCAGCAGCGTGGTGACCGTGCCCTCCAGCAGCTTGGGCACCCAGACCTACATCTGCAACGTGAATCACAAGCCCAGCAACACCAAGGTGGACAAGAGAGTTGAGCCCAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGCACCTGAAGCAGCGGGGGGACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTGAGCCACGAAGACCCTGAGGTCAAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAGCAGTACAACAGCACGTACCGGGTGGTCAGCGTCCTCACCGTCCTGCACCAGGACTGGCTGAATGGCAAGGAGTACAAGTGCAAGGTCTCCAACAAAGCCCTCCCAGCCCCCATCGAGAAAACCATCTCCAAAGCCAAAGGGCAGCCCCGAGAACCACAGGTGTACACCCTGCCCCCATCCCGGGAGGAGATGACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTATCCCAGCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTACAGCAAGCTCACCGTGGACAAGAGCAGGTGGCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACGCAGAAGAGCCTCTCCCTGTCTCCGGGTAAASEQIDNO:174DIVLTQPPSVSGAPGQRVTISCSGSSSNIGNHYVSWYQQLPGTAPKLLIYANTKRPSGVPDRFSGSKSGTSASLAITGLQSEDEADYYCSSYDGSQSIVFGGGTKLTVLGQPKAAPSVTLFPPSSEELQANKATLVCLISDFYPGAVTVAWKADSSPVKAGVETTTPSKQSNNKYAASSYLSLTPEQWKSHRSYSCQVTHEGSTVEKTVAPTECSSEQIDNO:175GATATCGTGCTGACCCAGCCGCCTTCAGTGAGTGGCGCACCAGGTCAGCGTGTGACCATCTCGTGTAGCGGCAGCAGCAGCAACATTGGTAATCATTATGTGTCTTGGTACCAGCAGTTGCCCGGGACGGCGCCGAAACTTCTGATTTATGCTAATACTAAGCGTCCCTCAGGCGTGCCGGATCGTTTTAGCGGATCCAAAAGCGGCACCAGCGCGAGCCTTGCGATTACGGGCCTGCAAAGCGAAGACGAAGCGGATTATTATTGCTCTTCTTATGATGGTTCTCAGTCTATTGTGTTTGGCGGCGGCACGAAGTTAACCGTCCTAGGTCAGCCCAAGGCTGCCCCCTCGGTCACTCTGTTCCCGCCCTCCTCTGAGGAGCTTCAAGCCAACAAGGCCACACTGGTGTGTCTCATAAGTGACTTCTACCCGGGAGCCGTGACAGTGGCCTGGAAGGCAGATAGCAGCCCCGTCAAGGCGGGAGTGGAGACCACCACACCCTCCAAACAAAGCAACAACAAGTACGCGGCCAGCAGCTATCTGAGCCTGACGCCTGAGCAGTGGAAGTCCCACAGAAGCTACAGCTGCCAGGTCACGCATGAAGGGAGCACCGTGGAGAAGACAGTGGCCCCTACAGAATGTTCASEQIDNO:176EVQLVQSGAEVKKPGSSVKVSCKASGGTFNSYAISWVRQAPGQGLEWMGNIIPHYGFAYYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCARAAYHPLVFDNWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGKSEQIDNO:177GAGGTGCAATTGGTTCAGTCTGGCGCGGAAGTGAAAAAACCGGGCAGCAGCGTGAAAGTGAGCTGCAAAGCCTCCGGAGGCACTTTTAATTCTTATGCTATTTCTTGGGTGCGCCAAGCCCCTGGGCAGGGTCTCGAGTGGATGGGCAATATTATTCCTCATTATGGTTTTGCTTATTATGCTCAGAAGTTTCAGGGTCGGGTGACCATTACCGCGGATGAAAGCACCAGCACCGCGTATATGGAACTGAGCAGCCTGCGTAGCGAAGATACGGCCGTGTATTATTGCGCGCGTGCTGCTTATCATCCTCTTGTTTTTGATAATTGGGGCCAAGGCACCCTGGTGACGGTTAGCTCAGCCTCCACCAAGGGTCCATCGGTCTTCCCCCTGGCACCCTCCTCCAAGAGCACCTCTGGGGGCACAGCGGCCCTGGGCTGCCTGGTCAAGGACTACTTCCCCGAACCGGTGACGGTGTCGTGGAACTCAGGCGCCCTGACCAGCGGCGTGCACACCTTCCCGGCTGTCCTACAGTCCTCAGGACTCTACTCCCTCAGCAGCGTGGTGACCGTGCCCTCCAGCAGCTTGGGCACCCAGACCTACATCTGCAACGTGAATCACAAGCCCAGCAACACCAAGGTGGACAAGAGAGTTGAGCCCAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGCACCTGAAGCAGCGGGGGGACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTGAGCCACGAAGACCCTGAGGTCAAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAGCAGTACAACAGCACGTACCGGGTGGTCAGCGTCCTCACCGTCCTGCACCAGGACTGGCTGAATGGCAAGGAGTACAAGTGCAAGGTCTCCAACAAAGCCCTCCCAGCCCCCATCGAGAAAACCATCTCCAAAGCCAAAGGGCAGCCCCGAGAACCACAGGTGTACACCCTGCCCCCATCCCGGGAGGAGATGACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTATCCCAGCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTACAGCAAGCTCACCGTGGACAAGAGCAGGTGGCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACGCAGAAGAGCCTCTCCCTGTCTCCGGGTAAASEQIDNO:178DIVLTQPPSVSGAPGQRVTISCSGSSSNIGNHYVNWYQQLPGTAPKLLIYRNNHRPSGVPDRFSGSKSGTSASLAITGLQSEDEADYYCQSWDYSGFSTVFGGGTKLTVLGQPKAAPSVTLFPPSSEELQANKATLVCLISDFYPGAVTVAWKADSSPVKAGVETTTPSKQSNNKYAASSYLSLTPEQWKSHRSYSCQVTHEGSTVEKTVAPTECSSEQIDNO:179GATATCGTGCTGACCCAGCCGCCTTCAGTGAGTGGCGCACCAGGTCAGCGTGTGACCATCTCGTGTAGCGGCAGCAGCAGCAACATTGGTAATCATTATGTGAATTGGTACCAGCAGTTGCCCGGGACGGCGCCGAAACTTCTGATTTATCGTAATAATCATCGTCCCTCAGGCGTGCCGGATCGTTTTAGCGGATCCAAAAGCGGCACCAGCGCGAGCCTTGCGATTACGGGCCTGCAAAGCGAAGACGAAGCGGATTATTATTGCCAGTCTTGGGATTATTCTGGTTTTTCTACTGTGTTTGGCGGCGGCACGAAGTTAACCGTCCTAGGTCAGCCCAAGGCTGCCCCCTCGGTCACTCTGTTCCCGCCCTCCTCTGAGGAGCTTCAAGCCAACAAGGCCACACTGGTGTGTCTCATAAGTGACTTCTACCCGGGAGCCGTGACAGTGGCCTGGAAGGCAGATAGCAGCCCCGTCAAGGCGGGAGTGGAGACCACCACACCCTCCAAACAAAGCAACAACAAGTACGCGGCCAGCAGCTATCTGAGCCTGACGCCTGAGCAGTGGAAGTCCCACAGAAGCTACAGCTGCCAGGTCACGCATGAAGGGAGCACCGTGGAGAAGACAGTGGCCCCTACAGAATGTTCASEQIDNO:180EVQLVQSGAEVKKPGSSVKVSCKASGGTFNSYAISWVRQAPGQGLEWMGNIIPYSGFAYYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCARAAYHPLVFDNWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGKSEQIDNO:181GAGGTGCAATTGGTTCAGTCTGGCGCGGAAGTGAAAAAACCGGGCAGCAGCGTGAAAGTGAGCTGCAAAGCCTCCGGAGGCACTTTTAATTCTTATGCTATTTCTTGGGTGCGCCAAGCCCCTGGGCAGGGTCTCGAGTGGATGGGCAATATTATTCCTTATTCTGGTTTTGCTTATTATGCTCAGAAGTTTCAGGGTCGGGTGACCATTACCGCGGATGAAAGCACCAGCACCGCGTATATGGAACTGAGCAGCCTGCGTAGCGAAGATACGGCCGTGTATTATTGCGCGCGTGCTGCTTATCATCCTCTTGTTTTTGATAATTGGGGCCAAGGCACCCTGGTGACGGTTAGCTCAGCCTCCACCAAGGGTCCATCGGTCTTCCCCCTGGCACCCTCCTCCAAGAGCACCTCTGGGGGCACAGCGGCCCTGGGCTGCCTGGTCAAGGACTACTTCCCCGAACCGGTGACGGTGTCGTGGAACTCAGGCGCCCTGACCAGCGGCGTGCACACCTTCCCGGCTGTCCTACAGTCCTCAGGACTCTACTCCCTCAGCAGCGTGGTGACCGTGCCCTCCAGCAGCTTGGGCACCCAGACCTACATCTGCAACGTGAATCACAAGCCCAGCAACACCAAGGTGGACAAGAGAGTTGAGCCCAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGCACCTGAAGCAGCGGGGGGACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTGAGCCACGAAGACCCTGAGGTCAAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAGCAGTACAACAGCACGTACCGGGTGGTCAGCGTCCTCACCGTCCTGCACCAGGACTGGCTGAATGGCAAGGAGTACAAGTGCAAGGTCTCCAACAAAGCCCTCCCAGCCCCCATCGAGAAAACCATCTCCAAAGCCAAAGGGCAGCCCCGAGAACCACAGGTGTACACCCTGCCCCCATCCCGGGAGGAGATGACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTATCCCAGCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTACAGCAAGCTCACCGTGGACAAGAGCAGGTGGCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACGCAGAAGAGCCTCTCCCTGTCTCCGGGTAAASEQIDNO:182DIVLTQPPSVSGAPGQRVTISCSGSSSNIGNHYVNWYQQLPGTAPKLLIYRNNHRPSGVPDRFSGSKSGTSASLAITGLQSEDEADYYCQSWDYSGFSTVFGGGTKLTVLGQPKAAPSVTLFPPSSEELQANKATLVCLISDFYPGAVTVAWKADSSPVKAGVETTTPSKQSNNKYAASSYLSLTPEQWKSHRSYSCQVTHEGSTVEKTVAPTECSSEQIDNO:183GATATCGTGCTGACCCAGCCGCCTTCAGTGAGTGGCGCACCAGGTCAGCGTGTGACCATCTCGTGTAGCGGCAGCAGCAGCAACATTGGTAATCATTATGTGAATTGGTACCAGCAGTTGCCCGGGACGGCGCCGAAACTTCTGATTTATCGTAATAATCATCGTCCCTCAGGCGTGCCGGATCGTTTTAGCGGATCCAAAAGCGGCACCAGCGCGAGCCTTGCGATTACGGGCCTGCAAAGCGAAGACGAAGCGGATTATTATTGCCAGTCTTGGGATTATTCTGGTTTTTCTACTGTGTTTGGCGGCGGCACGAAGTTAACCGTCCTAGGTCAGCCCAAGGCTGCCCCCTCGGTCACTCTGTTCCCGCCCTCCTCTGAGGAGCTTCAAGCCAACAAGGCCACACTGGTGTGTCTCATAAGTGACTTCTACCCGGGAGCCGTGACAGTGGCCTGGAAGGCAGATAGCAGCCCCGTCAAGGCGGGAGTGGAGACCACCACACCCTCCAAACAAAGCAACAACAAGTACGCGGCCAGCAGCTATCTGAGCCTGACGCCTGAGCAGTGGAAGTCCCACAGAAGCTACAGCTGCCAGGTCACGCATGAAGGGAGCACCGTGGAGAAGACAGTGGCCCCTACAGAATGTTCASEQIDNO:184GGSISTGSYSEQIDNO:185NHMGISEQIDNO:186TTRYWMSHILAYGMDYSEQIDNO:187SSSNIGNHYSEQIDNO:188ANTSEQIDNO:189YDGSQSISEQIDNO:190GGSISTGSYSEQIDNO:191WHSGPSEQIDNO:192TTRYWMSHILAYGMDYSEQIDNO:193SSSNIGNHYSEQIDNO:194ANTSEQIDNO:195YDGSQSISEQIDNO:196EIHGHGFTFYNPSLKSSEQIDNO:197GGSISTGSYSEQIDNO:198HGHGFSEQIDNO:199TTRYWMSHILAYGMDYSEQIDNO:200SSSNIGNHYSEQIDNO:201ANTSEQIDNO:202YDGSQSISEQIDNO:203GGTFNSYSEQIDNO:204IPIYGTSEQIDNO:205AAYHPLVFDNSEQIDNO:206SSSNIGNHYSEQIDNO:207RNNSEQIDNO:208WDYSGFSTSEQIDNO:209GGTFNSYSEQIDNO:210NPFYIGESEQIDNO:211AAYHPLVFDNSEQIDNO:212SSSNIGNHYSEQIDNO:213RNNSEQIDNO:214WDYSGFSTSEQIDNO:215GGTFNSYSEQIDNO:216IPHYGFSEQIDNO:217AAYHPLVFDNSEQIDNO:218SSSNIGNHYSEQIDNO:219RNNSEQIDNO:220WDYSGFSTSEQIDNO:221GGTFNSYSEQIDNO:222IPYSGFSEQIDNO:223AAYHPLVFDNSEQIDNO:224SSSNIGNHYSEQIDNO:225RNNSEQIDNO:226WDYSGFSTSEQIDNO:227GGTFNSYSEQIDNO:228NPFYIGESEQIDNO:229AAYHPLVFDNSEQIDNO:230SSSNIGNHYSEQIDNO:231RNNSEQIDNO:232WDYSGFSTSEQIDNO:233GGTFNSYSEQIDNO:234IPMTGQSEQIDNO:235AAYHPLVFDNSEQIDNO:236SSSNIGNHYSEQIDNO:237RNNSEQIDNO:238WDYSGFSTSEQIDNO:239NIIPITGQTYYAQKFQGSEQIDNO:240GGTFSTFSEQIDNO:241IPIFGTSEQIDNO:242GGYGGYYYFDYSEQIDNO:243SQSISNRSEQIDNO:244KGSSEQIDNO:245HKVWLTSEQIDNO:246GGTFSTFSEQIDNO:247IPIFGTSEQIDNO:248GGYGGYYYFDYSEQIDNO:249SQSISNRSEQIDNO:250KGSSEQIDNO:251HYVWSTSEQIDNO:252GGTFSTFSEQIDNO:253IPIFGTSEQIDNO:254GGYGGYYYFDYSEQIDNO:255SQSISNRSEQIDNO:256KGSSEQIDNO:257HYQWLTSEQIDNO:258GFTFSSYSEQIDNO:259QSSGENSEQIDNO:260VMIGYGFDYSEQIDNO:261SQSIFNYSEQIDNO:262DSSSEQIDNO:263YSGLLF当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1