一种异质细胞三维打印系统和方法与流程
本发明属于生物制造和细胞打印领域,具体地涉及到一种异质细胞精确受控组装设备和工艺。
背景技术:
近年来,细胞打印技术在组织工程学、病理模型构建、药物筛选与检测、细胞行为研究等领域发挥着越来越重要的作用。在组织工程领域,细胞打印技术实现了异种细胞的三维受控组装,可以在体外构建出复杂组织的结构体,促进了组织工程向规模化、自动化、计算机辅助加工化的方向发展;在病理模型构建领域,细胞打印可以将病变细胞(如肿瘤细胞)与正常细胞进行特定顺序的组装,为医学工作者研究细胞癌变机理提供了有效的研究手段;在药物筛选与检测方面,利用细胞打印技术制造的细胞芯片可以降低药物筛选的成本、缩短药物筛选的周期以及减少动物实验等;在细胞行为研究方面,利用细胞打印技术还可以对特定种类和数量的细胞进行组装和排列,从而为研究细胞的增殖、迁移和分化等行为提供途径。
体外三维细胞模型的人工构建是国际生物医学及工程学科研究的最新前沿。2000年在德国Freiburg大学召开的“RP(快速原型)在生物医学的应用研讨会”首次探讨了以RP为基础的组织工程支架和器官打印技术(cell/organ printing)的发展。随后以组织器官修复与重建为目的,开发了各种基于微滴喷射的细胞三维直接受控组装和器官打印的新工艺。包括用于组织构建的基于微喷嘴的连续细胞挤压;低温沉积组织工程支架制造工艺;基于喷墨技术的细胞打印;细胞和细菌的激光直接写入;细胞和细菌的微接触印刷;通过机械的、光学的、电学的、磁的、超声的以及离子的方法进行的 细胞操纵及通过照相或电蚀刻以及软光刻技术进行的细胞仿制。然而人体组织系统极其复杂,如:体内肿瘤组织普遍具有异质性,使得使得肿瘤学、药理学、药物开发和临床治疗等研究变得空前复杂。目前的细胞体外三维细胞模型的人工构建技术均采用单一的细胞打印方式,单一的细胞打印方式均存在各自的弊端,如微喷嘴的连续细胞挤压式有利于构建整体的细胞架构,而无法完成滴落式细胞打印的定点喷射,细胞和细菌的激光直接写入的方式有利于完成细胞的单个打印,但在无法完成细胞的整体架构的构建。若将不同的打印方式进行结合,刚可将不同打印方式的优点结合,完成高度仿生的复杂三维异质性肿瘤模型的打印,以满足对多细胞复杂结构组织的仿生构建要求。但是不同的打印方式的驱动不同,控制单元也截然不同,因此目前还没有将两种不同驱动的打印方式相结合的细胞打印设备。
技术实现要素:
(一)要解决的技术问题
针对现有技术中没有可将两种不同驱动的打印方式结合在一起的打印设备,而无法完成异质细胞三维打印的缺陷,本发明提供一种将两种不同驱动的打印方式结合在一起的异质细胞三维打印系统。
(二)技术方案
本发明所述的异质细胞三维打印系统,包括运动平台、固定于所述运动平台上的挤出式细胞打印机构和滴落式细胞打印机构,用于观测和反馈细胞打印情况的观测单元以及控制单元;
所述控制单元首先控制挤出式细胞打印机构完成立体细胞水凝胶结构的打印,然后控制滴落式细胞打印机构在所述立体细胞水凝胶结构上完成单个或多个细胞的打印;在打印的过程中,所述控制单元控制所述运动平台的三维运动,以实现在所需位置的打印。在打印的过程中,运动平台需在XY轴和Z轴方向进行较高运动精度的运动,挤 出式细胞打印中需要进行连续信号的输出,滴落式细胞打印中需进行中脉冲信号的输出,本发明所述的控制单元可满足上述三种工作目标,而且具有较高的稳定性和精度。
本发明中,所述控制单元包括工控机、PMAC控制器、信号发生器和功率放大器;
所述工控机与所述PMAC控制器和所述观测单元相连接,用于接收反馈信息和向PMAC控制器发出指令;所述PMAC控制器控制运动平台的三维运动和所述挤出式细胞打印机的挤出;进一步的,所述PMAC控制器还调整滴落式细胞打印机构的位置,通过控制信号发生器和功率放大器来控制细胞的滴落式打印。
本发明中,所述挤出式细胞打印机构包括固定于所述运动平台的Z轴上的注射器驱动电机、压头、注射器及其喷头和保温套筒,其中,所述喷头安装在注射器口部,注射器固定在保温套筒内;注射器驱动电机在所述PMAC控制器的控制下,通过所述压头推动注射器活塞实现内部液体的连续挤出。
本发明中,所述滴落式细胞打印机构包括固定于所述运动平台的Z轴上的位置微调电机、压头、往复运动机构和与之相连的滴落式细胞打印用微喷头;其中,所述微喷头固定在往复运动机构上,所述往复运动机构依次与压头和位置微调电机相连;所述PMAC控制器与位置微调电机相连,用于微调所述微喷头的位置;所述PMAC控制器还控制信号发生器产生波形,所述波形经所述功率放大器放大后输送到所述往复运动机构上,通过往复运动机构的运动实现滴落式打印。
优选的,往复运动机构选择为封装压电陶瓷。利用压电陶瓷在接受电信号后产生伸长和收缩的特点,带动微喷头实现往复运动,利用往复运动中的摩擦力和惯性力实现液滴的滴落。
本发明中,所述观测单元包括水平观测显微镜和竖直观测显微镜。其中,水平显微镜对喷头工作高度和喷头内细胞排布进行观测, 竖直显微镜对水凝胶中的细胞进行定位。通过两个显微镜同时从两个方向进行观察,一方面可以避免倾斜观察所造成的视场误差,提高观测的精度;另一方面根据观测得到的结果可以对滴落式打印的液滴位置进行确定,提供了一种根据水凝胶中细胞分布进行打印的实时反馈的随形打印方法。
本发明的另一目的是提供利用本发明所述的打印系统进行异质细胞三维打印的方法,其特征在于,包括如下步骤:
1)对所述异质细胞三维打印系统进行灭菌处理;
2)根据预先设计的模型,所述控制单元控制所述运动平台的Z轴高度和XY位置,并控制所述挤出式细胞打印机构进行打印,得到立体细胞水凝胶结构;
3)根据预先设计的模型和观测单元反馈的信息或仅根据预先设计的模型,所述控制单元调节所述运动平台的Z轴高度和XY位置,并通过对滴落式细胞打印机构位置的微调,实现双喷头工作状态切换和滴落式细胞打印的位置定位;
4)所述控制单元控制所述滴落式细胞打印机构通过基于交变滞惯力驱动的细胞打印技术,在所述立体细胞水凝胶结构上进行滴落式打印,得到异质细胞三维模型;
5)针对不同的模型需要,重复步骤3)和4),直至构建出所需的异质细胞三维模型。
本发明中,所述微挤出式细胞打印中水凝胶的凝结采用物理交联和化学交联,所述物理交联中,通过低温使所述立体细胞水凝胶结构中的明胶组分发生交联,变成凝胶状态;所述化学交联中,通过钙离子使所述立体细胞水凝胶结构中的海藻酸组分进行交联;具体地,在所述化学交联的过程中,向打印得到的立体细胞水凝胶结构中加入2~4%的CaCl2溶液至浸没,并在室内条件下保持2~4min,然后吸走溶液,便实现了所述立体细胞水凝胶结构的化学交联。打印完毕后水 凝胶丝的直径在100-800微米之间。
本发明中,所述滴落式细胞打印在挤出式细胞打印完毕后立即开始,或者在所述宏观水凝胶丝培养形成细胞团簇后再进行。所述两种不同的打印过程中,前者在构建微环境过程中需利用细胞的增值、迁移和自组装的特性,后者则直接构建出与体内类似的团簇状肿瘤组织。两种不同的方法,得到的模型存在一定的区别,可分别对细胞模型产生过程中的细胞生长等生理活动和肿瘤药物检测等进行医学研究。
本发明中,所述滴落式细胞打印的最终细胞数目是单个或多个。利用该特点,在构建异质细胞体外模型中提出了两种工艺。一是通过挤出式细胞打印水凝胶丝中的细胞生长增殖形成细胞团簇,并在其周围滴落打印单个细胞形成微环境;另一种是通过挤出式细胞打印水凝胶丝中的细胞均匀分布形成微环境细胞,并通过滴落打印向水凝胶丝中添加较大细胞密度的细胞团簇,所述较大细胞浓度为106~107;针对这两种工艺可以应用到不同需求的体外细胞模型构建中。
本发明中,所述滴落式细胞打印的细胞种类与所述宏观水凝胶丝结构中的细胞种类相同,或者为与所述宏观水凝胶丝结构中细胞种类不同的一种或多种细胞。当采用同种细胞时,通过滴落式细胞打印方法可以实现局部细胞密度的改变,可以研究不同细胞密度对细胞形态、增殖方式和自组装方式的影响。当采用多种细胞时,可对不同细胞种类之间的相互作用进行研究,也可构建出与体内多种细胞相类似的人工替代物。
本发明中,所述玻璃微喷管可以悬于含细胞结构体支架的上方一定高度进行特定图案或形状的滴落式细胞打印,也可以在支架的网格空隙处进行滴落式细胞打印,以实现在支架特定位置种植特定数量细胞。该方法可以实现在不同的位置的微滴的滴落,保证水凝胶丝内部不同种类细胞分布的可控,保证异质细胞之间的空间排布和信息交 流,避免了由于细胞空间位置分离而造成的异质细胞模型失效。
(三)有益效果
1)本发明综合利用微挤出式细胞打印技术和滴落式细胞精确打印技术进行集成式异质细胞精确受控组装,最大的特点是既可以实现宏观细胞团簇的打印,又可以实现在细胞团簇特定位置进行微观单个细胞的定点打印,并且打印的细胞团簇和打印的单个细胞可以是任何两种或多种异种细胞;本发明在滴落式打印的过程中,通过加大细胞溶液中细胞的密度,可直接进行团簇细胞的打印,避免了形成团簇需要进行的培养过程。是一种构建异质细胞模型方法中的新工艺。
2)该技术中挤出式细胞打印采用两步交联法,即包括第一步物理交联和第二步化学交联;物理交联是指通过低温使材料中的明胶组分发生交联,变成凝胶状态;化学交联是指通过钙离子使材料中的海藻酸组分进行交联。两步交联微挤出式打印技术可以高效构建高密度的细胞/水凝胶材料结构体,得到100~800微米的水凝胶丝结构,研究发现细胞在100-800微米水凝胶丝中经过培养后会聚集成三维团簇状细胞结构,很高程度的模拟了体内细胞组装和聚集的形式,具有重要的仿生价值;
3)本发明中而滴落式细胞精确打印采用的是基于交变滞惯力驱动的细胞打印技术,该技术通过交替变化的粘性力和惯性力作用可以精确的控制单个细胞的打印和组装,实现以单个细胞为最小单元的细胞模型构建,并且该工艺在打印过程中不产生高温、高压、强电场和流体流涎现象,细胞打印后成活率在90%以上,非常适合细胞打印工艺。总之,本发明集成了两步交联微挤出式打印技术和基于交变滞惯力驱动的滴落式细胞打印技术既保证了宏观细胞团簇的高效构建,有保证了微观单个细胞在团簇细胞上的定点打印,具有重要的病理学、药理学应用潜力。
附图说明
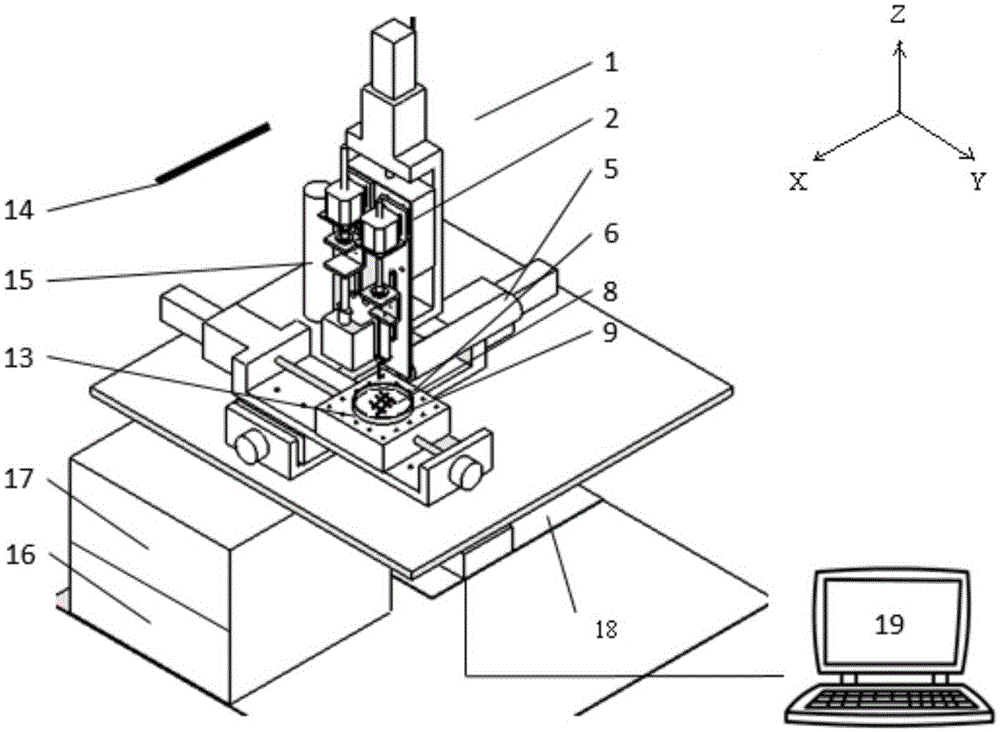
图1为异质细胞三维打印系统结构示意图
图2为异质细胞三维打印系统喷头结构放大示意图
图3为在刚打印完毕的含细胞水凝胶支架上进行滴落式细胞打印示意图;
图4为滴落式细胞打印喷头悬在水凝胶支架外,在水凝胶支架中细胞团簇的特定位置上进行滴落式细胞打印。
图5为滴落式细胞打印喷头插入水凝胶支架内,在水凝胶支架中细胞团簇的特定位置上进行滴落式细胞打印。
图6为在挤出式细胞打印的水凝胶支架上进行多个细胞滴落式打印,打印得到细胞团簇示意图。
图中:1、设备成型室,2、Z轴运动平台,3、喷头夹持机构,4、压电陶瓷,5、水平观测显微镜,6、XY轴运动平台,7、滴落式细胞打印用微喷头,8、细胞/水凝胶材料结构体,9、培养皿,10、注射器驱动电机,11、保温套筒,12、1mL注射器及喷头,13、半导体制冷片,14、紫外灭菌灯,15、垂直观测显微镜,16、信号发生器,17、功率放大器,18、PMAC控制器,19、工控机,20位置微调电机,21压头,22螺杆。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。
实施例1
本实施例涉及一种异质细胞三维细胞打印系统,包括运动平台和固定于所述运动平台上的挤出式细胞打印机构和滴落式细胞打印机构,用于观测细胞打印位置的观测单元和控制单元;
所述控制单元先控制挤出式细胞打印机构完成细胞水凝胶结构的打印,然后控制滴落式细胞打印结构在所述细胞水凝胶结构上完成单个细胞的打印;在打印的过程中,控制单元控制运动平台在X、Y、Z三个方向移动,以实现所述挤出式细胞打印机构和所述滴落式细胞 打印机构在不同位置的打印。
实施例2
本实施例涉及一种异质细胞三维打印系统,其结构如图1和图2所示同实施例1相比,其区别在于,所述打印系统安置于成型室1中,所述成型室中设有紫外灭菌灯14;
所述挤出式细胞打印机构固定于运动平台的Z轴运动平台2上,由注射器驱动电机10、保温套筒11,1mL注射器及其喷头12组成;所述滴落式细胞打印机构由位置微调电机20、压头21、压电陶瓷4和滴落式细胞打印用微喷头7组成,均通过喷头夹持机构3固定于所述Z轴运动平台2上;
所述观测单元包括设于喷头夹持机构3上的水平观测显微镜5和设于所述成型室1底部的垂直观测显微镜15;
所述控制单元包括信号放大器16、功率放大器17、PMAC控制器18和工控机19;其中,所述工控机19为计算机,计算机与所述PMAC控制器18和所述水平观测显微镜5、所述竖直显微镜15相连。在运动位置调节上,所述PMAC控制器18分别与所述XY轴运动平台6、所述Z轴运动平台2相连,并控制各轴的运动。在挤出式细胞打印控制上,所述PMAC控制器18与所述注射器驱动电机10相连,并对其运动速度等参数进行调整。在滴落式细胞打印控制上,所述PMAC控制器18与信号发生器16和位置微调电机20相连。所述PMAC控制器18控制信号发生器16产生波形,信号发生器16产生的波形经所述功率放大器17放大后输送到所述压电陶瓷4上进行微滴的产生。
所述细胞承载器包括位于所述XY轴运动平面上的半导体制冷片13,置于其上的培养皿9和放于所述培养皿的细胞/水凝胶材料结构体8。
实施例3
本实施例涉及一种利用本发明所述的异质细胞三维打印系统进 行肿瘤细胞模型打印的方法,其特征在于,包括如下步骤:
1)配制用于挤出式细胞打印的细胞溶液。将含有A549细胞的培养液离心后在培养基中进行悬浮,达到4×106/ml的细胞密度。之后将所述A549细胞培养液、4%海藻酸钠溶液和20%明胶溶液按照体积比为1:1:1的比例进行混合,并使最终的细胞密度在1×106/ml左右。
2)配置用于滴落式细胞打印的细胞溶液。将所述A549细胞培养液进行吸取和稀释,使得最终的细胞密度在5×104/ml。其中,值得说明的是,细胞溶液中的细胞密度根据不同的模型需要可以进行调整,不仅局限于现用的细胞密度。
3)打开紫外灭菌灯15~30min,对所述细胞打印系统进行灭菌处理;
4)分别将所述用于挤出式细胞打印用细胞溶液和滴落式细胞打印用细胞溶液装入所述注射器中和微喷管中。
5)启动所述控制单元和观测单元,结合设计的宏观模型,首先进行挤出式细胞打印。模型信息通过所述工控机的编译变成代码发送给所述PMAC控制器,所述PMAC控制器则根据得到的代码,控制包括XY轴运动平台、Z轴运动平台的运动,以及注射器驱动电机的运动。上述电机轴之间的相互配合和联动便实现了水凝胶丝的挤出和打印。同时,观测单元中水平观测显微镜和竖直观测显微镜可以对打印得到的水凝胶丝的情况进行反馈,从工控机的显示端口上便可以得到水凝胶的成形质量等相关信息。
6)启动所述控制单元和观测单元,结合模型设计和实时观测结果,进行滴落式细胞打印。滴落打印位置根据预先设计模型及水凝胶丝中实际细胞分布进行判断。观测单元中水平观测显微镜和竖直观测显微镜通过光学观察可以得到水凝胶丝中细胞的具体位置等相关信息,从工控机的显示端口上得到相关信息后,通过向PMAC控制器输入代码指令包括XY轴运动平台、Z轴运动平台和所述位置微调电机的 运动,使得微喷管管口的位置处在待滴落位置的上方。随后,通过工控机向所述PMAC控制器输出代码指令,所述PMAC控制器控制信号发生器输出预先设定好的波形给所述功率放大器,所述功率放大器将信号放大后驱动压电陶瓷的振动。压电陶瓷振动一次后,便实现液滴的一次形成和滴落。
7)重复步骤6),可以得到异质肿瘤细胞模型。
本实施例所述打印方式为挤出式打印完成后立即进行滴落式打印,其示意图如图3。
实施例4
同实施例3相比,本实施例进行肿瘤细胞模型的打印,在所述步骤6)中,滴落式细胞滴落式细胞打印喷头悬在水凝胶支架外,在水凝胶支架中细胞团簇的特定位置上进行滴落式细胞滴落式细胞打印,其示意图如图4。通过该方法打印的异质细胞模型,培养过程中利用细胞的增值、移动和自组装技术,构建的细胞模型过程中可对细胞的生命活动可进行测试,在进行肿瘤细胞迁移和肿瘤发病机理研究上具有潜在应用。
实施例5
同实施例3相比,本实施例进行肿瘤细胞模型的打印,在所述步骤6)中,滴落式细胞滴落式细胞打印喷头伸入水凝胶支架内,在水凝胶支架中细胞团簇的特定位置上进行滴落式细胞滴落式细胞打印,其示意图如图5。通过该方法打印的异质细胞模型中,异质细胞之间的距离更近,细胞之间的相互作用更直接,构建的细胞模型对体外肿瘤模型的构建,对细胞间相互作用的影响和肿瘤药物检测上具有应用。
实施例6
同实施例3相比,本实施例进行肿瘤细胞模型的打印,在所述步骤2)中,调节滴落式打印的细胞浓度至4×106/ml,提高细胞密度后, 便可以通过滴落式细胞打印的方法构建细胞团簇。与实施例3)中的方法相比,避免了形成团簇需要进行的培养过程。是一种构建异质细胞模型方法中的新工艺。其打印示意图如图6。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种faslg基因的原位杂交检测试剂盒及其检测方法和应用的制作方法
- 一种KiSS1基因的原位杂交检测试剂盒及其检测方法和应用的制作方法
- 一种lamb1基因的原位杂交检测试剂盒及其检测方法和应用的制作方法
- 一种mcm2基因的原位杂交检测试剂盒及其检测方法和应用的制作方法
- 一种mmp2基因的原位杂交检测试剂盒及其检测方法和应用的制作方法
- 一种mta1基因的原位杂交检测试剂盒及其检测方法和应用的制作方法
- 一种opn基因的原位杂交检测试剂盒及其检测方法和应用的制作方法
- 一种pcna基因的原位杂交检测试剂盒及其检测方法和应用的制作方法
- 一种plau基因的原位杂交检测试剂盒及其检测方法和应用的制作方法
- 一种Survivin基因的原位杂交检测试剂盒及其检测方法和应用的制作方法