20(R)-原人参三醇及衍生物的制备方法和医药用途与流程
本发明涉及天然药物用途领域,涉及20(R)-原人参三醇(PPT)及衍生物的制备方法和医药用途,具体涉及一系列人参皂苷酸降解化合物及其在制备降血糖药物中的应用。
背景技术:
随着生活水平的提高,糖尿病(diabetes mellitus,DM)已成为严重危害人类健康的公共卫生问题,而我国是糖尿病患病率增长最快的国家之一,目前为糖尿病第二大国。糖尿病的主要危害是高血糖导致多系统、多脏器并发症的发生,多脏器并发症是糖尿病引起死亡及残疾的主要原因。近年来,餐后血糖波动和日内最大血糖波动是造成Ⅱ型糖尿病患者血管内皮损伤的重要因素。餐后高血糖是心血管疾病死亡的独立危险因素,其作用独立于持续血糖水平。将餐后血糖水平保持接近正常范围,是控制血糖波动、预防心脑血管疾病的发生、降低心脑血管疾病死亡率的重要途径之一。血糖的主要来源是食物中的糖类。碳水化合物经过α-葡萄糖苷酶催化水解,生成单糖才能被吸收,而催化水解碳水化合物的α-葡萄糖苷酶主要分布于小肠黏膜刷状缘上,其包含有α-淀粉酶、α-糊精酶、麦芽糖酶、蔗糖酶和乳糖酶等。因此α-葡萄糖苷酶是调节食物来源血糖的关键酶,成为调控餐后血糖药物的作用靶酶,α-葡萄糖苷酶抑制剂(α-glucosidase inhibitor,AGI)是控制餐后血糖的对症治疗药物。蛋白质络氨酸磷酸酶1B(PTP1B)是一种在体内广泛表达的胞内蛋白质络氨酸磷酸酶,在调节胰岛素敏感性和能量代谢的过程中起着重要作用。通过抑制PTP1B可增加胰岛素和蛋白的活性,同时也为降糖先导化合物的确定提供了依据。
人参皂苷为人参中的主要活性成分,现代药理学研究表明,人参皂苷在酸性或者碱性的条件下水解所得的人参皂苷元具有更强的药理活性,传统的水解主要运用强酸或者强碱对人参总皂苷进行水解,将所得水解产物运用简单的硅胶柱层析进行分离,从而得到活性皂苷元,该方法具有制备周期过长,使用溶剂单一,且多具有毒性,大大的限制了生产效率的提高。本发明首次采用超声和摇床进行酸水解人参总皂苷,极大的提高了人参总皂苷的水解效率,使其易于工业化放大生产。所得水解产物我们分别利用传统的硅胶柱层析与大孔树脂相结合的方法的进行分离,利用大孔树脂对皂苷的富集特性,极大的提高了对皂苷元的生产效率,降低了能耗,同时采用多种流动相系统进行洗脱制备,丰富了制备方法,减少了部分流动相高毒性对人体造成的危害,避免了次生危害的产生。首次利用高效液相色谱法建立25-OH-PPT、25-OCH3-PPT、PPT和PT的同步测定方法,指导利用制备HPLC对所得水解产物进行分离制备,同时在HPLC分离制备时采用盲分法和连续进样法对水解产物进行分离制备,极大的减少了时间和物料的损耗,提高了生产效率,为降血糖活性皂苷元的高效快速制备提供了有力的技术支持。
人参为我国药典收载品种,为五加科(Araliaceae)人参属(Panax)植物人参(Panax ginseng C.A.Meyer)的干燥根及根茎,是传统的益气补血中药,主产于我国东北地区,是驰名中外、老幼皆知的名贵药材。《神农本草经》将人参列为上品,有人参“补五脏、安精神、定魂魄、止惊悸、除邪气、明目、开心、益智,久服轻身延年”的记载。人参多年来被用作贵重的药物治疗各种虚弱病症、补血等,而临床试验有力的证明了人参及其有效活性成分人参皂苷具有抗糖尿病的作用。人参皂苷为人参中分离得到的主要活性成分,有学者对人参根和人参果的提取物进行了降血糖活性研究,用具有肥胖与高血糖症状的ob/ob小鼠为模型,通过测定各个小组中的小鼠的血糖变化,结果表明,人参果与人参根组小鼠的血糖都显著降低。与此同时,实验结果表明人参果组动物体重明显降低。表明人参果降血糖的机理可能与抗肥胖作用有关,改善血脂代谢相关(Kim SH,Park KS.Effect of Panax ginseng extract on lipid metabolism in humans[J].Pharmacol Res.2003,48(5):511-513)。Attele等(Attele AS,Zhou YP,Xie JT et al.Antidiabetic effects of Panax ginseng berry extract the identification of an effective component[J].Diabetes.2002.51(6):1851-1858)通过研究表明人参皂苷能够显著改善高血糖患者腹腔血糖含量,起到明显的降血糖作用,尤其对II型糖尿病的效果显著。有研究表明不同的人参皂苷能够对不同的糖尿病起到显著的效果,表明人参皂苷降血糖的全能性,同时临床试验表明他们能够显著增强胰岛素对血糖代谢的影响。
有研究表明,人参作为传统中药材,其降血糖作用得到了广泛的研究和关注(Vuksana,V,Sievenpipera,J.L.Herbal remedies in the management of diabetes:Lessons learned from the study of ginseng[J]..Nutr.Metab.Cardiovasc.Dis.2005,15,149-1601)。有学者通过以ob/ob小鼠动物为模型,检测人参皂苷Re对小鼠血糖的影响,结果表明人参皂苷Re具有极强的降血糖作用,能够通过提高小鼠对葡萄糖的耐受能力,从而达到降血糖的作用(Xie JT,Mehendale SR,Li XM,et al.Anti-diabetic effect of ginsenoside Re in ob/ob mice[J].Biochimicaet Biophysica Acta.2005,1740:319-325)。人参总皂苷、人参皂苷Rb1、Rg1、Rg3、Re、和Rh1对α-葡萄糖苷酶均有显著的抑制作用,且强于阳性对照阿卡波糖3-10倍(宋纯清。人参皂苷类成分在制备抑制α-葡萄糖苷酶活性药物上的应用[P]。中国:CN200910194673)。Han发现PPT作为人参皂苷的代谢物之一,PPT能够显著增加PPARγ转录表达活性,结果表明PPT可被用作PPARγ激动剂,能够增强胰岛素抵抗产生降糖作用(Han KL,Jung MH.Ginsenoside 20S-protopanaxatriol(PPT)actvates peroxisome proliferator-activated receptorgamma(PPARgamma)in 3T3-L1adipocytes[J].BiolPharm Bull,2006,29(1):110)。叶银等(叶银。体外胰岛素和人参皂甙Rg1对3T3-L1脂肪细胞脂联素mRNA表达的影响[D]。杭州:浙江大学,2005)将3T3-L1脂肪细胞在含有胰岛素和人参皂苷Rg1的培养环境中共培养一段时间,胰岛素活性呈现剂量依赖性降低3T3-L1脂肪细胞脂联素mRNA表达,结果说明人参皂苷Rg1能够促进脂肪组织的生长壮大,从而间接的增强了体内葡萄糖的消耗,达到降血糖的功效,这也是人参降血糖作用机制的另一种表现。
Cho等通过研究口服给药人参皂苷给糖尿病大鼠,研究表明人参皂苷Re对实验动物模型作用显著,给药动物组血糖值明显低于对照组,在对葡萄糖的耐受力方面表现出一定的正相关作用(Xue JT,Mehendale SR,Li X,et al.Anti-diabetic;effect of ginsenoside Re in ob/ob mice[J].Biochimica et Biophysica Acta.2005,1740(3):319-325)。孙连庆等对人参皂苷Re降血糖的作用机制进行研究发现,其能通过提高胰岛B细胞神经丛酶和海马区L-SA的活性起到降血糖的作用(孙连庆,梁晓春,等。中药降血糖机制实验研究进展[J]。中华中医药杂志,2007,22(11):789-791)。
陈艳等对人参皂苷Re和人参果提取物进行研究发现,二者对α-葡萄糖苷酶都有一定的抑制作用,但在相同浓度条件下,人参果提取物表现出较高的抑制作用,10mg/kg时表现出完全抑制作用。后期又对人参果胶进行研究,其对α-葡萄糖苷酶抑制作用表现出一定的剂量依赖性(陈艳。人参水提物降血糖作用的研究[D]。长春:东北师范大学博士学位论文,2010,05)。近年来大多数研究发现人参的主要活性成分人参皂苷具有较强的降血糖活性。其中人参皂苷Rg1、人参皂苷Re都表现出了极强的降血糖活性,同时研究发现原人参三醇组(PPT)相比较原人参二醇组(PPD)表现出更强的降血糖性。人参皂苷作为天然、廉价、低毒的降血糖药物,已经受到了广泛关注。对活性较低的人参皂苷进行有目的的结构修饰,制备活性较高的人参皂苷衍生物,改善其药代动力学性质,增加其降血糖活性的研究,具有广阔的应用前景和发展前途。发明人在人参皂苷酸降解化合物中发现一种新化合物,具有良好的降血糖活。另外,人参在韩国、日本以及其他一些国家也有着广泛的应用历史,人参进入药品、食品等各个领域,目前更有人参饮料、饼干、糖、茶等多种制品流通市场。
技术实现要素:
本发明的目的在于提供一系列20(R)-原人参三醇(PPT)及其衍生物分离制备方法。
本发明同时还提供了20(R)-原人参三醇(PPT)及其衍生物的降血糖活性研究实验。
本发明的20(R)-原人参三醇(PPT)及其衍生物的结构如下:
本发明提供了所述20(R)-原人参三醇(PPT)及其衍生物的制备方法,包括直接从原植物中进行提取分离和酸降解制备。
选用石油醚-乙酸乙酯、氯仿-甲醇-水或者石油醚-丙酮等系统反复干柱层析或HPLC分离纯化,制备20(R)-原人参三醇(PPT)及其衍生物。
从原植物中进行提取分离:精密称定10.0g三七茎叶,用70%乙醇提取三遍,后将所得的粗品用大孔树脂处理,(分别用30%、50%、70%、90%的甲醇水以及纯水洗脱),得人参皂苷化合物。将此化合物用相应的溶剂配成溶液,然后借助高效制备液相或者传统制备玻璃柱对产物进行分离,合并各人参皂苷的收集液,减压挥去溶剂,真空冷冻干燥即得6种单体化合物的冻干粉。
其酸水解制备方法是:精密称取10份1.0g人参茎叶皂苷,用1.0~6.0倍量甲醇,超声溶解,待溶解后分别加入浓度为1.2~12mol/L酸2~20mL,恒温(38~60℃)摇床反应0.5~3h。用1mol/L NaOH中和至pH=7,加水沉淀后离心,干燥,得人参皂苷酸降解化合物粗品。将所得粗品用大孔树脂处理(分别用30%、50%、70%、90%的甲醇水以及纯水洗脱),得人参茎叶总皂苷酸降解化合物。将酸降解化合物用相应的溶剂配成溶液,然后借助高效制备液相或者传统制备玻璃柱对产物进行分离,合并各人参皂苷的收集液,减压挥去溶剂,真空冷冻干燥即得6种单体化合物的冻干粉。
本发明与的中国专利文献CN 101828712A人参皂苷酸降解物制备工艺及其应用方法进行比较发现,本发明酸水解反应条件更加温和,反应过程以摇床反应代替回流提取,适合大工业化生产,具有极强的现实应用价值。
本发明制备酸降解化合物的方法中,所用皂苷为:人参总皂苷,是人参茎叶总皂苷、或人参根总皂苷、或人参果总皂苷、或人参花总皂苷、或人参二醇组皂苷、或西洋参总皂苷、或西洋参茎叶总皂苷、或西洋参二醇组皂苷、或三七总皂苷、或三七茎叶总皂苷。
本发明制备酸降解化合物的方法中,酸可以是盐酸、或硫酸、或冰醋酸、或草酸、或柠檬酸中的一种,浓度范围最佳为1.2~12mol/L;酸降解在1.0~6.0倍量甲醇中溶解,原料量为溶剂的10%~60%;反应在摇床中进行。酸降解温度为38~60℃;水解时间为0.5~3h。碱可以为碱金属氢氧化物、碱金属盐、低级醇钠之一种,浓度为0.3~2.0mol/L。
本发明提供了利用高效液色谱相同步检测PPT及其衍生物的方法,为利用高效制备液相色谱(HPLC)法制备分离酸水解产物提供指导。
本发明涉及的高效液相色谱法检测4种酸水解产物的色谱条件为0~30min,70%A;30~45min,80%。
本发明提供了20(R)-原人参三醇(PPT)及其衍生物的制备方法,高效制备液相色谱(HPLC)法应用高纯度人参皂苷标准对照品分离制备酸水解产物。
本发明与的中国专利文献CN 101575357A一种三七皂苷Rl、人参皂苷Rgl、Re、Rbl和Rd的制备方法相比,我们的发明能够达到同步制备分离6个化合物,且单次制备6个化合物在80min内完成,生产周期极大的缩短,与以往的薄层分离相比,得到产品纯度高,制备周期大为缩短,极大的提高了生产效率。
人参茎叶皂苷,高效制备液相色谱(HPLC)分离,色谱条件:以Kromasil C18(4.5mm×150mm,5μm)为固定相,进样体积1uL-40mL,柱温25℃,流速1.0mL/min;流动相:甲醇(A)和H2O(B)按不同体积比混合,梯度洗脱程序:0~30min,70%A;30~45min,80%。
同步采用蒸发光检测器(ELSD),气化室温度50℃,载气流速3L/min,监视流出曲线而指导产品收集。
收集液用旋转蒸发仪浓缩,后放置于冰箱(4摄氏度)进行析晶体,既得各个单体成分。
用本方法得到的产物,用紫外、红外以及梯度高效液相色谱对其进行纯度鉴定,结果表明所得产物纯度均大于98%。
北京创新通恒科技有限公司Fuji-C18-10μ高效液相色谱柱;柱温:25℃;检测波长:254nm;流动相:甲醇-水;体积流量:20.0mL/min;进样量:1.0mL(连续进样法)。选取甲醇:水=83:17流动相梯度,进样浓度为20mg/mL,进样时间间隔13.5min作为进行套针法大量制备高纯度人参皂苷标准对照品。所得谱图中的分离度、峰形、峰高均符合要求,极大的提高制备效率,套针分离法通过这样的连续间隔进样,可以节省时间、提高效率、节约流动相,减少消耗,降低废液的排放等,可作为大量制备人参皂苷的方法。
北京创新通恒科技有限公司Fuji-C18-10μ高效液相色谱柱;柱温:25℃;流动相:甲醇-水。选取甲醇:水=81:19流动相梯度,称取样品0.5g,溶于甲醇配制成饱和溶液,进样量2.5mL,作为进行盲分法大量制备高纯度人参皂苷标准对照品。盲分法的优势在于当需要进行大剂量物质的分离制备而又受实验条件限制无检测器检测物质信号时,运用盲分法就可以达到目的。因为其不需要检测器的检测就可以分离制备出所需要的物质,因此其具有广阔的应用范围。
本发明提供了20(R)-原人参三醇(PPT)及其衍生物的传统色谱制备方法,大孔树脂和常压正向硅胶柱色谱分离制备。
本发明在前期研究的基础上,对提取方法进行了改进,革除了Sephadex LH-20和ODS反复纯化过程,改进后的提取方法,工艺简单、易行,成本大大降低,得率高。
本发明的制备方法包括:人参酸水解产物,提取液先用大孔树脂柱层析,层析柱用乙醇洗脱,洗脱液浓缩后再进行萃取除杂,除杂后剩下的水层部分经硅胶柱层析色谱分离,重结晶,即得。
其中大孔树脂柱层析用乙醇洗脱前,优选先用水和20%-30%乙醇淋洗除杂,本发明中的百分比均为体积百分比。
用于提取的乙醇浓度优选50%-90%,大孔树脂柱层析洗脱时优选收集60%-70%乙醇的流分。
提取用乙醇的量优选:药材:乙醇水溶液1:10-1:12w/v。
萃取除杂用溶剂优选乙酸乙酯。
硅胶柱层析色谱分离时,优选以、石油醚-乙酸乙酯(1:5、1:4、1:3、1:2、1:1、2:1、3:1、5:1)氯仿-甲醇(20:1、15:1、10:1、10:2、10:2.5、10:3、10:4、10:5.5、10:6、10:7)石油醚-丙酮(5:1、4:1、3:1、2:1、1:1、1:2)等混合溶剂进行洗脱。
大孔树脂柱层析优选D101型或HPD-100型。
重结晶溶剂优选甲醇、乙醇或正丁醇,或甲醇、乙醇或正丁醇的水溶液。最优选为甲醇的水溶液。优选甲醇:水为1:1-10:1v/v。
本发明同时还提供了PPT及其衍生物的降血糖活性研究实验。
通过以下的测试结果对人参皂苷酸降解化合物降血糖效果进行说明:
体外降血糖酶实验:
对α-葡萄糖苷酶的抑制作用。
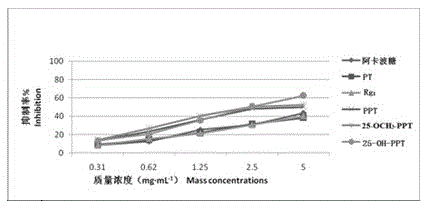
其原理为以PNPG为反应底物,通过检测PNPG与α-葡萄糖苷酶反应生成的黄绿色对硝基苯酚(PNP)溶液的吸光度(OD)来判断样品抑制活性。实验方法为将30μLα-葡萄糖苷酶溶液,20μL抑制剂加入试管中,37℃温浴5min,加入150μL PNPG,800μl磷酸缓冲盐。密封,放入37℃温浴30min后,加入2mLNa2CO3终止液,停止反应。用酶标仪在405nm下测值。DMSO作空白对照,阿卡波糖作阳性对照。采用如下公式计算,结果如图1、表1所示。
抑制率=(空白组OD-测试样品OD)/空白组OD×100%
统计学处理:以SPSS10.0软件进行统计分析IC50。
表1 本发明化合物α-葡萄糖苷酶活性研究(x士S,n=2)
α-葡萄糖苷酶活性研究表明,20(R)-原人参三醇(PPT)等系列人参皂苷对α-葡萄糖苷酶具有极强的抑制活性,其中25-OCH3-PPT、25-OH-PPT和PPT对α-葡萄糖苷酶抑制活性强于阳性对照药阿卡波糖(acarbose)。几种衍生物中25-OH-PPT对α-葡萄糖苷酶抑制作用最强,其抑制率达到2.5±0.15,同时也较三醇组皂苷Rg1强很多。
对α-淀粉酶活性的抑制作用
体外实验方法:α-淀粉酶抑制作用的测定按照日本和光株式会社α-淀粉酶测定试剂盒方法进行。即0.5mL的基质液中加入200mM磷酸缓冲液(PH=7.0)0.5ml,保温5min后加入市售的α-淀粉酶溶液0.01ml,使之反应5min,然后加入纯水2.5mL和碘液0.5mL,充分搅拌,于660um处测定,计算5min淀粉酶的活性。在这个测定系统中加入不同浓度的PPT等系列人参皂苷的测试液,观察结果。无添加的对照组的酶活性为100%。
表2 本发明化合物α-葡萄糖苷酶活性研究(x士S,n=2)
α-淀粉酶活性研究表明,20(R)-原人参三醇(PPT)等系列人参皂苷对α-淀粉酶具有极强的抑制活性,其中25-OCH3-PPT和25-OH-PPT对α-葡萄糖苷酶抑制活性强于阳性对照药阿卡波糖(acarbose)。几种衍生物中25-OH-PPT对α-葡萄糖苷酶抑制作用最强,其抑制率达到4.33±0.21,同时也较三醇组皂苷Rg1强很多。
蛋白质络氨酸磷酸酶1B(PTP1B)活性实验。
使用pNPP(对硝基苯基磷酸酯)作为底物进行磷酸酶活性测定。原理为:蛋白质酪氨酸磷酸酶-1B(PTP1B),是在体内广泛分布的酪氨酸磷酸酶,主要通过对胰岛素受体底物-1(IRS-1)和胰岛素受体底物-2(IRS-2)的去磷酸化作用,最终调节胰岛素受体信号的传导。即胰岛素通过与胰岛素受体结合,导致胰岛素受体和胞内蛋白质逐级磷酸化,从而将信号传入细胞内来产生生理效应。而PTP1B通过催化去磷酸化作用,阻碍这个过程的进行,造成了胰岛素抵抗的现象。胰岛素抵抗是II型糖尿病的根本原因,使得机体对自身胰岛素敏感性降低,说明PTP1B与II型糖尿病有着密切的关系。
化合物抑制PTP1B酶活性实验在96孔板中进行,实验组依次加入83μL含酶缓冲溶液(0.4μL酶)、10μL化合物溶液和4μL底物溶液,阳性对照组依次加入83μL含酶缓冲溶液(0.4μL酶)、10μL钒酸钠溶液和4μL底物溶液。空白对照组依次加入93μL含酶缓冲溶液(0.4μL酶)和4μL底物溶液。试剂对照组加入83μL含酶缓冲溶液(0.4μL酶)、10μL DMSO溶液和4μL底物溶液,在恒温培养箱中37℃反应30分钟后,用5μL NaOH终止反应。通过酶标仪测量产物在405nm波长处吸收强度,并且钒酸钠为PTP1B活性抑制剂的阳性对照药。
表3 本发明化合物PTP1B酶活性研究研究
PTP1B酶活性研究表明,20(R)-原人参三醇(PPT)等系列人参皂苷对PTP1B具有极强的抑制活性,活性几乎都强于阳性对照药钒酸钠,同时Re做为人参皂苷类降血糖作用研究最多的一种成分,它对PTP1B的抑制作用弱于阳性对照药物钒酸钠,同时也弱于我们的20(R)-原人参三醇(PPT)系列衍生物。
体外酶活性实验结果表明,本发明化合物两种酶均有抑制作用,均表现出较强的抑制率,与对照组相比该化合物同样具有较强的抑制活性。
体内降血糖酶实验
实验例1以25-OH-PPT(T19)为例对STZ致高血糖小鼠降血糖作用研究。
选用4周龄C57/BL雄性小鼠,适应性喂养一周后以50mg/kg体重剂量腹腔注射STZ柠檬酸钠溶液共3次,每次间隔2天),诱导其血糖升高。小鼠禁食16h后尾端取静脉血一滴测其血糖值,选择血糖值在10~14间的小鼠作为理想模型组,构建STZ诱导的II型糖尿病小鼠模型,正常饲喂条件下,采用灌胃方式分别给予不同剂量的T19和二甲双胍片剂(阳性对照),给药时间为四周,每周测试其体重及餐后血糖值。停药后,进行糖耐量实验;检测血液中甘油三酯和胆固醇含量和脏器指数分析。
每周体重检测:
STZ组小鼠体重持续增加,且明显高于空白对照组。给予二甲双胍和T19的小鼠体重于第三周开始明显降低。
图2
每周血糖监测
根据图3数据可见,STZ组小鼠血糖持续高于空白对照组,并且,二甲双胍和三种剂量的T19都能明显降低小鼠血糖,其中剂量为20mg/kg的T19无论是降血糖的能力还是降血糖的稳定性,都优于阳性药二甲双胍。
腹腔注射糖耐量测试
给药四周后,糖耐量实验显示剂量为20mg/kg的T19能够显著增强小鼠的糖耐量,如图4、图5。
脏器指数
脏器指数(内脏与体重的比重)并未见差异,如图6。
血脂测定
血液中甘油三酯(TG)及胆固醇(CHO)测定血清中脂质含量测定,选择TG和CHO含量进行代表测定。结果显示,T19能明显降低血液中甘油三酯和胆固醇含量,并且效果好于阳性药,如图7、图8。
综上所述,T19在短期给予条件下降糖效果明显。针对糖耐量实验发现,低剂量T19(20mg/kg)在长期给予条件下对机体糖耐的改善效果明显甚至优于市售二甲双胍。对于体内脏器的影响未见差异,而在血脂测定时T19的作用也优于阳性药二甲双胍。
综上所述,T19等系列人参皂苷酸降解化合物具有很好的降血糖作用,可开发为很好的临床用药。
实验例2人参皂苷元25-OH-PPT(T19)对四氧嚓咤诱导的糖尿病小鼠的降血糖作用:
动物系昆明种小鼠,体重20-22g,雌性。
对四氧嘧啶型糖尿病小鼠血糖的影响
取健康小鼠60只,随机取8只作为空白对照,即正常组,其余小鼠均腹腔注射四氧嘧啶20mg/kg,6天后,将造模成功的小鼠随机分为四组(每组8只):模型对照组,人参皂苷元25-OH-PPT(T19)5mg/kg,10mg/kg,20mg/kg三个剂量治疗组。分组后分别灌胃给药,每天上午8:30-9:30给药一次,连续给药14天。分别在第0天,第7天,第14天测空腹12h血糖。
对四氧嘧啶型糖尿病小鼠糖耐量的影响
取健康小鼠60只,随机取8只作为空白对照,即正常组,其余小鼠均腹腔注射四氧嘧啶20mg/kg,6天后,将造模成功的小鼠随机分为四组(每组8只):模型对照组,人参皂昔25-OH-PPT(T19)5mg/kg,10mg/kg,20mg/kg三个剂量治疗组。分组后分别灌胃给药,每天上午8:30-9:30给药一次,连续给药14天。第14天,灌胃给予空腹小鼠葡萄糖2g/kg,断尾取血分别测定0min,30min,60min,120min血糖。对四氧嘧啶型糖尿病小鼠体重的影响
取健康小鼠60只,随机取8只作为空白对照,即正常组,其余小鼠均腹腔注射四氧嘧啶20mg/kg,6天后,将造模成功的小鼠随机分为四组(每组8只):模型对照组,人参皂苷25-OH-PPT(T19)5mg/kg,10mg/kg,20mg/kg三个剂量治疗组。分组后分别灌胃给药,每天上午8:30-9:30给药一次,连续给药14天。每天给药前记录小鼠体重。
对四氧嘧啶型糖尿病小鼠摄食量的影响
取健康小鼠60只,随机取8只作为空白对照,即正常组,其余小鼠均腹腔注射四氧嘧啶20mg/kg,6天后,将造模成功的小鼠随机分为四组(每组8只):模型对照组,人参皂苷25-OH-PPT(T19)5mg/kg,10mg/kg,20mg/kg三个剂量治疗组。分组后分别灌胃给药,每天上午8:30-9:30给药一次,连续给药14天。每天上午称鼠粮,计算摄食量。
对四氧嘧啶型糖尿病小鼠饮水量的影响
取健康小鼠60只,随机取8只作为空白对照,即正常组,其余小鼠均腹腔注射四氧嘧啶20mg/kg,6天后,将造模成功的小鼠随机分为四组(每组8只):模型对照组,人参皂苷25-OH-PPT(T19)5mg/kg,10mg/kg,20mg/kg三个剂量治疗组。分组后分别灌胃给药,每天上午8:30-9:30给药一次,连续给药14天。每天上午记录饮水量。
实验结果
对四氧嘧啶型糖尿病小鼠空腹血糖水平的影响
分别在第0天、第7天、第14天测定小鼠血糖。第0天,人参皂苷25-OH-PPT(T19)治疗组5mg/kg,10mg/kg,20mg/kg和模型组的血糖水平都明显高于正常组。第14天,10mg/kg组小鼠血糖(6.58mmol/L)与20mg/kg组小鼠血糖(6.50mmol/L)与模型组(10.40mmol/L)相比分别降低36.7%及37.5%,25mg/kg组小鼠的血糖已恢复正常水平。(见附图9)
对四氧嘧啶型糖尿病小鼠口服糖耐量的影响
经过14天治疗,10mg/kg组小鼠的糖耐量与模型组相比明显改善,AUC降低34.47%(P<0.05)。120min时,10mg/kg组小鼠的血糖已恢复正常水平。然而,三个剂量组的AUC仍明显高于正常组。(见附10)
对四氧嘧啶型糖尿病小鼠体重的影响
人参皂苷25-OH-PPT(T19)对四氧嘧啶型糖尿病小鼠体重没有明显的影响。
对四氧嘧啶型糖尿病小鼠摄食量的影响
与模型组相比,人参皂苷25-OH-PPT(T19)治疗后,5mg/kg组与20mg/kg组小鼠的摄食量显著降低(P<0.01)。(见附图11)
对四氧嘧啶型糖尿病小鼠饮水量的影响
经过5mg/kg,10mg/kg,20mg/kg三个剂量人参皂苷25-OH-PPT(T19)的治疗,糖尿病小鼠的饮水量与模型组相比均显著降低。(见附图12)
讨论
人参皂苷25-OH-PPT(T19)能够降低四氧嘧啶型糖尿病小鼠血糖,改善小鼠口服糖量,降低糖尿病小鼠摄食量和饮水量,然而,人参皂苷25-OH-PPT(T19)对糖尿病小鼠体重没有明显的影响。综上,人参皂苷25-OH-PPT(T19)具有一定的降血糖和改善葡萄糖耐量的功能。
本发明的有益效果在于:本发明资源丰富,反应条件温和,成本低廉,质量可控,周期短,收率高,生产提取工艺简单易行,适合工业化生产,可制成各种食品及保健食品,无毒副作用,可长期服用或食用,易于推广。
附图说明
图1为本发明对不同质量浓度下5种人参皂苷对α-葡萄糖苷酶抑制活性。
图2为每周体重监测。
图3为每周血糖监测。
图4为腹腔注射糖耐量测试。
图5为腹腔注射糖耐量测试。
图6为脏器指数。
图7为血清中甘油三酯含量测定。
图8血清中胆固醇含量测定。
图9对四氧嘧啶型糖尿病小鼠空腹血糖水平的影响。
图10对四氧嘧啶型糖尿病小鼠口服糖耐量的影响。
图11对四氧嘧啶型糖尿病小鼠体重的影响。
图12对四氧嘧啶型糖尿病小鼠饮水量的影响。
图13为本发明所含的6个产品纯度检测的分析型高效液相色谱图。
图14市售人参总皂苷酸水解产物的制备型高效液相色谱图。
图15图16为连续进样法分离制备人参皂苷元25-OH-PPT的R和S异构体(T19)。
具体实施方式
通过以下实施案例进一步描述本发明,并不以任何方式限制本发明,在不背离本发明的技术解决方案的前提下,对本发明所作的本领域普通技术人员容易实现的任何改动或改变都将落入本发明的权利要求范围之内。
实施例1
精密称取1.0g人参茎叶皂苷,用1.0~6.0倍量甲醇,超声溶解,待溶解后分别加入浓度为1.2mol/L HCl2~20mL,恒温(38~60℃)摇床反应0.5~3h。用1mol/L NaOH中和至pH=7,加水沉淀后离心,干燥,得人参皂苷酸降解化合物粗品。将所得粗品用大孔树脂处理,得人参茎叶总皂苷酸降解化合物。取人参茎叶总皂苷酸水解产物100mg,充分地溶于20ml甲醇中,将上述水解产物的溶液应用于制备型反相高效液相色谱,以Kromasil C18(4.5mm×150mm,5μm)为固定相,进样体积3mL,柱温25℃,流速1.0mL/min;流动相:甲醇(A)和水(B)按不同体积比混合,梯度洗脱程序:0~30min,70%A;30~63min,80%;ELSD气化室温度50℃,载气流速3L/min,分别收集人参皂苷25-OCH3-PPT、25-OH-PPT、PT和PPT的洗脱峰。合并各人参皂苷的收集液,减压挥去溶剂,真空冷冻干燥即得4种单体化合物的冻干粉。
实施例2
精密称取1.0g人参茎叶皂苷,用1.0~6.0倍量甲醇,超声溶解,待溶解后分别加入浓度为1.2mol/L HCl各2~20mL,恒温(38~60℃)摇床反应0.5~3h。用1mol/L NaOH中和至pH=7,加水沉淀后离心,干燥,得人参皂苷酸降解化合物粗品。将所得粗品用大孔树脂处理,得人参茎叶总皂苷酸降解化合物。取人参茎叶总皂苷酸水解产物100mg,充分地溶于20ml甲醇中,将上述水解产物的溶液应用于制备型反相高效液相色谱,以Kromasil C18(4.5mm×150mm,5μm)为固定相,进样体积3mL,柱温25℃,流速1.0mL/min;流动相:乙腈(A)和水(B)按不同体积比混合,梯度洗脱程序:0~30min,70%A;30~63min,80%;ELSD气化室温度50℃,载气流速3L/min,分别收集人参皂苷25-OCH3-PPT、25-OH-PPT、PPT和PT的洗脱峰。合并各人参皂苷的收集液,减压挥去溶剂,真空冷冻干燥即得4种单体化合物的冻干粉。
实施例3
精密称取1.0g人参茎叶皂苷,用1.0~6.0倍量甲醇,超声溶解,待溶解后分别加入浓度为1.2mol/L HCl各2~20mL,恒温(38~60℃)摇床反应0.5~3h。用1mol/L NaOH中和至pH=7,加水沉淀后离心,干燥,得人参皂苷酸降解化合物粗品。将所得粗品用大孔树脂处理,得人参茎叶总皂苷酸降解化合物。称取人参茎叶总皂苷酸降解化合物样品0.4g,配制成浓度为20mg/mL的溶液进行套针制备,流动相为甲醇:水=83:17,进样量为1mL,进样时间间隔13.5min。分别收集人参皂苷25-OCH3-PPT、25-OH-PPT、PPT和PT的洗脱峰。合并各人参皂苷的收集液,减压挥去溶剂,真空冷冻干燥即得4种单体化合物的冻干粉。
实施例4
精密称取1.0g人参茎叶皂苷,用1.0~6.0倍量甲醇,超声溶解,待溶解后分别加入浓度为1.2mol/L HCl各2~20mL,恒温(38~60℃)摇床反应0.5~3h。用1mol/L NaOH中和至pH=7,加水沉淀后离心,干燥,得人参皂苷酸降解化合物粗品。将所得粗品用大孔树脂处理,得人参茎叶总皂苷酸降解化合物。利用盲分法在甲醇:水=81:19流动相梯度下,称取人参茎叶总皂苷酸降解化合物样品0.5g,溶于甲醇配制成饱和溶液,进样量2.5mL,接收所制备的馏分,使用分析型高效液相色谱仪对接收流动相进行检测。鉴别25-OCH3-PPT、25-OH-PPT、PPT和PT各馏分。合并各人参皂苷的收集液,减压挥去溶剂,真空冷冻干燥即得4种单体化合物的冻干粉。
实施例5
精密称取1.0g人参茎叶皂苷,用1.0~6.0倍量甲醇,超声溶解,待溶解后分别加入浓度为1.2mol/L HCl各2~20mL,恒温(38~60℃)摇床反应0.5~3h。用1mol/L NaOH中和至pH=7,加水沉淀后离心,干燥,得人参皂苷酸降解化合物粗品。将所得粗品用大孔树脂处理,得人参茎叶总皂苷酸降解化合物。将酸降解化合物粗品用少量丙酮溶解,加入适量硅胶搅拌均匀,挥去溶剂,采用正相层析硅胶干法装柱,经过洗脱体系石油醚-乙酸乙酯(1:5、1:4、1:3、1:2、1:1、2:1、3:1、5:1)洗脱,合并各人参皂苷的收集液,减压挥去溶剂,真空冷冻干燥即得4种单体化合物的冻干粉。
实施例6
精密称取10份1.0g人参皂苷,用1.0~6.0倍量甲醇,超声溶解,待溶解后分别后向各个试管中逐滴加入浓度为12mol/L HC1,1mL,恒温(38~60℃)回流提取2h。用1mol/L NaOH中和至pH=7,加水沉淀后离心,干燥,得人参皂苷酸降解化合物粗品。将所得粗品用大孔树脂处理,得人参茎叶总皂苷酸降解化合物。将酸降产物用少量丙酮溶解,加入适量硅胶搅拌均匀,挥去溶剂,采用正相层析硅胶干法装柱,经过洗脱体系氯仿-甲醇(20:1、15:1、10:1、10:2、10:2.5、10:3、10:4、10:5.5、10:6、10:7)洗脱,合并各人参皂苷的收集液,减压挥去溶剂,真空冷冻干燥即得4种单体化合物的冻干粉。
实施例7
精密称取10份1.0g人参皂苷,用1.0~6.0倍量甲醇,超声溶解,待溶解后分别后向各个试管中逐滴加入浓度为12mol/L硫酸,1mL,恒温(38℃)回流提取2h。用1mol/L NaOH中和至pH=7,加水沉淀后离心,干燥,得人参皂苷酸降解化合物粗品。将所得粗品用大孔树脂处理,得人参茎叶总皂苷酸降解化合物。将酸降解产物用少量丙酮溶解,加入适量硅胶搅拌均匀,挥去溶剂,采用正相层析硅胶干法装柱,经过洗脱体系石油醚-丙酮(5:1、4:1、3:1、2:1、1:1、1:2)洗脱,合并各人参皂苷的收集液,减压挥去溶剂,真空冷冻干燥即得4种单体化合物的冻干粉。
实施例8
将上述制备的人参皂苷酸降解化合物50mg,用10mL 0.3%的食用梭甲基纤维素钠溶解,加入500mL牛奶中制成食品。
实施例9
将上述制备的人参皂苷酸降解化合物50mg,加入5mg异麦芽糖制成溶液,分装成保健食品。
实施例10
将上述制备的人参皂苷酸降解化合物50g,淀粉100g糊精50g,用适量50%乙醇作润湿剂,制成软材,按常规方法制粒,加入质量硬脂酸镁混匀,经压片机制成0.2g/片,每片含新人参二醇50mg。
实施例11
将上述制备的人参皂苷酸降解化合物50mg,用适当的辅料及赋形剂制成合适剂型的药品。
- 还没有人留言评论。精彩留言会获得点赞!