重组糖蛋白生产中的细胞生长和糖基化的调节的制作方法
背景
重组糖蛋白通常通过使用真核表达系统的发酵生产工艺来产生。蛋白质的翻译后糖基化对于满足重要的物理化学和生物学性质和功能(如蛋白质溶解度、稳定性、清除率、免疫原性和免疫效应子功能)来说是至关重要的。糖蛋白的糖基化状态受严格调控,并且,即使是糖基化中的微小差异也可能具有显著效果。然而,由于大量的酶参与糖基化,特别是参与N-糖基化,因此该途径是真核细胞中进行的最复杂的翻译后修饰。在糖蛋白中,糖要么附接至天冬酰胺侧链中的酰胺氮原子(N-连接),要么附接至丝氨酸或苏氨酸侧链中的氧原子(O-连接)。糖基化开始于在内质网中的N-连接的形成,所谓的“核心糖基化”。在这之后,多肽被输送到高尔基体,在那里,添加O-连接的糖并且以多种不同方式修饰N-连接的糖链,例如,通过去除甘露糖残基,添加N-乙酰葡糖胺、半乳糖和/或岩藻糖和/或唾液酸残基。
金属及其离子在生物学中发挥重要作用(Yannone等人,Current Opinion in Biotechnology 23.1(2013)89-95)。已经报告,39个基本生物学元素中,26个是金属。此外,这些金属实现其生物学功能所需的有效浓度有显著差异。必需金属可以分为宏量营养元素,如钙、钾或镁,和微量营养元素如微量金属铁、锌、锰或铜,以及超微量元素,如钒和钨。虽然这些必需金属是生物内环境稳定的关键,但是当浓度超过它们的生物学功能所必需的浓度时,它们能是有毒的。因此,全身金属浓度的严格调控对于生物内环境稳定来说是非常重要的。
过渡金属铜、铁、锌和锰根据它们的生物学活性浓度被分类为微量元素,并且在细胞稳态中起关键作用。它们被发现于许多酶的活性位点中,如描述于Fraga和Fraga(Mol.Aspects Med.26.4-5(2005)235-44)。
多年以来,已经使用动物饲养和细胞培养实验研究了微量元素在细胞生长中的作用。Ham等人(Proc.Natl.Acad.Sci.USA 53(1965)288-93)已经显示微量元素是成功的细胞培养所需要的。人们对微量元素在蛋白质糖基化中的作用也有很大的兴趣,但是,不同微量元素的详细酶促贡献和金属阳离子在糖基化途径中的相互作用仍然是相对未知的。
在一般情况下,糖基化酶的活性取决于二价微量元素(如,Zn2+,Mn2+,Ca2+,Mg2+)的可用性、pH环境和核苷磷酸酯(UTP,GTP,CTP)和相应的糖衍生物(UDP-Gal,UDP-GlcNAc,GDP-Fuc,CMP-唾液酸)的可用性。
Kaminska等人(Glyconj.J.15.8(1998)783-88)研究了二价阳离子对于糖蛋白6-α-L-岩藻糖基转移酶活性的作用,并发现,虽然二价阳离子如Mg2+和Ca2+激活这种酶,但是Cu2+、Zn2+和Ni2+强烈抑制这种酶的活性。Witsell等人,(J.Biol.Chem.265.26(1990)15731-37)描述了特定的二价阳离子在天然乳腺高尔基小泡中的半乳糖基转移酶的激活中的作用。Crowell等人(Biotechnol.Bioeng.96.3(2007)538-49)描述了,在采用应激培养的后期工艺阶段,微量元素(尤其是锰)与其他培养因素(如,氨基酸可用性)相互作用,从而调控蛋白质糖基化。Gawlitzek等人(Biotechnol.Bioeng.103.6(2009)1164-75)观察到细胞培养条件,如,锰和铁浓度,比生产率增强剂丁酸盐,甲状腺素和培养物pH值可以控制CHO细胞中表达的重组糖蛋白的N-糖基化位点占据。
如US 2007/0161084中概述的,一些参与糖基化的酶利用不同的阳离子作为辅因子。在该申请中,发明人发现,通过使表达糖蛋白的哺乳动物宿主细胞生长于含有无毒量的锰的培养基中,可以改善糖蛋白的唾液酸化,(即向糖蛋白上的碳水化合物链添加末端唾液酸残基),并且尤其是促红细胞生成素的唾液酸化。锰可以存在于初始生长培养基上,或者可以在快速细胞生长阶段之后加入,或者可以在一个或两个收获周期之后加入。
锰在细胞生长中的作用及其活性浓度是有争议的。据报道,锰对于正常细胞生长和发展是必需的,但同时在高浓度下有毒(Au等人,Neurotoxicology 29.4(2008)569-76)。例如,已经表明锰结合至位于细胞表面的整合素并激活MAP激酶,ERK1和ERK2,这两者均是关于细胞生长的重要开关(Roth等人,Neurotoxicology 23.2(2002)147-57)。另一方面,Roth等人也表明锰通过发动许多凋亡因子而与细胞死亡和细胞的凋亡有关,所述凋亡因子最终通过破坏线粒体功能和诱导失去ATP导致细胞死亡。当从细胞培养基中去除铁时,锰的毒性作用相当强,这是因为铁和锰竞争同一细胞膜穿梭物DMT1(Roth等人)。
US 2008/0081356描述了这样的方法,该方法通过使用包含10和600nM之间的摩尔累积浓度的锰和低于约8mM的摩尔累积谷氨酰胺浓度的培养基,在商业规模的细胞培养中大规模生产具有改变的糖基化模式的糖蛋白。
WO 2012/149197描述了这样的方法,该方法通过向生产培养基补充锰和/或半乳糖,在CHO和NSO细胞系中调节重组表达的蛋白质(并且尤其是抗体)的半乳糖基化谱。
Mn2+作为β-1,4-半乳糖基转移酶活性的辅因子的重要性先前已由Ramakrishnan等人,(J.Mol.Biol.357.5(2006)1619-33)描述。
已经报道,锌对于细胞增殖和分化(尤其对于DNA合成和有丝分裂的调控)是至关重要的。锌是大量蛋白质的结构组分,所述蛋白质包括转录因子和来自细胞信号通路的酶,如第二信使代谢、蛋白激酶和蛋白磷酸酶活性(Beyersmann等人,Biometals 14.3-4(2001)331-41)。因此,生物可利用的锌已与细胞增殖相关联。
铁是细胞生长调节中的关键角色。先前已经报道将铁或其转运蛋白转铁蛋白补充到化学成分确定的细胞培养基中对于生物质产生是至关重要的。例如,已经表明铁在无血清培养基中促进C6胶质瘤和L1210白血病癌细胞系的细胞生长(Basset等人,Carcinogenesis 6.3(1985)355-59)。铁在细胞生长中的基础作用通过能够穿过质膜的螯合剂得到了进一步证明,所述螯合剂通过结合细胞内的金属限制了其生物利用度。活性剂如去铁胺(desferrioxamine)和去铁硫辛(desferrithiocin)在培养物中抑制多种肿瘤细胞的生长(Reddel等人,Exp.Cell Res.161.2(1985)277-84和Basset等人,同上)并大大降低T细胞增殖(Polson等人,Immunology 71.2(1990)176-81和Pattanapanyasat等人,Br.J.Haematol.82.1(1992)13-19)。在此,可能的细胞生长抑制机制是铁剥夺,其与降低的核糖核苷酸还原酶活性和脱氧核糖核苷酸的降低的量相关。这随后导致S期中的有丝分裂停止。向培养基中添加铁逆转生长抑制(Lederman等人,Blood 64.3(1984)748-53)。
WO 98/08934描述了补充有锌和铁(除了其他组分以外)的培养基在悬浮培养中用于支持哺乳动物细胞的高密度生长的用途。
铜在细胞稳态中起重要作用,然而铜和铁的代谢命运紧密相连(Arredondo等人,Molecular Aspects of Medicine 26.4(2005)313-27)。全身性的铜缺乏引起细胞缺铁,这导致表型相似效应如减弱的细胞生长。此外,在细胞培养研究中,通过螯合铜降低生物利用度已与生长因子刺激的受体磷酸化能力降低并最终抑制细胞增殖途径相关联(Turski等人,J.Biol.Chem.284.4(2009)717-21)。另一方面,已经表明,铜刺激血管形成,并且,由饮食或铜螯合剂所致的缺铜削弱肿瘤支持血管生成响应(Harris等人,Nutr.Rev.62.2(2004)60-64)和癌的生长(Gupte等人,Cancer Treat.Rev.35.1(2009)32-46)的能力。
US 2009/0068705描述了一种用于在细胞培养中大规模生产蛋白质和/或多肽的方法,其中,培养基包含铜和/或谷氨酸盐,并且由此该多肽具有更广泛的或更期望的糖基化模式。
虽然,在这个领域中的工作已集中于金属辅因子在刺激glycoenzymes中的活性,多位作者,如Kaminska等人(同上),也已表明相同或不同的金属辅因子可以抑制另一种glycoenzyme的活性(例如Ca2+激活甘露糖基-寡糖1,2-α-甘露糖苷酶并同时抑制α-1,3-甘露糖基-糖蛋白2-β-N-乙酰葡萄糖氨基-转移酶)。关于蛋白质的激活或结构布置所需的体外金属辅因子以及一些参与糖基化的酶的金属抑制剂的信息可以从BRENDA数据库(http://www.brenda-enzymes.org)获得。多种金属辅因子的这种双重活性凸显了对糖蛋白生产中微量元素使用的严格调控的需要。
已经表明,糖化工程(即,通过重组共表达内源性或异源性glycoenzyme来改变蛋白质相关的碳水化合物)影响蛋白质的药物代谢动力学性质,如分子稳定性、溶解度、体内生物活性和免疫原性。尤其是在抗体中,已经表明增加半乳糖基化的量影响抗体效应子功能,如CDC(Raju,Curr.Opin.Immunol.20.4(2008)471-8)或抗体依赖性细胞毒性(ADCC),例如,人IgG单克隆抗D的半乳糖基化影响Fc受体介导的功能活性(Kumpel等人,Hum.Antib.Hyb.5.3-4(1994)143-51);或者,已经表明增加半乳糖基化的量增强通过IgG免疫复合物阻止补体介导的炎症(Karsten等人,Nat.Med.18.9(2012)1401-6)。抗体Fc区的N-糖基化对于结合至Fc受体来说是必不可少的,所述Fc受体参与抗体效应子功能。岩藻糖在许多抗体的N-聚糖中是核心残基,但是非岩藻糖基化形式已被证明相对于它们的岩藻糖基化对应物具有增强的ADCC。增加非岩藻糖基化蛋白质的产生和/或影响抗体的岩藻糖基化的方法因此也是理想的。
因此,在本领域中仍然需要增强细胞培养策略的方法,包括改善细胞生长和生物质产生和/或使糖蛋白直接糖基化并且因此使糖蛋白成熟。
技术实现要素:
发明人已经确定生物活性微量元素在细胞培养性能中并且尤其是关于细胞生长和糖蛋白中的聚糖形成并因此在糖蛋白成熟中的作用。因此,本发明涉及这样的方法,所述方法用于在影响细胞生长或生物质产生的条件和影响由细胞产生的所表达的糖蛋白中的N-聚糖成熟度的条件之间进行选择。因此,在本发明的方法中,在针对期望的最终结果而定制的培养基中培养产生糖蛋白的细胞。
本发明是用于在发酵培养条件下在真核细胞中产生重组糖蛋白的方法,所述方法包括在培养期间调整培养基中铁、铜、锌和锰中每一种的浓度,以影响生物质产生和/或所表达的糖蛋白中的N-聚糖成熟度。
本方法包括调整铁、铜、锌和锰的浓度以影响生物质产生和/或所表达的糖蛋白的N-聚糖成熟度。铁、铜、锌和锰的浓度的调整将意味着细胞中的条件将有利于生物质产生或者将对所表达的糖蛋白的成熟度产生影响。如本文中使用的“有利于”意指细胞的活性将是在陈述的方向上,所述陈述的方向是与在相同条件下但其中铁、铜、锌和锰中每一种的浓度没有这样调整的细胞生长相比而言的。因此,当有利于生物质产生时,细胞将被引导为更加朝向增殖,而不是朝向糖蛋白的产生。因此,生物质产生将增强或增加。同样地,当铁、铜、锌和锰的浓度的调整或仅锌和锰的调整影响所表达的糖蛋白的N-聚糖成熟度时,细胞将被引导为更加朝向产生这类糖蛋白,而不是朝向例如生物质产生或产生其他糖蛋白类型。因此,期望的糖蛋白类型的产生将增强或增加。
本发明的方法影响所表达的糖蛋白的N-聚糖成熟度,例如,用于导致产生具有期望成熟度水平的糖蛋白。因此,该方法影响成熟的N-糖基化糖蛋白和/或不成熟的N-糖基化糖蛋白、成熟的非岩藻糖基化糖蛋白和/或不成熟的非岩藻糖基化糖蛋白的产生。本发明的方法包括提高所表达的N-糖基化糖蛋白的成熟度、增加成熟的N-糖基化糖蛋白的产生、增加成熟的非岩藻糖基化糖蛋白的产生和/或增加不成熟的非岩藻糖基化糖蛋白的产生。与增加成熟的N-糖基化糖蛋白的产生相伴随的可能是成熟和/或不成熟的非岩藻糖基化糖蛋白种类和不成熟的N-糖基化糖蛋白的产生的减少。与增加不成熟的非岩藻糖基化糖蛋白的产生相伴随的可能是成熟的非岩藻糖基化糖蛋白和/或成熟或不成熟的N-糖基化糖蛋白的产生的减少。
在某些实施方案中,可以调整培养基中铁、铜、锌和锰的浓度从而有利于生物质产生,即,从而增强细胞的生长,并因此增加生物质。在其他实施方案中,可以调整培养基中铁、铜、锌和锰的浓度以提高所表达的糖蛋白的成熟度。在一个实施方案中,可以调整培养基中铁、铜、锌和锰的(或者,仅锌和锰的)浓度以有利于(即,增加)成熟的N-糖基化糖蛋白的产生。在另一个实施方案中,可以调整铁、铜、锌和锰的浓度以有利于(即,增加)不成熟的非岩藻糖基化糖蛋白的产生。在又一个实施方案中,可以首先调整培养基中铁、铜、锌和锰的浓度以增强生长并因此增加生物质,并且随后再次调整以影响糖蛋白成熟度,从而增加所表达的糖蛋白中的成熟度、增加成熟的N-糖基化糖蛋白的产生、或者增加成熟或不成熟的非岩藻糖基化糖蛋白的产生。
因此,本发明包括:
-通过增加培养基中铁、铜、锌和锰中每一个的浓度从而有利于生物质产生;
-通过增加培养基中锌和锰中每一个的浓度以及任选地降低铁和铜的浓度从而有利于增加所表达的N-糖基化糖蛋白中的成熟度;和
-通过(i)降低培养基中铁、铜、锌和锰中每一个的浓度,或者(ii)增加培养基中铜和铁中的每一个的浓度并降低锌和锰中每一个的浓度,从而有利于不成熟的非岩藻糖基化糖蛋白的产生。
在一个方面,本发明包括如上所述的方法,其中,为了有利于生物质产生,将培养基中的铁、铜、锌和锰的浓度调整为:
-(a)铁—从15μM至多于80μM;
-(b)铜—从0.3μM至多于2.5μM;
-(c)锌—从20μM至多于50μM;和
-(d)锰—从0.01μM至多于3μM。
在一个方面,本发明包括如上所述的方法,其中,为了有利于增加所表达的N-糖基化糖蛋白中的成熟度,将培养基中的铁、铜、锌和锰的浓度[(i)中]或锌和锰的浓度[(ii)中]调整为:
(i)
-(a)铁—从0μM至25μM;
-(b)铜—从0μM至0.1μM;
-(c)锌—从20μM至多于50μM;和
-(d)锰—从0.01μM至多于3μM;或者
(ii)
-(a)锌—从20μM至多于50μM;和
-(b)锰—从0.01μM至多于3μM。
在一个方面,本发明包括如上所述的方法,其中,为了有利于不成熟的非岩藻糖基化糖蛋白的产生,将培养基中的铁、铜、锌和锰的浓度任一调整为以下任一:
(i)
-(a)铁—从0μM至35μM;
-(b)铜—从0μM至1μM;
-(c)锌—从0μM至20μM;和
-(d)锰—从0μM至0.01μM;或者
(ii)
(a)铁—从15μM至多于80μM;
-(b)铜—从0.3μM至多于2.5μM;
-(c)锌—从0μM至20μM;和
-(d)锰—从0μM至0.01μM。
在一个方面,本发明包括如上所述的方法,其中所述糖蛋白对于真核细胞是外源性的或内源性的,任选地,其中所述糖蛋白是结构糖蛋白、激素、抗体或酶。
在一个方面,本发明包括如上所述的方法,其中所述糖蛋白是抗体,任选地,其中所述抗体是治疗性或诊断性抗体,任选嵌合抗体、人源化抗体或人抗体。
在一个方面,本发明包括如上所述的方法,其中所述真核细胞是哺乳动物细胞、酵母细胞或昆虫细胞。
在一个方面,本发明包括如上所述的方法,其中在生长和/或生产培养阶段期间调整铁、铜、锌和锰的浓度。
在一个方面,本发明包括如上所述的方法,其中,培养基中铁、铜、锌和锰中任一种或全部的浓度的增加通过向其中培养有细胞的培养基中补充铁、铜、锌和锰中任一种或全部来实现,和/或通过将细胞分离到补充有铁、铜、锌和锰中任一种或全部的新鲜培养基中来实现。
在一个方面,本发明包括如上所述的方法,其中,培养基中铁、铜、锌和锰中任一种或全部的生物可利用浓度的降低通过使铁、铜、锌和锰与螯合剂络合来实现,和/或通过将细胞接种到与紧前培养阶段的培养基相比含有降低浓度的铁、铜、锌和锰中任一种或全部的新鲜培养基中来实现。
在一个方面,本发明包括如上所述的方法,其中,在培养期间调整培养基中铁、铜、锌和锰中每一种的浓度,首先使得有利于生物质产生,并且,然后使得有利于成熟的N-糖基化糖蛋白的产生或不成熟的非岩藻糖基化糖蛋白的产生。
本文中还提供了一种适于在发酵培养条件下在真核细胞中产生重组糖蛋白的培养基,所述培养基包含有利于生物质产生和/或影响所表达的糖蛋白的N-聚糖成熟度的浓度的铁、铜、锌和锰中的每一种,。
在一个方面,培养基包含以下浓度的铁、铜、锌和锰:
-(a)铁—从15μM至多于80μM;
-(b)铜—从0.3μM至多于2.5μM;
-(c)锌—从20μM至多于50μM;和
-(d)锰—从0.01μM至多于3μM。
在发酵培养条件下在真核细胞中在重组糖蛋白的生产中使用这样的培养基有利于生物质产生。
在一个方面,培养基包含以下浓度的铁、铜、锌和锰,或者以下浓度的锌和锰:
(i)
-(a)铁—从0μM至25μM;
-(b)铜—从0μM至0.1μM;
-(c)锌—从20μM至多于50μM;和
-(d)锰—从0.01μM至多于3μM;或者
(ii)
-(a)锌—从20μM至多于50μM;和
-(b)锰—从0.01μM至多于3μM。
在发酵培养条件下在真核细胞中在重组糖蛋白的生产中使用分别包含(i)或者(ii)中的浓度的铁、铜、锌和锰或者锌和锰的培养基有利于所表达的N-糖基化糖蛋白中的成熟度增加。
在一个方面,培养基包含以下任一组浓度的铁、铜、锌和锰:
(i)
-(a)铁—从0μM至35μM;
-(b)铜—从0μM至1μM;
-(c)锌—从0μM至20μM;和
-(d)锰—从0μM至0.01μM;或者
(ii)
-(a)铁—从15μM至多于80μM;
-(b)铜—从0.3μM至多于2.5μM;
-(c)锌—从0μM至20μM;和
-(d)锰—从0μM至0.01μM。
在发酵培养条件下在真核细胞中在重组糖蛋白的生产中使用包含上面(i)或(ii)的铁、铜、锌和锰浓度的培养基有利于不成熟的非岩藻糖基化糖蛋白的产生。
附图描述
图1:发酵期的工艺步骤。例如初级种子库(PSB)的冷冻小瓶,在种子培养培养基中解冻。在此,将细胞培养约三周以从解冻应激中恢复(使细胞倍增时间正常化)。细胞随后被转到接种培养n-1和n-2,用于培养物的扩增。大约一周后,细胞被转到生产规模,用于为时两周的补料分批发酵工艺。
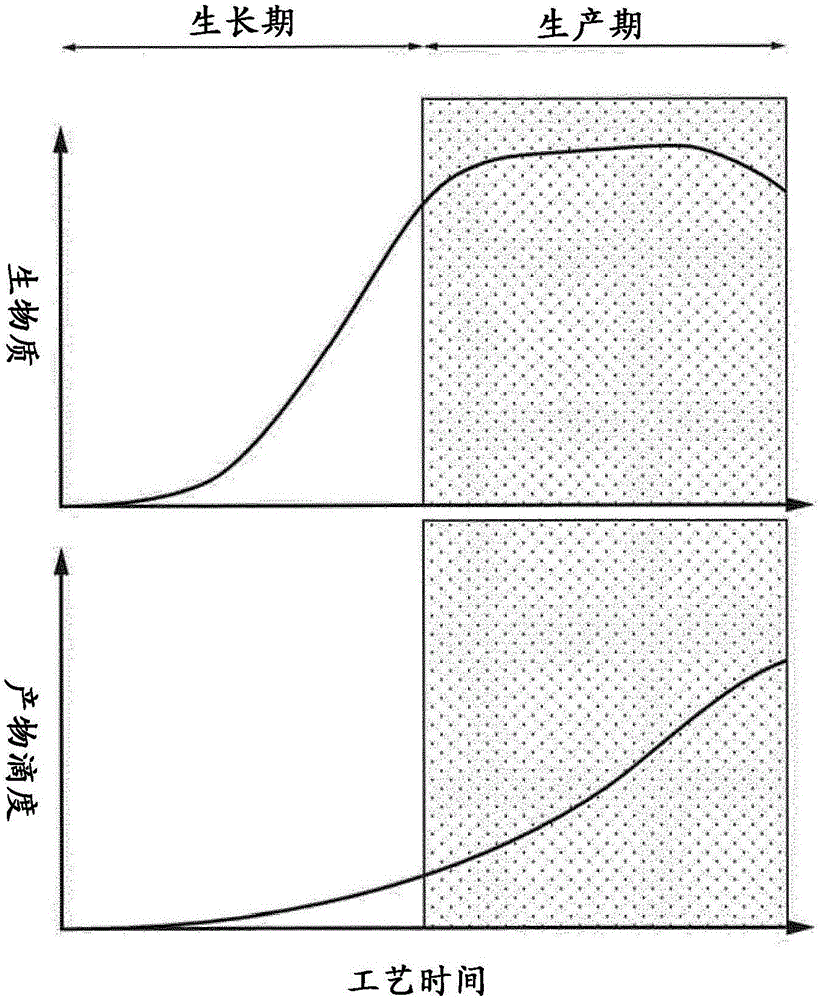
图2:补料分批工艺的特征在于两个表型不同的阶段。生产阶段被分为两个部分,其中细胞生长或目标蛋白产生分别占主导地位。
图3:用于DoE实验的不同方法。根据期望的实验结果,不同的DoE方法可以用于工艺优化。例如,三个因素的优化通常在最小(-1)、中等(0)和最大水平(+1)之间变化用于优化DoEs。(图片采用自http://www.gmpua.com,并进行了修改)。
图4:微量元素对克隆独立性单抗半乳糖基化的影响。在实验开始时,使用专有细胞培养平台A(培养基和工艺),将铝、钼、钡、铬、溴、碘、铜、锰、铷、银、锌、锡和锆盐储液补充至克隆1(n=4)和克隆3(n=3)的补料分批培养物。通过用现有的实验数据建模G1(A、B)和G2(C、D)水平,分析了微量元素在第7、12和13天对单抗半乳糖基化的影响。实际对预测图(A、C)中的每个点代表单个培养实验。关于G1(B)和G2(D),各微量元素对G1和G2水平的统计显著性通过平均而集中,并且通过范围/2而衡量。
图5:通过锰来调控单抗半乳糖基化的时机。通过JMP软件的预测分析器工具分析了锰对克隆3(板5、6和7)聚糖形成的G1(A)和G2(B)的显著影响。锰对G1和G2的正面影响关于早期工艺阶段(第7天)和后期工艺阶段(第13天)的差异高达100%(预测分析器曲线中的斜率)。该实验以n=3进行。
图6:组合的锌、铁、铜和锰补充对细胞生长、半乳糖基化和非岩藻糖基化糖蛋白种类的不同影响。在DoE实验中,采用克隆2的补料分批实验补充有不同浓度的锌、铁、铜和锰。分析了最大活细胞密度(A-C)、最终细胞时间积分(D-F)、G1种类(G-I)和甘露糖基化种类w/o Fuc的总和(J-L)的影响。对于每个特定模型,预测模型(A、D、G、J)和排序参数估计(B、E、H、K)显示了质量和分别对细胞生长和糖基化具有显著因子的微量元素。用JMP预测分析器的最大化工具确定了在补料分批培养中用于最佳细胞生长(C、F)、糖蛋白的最佳半乳糖基化(I)和高的非岩藻糖基化(afucosylated)糖蛋白种类(L)的锌、铁、铜和锰的最佳浓度(灰色数字:归一化浓度,水平虚线:最大值)。请注意,对于糖基化来说,微量元素锌和铜显示出反向相互作用。
图7:锌和铜对非岩藻糖基化糖蛋白种类的相互作用。使用JMP预测分析器工具分析了锌水平对铜与甘露糖基化聚糖种类的相关性的影响。中等水平的锌和铜(A),平衡的锌和铜水平(B),高锌和中等铜水平(C),低锌和低铜水平(D),低锌和中等铜水平(E),高锌和低铜水平(F),中等锌和高铜水平(G)中,高锌和高铜水平(H),中等锌和低铜水平(I),高铜浓度时锌水平-0.2(即25.416μM)(J)。
图8:细胞生长、半乳糖基化和非岩藻糖基化糖蛋白种类的锌、铁、铜和锰的最佳浓度。使用关于VCD、CTI、单抗半乳糖基化和高甘露糖聚糖(Man5)的水平的单一有效预测模型,示出了不同的锌、铁、铜和锰变化的影响。
图9:通过有目标的微量元素浓度调节细胞生长。使用克隆2和专有培养基和工艺平台B,在三个生物反应器补料分批实验(“afucosylation”(三角形)、“生长”(方形)和“半乳糖基化”(圆形))中测试了有利于细胞生长和单抗糖基化的预测的微量元素浓度(A)。分析了对活细胞密度(B)、细胞时间积分(C)和细胞生存力(D)的影响。Afucosylation与非岩藻糖基化相同。
图10:通过补充铜的不同的细胞代谢。在“糖基化”阶段(d6-d14)中使用“半乳糖基化”工艺减少了最终的铵(A)并提高了乳酸盐(B)水平。与对照和“生长”工艺相比,作为溶解的细胞的标志物的LDH评估显示降低50%的水平。
图11:通过有目标的微量元素浓度调节半乳糖基化和非岩藻糖基化种类。使用克隆2和专有培养基和工艺平台B,在三个生物反应器补料分批实验(“afucosylation”(三角形)、“生长”(方形)和“半乳糖基化”(圆形))中测试了有利于单抗糖基化的预测的微量元素浓度。分析了有目标的微量元素调节对Man5(A)、G0(B)和G1(C)种类以及对累积的非岩藻糖基化种类(D)的相对丰度的影响。
图12:微量金属对克隆1上的细胞生长和半乳糖基化/非岩藻糖基化的作用—生物反应器补料分批实验。在三个生物反应器补料分批实验中测试了有利于细胞生长和调节单抗糖基化成熟的预测的微量元素浓度,所述实验结合了接种培养(阶段n-2/n-1)期间的良好和不良细胞生长和补料分批(阶段n)中的单抗半乳糖基化和非岩藻糖基化(形成不成熟的聚糖)。测试用例应该在接种培养和生产阶段期间特异性地调节细胞生长、蛋白质半乳糖基化和不成熟的糖基化(A)。用于预期实验设置的不同微量元素浓度描绘于(B)。生物反应器“GG”(菱形)支持细胞生长和蛋白质半乳糖基化,生物反应器“GA”(方形)支持细胞生长和单抗非岩藻糖基化,并且,生物反应器“AA”(三角形)抑制细胞生长并引发蛋白质非岩藻糖基化。分析了对活细胞密度(C)、细胞时间积分(D)、第6天和第14天的单抗成熟(合计G1和G2种类)(E)以及第6天和第14天的单抗不成熟(合计Man6、Man5和G0-GlcNAc)(F)的影响。
图13:关于生物反应器实验1的铁、锌、锰和铜的测量浓度。通过细胞培养上清液的ICP-MS分析测量的铜(A)、铁(B)、锰(C)和锌(D)的实际浓度被示出。理论上的锌、铁、锰和铜浓度的逐渐增加是在第3、5和9天进行团注进料的结果。在第6天分开培养物。
图14:在生物反应器实验2中用于培养基计算的铁、锌、锰和铜浓度。通过细胞培养上清液的ICP-MS分析测量的用于代表性补料分批培养(包括克隆1、克隆2、克隆3、克隆4的阶段n-2、n-1、n(n>3))的锌(A)、锰(B)、铁(C)和铜(D)的实际浓度。
图15:锌和锰对半乳糖基化糖蛋白种类的相互作用。使用JMP预测分析器工具分析了克隆2的锌水平对锰与半乳糖基化G1聚糖种类的相关性的影响。低水平的锌和高水平的锰(A),低水平的锌和低水平的锰(B),高水平的锌和低水平的锰(C),高水平的锌和高水平的锰(D)。
图16:锌和锰对半乳糖基化糖蛋白种类的相互作用是时间依赖性的。使用JMP预测分析器工具分析了克隆1(n=4)和克隆3(n=3)的锌水平对锰与半乳糖基化G1和G2聚糖种类的相关性的影响。高水平的锌和高水平的锰(A),高水平的锌和低水平的锰(B),低水平的锌和低水平的锰(C),低水平的锌和高水平的锰(D)。
术语
如本文中使用的“调整”是指增加或降低培养基中元素的浓度。元素的浓度的增加或降低是相对于紧接调整之前的培养阶段的培养基中该元素的浓度而言的。例如,如果所述调整是微量元素的增加并且在生产阶段的开始时是必需的,那么这是那些微量元素的浓度相对于紧接生长阶段之前的培养基中所包含的那些元素的浓度的增加。
如本文中使用的“调整浓度”是指,在给定时间点,包围细胞的培养基中元素的经测量的或可测量的实际浓度的变化,或者,经计算的或可计算的实际浓度的变化。
如本文中使用的“影响”是指导致细胞的过程的变化的动作,所述细胞的过程是生物质产生或N-聚糖成熟度。由此产生的效果可以是例如生物质产生的增加或具有期望的糖基化模式的糖蛋白的产生的增加。
如本文中使用的“和/或”应当理解为,在有或没有另一者的情况下,两个指定的特征或组分中每一个的具体公开。例如“A和/或B”应当理解为具体公开了(i)A、(ii)B和(iii)A和B中的每一个,就如同在本文中单独陈述每一个那样。
如本文中使用的“抗体”是指免疫球蛋白分子或免疫球蛋白分子的免疫活性部分,即包含抗原结合位点的分子,如Fab或F(ab’)2片段,不论是天然产生还是部分或全部合成产生。术语“抗体”以其最广泛的意义使用,并且涵盖单克隆抗体(包括具有免疫球蛋白Fc区的全长抗体或完整的单克隆抗体)、具有多表位特异性的抗体组合物、多克隆抗体、多价抗体(通常被工程化以具有三个或更多个抗原结合位点)、由至少两个完整抗体形成的多特异性抗体(例如双特异性抗体),双抗体和单链分子如scFv分子,以及抗体片段(例如Fab、F(ab’)2和Fv)。包括在抗体定义内的是抗体缀合物,如抗体药物缀合物(ADCs)或与例如标签要素缀合的抗体。
如本文中使用的“生物质”是指培养基中所培养的细胞的数量或重量。生物质可以通过确定活细胞密度、总细胞密度、(关于活细胞密度和总细胞密度的)细胞时间积分、(关于活细胞密度和总细胞密度的)细胞体积时间积分、细胞压积、干重或湿重直接地或间接地测量。
如本文中使用的“生物反应器”是指用于哺乳动物细胞培养物生长的任何容器。通常,生物反应器将是至少1升,并且可以是10、100、250、500、1000、2500、5000、8000、10,000、12,000升或更大,或者是它们之间的任何体积。在培养期间,生物反应器的内部条件(包括但不限于pH值、溶解氧和温度)通常受到控制。生物反应器可以由适合于使哺乳动物细胞培养物在本发明的培养条件下在培养基中保持悬浮的任何材料制成,包括玻璃、塑料或金属。
“细胞”和“细胞系”在本文中可以互换使用,并且,所有这类名称都包括子代。
如本文中使用的“细胞密度”是指在给定体积的培养基中存在的细胞的数量。
如本文中使用的“细胞生存力”是指细胞在给定的一组培养条件或实验变量下在培养物中存活的能力。如本文中使用的该术语也指,相对于在特定时间在培养物中活的或死的细胞的总数量,其中在那个时间是活的细胞的那部分。
如本文中使用的“螯合剂”是指能够通过形成螯合物(即,通过结合金属离子)来抑制化学活性的化合物。
如本文中使用的关于微量元素铁、铜、锌和锰的“浓度”是指在培养基内包含的每一种微量元素的量。浓度可以是在给定时间点包围细胞的培养基中元素的经测量的或可测量的实际浓度,或者,经计算的或可计算的实际浓度。用于测量培养基中这些微量元素的浓度的方法在本领域中是已知的。这类方法的例子包括ICP-MS(Agilent,Germany)。因此,浓度也指在培养期间包围细胞的培养基中包含的每一种微量元素的量,并且因此是相应的微量元素在给定时间点的实际浓度。该浓度可以通过分析来确定,并且,该浓度由以下情况产生,例如,将所述元素引入培养物中(通过称重、通过从预培养物转移细胞和培养基、通过引入杂质、通过沥滤等),来自细胞释放(例如通过细胞死亡或通过主动分泌),来自细胞摄取以及其他因素。
如本文中使用的“铜”是指Cu2+阳离子。
如本文中使用的“培养物”或“细胞培养物”是指,在适于该细胞群体的存活和/或生长的条件下,在培养基中悬浮的细胞群体。这些术语将也应用于培养基和其中悬浮的细胞群体的组合。
“培养条件”和“发酵条件”在本文中可以互换使用,并且是指必须满足以实现成功的细胞培养的那些条件。通常,这些条件包括适当的培养基的供应,以及例如温度(温度应为约37℃,但也可能包括培养期间的温度偏移(例如37℃至34℃))和pH值(通常是6.8和7.2之间)的控制,以及氧气和二氧化碳的供应。这类条件还包括细胞培养的方式,例如摇床或自动培养。
如本文中使用的关于微量元素铁、铜、锌或锰的浓度的“降低”意指,相对于在紧前的阶段或部分阶段中其中培养细胞的培养基中那些微量元素的浓度,所述培养基中那些微量元素的浓度的降低。
如本文中使用的“有利于”意指,与在相同条件下但其中铁、铜、锌和锰中每一种的浓度没有根据本发明的方法调整时的细胞生长相比,细胞在规定方向上的活性将是增强的。例如,当有利于生物质产生时,对培养基中微量元素浓度的调整将导致细胞被引导为更加朝向增殖,而不是朝向糖蛋白的产生。因此,生物质产生将增加。在本文中与“有利于”同义的是“提高”或“增强”。
如本文中使用的“补料分批培养”是指一种培养细胞的方法,其中,在培养过程开始之后的一个或多个时间将附加组分提供至培养物中。补料分批培养通常在某一点停止,并且,培养基中的细胞和/或组分被收获并任选地纯化。
如本文中使用的关于糖蛋白的“半乳糖基化”是指糖蛋白包含一个或多个半乳糖残基,形成G1和G2糖结构。
如本文中使用的“基因”是指编码多肽的任何核苷酸序列、DNA或RNA、其至少一些部分。任选地,基因不仅包括关于多肽的编码序列,而且包括编码序列之前和/或之后的调节表达的基础水平的区域和/或编码区段或外显子之间的内含子。
如本文中使用的“糖形式”是指附接有不同糖类的糖蛋白的几种不同形式中的任一种。
如本文中使用的“糖蛋白”是指包含一个或多个共价连接的寡糖链的蛋白质或多肽。所述寡糖链可以由单个糖残基、单个不分支的链或多个糖残基组成,或者可以由一连串分支一次或多次的糖残基组成。寡糖链可以是N-连接的或O-连接的。
如本文中使用的“宿主细胞”是指可以工程化以产生糖蛋白的任何类型的细胞系统。
如本文中使用的关于微量元素铁、铜、锌或锰的浓度的“增加”意指,相对于在紧前的阶段或部分阶段中其中培养细胞的培养基中那些微量元素的浓度,所述培养基中那些微量元素的浓度的增加。
如本文中使用的“铁”意指Fe(III)(Fe3+)或Fe(II)(Fe2+)阳离子。
如本文中使用的“锰”是指Mn2+阳离子。
如本文中使用的“成熟度”和“糖蛋白成熟度”是指重组产生的糖蛋白中的糖基化模式。所有的N-糖基化蛋白质具有共同的五糖核心(核心=GlcNAc2Man3)和末端糖基化(发生于高尔基复合体),产生庞大的结构多样化,这归因于添加到核心上的寡糖的不同组合。因此,增加糖蛋白的成熟度涉及将寡糖单元添加到核心上,和/或对寡糖单元进行随后的修饰。因此,对N-聚糖成熟度的影响包括相对于核心结构或者相对于紧前的碳水化合物结构提高糖蛋白的成熟度。因此,随着核心结构通过添加寡糖单元或通过从不成熟的混合结构去除例如甘露糖残基而被修饰,糖蛋白的成熟度增加。因此,成熟度的增加例如包括,从例如Man3-5结构或从核心结构产生具有G0结构的糖蛋白。完全成熟的糖蛋白种类可以是含有一个或两个半乳糖残基的半乳糖基化种类,或者是含有一个或两个唾液酸残基的唾液酸化种类,如GlcNAc3Man3GlcNAc2Gal1、GlcNAc3Man3GlcNAc2Gal2、GlcNAc3Man3GlcNAc2Gal1Sia1、GlcNAc3Man3GlcNAc2Gal2Sia1和GlcNAc3Man3GlcNAc2Gal2Sia2。不成熟的糖蛋白可以是含有从4至9个甘露糖残基或不成熟混合结构的高甘露糖种类,如GlcNAc3Man5GlcNAc、GlcNAc3Man4GlcNAc和GlcNAc3Man3GlcNAc。在一些情况下,希望产生这样的糖蛋白,其中在正常情况下加入的糖残基不那样加入。本文中包括的是部分或完全非岩藻糖基化的糖蛋白,其缺乏核心岩藻糖残基,例如G0-F、G1-F和G2-F。成熟和不成熟的糖蛋白种类可以是非岩藻糖基化的,即,它们可以缺乏核心岩藻糖残基。
“培养基(medium)”、“细胞培养基”和“培养基(culture medium)”在本文中可以互换使用,并且是指含有维持哺乳动物细胞生长的营养素的溶液。通常,这类溶液提供必需和非必需氨基酸、维生素、能量来源、脂质和微量元素,这些是细胞为了最低量生长和/或存活所需的。这样的溶液还可以含有增强生长和/或存活超过最低速率的补充组分,包括但不限于,激素和/或其他生长因子,特定的离子,如钠、氯化物、钙、镁和磷酸盐,缓冲液,维生素,核苷或核苷酸,微量元素,氨基酸,脂质和/或葡萄糖或其他能量源。培养基被有利地配制成对于细胞存活和增殖来说最优的pH值和盐浓度。培养基可以是低血清培养基或无血清培养基,即,其中分别来说,所述培养基含有约1-5%血清或当所述培养基基本上不含有任何哺乳动物血清(例如胎牛血清)时。基本上不含有,意指所述培养基含有0-5%之间的血清,优选约0-1%之间的血清,并且最优选约0-0.1%之间的血清。可以使用无血清的确定的培养基,其中培养基的各组分的身份和浓度是已知的。培养基可以是无蛋白质培养基,即,这将不含有蛋白质,但将含有不限定的肽,例如来自植物水解产物。培养基可以含有人血清白蛋白和人转铁蛋白,但也可能含有动物来源的胰岛素和脂质,或者,含有人血清白蛋白、人转铁蛋白、人胰岛素和化学上确定的脂质的无异源(xeno-free)培养基。可选地,培养基可以是化学上确定的培养基,那是指这样一种培养基,其中所有物质都是确定的并且以确定的浓度存在。这些培养基可以仅含有重组蛋白和/或激素或无蛋白质的化学上确定的培养基,即,仅含有低分子量成分和合成肽/激素(如果需要的话)。化学上确定的培养基也可以完全不含任何蛋白质。
“非岩藻糖基化糖蛋白”是缺乏一个或多个核心N-岩藻糖残基的成熟的或不成熟的糖蛋白。这些结构可以是本身非岩藻糖基化的,因为该糖蛋白天然地不包含岩藻糖残基,或者它们可以是归因于缺少在天然情况下预期将存在于该糖蛋白中的岩藻糖残基而非岩藻糖基化的。在本申请中,非岩藻糖基化的(non-fucosylated)和afucosylated可以互换使用。
如本文中使用的“灌注培养”是指一种培养细胞的方法,包括使细胞在接种基础培养基上生长,并且,当细胞达到期望的细胞密度时,用新鲜培养基更换用过的培养基。灌注可以包括连续或间歇性的灌注,并且可以包括将至少一次团注进料输送至细胞培养物。灌注培养之后可以是补料分批培养。
如本文中使用的“多肽”是指经由肽键连接在一起的氨基酸顺序链。不针对这样的氨基酸链施加长度限制,所述氨基酸链可以包含从2个至许多个氨基酸。多肽可以被加工和/或修饰,如,通过糖基化。
如本文中使用的“蛋白质”是指一个或多个作为离散单元起作用的多肽。当蛋白质仅包含一个多肽而起作用时,术语多肽和蛋白质是可互换的。
如本文中使用的“重组糖蛋白”或“重组表达的糖蛋白”是指由宿主细胞表达的糖蛋白,所述宿主细胞为这类表达的目的而被操作。操作包括一种或多种基因修饰,如引入一个或多个编码待表达糖蛋白的异源基因。异源基因可以编码在正常情况下在该细胞中表达的糖蛋白或者对于该宿主细胞来说是外来的糖蛋白。可选地,操作可以是上调或下调一个或多个内源基因。
如本文中使用的“分开”也被称为传代或细胞的传代培养。这涉及到将少数细胞转移到新鲜培养基中,由此分开的细胞接种新的培养物。在悬浮培养中,含有少数细胞的少量培养物被稀释到较大体积的新鲜培养基中。
如本文中使用的“滴度”是指在给定量的培养基体积中由哺乳动物细胞培养物产生的重组表达的糖蛋白的总量。滴度通常以毫克糖蛋白/毫升培养基的单位表示。
如本文中使用的“锌”是指Zn2+阳离子。
本文中使用下列缩写:
Asn 天冬酰胺
ADCC 抗体依赖性细胞毒作用
CTI 细胞时间积分
CDC 补体依赖性细胞毒作用
CMP 单磷酸胞苷
CTP 三磷酸胞苷
GDP 二磷酸鸟苷
GTP 三磷酸鸟苷
ICP-MS 电感耦合等离子体质谱
LDH 乳酸脱氢酶
UDP 二磷酸尿苷
UTP 三磷酸尿苷
mAb 单克隆抗体
PSB 初级种子库
PSE 伪标准误差
RSME 设计标准误差
Fuc L-岩藻糖
Gal D-半乳糖
GlcNAc N-乙酰葡糖胺
NANA N-乙酰神经氨酸
Man D-甘露糖
Man5 GlcNAc2Man5
Man6 GlcNAc2Man6
高甘露糖 GlcNAc2Man5-8
核心 GlcNAc2Man3
G0 GlcNAc Fuc GlcNAc Man3GlcNAc2
G0-F GlcNAc GlcNAc Man3GlcNAc2
G1 GlcNAc Fuc GlcNAc Man3GlcNAc2Gal
G1-F GlcNAc GlcNAc Man3GlcNAc2Gal
G2 GlcNAc Fuc GlcNAc Man3GlcNAc2Gal2
G21SA GlcNAc Fuc GlcNAc Man3GlcNAc2Gal2NANA1
复合物 GlcNAc Fuc GlcNAc Man3GlcNAc2Gal0-2
复合物-F GlcNAc GlcNAc Man3GlcNAc2Gal0-2
详细说明
本发明涉及用于在发酵培养条件下在真核细胞中产生重组糖蛋白的方法和培养基,所述方法包括在培养期间调整培养基中铁、铜、锌和锰中每一种的浓度,从而影响生物质产生和/或所表达的糖蛋白的N-聚糖成熟度。
在一个方面,本发明的方法包括调整培养基中铁、铜、锌和锰中每一种的浓度,以有利于生物质产生。作为其结果,培养基中所培养的细胞的数量或重量将有增加。可以使用本领域中已知的技术,通过确定活细胞密度、总细胞密度、(关于活细胞密度和总细胞密度的)细胞时间积分、(关于活细胞密度和总细胞密度的)细胞体积时间积分、细胞压积、干重或湿重来测量生物质。
在一个方面,本发明的方法包括调整培养基中铁、铜、锌和锰中每一种的浓度,或者仅锌和锰的浓度,以影响所表达的糖蛋白中的N-聚糖成熟度。N-聚糖成熟度是指糖基化模式,这使得所述糖蛋白将包含全部、基本上全部或少于全部的基因上预期的聚糖残基,即,由内源性基因编码的糖基化酶添加的聚糖残基。
在一个优选的实施方案中,对培养基中铁、铜、锌和锰中每一种的浓度或者仅锌和锰的浓度的调整将用于增加所表达的糖蛋白中的成熟度。这类所表达的糖蛋白中的碳水化合物模式的例子是:GlcNAc Fuc GlcNAc Man3GlcNAc2(G0);GlcNAc Fuc GlcNAc Man3GlcNAc2Gal(G1)和GlcNAc Fuc GlcNAc Man3GlcNAc2Gal2(G2)。这里还包括成熟的非岩藻糖基化糖蛋白,如GlcNAc GlcNAc Man3GlcNAc2(G0-F)和GlcNAc GlcNAc Man3GlcNAc2Gal0-2(G1-F,G2-F)。在特别优选的实施方案中,具有G0、G1和/或G2碳水化合物结构的糖蛋白将是有利的。
在另一个优选实施方案中,对培养基中铁、铜、锌和锰中每一种的浓度的调整将影响糖蛋白的产生,所述糖蛋白是不成熟的非岩藻糖基化糖蛋白。这类不成熟的非岩藻糖基化糖蛋白中的糖基化模式的例子是高甘露糖的糖蛋白,即,含有Man5、Man6和Man7的那些,如:GlcNAc2Man5-8,例如GlcNAc2Man5和GlcNAc2Man6。
本发明涉及重组糖蛋白的生产。对所述糖蛋白的性质不作限制,只要它可以通过发酵培养产生并在真核细胞中表达即可。适合于通过该方法生产的糖蛋白包括分泌性糖蛋白和膜结合糖蛋白和/或对于真核细胞来说是外源性或内源性的糖蛋白,包括,例如,结构糖蛋白、激素、抗体、酶等。
在本发明的优选实施方案中,该糖蛋白是抗体,典型地是治疗性或诊断性抗体,并且,在另外的实施方案中,该抗体是嵌合抗体、人源化抗体或人抗体。
当该糖蛋白是抗体时,该抗体可以是在治疗方面有效的抗体并且可以结合至任何蛋白质,包括血管生成素家族的成员,如Ang1、Ang2、Ang3和Ang4,和双特异于血管生成素家族的成员和例如VEGF(如Ang2/VEGF)的抗体;HER受体家族的成员,如HER1(EGFR)、HER2、HER3和HER4;CD蛋白如CD3、CD4、CD8、CD18、CD19、CD20、CD21、CD22、CD25、CD33、CD34、CD38、CD40、CD44和CD52;细胞粘附分子,如LFA-1、VLA04、ICAM-1、VCAM和整合素,包括其α或β亚基(例如,抗CD11a、抗CD18或抗CD11b抗体);生长因子如血管内皮生长因子(VEGF);细胞因子受体如胸腺基质淋巴细胞生成素受体(TSLP-R);IgE;血型抗原;flk2/flt3受体;肥胖(OB)受体和蛋白C。其他示例性的蛋白质包括生长激素(GH),包括人生长激素(hGH)和牛生长激素(bGH);生长激素释放因子;甲状旁腺激素,促甲状腺激素;脂蛋白;α-1抗胰蛋白酶;胰岛素A链;胰岛素B链;胰岛素原,卵泡刺激素;降钙素;促黄体激素;胰高血糖素;凝血因子如因子VIIIC;组织因子(TF);血管性血友病因子;心钠素;肺表面活性剂;纤溶酶原激活剂如尿激酶或组织型纤溶酶原激活剂(t-PA),邦巴津织物(bombazine),凝血酶,肿瘤坏死因子-α和肿瘤坏死因子-β;脑啡肽;RANTES(活化正常T细胞表达和分泌的调节物);人巨噬细胞炎性蛋白(MIP-1-α);血清白蛋白如人血清白蛋白(HSA);苗勒氏抑制物质;松弛素A链,松弛素B链;松弛素原;小鼠促性腺激素相关肽;脱氧核糖核酸酶;抑制素;激活素;激素或生长因子的受体;蛋白A或蛋白D;成纤维细胞活化蛋白(FAP);癌胚抗原(CEA);类风湿因子;神经营养因子如骨源性神经营养因子(BDNF);神经营养蛋白-3、-4、-5或-6(NT-3、NT-4、NT-5或NT-6)或神经生长因子如NGF-β;血小板源生长因子(PDGF);成纤维细胞生长因子如aFGF和bFGF;表皮生长因子(EGF)和表皮生长因子受体(EGFR);转化生长因子(TGF)如TGF-α和TGF-β,包括TGF-β1、TGF-β2、TGF-β3、TGF-β4或TGF-β5;胰岛素样生长因子-I和-II(IGF-I和IGF-II);去(1-3)-IGF-I(脑IGF-I);胰岛素样生长因子结合蛋白(IGFBPs);促红细胞生成素(EPO);血小板生成素(TPO);骨诱导因子;免疫毒素;骨形态发生蛋白(BMP);干扰素(干扰素-α,-β或-γ);细胞集落刺激因子(CSFs)例如M-CSF、GM-CSF和G-CSF;白细胞介素(ILs),例如IL-1至IL-10和IL-17;超氧化物歧化酶;T细胞受体;BlyS(Br3)受体;Br3-Fc免疫粘附素;Apo-2受体;Fc受体;表面膜蛋白;衰变加速因子(DAF);病毒抗原,如,举例来说,AIDS包膜的一部分;转运蛋白;归巢受体;地址素;调节蛋白;免疫粘附素;以及以上任一个的生物活性片段或变体。可选地,抗体可以是针对乳腺上皮细胞或与结肠癌细胞结合的抗体、抗EpCAM抗体、抗GpIIb/IIIa抗体、抗RSV抗体、抗CMV抗体、抗HIV抗体、抗肝炎抗体、抗CA 125抗体、抗αvβ3抗体、抗人肾细胞癌抗体、抗人17-1A抗体、抗人结肠直肠肿瘤抗体、针对GD3神经节苷脂的抗人黑素瘤抗体R24、抗人鳞状细胞癌、抗人白细胞抗原(HLA)抗体、抗HLA DR抗体。
根据本发明的方法,重组糖蛋白在真核细胞中产生。可以根据本发明使用对细胞培养和对糖蛋白的表达敏感的任何真核细胞。真核细胞优选这样的真核细胞系,当在含有适当的营养素和生长因子的培养基中置于悬浮培养时,其能够生长和存活,并且,其通常能够将大量的感兴趣的特定糖蛋白表达和分泌进入培养基。
在一个优选的实施方案中,真核细胞是哺乳动物细胞、酵母细胞或昆虫细胞。
当所述真核细胞是哺乳动物细胞时,这可以是,例如,NSO小鼠骨髓瘤细胞系,由SV40转化的猴肾CVI系(COS-7,CRL 1651);人胚肾细胞系293S(Graham等人,J.Gen.Virol.36(1977)59);幼仓鼠肾细胞(BHK,CCL 10);小鼠睾丸支持细胞(TM4,Mather,Biol.Reprod.23(1980)243);猴肾细胞(CVI-76,CCL 70);非洲绿猴肾细胞(VERO-76,CRL 1587);人宫颈癌细胞(HELA,CCL 2);犬肾细胞(MDCK,CCL 34);布法罗大鼠肝细胞(buffalo rat liver cells)(BRL 3A,CRL 1442);人肺细胞(W138,CCL 75);人肝细胞(Hep G2,HB 8065);小鼠乳腺肿瘤细胞(MMT060562,CCL 5I);大鼠肝癌细胞(HTC,MI.54,Baumann等人,J.Cell Biol.,85(1980)1);以及TR-1细胞(Mather等人,Annals N.Y.Acad.Sci.383(1982)44),PER.C6细胞系(Percivia LLC)和杂交瘤细胞系。
中国仓鼠卵巢细胞(CHO,Urlaub和Chasin P.N.A.S.77(1980)4216)或PER.C6是用于实践本发明的优选细胞系。适合于在本文中使用的已知CHO衍生物包括,例如CHO/-DHFR(Urlab和Chasin,同上),CHOK1SV(Lonza),CHO-K1DUC B11(Simonsen和Levinson P.N.A.S.80(1983)2495-2499)和DP12CHO细胞(EP 307,247)和CHO DG44细胞(Derouazi等人,Biochem.Biophys.Res.Commun.340(2006)1069-77)。
当真核细胞是酵母细胞时,这可以是,例如,酿酒酵母或毕赤酵母。
当真核细胞是昆虫细胞时,这可以是,例如,Sf-9。
本发明中使用的真核细胞可以是糖工程化细胞,其中细胞已被工程化,以便改变其糖基化谱。这类工程化包括,例如,与N-聚糖的合成有关的基因敲除或基因敲入。
在本发明中最优选的是,所述细胞是CHO细胞,任选糖工程化CHO细胞。
对本发明中使用的真核细胞进行选择或操作以产生重组糖蛋白。操作包括一个或多个基因修饰,如引入一个或多个编码待表达糖蛋白的异源基因。该异源基因可以编码这样的糖蛋白,该糖蛋白正常情况下在该细胞中表达,或者,该糖蛋白对于该宿主细胞来说是外来的。操作可以附加地或可选地用于上调或下调一个或多个内源基因、通常,对细胞进行如下操作以产生重组糖蛋白,例如,通过引入编码该糖蛋白的基因,和/或,通过引入调控编码感兴趣糖蛋白的基因的表达的控制元件。编码重组糖蛋白的基因和/或控制元件可以经由载体(如,质粒、噬菌体或病毒载体)而被引入到宿主细胞中。某些载体能够在引入了这些载体的宿主细胞中自主复制,而其他载体可以整合到宿主细胞的基因组中,并由此与宿主基因组一起被复制。许多载体是公众可获得的,并且,载体的确切性质对于本发明来说并不重要。通常,载体组件包括一个或多个信号序列、复制起点、一个或多个标记基因、启动子和转录终止序列。在WO 97/25428中描述了这类组件。
根据本发明的方法,来自真核细胞的生物质产生和糖蛋白表达通过发酵培养条件下的细胞培养来实现。本发明可以使用适合于使细胞生长用于生物质产生和糖蛋白表达的任何发酵细胞培养方法或系统。例如,可以通过分批培养、补料分批培养或分开分批培养来生长细胞,其中在糖蛋白的充分表达已发生后中止培养,在这之后糖蛋白被收获并且(如果需要的话)进行纯化。如果使用补料分批培养,在培养期间可以进行一次或多次培养物补料。当进行多次补料时,可以使用相同或不同的补料溶液。在可选方案中,细胞可以在灌注培养中生长,其中不终止培养,并且,将新的营养素和组分周期地或连续地添加到培养物中并周期地或连续地移除所表达的糖蛋白。在优选的实施方案中,本发明中使用的细胞培养方法是补料分批或分开分批或两者的组合。
反应器、温度和用于生物质产生和糖蛋白生产的细胞发酵培养的其他条件(如,氧浓度和pH值)在本领域中是已知的。可以使用本领域中可用的信息来选择适用于所选真核细胞的培养的任何条件。培养条件(如,温度、pH值等)通常是先前关于被选择用于表达的宿主细胞使用的那些,并且,对于本领域技术人员来说将是显而易见的。如果需要的话,温度和/或pH值和/或CO2可以在培养期间进行改变,以提高产量和/或提高期望的糖蛋白品质的相对量。
其中培养细胞的和其中微量元素铁、铜、锌和锰的浓度根据本发明的方法进行调整的培养基可以是本领域中已知的多种培养基中的任一种。如果需要的话,所述培养基可以是化学上确定的培养基,其中培养基的组分是已知的并且是受控制的,或者,所述培养基可以是复合培养基,其中并非所有组分都是已知的和/或受控制的。
在最近的历史中,化学上确定的培养基已广泛开发和公布,包括用于培养哺乳动物细胞的这类培养基。确定的培养基的所有组分均被良好表征,并且,这类培养基不包含复杂添加剂如血清和水解产物。通常,这些培养基包含确定量的纯化的生长因子、蛋白质、脂蛋白、和可以另外由血清或提取补充物提供的其他物质。生产这类培养基的唯一目的是支持高产细胞培养。某些确定的培养基可以称为低蛋白质培养基,或者,如果低蛋白质培养基的典型组分胰岛素和转铁蛋白未被包含,可以称为无蛋白质培养基。无血清培养基可以另外用在本发明的方法中。这类培养基通常不包含血清或蛋白质级分,但是可能包含不确定的组分。
市售培养基的例子包括Ham’s F10(Sigma)、最小必需培养基(MEM,Sigma)、RPMI-1640(Sigma)和Dulbecco氏改良的Eagle氏培养基(DMEM,Sigma)以及由Life Technologies出售的化学上确定的培养基和进料补充物。任何这类培养基都可以根据需要补充激素和/或其他生长因子(如胰岛素、转铁蛋白或表皮生长因子);盐(如氯化钠、钙、镁和磷酸盐),缓冲剂(如HEPES);核苷(如腺苷和胸苷),抗生素(如GENTAMYCINTM),以及葡萄糖或等效能量源。
针对特定细胞系的、用于培养基的必需的营养素和生长因子包括它们的浓度可以根据经验确定并且无需过多的实验,如描述于,例如,Mammalian Cell Culture,Mather(Plenum Press:NY 1984);Barnes和Sato,Cell 22(1980)649或者Mammalian Cell Biotechnology:A Practical Approach M.Butler(IRL Press,1991)。合适的培养基包含基础培养基组分,如基于DMEM/HAM F12的配方,对其中一些组分(如氨基酸、盐、糖和维生素)的浓度进行改变,并且任选地包含甘氨酸、次黄嘌呤、胸苷、重组人胰岛素、水解蛋白胨(如PRIMATONE HSTM或PRIMATONE RLTM(Sheffield,England)或等价物)、细胞保护剂(如PLURONIC F68TM或等价物普兰尼克多元醇)和庆大霉素TM(GENTAMYCINTM)。
在下文中,表1示出不同市售细胞培养基中微量元素铁、铜、锌和锰的不同量,其中的任何一种均可用于细胞培养。
表1:商业培养基中的铁、铜、锌和锰的计算浓度
RPMI 1640和199是高级培养基
如果商业培养基补充有复杂成分,如血清或蛋白胨,那些培养基中的所计算的铁、铜、锌和锰的浓度(如上)将会改变。
当本发明的方法包括通过将铁、铜、锌和锰添加到培养基中而调整培养基中那些微量元素的浓度时,或者培养基包括调整后浓度的那些元素时,微量元素可以以金属盐的形式添加到或存在于培养基中。可以使用适合于包含在用于产生重组糖蛋白的培养基中的任何铁、铜、锌和锰盐。通常优选的是,金属盐为适当的金属硫酸盐、卤化物、氧化物、硝酸盐、柠檬酸盐、乙酸盐或磷酸盐的形式,呈水合或无水形式,或者金属离子结合至螯合剂,如转铁蛋白或乳铁蛋白。
通常,适合于在本发明中使用的铁(II)和(III)盐包括铁(III)-柠檬酸盐、FeSO4、FeCl2、FeCl3、Fe(NO3)3和FePO4以及与转铁蛋白或乳铁蛋白结合的铁。
通常,适合于在本发明中使用的铜(II)盐包括CuSO4、CuCl2和醋酸铜。
通常,适合于在本发明中使用的锌(II)盐包括ZnSO4和ZnCl2。
通常,适合于在本发明中使用的锰盐包括MnSO4、MnCl2、MnF2和MnI2。
本发明提供在发酵培养条件下的细胞培养。这通常是多步骤培养程序,其中细胞在若干步骤或阶段中进行培养。根据该优选程序,发酵培养工艺(例如来自细胞的冷冻小瓶)通常包括三个不同的阶段,如图1中所描绘的那样,即:
i)种子培养,用于解冻应激后细胞的恢复并使细胞倍增时间正常化,这可以持续14天至例如超过60天之间,取决于细胞恢复的速度和生产规模。在图1中,这被描绘为持续21天;
ii)生长阶段,或接种培养,其被称为n-x阶段(n是生产阶段),其中,x通常为1至5,优选1或2。在图1中,示出了n-1和n-2阶段。这些阶段也可以被称为一个或多个生长阶段,其中细胞被接种到适合于促进生长和生物质产生的培养基中。因此,n-x阶段通常为了培养物的扩增用于更大的培养形式和洗出所选化合物。当n-x阶段由n-1和n-2阶段组成时,n-1和n-2阶段中的每一个需要例如从2至7天,通常各持续3天或4天;和
iii)生产阶段,或n-阶段,用于以适当的数量和/或质量产生重组糖蛋白。该阶段的持续时间可以取决于例如重组细胞的性质以及所表达的糖蛋白的数量和/或质量。通常,该阶段将持续约11天至约20天之间。在图1中,该阶段被描绘为持续14天。
通过例如将新鲜培养基或营养补充物适当地添加至现有的培养基中,细胞可以维持在种子培养或维持在生长阶段合适的一段时间。
通常,生产阶段或n-阶段的特征是两个不同的阶段,如图2中所描绘的那样。这些阶段中的第一个阶段是生长阶段,这是为了产生足够的活生物质用于细胞特异性蛋白质产生,并且,其第二个阶段是为了产生重组糖蛋白,而没有显著的细胞生长。
种子培养、生长阶段和生产阶段中的任一个或全部可以是连续的,或者,来自一个阶段的细胞可以用于接种下一阶段。
在培养期过程中或在培养期结束时,优选生产阶段,回收所表达的糖蛋白可以使用本领域中已知的方法实现。糖蛋白优选作为分泌多肽从培养基回收,尽管当不带分泌信号而直接产生时,它可以从宿主细胞裂解物回收。如果糖蛋白是膜结合的,可以使用合适的去污剂溶液(例如Triton-X100)使其从膜释放,或者,可以通过酶促切割来释放其胞外区域。必要时可以使用本领域中已知的技术对所表达的糖蛋白进行分离和/或纯化。
在本发明的方法中,在发酵工艺的任何或全部生长或生产阶段中调整铁、铜、锌和锰的浓度。在优选的实施方案中,在生长阶段开始时或生长阶段期间和/或在生产阶段开始时或生产阶段期间调整铁、铜、锌和锰的浓度。最优选的是,在生长阶段开始时和在生产阶段开始时调整铁、铜、锌和锰的浓度,或者,在生长阶段开始时、生长阶段期间、生产阶段开始时和生产阶段期间中的任一个或全部调整铁、铜、锌和锰的浓度。
通过增加或降低培养基中铁、铜、锌和锰的浓度来调整那些微量元素的浓度。在本发明中,当增加或降低那些元素的浓度时,浓度的这种增加或降低是相对于紧接该增加或降低之前的培养阶段中的培养基中那些元素的浓度而言的。因此,如果在生产阶段开始时培养基中的例如铁、铜、锌和锰中每一种的浓度增加,这就是说,那些微量元素的浓度相对于紧前生长阶段的培养基中那些微量元素的浓度增加。同样地,如果在生产阶段期间培养基中的例如铁、铜、锌和锰中任一种或全部的浓度增加,这就是说,那些微量元素的浓度相对于紧前部分的生产阶段的培养基中那些元素的浓度增加。同样地,如果在任何生长或生产阶段开始时或期间培养基中的例如铁、铜、锌和锰中任一种或全部的浓度有降低,这就是说,那些微量元素的浓度相对于紧前培养阶段的培养基中那些微量元素的浓度有降低。同样地,如果在生产阶段开始时或期间培养基中的例如铁和铜的浓度有降低以及例如锌和锰的浓度增加,这就是说,与紧前培养阶段的培养基中那些微量元素的浓度相比,铁和铜的浓度有降低,以及,锌和锰的浓度增加。
通常优选的是,当在培养基中调节铁、铜、锌和锰中任一种或全部的浓度时,在同一时间调整所有这些微量元素的浓度。然而,本发明的方法也包括单独地、成对地、或通过同时调整铁、铜、锌和锰这些微量元素中的三个并随后调整第四个(或者,反之亦然)来调整铁、铜、锌和锰。尤其,如果要增加所述微量元素中两种的浓度并且要降低所述元素中两种的浓度,调整为增加或降低可以在同一时间或在不同时间发生。在那种情况下优选的是,增加两种微量元素的浓度的调整和降低两种元素的浓度的调整在同一时间点或在同一培养基中发生。
在本发明的方法中,调整铁、铜、锌和锰的浓度可以通过适合于所用发酵条件的任何技术来实现。调整这些微量元素的浓度的方法对于本发明来说不是至关重要的,并且,适当的方法在本领域中是已知的。因此,可以通过对正在培养细胞的培养基(在增加任何或全部微量元素的浓度的情况下)进行补充,或者,通过将全部或部分细胞转移(即,分开)到含有期望浓度的微量元素的新鲜培养基中,对微量元素浓度进行调整。如果需要的话,可以使用这两种方法的组合。
因此,对铁、锌、铜和锰的浓度的调整在整个或部分培养期中可以是连续的,或者可以是间歇的,例如作为对培养基中一种或多种微量元素的假定的、计算的或测量的浓度的反应。本发明限定了将微量元素的浓度调整到范围内。在限定培养期过程中,例如在生长或生产阶段期间,如果每一种或全部微量元素的浓度的实际测量或计算表明每一种或全部微量元素的浓度落入本文中列举的范围内,浓度的调整仍然可能发生,只要所得的微量元素浓度保持在所列举的范围内。
如果需要的话,在进行调整之前,可以使用已知技术来测量培养基中微量元素的实际浓度。这些包括在线和离线分析相应的微量元素浓度。
因此,如果正在使用分批发酵条件,可以通过以下方式实现微量元素浓度的增加,例如,通过接种到含有或补充有相对于现有培养基具有增加的浓度的适当微量元素的新鲜培养基中,或者,通过将细胞分开到含有或补充有相对于现有培养基具有增加的浓度的适当微量元素的培养基中。如果正在使用补料分批发酵条件,可以通过以下方式实现微量元素浓度的增加,例如,接种到含有或补充有增加的浓度的适当微量元素的新鲜培养基中,将适当微量元素的一次或多次团注或连续进料给至培养基;通过确定基于细胞数量的或根据已知代谢模型、代谢替代标志物等计算的进料速率,或通过将培养物分开到含有或已补充有增加的浓度的适当微量元素的培养基中。如果正在添加团注或连续进料,这可以包含除了铁、铜、锌和锰中任一种或全部以外的、培养所需的其他营养素/组分。如果正在使用灌注发酵条件,可以例如通过与正被添加至灌注培养物的其他营养素/组分同时或分开地将微量元素连续地或间歇地添加到反应器中,实现微量元素浓度的增加。
如果需要降低铁、锌、铜和锰中任一种或全部的浓度,这可以通过将细胞接种到这样的新鲜培养基中来实现,所述新鲜培养基中微量元素的浓度与紧前培养阶段的培养基中那些微量元素的浓度相比是降低的。可选地,或另外地,铁、锌、铜或锰中任一种或全部的浓度的降低可以在现有或新鲜培养基中通过金属离子的络合实现,例如通过将金属离子螯合剂添加至培养基并洗出被络合的金属离子。可以使用能够络合适当的金属离子从而导致培养基中那种金属离子的生物可利用浓度降低的任何金属离子螯合剂。用于铁和铜的合适的这类螯合剂包括,例如,小分子或金属结合蛋白,如,举例来说,EDTA,EGTA,铁载体如去铁胺、去铁硫辛、四环素、喹诺酮、膦酸酯、多酚类,蛋白质如转铁蛋白或铜蓝蛋白(ceruloplamin),多糖,有机酸如马来酸盐、suprizone、浴铜灵磺酸盐(bathocuproine sulphonate)、向红菲咯啉磺酸盐(bathophenanthroline sulphonate),以及D-青霉胺(D-pencillamine)。此外,可以通过由备选微量元素抑制/激活糖基化酶、通过与细胞转运蛋白靶向竞争或通过对细胞转运蛋白活性进行靶向调节来模仿降低微量元素浓度的效果。
金属的降低或增加的浓度的具体值基于培养基中金属的实际测量结果,或者基于包围细胞的培养液中金属的理论浓度或浓度计算结果。从业者将理解,可能会存在例如经由杂质所引入的或浸出的一些浓度的微量元素,并且,当根据本发明计算微量元素的降低或增加的浓度时将会考虑这些。
在本发明的方法中,优选的是,微量元素中任一种或全部的浓度的降低在适当时通过将细胞接种到这样的新鲜培养基中来实现,所述新鲜培养基中微量元素的浓度与紧前培养阶段的培养基中那些微量元素的浓度相比是降低的。
在本发明的某些实施方案中,可以在培养基中调整铁、铜、锌和锰的浓度,以有利于细胞的生长,并由此增加生物质。在其他实施方案中,可以在培养基中调整铁、铜、锌和锰的浓度或者仅锌和锰的浓度,以增加所表达的N-糖蛋白中的成熟度和具有成熟糖基化模式的糖蛋白的产量。在另一个实施方案中,可以调整铁、铜、锌和锰的浓度以有利于增加不成熟的非岩藻糖基化糖蛋白的产量。在又一个实施方案中,可以首先调整培养基中铁、铜、锌和锰的浓度以增强生长,并且随后再次调整以影响糖蛋白成熟度,从而增加所表达的N-糖基化糖蛋白的成熟度或增加不成熟的非岩藻糖基化糖蛋白的产量。
在本发明的方法中,在生长和/或生产阶段开始时或期间应用不同的微量元素浓度可以对生物质产生和所表达的糖蛋白中的N-糖基化成熟度产生直接作用,如下面的表2中所示。在这些培养阶段期间调整铁、铜、锌和锰的浓度导致在生物质产生和所表达的糖蛋白中的N-糖基化成熟度之间切换。表2中的“Afucosylation”与非岩藻糖基化相同。
表2:用于有目标的蛋白质生产的工艺策略
作为本发明的方法的结果,在针对期望的最终结果定制的培养基中培养产生糖蛋白的细胞。因此,如下面的表3中所示,生长培养基主要促进生物质产生,半乳糖基化培养基主要促进所表达的N-糖蛋白的成熟度的增加和成熟糖蛋白的产生,并且,非岩藻糖基化培养基主要促进不成熟的非岩藻糖基化糖蛋白的产生。每个培养基可能有一些互相关联的作用,使得其他结果可能受到一定程度的影响,如下所示,但期望的最终结果是有利的一个。
表3:定制的培养基和期望的结果之间的关系
在优选的实施方案中,本发明提供了增加培养基中铁、铜、锌和锰中每一种的浓度,以有利于细胞生长/生物质产生。在该实施方案中,在生长阶段开始时和/或期间以及任选地还在生产阶段开始时和/或期间增加铁、铜、锌和锰中每一种的浓度。该实施方案尤其适合于具有低生长能力的细胞、生物质和生产率耦合的细胞系以及如果期望低水平的成熟的半乳糖基化糖蛋白。
在备选的优选实施方案中,本发明提供了增加锌和锰中每一种的浓度并任选地降低培养基中铁和铜的浓度,以增加所表达的N-糖蛋白中的成熟度,合适地产生具有成熟的糖基化模式的糖蛋白并由此减少产生不成熟的糖蛋白,包括不成熟的非岩藻糖基化糖蛋白。在该实施方案中,在生长阶段开始时和/或在生产阶段开始时和/或期间调整铁、铜、锌和锰中每一种的浓度或者仅锌和锰的浓度。当期望低的细胞生长时,并且尤其是当所表达的糖蛋白复合有许多不期望的副产物时,通过在生长和生产阶段期间调整微量元素的浓度而有利于增加糖蛋白的成熟度和具有成熟糖基化模式的糖蛋白的产生是最佳的。当在生长阶段期间已经实现良好生长时,通过在生产阶段开始时调整培养基中微量元素的浓度而有利于增加的糖蛋白的成熟度和具有成熟糖基化模式的糖蛋白的产生是特别有用的。当关于生长阶段和在生产阶段开始时已经调整微量元素的浓度以确保良好的生物质产生时,通过在生产阶段期间调整培养基中微量元素的浓度而有利于增加的糖蛋白的成熟度和具有成熟糖基化模式的糖蛋白的产生是特别合适的。
在备选的优选实施方案中,本发明提供了降低培养基中铁、铜、锌和锰中每一种的浓度,以有利于不成熟的非岩藻糖基化糖蛋白的产生。在该实施方案中,在生长阶段开始时和/或在生产阶段开始时和/或期间调整铁、铜、锌和锰中每一种的浓度。当细胞生长良好时,通过在生长和生产阶段开始时调整微量元素的浓度而有利于不成熟的非岩藻糖基化糖蛋白的产生是最佳的。当在生长阶段期间已经实现良好生长时,通过在生产阶段开始时调整微量元素的浓度而有利于不成熟的非岩藻糖基化糖蛋白的产生是特别有用的。当关于生长阶段和在生产阶段开始时已经调整微量元素的浓度以确保良好的生物质产生时,通过在生产阶段期间调整培养基中微量元素的浓度而有利于不成熟的非岩藻糖基化糖蛋白的产生是特别合适的。
在备选的优选实施方案中,本发明提供了在生长阶段开始时和任选地在生产阶段开始时增加培养基中铁、铜、锌和锰中每一种的浓度,以有利于细胞生长/生物质产生,以及附加地,在生产阶段开始时或期间增加锌和锰中每一种的浓度并降低培养基中铁和铜的浓度,使得增加糖蛋白的成熟度,例如,使得相对于不成熟的糖蛋白(包括不成熟的非岩藻糖基化糖蛋白)的产生来说更有利于具有成熟的N-糖基化模式的糖蛋白的产生。在该实施方案中,当在生产阶段开始时增加铁、铜、锌和锰的浓度以有利于生物质产生时,通过在生产阶段期间进一步调整那些微量元素的浓度,增加糖蛋白的成熟度,例如,有利于具有成熟的N-糖基化模式的糖蛋白的产生得以进行。
在备选的优选实施方案中,本发明提供了在生长阶段开始时和任选地在生产阶段开始时增加培养基中铁、铜、锌和锰中每一种的浓度,以有利于细胞生长/生物质产生,以及附加地,在生产阶段开始时或期间降低培养基中铁、铜、锌和锰中每一种的浓度,以有利于不成熟的非岩藻糖基化糖蛋白的产生。在该实施方案中,当在生产阶段开始时增加铁、铜、锌和锰的浓度以有利于生物质产生时,通过在生产阶段期间进一步调整那些微量元素的浓度,有利于不成熟的非岩藻糖基化糖蛋白的产生得以进行。
在本发明的优选实施方案中,优选的是,为了有利于生物质产生,培养基中的铁(如,Fe2+或Fe3+)的浓度被调整到15μM至多于80μM之间,优选20μM至多于60μM之间,并且最优选25μM至多于50μM之间。
在本发明的优选实施方案中,优选的是,为了增加所表达的N-糖蛋白中的成熟度,例如,为了有利于成熟的N-糖基化糖蛋白种类的产生,培养基中的铁(如,Fe2+或Fe3+)的浓度被调整到0μM至25μM之间,优选0μM至20μM之间,并且最优选0μM至16μM之间。
在本发明的优选实施方案中,优选的是,为了有利于不成熟的非岩藻糖基化糖蛋白种类的产生,培养基中的铁(如,Fe2+或Fe3+)的浓度被调整到0μM至35μM之间,优选0μM至30μM之间,并且最优选0μM至25μM之间,或者被调整到15μM至多于80μM之间,优选20μM至多于60μM之间,并且最优选25μM至多于50μM之间。
在本发明的优选实施方案中,优选的是,为了有利于生物质产生,培养基中的铜(如,Cu2+)的浓度被调整到0.3μM至多于2.5μM之间,优选0.5μM至多于1.5μM,并且最优选0.3μM至多于1μM之间。
在本发明的优选实施方案中,优选的是,为了增加所表达的N-糖蛋白中的成熟度,例如,为了有利于成熟的N-糖基化糖蛋白种类的产生,培养基中的铜(如,Cu2+)的浓度被调整到0μM和0.1μM之间,优选0μM至0.08μM之间,并且最优选0μM至0.06μM之间。
在本发明的优选实施方案中,优选的是,为了有利于不成熟的非岩藻糖基化糖蛋白种类的产生,培养基中的铜(如,Cu2+)的浓度被调整到0μM至1μM之间,优选0μM至0.5μM之间,并且最优选0μM至0.3μM,或者被调整到0.3μM至多于2.5μM之间,优选0.5μM至多于1.5μM,并且最优选0.3μM至多于1μM之间。
在本发明的优选实施方案中,优选的是,为了有利于生物质产生,培养基中的锌(如,Zn2+)的浓度被调整到20μM至多于50μM之间,优选25μM至多于45μM之间,并且最优选28μM至多于43μM之间。
在本发明的优选实施方案中,优选的是,为了增加所表达的N-糖蛋白中的成熟度,例如,为了有利于成熟的N-糖基化糖蛋白种类的产生,培养基中的锌(如,Zn2+)的浓度被调整到20μM至多于50μM之间,优选25μM至多于45μM之间,并且最优选28μM至多于43μM之间。
在本发明的优选实施方案中,优选的是,为了有利于不成熟的非岩藻糖基化糖蛋白种类的产生,培养基中的锌(如,Zn2+)的浓度被调整到0μM至20μM之间,优选0μM至15μM之间,并且最优选0μM至13μM之间。
在本发明的优选实施方案中,优选的是,为了有利于生物质产生,培养基中的锰(如,Mn2+)的浓度被调整到0.01μM至多于3μM之间,优选0.05μM至多于2μM之间,并且最优选0.1μM至多于1μM之间。
在本发明的优选实施方案中,优选的是,为了增加所表达的N-糖蛋白中的成熟度,例如,为了有利于成熟的N-糖基化糖蛋白种类的产生,培养基中的锰(如,Mn2+)的浓度被调整到0.01μM至多于3μM之间,优选0.05μM至多于2μM之间,并且最优选0.1μM至多于1μM之间。
在本发明的优选实施方案中,优选的是,为了有利于不成熟的非岩藻糖基化糖蛋白种类的产生,培养基中的锰(如,Mn2+)的浓度被调整到0μM至0.01μM之间,优选0μM至0.05μM之间,并且最优选0μM至0.07μM之间。
用于本发明定制结果的培养基中铁、铜、锌和锰的组合的优选浓度是:
A.为了有利于生物质产生:
-(a)铁:从15μM至多于80μM;
-(b)铜:从0.3μM至多于2.5μM;
-(c)锌:从20μM至多于50μM;和
-(d)锰:从0.01μM至多于3μM。
B.为了增加所表达的N-糖蛋白中的成熟度,例如,为了有利于成熟的N-糖基化糖蛋白的产生:
(i)
-(a)铁:从0μM至25μM;
-(b)铜:从0μM至0.1μM;
-(c)锌:从20μM至多于50μM;和
-(d)锰:从0.01μM至多于3μM;或者
(ii)
-(a)锌:从20μM至多于50μM;和
-(b)锰:从0.01μM至多于3μM。
C.为了有利于不成熟的非岩藻糖基化糖蛋白的产生,:
(i)
-(a)铁:从0μM至35μM;
-(b)铜:从0μM至1μM;
-(c)锌:从0μM至20μM;和
-(d)锰:从0μM至0.01μM;或者
(ii)
(a)铁:从15μM至多于80μM;
-(b)铜:从0.3μM至多于2.5μM;
-(c)锌:从0μM至20μM;和
-(d)锰:从0μM至0.01μM。
使得有利于生物质产生、增加所表达的N-糖蛋白中的成熟度(例如具有成熟的N-糖基化模式的糖蛋白的产生)、和/或使得有利于不成熟的非岩藻糖基化糖蛋白的产生的培养基中铁、铜、锌和锰的特别优选的浓度组合如下面的表4中所示。
表4:培养阶段中的微量元素浓度
根据本发明的方法,在用于产生重组糖蛋白的发酵条件下在培养期间增加培养基中铁、铜、锌和锰的浓度水平以有利于、促进或增加生物质产生将导致,与其中铁、铜、锌和锰的浓度水平未作调整的可比较的培养物相比,生物质增加至少5%,优选至少10%、15%、20%、25%、30%、40%、45%、50%、55%或60%。用于对细胞生长的增加进行测量和定量的方法在本领域中是已知的。通常,这可以通过分析最大活细胞密度和最终细胞时间积分来完成。
正如对本领域技术人员来说显而易见的,在重组糖蛋白的生产中,在细胞培养的一个阶段期间生物质的增加将导致在细胞培养的后面阶段期间所产生的糖蛋白的量增加。
根据本发明的方法,在发酵条件下在培养期间靶向调整培养基中的铁、铜、锌和锰的浓度水平,或者仅锌和锰的浓度水平,以增加所表达的N-糖蛋白中的成熟度,例如,以有利于、促进或增加具有成熟的N-糖基化模式的糖蛋白的产生将导致,与其中在培养期间铁和铜、和/或锌和锰的浓度水平未作调整的可比较培养物相比,成熟的N-糖基化糖蛋白的产生增加至少5%,优选至少10%、15%、20%、25%、30%、40%、45%、50%、55%或60%。
根据本发明的方法,在发酵条件下在培养期间靶向调整培养基中的铁、铜、锌和锰的浓度水平,或者仅锌和锰的浓度水平,以有利于、促进或增加具有G0、G1或G2模式的糖蛋白的产生将导致,与其中在培养期间铁、铜、锌和锰的浓度水平未作调整的可比较培养物相比,具有G0、G1或G2模式的糖蛋白的产生增加至少5%,优选至少10%、15%、20%、25%、30%、40%、45%、50%、55%或60%。
根据本发明的方法,在发酵条件下在培养期间靶向调整培养基中的铁、铜、锌和锰的浓度水平以有利于、促进或增加不成熟的非岩藻糖基化糖蛋白的产生将导致,与其中在培养期间铁、铜、锌和锰的浓度水平未作调整的可比较培养物相比,不成熟的非岩藻糖基化糖蛋白的产生增加至少5%,优选至少10%、15%、20%、25%、30%、40%、45%、50%、55%或60%。
下列实施例说明本发明。
实施例
材料和化学物质
细胞系
关于所描述的研究,我们使用了9株内部产生的重组CHO-K1细胞系:克隆1和克隆2,两者均表达相同的单克隆抗体,克隆3,表达另一株单克隆抗体,并且,克隆A、克隆B、克隆C、克隆D、克隆E和克隆F表达糖工程化抗体。与克隆1相比,克隆2显示出高水平的高甘露糖聚糖种类(Man5)。使用专有的、化学上确定的、无蛋白质的内部培养基和工艺平台(在下文中称为平台A和平台B)培养所有克隆。
过程中控制——细胞生长和对代谢物的分析
通过使用台盼蓝排斥法(Strober,Curr.Protoc.Immunol.Appendix 3(2001))和自动CedexHiRes装置(Roche Innovatis,Bielefeld,Germany)分析细胞生长和生存力。为了对代谢物乳酸盐和铵进行定量,对细胞培养液进行离心以分离细胞并使用Cobas Integra 400plus系统(Roche,Mannheim,Germany)进行分析。通过Cobas Integra 400plus系统(Roche,Mannheim,Germany)或通过如由Zeck等人(PLoS.One 7.7(2012)e40328)描述的PorosA HPLC法对产物滴度进行定量。
过程中控制——微量元素
使用无细胞培养上清液和关于ICP-MS系统(Agilent,Germany)的内部方法分析微量元素浓度。
DoE实验
通过DoE(Design of Experiments)的统计实验规划是强有力的和公知的技术,对于许多因素相互依赖地影响最终结果的生物学和化学反应优化来说尤其如此。例如,DoE被成功地用于细胞培养基(Zhang等人,Cytotechnology 65.3(2013)363-78)、发酵工艺(Fu等人,Biotechnology Progress 28.4(2012)1095-105)、蛋白质纯化工艺(Pezzini等人,J.Chromatogr.A 1218.45(2011)8197-208)和细胞培养条件(Chen等人,Tissue Eng.Part C.Methods 17.12(2011)1211-21)的优化。
基于所期望的结果,可以将不同的DoE(实验设计)方法应用于本工艺(图3)。部分因子设计(其经常用于具有庞大数量的影响因素的系统)允许鉴定工艺中显著的主要调节者。另一方面,实验设计,如全因子、Box Behnken、或中心组合(Central composite)不仅鉴定关键调节者,也允许定量离散最佳浓度或其设置。对于这一点,当关键调节者的浓度或设置在电脑中(in silico)在最小(-1)和最大(1)状态中变化时,所谓的预测分析器(Prediction profiler)工具交互式地假定实验结果。为了计算最佳浓度,必须通过与所使用的设定浓度相乘来确定预测的最优水平(-1和+1之间的值)。
本研究中所有DoE方法都使用统计软件工具JMP(SAS Institute GmbH,Germany)来规划和分析。实验被设计为补料分批培养,以模拟类似生产工艺的条件。使用摇床或自动培养系统和专有培养基和进料平台A和B进行所有的DoE补料分批实验。所使用的培养基是化学上确定的无血清和无蛋白质的培养基。
糖种类分析
为了分析单抗糖基化,对所收获的细胞培养液进行离心(用于细胞分离)和过滤(通过0.2μM膜过滤)。如由Reusch等人(Anal.Biochem.432.2(2013)82-89)所描述的那样,并且通过内部毛细管电泳方案,对单抗糖基化种类进行分析。
实施例1
通过锰和铜的半乳糖基化的逆向调节
为了测试这些微量元素对细胞培养物性能的一般相关性,我们使用了两株内部产生的重组CHO-K1细胞系,克隆1和克隆3,它们分别表达两株不同的单克隆抗体。使用部分因子DoE设计(表5),可以分析不同微量元素(通过向基础培养基补充特定储备溶液来实现)的统计显著性。使用完全控制的自动培养系统,将部分因子DoE方法应用于每株克隆并进行重复(关于克隆1重复4次,关于克隆3重复3次)。
表5:微量元素对细胞培养物性能的部分因子DoE筛选。使用17次不同的补料分批实验,我们将不同的对称平衡水平的铝、钼、钡、铬、溴、碘、铜、锰、铷、银、锌、锡和锆储备溶液施加至基础培养基(-1:低水平,0:中水平,+1:高水平)。实验设计被应用于克隆1(n=4)和克隆3(n=3)两者。使用JMP DoE工具生成实验设计。
接下来,关于每个条件,汇总了在DoE补料分批实验开始时的铝、钼、钡、铬、溴、碘、铜、锰、铷、银、锌、锡和锆的理论有效浓度(cTE有效)(表6)。这些微量元素在实验开始时的理论cTE有效根据公式1计算:
(公式1)
表6:在部分因子DoE补料分批实验(实施例1)开始时的理论有效微量元素浓度cTE有效。
通过组合两株克隆(克隆1和克隆3,两者表达不同的单抗)的G1和G2聚糖相对水平,分析铝、钼、钡、铬、溴、碘、铜、锰、铷、银、锌、锡和锆对半乳糖基化的推定影响,并且,来自第7、12和13天的样品用于鉴定一般的、克隆和时间的独立影响。
使用JMP DoE分析工具,我们发现了描述微量元素对单抗半乳糖基化的影响的良好线性模型。在此,我们观察到锰对G1和G2水平的强大正面影响(图4A-D)。此外,锌趋向于对G1和G2相对丰度具有正面影响。另一方面,铜对G1聚糖形成具有统计学显著的负面影响(图4A-B),提示在体外观察到的抑制作用(如由Kamińska J等人,Glycoconj J.15.8(1998)783-8所详述)可以通过细胞培养实验在体内证实。
有趣的是,与锰组合的锌的添加显示对半乳糖基化聚糖形成的协同作用,并且,该作用似乎是过程时间依赖性的。为了对该作用进行量化,我们建模了仅高浓度和低浓度的效应物锌和锰的G1和G2形成(图16)。关于与高锌水平组合的高锰水平预测了G1和G2种类的最高量。
使用筛选实验的比例估算(图4B、D),用于半乳糖基化的最佳浓度可以概括为:
·锰:>0.0963μM,因为线性模型在最高浓度处显示最好的结果→尚未达到最佳浓度)
·铜:<0.3142μM,因为线性模型在最低浓度处显示最好的结果→尚未达到最佳浓度)。
通过将克隆3用作模型细胞系,我们进一步分析了上述显著性的元素对半乳糖基化的影响的时机。通过使用预测分析器工具从第7天切换至第13天,锰在早期生产阶段和后期生产阶段中的影响被量化。对于G1和G2两者来说,在后期工艺阶段(第13天)中,锰的影响都下降了。预测分析器曲线中的斜率的降低表明锰的生物利用度不像在早期工艺阶段(第7天)中那样好(图5)。
实施例2
铜和铁对细胞生长和糖基化的相反的影响
为了鉴定负责细胞生长和糖基化调节的单个微量元素和组合效应,我们使用重组克隆2,通过全因子DoE实验分析了锌、铜、铁和锰(它们被称作高度生物活性的微量元素)对细胞生长和单抗糖基化的影响(表7)。克隆2被用作报道细胞系,这是因为高甘露糖聚糖结构的形成水平内源性升高。
表7:锌、铁、铜和锰对细胞生长、半乳糖基化和非岩藻糖基化糖蛋白种类的全因子DoE筛选。使用关于克隆2的19次不同的补料分批摇床实验,我们将不同的对称平衡水平的锌、铁、铜和锰施加至基础培养基(-1:低水平,0:中水平,+1:高水平)。三个中心点(“0000”—摇床5、8和11)被用于确定内在实验方差。使用JMP DoE工具生成实验设计。
在本实施例中,关于每个条件,汇总了在DoE补料分批实验开始时的理论有效锌、铁、铜和锰浓度cTE有效(表8)。锌、铁、铜和锰在实验开始时的理论cTE有效如上所述计算。
表8:在DoE补料分批实验(实施例2)开始时的理论有效锌、铁、铜和锰浓度cTE有效。
通过补充铁显示了对细胞生长的最高影响,这是通过最大活细胞密度(图6A-C)和最终细胞时间积分(图6D-F)来分析的。在一般情况下,在实验中使用高浓度的锌、锰和铜趋向于导致更高的细胞生长和生物质产生(图6C、F)。另一方面,锌、铜、铁和锰的靶向组合调节半乳糖基化或非岩藻糖基化种类的量。高浓度的锰改善半乳糖基化,这里显示了G1(图6G-I),而锌和铜的组合效应以及锰的缺乏导致更高量的不成熟糖基化单抗种类(图6J-L)。
铜和锌对不成熟的聚糖形成表现出强烈的相互作用。因此,我们使用JMP预测分析器工具进一步详细分析了对非岩藻糖基化聚糖种类(具有高甘露糖含量的糖蛋白)的这种相互作用。在一般情况下,在中等水平时(实验中的水平0),锌(水平0表示28.295μM)显示与高甘露糖聚糖的量负相关,并且,铜(水平0表示0.330μM)显示与高甘露糖聚糖的量正相关(图7A)。这通过以下事实得到了证实,即-0.2(表示25.416μM)的负的锌水平和0.6(表示0.349μM)的正的铜水平不再对甘露糖基化聚糖种类的总和表现出影响(图7B)。在下文中,模拟了显著调节物锌、铜和锰对高甘露糖聚糖种类的不同情形:
·中水平和高水平(-0.2至1表示25.416μM至43.301μM)的锌诱导铜的正效应(图7C、F、G、H、I)
·低水平(-1至-0.2表示13.900μM至25.416μM)的锌诱导铜的负效应(图7D、E)
·中水平(-0.2表示25.416μM)的锌消除铜的影响(图7B、J)
·锰的负效应不依赖于锌和铜的水平
我们使用JMP的预测分析器工具来确定用于细胞生长和单抗聚糖形成的组合优化的锌、铜、铁和锰的最佳浓度。在此,使用了一个考虑所有微量元素参数的有效模型(铁的二次效应)。
根据预测分析器,最高浓度的锌、铜和锰以及处于>0.42(即>36.704μM)水平的铁将改善细胞生长(图8A、C)。使用高浓度的锌、铁和锰以及低浓度的铜将增加半乳糖基化单抗种类的量(图8D)。另一方面,并行的低浓度(水平-1)的锰(即0.071μM)、铜(即0.312μM)和锌(即13.900μM)和处于-0.3的水平的铁(即11.288μM)增加非岩藻糖基化单抗种类的量(图8F)。
当选择高水平的锌和铜以及低水平的铁和锰时,实现了VCD和CTI的最小值(图8B)。通过选择低浓度的所有四种元素产生了低半乳糖基化聚糖种类(图8D)。关于高的锌和锰水平和低的铁和铜水平产生了最低水平的甘露糖基化聚糖(图8G)。
此外,我们还通过对数据的JMP建模测试了仅与锰组合而添加锌以增加半乳糖基化聚糖形成的选项。如前所示,锌和锰对半乳糖基化聚糖形成具有协同作用。为了对该作用进行量化,我们对处于高和低浓度的效应物锌和锰的G1形成进行了建模(图15)。添加高水平的锌与高水平的锰可以使G1种类增加17%(图15A、D)。
为了调节聚糖种类成熟程度,最佳的微量元素水平是G1和高甘露糖预测的组合(图8D-G)。
·关于成熟聚糖:高G1和低Man5的最佳水平
·关于不成熟聚糖:高Man5和低G1的最佳水平。
实施例3
通过调节铜、铁、锌和锰来靶向产生半乳糖基化和非岩藻糖基化聚糖种类:生物反应器实验1
CHO-K1克隆2在受控的2L Quad发酵系统(Sartorius,Germany)中生长14天,使用专有培养基和团注进料工艺平台B。在第3、6和9天按培养起始体积的10%补充浓缩的营养素进料。在第6天,通过补充有利于单抗糖基化的特定培养基来进行靶向的微量元素调节。
在先前的实验中确定的锌、铜、铁和锰的比例和目标浓度汇总在表9中。使用具有内源性高水平Man5聚糖种类的克隆2,在生物反应器补料分批验证实验中测试锌、铜、铁和锰的这些浓度和比例。通过使用分别如表9A和表9B中所描述的用于“生物质”和“糖基化”阶段的两种不同的培养基,我们使用分开培养基策略和有目标的补充来调整微量元素比例,从而在第一补料分批阶段(d0-d5)中支持细胞生长并在第二补料分批阶段(d6-d14)中使单抗糖基化成熟成为可能。
表9A:在生物反应器实验中使用的“生物质”培养基用于从d0-d5的生长阶段。
表9B:在生物反应器实验中使用的“糖基化”培养基用于从d6-d14的糖基化阶段。
与在整个工艺中使用恒定浓度的锌、铜、铁和锰以有利于不成熟聚糖形成(被称为“非岩藻糖基化”)的设置相比,我们通过仅在两个水平之间改变铜浓度,就定向的细胞生长和单抗糖基化成熟对预测的微量元素浓度进行了测试,在下文中称作“生长”和“半乳糖基化”(图9A)。我们决定这样做,因为铜对糖基化的影响似乎比对最大活细胞密度的影响更强(图8)。
下表(表10)示出了用于生物反应器实验1的理论目标浓度。
表10:调节细胞生长、单抗半乳糖基化和非岩藻糖基化的目标理论微量元素浓度。在生物反应器实验1中使用的铜、锰、铁和锌的浓度,参见图9A中的设置。
(n/a,不适用)
使用这种设置,我们证明了,可以通过显示最高的活细胞密度和CTI的关于“生长”的微量元素平衡来调节细胞生长能力,直到第6天为止,随后是“非岩藻糖基化”和“半乳糖基化”工艺(图9B、C)。从第6天起,关于活细胞密度和细胞时间积分,对于“半乳糖基化”工艺清楚地显示了随后切换至有利于糖基化的条件以及至减少的细胞生长。有趣的是,在后期工艺阶段微量元素比例的调整显示出对细胞生存力的强烈影响(图9D)。与“生长”工艺相比,减少铜趋向于使最终活细胞密度增加高达近30%生存力(关于“半乳糖基化”工艺)。通过降低铜浓度使细胞生存力增加的效果也可以通过LDH释放分析来证实(图10C)。
另一方面,铜已被证明在后期工艺阶段正面地影响乳酸盐再代谢(remetabolization)(Luo等人,Biotechnol.Bioeng.109.1(2012)146-56)。在上面描述的验证实验中,我们证实了铜与乳酸盐再代谢的相关性,因为在后期工艺阶段“半乳糖基化”显示增加的但并不严重的(→高细胞生存力)乳酸盐浓度,这是与“非岩藻糖基化”和“生长”相比而言的,这两者在第14天以前几乎所有乳酸盐都被消耗了(图10B)。正如已知的那样,高水平的乳酸盐可以有利于铵的解毒(Li等人,Biotechnol.Bioeng.109.5(2012)1173-86),关于“半乳糖基化”工艺,我们可以确认乳酸盐积累和铵再同化(re-assimilation)的负相关(图10A)。
为了研究微量元素调整对单抗糖基化动力学的影响,我们分析了关于非岩藻糖基化种类和半乳糖基化种类运行的生物反应器的过程中样品。可以通过预测的微量元素调整来减少(关于Man5高达30%)高甘露糖种类Man5(图11A)以及累积的非岩藻糖基化种类(图11D),所述调整以铜浓度依赖性方式进行(铜浓度:“非岩藻糖基化”>“生长”>“半乳糖基化”)。一旦工艺从生长切换到糖基化条件,微量元素的调整导致从高甘露糖种类改变为G0(高达30%),并随后改变为G1种类(在第13天高达30%)(图11A-C)。在“半乳糖基化”配置中,G1种类在第14天的下降可能是由于在后期工艺阶段中生物可利用的Mn2+和Zn2+的限制所造成的。
实施例4
通过铁、铜、锌和锰来靶向调节细胞生长和单抗糖基化:生物反应器实验2
CHO-K1克隆2在摇瓶中生长用于培养物扩增,并且在受控的2LQuad发酵系统(Sartorius,Germany)中生长14天用于生产补料分批培养,以评价铁、铜、锌和锰对细胞生长和蛋白质糖基化的影响。使用专有培养基和工艺平台B。每天以初始的培养起始体积的2.73%(v/v)连续补充浓缩的营养素进料。使用培养基中特定的金属浓度和连续进料(表11-13)并通过在接种培养期间(阶段n-2和n-1)分开培养物并转移至生产规模(阶段n)进行靶向的微量元素调节。基于比细胞和培养系统消耗速率(图13和14)并考虑分开和培养期间的体积平衡(例如补充校正剂如葡萄糖原料、消泡剂、碱),计算铁、锌、铜和锰的相应浓度。铁、锌、铜和锰的实际浓度可以通过ICP-MS来测量(Agilent,Germany)。
设计测试用例,用于支持细胞培养物扩增期间的细胞生长、补料分批中的初始生物质产生和在补料分批期间在生产阶段中(第6-14天)的蛋白质半乳糖基化,或者用于支持细胞培养物扩增期间的细胞生长、补料分批中的初始生物质产生和在补料分批期间在生产阶段中(第6-14天)的蛋白质非岩藻糖基化,或者用于干扰细胞培养物扩增期间的细胞生长、补料分批中的初始生物质产生并用于支持在补料分批期间在生产阶段中(第6-14天)的蛋白质非岩藻糖基化(图12A)。
表11:在各培养阶段开始时用于调节细胞生长和单抗糖基化的目标理论微量元素浓度—“生长/生长”(GG)。在生物反应器验证实验2中使用的铜、锰、铁和锌的浓度,参见图12A中的设置。
(na,不适用)
表12:在各培养阶段开始时用于调节细胞生长和单抗糖基化的目标理论微量元素浓度——“生长/非岩藻糖基化”(GA)。在生物反应器验证实验2中使用的铜、锰、铁和锌的浓度,参见图12A中的设置。
(na,不适用)
表13:在各培养阶段开始时用于调节细胞生长和单抗糖基化的目标理论微量元素浓度——“非岩藻糖基化/非岩藻糖基化”(AA)。在生物反应器验证实验2中使用的铜、锰、铁和锌的浓度,参见图12A中的设置。
(na,不适用)
正如预期的那样,测试用例“AA”在接种培养和生产阶段期间显然干扰了细胞生长,如通过阶段n中的活细胞密度和细胞时间积分所显示(图12C-D)。另一方面,在细胞培养扩增和补料分批中的细胞生长阶段期间,关于测试用例“GG”和“GA”没有观察到生物质产生中的差异。通过聚糖丰度测量分析了对单抗成熟的影响。关于成熟的和不成熟的单抗糖基化种类,将G1和G2或者Man6、Man5和G0-GlcNAc汇集。正如预期的那样,测试用例“GG”有利于成熟的聚糖种类的形成(与“AA”和“GA”相比,增加1.4-7倍)(图12E),并且,测试用例“GA”和“AA”支持不成熟的聚糖形成(与“GG”相比,增加2-3倍)(图12F)。
总之,通过使用生物技术生产工艺的靶向微量元素平衡,所描述的程序允许调节糖蛋白,尤其是单抗糖基化成熟。通过使用关于锌、铜、铁和锰浓度和比例的调整策略而从“生物质”条件切换到“糖基化”条件,该方法满足了对经济性高滴度工艺的需求。
- 还没有人留言评论。精彩留言会获得点赞!