自动化处理混合样本的方法和设备与流程
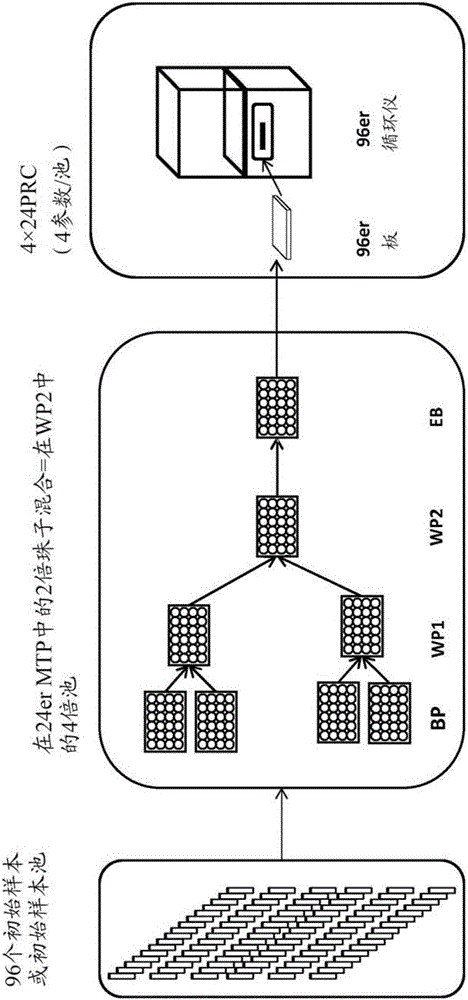
本发明涉及自动化处理混合样本,特别是血液样本的新方法。此外,本发明涉及进行所述方法的设备以及相应的用途。具体地,所述方法和相应的设备可被用于实施核酸扩增技术(NAT),以测试捐献的血液和血液制品。发明背景在医学上,人血液很有价值且迄今为止是不可或缺的原料,其现在被用于提取或制备大量的组分和制品。在20世纪90年代早期的所谓的AIDS丑闻突然引起了公众和专业人员对血液和血液制品的病毒安全性的注意。核酸扩增技术(NAT)降低了输血期间感染的风险。在过去的几年里,由于改善的捐献血液的分析方法,在输血期间被病毒病原体如HIV1/2、HCV、HBV或HAV感染的风险显著降低。已记载,NAT的引入显著增加了检测感染的血液储备的可能性。在施用于患者之前,必须对供体血液进行病原体筛查。在引入NAT之前,主要用抗体检测来鉴定血液储备中诸如HIV和肝炎病毒的病原体。由于在针对实际感染的应答中,免疫系统需要一定的时间形成此类抗体,因此使这些控制经受开放的时间窗(诊断窗)。在感染早期阶段检测相应的捐献血液中的病原体是不可能的,这意味着感染的血液能够进入医疗护理。对于治疗性的新鲜血浆,仅可以通过要求所有供血者二次捐献使输注感染的血液制品的风险最小化,所述二次捐献在2-3个月的最小间隔后进行。这允许检测到感染情况下的过渡时期已在供体体内形成的抗体。最初捐献的血浆被冷冻,并且不能被用于医学治疗,直至二次捐献测试为抗体阴性。对于具有仅数天的保存期较短的血液制品,如红细胞或血小板,该方法不可行。在这些情况下,一旦被测试为阴性,制品在捐献后必须立即释放。这意味着测试应当尽早显示阳性结果,以在血液供体感染的情况下使诊断窗最小化。这通过引入NAT作为捐献血液中病毒污染的灵敏的直接检测的筛查测试来完成。自从20世纪90年代中期,基于病毒核酸检测病毒的方法的发展取得了成功进展。在血浆处理工业的建议(其对保护其血浆制品如凝血因子VIII或IX的生产池以防高病毒负载感兴趣)下,在20世纪90年代中期引入了NAT,用于将输血相关病毒HIV-1/2、HCV和HBV,以及后来将细小病毒B19(PB19)和HAV作为质量控制度量。在1999年,疫苗及血清研究所(PaulEhrlichInstitute(PEI))使得对血浆和血液细胞组分强制进行HCVNAT测试。从1997年开始,一些早在1997年,德国红十字会(DRK)和巴伐利亚红十字会(BRK)的献血服务开始使用NAT对所有捐献血液的输血相关病毒HCV、HIV和HBV进行了测试。在2000年,他们也首次将NAT测试扩展至细小病毒PB19和HAV,其现在是所有DRK献血服务的标准。在2004年5月,PEI也将HIV-1NAT强制化。因此,在中欧,在1997年至2002年的研究中,用NAT对360万捐献的血液样本进行HCV和HIV-1(Roth,WK等人Transfusion2002;42:862-868)以及HBV(Roth,WK等人Transfusion2002;42:869-875)测试。这使得鉴定出6个HCV和2个HIV-1PCR确认的阳性、抗体阴性的捐献(得率,分别为1/60万或1/180万)以及6个最终为HBsAg阴性的HBVPCR确认的阳性捐献。由于不同度量,如供体选择、ELISA测试和NAT测试,筛查的输血相关病毒的剩余的病毒风险降低至先前未知的不可估量的低水平。因此,在德国,引入PCR之后,三种输血相关病毒HCV、HIV和HBV的剩余风险低至对于HCV,小于1:20百万,对于HIV-1,小于1:4百万,以及对于HBV,小于1:1百万,以使人们甚至可以基本不再提及确切剩余的病毒风险。通常,复杂和昂贵的NAT的引入导致献血服务的额外财政负担。降低费用的一种方式是通过形成所谓的迷你池(mini-pool)将许多个体供体样本合并为单一样本(参见Roth,WK和Seifried,E,TransfusionMedicine2002;12:255-258)。该方法使每天有2,000至4,000例捐献的大规模DRK献血服务特别受益。以单个测试的形式,对如此大量的供体样本进行目前的6种病毒测试将需要每天实施多达24,000次单个NAT测试。对于在8小时工作制中进行如此大量的单个NAT测试仍存在不能克服的技术限制,因为既有的热循环仪/分析仪和方法均不允许达到此种通量。混合将测试次数降低至技术上和财政上可行的程度。将多达96个供体血液样本合并为池,这使得在少量测试中获得高样本通量(Roth,WK等人,TheLancet1999;Roth,WK等人,VoxSang2000;78(suppl2):257-259)。然而,即使是用于捐献血液测试的混合的NAT,其仍是部分手动操作程序,所述混合的NAT将潜在的大样本数的巨大花费降低至可接受的水平,但是仍未使包含混合和后续步骤的整个过程自动化。那将是关于过程安全性的主要且重要的一步。将供体样本合并至较大的迷你池对于具有小量至中等量供体数的献血服务以及对于具有高病毒流行率的国家可能获益较少。如果病毒流行率升高超过特定的水平,则包含太多阳性的迷你池或者所有迷你池(在最坏的情况下)必须分散,并分为阳性单样本。这导致这些阳性池中的所有样本(包括阴性样本)的初步封闭。因此,池中代表的血液制品可用于应用之前,需要1-3天。因此,用多达96个供体血液样本创建迷你池的概念仅对于在供体集合体中具有高流行率的国家中进行的NAT测试具有有限适用性。DE10258258A1教导了实现十分高的通量以满足大型献血服务的需求的NAT程序的用途。然而,它仍需要人工干预。将与来自单个样本或混合样本的核酸结合的磁性颗粒合并通常是有益的。该过程理论上可以无限继续下去,但实际上,在3至4步之后,如此多的珠子聚集使得核酸的洗脱需要越来越大的缓冲液体积,这意味着对于个体来源的样本,必需接受不利的稀释效应。因此,本发明的目标是研发用于具有高流行率的国家,也用于实现十分高的通量以满足大型献血服务的需求的允许更快且性能改善的核酸扩增技术的方法。此外,对于个体捐献,混合不再默认地影响测试灵敏度,但是必需与单个样本测试等同。这将消除过去提出的关于混合的主要问题。本发明通过提供处理混合或单个样本(优选自动地)的方法实现了该目标。所述方法包括下述步骤:a)在容器中提供待分析的样本,所述容器各自带有机器可读的标记,b)如果适用,则将来自a)的样本合并(混合)至容器中的至少一个样本池中,所述容器各自也带有机器可读的标记,c)向来自a)或b)的样本中添加适用于细胞裂解的溶液以及适用于结合核酸的磁珠,d)使样本中的核酸与所述磁珠结合,e)使样本中的磁珠与磁体结合,f)通过将来自至少两个样本的磁性颗粒转移至新的共有容器中来混合来自e)的珠子,g)用至少另一组待分析的样本重复步骤a)至f),h)使来自步骤f)和g)的样本池的珠子混合至来自至少4个样本池的共有的珠子池中,i)用至少另一组待分析的样本重复步骤a)至h),j)将来自步骤h)和i)的样本池的珠子转移至至少8倍的珠子池中,k)用洗脱缓冲液洗脱来自j)的池,以及l)将来自步骤k)的洗脱的核酸转移至一种或数种其它检测方法。在优选实施方案中,该方法包括一个或数个使用洗涤缓冲液和磁体的洗涤步骤。在又一优选实施方案中,该方法允许在步骤b)中,每个样本池合并2至15个,以及甚至30个样本,即2、3、4、5、6、7、8、9、10、11、12、13、14或15个样本。除了混合的样本,向珠子混合物中添加单个样本也是可行的,其实现了针对单个样本的典型的较高灵敏度,并具有较高通量。本发明通过提供自动化处理混合的或单个样本以及通过利用珠子混合合并两个或者更多个单个样本或样本池的方法实现了该目标。根据本发明的方法导致在具有高流行率的国家中的增加的样本通量,降低了样本制备和处理所需的时间和/或增强了样本制备和处理的可靠性。本发明的方法避免了对于来源样本的灵敏度的损失,因为可以使用大的来源体积,例如在单个捐献的情况下。通过使其上结合有核酸的珠子合并为2个、4个、8个等的池,仍实现了混合效应。在洗脱步骤期间,核酸从珠子上脱离,并且被转移至检测反应。因此,2、4、8、...n倍的更多的珠子到达洗脱缓冲液。如果关于单个样本,核酸浓度不改变,则洗脱缓冲液的量(体积)必需保持恒定,并且可能不会相应地增加(2倍、4倍、8倍等)。这将增加洗脱缓冲液中珠子的浓度,而可用的洗脱缓冲液的量将降低,因为珠子之间的中间空间也成为双倍、四倍等。这通常被认为是不利的。然而,出人意料地发现这是容许的。在利用2倍的珠子池的比较测试中,发明人未发现任何灵敏度损失,并且洗脱体积仅略微增加直至4倍的珠子池。样本本身能够再次混合的事实增加了通量,伴随着灵敏度降低的已知劣势,因为根据池的尺寸,单个样本向该过程贡献更少材料。当前的计划推测可以使用向所述过程贡献1.5mL的样本体积,也可以使用向所述过程贡献2.0mL的样本体积。这允许提取1.5mL单个样本体积,或者例如在15个样本的池中提取100μL的单个样本体积,在10个样本的池中提取150μL的单个样本体积,在5个样本的池中提取300μL的单个样本体积。关于通量,将样本池乘以珠子池,例如如果15个样本的池与4倍的珠子池合并,则通量等于60个样本/“池”。连同过程长度和每8小时的运行次数,这导致每班的最大通量。如果可能,该方法使得用户能够并行提取单个捐献和/或池,其中新的平台不仅实施珠子的混合,而且也自动实施多达15个样本池的上游样本混合。先前并未执行在提取/PCR平台自动实施的样本混合,并且建立了重要优势。使混合(基于珠子池,多达8倍)与单个捐献测试一样灵敏,并且具有可在同一平台实施高通量的样本混合的更多优势,其消除了对单独的混合设备的需求(如在现有技术中)。就单个捐献的测试来说,用户仅装载单个供体的初始小瓶,其也仅得到每名供体的一个结果,尽管实施了混合(自动地)。因此,关于混合,用户可以“忽略”。在阳性混合结果的情况下,仅将受影响的单个小瓶返回至装置,以鉴定阳性单个样本。在优选实施方案中,为步骤a)提供的样本应当是液体或者液化样本。样本优选是血液样本和其它体液,特别是全血、血浆、血清、血液细胞组分和/或其它血液制品。血液样本优选为包含血液组分的样本。优选使用存在于且用于献血和输血医学的样本。这也可以包括来自全血或成分捐血(apheresisdonation)的下述血液制备物:–个体捐献的制品,如红细胞浓缩物(EC)、血小板浓缩物(PC)、干细胞制备物、来自血浆分离置换法(apheresis)的粒细胞或淋巴细胞、冷冻的新鲜血浆(FFP);-混合的血小板制品,如来自血沉棕黄层的混合PC;-来自血浆池的制品,如含有SD(溶剂/清洁剂)失活的病原体、白蛋白、凝血因子、纤维蛋白胶、抑制剂、免疫球蛋白的FFP。在优选实施方案中,可以重复实施所述方法的步骤c)、d)和e)。在根据本发明的方法的优选实施方案中,直接在用条形码标记的容器中或者在板孔中实施血液样本的混合。本发明的方法有效地消除了存在于包括用于病毒富集的部分手动步骤的之前方法中的样本混淆的风险。出于该目的,血液样本的混合直接发生于用条形码标记的容器中或者板孔中。在优选实施方案中,根据本发明的方法代表不存在人工干预的单一均匀化过程。优选地,在步骤c)中添加的溶液由用于病毒裂解的试剂以及提取试剂组成,所述用于病毒裂解的试剂如裂解缓冲液或使用清洁剂、蛋白酶、离液序列高的盐、有机溶剂或者本领域技术人员已知的适用于提取核酸的其它溶液和悬液的合并的裂解/结合缓冲液。缓冲液可以具有碱性、中性或酸性pH值。可向缓冲液中添加用于结合释放的核酸的固相。固相可以是顺磁性的、含铁的、未涂覆或涂覆的,并且含有官能团或者不含官能团。在又一优选实施方案中,对样本,并且特别是血液样本中核酸的存在进行筛查。核酸优选是DNA、RNA。此外,核酸应当优选是病毒的核酸。病毒可以选自:人免疫缺陷病毒1和2(HIV-1和HIV-2)以及HIV-1亚群M、N和O,丙型肝炎病毒(HCV),乙型肝炎病毒(HBV),巨细胞病毒(CMV,HHV5),甲型肝炎病毒(HAV),戊型肝炎病毒,细小病毒B19(PB19),人T细胞白血病病毒I/II(HTLVI/II),西尼罗河病毒(WNV),SARS冠状病毒(SARSCoV),MERS冠状病毒,登革热病毒和其它病毒,以及EBV,HHV8,HGV/GBVC,TTV或基孔肯雅热病毒。该方法还使得可对之前未知病毒的核酸的存在进行筛查。在优选实施方案中,该方法包括同时对来自多种病毒的核酸的存在进行筛查。该方法优选用于同时筛查多达7种病毒,如HCV、WNV、HCMV、HIV-1、HIV-2、HBV、HAV、HEV和PB19。可选实施方案可以包括对游离核酸,例如在血浆中循环的游离核酸进行筛查。该方法的优选实施方案使用大体积的患者血液组分样本。使其中包含的核酸经受所述方法。优选的提取方法是在清洁剂的帮助下进行裂解,在酸性条件下使释放的核酸与磁性颗粒结合,使用基于离液序列高的盐(如与膜相连的盐或者作为固相的磁性颗粒)的提取试剂或者本领域技术人员已知的其它提取方法。在又一优选实施方案中,制备样本池,用于用户所选的后续扩增步骤。优选地,这包括通过使核酸与固相结合而对核酸进行的纯化,一个或多个洗涤步骤,以及纯化且浓缩的核酸的洗脱。具体地,对7种病毒的提取和PCR准备同时发生,所述7种病毒如HCV、HIV-1、HIV-2、HBV、HAV、HEV和PB19。根据本发明的方法的优选实施方案能够在8小时内分析3,780个样本,其中最大的池大小为n=15,以及在3次运行中最多进行4倍(2步)珠子混合。优选地,该方法的每个样本池合并2至15个样本,或者多达30个样本(步骤b)。优选地,可将根据本发明的方法用于将2、5、10或15个样本合并至样本池中(步骤a)。在优选实施方案中,可将各自为100μL的15个样本进行合并,将各自为300μL的5个样本进行合并,或者将各自为750μL的2个样本进行合并。优选的样本池总体积为1.5mL,任选地2.0mL。根据本发明的方法为潜在的扩大规模提供了有利的高适应性。因此,如果需要更高的灵敏度,则可以增加样本的源体积。在优选实施方案中,使用各自为100μL的15个样本,各自为300μL的5个样本,或者各自为750μL的2个样本。此外,根据本发明的方法提供了通过在多达三个步骤的纯化过程中合并(“珠子池”)至少两个样本池而使样本通量增加2倍、4倍或8倍的选择。在该方法的优选实施方案中,其它检测程序由核酸扩增组成。根据本发明的核酸扩增可以包括PCR、TaqManPCR、实时PCR、TMA、NASBA、SDA或LCR。在又一优选实施方案中,扩增之后进行扩增的核酸的检测方法。然而,也可对样本池进行无需前期扩增的检测方法。该方法的高度优选的实施方案包括实时PCR形式的核酸扩增,其使得能够同时在线检测扩增的核酸。本发明的另一方面是设备,所述设备的特征在于其适用于实施根据本发明的方法。在优选实施方案中,根据本发明的设备适用于产生样本池、自动核酸提取包括珠子混合、PCR准备和原始数据分析。根据本发明的设备允许样本池所位于的容器的有利连接,其使用自动化提取方法。根据本发明的设备包含几种组件:–至少一个自动移液工作站,–至少一个磁性分离器,–至少一个流体处理臂,和–至少一个机械臂,以及如果需要且优选地–至少一个扩增单元,和–至少一个检测单元相应的组件对于本领域技术人员而言通常是已知的。可将磁性分离器整合至自动移液工作站中。在向样本池或单个样本添加液体(外加磁性固相)之后发生混合过程(例如基于上下吹吸)。然后经磁性分离器上的液体处理臂将液体转移至反应器皿中。任选地,经电磁体或永磁体(“浸渍法”)将磁性固相转移至反应器皿中。在该步骤中,可以通过转移分别将两个样本池或者单个样本的磁性固相在同一反应器皿中合并。在根据本发明的设备的优选实施方案中,所有组件均被设计为集成设备,并且位于外壳内。用于根据本发明的设备的合适的组件为,例如瑞士(Switzerland)的Hamilton公司的装置。因此,合适的自动化移液装置可以,例如由HamiltonStar或HamiltonVantage移液器组成,而例如KingFisher类型的装置可以用作磁性分离器。诸如Tecan、Beckman、Xiril、Sias、ThermoFisher和Qiagen的其它制造商的装置也是合适的组件。在又一优选实施方案中,根据本发明的设备是软件可控的。根据本发明,可以用软件控制提取过程。可以利用软件实现整个过程(混合、提取、珠子混合、检测、评价)的监测。软件监测整个过程。在该背景下,软件向单个子步骤的软件程序提供工作列表,并处理、评价和存档,例如错误信息和子步骤结果。优选地,可以对根据本发明的软件进行编程,以整合混合、提取、珠子混合、PCR准备和实时PCR。因此,本发明的又一方面包括控制和监测根据本发明的方法的计算机程序。在又一特别优选的实施方案中,用条形码标记追踪诸如捐献的血液样本至最终结果,并且可通过该条形码对其进行鉴定。在用条形码标记的容器中的直接混合以及自动化的条形码控制的核酸提取、扩增和浓缩过程之后的检测排除了整个NAT测试过程期间样本的任何混淆。因此,根据本发明的方法将包括浓缩步骤的方法的高通量和高灵敏度与自动化且完全条形码控制的过程的高安全性水平进行了组合。根据本发明的方法有效地消除了存在于包括用于病毒富集的部分手动步骤的之前方法中的样本混淆的风险。出于该目的,将样本,特别是血液样本直接在用条形码标记的容器中混合。然后将这些容器转移至提取程序,所述提取程序由于条形码监测或者固定的物理分配而不允许任何样本混淆。优选地,这是无人工干预的完全自动化的均匀化过程。提取过程(包括珠子混合)之后进行自动化和软件监测的PCR设置、扩增以及软件辅助检测和评价。本发明的另一方面涉及根据本发明的设备在根据本发明的如上所述的自动化处理混合或单个样本中的用途。也处理之前混合的样本的选择以及在特定的后续过程中再次将其合并至较大的池的选择也是可用的,包括在同一自动化设备中实施该预混合的选择。这也将使得在此种情况下将初始小瓶直接装载于平台上而没有单独的混合装置,以及在同一过程中实施自动化的预混合是可行的。在小的血液体积和高流行率的情况下,对单个样本进行测试是选择的方法。在较大体积的情况下,优选在数个后续步骤的提取过程中,分别合并至少两个单个样本,或者形成例如10个或者更少的捐献血液样本的较小迷你池。该方法能够实现足够的通量,即使具有高流行率亦如此。在低流行率的情况下,即使高通量的NAT也是可行的。参考附图,在下述实施例中进一步解释了本发明,但其不限于所述实施例。附图图1:来自实施例1的选择1的设备和流程图。图2:来自实施例2的选择2的设备和流程图。图3:来自实施例3的每种样本类型Cp值的平均值(MW)(带标准差)的图形描述。图4:来自实施例3的每种样本类型Cp值的平均值(MW)(带标准差)的图形描述。图5:来自实施例3的每种样本类型Cp值的平均值(MW)(带标准差)的图形描述。图6:来自实施例3的每种样本类型Cp值的平均值(MW)(带标准差)的图形描述。图7:来自实施例3的每种样本类型Cp值的平均值(MW)(带标准差)的图形描述。观察到了板1(未混合的)上和最终4倍混合的板上的各HBV的一次失败。图8:来自实施例3的每种样本类型的Cp值(带标准差)的总结。对贯穿板的样本类型(分别为未混合的、2倍或4倍混合的)的所有重复进行总结。实施例下述实施例1和2讨论了所述8倍或4倍珠子混合原则的两种可能的选择,其中所有三部分均合并至连续过程的单一测试平台中。可以提供分别吹吸或者在同一平台上吹吸的“预”混合的样本代替单个供体样本。可以使用样本池代替单个样本。也可以将3个或者更多个样本或样本池进行合并来代替如此处所示的各2个样本(样本板)。实施例1:处理48个样本(持续大约4h)混合发生在与提取和PCR设置相同的自动移液工作站。出于该目的,通过条架(striprack)上的移液机械臂移动多达48个初始条形码标记的小瓶(EDTAVacuette,Greiner,Frickenhausen,Germany),之前将所述小瓶在5,500xg离心15min(Multifuge,Kendro,Osterode,Germany),以分离血浆和血液细胞组分。此外,将多达48个条形码标记的池容器(例如小瓶)置于移液机械臂的工作空间。移液装置配备有用于自动化核酸分离的磁性分离器。例如,病毒核酸的提取使用如德国专利DE10258258A1中公开的基于磁性颗粒的提取化学。除了48个条形码标记的小瓶之外,提取装置还配备有耗材(一次性吸头、反应器皿)、提取试剂(GFEBlut的autoX提取试剂盒)以及用于HIV、HCV、HBV、HAV和PB19(所谓混合母液(mastermixes))的PCR试剂。在完全自动化的提取过程开始之后,读取初始小瓶的条形码。从各初始小瓶提取100μL血浆,并将其置于离心小瓶(混合容器)中。向样本池中添加800μL结合缓冲液。然后将这些搅拌10min。然后将分别来自2个小瓶的裂解物在反应器皿中合并。由磁性颗粒分离剩余的裂解物,并且仅对与核酸结合的磁性颗粒进行进一步处理。随后用含有蛋白酶的洗涤缓冲液进行两个洗涤步骤以及于80℃(磁性分离器的加热模块),在具有低离子强度的缓冲液中进行核酸的洗脱。在各种情况下,通过磁性分离器上的磁性分离进行液体和核酸结合基质的分离。一旦核酸分离完成,随后进行完全自动化的PCR设置。正如在核酸提取的情况下,该步骤是完全条形码控制的,并且遵循由软件所产生的工作表。出于该目的,将之前置于提取装置的工作空间的相应的病毒特异的PCR混合母液置于各PCR板,并且随后添加提取物。提取和PCR设置的总持续时间为大约2.5小时。合适的移液装置及其组件为,例如德国的TecanofCrailsheim的装置。因此,合适的自动化移液装置可以由FreedomEVO组成,而诸如TeMagS类型的装置可以用作磁性分离器,以及可将诸如IKAKScontrol130类型的装置用于搅拌。德国MerckofDarmstadt的二氧化硅是合适的磁性颗粒的实例。条形码以及提取和PCR设置的监测由软件控制。最终步骤是PCR板的手动或自动密封,以及其向实时PCR热循环仪的转移。如之前所公开的实施扩增;对于HIV-1,参见DrostenC等人(J.Clin.Microbiol.,2001,39:4302-4308);对于HBV,参见DrostenC.等人(Transfusion,2000,40:718-427);对于HCV、HBV和HIV-1,参见RothWK等人(Lancet,1999,353:359-363)。优选地,这包括含有竞争性内部对照的TaqManPCR分析。以上扩增和检测花费大约2小时。RocheDiagnostics的480装置是合适的热循环仪的实例。结果:所描述的测试实现了NAT测试过程的完全条形码控制。确定排除了样本的任何混淆。关于单一捐献,对于各病毒,以三倍浓度使用由GFEBlut的autoX系统实现的95%的检测限(对于HCV,102IU/mL;对于HIV-1,1046IU/mL;对于HBV,91IU/mL;对于HAV,40IU/mL;以及对于PB19,483IU/mL)。未观察到失败,得到这样的结论:所述方法具有等同灵敏度。实施例2:处理192个样本(持续大约3小时)手动制备样本,但是这也可以在移液平台上实施。用ThermoFisher的KingFisherFlex实施提取,并且手动进行本实施例中的PCR设置(也可在移液平台上实施)。出于该目的,通过条架上的移液机械臂移动多达192个原始条形码标记的小瓶(EDTAVacuette,Greiner,Frickenhausen),之前将所述小瓶在5,500xg离心15min(Multifuge,Kendro,Osterode),以分离血浆和血液细胞组分。此外,将多达2个条形码标记的池容器(例如,具有96个孔的板)置于移液机械臂的工作空间上。为了使核酸分离自动化,使移液装置配备有磁性分离器(KingFisher)。然而,由于其还未被实施,因此在单独的KingFisher模块上进行提取。例如,病毒核酸的提取使用如德国专利DE10258258A1中所公开的基于磁性颗粒的提取化学。除了4个条形码标记的96孔板之外,提取装置还配备有耗材(一次性吸头、反应器皿、深孔板),提取试剂(GFEBlut的autoX提取试剂盒)以及用于HIV、HCV、HBV、HAV和PB19的PCR试剂(所谓的混合母液)。在样本制备过程(也用于混合)开始之后,读取初始小瓶的条形码。从各初始小瓶提取100μL血浆,并将其置于96孔板内。向各样本池添加800μL结合缓冲液,并将其置于KingFisher模块上。然后将样本搅拌10min。随后由磁性颗粒分离剩余的裂解物,并且仅将分别来自2个板位置的与核酸结合的磁性颗粒在96孔板的一处位置合并,以用于进一步处理。随后用含有蛋白酶的洗涤缓冲液进行两个洗涤步骤以及于80℃(磁性分离器的加热模块),在具有低离子强度的缓冲液中进行核酸的洗脱。在各种情况下,经磁性分离器,通过磁性分离进行液体和核酸结合基质的分离(用永磁头进行浸渍处理)。一旦核酸分离完成,则可以开始完全自动化的PCR设置(这在该实施例中手动进行)。正如在核酸提取的情况下,该步骤是完全条形码控制的,并且遵循由软件产生的工作表。出于该目的,将之前位于提取装置的工作空间上的相应的病毒特异性PCR混合母液置于各PCR板内,并且随后添加提取物。提取和PCR设置的总持续时间为大约1小时。合适的移液装置及其组件为,例如TecanofCrailsheim的装置。因此,合适的自动化移液装置可以由FreedomEVO装置组成,而诸如KingFisherFlex类型的装置可以用作磁性分离器。MerckofDarmstadt的二氧化硅是合适的磁性颗粒的实例。系统软件控制条形码,并且控制且监测提取和PCR设置。最终步骤是PCR板的手动或自动化密封,以及其向实时PCR热循环仪的转移。如之前公开的实施扩增;对于HIV-1,参见DrostenC.等人(J.Clin.Microbiol.,2001,39:4302-4308);对于HBV,参见DrostenC.等人(Transfusion,2000,40:718-427);对于HCV、HBV和HIV-1,参见RothWK等人(Lancet,1999,353:359-363)。优选地,这包括含有竞争性内部对照的TaqManPCR分析。以上扩增和检测花费大约2小时。RocheDiagnostics的480装置是合适的热循环仪的实例。结果:所述测试实现了NAT测试过程的完全条形码控制。确定排除了样本的任何混淆。关于单一捐献,对于各病毒,以三倍浓度使用由GFEBlut的autoX系统实现的95%的检测限(对于HCV,997IU/mL;对于HIV-1,1029IU/mL;对于HBV,59IU/mL),并且在珠子混合的各种情况下,将其与阴性样本组合。未观察到失败,得到这样的结论:所述方法具有等同灵敏度。实施例32倍珠子混合为了提供方法的功能的证据,在使用提取模块(EM,用于加热样本、磁性分离和磁性颗粒的重悬的装置)的同时,实施2倍珠子混合,即来自两个样本池的磁性颗粒的合并。为此,提供24孔形式的两个样本板,其中样本池如下:板1:板2:阳性=分别为100μl的15(分析1)或13(分析2)个样本的池,它们中的14个或12个是病毒阴性样本(NHP)并且一个是与GFEautoX系统的2倍检测限相对应的病毒阳性样本:阴性=1.5(分析1)或1.3(分析2)ml阴性人血浆(NHP)IC=内部对照,由重组RNA病毒组成,用于监测从病毒裂解至RT-PCR的过程步骤以及控制珠子的转移。在病毒裂解和核酸与磁性颗粒结合之后,将来自板1和2的磁性颗粒合并:板3:在每个初始板可用的24个重复中,对于分别来自板1或板2的各6个重复,不实施珠子混合。对于另外6个重复,将阳性材料与阳性材料混合,其中IC各自仅存在于半行中。这导致具有各自单一量的IC的理论上两倍的阳性材料。因此,应当用如未混合样本中的更早的Cp值来检测各病毒(理论位移-1),而IC的检测不应改变。对于剩余的6个重复,将阳性材料与阴性材料混合,而IC各自仅存在于半行中。在此,应当在无任何改变的情况下检测各病毒和IC,即可与不存在珠子混合的分析相比较,而无Cp位移。使用该板配置,在使用的磁性颗粒的种类和提取方案(分别不使用或者使用乙醇)不同的两个独立分析中,可以显示,方法的灵敏度不受2倍珠子混合的影响。分析1:1.5ml血浆,离液序列高的裂解以及与具有二氧化硅表面的磁性颗粒结合,使用温和且不含乙醇的洗涤缓冲液。不同的样本类型包含于24深孔KF板中,每孔如下:阳性+IC:100μlPos+1.4mlNHP+10μlIC成套液(kit)阳性:100μlPos+1.4mlNHP阴性+IC:1.5mlNHP+10μlIC成套液阴性:1.5mlNHP在提取模块的提取的顺序,包括下述手动步骤:-在24深孔板中提供待提取的样本(参见上述);-添加975μl蛋白酶K溶液;-添加1.970μl含磁性颗粒的离液序列高的结合缓冲液;-通过EM裂解(在56℃混合/孵育),收集珠子,并转移至500μl洗涤缓冲液1中;-通过EM混合,收集珠子,并转移至500μl洗涤缓冲液2中;-通过EM混合,收集珠子,并转移至130μl洗脱缓冲液中,在80℃洗脱;-通过EM收集珠子;-将洗脱物(~80μl)手动转移至PCR反应中(参见下文)。PCR反应:通过向参数HBV/HCV(bc)、HIV-1(i1)、HIV-2/HAV(i2a)和PB19(b19)的各寡聚混合物(OM)中添加基础混合物(BM)来制备PCR-混合母液(MM)。bc、i2a:每132μlOM,各858μlBM30μlMM/孔分别添加20μl各洗脱物或PosKo(阳性对照的成套液)或NTC(阴性对照的成套液);i1、b19:每84μlOM,各546μlBM15μlMM/孔分别添加10μl各洗脱物或PosKo(阳性对照的成套液)或NTC(阴性对照的成套液);用RocheLightCycler480II系统在96孔板中运行定量RT-PCR。结果:+在无珠子混合的情况下的单一量的阳性材料(分别是板1或板2)++两个阳性样本进行珠子混合之后的双倍量的阳性材料+-在一个阳性样本和一个阴性样本进行珠子混合之后的单一量的阳性材料Cp值的平均值(MW):图3显示了每种样本类型Cp值的平均值(MW)(带标准差)的图形描述。除了HIV-2(在+(板1)一次失败)以外,未观察到失败。结果显示珠子混合在未丧失任何灵敏度下起作用。这一方面显示于IC中,其最终以单一量见于所有样本中(不存在或者存在珠子混合),并且对于所有参数(bc、i1、i2a、b19),可分别用非常相当的Cp值对其进行鉴定。另一方面,对于最终单一量的阳性材料(+)的所有样本(不存在以及存在珠子混合),所有病毒参数(HCV、HBV、HIV-1、HIV-2、HAV、PB19)各自显示出非常相当的Cp值。此外,在珠子混合之后,如所期望的,包含双倍量的阳性材料(++)的所有样本显示出略小的Cp值,反映增加量的病毒。总之,符合单一珠子混合的预期。与未混合的样本相比,最终增加的珠子的量不会导致洗脱效力的显著变差。在分析2中,使用不同的磁性颗粒和不同的方案确认了对于双倍珠子混合的该结果。分析2:1.3ml血浆,离液序列高的裂解以及核酸与磁性颗粒(用官能团修饰的表面)的结合的异丙醇沉淀,用包含乙醇的洗涤缓冲液洗涤。不同的样本类型如下包含于24深孔KF板的各孔中:阳性+IC:100μlPos+1.2mlNHP+10μlIC成套液阳性:100μlPos+1.2mlNHP阴性+IC:1.3mlNHP+10μlIC成套液阴性:1.3mlNHP在提取模块(EM)的提取的顺序,包括下述手动步骤:-在24深孔板中提供待提取的样本(参见上述);-添加325μl蛋白酶K溶液;-添加1.300μl含有磁性颗粒的离液序列高的结合缓冲液;-通过EM裂解(在56℃混合/孵育);-添加10μl磁性颗粒;-添加2.050μl异丙醇;-通过EM收集珠子,并转移至700μl洗涤缓冲液1中;-通过EM混合,收集珠子,并转移至800μl洗涤缓冲液2中;-通过EM混合,收集珠子,并转移至130μl洗脱缓冲液中,在80℃洗脱;-通过EM收集珠子;-将洗脱物(~80μl)手动转移至PCR反应中(参见下文)。PCR反应:通过向参数HBV/HCV(bc)、HIV-1(i1)、HIV-2/HAV(i2a)和PB19(b19)的各寡聚混合物(OM)中添加基础混合物(BM)来制备PCR-混合母液(MM)。bc、i2a:每132μlOM,各858μlBM30μlMM/孔分别添加20μl各洗脱物或PosKo(阳性对照的成套液)或NTC(阴性对照的成套液);i1、b19:每84μlOM,各546μlBM15μlMM/孔分别添加10μl各洗脱物或PosKo(阳性对照的成套液)或NTC(阴性对照的成套液);使用RocheLightCycler480II系统,在96孔板中运行定量RT-PCR。结果:+在无珠子混合的情况下的单一量的阳性材料(分别是板1或板2)++两个阳性样本进行珠子混合之后的双倍量的阳性材料+-在一个阳性样本和一个阴性样本进行珠子混合之后的单一量的阳性材料Cp值的平均值(MW):MWCpHCVHBVHIV-1v3HIV-2v2HAVv2PB19IC(bc)IC(i1)IC(i2av2)IC(b19)+(板1)34.0332.8629.1727.2126.5630.2629.3126.0525.7826.09+(板2)33.7332.3929.4026.9626.3630.1628.9025.7625.6126.04++33.1231.7629.0825.8025.2429.2929.8626.3025.5526.55+-33.5633.0430.0727.3126.3030.4730.0426.5626.0526.48图4显示了每种样本类型Cp值的平均值(MW)(带标准差)的图形描述。未观察到失败。结果确认了珠子混合也在不同的实验设置中的成功实践实施。这在一方面显示于IC中,其最终以单一量见于所有样本中(不存在或存在珠子混合),并且对于所有参数(bc、i1、i2a、b19),可分别用非常相当的Cp值对其进行鉴定。未能观察到珠子混合的显著变差。另一方面,对于最终为单一量的阳性材料(+)的所有样本(不存在或存在珠子混合),所有病毒参数(HCV、HBV、HIV-1、HIV-2、HAV、PB19)各自显示出非常相当的Cp值。此外,在珠子混合之后,如所期望的,包含双倍量的阳性材料(++)的所有样本显示出略小的Cp值,反映增加量的病毒。总之,结果符合预期,与未混合的样本相比,最终增加的珠子的量不会导致洗脱效力的显著变差。在分析3中,确认了对于4倍珠子混合的该结果。分析3:为了确认方法的功能,使用提取模块(EM,用于加热样本,磁性分离和磁性颗粒重悬的装置)实施所谓的4倍珠子混合,即来自4个样本池的磁性颗粒的混合。实验设置:对于4倍珠子混合,需要2个EM,每个同时裂解两个样本板,即总共处理4个样本板。裂解之后,在各EM,在洗涤缓冲液1中合并两个样本板的珠子(→2倍混合)。在下一步骤中,将两个WB1板置于EM的外巢上,并且在洗涤缓冲液2(中间巢)中合并两个板的珠子(→总共4倍混合)。将实验计划为,可以使用Cp值作为读出,在定量RT-PCR中最终控制各单个板的裂解以及2倍和4倍珠子混合。对于此,在提取时,产生未混合的、2倍混合的以及4倍混合的样本。每行以交替串联向样本板中添加IC,以在成功进行珠子混合之后,在各样本位置可以检测到单一量的IC。为了对混合的效力以及混合可能的负面影响进行测试,在另一方面,将“阳性材料与阳性材料”进行比较,以及在另一方面,“将阳性材料与阴性材料(NHP)”混合。分析3:4倍混合的“阳性材料与阳性材料”:1.5ml血浆,离液序列高的裂解,以及与具有二氧化硅表面的磁性颗粒结合,使用温和且不含乙醇的洗涤缓冲液使24孔形式的四个初始样本板载有如下样本池,其中使用两个不同的样本类型:Pos+IC:100μlPos+1.4mlNHP+10μlIC成套液Pos:100μlPos+1.4mlNHP阳性(Pos)=各100μl的15个样本的池,其包含14个病毒阴性样本(NHP)和一个与GFEautoX系统的2倍检测限相对应的病毒阳性样本:IC=内部对照,由重组RNA病毒组成,用于监测病毒裂解至RT-PCR的处理步骤以及控制珠子的转移。板1(EMv2,巢1):板2(EMv2,巢3):123456APosPosPosABBCPos+ICPos+ICPos+ICPos+ICPos+ICPos+ICCDPosPosPosD123456板3(EMv1,巢1):123456AABPos+ICPos+ICPos+ICPos+ICPos+ICPos+ICBCPosPosPosCDPosPosPosD123456板4(EMv1,巢3):123456AABPosPosPosBCPosPosPosCDPos+ICPos+ICPos+ICPos+ICPos+ICPos+ICD123456随后在WB1中的2倍珠子混合:2xPos=作为2倍珠子混合的结果的双倍量的阳性材料。WB1(EMv2)中的板1+2:WB1(EMv1)中的板3+4:随后在WB2中的4倍珠子混合:4xPos=作为4倍珠子混合的结果的4倍量的阳性材料。WB1(EMv1)+WB1(EMv2)=板1+2+3+4在每个初始板中呈现的24个重复中,对于各板1-4的3个重复,未实施珠子混合(总共12个重复)。对于两个2倍珠子混合制备物中的另外3个重复,将阳性材料与阳性材料混合,其中IC仅存在于一行(总共6个重复)。这导致各单一量的IC的理论上双倍的阳性材料(2xPos)。因此,应当用在未混合样本中的较早的Cp值(理论位移-1)来检测各病毒,而IC的检测不应改变。对于剩余的6个重复,在2个步骤中,分别将阳性材料与阳性材料合并,其中IC仅存在于一行中。这通过两个随后的珠子混合步骤,导致单一量的IC的理论上四倍的阳性材料(4xPos)。因此,与应当观察到理论位移-2的Cp的未混合的样本相比,应当用2倍混合样本中甚至更早的Cp值(理论位移-1)来检测各病毒。IC的检测不应改变。在提取模块(EM)的提取的顺序,包括下述手动步骤:-在24深孔板中提供待提取的样本(参见上述);-添加975μl蛋白酶K溶液;-添加1.970μl含磁性颗粒的离液序列高的结合缓冲液;-通过EM裂解(在56℃混合/孵育);收集珠子;-2倍珠子混合:通过EM将珠子从各2个初始样本板转移至500μl洗涤缓冲液1中;-混合,收集珠子;-4倍珠子混合:通过EM将2倍混合的转移至500μl洗涤缓冲液2中;-通过EM混合,收集珠子,并转移至150μl洗脱缓冲液中,在80℃洗脱;-通过EM收集珠子;-将洗脱物(~80μl)手动转移至PCR反应中(参见下述)。PCR反应:与2倍珠子混合的分析类似。结果:Pos+IC在不存在珠子混合的情况下的单一量的阳性材料,单一量的IC2xPos+IC在两个阳性样本的2倍珠子混合之后的双倍量的阳性材料,单一量的IC4xPos+IC在四个阳性样本的4倍珠子混合之后的四倍量的阳性材料,单一量的IC。图5显示了每个参数和板的Cp值的平均值(MW)(带标准差)的图形描述。未观察到失败。图6显示了Cp值的总结:对贯穿板的样本类型(分别为未混合的、2倍混合池或4倍混合池)的所有重复进行总结。结果显示也可以实施4倍珠子混合,而不存在任何问题。这在一方面显示于IC中,其最终见于单一量的所有样本中(分别不存在以及存在2倍或4倍珠子混合),并且对于所有参数(bc、i1、i2a、b19),可分别用非常相当的Cp值对其进行鉴定。在另一方面,如可从未混合的材料至2倍混合的材料直至4倍混合的材料很好地看出,如所期望的,所有病毒参数(HCV、HBV、HIV-1、HIV-2、HAV、PB19)各自显示出Cp值的增加。这反映了增加量的病毒。总之,结果符合预期,与未混合的样本相比,最终增加的珠子的量不会导致洗脱效力的显著变差。分析4:4倍混合的“阳性材料和阴性材料”:1.5ml血浆,离液序列高的裂解以及与具有二氧化硅表面的磁性颗粒结合,使用温和且不含乙醇的洗涤缓冲液。使24孔形式的四个初始样本板载有如下样本池,其中使用四个不同的样本类型:Pos+IC:100μlPos+1.4mlNHP+10μlIC成套液Pos:100μlPos+1.4mlNHPNeg+IC:1.5mlNHP+10μlIC成套液Neg:1.5mlNHP阳性(Pos)=各100μl的15个样本的池,其包含14个病毒阴性样本(NHP)和一个与GFEautoX系统的2倍检测限相对应的病毒阳性样本:阴性(Neg)=各100μl的15个病毒阴性(NHP)样本的池。IC=内部对照,由重组RNA病毒组成,其用于病毒裂解至RT-PCR的处理步骤以及控制珠子的转移。板1(EMv1,巢1):板2(EMv1,巢3):板3(EMv2,巢1):123456AABPos+ICPos+ICPos+ICPos+ICPos+ICPos+ICBCNegNegNegCDNegNegNegD123456板4(EMv2,巢3):123456AABNegNegNegBCPosPosPosCDPos+ICPos+ICPos+ICPos+ICPos+ICPos+ICD123456随后在WB1中的2倍珠子混合:在WB1(EMv1)中的板1+2:在WB1(EMv2)中的板3+4:随后在WB2中的4倍珠子混合:WB1(EMv1)+WB1(EMv2)=板1+2+3+4在每个初始板中呈现的24个重复中,对于各板1-4的3个重复,未实施珠子混合(总共12个重复)。对于两个2倍珠子混合制备物中的另外3个重复,将阳性材料与阳性材料混合,其中IC仅存在于一行(总共6个重复)。对于剩余的6个重复,在2个步骤中,将阳性材料与三倍阴性材料混合一次成4倍,其中IC仅存在于一行中。因此,实验理论上导致24个相同的样本,其中阳性材料以及IC均以单一量存在(Pos+IC)。因此,这些样本在PCR中应当表现类似,并且应当用类似的Cp值对其进行检测。在该实施例中,如以上所述,以与其它分析类似地实施该实验。图7显示了每个参数和板的Cp值的平均值(MW)(带标准差)的图形描述。观察到了板1(未混合的)上以及最后的4倍混合板上各HBV的一次失败。此外,图8显示了Cp值的总结:对贯穿板的样本类型(分别为未混合的、2倍混合的或4倍混合的)的所有重复进行总结。结果显示也可以实施4倍珠子混合,而不存在任何问题。这在一方面显示于IC以及病毒参数(HCV、HBV、HIV-1、HIV-2、HAV、PB19)中,其最终见于单一量的所有样本中(分别不存在以及存在2倍或4倍珠子混合),并且对于所有参数,可分别用非常相当的Cp值对其进行鉴定。总之,1个阳性与3个阴性池样本的4倍珠子混合的结果符合预期。与未混合的样本相比,最终增加的珠子的量不会导致洗脱效力的显著变差。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1