使用核苷酸可逆终止子的离子传感器DNA和RNA合成测序的制作方法
本申请通过引用并入名为“150518_0575_82337-PCT_Sequence Listing_JAK.txt”的文件中记载的核苷酸和/或氨基酸序列,此文件大小为1千字节,于2015年5月18日以IBM-PC机格式创建,与MS-Windows的操作系统兼容,且作为本申请的一部分包含在于2015年5月18日提交的文本文件中。
本发明受到政府的支持,在美国国立卫生研究院授予的基金号HG003582和HG005109下进行。美国政府对本发明有一定的权利。
在本申请全文中,在括号中引用了某些出版物。在权利要求之前紧挨着权利要求可以找到这些出版物的完整引用。这些出版物的全部公开通过引用并入本申请以便更充分地描述本发明所涉及的现有技术。
背景技术:
从像生态学和进化这样不同的领域到基因发现和个性化医疗,高通量测序已成为基本所有现代生物学领域的基本支持技术。通过在其所有变体中使用大规模平行测序,可以鉴定整个生命树中基因之间的同源性,以检测个人的单核苷酸多态性(SNP)、变体拷贝数和基因组重排,详细表征转录组及其转录因子结合位点,并提供表观基因组的详细的甚至完整的视图(Hawkins et al.2010;Morozova et al.2009;Park et al.2009)。
为了向前推进个性化医疗领域,必须为包括具有范围广泛的复杂疾病的个体在内的所有地缘种族群体的代表性样品收集完整的基因型和表型信息。拥有这样的数据概要最终将允许医生为每个患者定制疗法,同时将控制其对不同药物耐受和反应能力的遗传因素考虑在内。然而,这将要求全基因组测序的成本在大多数其他医学测试的成本范围内,通常认为其他医学测试的成本为1000美元或更少,并且要求每个碱基的错误率低于除了最罕见的SNP之外的所有SNP的频率(在10,000中<1)(Fuller et al.2009;Ng et al.2010;Shen et al.2010)。
最近各种所谓的“下一代”测序技术已将相对高准确度的基因组测序成本降低至接近100,000美元,但即使在最富裕的国家对于医疗保健系统来说这个费用仍然很高。需要进一步提高当前技术的效率并引入突破性技术才能推动该领域实现1,000美元的目标。在“下一代”测序技术中,最流行的是合成测序(SBS)策略(Fuller et al.2009),该策略以诸如Roche、Illumina、Helicos和Intelligent Biosystems等公司已商品化的或正在开发的多种仪器为基础。一种成功的SBS方法涉及荧光标记的核苷酸可逆终止子(NRT)的使用(Ju et al.2003;Li et al.2003;Ruparel et al.2005;Seo et al.2005;Ju et al.2006)。这些核苷酸可逆终止子是修饰的dNTP(A、C、T/U和G),所述修饰的dNTP具有碱基特异性荧光团和阻断糖的3'羟基从而阻止其通过将下一个核苷酸经由可化学裂解的键、可酶裂解的键或可光裂解的键连接到每个dNTP进行延伸。这允许中断聚合酶反应,根据连接的荧光标签的颜色确定并入的碱基,然后去除荧光团和3'-OH保护基团以允许再加入一个碱基。使用NRT的重要性在于,其大大降低了由加入多于一个核苷酸导致的预读的可能性,特别是在使用中间同步策略的情况下。Roche的焦磷酸测序方法(Ronaghi et al.1998)以及Helicos的“虚拟”终止子的使用(Bowers et al.2009;Harris et al.2008)均需要逐个添加每个碱基,随后得到间接读数(在前者中为光产生量),或得到直接读数但该读数为单色(在后者中)。尽管这些方法具有不可否认的影响(Roche的方法具有长读长(read length),Helicos的方法具有单分子能力),但是所述方法难以精确解码长于~4或5个碱基的同聚物片段(stretch)(Ronaghi et al.2001)。此外,焦磷酸测序有假阳性问题,因为游离dNTP会在溶液中自发分解,释放焦磷酸(Gerstein 2001)产生信号。
最近,Ion Torrent有限公司描述了测序策略,其中当每个核苷酸并入DNA链中时释放的质子被离子传感器捕获并使用半导体技术将其数字化(Anderson et al.2009;Rothberg et al.2011)。然而,由于这些策略使用天然核苷酸,因此无论并入四种核苷酸中的哪一种,这种输出都是相同的,这使逐一添加碱基的策略是必要的,且固有地难以在同聚物碱基运行时获得准确的读段(read)。
已对SBS方法进行了描述,其中每个核苷酸具有独特的拉曼光谱峰,其中确定拉曼峰的波数用于鉴定并入的核苷酸类似物(PCT国际申请公开号WO2012/162429,其再次通过引用并入)。然而,使用拉曼光谱检测并鉴定核苷酸类似物具有这种技术固有的低灵敏度问题。
技术实现要素:
本发明涉及在溶液中确定单链DNA的核苷酸残基的身份的方法,其包括:
(a)使具有与其一部分杂交的引物的单链DNA与DNA聚合酶和脱氧核糖核苷三磷酸(dNTP)类似物在下述条件下接触:如果所述dNTP类似物与单链DNA的核苷酸残基互补,所述核苷酸残基在5'方向上紧挨着与引物的3'末端核苷酸残基杂交的所述单链DNA的核苷酸残基,则允许所述DNA聚合酶催化将所述dNTP类似物并入至所述引物中从而形成DNA延伸产物,其中(1)dNTP类似物具有以下结构:
其中B为碱基并且为腺嘌呤、鸟嘌呤、胞嘧啶或胸腺嘧啶,(2)R'为(i)-CH2N3或2-硝基苄基,或(ii)质量小于300道尔顿的烃基或取代烃基;以及
(b)通过确定溶液的氢离子浓度是否增加来确定在步骤(a)中所述dNTP类似物是否并入了引物以形成DNA延伸产物,其中(i)如果所述dNTP类似物已并入引物,根据并入的dNTP类似物的身份确定单链DNA中与其互补的核苷酸残基的身份,由此确定所述单链DNA中的核苷酸残基的身份,以及(ii)如果氢离子浓度没有变化,重复进行步骤(a),其中在步骤(a)的每次重复中,dNTP类似物包含的碱基的类型与步骤(a)的每次在前重复中dNTP类似物的碱基的类型不同,直到dNTP类似物并入引物以形成DNA延伸产物,并根据并入的dNTP类似物的身份确定单链DNA中与其互补的核苷酸残基的身份,由此确定所述单链DNA中核苷酸残基的身份。
本发明还涉及在溶液中确定单链DNA的连续核苷酸残基的序列的方法,其包括:
(a)使具有与其一部分杂交的引物的单链DNA与DNA聚合酶和脱氧核糖核苷三磷酸(dNTP)类似物在下述条件下接触:如果所述dNTP类似物与单链DNA的核苷酸残基互补,所述核苷酸残基在5'方向上紧挨着与引物的3'末端核苷酸残基杂交的所述单链DNA的核苷酸残基,则允许所述DNA聚合酶催化将所述dNTP类似物并入至所述引物中从而形成DNA延伸产物,其中(1)dNTP类似物具有以下结构:
其中B为碱基并且为腺嘌呤、鸟嘌呤、胞嘧啶或胸腺嘧啶,(2)R'为(i)-CH2N3或2-硝基苄基,或(ii)质量小于300道尔顿的烃基或取代烃基;以及
(b)通过检测溶液的氢离子浓度的增加来确定在步骤(a)中所述dNTP类似物是否并入,其中氢离子浓度的增加表明所述dNTP类似物已经并入引物以形成DNA延伸产物,如果溶液的氢离子浓度增加,则根据并入的dNTP类似物的身份确定单链DNA中与其互补的核苷酸残基的身份,由此确定所述单链DNA中的核苷酸残基的身份,并且其中氢离子浓度没有变化表明在步骤(a)中所述dNTP类似物没有并入引物中;
(c)如果在步骤(b)中未检测到氢离子浓度的变化,重复进行步骤(a)和(b),其中在针对正被测定身份的指定核苷酸残基的步骤(a)的每次重复中,dNTP类似物包含的碱基的类型与针对所述核苷酸残基的步骤(a)的每次在前重复中dNTP类似物的碱基的类型不同,直到dNTP类似物并入引物以形成DNA延伸产物,并根据并入的dNTP类似物的身份确定单链DNA中与其互补的核苷酸残基的身份,由此确定所述单链DNA中核苷酸残基的身份;
(d)如果已检测到氢离子浓度的增加并且并入了dNTP类似物,则随后处理并入的dNTP类似物以便用H原子代替其R'基团,从而在DNA延伸产物的3'端提供3'OH基团;以及
(e)根据需要,对待测序的单链DNA的连续核苷酸残基的每个核苷酸残基重复进行步骤(a)至(d),除了:在步骤(a)的每次重复中,(i)dNTP类似物并入由步骤(a)或步骤(c)的在前重复产生的DNA延伸产物中,并且(ii)dNTP类似物与单链DNA的核苷酸残基互补,所述核苷酸残基在5'方向上紧挨着与由步骤(a)或步骤(c)的在前重复产生的DNA延伸产物中的3'末端核苷酸残基杂交的所述单链DNA的核苷酸残基,从而形成随后的DNA延伸产物;条件为对于待测序的最后一个核苷酸残基,步骤(d)是任选的,
由此确定所述单链DNA的连续核苷酸残基中每个核苷酸残基的身份,从而确定所述DNA的连续核苷酸残基的序列。
本发明还涉及在溶液中确定单链RNA的核苷酸残基的身份的方法,其包括:
(a)使具有与其一部分杂交的RNA引物的单链RNA与聚合酶和核糖核苷三磷酸(rNTP)类似物在下述条件下接触:如果所述rNTP类似物与单链RNA的核苷酸残基互补,所述核苷酸残基在5'方向上紧挨着与引物的3'末端核苷酸残基杂交的所述单链RNA的核苷酸残基,则允许所述聚合酶催化将所述rNTP类似物并入至所述RNA引物中从而形成RNA延伸产物,其中(1)rNTP类似物具有以下结构:
其中B为碱基并且为腺嘌呤、鸟嘌呤、胞嘧啶或尿嘧啶,(2)R'为(i)-CH2N3或2-硝基苄基,或(ii)质量小于300道尔顿的烃基或取代烃基;以及
(b)通过确定溶液的氢离子浓度是否增加来确定在步骤(a)中所述rNTP类似物是否并入了RNA引物以形成RNA延伸产物,其中(i)如果所述rNTP类似物已并入RNA引物,根据并入的rNTP类似物的身份确定单链RNA中与其互补的核苷酸残基的身份,由此确定所述单链RNA中的核苷酸残基的身份,以及
(ii)如果氢离子浓度没有变化,重复进行步骤(a),其中在步骤(a)的每次重复中,rNTP类似物包含的碱基的类型与步骤(a)的每次在前重复中rNTP类似物的碱基的类型不同,直到rNTP类似物并入引物以形成RNA延伸产物,并根据并入的rNTP类似物的身份确定单链RNA中与其互补的核苷酸残基的身份,由此确定所述单链RNA中核苷酸残基的身份。
本发明还涉及在溶液中确定单链RNA的连续核苷酸残基的序列的方法,其包括:
(a)使具有与其一部分杂交的RNA引物的单链RNA与聚合酶和核糖核苷三磷酸(rNTP)类似物在下述条件下接触:如果所述rNTP类似物与单链RNA的核苷酸残基互补,所述核苷酸残基在5'方向上紧挨着与RNA引物的3'末端核苷酸残基杂交的所述单链RNA的核苷酸残基,则允许所述聚合酶催化将所述rNTP类似物并入至所述RNA引物中从而形成RNA延伸产物,其中(1)rNTP类似物具有以下结构:
其中B为碱基并且为腺嘌呤、鸟嘌呤、胞嘧啶或尿嘧啶,(2)R'为(i)-CH2N3或2-硝基苄基,或(ii)质量小于300道尔顿的烃基或取代烃基;以及
(b)通过检测溶液的氢离子浓度的增加来确定在步骤(a)中rNTP类似物是否并入,其中氢离子浓度的增加表明所述rNTP类似物已经并入RNA引物以形成RNA延伸产物,如果溶液的氢离子浓度增加,则根据并入的rNTP类似物的身份确定单链RNA中与其互补的核苷酸残基的身份,由此确定所述单链RNA中的核苷酸残基的身份,并且其中氢离子浓度没有变化表明在步骤(a)中rNTP类似物没有并入RNA引物中;
(c)如果在步骤(b)中未检测到氢离子浓度的变化,重复进行步骤(a)和(b),其中在针对正被测定身份的指定核苷酸残基的步骤(a)的每次重复中,所述rNTP类似物包含的碱基的类型与针对所述核苷酸残基的步骤(a)的每次在前重复中rNTP类似物的碱基的类型不同,直到rNTP类似物并入引物以形成RNA延伸产物,并根据并入的rNTP类似物的身份确定单链RNA中与其互补的核苷酸残基的身份,由此确定所述单链RNA中核苷酸残基的身份;
(d)如果已检测到氢离子浓度的增加并且并入了rNTP类似物,则随后处理并入的rNTP核苷酸类似物以便用H原子代替其R'基团,从而在RNA延伸产物的3'端提供3'OH基团;以及
(e)根据需要,对待测序的单链RNA的连续核苷酸残基的每个核苷酸残基重复进行步骤(a)至(d),除了:在步骤(a)的每次重复中,(i)rNTP类似物并入由步骤(a)或步骤(c)的在前重复产生的RNA延伸产物中,并且(ii)rNTP类似物与单链RNA的核苷酸残基互补,所述核苷酸残基在5'方向上紧挨着与由步骤(a)或步骤(c)的在前重复产生的RNA延伸产物中的3'末端核苷酸残基杂交的所述单链RNA的核苷酸残基,从而形成随后的RNA延伸产物;条件为对于待测序的最后一个核苷酸残基,步骤(d)是任选的,
由此确定所述单链RNA的连续核苷酸残基中每个核苷酸残基的身份,从而确定所述RNA的连续核苷酸残基的序列。
本发明还涉及在溶液中确定单链RNA的核苷酸残基的身份的方法,其包括:
(a)使具有与其一部分杂交的DNA引物的单链RNA与逆转录酶和脱氧核糖核苷三磷酸(dNTP)类似物在下述条件下接触:如果所述dNTP类似物与单链RNA的核苷酸残基互补,所述核苷酸残基在5'方向上紧挨着与DNA引物的3'末端核苷酸残基杂交的所述单链RNA的核苷酸残基,则允许所述逆转录酶催化将所述dNTP类似物并入至所述DNA引物中从而形成DNA延伸产物,其中(1)dNTP类似物具有以下结构:
其中B为碱基并且为腺嘌呤、鸟嘌呤、胞嘧啶或胸腺嘧啶,和(2)R'为(i)-CH2N3或2-硝基苄基,或(ii)质量小于300道尔顿的烃基或取代烃基;以及
(b)通过确定溶液的氢离子浓度是否增加来确定在步骤(a)中所述dNTP类似物是否并入了DNA引物以形成DNA延伸产物,其中(i)如果所述dNTP类似物已并入DNA引物,根据并入的dNTP类似物的身份确定单链RNA中与其互补的核苷酸残基的身份,由此确定所述单链RNA中的核苷酸残基的身份,以及
(ii)如果氢离子浓度没有变化,重复进行步骤(a),其中在步骤(a)的每次重复中,dNTP类似物包含的碱基的类型与步骤(a)的每次在前重复中dNTP类似物的碱基的类型不同,直到dNTP类似物并入DNA引物以形成DNA延伸产物,并根据并入的dNTP类似物的身份确定单链DNA中与其互补的核苷酸残基的身份,由此确定所述单链DNA中核苷酸残基的身份。
本发明还涉及在溶液中确定单链RNA的连续核苷酸残基的序列的方法,其包括:
(a)使具有与其一部分杂交的DNA引物的单链RNA与逆转录酶和脱氧核糖核苷三磷酸(dNTP)类似物在下述条件下接触:如果所述dNTP类似物与单链RNA的核苷酸残基互补,所述核苷酸残基在5'方向上紧挨着与DNA引物的3'末端核苷酸残基杂交的所述单链RNA的核苷酸残基,则允许所述逆转录酶催化将所述dNTP类似物并入至所述引物中从而形成DNA延伸产物,其中(1)dNTP类似物具有以下结构:
其中B为碱基并且为腺嘌呤、鸟嘌呤、胞嘧啶或胸腺嘧啶,(2)R'为(i)-CH2N3或2-硝基苄基,或(ii)质量小于300道尔顿的烃基或取代烃基;以及
(b)通过检测溶液的氢离子浓度的增加来确定在步骤(a)中dNTP类似物是否并入,其中氢离子浓度的增加表明所述dNTP类似物已经并入DNA引物以形成RNA延伸产物,如果溶液的氢离子浓度增加,则根据并入的dNTP类似物的身份确定单链RNA中与其互补的核苷酸残基的身份,由此确定所述单链RNA中的核苷酸残基的身份,并且其中氢离子浓度没有变化表明在步骤(a)中dNTP类似物没有并入DNA引物中;
(c)如果在步骤(b)中未检测到氢离子浓度的变化,重复进行步骤(a)和(b),其中在针对正被测定身份的指定核苷酸残基的步骤(a)的每次重复中,dNTP类似物包含的碱基的类型与针对所述核苷酸残基的步骤(a)的每次在前重复中dNTP类似物的碱基的类型不同,直到所述dNTP类似物并入DNA引物以形成DNA延伸产物,并根据并入的dNTP类似物的身份确定单链RNA中与其互补的核苷酸残基的身份,由此确定所述单链RNA中核苷酸残基的身份;
(d)如果已检测到氢离子浓度的增加并且并入了dNTP类似物,则随后处理并入的dNTP类似物以便用H原子代替其R'基团,从而在DNA延伸产物的3'端提供3'OH基团;以及
(e)根据需要,对待测序的单链RNA的连续核苷酸残基的每个核苷酸残基重复进行步骤(a)至(d),除了:在步骤(a)的每次重复中,(i)dNTP类似物并入由步骤(a)或步骤(c)的在前重复产生的DNA延伸产物中,并且(ii)dNTP类似物与单链RNA的核苷酸残基互补,所述核苷酸残基在5'方向上紧挨着与由步骤(a)或步骤(c)的在前重复产生的DNA延伸产物中的3'末端核苷酸残基杂交的所述单链RNA的核苷酸残基,从而形成随后的DNA延伸产物;条件为对于待测序的最后一个核苷酸残基,步骤(d)是任选的,
由此确定所述单链RNA的连续核苷酸残基中每个核苷酸残基的身份,从而确定所述RNA的连续核苷酸残基的序列。
附图说明
图1为在3'-OH位置具有各种保护基团(R)的核苷酸可逆终止子(NRT)。2-硝基苄基基团(下部中央)的光裂解(cleavage)或烯丙基(左下)和叠氮基甲基(右下)的化学裂解恢复了3'-OH以用于随后的反应循环。
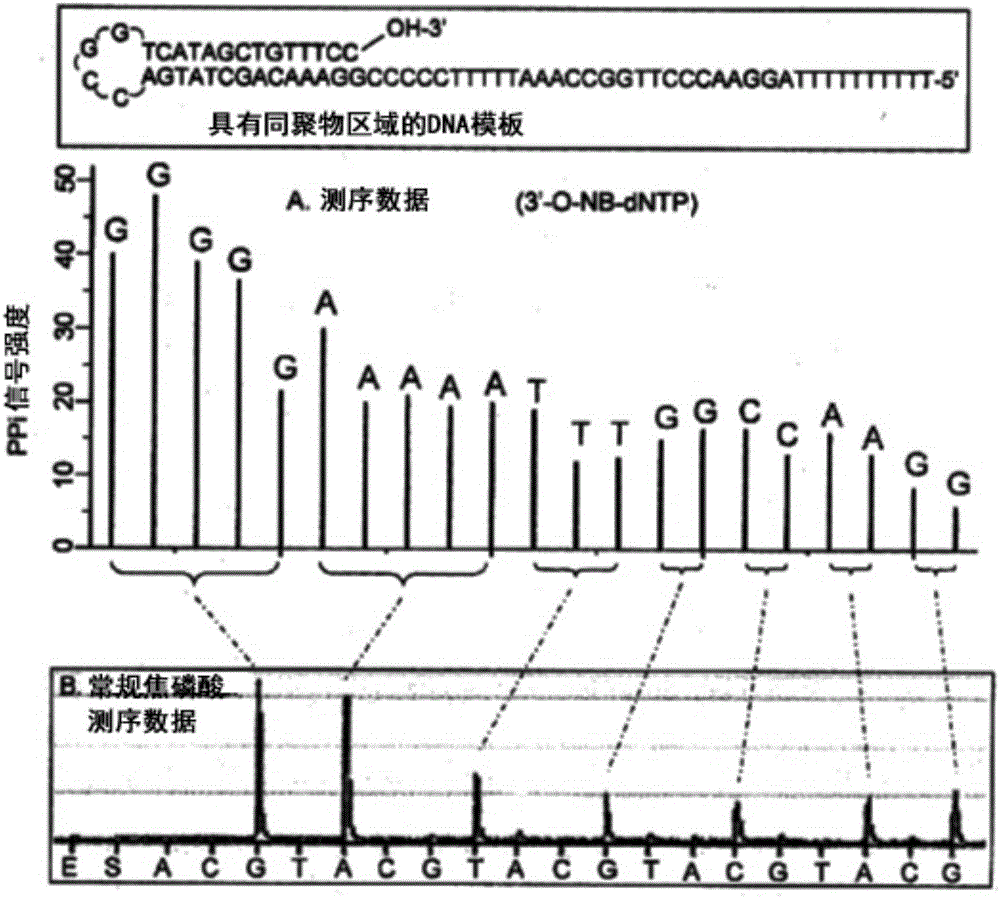
图2为使用3'-O-(2-硝基苄基)-dNTP的DNA可逆终止子-焦磷酸测序与使用天然核苷酸的常规焦磷酸测序的比较(NB=2-硝基苄基)。(A)使用3'-O-(2-硝基苄基)-dNTP对具有同聚区域的片段(5C's、5T's、3A's、2C's、2G's、2T's和2C's)的自引发(self-priming)DNA模板进行测序。用与DNA模板中每个碱基的身份相对应的每个峰清楚地鉴定同聚区域。(B)使用天然核苷酸的焦磷酸测序数据。同聚区域产生了对应于G's和A's片区的两个大峰和对应于T's、G's、C's、A's和G's片区的5个较小的峰。然而,从数据中得到解码确切的序列是非常困难的。
图3为使用NRT的离子传感器合成测序(SBS)。表面连接的模板用NRT延伸,一次添加一个。如果发生并入,则会释放H+离子,对H+离子进行检测。在裂解保护基团后,开始下一个循环。因为NRT迫使反应在每个循环后暂停,所以可精确地测定同聚物的长度。
具体实施方式
本发明涉及在溶液中确定单链DNA的核苷酸残基的身份的方法,其包括:
(a)使具有与其一部分杂交的引物的单链DNA与DNA聚合酶和脱氧核糖核苷三磷酸(dNTP)类似物在下述条件下接触:如果所述dNTP类似物与单链DNA的核苷酸残基互补,所述核苷酸残基在5'方向上紧挨着与引物的3'末端核苷酸残基杂交的所述单链DNA的核苷酸残基,则允许所述DNA聚合酶催化将所述dNTP类似物并入至所述引物中从而形成DNA延伸产物,其中(1)dNTP类似物具有以下结构:
其中B为碱基并且为腺嘌呤、鸟嘌呤、胞嘧啶或胸腺嘧啶,(2)R'为(i)-CH2N3或2-硝基苄基,或(ii)质量小于300道尔顿的烃基或取代烃基;以及
(b)通过确定溶液的氢离子浓度是否增加来确定在步骤(a)中所述dNTP类似物是否并入了引物以形成DNA延伸产物,其中(i)如果所述dNTP类似物已并入引物,根据并入的dNTP类似物的身份确定单链DNA中与其互补的核苷酸残基的身份,由此确定所述单链DNA中的核苷酸残基的身份,以及(ii)如果氢离子浓度没有变化,重复进行步骤(a),其中在步骤(a)的每次重复中,dNTP类似物包含的碱基的类型与步骤(a)的每次在前重复中dNTP类似物的碱基的类型不同,直到dNTP类似物并入引物以形成DNA延伸产物,并根据并入的dNTP类似物的身份确定单链DNA中与其互补的核苷酸残基的身份,由此确定所述单链DNA中核苷酸残基的身份。
本发明还涉及在溶液中确定单链DNA的连续核苷酸残基的序列的方法,其包括:
(a)使具有与其一部分杂交的引物的单链DNA与DNA聚合酶和脱氧核糖核苷三磷酸(dNTP)类似物在下述条件下接触:如果所述dNTP类似物与单链DNA的核苷酸残基互补,所述核苷酸残基在5'方向上紧挨着与引物的3'末端核苷酸残基杂交的所述单链DNA的核苷酸残基,则允许所述DNA聚合酶催化将所述dNTP类似物并入至所述引物中从而形成DNA延伸产物,其中(1)dNTP类似物具有以下结构:
其中B为碱基并且为腺嘌呤、鸟嘌呤、胞嘧啶或胸腺嘧啶,(2)R'为(i)-CH2N3或2-硝基苄基,或(ii)质量小于300道尔顿的烃基或取代烃基;以及
(b)通过检测溶液的氢离子浓度的增加来确定在步骤(a)中dNTP类似物是否并入,其中氢离子浓度的增加表明所述dNTP类似物已经并入引物以形成DNA延伸产物,如果溶液的氢离子浓度增加,则根据并入的dNTP类似物的身份确定单链DNA中与其互补的核苷酸残基的身份,由此确定所述单链DNA中的核苷酸残基的身份,并且其中氢离子浓度没有变化表明在步骤(a)中所述dNTP类似物没有并入引物中;
(c)如果在步骤(b)中未检测到氢离子浓度的变化,重复进行步骤(a)和(b),其中在针对正被测定身份的指定核苷酸残基的步骤(a)的每次重复中,dNTP类似物包含的碱基的类型与针对所述核苷酸残基的步骤(a)的每次在前重复中dNTP类似物的碱基的类型不同,直到dNTP类似物并入引物以形成DNA延伸产物,并根据并入的dNTP类似物的身份确定单链DNA中与其互补的核苷酸残基的身份,由此确定所述单链DNA中核苷酸残基的身份;
(d)如果已检测到氢离子浓度的增加并且并入了dNTP类似物,则随后处理并入的dNTP类似物以便用H原子代替其R'基团,从而在DNA延伸产物的3'端提供3'OH基团;以及
(e)根据需要,对待测序的单链DNA的连续核苷酸残基的每个核苷酸残基重复进行步骤(a)至(d),除了:在步骤(a)的每次重复中,(i)dNTP类似物并入由步骤(a)或步骤(c)的在前重复产生的DNA延伸产物中,并且(ii)dNTP类似物与单链DNA的核苷酸残基互补,所述核苷酸残基在5'方向上紧挨着与由步骤(a)或步骤(c)的在前重复产生的DNA延伸产物中的3'末端核苷酸残基杂交的所述单链DNA的核苷酸残基,从而形成随后的DNA延伸产物;条件为对于待测序的最后一个核苷酸残基,步骤(d)是任选的,
由此确定所述单链DNA的连续核苷酸残基中每个核苷酸残基的身份,从而确定所述DNA的连续核苷酸残基的序列。
在本文所述的任一发明的一个实施方案中,R'为-CH2N3。
在本文所述的任一发明的另一个实施方案中,R'为取代烃基,并且为硝基苄基。在另一个实施方案中,R'为2-硝基苄基。
在本文所述的任一发明的另一个实施方案中,R'为烃基,并且为烯丙基(-CH2-CH=CH2)。
在本文所述的任一发明的一个实施方案中,DNA在设置在传感器上的反应室内的溶液中,所述传感器(i)形成在半导体衬底中,并且(ii)包括场效应晶体管或化学场效应晶体管,所述场效应晶体管或化学场效应晶体管被配置用于响应由核苷三磷酸或核苷三磷酸类似物与引物或DNA延伸产物之间磷酸二酯键的形成引起的溶液氢离子浓度增加而提供至少一个输出信号。
在本文所述的任一发明的另一个实施方案中,反应室是设置在传感器阵列上的多个反应室之一,所述传感器阵列形成于半导体衬底中且包括多个传感器,每个反应室设置在至少一个传感器上,且阵列中的每个传感器包括场效应晶体管,所述场效应晶体管被配置用于响应由核苷三磷酸或核苷三磷酸类似物与引物或DNA延伸产物之间磷酸二酯键的形成引起的溶液氢离子浓度增加而提供至少一个输出信号。
在本文所述的任一发明的另一个实施方案中,反应室是设置在传感器阵列上的多个反应室之一,所述传感器阵列形成于半导体衬底中且包括多个传感器,每个反应室设置在至少一个传感器上,且阵列中的每个传感器包括化学场效应晶体管,所述化学场效应晶体管被配置用于响应由核苷三磷酸或核苷三磷酸类似物与引物或DNA延伸产物之间磷酸二酯键的形成引起的溶液氢离子浓度增加而提供至少一个输出电信号。在另一个实施方案中,所述阵列的每个所述传感器占据100μm或更小的面积并具有10μm或更小的间距,并且其中每个所述反应室具有1μm3至1500μm3范围内的容积。在另一个实施方案中,每个所述反应室容纳溶液中的至少105个单链DNA拷贝。在另一个实施方案中,所述多个反应室和所述多个传感器各自的数目均大于256,000。
在本文所述的任一发明的另一个实施方案中,所述溶液中的单链DNA被连接至固体基质。在本文所述的任一发明的另一个实施方案中,所述溶液中的引物被连接至固体基质。在一个实施方案中,所述单链DNA或引物通过聚乙二醇分子被连接至固体基质。在另一个实施方案中,固体基质是叠氮基官能化(azide-functionalized)的。在一个实施方案中,所述DNA或引物通过叠氮基连接、炔基连接或生物素-链霉亲和素相互作用连接至固体基质。在一个实施方案中,所述DNA或引物是炔标记的。
在本文所述的任一发明的另一个实施方案中,所述DNA或引物被连接至固体基质,所述固体基质为以下形式:芯片、珠、孔(well)、毛细管、载玻片、晶片、过滤器、纤维、多孔介质、基质(matrix)、多孔纳米管或柱。在另一个实施方案中,所述DNA或引物被连接至固体基质,所述固体基质为金属、金、银、石英、二氧化硅、塑料、聚丙烯、玻璃、尼龙或金刚石。在另一个实施方案中,所述DNA或引物被连接至固体基质,所述固体基质是附着有或浸渍有金属或金属组合的多孔非金属物质。在另一个实施方案中,所述DNA或引物被连接至固体基质,所述固体基质又被连接至第二固体基质。在另一个实施方案中,第二固体基质是芯片。
在本文所述的任一发明的另一个实施方案中,1×109个或更少的DNA或引物拷贝被连接至固体基质。在其他实施方案中,1×108个或更少、2×107个或更少、1×107个或更少、1×106个或更少、1×104个或更少或1,000个或更少的DNA或引物拷贝被连接至固体基质。
在本文所述的任一发明的另一个实施方案中,10,000个或更多的DNA或引物拷贝被连接至固体基质。在其他的实施方案中,1×107个或更多、1×108个或更多或1×109个或更多的DNA或引物拷贝被连接至固体基质。
在本文所述的任一发明的另一个实施方案中,所述DNA或引物被隔开在独立的隔室、孔或固体表面上的凹陷中。
在另一个实施方案中,在每个dNTP类似物中,R'具有以下结构:
其中Rx独立地为质量小于300道尔顿的取代或未取代的C1-C5烷基、C2-C5烯基或C2-C5炔基,或为H,其中波浪线表示与3'氧原子的连接点。
在另一个实施方案中,在每个dNTP类似物中,R'具有以下结构:
其中波浪线表示与3'氧原子的连接点。
在一个实施方案中,在多个单链DNA上平行进行所述方法。在另一个实施方案中,所述单链DNA是具有相同序列的模板。在另一个实施方案中,所述方法还包括在步骤(b)或(c)中已确定核苷酸残基的残基后,视情况使多个单链DNA或模板与双脱氧核苷三磷酸接触,从而永久地封闭(cap)任何未延伸的引物或未延伸的DNA延伸产物,所述双脱氧核苷三磷酸与已被鉴定的核苷酸残基互补。
在本文所述的任一方法的实施方案中,在步骤(a)之前从DNA样品扩增单链DNA。在本文所述方法的实施方案中,通过聚合酶链式反应扩增单链DNA。
在本文所述的任一发明的实施方案中,使用UV光处理并入引物或DNA延伸产物的dNTP类似物的R'基团,以便光化学裂解连接到3'-O的部分从而用3'-OH代替3'-O-R'。在另一个实施方案中,所述部分是2-硝基苄基部分。
本发明还涉及在溶液中确定单链RNA的核苷酸残基的身份的方法,其包括:
(a)使具有与其一部分杂交的RNA引物的单链RNA与聚合酶和核糖核苷三磷酸(rNTP)类似物在下述条件下接触:如果所述rNTP类似物与单链RNA的核苷酸残基互补,所述核苷酸残基在5'方向上紧挨着与引物的3'末端核苷酸残基杂交的所述单链RNA的'核苷酸残基,则允许所述聚合酶催化将所述rNTP类似物并入至所述RNA引物中从而形成RNA延伸产物,其中(1)rNTP类似物具有以下结构:
其中B为碱基并且为腺嘌呤、鸟嘌呤、胞嘧啶或尿嘧啶,(2)R'为(i)-CH2N3或2-硝基苄基,或(ii)质量小于300道尔顿的烃基或取代烃基;以及
(b)通过确定溶液的氢离子浓度是否增加来确定在步骤(a)中所述rNTP类似物是否并入了RNA引物以形成RNA延伸产物,其中(i)如果所述rNTP类似物已并入RNA引物,根据并入的rNTP类似物的身份确定单链RNA中与其互补的核苷酸残基的身份,由此确定所述单链RNA中的核苷酸残基的身份,以及
(ii)如果氢离子浓度没有变化,重复进行步骤(a),其中在步骤(a)的每次重复中,rNTP类似物包含的碱基的类型与步骤(a)的每次在前重复中rNTP类似物的碱基的类型不同,直到rNTP类似物并入RNA引物以形成RNA延伸产物,并根据并入的rNTP类似物的身份确定单链RNA中与其互补的核苷酸残基的身份,由此确定所述单链RNA中核苷酸残基的身份。
本发明还涉及在溶液中确定单链RNA的连续核苷酸残基的序列的方法,其包括:
(a)使具有与其一部分杂交的RNA引物的单链RNA与聚合酶和核糖核苷三磷酸(rNTP)类似物在下述条件下接触:如果所述rNTP类似物与单链RNA的核苷酸残基互补,所述核苷酸残基在5'方向上紧挨着与RNA引物的3'末端核苷酸残基杂交的所述单链RNA的核苷酸残基,则允许所述聚合酶催化将所述rNTP类似物并入至所述RNA引物中从而形成RNA延伸产物,其中(1)rNTP类似物具有以下结构:
其中B为碱基并且为腺嘌呤、鸟嘌呤、胞嘧啶或尿嘧啶,(2)R'为(i)-CH2N3或2-硝基苄基,或(ii)质量小于300道尔顿的烃基或取代烃基;以及
(b)通过检测溶液的氢离子浓度的增加来确定在步骤(a)中rNTP类似物是否并入,其中氢离子浓度的增加表明所述rNTP类似物已经并入RNA引物以形成RNA延伸产物,如果溶液的氢离子浓度增加,则根据并入的rNTP类似物的身份确定单链RNA中与其互补的核苷酸残基的身份,由此确定所述单链RNA中的核苷酸残基的身份,并且其中氢离子浓度没有变化表明在步骤(a)中rNTP类似物没有并入RNA引物中;
(c)如果在步骤(b)中未检测到氢离子浓度的变化,重复进行步骤(a)和(b),其中在针对正被测定身份的指定核苷酸残基的步骤(a)的每次重复中,所述rNTP类似物包含的碱基的类型与针对所述核苷酸残基的步骤(a)的每次在前重复中rNTP类似物的碱基的类型不同,直到rNTP类似物并入引物以形成RNA延伸产物,并根据并入的rNTP类似物的身份确定单链RNA中与其互补的核苷酸残基的身份,由此确定所述单链RNA中核苷酸残基的身份;
(d)如果已检测到氢离子浓度的增加并且并入了rNTP类似物,则随后处理并入的rNTP核苷酸类似物以便用H原子代替其R'基团,从而在RNA延伸产物的3'端提供3'OH基团;以及
(e)根据需要,对待测序的单链RNA的连续核苷酸残基的每个核苷酸残基重复进行步骤(a)至(d),除了:在步骤(a)的每次重复中,(i)rNTP类似物并入由步骤(a)或步骤(c)的在前重复产生的RNA延伸产物中,并且(ii)rNTP类似物与单链RNA的核苷酸残基互补,所述核苷酸残基在5'方向上紧挨着与由步骤(a)或步骤(c)的在前重复产生的RNA延伸产物的3'末端核苷酸残基杂交的所述单链RNA的核苷酸残基,从而形成随后的RNA延伸产物;条件为对于待测序的最后一个核苷酸残基,步骤(d)是任选的,
由此确定所述单链RNA的连续核苷酸残基中每个核苷酸残基的身份,从而确定所述RNA的连续核苷酸残基的序列。
在本文所述的任一发明的一个实施方案中,R'为-CH2N3。
在本文所述的任一发明的另一个实施方案中,R'为取代烃基,并且为硝基苄基。在另一个实施方案中,R'为2-硝基苄基。
在本文所述的任一发明的另一个实施方案中,R'为烃基,并且为烯丙基(-CH2-CH=CH2)。
在本文所述的任一发明的一个实施方案中,RNA在设置在传感器上的反应室内的溶液中,所述传感器(i)形成在半导体衬底中,并且(ii)包括场效应晶体管或化学场效应晶体管,所述场效应晶体管或化学场效应晶体管被配置用于响应由核苷三磷酸或核苷三磷酸类似物与引物或RNA延伸产物之间磷酸二酯键的形成引起的溶液氢离子浓度增加而提供至少一个输出信号。
在本文所述的任一发明的另一个实施方案中,反应室是设置在传感器阵列上的多个反应室之一,所述传感器阵列形成于半导体衬底中且包括多个传感器,每个反应室设置在至少一个传感器上,且阵列中的每个传感器包括场效应晶体管,所述场效应晶体管被配置用于响应由核苷三磷酸或核苷三磷酸类似物与引物或RNA延伸产物之间磷酸二酯键的形成引起的溶液氢离子浓度增加而提供至少一个输出信号。
在本文所述的任一发明的另一个实施方案中,反应室是设置在传感器阵列上的多个反应室之一,所述传感器阵列形成于半导体衬底中且包括多个传感器,每个反应室设置在至少一个传感器上,且阵列中的每个传感器包括化学场效应晶体管,所述化学场效应晶体管被配置用于响应由核苷三磷酸或核苷三磷酸类似物与引物或RNA延伸产物之间磷酸二酯键的形成引起的溶液氢离子浓度增加而提供至少一个输出电信号。在另一个实施方案中,所述阵列的每个所述传感器占据100μm或更小的面积并具有10μm或更小的间距,并且其中每个所述反应室具有1μm3至1500μm3范围内的容积。在另一个实施方案中,每个所述反应室容纳溶液中的至少105个单链RNA拷贝。在另一个实施方案中,所述多个反应室和所述多个传感器各自的数目均大于256,000。
在本文所述的任一发明的另一个实施方案中,所述溶液中的单链RNA被连接至固体基质。在本文所述的任一发明的另一个实施方案中,所述溶液中的引物被连接至固体基质。在一个实施方案中,所述单链RNA或引物通过聚乙二醇分子连接至固体基质。在另一个实施方案中,固体基质是叠氮基官能化的。在一个实施方案中,所述RNA或引物通过叠氮基连接、炔基连接或生物素-链霉亲和素相互作用连接至固体基质。在一个实施方案中,所述RNA或引物是炔标记的。
在本文所述的任一发明的另一个实施方案中,所述RNA或引物被连接至固体基质,所述固体基质为以下形式:芯片、珠、孔、毛细管、载玻片、晶片、过滤器、纤维、多孔介质、基质、多孔纳米管或柱。在另一个实施方案中,所述RNA或引物被连接至固体基质,所述固体基质为金属、金、银、石英、二氧化硅、塑料、聚丙烯、玻璃、尼龙或金刚石。在另一个实施方案中,所述RNA或引物被连接至固体基质,所述固体基质是附着有或浸渍有金属或金属组合的多孔非金属物质。在另一个实施方案中,所述RNA或引物被连接至固体基质,所述固体基质又被连接至第二固体基质。在另一个实施方案中,第二固体基质是芯片。
在本文所述的任一发明的另一个实施方案中,1×109个或更少的RNA或引物拷贝被连接至固体基质。在其他实施方案中,1×108个或更少、2×107个或更少、1×107个或更少、1×106个或更少、1×104个或更少或1,000个或更少的RNA或引物拷贝被连接至固体基质。
在本文所述的任一发明的另一个实施方案中,10,000个或更多的RNA或引物拷贝被连接至固体基质。在其他的实施方案中,1×107个或更多、1×108个或更多或1×109个或更多的RNA或引物拷贝被连接至固体基质。
在本文所述的任一发明的另一个实施方案中,所述RNA或引物被分隔在独立的隔室、孔或固体表面上的凹陷中。
在另一个实施方案中,在每个rNTP类似物中,R'具有以下结构:
其中Rx独立地为质量小于300道尔顿的取代或未取代的C1-C5烷基、C2-C5烯基或C2-C5炔基,或为H,其中波浪线表示与3'氧原子的连接点。
在另一个实施方案中,rNTP类似物的R'具有以下结构:
其中波浪线表示与3'氧原子的连接点。
在一个实施方案中,在多个单链RNA上平行进行所述方法。在另一个实施方案中,所述单链RNA是具有相同序列的模板。在另一个实施方案中,所述方法还包括在步骤(b)或(c)中已确定核苷酸残基的残基后,视情况使多个单链RNA或模板与双脱氧核苷三磷酸(dinucleotide triphosphate)接触,从而永久地封闭任何未延伸的引物或未延伸的RNA延伸产物,所述双脱氧核苷三磷酸与已被鉴定的核苷酸残基互补。
在本文所述的任一方法的实施方案中,在步骤(a)之前从RNA样品扩增单链RNA。在另一个实施方案中,通过逆转录酶聚合酶链式反应扩增单链RNA。
在本文所述的任一发明的实施方案中,使用UV光处理并入引物或RNA延伸产物的rNTP类似物的R'基团,以便光化学裂解连接到3'-O的部分从而用3'-OH代替3'-O-R'。在另一个实施方案中,所述部分是2-硝基苄基部分。
本发明还涉及在溶液中确定单链RNA的核苷酸残基的身份的方法,其包括:
(a)使具有与其一部分杂交的DNA引物的单链RNA与逆转录酶和脱氧核糖核苷三磷酸(dNTP)类似物在下述条件下接触:如果所述dNTP类似物与单链RNA的核苷酸残基互补,所述核苷酸残基在5'方向上紧挨着与DNA引物的3'末端核苷酸残基杂交的所述单链RNA的核苷酸残基,则允许所述逆转录酶催化将所述dNTP类似物并入至所述DNA引物中从而形成DNA延伸产物,其中(1)dNTP类似物具有以下结构:
其中B为碱基并且为腺嘌呤、鸟嘌呤、胞嘧啶或胸腺嘧啶,(2)R'为(i)-CH2N3或2-硝基苄基,或(ii)质量小于300道尔顿的烃基或取代烃基;以及
(b)通过确定溶液的氢离子浓度是否增加来确定在步骤(a)中所述dNTP类似物是否并入了DNA引物以形成DNA延伸产物,其中(i)如果所述dNTP类似物已并入DNA引物,根据并入的dNTP类似物的身份确定单链RNA中与其互补的核苷酸残基的身份,由此确定所述单链RNA中的核苷酸残基的身份,以及
(ii)如果氢离子浓度没有变化,重复进行步骤(a),其中在步骤(a)的每次重复中,dNTP类似物包含的碱基的类型与步骤(a)的每次在前重复中dNTP类似物的碱基的类型不同,直到dNTP类似物并入DNA引物以形成DNA延伸产物,并根据并入的dNTP类似物的身份确定单链RNA中与其互补的核苷酸残基的身份,由此确定所述单链RNA中核苷酸残基的身份。
本发明还涉及在溶液中确定单链RNA的连续核苷酸残基的序列的方法,其包括:
(a)使具有与其一部分杂交的DNA引物的单链RNA与逆转录酶和脱氧核糖核苷三磷酸(dNTP)类似物在下述条件下接触:如果所述dNTP类似物与单链RNA的核苷酸残基互补,所述核苷酸残基在5'方向上紧挨着与DNA引物的3'末端核苷酸残基杂交的所述单链RNA的核苷酸残基,则允许所述逆转录酶催化将所述dNTP类似物并入至所述引物中从而形成DNA延伸产物,其中(1)dNTP类似物具有以下结构:
其中B为碱基并且为腺嘌呤、鸟嘌呤、胞嘧啶或胸腺嘧啶,(2)R'为(i)-CH2N3或2-硝基苄基,或(ii)质量小于300道尔顿的烃基或取代烃基;以及
(b)通过检测溶液的氢离子浓度的增加来确定在步骤(a)中dNTP类似物是否并入,其中氢离子浓度的增加表明所述dNTP类似物已经并入DNA引物以形成DNA延伸产物,如果溶液的氢离子浓度增加,则根据并入的dNTP类似物的身份确定单链RNA中与其互补的核苷酸残基的身份,由此确定所述单链RNA中的核苷酸残基的身份,并且其中氢离子浓度没有变化表明在步骤(a)中dNTP类似物没有并入DNA引物中;
(c)如果在步骤(b)中未检测到氢离子浓度的变化,重复进行步骤(a)和(b),其中在针对正被测定身份的指定核苷酸残基的步骤(a)的每次重复中,dNTP类似物包含的碱基的类型与针对所述核苷酸残基的步骤(a)的每次在前重复中dNTP类似物的碱基的类型不同,直到dNTP类似物并入DNA引物以形成DNA延伸产物,并根据并入的dNTP类似物的身份确定单链RNA中与其互补的核苷酸残基的身份,由此确定所述单链RNA中核苷酸残基的身份;
(d)如果已检测到氢离子浓度的增加并且并入了dNTP类似物,则随后处理并入的dNTP类似物以便用H原子代替其R'基团,从而在DNA延伸产物的3'端提供3'OH基团;以及
(e)根据需要,对待测序的单链RNA的连续核苷酸残基的每个核苷酸残基重复进行步骤(a)至(d),除了:在步骤(a)的每次重复中,(i)dNTP类似物并入由步骤(a)或步骤(c)的在前重复产生的DNA延伸产物中,并且(ii)dNTP类似物与单链RNA的核苷酸残基互补,所述核苷酸残基在5'方向上紧挨着与由步骤(a)或步骤(c)的在前重复产生的DNA延伸产物的3'末端核苷酸残基杂交的所述单链RNA的核苷酸残基,从而形成随后的DNA延伸产物;条件为对于待测序的最后一个核苷酸残基,步骤(d)是任选的,
由此确定所述单链RNA的连续核苷酸残基中每个核苷酸残基的身份,从而确定所述RNA的连续核苷酸残基的序列。
在本文所述的任一发明的一个实施方案中,R'为-CH2N3。
在本文所述的任一发明的另一个实施方案中,R'为取代烃基,并且为硝基苄基。在另一个实施方案中,R'为2-硝基苄基。
在本文所述的任一发明的另一个实施方案中,R'为烃基,并且为烯丙基(-CH2-CH=CH2)。
在本文所述的任一发明的一个实施方案中,RNA在设置在传感器上的反应室内的溶液中,所述传感器(i)形成在半导体衬底中,并且(ii)包括场效应晶体管或化学场效应晶体管,所述场效应晶体管或化学场效应晶体管被配置用于响应由核苷三磷酸或核苷三磷酸类似物与引物或DNA延伸产物之间磷酸二酯键的形成引起的溶液氢离子浓度增加而提供至少一个输出信号。
在本文所述的任一发明的另一个实施方案中,反应室是设置在传感器阵列上的多个反应室之一,所述传感器阵列形成于半导体衬底中且包括多个传感器,每个反应室设置在至少一个传感器上,且阵列中的每个传感器包括场效应晶体管,所述场效应晶体管被配置用于响应由核苷三磷酸或核苷三磷酸类似物与引物或DNA延伸产物之间磷酸二酯键的形成引起的溶液氢离子浓度增加而提供至少一个输出信号。
在本文所述的任一发明的另一个实施方案中,反应室是设置在传感器阵列上的多个反应室之一,所述传感器阵列形成于半导体衬底中且包括多个传感器,每个反应室设置在至少一个传感器上,且阵列中的每个传感器包括化学场效应晶体管,所述化学场效应晶体管被配置用于响应由核苷三磷酸或核苷三磷酸类似物与引物或DNA延伸产物之间磷酸二酯键的形成引起的溶液氢离子浓度增加而提供至少一个输出电信号。在另一个实施方案中,所述阵列的每个所述传感器占据100μm或更小的面积并具有10μm或更小的间距,并且其中每个所述反应室具有1μm3至1500μm3范围内的容积。在另一个实施方案中,每个所述反应室容纳溶液中的至少105个单链RNA拷贝。在另一个实施方案中,所述多个反应室和所述多个传感器各自的数目均大于256,000。
在本文所述的任一发明的另一个实施方案中,所述溶液中的单链RNA被连接至固体基质。在一个实施方案中,所述单链RNA或引物通过聚乙二醇分子连接至固体基质。在另一个实施方案中,固体基质是叠氮基官能化的。在一个实施方案中,所述RNA或引物通过叠氮基连接、炔基连接或生物素-链霉亲和素相互作用连接至固体基质。在一个实施方案中,所述RNA或引物是炔标记的。
在本文所述的任一发明的另一个实施方案中,所述RNA或引物被连接至固体基质,所述固体基质为以下形式:芯片、珠、孔、毛细管、载玻片、晶片、过滤器、纤维、多孔介质、基质、多孔纳米管或柱。在另一个实施方案中,所述RNA或引物被连接至固体基质,所述固体基质为金属、金、银、石英、二氧化硅、塑料、聚丙烯、玻璃、尼龙或金刚石。在另一个实施方案中,所述RNA或引物被连接至固体基质,所述固体基质是附着有或浸渍有金属或金属组合的多孔非金属物质。在另一个实施方案中,所述RNA或引物被连接至固体基质,所述固体基质又被连接至第二固体基质。在另一个实施方案中,第二固体基质是芯片。
在本文所述的任一发明的另一个实施方案中,1×109个或更少的RNA或引物拷贝被连接至固体基质。在其他实施方案中,1×108个或更少、2×107个或更少、1×107个或更少、1×106个或更少、1×104个或更少或1,000个或更少的RNA或引物拷贝被连接至固体基质。
在本文所述的任一发明的另一个实施方案中,10,000个或更多的RNA或引物拷贝被连接至固体基质。在其他的实施方案中,1×107个或更多、1×108个或更多或1×109个或更多的RNA或引物拷贝被连接至固体基质。
在本文所述的任一发明的另一个实施方案中,所述RNA或引物被分隔在独立的隔室、孔或固体表面上的凹陷中。
在另一个实施方案中,在每个dNTP类似物中,R'具有以下结构:
其中Rx独立地为质量小于300道尔顿的取代或未取代的C1-C5烷基、C2-C5烯基或C2-C5炔基。
在另一个实施方案中,在每个dNTP类似物中,R'具有以下结构:
其中波浪线表示与3'氧原子的连接点。
在一个实施方案中,在多个单链RNA上平行进行所述方法。在另一个实施方案中,所述单链RNA是具有相同序列的模板。在另一个实施方案中,所述方法还包括在步骤(b)或(c)中已确定核苷酸残基的残基后,视情况使多个单链RNA或模板与双脱氧核苷三磷酸接触,从而永久地封闭任何未延伸的引物或未延伸的DNA延伸产物,所述双脱氧核苷三磷酸与已被鉴定的核苷酸残基互补。
在本文所述的任一方法的实施方案中,在步骤(a)之前从RNA样品扩增单链RNA。在另一个实施方案中,通过逆转录酶聚合酶链式反应扩增单链RNA。
在本文所述的任一发明的实施方案中,使用UV光处理并入引物或DNA延伸产物的dNTP类似物的R'基团,以便光化学裂解连接到3'-O的部分从而用3'-OH代替3'-O-R'。在另一个实施方案中,所述部分是2-硝基苄基部分。
将核酸连接至固体基质或固定核酸的实例描述于以下文献:Immobilization of DNA on Chips II(在芯片II上固定DNA),Christine Wittmann编辑(2005),斯普林格出版社(Springer Verlag),柏林,此文献通过引用并入本文。
离子敏感场效应晶体管(FET)以及使用大规模FET阵列测量由合成反应测序产生的H+的方法和装置是本领域已知的,且记载在以下文献中:美国专利申请公开号US 20100035252、US 20100137143、US20100188073、US 20100197507、US 20090026082、US 20090127589、US 20100282617、US 20100159461、US20080265985、US20100151479、US 20100255595;美国专利:7,686,929和7,649,358;以及PCT国际公开号WO/2009/158006A3、WO/2008/076406A2、WO/2010/008480A2、WO/2010/008480A3、WO/2010/016937A2、WO/2010/047804A1和WO/2010/016937A3。以上文献的全部内容通过引用并入本文。
本文所用的“烃”是指含有氢和碳的化合物。“烃基”是指除去一个氢的烃。烃基可以是未取代的或取代的。例如,烃基可以包括烷基(例如甲基或乙基)、烯基(例如乙烯基和丙烯基)、炔基(例如乙炔基和丙炔基)和苯基(例如苄基)。
本文所用的“烷基”包括具有指定数目碳原子的支链和直链饱和脂族烃基,可以是未取代的或取代的。因此,如在“C1-Cn烷基”中的C1-Cn被定义为包括具有呈直链或支链排列的1、2、……、n-1或n个碳的基团。例如,“C1-C5烷基”被定义为包括具有呈直链或支链排列的1、2、3、4或5个碳的基团,具体包括甲基、乙基、正丙基、异丙基、正丁基、叔丁基和戊基。
本文所用的“烯基”是指含有至少1个碳碳双键的直链或支链非芳族烃基,可存在最大可能数量的非芳族碳-碳双键,并且可以是未取代的或取代的。例如,“C2-C5烯基”是指分别具有2、3、4或5个碳原子和至多1、2、3或4个碳-碳双键的烯基。烯基包括乙烯基、丙烯基和丁烯基。
本文所用的“炔基”是指含有至少1个碳碳三键的直链或支链烃基,可存在最大可能数量的非芳族碳-碳三键,并且可以是未取代的或取代的。因此,“C2-C5炔基”是指具有2或3个碳原子和1个碳-碳三键或具有4或5个碳原子和至多2个碳-碳三键的炔基。炔基包括乙炔基、丙炔基和丁炔基。
本文所用的“取代的”是指在如上所述的官能团例如烷基或烃基中,其内包含的至少一个与氢原子所成的键被与非氢原子或非碳原子所成的键替代,只要保持正常价态并且取代得到的是稳定的化合物。被取代的基团还包括其中一个或多个与碳或氢原子所成的键被一个或多个与杂原子所成的键(包括双键或三键)替代的基团。取代基的非限制性实例包括上述官能团、-NO2,例如包括N,从而形成-CN。
除非另有说明,本文所用的以下术语中的每一个应具有下面给出的定义。
A-腺嘌呤;
C-胞嘧啶;
DNA-脱氧核糖核酸;
G-鸟嘌呤;
RNA-核糖核酸;
T-胸腺嘧啶;
U-尿嘧啶;和
NRT-核苷酸可逆终止子。
除非另有说明,“核酸”应指任何核酸分子,包括但不限于DNA、RNA及其杂合体。在实施方案中,形成核酸分子的核酸碱基可以是碱基A、C、G、T和U,及其衍生物。这些碱基的衍生物是本领域公知的,并且在PCR Systems,Reagents and Consumables(PCR体系、试剂和消耗品;Perkin Elmer Catalogue 1996-1997,Roche Molecular Systems,Inc.,Branchburg,New Jersey,USA)中进行了举例说明。在一个实施方案中,DNA或RNA是未被修饰的。在一个实施方案中,DNA或RNA仅在将其连接到表面(例如固体表面)的范围内进行修饰。
“固体基质”或“固体支持物”是指核酸或试剂可以附于其上的、存在于固相中的任何合适的介质。非限制性实例包括芯片、珠、纳米孔结构和柱。在实施方案中,固体基质或固体支持物可以存在于溶液中,包括水溶液、凝胶或流体。
“杂交”是指基于众所周知的序列互补原则将一个单链核酸退火至另一个核酸。在实施方案中,其他核酸是单链核酸。核酸之间杂交的倾向性取决于其周围环境的温度和离子强度、核酸的长度和互补程度。这些参数对杂交的影响是本领域公知的(参见Sambrook J,Fritsch EF,Maniatis T.1989.Molecular cloning:a laboratory manual.Cold Spring Harbor Laboratory Press,New York.)。如本文所用,引物序列或DNA延伸产物与另一核酸的杂交是指充分退火使得引物或DNA延伸产物各自可通过与能够形成磷酸二酯键的可用核苷酸或核苷酸类似物形成磷酸二酯键而延伸。
如本文所用,除非另有说明,核苷酸或核苷酸类似物的碱基“的类型与(对照的)碱基类型不同”是指碱基具有与一个或多个其它碱基/对照碱基不同的化学结构。例如,“不同于”腺嘌呤的碱基包括鸟嘌呤碱基、尿嘧啶碱基、胞嘧啶碱基和胸腺嘧啶碱基。例如,“不同于”腺嘌呤、胸腺嘧啶和胞嘧啶的碱基包括鸟嘌呤碱基和尿嘧啶碱基。
如本文所用,“引物”(引物序列)是短的、经常为化学合成的、合适长度(例如约18-24个碱基)的寡核苷酸,所述寡核苷酸足以与目标核酸(例如单链核酸)杂交,且允许在本领域公知的合适条件下在其上添加核苷酸残基或由其合成寡核苷酸或多核苷酸。目标核酸可以是自引发的。在实施方案中,引物是DNA引物,即由或主要由脱氧核糖核苷酸残基组成的引物。在另一个实施方案中,引物是RNA引物,即由或主要由核糖核苷酸残基组成的引物。引物被设计为具有与(与引物杂交的)模板/目标DNA或RNA的区域反向互补的序列。通过形成磷酸二酯键将核苷酸残基添加到DNA引物的3'末端,致使引物变成“DNA延伸产物”。通过形成磷酸二酯键将核苷酸残基添加到DNA延伸产物的3'末端得到进一步的DNA延伸产物。通过形成磷酸二酯键将核苷酸残基添加到RNA引物的3'末端致使引物变成“RNA延伸产物”。通过形成磷酸二酯键将核苷酸残基添加到RNA延伸产物的3'末端得到进一步的RNA延伸产物。“探针”是具有可检测标记或连接的引物。
如本文所用,“溶液中”的核酸(例如单链DNA或RNA)是指核酸浸没在适当的溶液中。溶液中的核酸可以被连接到包括固体表面的表面。因此,除非上下文另有说明,本文所用的“在溶液中”涵盖例如溶液中游离的DNA和溶液中被连接到固体表面的DNA。
“核苷酸残基”是在其被并入多核苷酸并因而变成多核苷酸的单体之后存在状态下的单核苷酸。因此,核苷酸残基是多核苷酸(例如DNA)的核苷酸单体,所述核苷酸单体通过其糖的3'位置处的磷酸二酯键与多核苷酸中的相邻核苷酸单体结合,并通过其磷酸基团与第二相邻核苷酸单体结合,以下情况除外:(i)3'末端核苷酸残基仅通过由其磷酸基团形成的磷酸二酯键与多核苷酸的一个相邻核苷酸单体结合,以及(ii)5'末端核苷酸残基仅通过由其糖的3'位置形成的磷酸二酯键与多核苷酸的一个相邻核苷酸单体结合。
由于众所周知的碱基配对规则,确定哪种dNTP或rNTP类似物并入引物或DNA延伸产物或RNA延伸产物揭示了单链多核苷酸中与引物或DNA延伸产物或RNA延伸产物杂交的互补核苷酸残基的身份。因此,如果并入的dNTP类似物包含腺嘌呤、胸腺嘧啶、胞嘧啶或鸟嘌呤,则单链DNA中的互补核苷酸残基分别被鉴定为胸腺嘧啶、腺嘌呤、鸟嘌呤或胞嘧啶。嘌呤中的腺嘌呤(A)与嘧啶中的胸腺嘧啶(T)配对。嘧啶中的胞嘧啶(C)与嘌呤中的鸟嘌呤(G)配对。类似地,对于RNA而言,在RNA与RNA引物杂交的情况下,如果并入的rNTP类似物包含腺嘌呤、尿嘧啶、胞嘧啶或鸟嘌呤,则单链RNA中的互补核苷酸残基分别被鉴定为尿嘧啶、腺嘌呤、鸟嘌呤或胞嘧啶。在RNA与DNA引物杂交的情况下,如果并入的dNTP类似物包含腺嘌呤、胸腺嘧啶、胞嘧啶或鸟嘌呤,则单链RNA中的互补核苷酸残基分别被鉴定为尿嘧啶、腺嘌呤、鸟嘌呤或胞嘧啶。
dNTP或rNTP类似物并入寡核苷酸或多核苷酸(例如引物或DNA延伸链或RNA延伸链)中是指在多核苷酸的3'末端核苷酸残基的3'碳原子和dNTP或rNTP类似物的5'碳原子之间形成磷酸二酯键,这会导致dNTP或rNTP类似物失去焦磷酸。
除非另有说明,否则如本文所用的脱氧核糖核苷三磷酸(dNTP)类似物为在其糖的3'-OH基团中化学基团取代并代替3'-OH基团的H原子的dNTP,或具有通过连接基连接至其碱基的化学基团的dNTP,所述化学基团为-CH2N3或质量小于300道尔顿的烃基或取代烃基,且其不会阻止dNTP类似物通过形成磷酸二酯键并入多核苷酸(例如DNA)。类似地,脱氧核糖核苷酸类似物残基为已并入多核苷酸中的脱氧核糖核苷酸类似物,其仍包含它的化学基团,所述化学基团为-CH2N3,或为质量小于300道尔顿的烃基或取代烃基。在脱氧核糖核苷三磷酸类似物的优选实施方案中,化学基团在其糖的3'-OH基团中取代并代替3'-OH基团的H原子。在脱氧核糖核苷酸类似物残基的优选实施方案中,化学基团在其糖的3'-OH基团中取代并代替3'-OH基团的H原子。在一个实施方案中,所述化学基团为-CH2N3。
除非另有说明,否则如本文所用的核糖核苷三磷酸(rNTP)类似物为在其糖的3'-OH基团中化学基团取代并代替3'-OH基团的H原子的rNTP,或具有通过连接基连接至其碱基的化学基团的rNTP,所述化学基团为-CH2N3或质量小于300道尔顿的烃基或取代烃基,且其不会阻止rNTP类似物通过形成磷酸二酯键并入多核苷酸(例如RNA)。类似地,核糖核苷酸类似物残基为已并入多核苷酸中的核糖核苷酸类似物,其仍包含它的化学基团,所述化学基团为-CH2N3,或为质量小于300道尔顿的烃基或取代烃基。在核糖核苷酸三磷酸类似物的优选实施方案中,化学基团在其糖的3'-OH基团中取代并代替3'-OH基团的H原子。在核糖核苷酸类似物残基的优选实施方案中,化学基团在其糖的3'-OH基团中取代并代替3'-OH基团的H原子。在一个实施方案中,所述化学基团为-CH2N3。
应当理解,本领域普通技术人员可以选择本发明化合物上的取代基和取代模式,以提供化学稳定的且可以由容易获得的起始原料通过本领域已知的技术及下面所述的那些方法容易地合成的化合物。如果取代基本身被多于一个基团取代,应理解只要能得到稳定的结构,这些多个基团可以在相同的碳上或不同的碳上。
在选择本发明的化合物时,本领域普通技术人员将认识到要根据公知的化学结构连接原则来选择各取代基,即R1、Rx等。
应当理解,当基团在本文中通过结构表示时,与主结构的连接点由波浪线表示。
在本文所述的化合物结构中,除核糖和脱氧核糖上的氢原子之外,通常未显示其他氢原子。然而,应当理解,在所示的碳原子上存在足够的氢原子以满足八隅体规则。
除非上下文另有明确指示,否则在提供了值的范围的情况下,应理解为本发明包括在该范围的上限和下限之间,该值的每个介于中间的整数及该值的每个介于中间的整数的每个十分位小数(each tenth),以及在所示出的范围内的任何其他所示出的值或介于中间的值。这些较小范围的上限和下限可以独立地包括在该较小范围内,并且也包括在本发明内,服从于所示出的范围中任何特别排除的限制值(limit)。当所示出的范围包括一个或两个限制值时,排除所包括的两个限制值中(i)任何一个或(ii)两者的范围也包括在本发明中。
本文所述的各种要素的所有组合在本发明范围内。本文所述的各种要素的所有子组合也在本发明范围内。
通过参考下面的实验细节将更好地理解本发明,但是本领域技术人员容易理解,详细的具体实验仅是对本发明的说明,在其后的权利要求书中更充分地描述本发明。
实验细节
本发明有许多创新方面。例如,离子传感策略和使用NRT的合成测序方法的结合(Ju et al.2003;Li et al.2003;Ruparel et al.2005;Seo et al.2005;Ju et al.2006)是不同的测序范例的新用途,从而得到混合方法,所述混合方法成本非常低,具有良好的灵敏度,避免由自发NTP去焦磷酸化引起的假阳性信号,且同时与任何可用的测序策略一样精确。
这里公开了NRT可被开发用于离子传感SBS,因为:(1)NRT在聚合酶延伸中显示特异性和良好的持续合成能力;(2)NRT允许离子传感步骤处理单碱基并入,克服了不同长度的同聚物运行中多个碱基并入的并发问题(complications);(3)若干选择组的在脱氧核糖的3'-OH和其它位置上具有的各种保护基团的NRT的合成允许选择在并入的速度和特异性以及去除保护基团的容易性并同时保持与DNA稳定性和离子传感要求的兼容性方面最佳的NRT(Li et al.2003;Ruparel et al.2005;Seo et al.2005;Ju et al.2006);(4)NRT在裂解保护基团后提供与正常核苷酸相同的修饰的核苷酸,因此允许实现更长的读段(read);和(5)在修饰的核苷酸上不存在荧光标签可增加聚合酶并入效率,大大降低了其合成成本,且不需要对背景荧光做出解释。
在过去,相对于竞争化学测序策略,利用Sanger测序方法提供的自动化可能性完成了高通量DNA测序(Sanger et al.1977)。虽然使用4色荧光标签和毛细管仪器能够实现相当高的通量(Ju et al.1995;Smith et al.1986),高达每几个小时每个仪器>600个碱基的读段(reads),但是全基因组测序需要的DNA制备步骤费用过高,通常必须进行DNA克隆和克隆储存。最近使用合成测序(罗氏焦磷酸测序和Illumina仪器)或杂交和连接测序(ABI's SOLIDTM平台)的策略已利用polony PCR(在珠上或直接在测序芯片上)的变型克服了这个障碍(Wheeler et al.2008;Bentley et al.2008;McKernan et al.2009),并同时利用小型化策略从而允许同时有数百万个读段,基本上使得Sanger方法除产生相当长的读段的能力以外的所有优点都相形见绌。Helicos和Pacific Sciences所支持的更新的策略已接近单分子测序,尽管在准确性方面付出一些代价(Harris et al.2008;Eid et al.2008)。其他选择(例如使用纳米孔辨别释放的核苷酸或完整的DNA链序列)仍在评估中(Branton et al.2008)。
对于合成测序策略,存在取决于检测策略类型的两种总体方案。在并入每个核苷酸时检测单个信号(在Roche 454、Helicos和Ion Torrent的情况下,分别为光、荧光染料和pH变化),必须逐个添加每个碱基,并且根据是否产生输出信号对并入进行评分。这种方法可以降低试剂成本并简化仪器设计,但是具有较低的总体准确性。相比之下,使用多个输出信号的方法(例如4种荧光染料,每种针对DNA的一种碱基),尽管涉及更昂贵的试剂,但可以提高准确性,特别是如果背景信号减少或被计算扣除的话。这些方法中的几种,特别是第一设计的那些,将标准dNTP用于并入,并测量磷酸二酯键形成的副产物。这种方法的缺点是难以解释同聚物片段中的信号。即使一次仅加入一种dNTP,也必须考虑以下事实:如果在后面几个位置存在其互补碱基,则准确确定连续添加了多少核苷酸是重要的但却难以实现的。目前的方案通常采用信号的可加测量,但超过约3或4个碱基时,碱基计数变得难以分辨。
这里,公开了使用3'-O-修饰的核苷酸可逆终止子(NRT)克服了这些问题。
合成测序期间的离子传感:最近,Ion Torrent有限公司介绍了一种测序方法,其利用了在过去几十年中半导体领域的巨大进步。该方法基于聚合酶反应中磷酸二酯键产生时H+离子的释放。反应在内置于芯片中的一系列孔中发生,检测层附接至半导体芯片以将所得的pH变化(化学信号)直接转化为数字数据。该技术快速、便宜、高度可规模化,并使用天然核苷酸。因为不管并入的核苷酸如何,总是存在单个信号,所以必须一次加入四种核苷酸中的一种。这可能导致难以解释同聚物片段中的信号,在同一轮反应中核苷酸将被多次并入在该同聚物片段中。本文通过使用特定的NRT解决了这个问题,如下面概述的,已成功使用所述NRT。
使用可逆终止子的合成测序:在许多出版物中描述了一系列实现合成测序的核苷酸可逆终止子(NRT)(Ju et al.2006;Wu et al.2007;Guo et al.2008)。本质上,此方法涉及使用在3'-OH位置具有保护基团的核苷酸类似物,其一旦并入DNA就会阻止后续核苷酸的添加。DNA模板结合到表面,引物与这些模板杂交。然后可以借助每个碱基连接的特定荧光团测量特定NRT在引发链(priming chain)上的并入,因为并入的NRT与模板链上的核苷酸互补。这些保护基团和荧光团可以使用不损害DNA模板或引物的化学裂解反应或光裂解反应容易地去除。以这种方式,可以进行其他轮次的并入、检测和裂解。这些SBS反应是准确的,未显示相移(dephasing)(提前读码或滞后),并且由错误并入的核苷酸或染料的不完全去除产生的背景相对较低。
合成在3'-OH位置带有烯丙基、叠氮甲基或2-硝基苄基的三个不同的由4种NRT构成的组(图1),并用于进行焦磷酸测序。2-硝基苄基基团可以通过光(~355nm照射)裂解,但需要简单的化学品来除去烯丙基(Na2PdCl4加上三苯基膦三磺酸三钠)或叠氮甲基(三(2-羧乙基)膦)(Ju et al.2006;Wu et al.2007;Guo et al.2008)。使用这些NRT中的每一种完成焦磷酸测序。将含有同聚区的模板固定在Sepharose珠上,使用NRT进行延伸-信号检测-脱保护循环。作为实例,使用用可光裂解的2-硝基苄基修饰的NRT的焦磷酸测序数据显示在图2中,并与使用天然核苷酸的常规焦磷酸测序进行了比较。可以看出,利用NRT使常规焦磷酸测序难以区分的多碱基信号变得容易分辨。
本文公开了3'-O-(2-硝基苄基)核苷酸对于离子传感器测量特别有用。它们被快速有效地并入,并且在不需要盐存在的条件下被光裂解,而盐会干扰随后轮次的离子感测。然而,其它修饰的碱基也是有用的。3'-O-叠氮甲基是特别有吸引力的。其不仅有效地并入,而且一旦裂解就再次生成天然碱基,因此不阻碍随后的核苷酸并入,产生长的序列读段(Guo et al.2008)。
制备NRT库并在与离子传感相容的SBS聚合酶和NRT条件下对其进行评价。
制备足够用于本申请的所有研究的全套NRT:使用已确立的方法合成用于离子传感SBS评价的NRT(Ju et al.2003;Ju et al.2006;Wu et al.2007;Guo et al.2008)。
用于离子传感的NRT的效用(utility)表征:确定支持NRT并入的9oN、Therminator II和Therminator III聚合酶(全部可获自New England Biolabs,伊普斯威奇,MA)的离子依赖性,最初使用双脱氧核苷三磷酸(ddNTP)进行单碱基延伸反应。使用合成模板/引物体系在溶液中进行测试,对净化后的延伸产物进行MALDI-TOF质谱(MS)以定量产物产量(yield)。测试一系列一价和二价阳离子以及一价阴离子的浓度。一旦利用dNTP和ddNTP建立了基本参数,就使用3'-O-(2-硝基苄基)核苷酸、3'-O-叠氮甲基核苷酸和3'-O-烯丙基核苷酸进行类似的测定,其中使用最能将这些修饰的核苷酸中的每一种并入的酶。利用相关时间点评估盐依赖性。尽管对Ion Torrent型系统来说不依赖于盐的2-硝基苄基基团的光裂解是有利的,但也可以进行叠氮甲基衍生物或烯丙基衍生物的自动化学裂解。
为了测试低盐缓冲液体系中的聚合酶特异性,所有四种ddNTP类似物或ddNTP类似物在反应中组合(combined)。在合成模板-引物体系中,已知接下来应当添加4种碱基中的哪一种,并且这些中每一种可以在质谱中作为良好分离的峰区分开。通过连续包含两个或更多个相同的碱基,检查这些光谱以确认反应在第一碱基之后完全终止。接下来,使用每种优选的聚合酶/核苷酸可逆终止子组合测试所用的缓冲体系。还测试了将盐浓度降低到足够低的量以允许随后的离子传感。
在离子传感平台中试验的NRT。当建立了酶/NRT/低离子缓冲体系时,在H+敏感离子传感系统(例如Ion Torrent有限公司平台)上进行2或3个碱基延伸的短运行,如图3所示。可处理的样品数量有很大的灵活性。最初,仅使用几种不同的合成模板。使用一系列最佳缓冲液/盐条件来最大化离子传感器充分检测的产率。在使短运行给出最佳结果的条件下进行需要较大量NRT的更长一些的运行。模板可以连接到珠或直接连接到孔,如果需要,连接适当的衔接子(adapters)以允许这样的操作。可以设计人工模板以测试特异性、相移(不完全反应或预读)和处理长同聚物序列的能力。
具有NRT的离子传感器SBS。在确认离子传感系统以良好的效率处理一组NRT之后,使用组合的SBS-离子传感方法对生物样品(已知的病毒基因组或细菌基因组)进行测序。组装序列并搜索多态性或序列错误的存在。例如,可以使用致病性和非致病性军团菌属(Legionella)菌种,并且进行比较分析,必要时进行基因注释。
使用NRT时多于几个碱基的同聚物运行的准确度接近完美,而使用标准核苷酸时准确度低得多。对并入、检测和裂解的循环的需要增加了额外的时间,但在并入和去保护的自动化和效率最大化的情况下,这没有超过准确度方面获得的益处。可以任选地在各个循环或每隔一个循环中包括ddNTP同步化步骤。对于低重复细菌序列从头组装序列。使用适当的长程配对文库(long-range mate-pair library)制备方法,也可以进行真核基因组的从头测序和重测序。长序列读段和短序列读段均可用,并且该方法可用于对原核和真核物种进行比较序列分析、基因组装配、注释和路径分析。
参考文献
Anderson,E.P.et al.(2008)A system for multiplexed direct electrical detection of DNA synthesis(用于DNA合成的多重直接电检测系统).Sens Actuators B Chem 129:78-86.
Bentley,D.R.et al.(2008)Accurate whole human genome sequencing using reversible terminator chemistry(使用可逆终止子化学的精确全人类基因组测序).Nature 456:53-59.
Bowers,J.et al.(2009)Virtual terminator nucleotides for next-generation DNA sequencing(用于下一代DNA测序的虚拟终止子核苷酸).Nature Methods,6:593-595.
Branton,D.et al.(2008)The potential and challenges of nanopore sequencing(纳米孔测序的潜力和挑战).Nat Biotechnol 26:1146-1153.
Edwards,J.R.et al.(2001)DNA sequencing using biotinylated dideoxynucleotides and mass spectrometry(使用生物素化的双脱氧核苷酸和质谱的DNA测序).Nucleic Acids Res,29:E104.
Eid,J.et al.(2008)Real-time DNA sequencing from single polymerase molecule(从单个聚合酶分子进行的实时DNA测序).Science 323:133-138.
Fuller,C.W.et al.(2009)The challenges of sequencing by synthesis(合成测序的挑战).Nat Biotechnol 27:1013-1023.
Gerstein,A.S.,ed.Molecular Biology Problem Solver:A Laboratory Guide,Ch.10,“Nucleotides,Oligonucleotides,and Polynucleotides”(分子生物学问题解决者:实验室指南,第10章,“核苷酸、寡核苷酸和多核苷酸”)(2001).
Guo,J.et al.(2008)Four-color DNA sequencing with 3'-O-modified nucleotide reversible terminators and chemically cleavable fluorescent dideoxynucleotides(使用3'-O-修饰的核苷酸可逆终止子和化学可裂解的荧光双脱氧核苷酸的四色DNA测序).Proc Natl Acad Sci USA105:9145-9150.
Haghighi,F.et al.(2008)Genetic architecture of the human tryptophan hydroxylase 2gene:existence of neural isoforms and relevance for major depression(人色氨酸羟化酶2基因的遗传结构:神经异构体的存在和重大抑郁症的相关性).Mol Psychiatry.13:813-820.
Harris,T.D.et al.(2008)Single-molecule DNA sequencing of a viral genome(病毒基因组的单分子DNA测序).Science,320:106-109.
Hawkins,R.D.et al.(2010)Next-generation genomics:an integrative approach(下一代基因组学:一种综合方法).Nat.Rev.Genet.11:476-486.
Ju,J.et al.(1995)Energy transfer fluorescent dye-labeled primers for DNA sequencing and analysis(用于DNA测序和分析的能量转移荧光染料标记的引物).Proc Natl Acad Sci USA 92:4347-4351.
Ju,J.et al.(2003)Massive parallel method for decoding DNA and RNA(解码DNA和RNA的大规模平行方法).U.S.Patent 6,664,079.
Ju,J.et al.(2006)Four-color DNA sequencing by synthesis using cleavable fluorescent nucleotide reversible terminators(使用可裂解的荧光核苷酸可逆终止子的四色DNA合成测序.Proc Natl Acad Sci USA103:19635-19640.
Landgraf,P.et al.(2007)A mammalian microRNA expression atlas based on small library RNA sequencing(基于小文库RNA测序的哺乳动物微RNA表达图谱).Cell 129:1401-1414.
Li,Z.et al.(2003)A Photocleavable Fluorescent Nucleotide for DNA Sequencing and Analysis(用于DNA测序和分析的可光裂解荧光核苷酸).Proc Natl Acad Sci USA 100:414-419.
Martí,A.A.et al.(2007)Design and characterization of two-dye and three-dye binary fluorescent probes for mRNA detection(用于mRNA检测的双染料和三染料二元荧光探针的设计和表征).Tetrahedron 63:3591-3600.
McKernan,K.J.et al.(2009)Sequence and structural variation in a human genome uncovered by short-read,massively parallel ligation sequencing using two base encoding(通过使用两个碱基编码的短读、大规模平行连接测序揭示的人类基因组中的序列和结构变化).Genome Research 19:1527-1541.
Morozova,O.et al.(2009)Applications of new sequencing technologies for transcriptome analysis(新测序技术在转录组分析中的应用).Annu Rev Genomics Hum Genet 10:135-51.
Ng,S.B.et al.(2010)Massively parallel sequencing and rare disease(大规模并行测序和罕见疾病).Hum Mol Genet 19:R19-R24.
Park,P.J.(2009)ChIP-seq:advantages and challenges of a maturing technology(ChIP-seq:成熟技术的优点和挑战).Nat Rev Genet 10:669-680.
Ronaghi,M et al.(1998)A sequencing method based on real-time pyrophosphate(基于实时焦磷酸的测序方法).Science,281:364-365.
Ronaghi,M.(2001)Pyrosequencing sheds light on DNA sequencing(焦磷酸测序揭示了DNA测序).Genome Res.,11:3-11.
Rothberg,J.M.et al.(2011)An integrated semiconductor device enabling non-optical genome sequencing(能够进行非光学基因组测序的集成半导体器件).Nature 475:348-352.
Ruparel,H.et al.(2004)Digital detection of genetic mutations using SPC-sequencing(使用SPC测序的遗传突变的数字检测).Genome Res.14:296-300.
Ruparel,H.et al.(2005)Design and Synthesis of a 3'-O-allyl Photocleavable Fluorescent Nucleotide as a Reversible Terminator for DNA Sequencing By Synthesis(作为用于DNA合成测序的可逆终止子的3'-O-烯丙基可光裂解荧光核苷酸的设计与合成).Proc Natl Acad Sci USA102:5932-5937.
Sanger,F.et al.(1977)DNA sequencing with chain-terminating inhibitors(使用链终止抑制剂的DNA测序).Proc Natl Acad Sci USA74:5463-5467.
Seo,T.S et al.(2005)Four-Color DNA Sequencing by Synthesis on Chip Using Photocleavable Fluorescent Nucleotide Analogues(使用可光裂解荧光核苷酸类似物通过芯片上合成进行的四色DNA测序).Proc Natl Acad Sci USA 102:5926-5931.
Shen,Y.et al.(2010)A SNP discovery method to assess variant allele probability from next-generation resequencing data(评估下一代重测序数据的变异等位基因概率的SNP发现方法).Genome Res 20:273-280.
Smith,L.M.et al.(1986)Fluorescence detection in automated DNA sequencing analysis(自动化DNA测序分析中的荧光检测).Nature321:674-679.
Strug,L.J.et al.(2009)Centrotemporal sharp wave EEG trait in rolandic epilepsy maps to Elongator Protein Complex 4(ELP4)(在对延伸体蛋白复合物4(ELP4)的中央沟区癫痫图中的中央颞区尖波EEG特征).Eur J Human Genet 17:1171-1181.
Wheeler,D.A.et al.(2008)The complete genome of an individual by massively parallel DNA sequencing(通过大规模平行DNA测序的个体的完整基因组).Nature 452:872-877.
Wu,J.et al.(2007)3'-O-modified Nucleotides as Reversible Terminators for Pyrosequencing(作为焦磷酸测序的可逆终止子的3'-O-修饰的核苷酸).Proc Natl Acad Sci USA 104:16462-16467.
序列表
<110> The Trustees of Columbia University in the City of New York
Ju, Jingyue
Russo, James J.
Yu, Lin
<120> 使用核苷酸可逆终止子的离子传感器DNA和RNA合成测序
<130> 0575/82337-PCT/JPW/GJG/JAK
<150> US 62/000,306
<151> 2014-05-19
<160> 1
<170> PatentIn version 3.5
<210> 1
<211> 69
<212> DNA
<213> 人工序列
<220>
<223> 合成寡核苷酸
<400> 1
tttttttttt aggaaccctt ggccaaattt ttcccccgga aacagctatg accggtcata 60
gctgtttcc 69
- 还没有人留言评论。精彩留言会获得点赞!