改进的缀合方法和由其获得的新的合成的寡糖‑蛋白质缀合物与流程
本发明涉及获得新的合成的寡糖-蛋白质(oligosaccharide-protein,OS-PR)缀合物的改进的缀合方法。本发明还涉及用于制备新的缀合物疫苗的新的合成OS-PR缀合物,其中所述寡糖为合成寡糖。
背景技术:
针对高分子量天然多糖抗原而产生的抗体识别对应于天然细菌荚膜多糖中一小部分的寡糖。所述寡糖有希望可能成为先导疫苗候选物,因为其不仅具有免疫原性而且还可作为半抗原在其蛋白质缀合物中发挥功能,所述蛋白质缀合物可在动物模型和人中引发特异性抗体。在生物研究和新一代有机合成疫苗技术领域中的进展已经提供了在有机合成实验室中进行复杂寡糖片段的更有效化学组装,这一般可在病原菌的表面上获得并从其纯化。
由天然多糖获得的缀合物已经被成功地开发为人疫苗。然而,其使用与例如以下问题相关:例如细菌多糖的大小和特性的显著变化、在与载体蛋白化学缀合期间重要的免疫显性特征受到破坏、缀合物中展现出显著的异质性以及存在高度毒性组分及其他可难以除去的宿主细胞杂质。有机合成可以以高纯度且相对大的量提供碳水化合物表位用于与载体蛋白的受控缀合。在这样的方法中,合成的糖类装备有人工间隔区以有利于与载体蛋白的选择性缀合。
针对b型流感嗜血杆菌(Haemophilus influenza type b)相关疾病的缀合物疫苗的出现打开了疫苗学的新时代。开发新一代疫苗的主要里程碑之一是在预防儿童期脑膜炎及其他疾病中开发了b型流感嗜血杆菌的荚膜寡糖的合成片段的有效蛋白质缀合物。关于开发合成寡糖及其缀合物的关键问题是多方面的,例如表位的大小、缀合物中每个蛋白质的寡糖拷贝数、间隔区对免疫应答的可能影响以及与动物模型的选择相组合的载体蛋白的适当选择。
鉴于合成寡糖为生物研究(特别是在疫苗技术领域中)提供了有效的先导化合物的事实,关于合成寡糖及其蛋白质缀合物的制备正进行大量的研究。然而,不存在用于制备具有生物重要性的寡糖的通用方案。每种先导缀合物分子的化学合成均是需要进行长时间且系统性的实验的研究工程。现有技术中报道的从原材料到产品的总过程时间需要20至24小时。常规寡糖及其蛋白质缀合物的低产率、低稳定性和低纯度是主要考虑的问题。因此,迫切需要获得具有更高稳定性且偶联有同质性的合成的寡糖-蛋白质缀合物以及以更佳的产率、稳定性和纯度获得这样的合成的缀合物疫苗的高效的合成OS-PR缀合方法。合成的缀合物疫苗的可负担性和可用性是一个显著问题,其需要以时间有效且有成本效益的方式来实现合成的缀合物疫苗的可用性的方法。
发明目的
为了消除现有技术的缺点,本发明的主要目的是提供获得新的合成的寡糖-蛋白质(OS-PR)缀合物的改进的缀合方法。
本发明的另一个目的提供改进的合成OS-PR缀合方法,其中所述方法能够实现寡糖-蛋白质缀合物的更高产率、更高纯度和更高稳定性。
本发明的另一个目的是提供改进的合成OS-PR缀合方法,其中所述方法快速且方便地用于所述寡糖与载体蛋白的缀合。
本发明的另一个目的是提供有成本效益的改进的合成OS-PR缀合方法以获得可负担的寡糖-蛋白质缀合物。
本发明的另一个目的是提供用于制备新缀合物疫苗的新的合成OS-PR缀合物。
本发明的另一个目的是提供新的合成OS-PR缀合物,其中所述寡糖为合成寡糖。
本发明的另一个目的是提供合成OS-PR缀合物,其中所述寡糖-蛋白质缀合物引发特异性且均质性的免疫应答。
本发明的另一个目的是提供新的合成OS-PR缀合物,其用于制备用作单价疫苗或用作组合疫苗并且还用作诊断工具的新的基于合成寡糖的缀合物。
发明概述
因此,本发明提供了获得新的合成OS-PR缀合物的改进的缀合方法。本发明的合成OS-PR缀合方法是提供引发高、单特异性且均质性免疫应答的OS-PR缀合物的快速方法。由此产生的缀合物提供可重现的结果,这增强基于这些缀合物的疫苗和诊断剂的可靠性。
由本发明方法获得的新的合成OS-PR缀合物产生新的基于合成寡糖的缀合物疫苗。
所述合成的缀合物是合成的在于合成OS-PR缀合物中的寡糖部分为合成寡糖,而载体蛋白是从革兰氏阳性菌获得的。
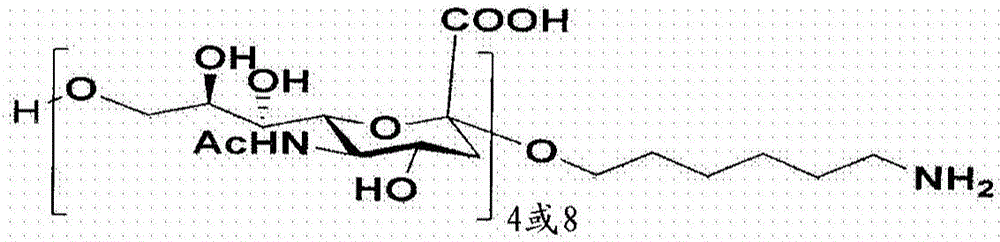
本发明涉及选择被修饰用于与蛋白质缀合的合适长度的合成寡糖,优选寡糖四聚体和八聚体(在下文中为寡聚体)。所述修饰包括以下步骤:向所述寡聚体添加接头,使用硫醇化剂来活化所述寡聚体,然后纯化所述活化的寡聚体(即硫醇化寡聚体)。在另一方面,通过活化来修饰合适的细菌蛋白,优选但不限于破伤风类毒素。使所述硫醇化寡聚体与所述活化的细菌蛋白缀合。
内置入所述寡聚体中的接头在所述寡聚体的末端提供氨基(-NH2)。所述末端氨基(-NH2)容易地可用于被硫醇化剂活化。所述硫醇化剂选自例如但不限于以下试剂的组:硫代乙酸和N-琥珀酰亚胺基S-乙酰基硫代乙酸酯(N-Succinimidyl S-Acetylthioacetate,SATA),优选SATA。然后,用选自还原剂组的亲核体处理所得的巯基化化合物以获得活化的寡聚体,然后将其纯化。进行测定以确定每寡糖单位的硫醇单元。
使用例如N-(β-马来酰亚胺基丙基氧基)琥珀酰亚胺酯(BMPS)的交联剂来活化所述蛋白质。将所述活化的寡糖和所述活化的蛋白质保持在一定实验条件下例如在特定温度下持续特定时间以进行缀合。本发明的所述寡糖-蛋白质缀合物的缀合化学是硫醚键(thio-ether linkage)。
本发明提供了其中全过程时间为14至22小时的合成缀合。本发明不需要氮吹扫(nitrogen purging)并且使用无需特殊操作技能的试剂,从而使所述方法方便且有成本效益。
本发明提供了亲本寡聚体骨架的不经任何修饰的缀合物,从而使全部表位保持完整以产生天然免疫应答。
寡糖与蛋白质比值在产生免疫应答方面具有关键作用。本发明提供在蛋白质上得到较高的寡糖负载以得到对于b型流感嗜血杆菌(Hib)和脑膜炎奈瑟菌(Neisseria meningitidis)血清组A、C、Y、W135或X(分别为MenA、MenC、MenY、MenW或MenX)而言期望的0.2至0.5的OS∶PR比值。对于Hib,寡糖蛋白质缀合物的总体缀合产率为约45%至65%,对于MenA/C/Y/W/X血清组,为约21%至48%。本发明还使用N-琥珀酰亚胺基S-乙酰基硫代乙酸酯(SATA)来活化寡聚体。SATA可溶解于二甲基亚砜(dimethyl sulphoxide,DMSO),并且能够使得寡糖与硫醇化剂在缓冲液中快速混合,从而使方法变得容易。本发明还提供了其中进行单步骤纯化的合成缀合方法,从而减少方法中的步骤,使得产率更佳且过程时间更短。
本发明的改进方法可用于制备大量可用于制备疫苗的缀合物。这样的OS-TT缀合物的一些非限制性实例为Hib-TT缀合物、MenX-TT缀合物、MenC-TT缀合物、MenA-TT缀合物、MenW-TT缀合物、MenY-TT缀合物、Hib-CRM197缀合物、MenX-CRM197缀合物、MenC-CRM197缀合物、MenA-CRM197缀合物、MenW-CRM197缀合物、MenY-CRM197缀合物。所述疫苗可作为单一疫苗或作为组合疫苗制备。
在其中可使用合成OS-PR缀合方法的众多实例中,在一个非限制性实例中,使所述合成制备的寡聚体与己胺(hexaylamine)接头连接,并使用N-琥珀酰亚胺基S-乙酰基硫代乙酸酯(SATA)来活化,其中所述SATA溶解于二甲基亚砜(DMSO)中。使由此获得的巯基化寡糖以非常低的流量经受预定条件持续固定的时间并随后纯化。然后,将所述经纯化的寡聚体浓缩,并与至少一种亲核体(例如盐酸羟胺)反应以获得硫醇化寡糖。
将N-(β-马来酰亚胺基丙基氧基)琥珀酰亚胺酯在N-甲基-2-吡咯烷酮(NMP)中的溶液与载体蛋白(例如,破伤风类毒素(tetanus toxoid,TT)(从破伤风梭菌(Clostridium tetani)获得)或CRM197(白喉毒素的交叉反应性突变体或非毒性突变体并且在本说明书中也称为CRM))混合,并且在预定条件下保持固定的时间。然后,纯化所述活化的载体蛋白的反应混合物并收集。
将酯化或活化的载体蛋白与所述硫醇化寡聚体混合,并在预定条件下孵育过夜。使用超速离心过滤器或其他尺寸排阻装置(例如,凝胶过滤色谱)来纯化寡聚体-蛋白质缀合物原料。
本发明的改进方法的最显著成果是由合成OS-PR缀合提供了结果可重现的寡糖-蛋白质缀合物,其例如但不限于:MenA-TT、MenC-TT、MenX-TT、MenY-TT、MenW-TT、Hib-TT缀合物。所述寡糖-蛋白质缀合物引发特异性且均质性的免疫应答,并且可用于产生单价疫苗或多价组合疫苗且可用作诊断工具。
附图简述
图1集合地示出了不同脑膜炎球菌血清组的合成的寡聚体的结构示意图。图1a:MenA,图1b:MenC,图1c:MenY,图1d:MenW135和图1e:MenX,其具有末端含胺接头。
图2a示出了产生反应性末端硫醇基的寡聚体活化过程的示意图。
图2b示出了显示产生对硫醇具有反应性的马来酰亚胺基团的载体蛋白活化的示意图。
图2c示出了显示通过硫醚键使硫醇化的合成的寡聚体与经马来酰亚胺标记的载体蛋白缀合的示意图。
图3a和3b示出了如在Waters UV/PDA检测仪上观察到的与活化蛋白质(TT和CRM)相比的缀合的寡聚体(MenC)4或(MenC)8的HP-SEC峰谱。
图3c示出了如在Waters UV/PDA检测仪上观察到的与活化蛋白质相比的缀合的四聚体Hib的HP-SEC峰谱。
图3d示出了如在Waters UV/PDA检测仪上观察到的与活化蛋白质相比的缀合的MenX四聚体的HP-SEC峰谱。
图4示出了(MenX)4和(MenX)4-TT缀合物的体外抗原特性,如根据针对细菌MenX多糖产生的抗体的百分比抑制所示。
图5a示出了如通过ELISA评估的在1、2和3次剂量的合成的MenC缀合物之后瑞士白化病小鼠(Swiss albino mice)中相对于抗MenC血清IgG浓度的免疫应答。
图5b示出了在3次剂量之后(MenC)4-TT缀合物相对于抗MenC血清杀菌测定效价的免疫应答。
图5c描述了在3次剂量之后(MenC)8-TT缀合物相对于抗MenC血清杀菌测定效价的免疫应答。
图5d示出了瑞士白化病小鼠中在3次剂量的合成的(MenX)4-TT缀合物之后相对于如通过ELISA评估的抗MenX IgG应答和血清杀菌效价的免疫应答。
带有举例说明和实施例的发明详述
因此,本发明提供了用于制备可用于制备疫苗的合成的寡糖-蛋白质缀合物的改进的缀合方法。
这样的缀合物的一些非限制性实例为Hib-TT缀合物、MenX-TT缀合物、MenC-TT缀合物、MenA-TT缀合物、MenW-TT缀合物、MenY-TT缀合物、Hib-CRM197缀合物、MenX-CRM197缀合物、MenC-CRM197缀合物、MenA-CRM197缀合物、MenW-CRM197缀合物、MenY-CRM197缀合物。所述疫苗可作为单价疫苗或作为组合疫苗制备。
本发明涉及选择合适的合成寡糖,优选寡糖四聚体和八聚体,所述合成寡糖包含至少一个内置的末端氨基接头,所述合成寡糖模拟从例如脑膜炎奈瑟菌血清组A、C、Y、W135、X(图1a、1b、1c、1d、1e)和流感嗜血杆菌的革兰氏阴性菌获得的具有末端氨基接头(-NH2)的天然多糖。所述末端氨基(-NH2)容易地可用于被巯基化剂活化。促进末端氨基接头转化成巯基的巯基化剂选自例如但不限于以下试剂的组:乙酸酐、乙酰氯、N-乙酰基高半胱氨酸硫代内酯、高半胱氨酸硫代内酯、硫代乙酸和N-琥珀酰亚胺基S-乙酰基硫代乙酸酯(SATA),优选SATA。将SATA溶解于二甲基亚砜(DMSO)中,并与所述合成寡糖的溶液在室温下搅拌1小时。然后,将反应混合物施加至凝胶过滤色谱,用HEPES缓冲液(约pH7.5)平衡以去除任何未反应的SATA。然后,将所述经SATA修饰的寡聚体与选自还原剂组的亲核体(优选盐酸羟胺)在室温下混合2小时以促进巯基转化成反应性硫醇基(图2a)。进行寡糖含量的确定:MenC、MenY和MenW通过间苯二酚测定来进行,MenX和MenA通过Chen测定来进行,并且Hib通过苔黑酚(orcinol)测定来进行。通过Ellman测定来确定所有类型的寡聚体的硫醇基(-SH)含量。通过用硫醇浓度除以寡聚体的浓度(以摩计)来确定硫醇化程度(%)。
活化合适的细菌载体蛋白以产生反应性马来酰亚胺官能团,所述载体蛋白优选但不限于破伤风类毒素(TT)和交叉反应性突变体(CRM197或简单地CRM)或者其重组形式。使用脂肪族异双官能交联剂来活化所述载体蛋白,所述交联剂优选但不限于N-(β-马来酰亚胺基丙基氧基)琥珀酰亚胺酯(BMPS)。将HEPES缓冲液(约pH7.6)中的所述载体蛋白(例如,TT和CRM197)与BMPS在N-甲基-2-吡咯烷酮(NMP)中的所述溶液在室温下混合2小时。然后,将所述载体蛋白的反应混合物用PBS缓冲液(约pH6.8)通过合适的离心截止过滤器洗涤6至7次(图2b)。通过Lowry法使用BSA作为标准品来确定所述活化的载体蛋白的蛋白质含量。通过Ellman测定来间接评估马来酰亚胺含量,其中首先使经马来酰亚胺标记的载体蛋白与已知量的β-巯基乙醇反应并通过DTNB来分析未反应的β-巯基乙醇。使用载体蛋白的摩尔浓度和马来酰亚胺的摩尔浓度来计算每单位载体蛋白的马来酰亚胺基团数量。
将HEPES缓冲液(约pH 7.5)中的硫醇化寡糖(选自例如脑膜炎奈瑟菌血清组A、C、Y、W135、X以及b型流感嗜血杆菌的革兰氏阴性菌的组)和PBS缓冲液(约pH6.8)中的用马来酰亚胺标记的所述活化载体蛋白(选自破伤风类毒素(TT)和交叉反应性突变体(CRM197))混合在一起以进行缀合。优选地在2至8℃下轻轻地搅拌pH为6.5至7.5的反应混合物过夜,但是这也可在室温下进行。通过50kD截止离心过滤器用MES缓冲液(约pH6.5)洗涤6至7次来纯化粗制缀合物以除去未缀合的寡聚体和例如未反应的盐酸羟胺的杂质。将最后的经纯化寡糖-蛋白质缀合物通过0.2μ过滤器过滤并储存在2至8℃下直到使用(图2c)。本发明的所述寡糖-蛋白质缀合物的缀合化学是硫醚键。
通过标准方法针对物理化学分析来进一步表征由所述改进的缀合方法获得的寡糖-蛋白质缀合物,例如蛋白质含量、寡糖含量、寡糖与蛋白质比值(oligosaccharide protein ratio)、游离寡糖的含量。通过高效尺寸排阻色谱(high performance size exclusion chromatography,HP-SEC)来分析缀合物以观察反应物向缀合物的转化和分子大小分布(图3a、3b、3c、3d)。进行测试由此获得的寡糖-蛋白质缀合物的抗原性(图4)和动物免疫原性的研究(图5a、5b、5c、5d)。
本发明提供了其中全过程时间为14至22小时的合成缀合。本发明不需要氮吹扫,并且使用无需特殊操作技能的试剂,从而使所述方法方便且有成本效益。
本发明提供了亲本寡聚体骨架的不经任何修饰的缀合物,从而使全部表位保持完整以产生天然免疫应答。本发明还提供了其中进行单步骤纯化的合成缀合方法,从而减少所述方法中的步骤,使得产率更佳且过程时间更短。
本发明的改进方法的最显著成果是由合成OS-PR缀合提供了结果可重现的寡糖-蛋白质缀合物,其例如但不限于:Hib-TT缀合物、MenX-TT缀合物、MenC-TT缀合物、MenA-TT缀合物、MenW-TT缀合物、MenY-TT缀合物、Hib-CRM197缀合物、MenX-CRM197缀合物、MenC-CRM197缀合物、MenA-CRM197缀合物、MenW-CRM197缀合物、MenY-CRM197缀合物。所述寡糖-蛋白质缀合物引发特异性且均质性的免疫应答,并且可用于产生单价疫苗或多价组合疫苗且可用作诊断工具。
实施例1:产生反应性硫醇官能团的寡聚体(MenA、MenC、MenY、MenW、MenX和Hib)的活化和分析
将合成寡糖在包含0.15M NaCl、10mM EDTA的0.1M HEPES缓冲液(pH 7.5)中浓度为10mg/ml的溶液与2.5×摩尔过量的S-乙酰基硫代乙醇酸N-羟基琥珀酰亚胺酯(SATA)在二甲基亚砜中的溶液混合。将溶液在室温下轻轻搅拌1小时。使SATA与合成的寡聚体的接头链中存在的胺反应以形成用于在第二反应步骤中产生反应性硫醇基的乙酰化中间体。将反应混合物施加到凝胶过滤色谱的sephadex G-10(GE Healthcare)柱(20至30ml床体积)上,所述柱用包含0.15M NaCl、10mM EDTA的0.1M HEPES缓冲液(pH 7.5)平衡以除去任何未反应的SATA。使用平衡缓冲液以等度模式来在4.0ml洗脱剂中收集经反应的寡聚体,随后将其浓缩至500μl。使由此获得的经SATA修饰的寡聚体以硫醇化寡聚体的浓度为约35摩尔过量来与盐酸羟胺在包含0.15M NaCl、10mM EDTA的0.1M HEPES(pH 7.5)中的溶液混合。在室温下混合2小时之后,将硫醇化的寡聚体储存在-20℃下直到进一步使用。活化寡聚体的示意图示于图2a中。使用MenX四聚体的两种不同端基异构体(即α端基异构体(αXTM)和β端基异构体(βXTM))来进行活化和缀合。
然后,将活化的寡聚体纯化并分析寡糖含量和硫醇含量。
对于MenC、MenY和MenW,通过间苯二酚测定使用N-乙酰基神经氨酸(NANA)作为标准品来确定寡糖含量;对于MenA和MenX,通过Chen测定使用磷作为标准品来确定寡糖含量;对于Hib,通过苔黑酚测定使用核糖作为标准品来确定寡糖含量。通过Ellman测定来确定硫醇基(SH)含量。通过用硫醇基的毫摩浓度除以寡聚体的毫摩浓度来获得硫醇化%。寡聚体活化实验的一些代表性结果在表1、2、3和4中给出。
表1:产生反应性硫醇基的MenC合成四聚体(MenC)4的活化
表2:产生反应性硫醇基的MenC合成八聚体(MenC)8的活化
表3:产生反应性硫醇基的MenX合成四聚体(MenX)4的活化
表4:产生反应性硫醇基的Hib合成四聚体(Hib)4的活化
寡聚体的活化过程产生活化的具有末端胺接头的合成寡糖。如图1a、1b、1c、1d、1e,图1集合体地展示了用于通过硫醚缀合化学来制备不同寡聚体-蛋白质缀合物的具有末端胺接头的不同合成脑膜炎球菌血清组。
实施例2:产生反应性马来酰亚胺官能团的TT的活化和分析
取0.1M HEPES缓冲液(pH 7.6)中浓度为20mg/ml(0.133毫摩)的破伤风类毒素(TT)并使其与1-甲基-2-吡咯烷酮中的7.2mg N-(β-马来酰亚胺基丙基氧基)琥珀酰亚胺酯(BMPS)(27毫摩)反应。在室温下混合2小时之后,将反应混合物用包含0.15M NaCl、5mM EDTA的0.1M PBS缓冲液(pH 6.8)通过50kD截止离心过滤器洗涤6至7次。在包含0.15M NaCl、5mM EDTA的0.1M PBS缓冲液(pH 6.8)中以0.5ml的体积收集活化的TT,并将其进一步用于实施例4中的缀合。TT的活化过程的示意图示于图2b中。
分析活化的蛋白质的蛋白质含量和马来酰亚胺含量。通过Lowry法使用BSA作为标准品来确定活化的TT的蛋白质含量;并且通过Ellman测定来间接评估马来酰亚胺含量,其中首先使经马来酰亚胺标记的TT与已知量的β-巯基乙醇反应,并通过DTNB来分析未反应的β-巯基乙醇。通过TT和马来酰亚胺的摩尔浓度来计算每个TT分子的马来酰亚胺数量。活化的TT的分析数据在表5中给出。
表5:产生反应性马来酰亚胺基团的蛋白质(破伤风类毒素)的活化
实施例3:产生反应性马来酰亚胺官能团的CRM197的活化
取1.8ml的0.1M HEPES缓冲液(pH 7.6)中浓度为25mg(0.24毫摩)的CRM197,并使其与1-甲基-2-吡咯烷酮中的2.6mg N-(β-马来酰亚胺基丙基氧基)琥珀酰亚胺酯(BMPS)(3.7毫摩)反应。在室温下混合2小时之后,将反应混合物用包含0.15M NaCl、5mM EDTA的0.1M PBS缓冲液(pH 6.8)通过10kD截止离心过滤器洗涤6至7次。在包含0.15M NaCl、5mM EDTA的0.1M PBS缓冲液(pH 6.8)中以0.5ml的体积收集活化的蛋白质并将其进一步用于缀合。通过Lowry法测试活化的蛋白质的总蛋白质含量并通过Ellman测定来测试马来酰亚胺含量以确定每CRM分子的马来酰亚胺基团。活化的CRM197的分析数据在表6中给出。
表6:产生反应性马来酰亚胺基团的CRM197的活化
实施例4:活化的寡聚体(Hib、MenA、MenC、MenY、MenW和MenX)与活化的蛋白质(TT或CRM)通过硫醚键的缀合
使包含0.15M NaCl、10mM EDTA的0.1M HEPES缓冲液(pH 7.5)中浓度为10mg/ml的实施例1的硫醇化寡聚体与0.1M PBS、0.15MNaCl、5mM EDTA(pH 6.8)中新鲜制备的约10mg/ml的经马来酰亚胺标记TT或CRM混合。将pH为pH 6.5至7.5(优选7.0)的反应混合物优选地在2至8℃下在轻轻搅拌下保持过夜,搅拌还可在室温下进行。用包含0.2M NaCl的0.05M MES缓冲液(pH 6.5)通过50kD截止离心过滤器洗涤6至7次来纯化粗制缀合物以除去未缀合的寡聚体和例如未反应的盐酸羟胺的杂质。将最后的经纯化缀合物通过0.2μ过滤器过滤并储存在2至8℃下直到使用。缀合的示意图示于图2(2c)中。
实施例5:从实施例4获得的MenC寡聚体缀合物的物理化学分析
通过Lowry测定使用0.25mg/ml BSA作为标准品来测试[MenC]4和[MenC]8缀合物的蛋白质含量,并且通过唾液酸测定使用0.5mg/ml N-乙酰基神经氨酸(NANA)作为标准品来测试寡聚体含量。基于wt./wt.来在数学上计算寡糖与蛋白质比值。在用脱氧胆酸钠沉淀之后评价游离OS的量。向900μl的缀合物样品(约100μg OS含量)中添加80μl的1%w/v脱氧胆酸钠水溶液(pH 6.8±0.2)。将反应混合物在2至8℃下保持30分钟,添加50μl的1N HCl,并将样品在6000×g下离心15分钟。收集上清液并通过间苯二酚测定来评估游离糖的含量(表7、8、9)。在UV检测仪上在串联有TSKgel PWXL保护柱(6.0×40mm,TOSOH)的TSKgel 4000 PWXL(7.8×300mm,颗粒尺寸7μm,TOSOH)和TSKgel 3000 PWXL(7.8×300mm,颗粒尺寸7μm,TOSOH)上将缀合物的HPSEC峰谱与蛋白质峰的HPSEC峰谱进行比较以确认所有的蛋白质均转化为缀合物。流动相为0.1M NaNO3(pH 7.2),以1.0ml/分钟的流量以等度模式进行30分钟。分别用葡聚糖(MW 50,00,000至400,00,000(HI-MEDIA))和氧化氘(D2O,Merck)来确定空隙和总柱体积。在280nm下检测蛋白质和缀合物的峰,示于图3a和图3b中。不同批次的(MenC)4-TT缀合物、(MenC)8-TT缀合物、(MenC)4和8-CRM缀合物的表征数据在表7、8和9中给出。
表7.不同批次的(MenC)4-TT缀合物的表征
表8.不同批次的(MenC)8-TT缀合物的表征
表9.不同批次的(MenC)4和8-CRM缀合物的表征
实施例6:从实施例4获得的Hib缀合物的物理化学分析
通过Lowry测定使用0.25mg/ml BSA作为标准品来确定经纯化缀合物的蛋白质含量,通过苔黑酚测定使用0.2摩d-核糖作为标准品来确定总Hib含量,并且在数学上计算Hib与蛋白质比值。在如前述实施例中进行的在1%脱氧胆酸盐(DOC)沉淀之后在上清液中确定游离寡糖的含量。不同批次的(Hib)4-TT缀合物的表征数据在表10中给出。如前述实施例中进行的,通过HP-SEC来分析(Hib)4-TT缀合物,与用于缀合的经修饰TT进行比较以确认完成蛋白质(TT或CRM)向缀合物的转化,示于图3c中。
表10.不同批次的(Hib)4-TT缀合物的表征
实施例7:从实施例4获得的MenX缀合物的物理化学分析
通过针对磷的Chen测定使用0.2毫摩磷溶液作为标准品来测试[MenX]4缀合物的寡聚体含量,并通过Lowry测定来测试蛋白质含量。基于wt./wt.来在数学上计算寡糖与蛋白质比值。通过间苯二酚测定来评估游离寡糖的量,并且在表11中给出。通过HPSEC来分析[MenXl4缀合物以确定完成经修饰的载体蛋白向MenX缀合物的转化。缀合物的HPSEC峰谱示于图3d中。
表11:不同批次的(MenX)4-TT缀合物的表征
实施例8:从实施例4获得的MenY缀合物的物理化学分析
通过唾液酸测定使用0.5mg/ml N-乙酰基神经氨酸(NANA)作为标准品来测试[MenY]4缀合物的寡聚体含量,并且通过Lowry测定来测试蛋白质含量。基于wt./wt.来在数学上计算寡糖与蛋白质比值。通过间苯二酚测定来评估游离寡糖的量,并且在表12中给出。通过HPSEC来分析[MenY]4缀合物以确证完成经修饰的载体蛋白向[MenY]4缀合物的转化。
表12:不同批次的(MenY)4-TT缀合物的表征
实施例9:从实施例4获得的MenW135缀合物的物理化学分析
通过唾液酸测定使用0.5mg/ml N-乙酰基神经氨酸(NANA)作为标准品来测试[MenW]4缀合物的寡聚体含量,并且通过Lowry测定来测试蛋白质含量。基于wt./wt.来在数学上计算寡糖与蛋白质比值。通过间苯二酚测定来评估游离寡糖的量,并且在表13中给出。通过HPSEC来分析[MenW]4缀合物以确证完成经修饰的载体蛋白向[MenW]4缀合物的转化。
表13:不同批次的(MenW)4-TT缀合物的表征
实施例10:确定合成的MenX-TT缀合物的抗原特性
在竞争性酶联免疫吸附测定(ELISA)中经合成的MenX四聚体-TT缀合物与MenX四聚体和无抗原对照的抗原性进行比较。在该测定中,在96孔微量滴定板(A板)中,将针对脑膜炎奈瑟菌血清组X的经8,000倍稀释的兔抗血清(228801;BD)与不同的抗原(合成的MenX四聚体-TT缀合物和合成的MenX四聚体)在37℃下孵育1小时,所述抗原在包含0.1%v/v Brij 35和5%FBS的磷酸缓冲盐水中以不同的浓度(10μg/ml、50μg/ml、100μg/ml、200μg/ml、400μg/ml、1000μg/ml)进行稀释。用MenX细菌多糖和甲基化人血清白蛋白(methylated-Human Serum Albumin,m-HAS)的混合物包被单独的板(B板),随后在于2℃至8℃下孵育过夜之后用5%FBS封闭。向该B板中添加来自A板的抗毒素-抗原混合物,并在37℃下孵育1小时且在室温下孵育1小时。用包含0.1%Brij 35的磷酸缓冲盐水(pH 7.4)洗涤板。将板用PBS(0.1%Brij 35和5%FBS)中经过氧化物酶标记的抗兔IgG抗体在室温下孵育60分钟。再次洗涤板,并用乙酸钠缓冲液中的100μl过氧化物酶底物3,3′,5,5′-四甲基联苯胺-H2O2在室温下孵育10分钟。通过添加50μl的2M H2SO4来停止反应。在ELISA读数器(微板读数器)上记录吸光度(A450)。将结果作为抑制率(%)相对于对浓度(μg/ml)绘制,并且示于图4中。
实施例11:用MenC寡聚体缀合物免疫接种小鼠
在第0、14和28天用1μg寡聚体MenC缀合物免疫接种8只雌性BALB/c小鼠(5至8周龄)的组。所有免疫接种均通过皮下途径施用200μl的疫苗稀释物来进行。对于阴性(载剂)对照组,仅使用生理盐水;对于免疫接种阳性对照组,使用了包含MenC细菌多糖缀合物的多价许可疫苗。在第14、28和35天收集血清。通过间接ELISA来评估特异性抗OS IgG抗体效价。按照表14,用不同的合成的MenC缀合物向动物给药。表14:在小鼠模型中研究免疫原性的不同(MenC)4缀合物制剂
实施例12:通过IgG ELISA来确定合成的MenC-TT和合成的MenC-CRM缀合物的抗原特性
通过每孔添加5μg/ml PS和m-HAS在PBS缓冲液(pH 7.4)中的100μl混合物来用MenC PS包被96孔板(Nunc Maxisorp)。将板在4℃下孵育过夜,并随后用PBS缓冲液(PBS中有0.1%Brij 35,pH 7.4)洗涤三次,并每孔用200μl的在PBS缓冲液(PBS中的0.1%Brij 35,pH 7.4)中的5%FBS溶液在37℃下封闭1小时。在每个孵育步骤之后均进行3次PBS缓冲液洗涤。将参照和受试血清样品在PBS缓冲液(PBS中的0.1%Brij 35、5%FBS,pH7.4)中稀释,转移至经包被-封闭的板(200μl),并连续稀释两倍,然后在4℃下孵育过夜。然后,每孔添加100μl的经1∶1000稀释的过氧化物酶缀合的抗鼠IgG,并在25℃下静置1小时。每孔添加100μl的底物3,3′,5,5′-四甲基联苯胺-H2O2用于显色。在25℃下显色10分钟之后,通过添加50μl的2M H2SO4来停止反应,并在微板读数器上在450nm下测量OD。使用Combistat软件来评价每种制剂的抗MenC多糖IgG浓度(根据ELISA单位/ml),并将几何平均浓度(IgGGMC)示于图5a中。
实施例13:合成(MenC)4-TT缀合物和(MenC)8-TT缀合物的血清杀菌测定(Serum Bactericidal Assay,SBA)
在绵羊血琼脂板上在37℃与5%CO2下培养脑膜炎奈瑟菌(N.meningitidis)血清组C细菌储备物(13102TM)过夜。挑选单独的菌落,并将其在另一个绵羊血琼脂板的表面上在37℃与5%CO2下孵育4小时。将1或2环量的细菌悬浮于5ml的测定缓冲液(不含钙和镁的Hank平衡盐溶液中的5%牛血清白蛋白)中,并将悬浮液的光密度(OD650)调节至0.1,使用测定缓冲液进一步稀释以获得6至10×104个菌落形成单位/ml的工作稀释度。将质量控制(quality control,QC)血清和受试血清样品在56℃下热灭活30分钟。在微孔板中,将受试血清的20μl的连续两倍稀释物与10μl工作稀释度的细菌和10μl幼兔补体(Pel-Freez)混合。对于阴性对照,将细菌在单独的板中用幼兔补体且没有受试血清以及用受试血清和经热灭活的幼兔补体孵育。通过轻轻地拍打测定板来使孔内容物混合,并将板在37℃与5%CO2下孵育1小时。通过划线平板法将来自每个孔的10μl样品平板接种在血琼脂板上。将血琼脂板在37℃与5%CO2下孵育过夜并计数菌落。与相应的活性补体对照相比在将细菌与反应混合物孵育之后显示每ml的菌落形成单位下降≥50%的最高血清稀释度被认为是SBA效价。
考虑了6项不同的研究以与许可的疫苗相比来评价MenC四聚体的SBA效价,并且结果示于图5b中。对于MenC八聚体的SBA效价评价,考虑了3项研究,并且结果示于图5c中。
免疫和血清杀菌测定揭示,本发明的OS-PR缀合物产生更高的总IgG抗体效价。对于脑膜炎C寡糖缀合物,在以1μg剂量3次给药之后,OS-PR缀合物显示出为免疫接种前效价的4倍多高并且多达18倍高的IgG效价。对于MenC,总IgG效价与许可疫苗的效价相当或或者比其更高。
对于MenC蛋白质缀合物,功能性抗体效价(也称为SBA效价)总是为免疫接种前SBA效价的4倍多高,并且与许可疫苗的效价相当或比其更高。
实施例14:用(MenX)4-TT缀合物免疫接种小鼠并且通过ELISA来确定IgG
在第0、14和28天用在生理盐水中配制的1μg和0.1μg(200μl)(MenX)4-TT缀合物通过皮下途径免疫接种8只雌性BALB/c小鼠(5至8周龄)的组。对于阴性对照组,仅使用生理盐水。在第14、28和35天收集血清。由于没有可用于MenX组的商业疫苗,因此与阴性对照比较效价。研究包括两个不同的剂量(1μg和0.1μg)以及评价两个不同批次的αXTM-TT和一个批次的βXTM-TT缀合物。按照图5d,取不同的(MenX)4缀合物制剂来在小鼠模型中研究其免疫原性。
通过ELISA来评估特异性抗OS IgG抗体效价。通过每孔添加5μg/ml PS和m-HAS在PBS缓冲液(pH 7.4)中的100μl混合物来用细菌MenX PS包被96孔板(Nunc Maxisorp)。将板在4℃下孵育过夜,并随后用PBS缓冲液(PBS中有0.1%Brij 35,pH 7.4)洗涤三次,并每孔用200μl的在PBS缓冲液(PBS中有0.1%Brij 35,pH 7.4)中的5%FBS溶液在37℃下封闭1小时。在每个孵育步骤之后均进行3次PBS缓冲液洗涤。将所有的血清样品在PBS缓冲液(PBS中有0.1%Brij 35、5%FBS,pH 7.4)中稀释,转移到经包被-封闭的板中(200μl),并连续稀释两倍,然后在4℃下孵育过夜。然后,每孔添加100μl的经1∶1000稀释的过氧化物酶缀合的抗小鼠IgG,并在25℃下静置1小时。每孔添加100μl的底物3,3′,5,5′-四甲基联苯胺-H2O2用于显色。在25℃显色10分钟之后,通过添加50μl的2M H2SO4来停止反应,并在微板读数器上在450nm下测量OD。使用Combistat软件来评价每种制剂的IgG GMC,如图5d中所示。
实施例15:合成的(MenX)4-TT缀合物的血清杀菌测定(SBA)
在绵羊血琼脂板上在37℃与5%CO2下培养脑膜炎奈瑟菌血清组X细菌储备物(35560)过夜。挑选单独的菌落并将其在另一个绵羊血琼脂板的表面上在37℃与5%CO2下孵育4小时。将1或2环量的细菌悬浮于5ml的测定缓冲液(不含钙和镁的Hank平衡盐溶液中的5%牛血清白蛋白)中,并将悬浮液的光密度(OD650)调节至0.1,使用测定缓冲液进一步稀释至6至10×104个菌落形成单位/ml的工作稀释度。将质量控制(QC)血清和受试血清样品在56℃下热灭活30分钟。在微孔板中,将受试血清的20μl的连续两倍稀释液与10μl工作稀释度的细菌和10μl幼兔补体(Pel-Freez)混合。对于阴性对照,将细菌在单独的板中用幼兔补体且没有受试血清以及用受试血清和热灭活的幼兔补体孵育。通过轻轻地拍打测定板来使孔内容物混合,并将板在37℃与5%CO2下孵育1小时。通过划线平板法将来自每个孔的10μl样品平板接种在血琼脂板上。将血琼脂板在37℃与5%CO2下孵育过夜并计数菌落。与相应的活性补体对照相比,在将细菌与反应混合物孵育之后显示每ml的菌落形成单位下降≥50%的最高血清稀释度被认为是SBA效价。
相对于阴性(载剂)对照血清和未缀合的MenX四聚体来评价三种不同的MenX缀合物,并且结果如图5d所示。MenX-TT缀合物的总IgG和SBA效价是阴性(载剂)对照的至少四倍高,并且与阴性(载剂)对照相比,总IgG为多达45倍高,并且SBA效价为多达350倍高。
- 还没有人留言评论。精彩留言会获得点赞!