LG-362B在治疗急性早幼粒细胞白血病中的应用的制作方法
本发明涉及医药技术领域,具体涉及小分子化合物lg-362b在制备治疗急性早幼粒细胞白血病药物中的应用。
背景技术:
白血病是一种常见的恶性血液疾病。研究表明,白血病是因为骨髓造血干细胞出现不正常的分化和过度增殖而引发的。因为其治愈率低,致死率高,发病群体广泛,最终严重威胁人类的生命,所以又被称为血癌。根据美国2015年《临床肿瘤杂志》最新报导,在美国白血病在各类癌症发病率中排名第九,约54,270名患者患有白血病;致死率排名第六,约24,450名患者死于白血病。根据中国2015年《临床肿瘤杂志》最新报导,在中国白血病在各类癌症发病率中排名第十四,致死率排名第十。急性早幼粒细胞白血病(acutepromyeloctyicleukemia,apl)作为m3型急性髓性白血病(acutemyeloidleukemia,aml),在所有成年aml患者中占大约10%。apl最早于1957年被发现,并被描述为“一周内即可死亡的疾病”,其高度致死性在当时引起了人们的极度恐慌。此外,已有相关报道表明,曾接受过化疗或放疗的患者尤其是乳腺癌患者患上apl的可能性也会增加,这种继发性的apl由于其病因复杂,治疗难度大,目前也越来越引起人们的重视。
15号染色体与17号染色体发生易位产生pml-rarα蛋白。它是导致急性早幼粒细胞白血病的直接原因。pml-rarα融合蛋白的主要功能是促进rarα蛋白与转录共抑制复合物相结合。这种结合进一步抑制rarα蛋白靶基因的表达,早幼粒细胞的正常分化也随之抑制。最后发生大量未成熟的早幼粒细胞导致apl的发生。与此同时,pml-rarα蛋白具有破坏核体nbs(nuclearbody)或pod(pml致癌结构域)结构的能力,使得pml无法正常定位,因此失去了诱导细胞凋亡和抑制细胞增殖的功能,引发细胞的恶性增殖,进一步加速了apl的发展。
apl的治疗目前分为两个阶段:(1)诱导缓解阶段;早在1967年,人们开始采用化学疗法治疗apl,1973年蒽环霉素被引入用于apl的临床治疗。直到1985年人们试图用全反式维甲酸(atra)治疗apl,并于1988年取得了较高的cr。因此,atra的出现是apl治疗发展史上的革命性事件,直到现在,临床上治疗apl仍然以atra为主,尤其在初期诱导缓解阶段。然而,临床上单独使用atra常常引发副作用。即维甲酸综合征(retinoicacidsymptom,ras)和atra耐药性复发。在治疗耐药复发型apl的药物中,临床上常用的是砷类药物。最具代表性的是三氧化二砷(arsenictrioxide,ato),又名砒霜。ato作为除了atra以外另一种靶向治疗apl的小分子药物,从2000年起,其与atra的联合使用开始引起人们的关注。研究表明,这两种药物的联用使apl患者获得了更高的cr,复发率更低,副作用也明显减轻,从一 定程度上提高了药物诱导早幼粒细胞成熟分化的能力,从而增强了药物的效果。除了上面提到的atra和ato两种小分子靶向药物以外,单克隆抗体和组蛋白去乙酰化酶抑制剂也是临床上常用的靶向治疗apl的常用药物。(2)缓解后巩固阶段。缓解后巩固阶段对于临床治疗apl是不可或缺的。临床数据表明,即使apl初期诱导缓解后的cr指数达到90%以上。如果患者没有进一步接受巩固治疗,80%以上的患者都会复发,其生存率不足36%,而经过巩固治疗可达61%以上。此外,复发会引发atra的耐药性,为apl的治疗增加了难度,也为患者带来了更多的痛苦。因此,为了避免此类事情发生,临床上通常对经过成功诱导缓解后的病人进行巩固治疗。常用的巩固治疗策略是多种化疗药物的联用。如atra与甲氨蝶呤(mtx)、巯蝶呤(6-mp)联合使用,用于巩固治疗,可使病人平均5年无病生存率达到70%以上,ato与ha、da或依托泊苷联合使用在apl患者巩固治疗阶段也常用的方案,大大提高了病人的生存率。
虽然atra、ato等靶向治疗apl的小分子药物在临床上取得了不错的成绩,在一定程度上缓解了apl病情的发展,然而这类药物所产生的副作用和耐药性复发也越来越引起人们的关注。因此,我们试图寻找其他更加高效安全的靶向治疗apl的新型小分子化合物,并期望能够解决临床上atra耐药性难题。
技术实现要素:
本发明第一目的是提供7-氨乙酰基氨基-n-苯乙酰基-1,3,4,9-四氢-beta-咔啉(lg-362b)化合物或其衍生物或其药学上可接受的盐化合物,在制备治疗急性早幼粒细胞白血病(acutepromyeloctyicleukemia,apl)药物或药物组合物中的用途。
其中,所述lg-362b化合物如式(i)所示,
式(i)所示lg-362b化合物是一种小分子化合物,分子量:362.42。
本发明提出了式(i)所示lg-362b化合物在制备体内和/或体外抑制apl细胞的生长、增殖、迁移、浸润、分化、或诱导apl细胞凋亡的药物中的应用。
在一实施方案中,所述药物或药物组合物能够在体内抑制apl细胞的浸润、或体内抑制apl细胞增殖或体内诱导apl细胞凋亡。在一个具体实施方案中,所述apl细胞包括pml-rara阳性细胞、pml-rara阴性细胞及atra耐药性细胞。
在另一实施方案中,所述药物或药物组合物能够在体内通过caspases依赖性途径,诱导pml-rarα融合蛋白及rarα蛋白的降解,清除apl细胞,从而达到治疗apl疾病的目的。
在一个实施方案中,所述lg-362b化合物还可与药学上可接受的固体或液体载体结合,以及任意地与药学上可接受的辅助剂和/或赋形剂结合。
本发明第二目的是提供上述一种式(i)所示lg-362b化合物或其衍生物或其药学上可接受的盐化合物,在体外研究其抑制apl细胞增殖、生长、迁移、浸润、或诱导apl细胞凋亡的用途。
在一个实施方案中,一种lg-362b化合物或其衍生物或其药学上可接受的盐化合物,可在体外抑制pml-rara阳性细胞、pml-rara阴性细胞及atra耐药性细胞的增殖。在一个具体实施方案中,其中所述apl包括apl细胞株nb4、hl60细胞、atra耐药性apl细胞株nb4-r1细胞。
在另一实施方案中,一种lg-362b化合物或其衍生物或其药学上可接受的盐化合物,可以抑制atra治疗无效的apl细胞株nb4-r1细胞增殖。
本发明第三目的是提供上述一种lg-362b化合物或其衍生物或其药学上可接受的盐化合物,在体外诱导atra耐药性apl细胞分化、抑制或筛选atra耐药性apl细胞株的用途。
在一个实施方案中,所述lg-362b化合物或其衍生物或其药学上可接受的盐化合物,可体外抑制atra耐药性apl细胞株nb4-r1细胞的增殖。
在另一实施方案中,所述一种lg-362b化合物或其衍生物或其药学上可接受的盐化合物,可体外诱导atra耐药性nb4-r1细胞的分化。
在上述任一所述的实施方案中,所述体外或体内包括人类或哺乳动物。在一个具体实施方案中,所述哺乳动物包括临床用实验动物。在更具体的实施方案中,所述实验动物包括实验用的小鼠、大鼠、兔、猴等。
本发明的有益效果在于,
本发明提出式(i)所示的lg-362b化合物在体外诱导apl细胞分化的应用及方法。瑞氏吉姆萨染色法可以检测由式(i)lg-362b体外所诱导的apl细胞株nb4、hl60及atra耐药细胞nb4-r1的分化;式(i)lg-362b可以体外诱导apl细胞株nb4、hl60及atra耐药细胞nb4-r1发生nbt还原反应;式(i)lg-362b可以在体外促进apl细胞株nb4、hl60及atra耐药细胞nb4-r1集落刺激因子受体(csfr)的表达;式(i)lg-362b可以在体外促进apl细胞株nb4、hl60及atra耐药细胞nb4-r1细胞表面抗原cd11b的表达。
本发明的atra敏感(as)及atra耐药(ar)移植性小鼠模型参照上海交通大学医学院陈国强教授实验室所建立的动物模型。本发明建立了atra敏感(as)及atra耐药(ar) 移植性小鼠模型。
本发明提出了式(i)所示的lg-362b化合物在体内和/或体外抑制apl细胞增殖的应用及方法。式(i)lg-362b可以抑制异体移植小鼠模型肿瘤的生长。
本发明提出了式(i)所示的lg-362b化合物在体内和/或体外强烈抑制apl细胞生长的应用及方法。式(i)lg-362b可以抑制异体移植小鼠模型肿瘤的生长。
本发明提出式(i)lg-362b化合物在体内和/或体外强烈抑制apl细胞的浸润的应用及方法。肝脏、脾脏的重量及大小是反应肿瘤是否浸润的一个直观指标。肝脏和脾脏的h&e染色从组织化学上进一步反映apl细胞是否浸润。
本发明提出式(i)lg-362b化合物在体内和/或体外强烈诱导apl细胞的分化。瑞氏吉姆萨染色法可以检测由式(i)lg-362b在体内诱导的apl细胞的分化。
本发明提出了式(i)所示的lg-362b化合物在体内和/或体外诱导apl细胞凋亡的应用及方法。式(i)lg-362b可以抑制异体移植小鼠模型肿瘤的生长。
本发明提出了式(i)所示的lg-362b化合物在体内和/或体外强烈抑制apl细胞的凋亡的应用及方法。
在一个实施方案中,所述lg-362b化合物还可与药学上可接受的固体或液体载体结合,以及任意地与药学上可接受的辅助剂和/或赋形剂结合。
我们采用mts试剂盒检测了由本实验室化学组合成的一系列小分子化合物筛选得到式(i)lg-362b,该化合物能够在体外和体内强烈抑制apl细胞的增殖以及诱导白apl细胞的分化和凋亡。
附图说明
图1所示为lg-362b在体内和外特异性抑制apl细胞增殖的效果。
图1(a)表示式(i)lg-362b的制备流程图及其化学结构式。
图1(b)表示式(i)lg-362b对nb4、hl6o两株apl细胞以及三株其它类型白血病细胞的增殖的抑制效果。
图1(c)表示式(i)lg-362b促进nb4和hl6o细胞凋亡呈剂量依赖性效果的直观统计图。
图1(d)表示通过测量肿瘤体积反应式(i)lg-362b在体内对apl细胞皮下生长的抑制效果。
图1(e)表示通过测量肿瘤重量反应式(i)lg-362b在体内对apl细胞皮下生长的抑制效果。
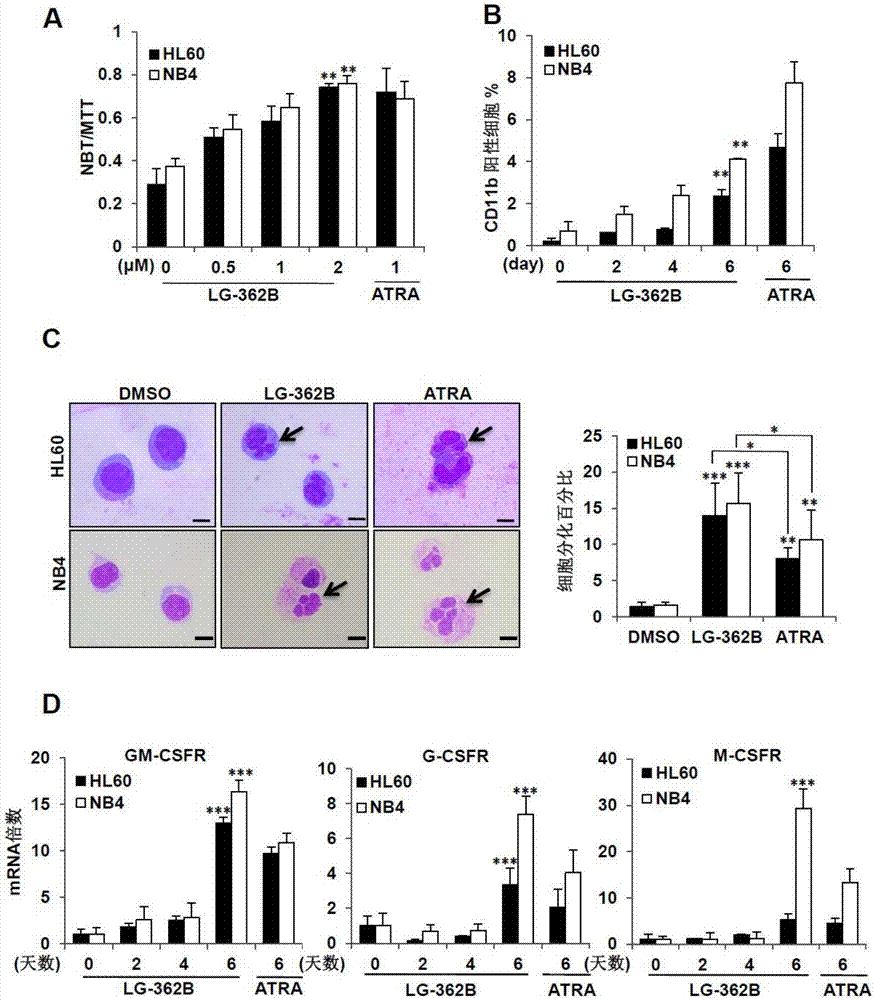
图2所示为式(i)lg-362b在体外诱导apl细胞分化的效果。
图2(a)表示式(i)lg-362b体外诱导apl细胞株nb4、hl60发生nbt还原反应。
图2(b)表示式(i)lg-362b体外促进apl细胞株nb4、hl60细胞表面抗原cd11b的表达。
图2(c)左图表示式(i)lg-362b体外诱导apl细胞株nb4、hl60细胞分化的瑞氏吉姆萨染色镜检图。
图2(c)右图表示式(i)lg-362b体外诱导apl细胞株nb4、hl60细胞分化的瑞氏吉姆萨染色镜检结果统计图。
图2(d)表示式(i)lg-362b体外促进apl细胞株nb4、hl60三种csfr表达水平统计图。
图3所示为式(i)lg-362b在体内诱导apl细胞分化的效果。
图3(a)表示式(i)lg-362b延长apl小鼠生存周期效果统计图。
图3(b)表示通过测量肝脏重量反应式(i)lg-362b抑制apl细胞肝脏浸润效果统计图。
图3(c)表示式(i)lg-362b体内抑制apl细胞脾脏浸润效果图。
图3(d)表示通过测量脾脏重量反应式(i)lg-362b抑制抑制apl细胞脾脏浸润效果统计图。
图3(e)表示式(i)lg-362b体内诱导apl细胞分化的瑞氏吉姆萨染色镜检图。
图3(f)表示式(i)lg-362b对apl小鼠肝脏、脾脏浸润效果的h&e染色镜检图。
图4所示为式(i)lg-362b体外抑制atra耐药apl细胞增殖及诱导atra耐药apl细胞分化效果图。图4(a)表示式(i)lg-362b抑制atra耐药apl细胞增殖效果图。
图4(b)表示式(i)lg-362b促进atra耐药apl细胞呈剂量依赖性凋亡的直观统计图。
图4(c)左图表示式(i)lg-362b体外诱导atra耐药apl细胞分化的瑞氏吉姆萨染色镜检图。
图4(c)右图表示式(i)lg-362b体外诱导atra耐药apl细胞分化的瑞氏吉姆萨染色镜检结果统计图。
图4(d)表示式(i)lg-362b体外诱导atra耐药apl细胞发生nbt还原反应。
图4(e)表示式(i)lg-362b体外促进atra耐药apl细胞表面抗原cd11b的表达。
图4(f)表示式(i)lg-362b体外促进atra耐药apl细胞三种csfr表达水平统计图。
图5所示为式(i)lg-362b在atra耐药小鼠模型体内诱导apl细胞分化的效果。
图5(a)表示式(i)lg-362b延长atra耐药小鼠模型生存周期效果统计图。
图5(b)表示通过测量肝脏重量反应式(i)lg-362b抑制atra耐药小鼠模型apl细胞肝脏浸润效果统计图。
图5(c)表示式(i)lg-362b体内抑制atra耐药小鼠模型apl细胞脾脏浸润效果直观图。
图5(d)表示通过测量脾脏重量反应式(i)lg-362b抑制atra耐药小鼠模型apl细胞脾脏浸润效果统计图
图5(e)表示式(i)lg-362b体内诱导atra耐药小鼠模型apl细胞分化的瑞氏吉姆萨染色镜检图。
图5(f)表示式(i)lg-362b对atra耐药小鼠模型体内肝脏、脾脏浸润效果的h&e染色镜检图。图6所示为式(i)lg-362b通过caspases依赖性途径诱导pml-rarα融合蛋白及rarα蛋白蛋白降解。
图6(a)表示式(i)lg-362b下调apl细胞及atra耐药apl细胞pml-rarα融合蛋白及rarα蛋白的表达效果。
图6(b)表示式(i)lg-362b降解hl60细胞皮下荷瘤小鼠模型体内实体肿瘤rarα蛋白效果。
图6(c)表示式(i)lg-362b对pml-rarα融合蛋白及rarα蛋白mrna表达水平的影响。
图6(d)表示确定式(i)lg-362b降解pml-rarα融合蛋白及rarα蛋白的途径。
图6(e)表示式(i)lg-362b诱导apl细胞及atra耐药apl细胞凋亡相关蛋白的表达。
具体实施方式
结合以下具体实施例和附图,对本发明作进一步的详细说明,本发明的保护内容不局限于以下实施例。在不背离发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求书为保护范围。实施本发明的过程、条件、试剂、实验方法等,除以下专门提及的内容之外,均为本领域的普遍知识和公知常识,本发明没有特别限制内容。
实施例1:式(i)lg-362b在体内体外对多种apl细胞增殖的抑制效果。
技术方法:
1.细胞的培养本实验中所用的jurkat细胞、thp-1细胞购买于atcc细胞库;hl60细 胞、nb4细胞、nb4-r1细胞、kg1-α细胞来自于上海交通大学医学院陈国强教授实验室。细胞培养于37℃恒温培养箱(湿度95%,co2浓度5%)中,培养基为含10%胎牛血清(front)的rpmi-1640(gibco)。待细胞长满后,用800rpm离心5min收集离心后的细胞,按一定的比例传代到装有新培养基的新的培养瓶。一般2天传代一次。
2.mts法测定细胞活力
离心重悬细胞后,不同的细胞株以1×104-2×104个/孔密度接种至96孔板(corning)中,96孔板四周用pbs封闭。每孔加入50μl含不同浓度药物的培养基,对照组加入等量的dmso,使得每孔最终为100μl体系。细胞培养48小时后,避光,每孔加入20μlmts溶液于37℃、5%co2培养箱中孵育1-2h。孵育完成后用酶标仪(spectramax190)于490nm波长下读取od值。细胞存活率(%)=加药物od值/对照组od值×100%。独立重复三次后,计算方差并制作统计图,以此分析药物对细胞活力的影响。
3.细胞凋亡(apoptosis)实验
将悬浮细胞接种于6孔板中,每孔大约50×104个细胞,加入药物使其最终浓度分别为0μm、0.5μm、1μm、5μm和10μm,不染组和单染组(pi组和annexinv组)的最终药物浓度均为10μm。于37℃、5%co2培养箱中培养48小时后利用凋亡检测试剂盒进行凋亡检测。流式细胞凋亡检测时,细胞分为不染组、单染pi组、单染annexinv组以及pi、annexinv双染组。离心收集细胞,计数保证每组不少于100×104/ml个细胞。pbs重悬细胞洗两次,离心收集细胞。每管加入100μl用milli-q水稀释成的1×bindingbuffer溶液,用移液枪轻轻吹打,使细胞重悬,不染组不加pi以及annexinv,单染pi组加入pi5μl,单染annexinv组加入annexinv5μl,annexin-v-pi双染组均加入pi和annexinv各5μl,混匀。室温避光孵育15分钟,加入400μl结合缓冲液混匀并转移到5ml流式管中,进行流式细胞仪检测分析。
4.小鼠皮下荷瘤模型
皮下荷瘤实验是检测体内肿瘤生长的常见模型。将500×104个hl60细胞皮下注射到32只4-5周龄的雄性免疫缺陷小鼠(blab/c-nude,裸鼠)背部皮下,两周后,有20只小鼠皮下肿瘤长到250mm3左右,然后根据肿瘤体积将小鼠分为四组,每组5只小鼠,并保证每组小鼠肿瘤的平均大小基本一致。四组小鼠分别为:对照组、10mg/kglg-362b处理组、30mg/kglg-362b处理组和30mg/kgatra处理组。分组后即可打药。10mg/kglg-362b处理组和30mg/kglg-362b处理组小鼠腹腔注射dmso溶解的浓度分别为10mg/kg、30mg/kg的小分子化合物lg-362b,每天注射,连续注射20天。对照组小鼠则每天腹腔注射同等剂量的dmso溶剂。对于atra处理组小鼠,隔天腹腔注射dmso溶解的30mg/kgatra,注射时间与lg-362b处理组小鼠相同。实验过程中,隔天记录小鼠体重并测量小鼠背部肿瘤大小,20天 后处死小鼠并剥下肿瘤,拍照并称重,用4﹪多聚甲醛固定肿瘤组织用于后续免疫组化分析。
实验结果如图1(b),(c)(d和e)所示,其中,
如图1(b)所示式(i)lg-362b对nb4、hl6o两株apl细胞以及三株其它类型白血病细胞的增殖效果,其中该化合物在较低剂量下就可以有效抑制nb4、hl60两株apl细胞的增殖,而对于其他三株非apl白血病细胞而言即使在较高剂量药物作用下抑制效果几乎不明显。
如图1(c)所示,式(i)lg-362b能够剂量依赖性地促进apl细胞nb4、hl6o的凋亡。
如图1(d和e)所示,lg-362b在体内能够有效抑制肿瘤的生长。高剂量给药组的抑制效果与阳性对照组(atra)的抑制效果基本相同。
以上实验表明式(i)lg-362b能显著抑制乳apl细胞株的体外细胞增殖,并能显著抑制体内apl肿瘤细胞的生长,预示其以作为制备治疗apl的潜在药物。
实施例2:式(i)lg-362b在体外诱导多种apl细胞及atra耐药细胞分化。
技术方法:
1.瑞氏吉姆萨(wright-giemsa)染色法检测apl细胞及atra耐药细胞的分化
首先,用低浓度药物长时间处理apl细胞及其atra耐药细胞,通过mts技术检测细胞的活性,探索在保证细胞活性的实验条件下研究化合物lg-362b诱导细胞分化的能力。与此同时,考虑到atra作为诱导早幼粒细胞正常分化的经典药物,我们将atra作为阳性对照以此判断lg-362b对细胞分化的诱导。接着,在相同实验条件下我们对nb4、hl60及nb4-r1进行加药处理,处理相应时间后进行细胞涂片及瑞氏吉姆萨染色。具体制作过程分为以下4个步骤:(1)制作细胞涂片,自然晾干(2)在涂片上滴加a液(约0.5ml-0.8ml)覆盖整个涂片,室温染色1min(3)在涂片上滴加a液2-3倍的b液,用吸耳球轻轻吹打混匀,室温染色3-5min(4)自来水或蒸馏水轻轻冲洗以洗去多余染料,自然晾干后封片,镜检。通过显微镜观察染色后细胞的细胞核的形态变化,就可以判定apl细胞是否发生分化。
2.硝基蓝四氮唑(nitrobluetetrazolium,nbt)还原实验
离心收集细胞制备浓度为1×104个/ml的细胞悬液,96孔板每孔接种100μl,加等量含药物的培养基使其最终浓度分别为0μm、0.5μm、1μm和2μm,于37℃、5%co2的增湿培养箱中培养,每两天换液一次,培养6天后于高速离心机离心96孔板,分别加入100μl由pbs配制的2mg/ml的mtt和1mg/mlnbt、0.24ug/mltpa溶液重悬细胞,并于37℃培养箱中各孵育1h 和4h,然后离心用pbs洗两次,每孔加入200μldmso于摇床上摇20min,注意不要过于剧烈以免dmso溅出影响实验结果。最后用酶标仪于570nm波长下检测其od值,并通过计算nbt与mtt的od值之比求得还原比。
3.细胞表面抗原检测技术
300g5min离心收集细胞。随后用4℃预冷的含2%胎牛血清的pbs反复洗两次。然后用200μlpbs重悬细胞并分为相同的两份,一份加1μlcd11b抗体于4℃冰箱中孵育,另一份细胞悬液不加抗体。30min-1h后,再次离心并用4℃预冷的含2%胎牛血清的pbs洗两次,以洗去多余的抗体,最后用200μlpbs重悬,保证悬液中至少1×104个细胞,避光进行流式细胞仪检测。
4.聚合酶链式反应(polymerasechainreaction,pcr)实验
4.1rna提取
提取rna的具体操作过程:(1)800rpm离心5min收集悬浮细胞,加1mltrizol,上下轻轻颠倒后室温裂解5min,放-80℃冰箱可保存一周(2)加200ml氯仿(三氯甲烷)颠倒震荡混匀,室温放置5min(3)12000rpm于4℃高速离心机离心20min(4)吸取上层水相至另外一个ep管,注意千万不要吸到中间界面(5)每毫升trizol加500μl异丙醇,混匀室温静置5min。(6)12000rpm4℃离心10min,弃上清,rna沉于管底(7)加1ml由depc水配制的75﹪乙醇,悬浮沉淀(8)800rpm4℃离心5min,尽量弃上清(9)自然晾干(10)加20-30μldepc水溶解rna(11)测rna浓度。
4.2反转录
反转录具体操作过程:(1)反应体系(10μl体系):5×primescriptrtmstermix2μl;totalrna最多500ng;rnasefreedh20upto10μl。(2)反应条件:37℃30min;85℃5s;4℃∞。
4.3实时定量pcr分析(real-timequantitativepcr)
(1)反应体系(total25μl):sybrpremixextaq12.5μl;pcrforwardprimer(10μm)0.5μl;pcrreverseprimer(10μm)0.5μl;cdna1μl;rnasefreedh2010μl。(2)反应条件:a.预变性:95℃5min1cycle。b.pcr反应:95℃30s变性;55℃30s延伸;72℃30s退火;进行40个cycle。c.溶解曲线:95℃30s;55℃30s;95℃30s;进行1个cycle。(3)realtimepcr引物:gm-csfr、g-csfr、m-csfr和人源β-actin引物序列如下:
gm-csfr
5"-aaacagcccaggacctatc-3"
5"-gacaagggttcccacgatta-3"
g-csfr
5"-agactgggagcagagcttc-3"
5"-cagcgtatctgcagggtgta-3"
m-csfr
5"-caatggcagcgtggaatgg-3"
5"-gcagtagtgcgtcctggtcct-3"
β-actin
5"-tgaagtgtgacgtggacatc-3"
5"-catactcctgcttgctgatc-3"
实验结果如图2(a),(b),(c),(d)及图4(c),(d),(e),(f)所示。
如图2(a)如图4(d)所示,式(i)lg-362b诱导apl细胞及其atra耐药细胞发生nbt反应.如图2(b)如图4(e)所示,式(i)lg-362b促进apl细胞及其atra耐药细胞表面抗原cd11b的表达.如图2(c)如图4(c)所示,式(i)lg-362b诱导apl细胞及其atra耐药细胞的细胞形态发生变化。如图2(d)如图4(f)所示,式(i)lg-362b促进apl细胞及atra耐药细胞三种csfrmrna的表达。
以上实验表明式(i)lg-362b能够体外诱导apl细胞及atra耐药细胞分化。可以作为制备治疗apl的潜在药物。
实施例3:式(i)lg-362b在体内诱导atra敏感及atra耐药患病小鼠体内apl细胞正常分化
1.小鼠的饲养
4-5周龄的雄性裸鼠和6-8周龄的雄性fvb/n小鼠均在华东师范大学动物中心清洁级屏障动物房饲养。每天饲喂水和鼠粮,定期更换垫料与鼠笼,每笼5只小鼠。从公司购买的小鼠不可直接进入华东师范大学动物中心清洁级屏障,必须在动物中心监察1周以确定其无传染病,方可进入屏障进行常规饲养。待动物基本适应饲养环境后,即可进行实验。实验全过程符合《华东师范大学动物实验伦理委员会实验操作规范流程》的相关规定,并受到华东师范大学动物实验伦理委员会的严格监督。
2.atra敏感(as)及atra耐药(ar)移植性小鼠模型建立
该模型的建立参照上海交通大学医学院陈国强教授实验室的atra敏感(as)及atra耐药(ar)移植性小鼠模型的建立方法,将6-8周fvb/n小鼠首先经过4.5gy剂量x射线 照射,一天后尾静脉注射2×105个hmrp8-pml-rarα蛋白或其突变体的转基因小鼠来源的脾脏细胞,移植后第二天即可进行给药。无论是atra敏感还是耐药的移植性小鼠,与正常小鼠相比,大概20天后均会出现毛发无光泽、活动能力差、脾脏肿大的患病症状,且生存期将明显降低。
3.骨髓细胞、外周血细胞采集及分析
3.1骨髓细胞采集
颈椎脱臼法处死小鼠后,用75﹪酒精浸泡小鼠5min。然后在超净台中用眼科剪小心剪开小鼠腹部皮肤,剪断小鼠脚踝及髋关节,分离出小鼠下肢。小心剥离下肢的皮肤及肌肉组织后,在胫骨与股骨的连接处剪断,分离胫骨与股骨。取胫骨或股骨,剪去骨两端的软骨,露出骨髓腔,用1ml无菌注射器吸取适量rpmi-1640培养基后轻轻插入骨髓腔,冲洗骨髓腔直至胫骨或股骨呈白色即可采集到骨髓细胞,制作细胞涂片并进行瑞氏吉姆萨染色。
3.2外周血细胞采集
小鼠外周血细胞采集采用眼球取血方法。固定小鼠,将中指轻按在小鼠心脏部位,无名指轻按在小鼠腹部。同时我们用拇指轻压取血侧眼部皮肤。然后用弯头镊摘除小鼠眼球,收集流出的血液制作血涂片并进行瑞氏吉姆萨染色。
4.h&e染色
(1)组织固定:将剥离的组织如肿瘤块、脾脏、心脏、肺、肝脏、肾脏等切成小块,放入4﹪的多聚甲醛溶液中于摇床中常温固定过夜。固定时间不宜超过24小时。将固定好的组织块修剪平整,放入包埋盒中流水冲洗过夜以洗去残余的多聚甲醛溶液。(2)组织脱水:将组织依次浸入50﹪乙醇、70﹪乙醇、90﹪乙醇i、90﹪乙醇ii、100﹪乙醇i、100﹪乙醇ii中各1h,使组织脱水。(3)组织透明:将组织依次浸入乙醇:二甲苯=1:1溶液30-45min,100﹪二甲苯i、100﹪二甲苯ii溶液各1h,使组织透明。(4)组织包埋:将组织浸入i号蜡30min,ii号蜡中可过夜,iii号蜡处理2h,三种蜡中二甲苯含量依次减少。用包埋机加蜡包埋,待其冷却凝固形成蜡块后放-20℃可长期保存。(5)组织切片、展片、烤片:修整蜡块以突出组织部分,并将其固定在leica切片机上,调节厚度为4μm进行切片,然后放入水温为42℃展片机中展片,待组织展平后,用硅化防脱载玻片捞出组织片,放在60℃烤片机上烤片2h使组织片固定在载玻片上。常温或37℃烘箱中保存。(5)将组织切片依次浸入二甲苯i、二甲苯ii、乙醇:二甲苯=1:1、100﹪乙醇i、100﹪乙醇ii、90﹪乙醇i、90﹪乙醇ii、70﹪乙醇i、70﹪乙醇ii、50﹪乙醇溶液中各5min。(6)将组织切片浸于苏木精中复染10min,在水里漂洗后盐酸酒精分色30s。自来水中返蓝30min。伊红染料染色5s。(7)将组织切片浸于85﹪乙醇、伊红、90﹪乙醇i、90﹪乙醇ii、100﹪乙醇i、100﹪乙醇ii、乙醇:二甲苯=1:1、 100﹪二甲苯i、100﹪二甲苯ii中浸泡各5min。(8)封片:中性树脂封片,晾干、镜检。
实验结果如图3(a),(b),(c),(d),(e),(f)及图5(a),(b),(c),(d),(e)所示。如图3(a)所示,不管是高剂量还是低剂量的lg-362b化合物均能延长atra敏感小鼠的生存期,但是相对而言,高剂量的lg-362b更为明显地延长了atra敏感小鼠的生存期,并且效果比atra的还要具有优势。如图5(a)所示,对于atra耐药(ar)移植性小鼠而言,atra已经已经无法起到治疗作用,而不管是高剂量还是低剂量的lg-362b化合物还是能够起到延长atra敏感小鼠的生存期的作用。如图3(b),(c),(d)以及图5(b),(c),(d)所示,lg-362b能够显著抑制atra敏感(as)及atra耐药(ar)移植性小鼠肝脏及脾脏apl细胞的浸润。然而,atra对于atra耐药(ar)移植性小鼠起的抑制作用远不及lg-362b化合物。如图3(e)及5(e)所示,lg-362b化合物能够体内诱导atra敏感(as)及atra耐药(ar)移植性小鼠外周血(pb)和骨髓细胞(bm)发生分化。如图3(f)及5(f)所示,h&e染色结果进一步从组织化学水平上验证了lg-362b能够显著抑制atra敏感(as)及atra耐药(ar)移植性小鼠肝脏及脾脏apl细胞的浸润。
以上实验表明式(i)lg-362b能够诱导atra敏感(as)及atra耐药(ar)移植性小鼠体内apl细胞及atra耐药细胞分化。可以作为制备治疗apl的潜在药物。
实施例4:式(i)lg-362b在体外体内降解apl细胞pml-rarα融合蛋白及rarα蛋白蛋白。
技术方法:
1.蛋白样品的制备
2000rpm离心5min收集药物处理后的细胞。用预冷的pbs洗两次。冰上用适量ripa裂解液裂解30min,每隔10min涡旋震荡以充分裂解细胞。12000rpm4℃离心20min,取上清,去沉淀。即可得到细胞裂解液。在蛋白印迹检测之前我们使用bca试剂盒(thermoscientific公司提供)来对蛋白进行定量,使得每组蛋白样品的蛋白总量一致。定量后,加5×sdsloading,于100℃水浴锅中煮10min,-20℃或-80℃储存。
2.westernblot(蛋白印迹)实验
蛋白经煮沸变性后用聚丙烯酰胺凝胶page电泳分离蛋白质样品,然后转移到硝酸纤维素薄膜上,首先用特异性抗体(一抗)孵育过夜,再用带有荧光标记的二抗体孵育一小时,最后用扫膜仪odyssey检测目的蛋白的表达水平。
实验结果如图6(a),(b),(c),(d),(e)所示。如图6(a)所示,lg-362b下调apl细胞及atra耐药apl细胞pml-rarα融合蛋白及rarα蛋白的表达。如图6(b)所 示lg-362b降解了皮下荷瘤小鼠体内实体肿瘤rarα蛋白。如图6(c)所示lg-362b不影响apl细胞内pml-rarα融合蛋白及rarα蛋白mrna的表达水平。如图6(d)所示lg-362b通过caspases依赖性途径诱导pml-rarα融合蛋白及rarα蛋白的降解。
以上实验表明式(i)lg-362b能够通过caspases依赖性途径诱导pml-rarα融合蛋白及rarα蛋白降解,从分子水平上揭示了lg-362的作用机理。可以作为制备治疗apl的潜在药物。
上述实施例仅为了说明本发明的技术构思及特点,其目的在于让本领域技术人员能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡是根据本发明内容的实质所作出的等效变化或修饰,都应涵盖在本发明保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!