一种检测胱抑素C的荧光探针及构建方法与流程
本发明属于分子生物及微生物技术领域,具体来说,本发明涉及利用噬菌体表面随机展示肽库筛选出一条与胱抑素C(Cys-C)特异性结合的配体序列,用固相多肽合成法合成该配体,并对其进行荧光标记制备成一种检测胱抑素C的荧光探针。
背景技术:
:
尿蛋白和血肌酐等标志物目前可以用来检测肾脏病变情况,但不能实现早期检测。因此寻找新型检测标志物,建立新的检测方法一直是人们研究的热点。自1983年研究人员首次在鸡蛋清中分离纯化出Cys-C以来,大量的研究表明,Cys-C在肾脏病变早期检测方面已经成为不可替代的有效标志物。
目前,Cys-C的测定方法很多,包括单向免疫扩散法、酶联免疫测定法、时间分辨荧光免疫法、放射免疫法、胶乳颗粒法、胶乳增强免疫比浊法等。其中单向免疫扩散(SRID)须手工操作、检测时间长,过程复杂,影响因素较多,灵敏度差,无法自动化,不利于临床应用。酶联免疫测定法(ELISA)为手工操作,不需要昂贵的仪器,检测灵敏度高,特异性强,但所需抗体昂贵,成本高,且检测时间较长,不适合急诊样本的检测。时间分辨荧光免疫法(TRFIA)用时间分辨技术测量荧光,同时检测波长和时间两个参数,可有效地排除非特异性荧光的干扰,极大地提高了分析灵敏度。但是需要特殊的仪器设备,且所需检测时间较长,难以在临床普及应用。放射免疫法(RIA)是利用同位素标记的与未标记的抗原同抗体发生竞争性抑制反应的方法。本法结果准确,特异性强,灵敏度高,但存在放射性污染,操作繁琐,检测时间长。胶乳颗粒法是一种免疫比浊测定法,该法操作简便快速,变异系数和误差小,易于自动化,但检测灵敏度低。胶乳增强免疫比浊法不易受干扰因素影响,特异性强,便于自动化分析,但检测成本高,灵敏度低。基于上述情况,亟待建立灵敏、特异、快速检测Cys-C的生物学新方法。
技术实现要素:
:
本发明的目的是:提供一种检测胱抑素C的荧光探针及构建方法,利用噬菌体展示技术筛选Cys-C特异性亲和配体并获得配体序列,该序列经过人工合成和荧光素标记获得的多肽荧光探针可与Cys-C特异性结合,替代Cys-C单克隆抗体用于免疫检测中。
本发明的技术方案是:以Cys-C为靶标,采用噬菌体表面随机展示十二肽库筛选出与Cys-C特异性结合的重组噬菌体,通过提取重组噬菌体的单链DNA(ssDNA)进行测序及序列比对,获得了一条分子量为1346.5的Cys-C特异性亲和配体序列:Gln-Val-Asn-Gly-Leu-Gly-Glu-Arg-Ser-Gln-Gln-Met。后通过固相多肽合成与荧光标记获得与Cys-C特异性结合的分子量为1848.7的荧光探针:FITC-Acp-Gln-Val-Asn-Gly-Leu-Gly-Glu-Arg-Ser-Gln-Gln-Met。
本发明在制备配体肽荧光探针的基础上,建立一种检测Cys-C的新方法。用标准样品包被荧光酶标板,加入一定浓度的目标荧光探针,该探针可与Cys-C特异性结合,随后用适宜的缓冲液洗去未结合的荧光探针,用荧光酶标仪检测其荧光强度,此时的荧光强度严格受到待测样品的Cys-C含量的控制。
本发明的构建方法:
1、特异性亲和配体的筛选(筛选包括非特异性洗脱和特异性洗脱)
(1)第一轮非特异性洗脱
a、将Cys-C用0.1mol/L、pH 8.6的NaHCO3溶液配制成100μg/ml的溶液。取1ml的该溶液于无菌的聚苯乙烯培养皿(60×15mm)中进行包被,反复小心旋转直至培养皿表面完全湿润。完成后将培养皿放入铺有湿纱布的塑料盒中4℃孵育过夜。
b、孵育过夜后倒掉培养皿中的包被液,并在经紫外照射过的滤纸上用力拍甩除去残留的包被液。除去残液后,向培养皿中加入2ml的封阻液,于4℃条件下封闭作用1hr以上。
c、封闭过后,按照b中所述的方法除去封阻液。然后用TBST(TBS+0.1%[v/v]Tween-20)缓冲液快速冲洗培养皿6次。每次都要小心旋转以使培养皿的底部及边缘均有被洗到,随后倒掉缓冲液,并在经紫外照射过的滤纸上拍干净残留在培养皿内的缓冲液。进行该操作时动作要快,以避免培养皿表面干燥。
d、用TBST缓冲液冲洗过后,往培养皿中加入1ml的TBST溶液,再加入2×1011的噬菌体(即10μg的原始文库),于室温条件下温和摇动1hr。
e、充分反应后,倒出未结合的噬菌体,并在经紫外照射过的滤纸上拍干净残留在培养皿内的液体。
F、按照c中所述的方法用TBST缓冲液冲洗培养皿10次,每次冲洗后拍甩残留的TBST缓冲液时都要换滤纸,以防止交叉污染。
g、冲洗完后向培养皿中加入1ml的非特异性缓冲液,即0.2mol/L的Glycine-HCl(pH2.2)(含有1mg/ml BSA),用来洗脱可与Cys-C特异性结合的噬菌体,于室温条件下温和摇动1hr,反应过后将培养皿中的洗脱液吸出,放入已灭菌的微量离心管中。然后向其中加入150μl的1mol/L的Tris-HCl(pH 9.1)溶液中和上述洗脱液。中和后的溶液即为第一轮非特异性洗脱物。
(2)第一轮洗脱物滴度测定
a、接大肠杆菌ER2738(噬菌体宿主)单菌落于10ml已灭菌的LB液体培养基中,于全温振荡培养箱中37℃、175rpm的条件下培养,培养至对数生长期(OD600=0.5)。
b、将第一轮洗脱物用已灭菌LB液体培养基在超净工作台内进行10倍系列梯度稀释。同时在37℃生化培养箱中温育LB/IPTG/Xgal平板,每个噬菌体稀释度要准备一个平板备用。
c、将顶层琼脂放置于微波炉中融化,然后在超净工作台内分成3ml等份置于灭菌试管中,每个噬菌体稀释度需要一份,分装完后放置在45℃干燥箱中保温备用。
d、当ER2738菌液培养到对数生长期时取出,分成200μl等份存于已灭菌的微量离心管中,每个噬菌体稀释度准备一管ER2738培养物。然后分别向每管ER2738培养物中加入10μl不同稀释度的噬菌体,快速颠倒混匀,于室温条件下温育1-5min。
e、将感染噬菌体的ER2738培养物分别加入到45℃条件下保温的顶层琼脂中,一次添加一管,快速颠倒混匀,注意不要摇出气泡,然后立即倾注于已在37℃生化培养箱中预温过的LB/IPTG/Xgal平板上,在琼脂凝固前适当倾斜或轻轻摇晃平板使顶层琼脂均匀铺开。待平板冷却5min后,倒置于37℃生化培养箱中培养过夜。
f、检查平板,挑选有~102个噬菌斑(即蓝斑)的平板并计算平板上的噬菌斑数。然后用此数目乘以稀释倍数即得到每10μl噬菌体的空斑形成单位(pfu)滴度。
g、确定滴度后,计算第一轮洗脱物中噬菌体的量和第一轮非特异性筛选的回收率。
(3)第一轮洗脱物扩增
a、接ER2738单菌落于已灭菌的LB-Tet液体培养基中,然后放置在全温振荡培养箱中37℃,175rpm条件下培养过夜。后将ER2738培养物以1:100的比例稀释于20ml的LB液体培养基中(用250ml三角瓶装),向锥形瓶中加入第一轮洗脱物。混匀后,于全温振荡培养箱中37℃剧烈摇动培养5hr。
b、将培养后的ER2738培养物转移至已灭菌的离心管中,于4℃、10000rpm的条件下离心10min,然后将上清液转入另一已灭菌的离心管中,同样条件重复离心一次,将上清液上部的80%溶液转入一新的已灭菌的离心管中,后加入1/6体积的PEG/NaCl溶液,4℃条件下沉淀过夜。
c、取沉淀过夜的溶液于4℃、10000rpm的条件下离心15min,弃去上清液,再短暂离心,然后用微量移液枪吸去残留的上清液。
d、向沉淀物中加入1ml的TBS溶液,使沉淀物重悬,然后将重悬液转移至已灭菌的微量离心管中,4℃条件下离心5min使溶液中残余的细胞沉淀下来。将上清液转移至新的已灭菌的微量离心管中,然后用1/6体积的PEG/NaCl溶液再沉淀,于冰上孵育1hr。
e、冰浴过后,于4℃、10000rpm的条件下离心10min,弃去上清,再短暂离心,用微量移液枪吸去残留的上清液。后将沉淀物重悬于200μl TBS(含0.02%NaN3)溶液中,离心1min,沉淀溶液中任何残余的不溶物。将上清转移至新的已灭菌的微量离心管中。此即为扩增后的洗脱物,记为一扩洗脱物。
(4)一扩洗脱物的滴度测定
根据(2)中所述的方法对一扩洗脱物进行滴度测定,然后计算一扩洗脱物中噬菌体的量,并换算出相应于2×1011pfu的第二轮筛选中噬菌体的加入量。若滴度太低,可再进行扩增、滴度测定。
(5)第二轮非特异性洗脱
根据(1)中的步骤a~c包被一已灭菌的聚苯乙烯培养皿,用一扩洗脱物中相当于2×1011pfu的噬菌体的量重复步骤d~g。另外,在清洗步骤中使用的TBST缓冲溶液中的Tween-20的浓度要增至0.5%(v/v),将最后得到的洗脱液记为第二轮洗脱物。
(6)第二轮洗脱物的滴度测定
根据(2)中所述方法对第二轮洗脱物进行滴度测定,确定滴度后计算第二轮洗脱物中噬菌体的量和第二轮非特异性筛选的回收率。
(7)第二轮洗脱物的扩增
根据(3)中所述方法对第二轮洗脱物进行扩增,扩增后的洗脱物记为二扩洗脱物。
(8)二扩洗脱物滴度测定
根据(2)中所述方法对二扩洗脱物进行滴度测定,然后计算二扩洗脱物中噬菌体的量并换算出相应于2×1011pfu的第三轮筛选中噬菌体的加入量。若滴度太低,可再进行扩增、滴度测定。
(9)第三轮特异性洗脱
根据(1)中的步骤a~c包被一已灭菌的聚苯乙烯培养皿,用二扩洗脱物中相当于2×1011pfu的噬菌体的量重复步骤d~f,步骤g中的非特异性洗脱液用1ml 100μg/ml的Cys-C的溶液(用TBS溶液配制)替换,进行特异性洗脱,最后收集到的洗脱液不需要用Tris-HCl中和,即为第三轮洗脱物,清洗步骤中的TBST缓冲溶液中Tween-20的含量仍为0.5%(v/v)。
(10)第三轮洗脱物滴度测定
根据(2)中所述方法对第三轮洗脱物进行滴度测定,确定滴度后计算第三轮洗脱物中噬菌体的量和第三轮特异性筛选的回收率,同时将有~102个噬菌斑(即蓝斑)的滴度测定平板于4℃冰箱存放留用。
2、重组噬菌体DNA的提取及目标序列的确定
从4℃冰箱中保存的第三轮洗脱物滴度测定平板中随机挑选30个蓝斑进行扩增,然后对这些噬菌体进行ssDNA提取,实验步骤如下:
(1)取扩增后的噬菌体溶液各200μl至已灭菌的微量离心管中,分别加入等体积量的Tris饱和酚,随后将微量离心管温和振荡2min。振荡完后,于4℃、12000rpm条件下离心5min。
(2)离心后将上层水相转移至另一已灭菌的微量离心管中,同时加入100μl的Tris饱和酚和100μl的氯仿-异戊醇溶液(体积比为24:1),随后将微量离心管温和振荡2min。振荡完后,于4℃、12000rpm的条件下离心5min。
(3)离心后将上清液转移至另一已灭菌的微量离心管中,同时加入200μl的氯仿-异戊醇溶液(体积比为24:1),随后将微量离心管温和振荡2min。然后,在4℃、12000rpm的条件下离心5min。
(4)离心后将上清液转移至另一已灭菌的微量离心管中并记下体积,同时加入1/8体积的NaAc(pH 4.6)和500μl的冷乙醇(已于-20℃预冷),然后在-20℃的条件下沉淀1hr。
(5)取出微量离心管,在4℃、12000rpm的条件下离心5min,用微量移液枪吸去上清液。向沉淀中加入500μl的70%冷乙醇(已于-20℃预冷),在-20℃的条件下重沉淀1hr。
(6)取出微量离心管,在4℃、12000rpm的条件下离心20min,用微量移液枪迅速吸去上清液。将微量离心管放置在室温条件下等待乙醇挥发干净,然后向微量离心管中加入10μl的TE溶液使沉淀复溶,此即为噬菌体的ssDNA,琼脂糖凝胶电泳鉴定后送样测序。
(7)通过比对分析测得的所有序列,最终获得了一条分子量为1346.5的Cys-C特异性亲和配体序列,即为:Gln-Val-Asn-Gly-Leu-Gly-Glu-Arg-Ser-Gln-Gln-Met。
3、Cys-C荧光探针的制备
(1)反应器硅烷化过夜处理,然后用无水乙醇淋洗4~5次。
(2)将0.1mmol的Rink Amide树脂用DMF溶液浸泡30min使其溶胀。
(3)加入两倍体积的DEP进行脱保护,时间为20min,然后用DMF淋洗6次。
(4)从C端到N端进行合成。取一定量的待合成序列中的第一个氨基酸衍生物、BOP和HOBT同时加入到Rink Amide树脂中,然后加入一定量的NMM和DMF反应2hr。
(5)反应2hr后用DMF淋洗6次,再进行脱保护,DMF淋洗6次,添加氨基酸衍生物等,即重复步骤(4)和(5),其中(5)中的氨基酸按待合成序列中的氨基酸顺序依次添加,如此循环直至待合成序列中的所有氨基酸按顺序添加完毕。
(6)FITC标记:如先前氨基酸的添加方式进行合成,在多肽的N端连上6-氨基己酸(Acp)作为手臂。即Acp的羧基与肽链N端的谷氨酰胺形成一个肽键,然后在手臂的N端进行FITC荧光素的标记。
(7)完成后,用甲醇淋洗6次,然后真空干燥过夜。
(8)用裂解液进行切割,将合成品从树脂上裂解下来,然后真空干燥获得FITC标记的Cys-C荧光探针粗品。
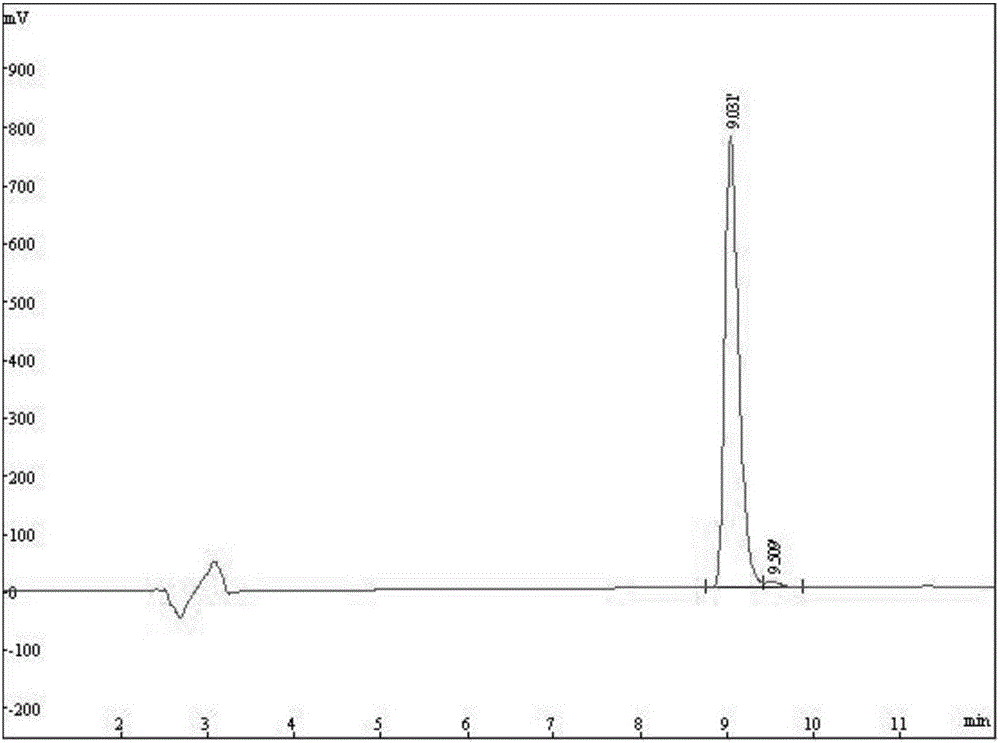
(9)荧光探针粗品经HPLC分离、纯化,HPLC条件为:
柱温:35℃;检测波长:220nm;流动相A:含有0.1%TFA的水溶液;流动相B:含有0.1%TFA的乙腈溶液;梯度洗脱:12min内27%乙腈~42%乙腈。
(10)收集目的馏分,收集完全后用旋转蒸发仪蒸去溶液中的乙腈,然后将浓缩后的溶液经冷冻干燥获得配体肽荧光探针纯品。
(11)荧光探针纯品通过质谱仪测定分子量为1848.7,与理论分子量相符。获得配体肽荧光探针序列为:FITC-Acp-Gln-Val-Asn-Gly-Leu-Gly-Glu-Arg-Ser-Gln-Gln-Met。
4、建立检测Cys-C的标准曲线
(1)用NaHCO3溶液将标准品Cys-C分别配制成0.039μg/ml、0.156μg/ml、0.625μg/ml、2.5μg/ml、10μg/ml、40μg/ml、160μg/ml的溶液,然后取上述浓度的Cys-C溶液各200μl包被于96孔板,每个浓度包被三个孔。同时用不添加Cys-C的NaHCO3溶液包被三个孔作为阴性对照。4℃包被12hr以上。
(2)除去多余包被液,向包被孔中加满封阻液,阴性对照孔也要进行封闭,在4℃条件下封闭2hr。
(3)除去封阻液,然后用TBST溶液洗板6次,每次倒完溶液后均要在干净的滤纸上拍净残留在包被孔中的溶液,此步骤动作要快避免包被孔干燥影响结果。
(4)向包被孔中各加入200μl荧光探针溶液(荧光探针用TBS溶液配制成80μg/ml的溶液),阴性对照孔也不例外,于室温条件下避光振荡10min。
(5)后除去各孔中未结合的荧光探针,用TBST溶液洗板6次,如步骤(3)中所述。
(6)向各孔中分别加入200μl的TBST溶液,然后利用多功能微孔检测仪在528nm条件下测定荧光吸收值,建立标准检测曲线。
本发明的检测对象是:Cys-C,样品检测浓度范围为0.039μg/ml~160μg/ml。
本发明的有益效果是:
1、为Cys-C的特异性识别、含量检测提供了一种全新的“工具”。
2、该荧光配体肽探针既可以定性地鉴别Cys-C,也可以定量地检测样品中Cys-C的含量。
附图说明
附表1:荧光配体肽探针检测Cys-C结果
附图1:Cys-C特异性亲和的荧光配体肽结构图。
附图2:Cys-C特异性亲和的荧光配体肽高效液相色谱图。
附图3:Cys-C特异性亲和的荧光配体肽质谱图。
附图4A:Cys-C浓度在0.039μg/ml~2.5μg/ml时测得的荧光值图。
附图4B:Cys-C的浓度在2.5μg/ml~160μg/ml时测得的荧光值图。
具体实施方式:
实施例1Cys-C检测方法的建立
1、特异性亲和配体的筛选(筛选包括非特异性洗脱和特异性洗脱)
(1)第一轮非特异性洗脱
a、将Cys-C用0.1mol/L、pH 8.6的NaHCO3溶液配制成100μg/ml的溶液。取1ml的该溶液于无菌的聚苯乙烯培养皿(60×15mm)中进行包被,反复小心旋转直至培养皿表面完全湿润。完成后将培养皿放入铺有湿纱布的塑料盒中4℃孵育过夜。
b、孵育过夜后倒掉培养皿中的包被液,并在经紫外照射过的滤纸上用力拍甩除去残留的包被液。除去残液后,向培养皿中加入2ml的封阻液,于4℃条件下封闭作用1hr以上。
c、封闭过后,按照b中所述的方法除去封阻液。然后用TBST(TBS+0.1%[v/v]Tween-20)缓冲液快速冲洗培养皿6次。每次都要小心旋转以使培养皿的底部及边缘均有被洗到,随后倒掉缓冲液,并在经紫外照射过的滤纸上拍干净残留在培养皿内的缓冲液。进行该操作时动作要快,以避免培养皿表面干燥。
d、用TBST缓冲液冲洗过后,往培养皿中加入1ml的TBST溶液,再加入2×1011的噬菌体(即10μg的原始文库),于室温条件下温和摇动1hr。
e、充分反应后,倒出未结合的噬菌体,并在经紫外照射过的滤纸上拍干净残留在培养皿内的液体。
F、按照c中所述的方法用TBST缓冲液冲洗培养皿10次,每次冲洗后拍甩残留的TBST缓冲液时都要换滤纸,以防止交叉污染。
g、冲洗完后向培养皿中加入1ml的非特异性缓冲液,即0.2mol/L的Glycine-HCl(pH2.2)(含有1mg/ml BSA),用来洗脱可与Cys-C特异性结合的噬菌体,于室温条件下温和摇动1hr,反应过后将培养皿中的洗脱液吸出,放入已灭菌的微量离心管中。然后向其中加入150μl的1mol/L的Tris-HCl(pH 9.1)溶液中和上述洗脱液。中和后的溶液即为第一轮非特异性洗脱物。
(2)第一轮洗脱物滴度测定
a、接大肠杆菌ER2738(噬菌体宿主)单菌落于10ml已灭菌的LB液体培养基中,于全温振荡培养箱中37℃、175rpm的条件下培养,培养至对数生长期(OD600=0.5)。
b、将第一轮洗脱物用已灭菌LB液体培养基在超净工作台内进行10倍系列梯度稀释。同时在37℃生化培养箱中温育LB/IPTG/Xgal平板,每个噬菌体稀释度要准备一个平板备用。
c、将顶层琼脂放置于微波炉中融化,然后在超净工作台内分成3ml等份置于灭菌试管中,每个噬菌体稀释度需要一份,分装完后放置在45℃干燥箱中保温备用。
d、当ER2738菌液培养到对数生长期时取出,分成200μl等份存于已灭菌的微量离心管中,每个噬菌体稀释度准备一管ER2738培养物。然后分别向每管ER2738培养物中加入10μl不同稀释度的噬菌体,快速颠倒混匀,于室温条件下温育1-5min。
e、将感染噬菌体的ER2738培养物分别加入到45℃条件下保温的顶层琼脂中,一次添加一管,快速颠倒混匀,注意不要摇出气泡,然后立即倾注于已在37℃生化培养箱中预温过的LB/IPTG/Xgal平板上,在琼脂凝固前适当倾斜或轻轻摇晃平板使顶层琼脂均匀铺开。待平板冷却5min后,倒置于37℃生化培养箱中培养过夜。
f、检查平板,挑选有~102个噬菌斑(即蓝斑)的平板并计算平板上的噬菌斑数。然后用此数目乘以稀释倍数即得到每10μl噬菌体的空斑形成单位(pfu)滴度。
g、确定滴度后,计算第一轮洗脱物中噬菌体的量和第一轮非特异性筛选的回收率。
(3)第一轮洗脱物扩增
a、接ER2738单菌落于已灭菌的LB-Tet液体培养基中,然后放置在全温振荡培养箱中37℃,175rpm条件下培养过夜。后将ER2738培养物以1:100的比例稀释于20ml的LB液体培养基中(用250ml三角瓶装),向锥形瓶中加入第一轮洗脱物。混匀后,于全温振荡培养箱中37℃剧烈摇动培养5hr。
b、将培养后的ER2738培养物转移至已灭菌的离心管中,于4℃、10000rpm的条件下离心10min,然后将上清液转入另一已灭菌的离心管中,同样条件重复离心一次,将上清液上部的80%溶液转入一新的已灭菌的离心管中,后加入1/6体积的PEG/NaCl溶液,4℃条件下沉淀过夜。
c、取沉淀过夜的溶液于4℃、10000rpm的条件下离心15min,弃去上清液,再短暂离心,然后用微量移液枪吸去残留的上清液。
d、向沉淀物中加入1ml的TBS溶液,使沉淀物重悬,然后将重悬液转移至已灭菌的微量离心管中,4℃条件下离心5min使溶液中残余的细胞沉淀下来。将上清液转移至新的已灭菌的微量离心管中,然后用1/6体积的PEG/NaCl溶液再沉淀,于冰上孵育1hr。
e、冰浴过后,于4℃、10000rpm的条件下离心10min,弃去上清,再短暂离心,用微量移液枪吸去残留的上清液。后将沉淀物重悬于200μl TBS(含0.02%NaN3)溶液中,离心1min,沉淀溶液中任何残余的不溶物。将上清转移至新的已灭菌的微量离心管中。此即为扩增后的洗脱物,记为一扩洗脱物。
(4)一扩洗脱物的滴度测定
根据(2)中所述的方法对一扩洗脱物进行滴度测定,然后计算一扩洗脱物中噬菌体的量,并换算出相应于2×1011pfu的第二轮筛选中噬菌体的加入量。若滴度太低,可再进行扩增、滴度测定。
(5)第二轮非特异性洗脱
根据(1)中的步骤a~c包被一已灭菌的聚苯乙烯培养皿,用一扩洗脱物中相当于2×1011pfu的噬菌体的量重复步骤d~g。另外,在清洗步骤中使用的TBST缓冲溶液中的Tween-20的浓度要增至0.5%(v/v),将最后得到的洗脱液记为第二轮洗脱物。
(6)第二轮洗脱物的滴度测定
根据(2)中所述方法对第二轮洗脱物进行滴度测定,确定滴度后计算第二轮洗脱物中噬菌体的量和第二轮非特异性筛选的回收率。
(7)第二轮洗脱物的扩增
根据(3)中所述方法对第二轮洗脱物进行扩增,扩增后的洗脱物记为二扩洗脱物。
(8)二扩洗脱物滴度测定
根据(2)中所述方法对二扩洗脱物进行滴度测定,然后计算二扩洗脱物中噬菌体的量并换算出相应于2×1011pfu的第三轮筛选中噬菌体的加入量。若滴度太低,可再进行扩增、滴度测定。
(9)第三轮特异性洗脱
根据(1)中的步骤a~c包被一已灭菌的聚苯乙烯培养皿,用二扩洗脱物中相当于2×1011pfu的噬菌体的量重复步骤d~f,步骤g中的非特异性洗脱液用1ml 100μg/ml的Cys-C的溶液(用TBS溶液配制)替换,进行特异性洗脱,最后收集到的洗脱液不需要用Tris-HCl中和,即为第三轮洗脱物,清洗步骤中的TBST缓冲溶液中Tween-20的含量仍为0.5%(v/v)。
(10)第三轮洗脱物滴度测定
根据(2)中所述方法对第三轮洗脱物进行滴度测定,确定滴度后计算第三轮洗脱物中噬菌体的量和第三轮特异性筛选的回收率,同时将有~102个噬菌斑(即蓝斑)的滴度测定平板于4℃冰箱存放留用。
2、重组噬菌体DNA的提取及目标序列的确定
从4℃冰箱中保存的第三轮洗脱物滴度测定平板中随机挑选30个蓝斑进行扩增,然后对这些噬菌体进行ssDNA提取,实验步骤如下:
(1)取扩增后的噬菌体溶液各200μl至已灭菌的微量离心管中,分别加入等体积量的Tris饱和酚,随后将微量离心管温和振荡2min。振荡完后,于4℃、12000rpm条件下离心5min。
(2)离心后将上层水相转移至另一已灭菌的微量离心管中,同时加入100μl的Tris饱和酚和100μl的氯仿-异戊醇溶液(体积比为24:1),随后将微量离心管温和振荡2min。振荡完后,于4℃、12000rpm的条件下离心5min。
(3)离心后将上清液转移至另一已灭菌的微量离心管中,同时加入200μl的氯仿-异戊醇溶液(体积比为24:1),随后将微量离心管温和振荡2min。然后,在4℃、12000rpm的条件下离心5min。
(4)离心后将上清液转移至另一已灭菌的微量离心管中并记下体积,同时加入1/8体积的NaAc(pH 4.6)和500μl的冷乙醇(已于-20℃预冷),然后在-20℃的条件下沉淀1hr。
(5)取出微量离心管,在4℃、12000rpm的条件下离心5min,用微量移液枪吸去上清液。向沉淀中加入500μl的70%冷乙醇(已于-20℃预冷),在-20℃的条件下重沉淀1hr。
(6)取出微量离心管,在4℃、12000rpm的条件下离心20min,用微量移液枪迅速吸去上清液。将微量离心管放置在室温条件下等待乙醇挥发干净,然后向微量离心管中加入10μl的TE溶液使沉淀复溶,此即为噬菌体的ssDNA,琼脂糖凝胶电泳鉴定后送样测序。
(7)通过比对分析测得的所有序列,最终获得了一条分子量为1346.5的Cys-C特异性亲和配体序列,即为:Gln-Val-Asn-Gly-Leu-Gly-Glu-Arg-Ser-Gln-Gln-Met。
3、Cys-C荧光探针的制备
(1)反应器硅烷化过夜处理,然后用无水乙醇淋洗4~5次。
(2)将0.1mmol的Rink Amide树脂用DMF溶液浸泡30min使其溶胀。
(3)加入两倍体积的DEP进行脱保护,时间为20min,然后用DMF淋洗6次。
(4)从C端到N端进行合成。取一定量的待合成序列中的第一个氨基酸衍生物、BOP和HOBT同时加入到Rink Amide树脂中,然后加入一定量的NMM和DMF反应2hr。
(5)反应2hr后用DMF淋洗6次,再进行脱保护,DMF淋洗6次,添加氨基酸衍生物等,即重复步骤(4)和(5),其中(5)中的氨基酸按待合成序列中的氨基酸顺序依次添加,如此循环直至待合成序列中的所有氨基酸按顺序添加完毕。
(6)FITC标记:如先前氨基酸的添加方式进行合成,在多肽的N端连上6-氨基己酸(Acp)作为手臂。即Acp的羧基与肽链N端的谷氨酰胺形成一个肽键,然后在手臂的N端进行FITC荧光素的标记。
(7)完成后,用甲醇淋洗6次,然后真空干燥过夜。
(8)用裂解液进行切割,将合成品从树脂上裂解下来,然后真空干燥获得FITC标记的Cys-C荧光探针粗品。
(9)荧光探针粗品经HPLC分离、纯化,HPLC条件为:
柱温:35℃;检测波长:220nm;流动相A:含有0.1%TFA的水溶液;流动相B:含有0.1%TFA的乙腈溶液;梯度洗脱:12min内27%乙腈~42%乙腈。
(10)收集目的馏分,收集完全后用旋转蒸发仪蒸去溶液中的乙腈,然后将浓缩后的溶液经冷冻干燥获得配体肽荧光探针纯品。
(11)荧光探针纯品通过质谱仪测定分子量为1848.7,与理论分子量相符,获得配体肽荧光探针序列为:FITC-Acp-Gln-Val-Asn-Gly-Leu-Gly-Glu-Arg-Ser-Gln-Gln-Met。
4、建立检测Cys-C的标准曲线
(1)用NaHCO3溶液将标准品Cys-C分别配制成0.039μg/ml、0.156μg/ml、0.625μg/ml、2.5μg/ml、10μg/ml、40μg/ml、160μg/ml的溶液,然后取上述浓度的Cys-C溶液各200μl包被于96孔板,每个浓度包被三个孔。同时用不添加Cys-C的NaHCO3溶液包被三个孔作为阴性对照。4℃包被12hr以上。
(2)除去多余包被液,向包被孔中加满封阻液,阴性对照孔也要进行封闭,在4℃条件下封闭2hr。
(3)除去封阻液,然后用TBST溶液洗板6次,每次倒完溶液后均要在干净的滤纸上拍净残留在包被孔中的溶液,此步骤动作要快避免包被孔干燥影响结果。
(4)向包被孔中各加入200μl荧光探针溶液(荧光探针用TBS溶液配制成80μg/ml的溶液),阴性对照孔也不例外,于室温条件下避光振荡10min。
(5)后除去各孔中未结合的荧光探针,用TBST溶液洗板6次,如步骤(3)中所述。
(6)向各孔中分别加入200μl的TBST溶液,然后利用多功能微孔检测仪在528nm条件下测定荧光吸收值,建立标准检测曲线。
Cys-C标准品检测范围为0.039μg/ml~160μg/ml。当Cys-C浓度在0.039μg/ml~2.5μg/ml时,检测的荧光强度与Cys-C浓度符合线性方程:y=1915.8x+148.31,R2=0.99667。当Cys-C的浓度在2.5μg/ml~160μg/ml时,检测的荧光强度与Cys-C浓度符合曲线方程:y=27973ln(x)-17664,R2=0.99508。
- 还没有人留言评论。精彩留言会获得点赞!