凝血酶直接抑制剂多肽盐的制作方法
本发明涉及化学技术领域,提供了一种凝血酶直接抑制剂多肽盐及其合成、纯化方法。
背景技术:
凝血酶直接抑制剂的多肽部分已有相关的报道(美国专利号为US5433940A)。中国专利CN102558305A提供了所述多肽的水合盐,通式为C98H138N24O33·mX·nH2O;X为醋酸、盐酸或三氟醋酸,m的取值范围为1≤m≤4,n的取值范围为2≤n≤12,所述水合盐具有良好的水溶性,利于制备多肽药物临床使用。然而此品作为一种注射制剂,其等渗、稳定性和安全性等性质需要严格控制。本发明预解决该技术难题。
技术实现要素:
鉴于现有技术存在的技术难题,本发明的一个目的是为提供具有足够渗透性和安全性凝血酶直接抑制剂多肽盐。
本发明通过大量实验提供了一种凝血酶直接抑制剂多肽盐,其通式为C98H138-mN24O33·0.5myX;
所述C98H138N24O33是指以下氨基酸组成的多肽:D-Phe-Pro-Arg-Pro-Gly-Gly-Gly-Gly-Asn-Gly-Asp-Phe-Glu-Glu-Ile-Pro-Glu-Glu-Tyr-Leu-OH,
X为钠离子(Na+)、钾离子(K+)、铵离子(NH4+)或者镁离子(Mg2+)、钙离子(Ca2+),当X为钠离子、钾离子或铵离子时,y=2;X为镁离子或钙离子时,y=1,m的取值范围为1≤m≤5,m为自然数。
本发明中,多肽的COOH和X通过阴阳离子形式结合。除特殊制定,与多肽结合的X均以上述离子形式存在。
本发明中除了特殊限定,所述多肽盐中多肽的氨基酸组成详细构象及顺序如下:D-Phenylalanyl(1)-L-Prolyl(2)-L-Arginyl(3)-L-Prolyl(4)-Glycyl(5)-Glycyl(6)-Glycyl(7)-Glycyl(8)-L-Asparagyl(9)-Glycyl(10)-L-Aspartyl(11)-L-Phenylalanyl(12)-L-Glutamyl(13)-L-Glutamyl(14)-L-Isoleucyl(15)-L-Proly(16)L-L-Glutamyl(17)-L-Glutamyl(18)-L-Tyrosyl(19)-L-Leucine(20)。
所述多肽分子中增加为Na+、K+、NH4+、Mg2+或者Ca2+的X,形成多肽盐,特别是钠盐、钾盐和铵盐,在保证足够水溶性的同时,提高多肽及其制剂的稳定性,保证注射使用的效果,降低不良反应,提高安全性。
进一步地,X优选为Na+,相对于K+、NH4+、Mg2+或者Ca2+具有更好的稳定性,且易于制备。
所述m的优选取值范围为1≤m≤3,特别是1、2和3,进一步保证多肽盐的水溶性和稳定性,具有更优异的稳定性效果。
本发明的目的之一在于提供一种所述凝血酶直接抑制剂多肽盐含有一定水分的水合盐,通式C98H138-mN24O33·0.5myX·nH2O,其中,n优选取值范围为1≤n≤8,n的取值包括1、2、3、4、5、6、7和8等,以及各数值的中间任意值。
n<1在制备过程中存在一定难度,如采用高温干燥可能会造成多肽杂质的产生,影响药物稳定性,如采用低温减压干燥,将大大增加生产时间,增加成本。而n>8时,多肽盐的稳定性明显变差。
进一步优选n的优选取值范围为2≤n≤5,保证溶解性,易于产品作为注射制剂制备,同时,控制水分对多肽稳定性的影响。
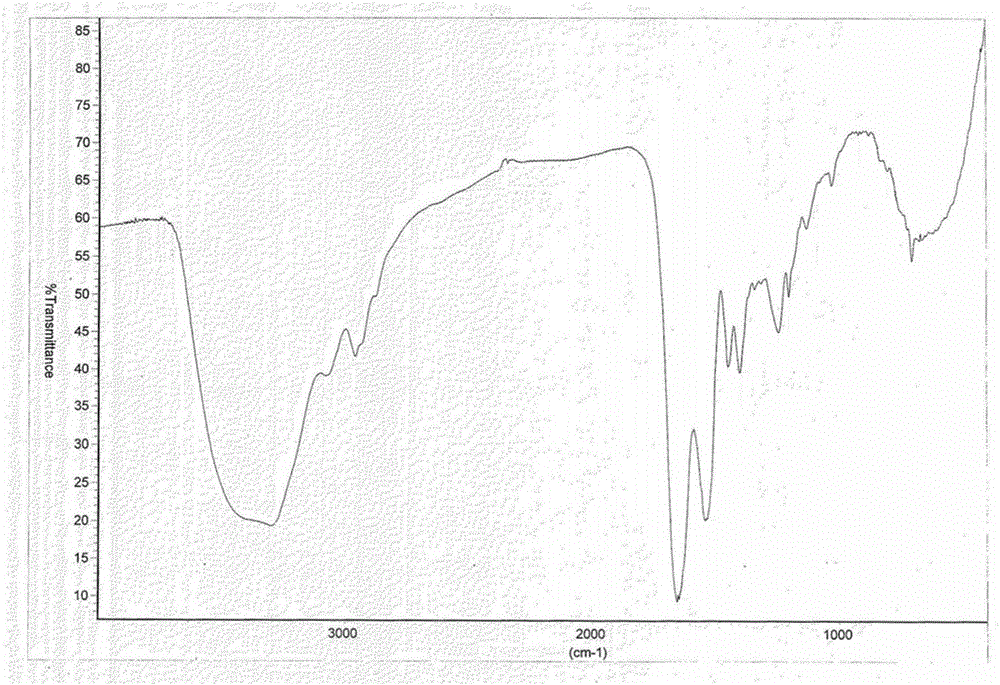
上述凝血酶直接抑制剂多肽盐分子式为C98H137N24O33·Na·nH2O时在红外衍射图中以波数cm-1表示,其红外光谱在703、1030、1134、1204、1246、1403、1451、1536、1658、2960(cm-1)处有特征吸收峰,误差±2,在3300cm-1左右有一宽峰(在红外光谱为宽峰时,可能误差较大,所以,所述“左右”可以理解为±10均为该物质可能的范围内),应注意:特定物质的不同样品具有同样的主要红外衍射吸收峰,但可能存在一定操作误差,当由本领域普通技术人员,采用相应方法得到的同晶型样品采用相同的仪器和检测方法进行检测时,吸收峰误差通常在±2cm-1以内(同样地,各吸收峰误差通常在±2cm-1以内的含义指的是大部分吸收峰,如超过80%以上的吸收峰误差在此范围内,而偶然有个别少数的吸收峰的误差超出该范围,均应认为属于相同晶型的红外吸收峰谱图)。
红外衍射检测条件:
测试仪器:美国尼高力公司生产的Avatar 330型红外分光光度计,测试方法:KBr压片法。
本发明的目的之一在于提供所述的凝血酶直接抑制剂多肽盐的制备方法,具体地,包括以下制备步骤:
采用固相合成方法制备得到C98H138N24O33·2TFA(TFA为三氟乙酸),将其溶解于水中,加入碱的水溶液至溶液的pH=3.6,析出沉淀,离心,冷水洗涤,沉淀再与以C98H138N24O33摩尔数为1计的m摩尔的碱的水溶液反应,反应后水溶液冻干,采用经质谱测定多肽的分子量,X的含量测定用离子色谱法,利用卡尔-费休滴定仪测定水分。
所述碱选自NaOH、Na2CO3、NaHCO3、KOH、K2CO3、KHCO3、氨水、Ca(OH)2、Mg(OH)2中的一种。
采用上述方法,不仅可以提高制备收率,同时,相对于其他酸碱调节制备方案,更有益于保证产品的纯度和稳定性,最大程度的降低新的杂质的产生。
其中,所述C98H138N24O33·2TFA的多肽盐可以通过CN102558305A公开的固相合成方法制备得到。
本发明的目的之一在于提供一种注射使用药物组合物,其特征在于,所述药物组合物中含有所述的凝血酶直接抑制剂多肽盐和一种以上药学上可接受的载体,采用注射用水为溶媒。优选载体为甘露醇,由于本发明性能优异的多肽盐,使得注射安全性效果更为优异。且采用甘露醇优于与其他注射用载体组合的使用效果。
再者,在对所述载体进行大量优选研究发现,当载体为甘露醇,所述凝血酶直接抑制剂多肽盐以C98H138N24O33计,与甘露醇的质量比优选为2:1。当质量比大于2:1,可能影响药物的澄明度效果。小于2:1,则不易控制药物和载体的浓度,增加控制凝血操作的复杂程度。且该方案优于相同比例与其他注射用载体组合的使用效果。
本发明的一种优选方案为所述药物组合物以水制成每1ml含有1mg的C98H138N24O33的溶液,药物组合物的酸碱度为4-6,不论是酸碱度<4或者>6都影响药物组合物的长期保存稳定性。
采用所述载体比例及药物酸碱度范围,所述药物组合物在近18个月以上的注射用制剂保存条件下,可控制杂质总量小于2%,其中特异性杂质Asp9杂质和D-Phe杂质的限量分别小于0.5%。大大的提高了产品的稳定性和安全性。
可以理解的是,在含有本发明多肽盐的任何原料或者制剂,只要通过酸碱、等电点测定或者其他测定方法确定所述多肽的COOH部分或全部以COO-形式存在,且采用离子色谱确定所述确定含有Na、K、Mg或者Ca,即可辨认含有本发明的多肽盐。而且,所述多肽盐的确认不以制备方法及制备前后顺序的不同而进行区分,比如采用多肽的酸盐,如三氟醋酸盐、盐酸盐等,在制剂或者其他终产品的使用中加入足够量的碱,而最终形成了本发明的多肽盐,也可认为也属于本发明保护的范围内。
本发明相对于现有技术的有益效果包括但不限于:
(1)、本发明的多肽盐相对于多肽的酸盐,如三氟醋酸盐、盐酸盐等,进一步提高稳定性,保证用药的有效性和安全性。
(2)、凝血酶直接抑制剂多肽水合盐,C98H138-mN24O33·0.5myX·nH2O,易溶于水,特别是X为钠,m=1、2或3,且2≤n≤5,保证良好的溶解性,易于产品作为注射制剂制备,同时,控制水分对多肽稳定性的影响;临床应用过程中,尽可能降低不良反应,是目前为止,该多肽盐产物最佳存在形式。
(3)、所述凝血酶直接抑制剂多肽盐以C98H138N24O33计,与甘露醇的质量比为2:1,以水制成每1ml含有1mg的C98H138N24O33的溶液时,药物组合物的酸碱度为4-6,是该多肽盐作为制剂研究以来最为稳定性好及利于临床应用的制剂形式。
附图说明
图1,凝血酶直接抑制剂多肽盐C98H137N24O33·Na·2H2O的红外光谱图
图2,凝血酶直接抑制剂多肽盐C98H137N24O33·Na·4H2O的红外光谱图
具体实施方式
下面结合实施例来进一步说明本发明,但并不作为对本发明的限定。
注:下述C98H138N24O33·2TFA的多肽盐可以通过CN102558305A公开的固相合成方法制备得到。本发明中采用经质谱测定多肽的分子量,确认多肽的组成,用HPLC测定多肽含量,X的含量测定用离子色谱法,确定X的组成,利用卡尔-费休滴定仪测定水分,确定多肽水合盐的水分含量。
实施例1凝血酶直接抑制剂多肽盐C98H137N24O33·Na的制备
采用固相合成方法制备得到C98H138N24O33·2TFA,将其溶解于水中,加入碱的水溶液至溶液的pH=3.6,析出沉淀,离心,冷水洗涤,沉淀再与C98H138N24O33等摩尔数的NaHCO3的水溶液反应,反应后水溶液冻干。
采用经质谱测定结果为(m/z):2179.9(M+1),用HPLC测定多肽含量,离子色谱法测定样品钠含量,确定Na为1个,水分含量约为2%—3%。
实施例2
在实施例1的基础上,在多肽与NaHCO3的水溶液反应的步骤中,分别加入以C98H138N24O33摩尔数为1计时,分别与2、3、4、5摩尔的NaHCO3的水溶液反应,反应后水溶液冻干。
实施例3
在实施例1和2的基础上,反应后水溶液冻干步骤,控制水分含量,得到C98H138-mN24O33·mNa·nH2O,其中,m=1、2、3、4或5;n=1、2、3、4、5、6、7或8。
具体的,如C98H137N24O33·Na·1H2O,C98H137N24O33·Na·2H2O,C98H137N24O33·Na·3H2O,C98H137N24O33·Na·4H2O,C98H137N24O33·Na·5H2O,C98H137N24O33·Na·6H2O,C98H137N24O33·Na·7H2O,C98H137N24O33·Na·8H2O;
C98H136N24O33·2Na·H2O,C98H136N24O33·2Na·3H2O,C98H136N24O33·2Na·6H2O;
C98H135N24O33·3Na·2H2O,C98H135N24O33·3Na·4H2O,C98H135N24O33·3Na·8H2O;
以及C98H134N24O33·4Na·7H2O,C98H134N24O33·4Na·8H2O等等。
采用以下红外衍射检测条件:测试仪器:美国尼高力公司生产的Avatar 330型红外分光光度计,测试方法:KBr压片法,测试凝血酶直接抑制剂多肽盐的红外光谱,测试结果误差±2cm-1。
具体的,所述凝血酶直接抑制剂多肽盐C98H137N24O33·Na·2H2O和C98H137N24O33·Na·4H2O的红外光谱分别如图1和图2所示。
从上述结果可以看出,凝血酶直接抑制剂多肽盐C98H137N24O33·Na.nH2O,其中n的变化对前述特征峰1-10的误差影响不大,可以理解特征峰1-10可以充分代表C98H137N24O33·Na.nH2O的凝血酶直接抑制剂多肽盐,n=1≤n≤8,优选2≤n≤5。
实施例4
在实施例1和2的基础上,分别将NaHCO3用KHCO3、氨水、Mg(OH)2、Ca(OH)2替换,得到对应的钾盐、铵盐、镁盐和钙盐。其中Mg(OH)2最好使用新鲜制备的,否则成盐反应时间较长。
实施例5
在实施例3的基础上,分别将NaHCO3用KHCO3、氨水、Mg(OH)2、Ca(OH)2替换,得到对应的钾盐、铵盐和钙盐的水合盐。其中Mg(OH)2最好使用新鲜制备的,否则成盐反应时间较长。
实施例6一种注射使用药物组合物
所述药物组合物含有实施例1—5任一种的多肽盐,所述凝血酶直接抑制剂多肽盐以C98H138N24O33计,与甘露醇的质量比为2:1,以水制成每1ml含有1mg的C98H138N24O33的溶液时,药物组合物的酸碱度为5±0.5。
实施例7稳定性实验对比
在前期研究中发现,多肽盐对高温较为敏感,高温60℃下易产生杂质。每个多肽盐取5个样品置于洁净、干燥的称量瓶中,开口放于无硅胶的密封干燥器中,分别置于60℃恒温箱中,于第10天取样,HPLC法测定总杂的变化情况,分析方法同CN102558305A,结果如下:
从上面结果可见,本发明的多肽Na、K、铵、Ca盐相对于多肽三氟醋酸盐在相同的高热的影响因素实验下具有更好的稳定性。同时,钠盐优于钾盐、铵盐和钙盐,钠盐的水合形式中(n=2-5)有更为明显优异的稳定性效果。
实施例8溶解性实验
根据《中国药典》2010版第二部附录XIXC《原料药于药物制剂的稳定性试验指导原则》的指导,以实施例得到多肽盐采用注射用水为溶媒在同等条件下进行水溶性实验,结果如下:
上述样品中,Na、K、NH4+盐的溶解度又明显大于Ca、Mg盐的溶解度。从上面结果可见,本发明的多肽Na盐及其水合盐,达到易溶的注射用水溶解效果,更利于注射剂的制备和使用。且对于钠盐,m=2和3,相对于m=1,有着优异的溶解性效果,更易溶于注射用水。
备注:
极易溶解:1g溶质在不到1ml溶剂中溶解;
易溶:1g溶质在1~10ml溶剂中溶解;
溶解:1g溶质在10~30ml溶剂中溶解;
略溶:1g溶质在30~100ml溶剂中溶解;
微溶:1g溶质在100~1000ml溶剂中溶解;
极微溶解:1g溶质在1000~10000ml溶剂中溶解;
几乎不溶或不溶指1g溶质在10000ml溶剂中不能完全溶解。
实施例9药物组合物稳定性实验对比
将药物组合物装入西林瓶中,压盖密封,放入温度为25℃的恒温箱中留样观察,定期取样,采用HPLC测定总杂含量的增加值。
从上述结果可见,采用本发明多肽盐,特别是钠盐,按照本发明优选的制剂处方方案制剂,是作为制剂研究以来最为稳定性好及利于临床应用的制剂形式。
以上内容是结合具体的优选实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换,都应当视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!