一种阳离子脂质类化合物及其制备方法与应用与流程
本发明属于基因载体制备与应用领域,具体涉及一种阳离子脂质类化合物及其制备方法以及在制备基因载体中的应用。
背景技术:
核酸转染是指将外源的核酸(包括质粒[plasmid DNA]、小干扰RNA[siRNA]、反义核酸[antisense nucleic acids]、微小RNA[microRNA]等)导入细胞内,使其在细胞内发挥生物学功能,从而达到调控基因表达的目的。
基因治疗(gene therapy)是指将目的基因(通常是质粒DNA)导入细胞内,使其表达具有活性的蛋白,从而治疗由基因突变或基因缺陷引起的病变。例如,脂蛋白酶酯酶缺乏症是基因突变引起的;携带野生型脂蛋白酶酯酶基因的腺病毒(AVV)类的基因药物Glybera能够将正常基因传送到肌肉细胞内并表达具有生物活性的LPL蛋白,从而降低血液内的脂肪浓度。
因为核酸带有强负电荷,而细胞表面也带负电荷,所以裸露的核酸很难穿过细胞膜进入细胞内。要想让核酸进入细胞内发挥作用,必须借助合适的载体。开发安全高效的输送载体是基因治疗(DNA输送)在临床应用的前提。基因载体可以分为病毒载体和非病毒载体两大类。病毒(viral vector)载体容易在体内容易引起机体的免疫原性,还存在着引起插入型基因突变和癌变等潜在隐患。所以,病毒在核酸传送领域的进一步应用研究极大地受到了限制,这使得以非病毒作为核酸传送载体的研究成为必然。非病毒(non-viral vector)载体传送法通常采用的材料包括脂质体,多肽,蛋白质,以及阳离子型高分子等。与病毒传递方法相比较,使用非病毒传送核酸可以避免免疫刺激 和癌变等副作用,然而目前非病毒核酸载体普遍存在细胞转染率低、细胞毒性大、价格昂贵等问题。因此,开发高效、低毒、廉价的非病毒基因载体具有重要意义。
技术实现要素:
针对本领域技术的不足之处,本发明的目的是提供一种细胞毒性低、细胞转染效率高、制备方法简单的基因载体。
本发明的另一目的是提供所述基因载体的制备方法与应用。
实现本发明上述目的的具体技术方案为:一种阳离子脂质类化合物,其化学结构如通式(I)所示:
式中R1为
R3选自以下基团:
R2选自H、赖氨酸、鸟氨酸、精氨酸或组氨酸的残基;如:
X、Y为NH、O或S;n为1或2,m为3或4。
优选地,本发明的阳离子脂质类化合物为:
优选地,本发明的阳离子脂质类化合物为:
本发明提供了上述化合物在制备基因载体中的应用。
具体地,是将本发明的化合物与DOPE或DOPC或卵磷脂按3~1:1~3的摩尔比例混合,溶解在氯仿中,用氮气流吹干后真空干燥过夜。加入pH7.2的PBS,用Avanti Mini-Extruder脂质体挤出器制备得到载体,在4℃冰箱内保存。
本发明提供了上述化合物在制备基因治疗药物中的应用。
含有上述化合物的基因载体属于本发明的保护范围。
本发明提供了含有上述化合物的基因载体在核酸转染中的应用。
本发明提供了上述化合物的制备方法,包括以下步骤:
(1)化合物I或II的合成:将饱和或不饱和烃基氨或醇、Boc-谷氨酸-OH或Boc-天冬氨酸-OH溶于有机溶剂中,在氮气保护下加入缩合剂,在0~35℃下搅拌12~24h后,蒸馏除去有机溶剂,加过量酸,在室温搅拌1~2h后蒸馏除去溶剂,用硅胶柱层析法分离纯化得到化合物I即谷氨酸的饱和或不饱和烃基取代酯或酰胺,或得到化合物II即天冬氨酸的饱和或不饱和烃基取代酯或酰胺;
(2)化合物III或IV的合成:
1)将Boc-鸟氨酸、Boc-鸟氨酸(Boc)-Osu或Boc-赖氨酸、Boc-赖氨酸(Boc)-OSu在碱性条件下有机溶剂中在0~35℃下搅拌24~36h,蒸馏除去有机溶剂后用硅胶柱层析法分离纯化得到中间体Boc-鸟氨酸(Boc)-鸟氨酸(Boc)-OH,或Boc-赖氨酸(Boc)-赖氨酸(Boc)-OH;所述的Boc是碳酸二叔丁酯;
其中m为3或4;
2)将1)得到的中间体、N-羟基琥珀酰亚胺、缩合剂在有机溶剂中搅拌12h,再加入Boc-鸟氨酸,或Boc-赖氨酸,在0~35℃下继续搅拌12~24h后蒸馏除去有机溶剂后用硅胶柱层析法分离纯化得到化合物III,即Boc-鸟氨酸(Boc)-鸟氨酸(Boc)-鸟氨酸(Boc)-COOH,或得到化合物IV,即Boc-赖氨酸(Boc)-赖氨酸(Boc)-赖氨酸(Boc)-COOH
其中m为3或4;
化合物I与化合物III、缩合剂、N,N-二异丙基乙胺溶于干燥的二氯甲烷中,四者的摩尔比为1:1:2:2或
化合物II与化合物III、缩合剂、N,N-二异丙基乙胺溶于干燥的二氯甲烷中,四者的摩尔比为1:1:2:2或
胆固醇与化合物III、缩合剂、N,N-二异丙基乙胺溶于干燥的二氯甲烷中,四者的摩尔比为2:1:2:2或
化合物I或化合物II与化合物IV、缩合剂、N,N-二异丙基乙胺溶于干燥的二氯甲烷中,四者的摩尔比为1:1:2:2或
胆固醇与化合物IV、缩合剂、N,N-二异丙基乙胺溶于干燥的二氯甲烷中,四者的摩尔比为2:1:2:2,溶剂量以其完全溶解为限,在氮气保护下冷却至0℃后在室温下搅拌24小时,之后将反应混合物溶解在二氯甲烷中,依次用5%柠檬酸溶液、水、饱和盐水洗涤,干燥后纯化目的物;
上述式中,R3选自以下任一个基团:
n为1或2;m为3或4。
上述方法中,所述的有机溶剂包括二氯甲烷、三氯甲烷、乙酸乙酯、四氢呋喃、二甲基亚砜、N,N-二甲基甲酰胺、1,4-二氧六环、甲醇、乙醇、乙醚、丙酮、苯、甲苯;
上述方法中,每个化学反应均使用碱性催化剂,所述碱性催化剂包括三乙胺、吡啶、4-二甲氨基吡啶,
每一步化学反应完成后,均对产物采用硅胶柱层析进行纯化,硅胶柱层析用的有机溶剂包括乙酸乙酯、正己烷、二氯甲烷、甲醇、乙醇、乙腈按照不同配比混合所得的溶剂体系。
所述的缩合剂为1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐、二 环己基碳二亚胺、二异丙基碳二亚胺、羰基二咪唑。
步骤(1)所述的过量酸包括盐酸、磷酸、甲磺酸和/或三氟乙酸。
本发明的有益效果在于:本发明所述含有阳离子脂质类化合物具有以下优点:(1)制备工艺简单、产率高;(2)本脂质类分子水溶性高、与质粒DNA结合力强、易形成脂质体;(3)特定比例的α-氨基和δ-氨基,如α-氨基:δ-氨基为2~4:1,使本脂质类化合物具有极高的生物相容性、与市面上现有的转染试剂(如,lipofectamine2000、lipofectamine3000、PEI等)相比较,本脂质类分子的细胞毒性明显低于前者;(4)基因(质粒DNA)转染效率高、由于毒性低,在转染过程中不需要换培养基,有效降低细胞培养及基因转染的成本。
利用本发明的化合物制备得到的基因载体粒径在100nm左右,大小均一,分散性良好;采用凝胶电泳阻滞实验检测脂质基因载体与siRNA的结合能力,结果显示,当N/P比例大于或等于2时,载体能够有效的阻滞质粒的电泳,包裹能力强;本发明的基因载体具有很低的细胞毒性,转染4小时后细胞存活率达到90%,明显高于商品化的脂质体lipofectamine 2000;本发明的基因载体与GFP表达质粒混合的复合物,其转染能力强,略高于lipofectamine 2000的转染能力。
附图说明
图1为由实施例3所得脂类分子化合物制得的基因载体形成的脂质体粒度分布。
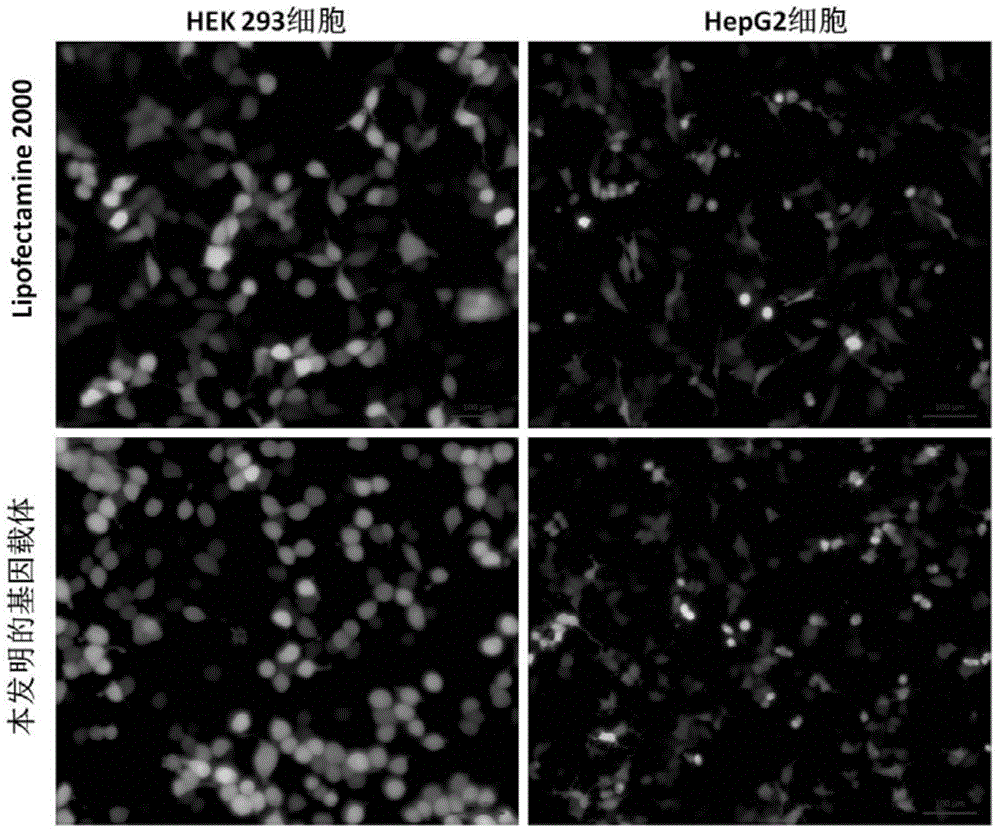
图2为使用实施例4所得脂类分子化合物制得的基因载体形成的脂质体,在HEK293细胞和HepG2细胞上转染pcDNA3-eGFP质粒,24小时后用荧光显微镜观察绿色荧光蛋白表达量。对照为lipofectamine2000试剂。
图3为实施例3中所得脂类分子化合物制得的基因载体的质谱分析结果。
图4为实施例3所得脂类分子化合物制得的基因载体与质粒DNA结合的凝胶电泳图;图中0、1、2、3、4分别代表脂质体上的氨基数 (N)与DNA分子上的磷酸基数(P)的摩尔比例。
图5为实施例4所得脂类分子化合物制得的基因载体的细胞毒性试验结果。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。
若未特别指明,实施例中所用的化学试剂均为常规市售试剂,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
除非另有说明,上下文中百分比为重量百分比,所有的温度以摄氏度给出。
实施例1原料的合成
化合物I(谷氨酸的饱和/不饱和脂肪烃酰胺)的合成:将饱和/不饱和烃基氨或醇、Boc-谷氨酸-OH溶于干燥的有机溶剂中,在氮气保护下加入缩合剂,在0~35℃下搅拌12~24h后,蒸馏除去有机溶剂,加过量酸的混合液,在室温搅拌1~2h后蒸馏除去溶剂,用硅胶柱层析法分离纯化得到中间体谷氨酸的饱和/不饱和烃基取代酯或酰胺,产率为70%。
化合物II(天冬氨酸的饱和/不饱和脂肪烃酰胺)的合成:将饱和/不饱和烃基氨或醇、Boc-天冬氨酸-OH溶于干燥的有机溶剂中,在氮气保护下加入缩合剂,在0~35℃下搅拌12~24h后,蒸馏除去有机溶剂,加过量酸的混合液,在室温搅拌1~2h后蒸馏除去溶剂,用硅胶柱层析法分离纯化得到中间体谷氨酸的饱和/不饱和烃基取代酯或酰胺,即化合物I,产率为75%。
实施例2原料的合成
化合物III(Boc保护的仿肽类分子)的合成:
第一步:将Boc-鸟氨酸、Boc-鸟氨酸(Boc)-OSu在碱性条件下 有机溶剂中在0~35℃下搅拌24~36h,蒸馏除去有机溶剂后用硅胶柱层析法分离纯化得到中间体Boc-鸟氨酸(Boc)-鸟氨酸(Boc)-COOH,所述的Boc是碳酸二叔丁酯。产率:60%。
第二步:将由第一步得到的中间体、N-羟基琥珀酰亚胺、缩合剂在有机溶剂中搅拌12h,再加入Boc-鸟氨酸,在0~35℃下继续搅拌12~24h后蒸馏除去有机溶剂后用硅胶柱层析法分离纯化得到化合物II,Boc-鸟氨酸(Boc)-鸟氨酸(Boc)-鸟氨酸(Boc)-COOH。所述的Boc是碳酸二叔丁酯。产率:65%。
化合物IV(Boc保护的仿肽类分子)的合成:
第一步:将Boc-赖氨酸、Boc-赖氨酸(Boc)-OSu在碱性条件下有机溶剂中在0~35℃下搅拌24~36h,蒸馏除去有机溶剂后用硅胶柱层析法分离纯化得到中间体Boc-赖氨酸(Boc)-赖氨酸(Boc)-COOH,所述的Boc是碳酸二叔丁酯。产率:60%。
第二步:将由第一步得到的中间体、N-羟基琥珀酰亚胺、缩合剂在有机溶剂中搅拌12h,再加入Boc-赖氨酸,在0~35℃下继续搅拌12~24h后蒸馏除去有机溶剂后用硅胶柱层析法分离纯化得到化合物IV,Boc-赖氨酸(Boc)-赖氨酸(Boc)-赖氨酸(Boc)-COOH。所述的Boc是碳酸二叔丁酯。产率:68%。
本发明中所述的一种脂质阳离子有机功能分子的合成步骤中所述的有机溶剂包括二氯甲烷、三氯甲烷、乙酸乙酯、四氢呋喃、二甲基亚砜、N,N-二甲基甲酰胺、1,4-二氧六环、甲醇、乙醇、乙醚、丙酮、苯、甲苯;每个反应均使用碱性催化剂,碱性催化剂包括三乙胺、吡啶、4-二甲氨基吡啶,所述柱层析用的有机溶剂包括乙酸乙酯、正己烷、二氯甲烷、甲醇、乙醇、乙醚、乙腈按照不同配比混合所得的溶剂体系。
本发明中所述的一种脂质阳离子有机功能分子的合成步骤中所 述的缩合剂为1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDCI)、二环己基碳二亚胺(DCC)、二异丙基碳二亚胺(DIC)、羰基二咪唑(CDI)。
本发明中所述的一种脂质阳离子有机功能分子的合成步骤中,所述的过量酸包括盐酸、磷酸、甲磺酸、三氟乙酸。
本发明中所述的一种脂质阳离子有机功能分子的合成步骤中所述的反应温度优选但不限0~35℃,特别优选25~35℃。
实施例3本发明化合物的制备(1)
原料包括化合物I(谷氨酸脂肪烷烃酰胺分子)、化合物III(氨基Boc保护的短肽类分子)、缩合剂(1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐EDCI)、碱(N,N-二异丙基乙胺DIPEA)溶于干燥的二氯甲烷中,化合物I:化合物III:缩合剂:碱(摩尔比)=1:1:2:2,溶剂量以化合物I、化合物III、缩合剂、碱完全溶解为限。
在氮气保护下用冰浴冷却至0℃后在25℃搅拌24小时。反应结束后,将反应混合物溶解在二氯甲烷中,依次用5%柠檬酸溶液、水、饱和盐水洗涤3次,用无水硫酸钠干燥后用硅胶柱层析方法(洗脱液:二氯甲烷/甲醇=15/1,v/v)纯化目的物,得到目的物2.13g产物,产率82%。
产物表征参数为:1HNMR(DMSO-d6,ppm):0.838-0.865(t,6H,-CH3),1.235-1.562(m,48H,-CH2-,-CONHCH2CH2-),1.576-1.707(m,16H,-NHCOCH2-,-NHCOCH2CH2,-NHCOCH(NH2)CH2-,-NHCOCH(NH2)CH2CH2-),1.938-2.098(t,8H,-CH2CH=CHCH2-),2.805(m,2H,NH2CH2-),2.993-3.006(m,2H,-CONHCH2-), 3.119-3.170(m,6H,-CH2(NH)CHCONHCH2-,NH2CONHCH2-),3.753(m,3H,-NHCOCH(NH2)-),4.271(m,1H,-NHCOCH(NH)CH2-),5.311-5.352(m,4H,-CH=CH-),7.809-8.612(m,14H,CONH-,-NH2).MS(ESI)m/z 988.76(M)+。(见图3)表征数据说明结构正确。
实施例4本发明化合物的制备(2)
原料包括化合物II(天冬氨酸脂肪烷烃酰胺分子)、化合物III(氨基Boc保护的短肽类分子)、缩合剂(1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐EDCI)、碱(N,N-二异丙基乙胺DIPEA)溶于干燥的二氯甲烷中,化合物II:化合物III:缩合剂:碱(摩尔比)=1:1:2:2,溶剂量以化合物II、化合物III、缩合剂、碱完全溶解为限。
在氮气保护下用冰浴冷却至0℃后在25℃搅拌24小时。反应结束后,将反应混合物溶解在二氯甲烷中,依次用5%柠檬酸溶液、水、饱和盐水洗涤3次,用无水硫酸钠干燥后用硅胶柱层析方法(洗脱液:二氯甲烷/甲醇=15/1,v/v)纯化目的物,产率85%。
产物表征参数为:1HNMR(DMSO-d6,ppm):0.838-0.865(t,6H,-CH3),1.235-1.562(m,48H,-CH2-,-CONHCH2CH2-),1.576-1.707(m,16H,-NHCOCH2-,-NHCOCH2CH2,-NHCOCH(NH2)CH2-,-NHCOCH(NH2)CH2CH2-),1.938-2.098(t,8H,-CH2CH=CHCH2-),2.805(m,2H,NH2CH2-),2.993-3.006(m,2H,-CONHCH2-),3.119-3.170(m,6H,-CH2(NH)CHCONHCH2-,NH2CONHCH2-),3.753(m,3H,-NHCOCH(NH2)-),4.271(m,1H,-NHCOCH(NH)CH2-),5.311-5.352(m,4H,-CH=CH-),7.809-8.612(m,14H,CONH-,-NH2).MS(ESI)m/z 974.7(M)+。(见图3)表征数据说明结构正确。
实施例5本发明化合物的制备(3)
原料包括化合物III(氨基Boc保护的短肽类分子)、胆固醇、缩合剂(1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐EDCI)、碱(N,N-二异丙基乙胺DIPEA)溶于干燥的二氯甲烷中,化合物III:胆固醇:缩合剂:碱(摩尔比)=1:2:2:2,溶剂量以化合物III、胆固醇、缩合剂、碱完全溶解为限。
将化合物III、胆固醇、缩合剂、碱按比例称取,在氮气保护下用冰浴冷却至0℃后在25℃搅拌24小时。反应结束后,将反应混合物溶解在二氯甲烷中,依次用5%柠檬酸溶液、水、饱和盐水洗涤3次,用无水硫酸钠干燥后用硅胶柱层析方法(洗脱液:二氯甲烷/甲醇=15/1,v/v)纯化目的物,产率79%。对目的物进行氢谱质谱验证,其表征参数说明该化合物结构正确。
实施例6含本发明化合物的脂质体转基因载体的制备与生物学活性验证
分别将由实施例3、实施例4、实施例5得到的脂质分子化合物与DOPE或DOPC按3~1:1~3的摩尔比例混合,溶解在氯仿中,减压蒸馏移去氯仿后真空干燥过夜;加入pH7.2的PBS混匀后,在室温放置1小时;用Avanti Mini-Extruder脂质体挤出器(含孔径100纳米的膜)反复挤出(20到50次),制备得到脂质体基因载体,在4℃冰箱内保存。对制备得到的新型脂质体转基因载体,对实施例3-5的化合物制得的基因载体其进行下述几个方面的检测:
(1)利用激光粒度仪检测载体的大小、粒径分布情况,图1显 示结果,实施例3的化合物制得的基因载体粒径在100 nm到150nm左右,大小均一,分散性良好。实施例4、5得到的化合物制得的基因载体的效果同此。
(2)采用凝胶电泳阻滞实验检测脂质基因载体与pcDNA3-eGFP质粒的结合能力,结果显示,当氨基:磷酸基团比例(即,N/P比例)大于或等于2时,载体能够有效的阻滞质粒的电泳,说明其结合和包裹DNA的能力强(见图4)。实施例4、5得到的化合物制得的基因载体的效果同此。
(3)细胞转染效率的测定:
HepG2细胞、HEK293细胞的培养:在含有10%的胎牛血清的培养液中,在37℃,5%CO2条件下培养24小时。
转染前一天,按每孔2.5×105细胞密度接种于12孔培养板,在5%CO2、温度为37℃的细胞培养箱中继续培养到细胞密度达到70%左右;更换含有10%小牛血清的新鲜培养液(1.0 ml/孔);将pcDNA3-eGFP质粒(1.0ug在100 ul Opti-MEM培养液中)和5-7微升的脂质体转染试剂(由实施例4所得)(在100ul Opti-MEM培养液中),按1:1体积比例混合两种溶液,在室温放置30分钟后,加入到细胞上面,继续培养48小时;
转染效率的测定:在荧光倒置显微镜下观察并取照相,如图2所示。结果显示采用本发明实施例4得到的化合物制得的基因载体与GFP表达质粒混合的复合物,其转染能力强,与商品化lipofectamine2000转染试剂相同或略高。实施例3、5的化合物制得的基因载体效果与此相同。
(4)细胞存活率检测:
转染前一天,按每孔1.0×104细胞密度接种于96孔培养板,在5%CO2、温度为37℃的细胞培养箱中继续培养到细胞密度达到70%左右;更换含有10%小牛血清的新鲜培养液(1.0 ml/孔);将 pcDNA-GFP质粒(1.0ug在100 ul Opti-MEM培养液中)和脂质转染试剂(实施例4得到的化合物制得的基因载体,5~7ul在100 ulOpti-MEM培养液中),混合两种溶液,在室温放置30分钟后,取1.0ul,加入到细胞上面,继续培养48小时后,采用MTT方法,测定细胞存活率,其计算公式为:
[细胞存活率(%)=(Asample/Acontrol)×100,其中,
Asample是被转染细胞孔的吸收,Acontrol是没有经过转染的细胞孔的吸收,每组实验重复6次,结果如图5所示。结果显示,HEK293细胞在转染4小时后细胞存活率达到95%,明显高于lipofectamine2000(细胞存活率为70%)和lipofectamine 3000(细胞存活率为85%),实施例3、5的化合物制得的基因载体效果与此相同,细胞转染4小时候细胞存活率达到95%,可见本发明的基因载体具有很低的细胞毒性。
以上的实施例仅仅是对本发明的优选实施方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通工程技术人员对本发明的技术方案作出的各种变型和改进,均应落入本发明的权利要求书确定的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!