用于华法林个体化用药相关基因SNP检测的试剂盒及其检测方法与流程
本发明涉及多重基因检测的试剂盒及其检测方法,尤其是用于华法林个体化用药相关基因SNP检测的试剂盒及其检测方法。
背景技术:
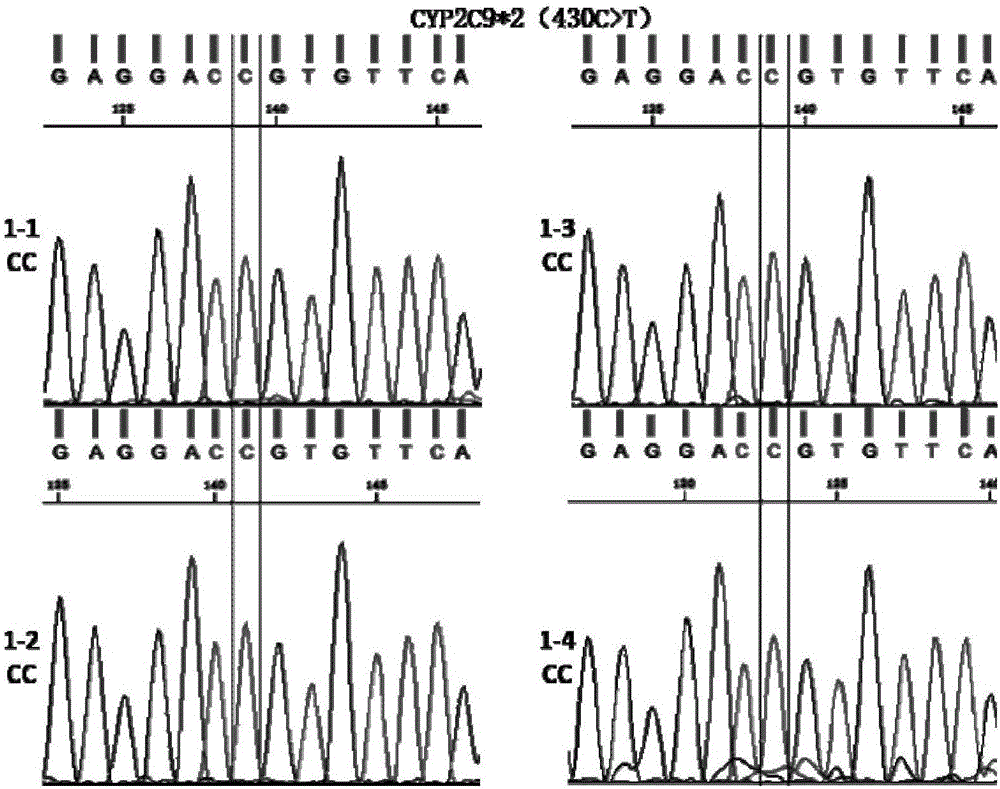
:华法林是目前临床上广泛使用的一种双香豆素衍生物类口服抗凝药,用于预防和治疗血栓栓塞性疾病。但是由于华法林的有效治疗范围较窄且不同个体之间给药剂量存在较大的差异,致使临床治疗时华法林的剂量很难掌握。据估计,服用华法林的患者中,每年有15.2%的人发生出血副作用,其中致命性的大出血占3.5%。不同个体间华法林稳定剂量的差异可达20倍以上。药物基因组学研究表明,华法林的靶酶VKORC1和代谢酶CYP2C9的基因遗传多态性是影响华法林用药剂量差异性的重要因素。而当前确定华法林需求剂量时无法考虑遗传因素的影响,常常造成患者严重的出血并发症。研究表明,华法林由CYP2C9代谢,而其突变体使华法林代谢速率大大降低,用药个体在使用初期就有较高的出血危险性。人CYP2C9基因具有遗传多态性,亚型分为*1、*2和*3,其中与亚洲人群最为密切的是CYP2C9基因的c.1075位核苷酸存在A/C多态性。多态性位点为C(CYP2C9*3型)时,酶活性比野生型降低了80%,而尽管CYP2C9*2(430C>T)型等位基因在中国人中所占比例较低,但是该位点一旦发生突变,也会显著影响酶的活性。维生素K氧化还原酶是抗凝药物华法林的作用靶点。维生素K环氧化物还原酶复合物1的编码基因VKORC1的遗传变异可通过影响VKORC1表达,从而影响华法林的敏感性。位于该基因启动子区(-1639G>A)的单核苷酸突变可影响VKORC1的表达,是导致华法林用药剂量个体差异的主要原因之一。目前常用的检测基因多态性的方法有DNA直接测序法、限制性片段长度多态性分析法(PCR-PFLP)、高分辨率溶解曲线(HRM)、基因芯片、液相芯片法、荧光定量PCR法等。测序技术是公认的检测基因突变的金标准,但其设备成本高、检测周期长、检测通量低、检测灵敏度低、对实验人员的技术操作要求高、结果判定步骤繁琐等原因,较难形成商业化的诊断产品;限制性片段长度多态性分析法检测灵敏度同样不高、操作步骤繁琐,检测的结果仍需要进行一代测序法的再次验证,尤其当样本量多时极易造成PCR产物的交叉污染且容易出现酶切不充分或酶切过度而出现假阴性或假阳性结果,因此也无法应用到临床上。芯片检测因其检测结果的准确性和重复性较差,实验周期长等缺点,也不适于开发临床检测试剂盒。荧光定量PCR的检测方法拥有成本低、灵敏度高、特异性强,结果的重复性好等优点,是检测SNP的非常好的一种检测手段,但是常规的Taqman探针法探针订购成本太高,多个位点同时检测时很难保证所有引物探针在同一扩增条件下均达到非常好的扩增效果。因此,急需要找到一种简便易行的基因分型方法。技术实现要素:本发明所要解决的技术问题是,提供一种快速、简便、经济、实用的用于华法林个体化用药相关基因SNP检测的试剂盒及其检测方法。为了解决上述技术问题,本发明采用的技术方案是:一种用于华法林个体化用药相关基因SNP检测的试剂盒,包括2XqPCR混合反应液和检测基因CYP2C9*2(430C>T)SNP位点的引物mix和检测基因CYP2C9*3(c.1075A>C)SNP位点的引物mix和检测基因VKORC1(-1639G/A)SNP位点的引物mix;所述的检测基因CYP2C9*2(430C>T)SNP位点的引物mix含有检测该SNP位点的两条特异性正向引物及一条反向引物;所述的检测基因CYP2C9*3(c.1075A>C)SNP位点的引物mix含有检测该SNP位点的两条特异性正向引物及一条反向引物;所述的检测基因VKORC1(-1639G/A)SNP位点引物mix含有检测该SNP位点的两条特异性正向引物和一条特异性反向引物。所述检测基因CYP2C9*2(430C>T)SNP位点的的两条特异性正向引物及一条反向引物序列如SEQIDNO.3、SEQIDNO.4、SEQIDNO.5所示;所述检测基因CYP2C9*3(c.1075A>C)SNP位点的的两条特异性正向引物及一条反向引物序列如SEQIDNO.6、SEQIDNO.7、SEQIDNO.8所示;所述检测基因VKORC1(-1639G/A)SNP位点的两条特异性正向引物和一条特异性反向引物序列如SEQIDNO.9、SEQIDNO.10、SEQIDNO.11所示。所述的2XqPCR混合反应液中含PCRBuffer、MgCl2、dNTPs、TaqDNA聚合酶、两条分别用FAM和HEX标记的通用荧光探针,所述FAM标记的通用荧光探针序列如SEQIDNO.1所示,所述HEX标记的通用荧光探针序列如SEQIDNO.2所示。上述的用于华法林个体化用药相关基因SNP检测的试剂盒的检测方法,包括以下步骤:提取待检测样本的基因组DNA,然后分成3个反应管(a、b、c)进行检测,首先在每个反应管中分别加入2XqPCR混合反应液,然后在反应管a加入检测基因CYP2C9*2(430C>T)SNP位点的引物mix;在反应管b加入检测基因CYP2C9*3(c.1075A>C)SNP位点的引物mix;在反应管c加入检测基因VKORC1(-1639G/A)SNP位点的引物mix,最后在3个反应管(a、b、c)中加入待检测样本的基因组DNA,进行核酸样本的荧光定量PCR扩增,在37℃进行荧光信号的扫描,使用LightCycler480Softwarerelease软件中的EndpiontGenotyping模块根据两种荧光信号的强度及比值对基因型进行自动判别。所述PCR扩增程序如下:预变性的条件为:温度为94℃,时间为15秒;PCR扩增由第一阶段和第二阶段构成;第一阶段由10次扩增循环构成,其条件为:变性:温度为94℃,时间为20秒;退火+延伸:起始温度为61℃,每一轮扩增循环温度递减0.5℃,直至扩增循环结束,时间为60秒;第二阶段由29轮循环构成,其条件为:变性:温度为94℃,时间为20秒;退火+延伸:温度为55℃,时间为60秒;信号扫描条件为:温度为37℃,时间为60秒。本发明的有益效果是:本发明的试剂盒能快速、简便、经济、实用的对基因分型,并且通过与一代测序技术检测结果比对,结果符合度高达99%以上,有望在临床快速基因分型中得到广泛应用。解决现有其他检测技术价格昂贵、效率低下及通量不高的问题。附图说明图1为采用本发明试剂盒中的检测基因CYP2C9*2(430C>T)位点的两条特异性正向引物和一条反向引物对四个样品的检测结果图。图2为图1中所示的1-1、1-2、1-3、1-4四个待测样本的一代测序(Sanger测序)图。图3为采用本发明试剂盒中的检测基因CYP2C9*3(c.1075A>C)位点的两条特异性正向引物和一条反向引物对四个样品的检测结果图。图4为图3中所示的2-1、2-2、2-3、2-4四个待测样本的一代测序(Sanger测序)图。图5为采用本发明试剂盒中的检测基因VKORC1(-1639G/A)位点的两条特异性正向引物和一条反向引物对四个样品的检测结果图。具体实施方式下面结合附图和具体实施方式对本发明作进一步详细说明:本发明用于华法林个体化用药相关基因SNP检测的试剂盒及其检测方法,所述试剂盒包括检测基因CYP2C9*2(430C>T)SNP位点的的两条特异性正向引物及一条反向引物,和检测基因CYP2C9*3(c.1075A>C)SNP位点的两条特异性正向引物及一条反向引物,和检测基因VKORC1(-1639G/A)SNP位点的两条特异性正向引物和一条特异性反向引物。所述检测基因CYP2C9*2(430C>T)SNP位点的的两条特异性正向引物及一条反向引物序列如下所示:C等位基因正向引物:GAAGGTGACCAAGTTCATGCTGGAAGAGGAGCATTGAGGACCSEQIDNO.3T等位基因正向引物:GAAGGTCGGAGTCAACGGATTGGGAAGAGGAGCATTGAGGACTSEQIDNO.4反向引物:AGGCAGCGGGCTTCCTCTTGAASEQIDNO.5所述检测基因CYP2C9*3(c.1075A>C)SNP位点的的两条特异性正向引物及一条反向引物序列如下所示:A等位基因正向引物:GAAGGTGACCAAGTTCATGCTGTGCACGAGGTCCAGAGATACASEQIDNO.6C等位基因正向引物:GAAGGTCGGAGTCAACGGATTGCACGAGGTCCAGAGATACCSEQIDNO.7反向引物:AGGCTGGTGGGGAGAAGGTCAASEQIDNO.8所述检测基因VKORC1(-1639G/A)SNP位点的的两条特异性正向引物及一条反向引物序列(反义链)如下所示:G等位基因正向引物:GAAGGTGACCAAGTTCATGCTGCGTGAGCCACCGCACCCSEQIDNO.9A等位基因正向引物:GAAGGTCGGAGTCAACGGATTGCGTGAGCCACCGCACCTSEQIDNO.10反向引物:GGAAGTCAAGCAAGAGAAGACCTGAASEQIDNO.11其中,所述正向引物均由两部分序列结合而成:野生型正向引物的5’端为通用序列GAAGGTGACCAAGTTCATGCT(SEQIDNO.1),3’端为识别相应位点的特异序列;突变型正向引物的5’端为通用序列GAAGGTCGGAGTCAACGGATT(SEQIDNO.2),3’端为识别相应位点的特异序列。本发明试剂盒的检测方法,扩增程序如下所示:预变性的条件为:温度为94℃,时间为15秒;PCR扩增由第一阶段和第二阶段构成;第一阶段由10次扩增循环构成,其条件为:变性:温度为94℃,时间为20秒;退火+延伸:起始温度为61℃,每一轮扩增循环温度递减0.5℃,直至扩增循环结束,时间为60秒;第二阶段由29轮循环构成,其条件为:变性:温度为94℃,时间为20秒;退火+延伸:温度为55℃,时间为60秒;信号扫描条件为:温度为37℃,时间为60秒。本发明的引物(primer)是PCR(聚合酶链式反应)技术中的重要组成部分,它是一小段单链DNA,作为DNA复制的起始点,在核酸合成反应时,作为每个多核苷酸链进行延伸的出发点而起作用的多核苷酸链,在引物的3’-OH上,核苷酸以二酯键形式进行合成,因此引物的3’-OH必须是游离的。野生型正向引物的5’通用序列与2XPCR混合反应液中用FAM荧光染料标记的通用序列一致;突变型正向引物的5’通用序列与2XPCR混合反应液中用HEX荧光染料标记的通用序列一致;携带荧光染料标记的通用序列用于为荧光定量PCR扩增完成后提供荧光信号。本发明的工作原理是:针对每个位点分别设计了两条特异性正向引物和一条反向引物。两条特异性正向引物3’端最后一个核苷酸分别与突变位点所检测的碱基互补配对,在PCR(聚合酶链式反应)扩增时联合反向引物对待测DNA模板进行特异性扩增。PCR前10个循环的扩增采用了TouchdownPCR,即降落PCR,是优化和改良后的一种PCR方法,指每一个(或n个)循环降低0.5℃(或n℃)退火温度,直到达到一个较低的退火温度(Touchdown退火温度),以此来保证不同Tm值的引物均可以与相应的待测DNA模板结合并进行特异性扩增。随后进行的29个循环的PCR扩增过程中,2XPCR混合反应液中的分别用FAM和HEX标记的两条通用探针会以前10轮PCR扩增时产生的PCR产物为模板,配合反向引物产生出携带有不同荧光染料标记的PCR产物。最后在37℃进行荧光信号的扫描,由软件根据两种荧光信号的强度及比值对基因型进行自动判别。本发明与现有技术相比具有以下的优点和效果:1、本发明采用特殊设计的引物,荧光信号由PCR混合液中的两种携带不同荧光染料标记的通用序列提供,无需单独设计特异性探针,极大的减少了研发周期及检测成本。2、本发明采用特殊的PCR程序,大大减少了由于Tm值太低而导致的引物与模板在错误位点的结合,从而提高了PCR效率和灵敏度,为临床华法林用药剂量调整提供可靠的依据。3、本发明采用的SNP位点基因分型软件,可以直观的自动判别每个待测位点的基因型,无需通过Ct值的繁琐计算,极大的降低了结果判读时的人为失误,并缩短了结果判读的时间,提高了检测效率。4、本发明的试剂盒,可以根据待测样本数量的多少,灵活的选用8连管、96孔板或者384孔板进行检测,一次的检测通量分别为1人份、28人份和124人份。5、本发明的试剂盒,可以实现高准确度、高效率的对CYP2C9*2、CYP2C9*3和VKORC1(-1639G/A)基因的SNP位点检测,从而达到对华法林用药剂量的量化控制,甚至对血栓性疾病的预防、抗凝药物的选择、新抗凝药的研发、血栓性的疾病预后也起到一定的作用。实施例1一种用于指导华法林个体化用药相关基因SNP检测的试剂盒包含:2XPCR混合反应液、引物mix。检测基因CYP2C9*2(430C>T)SNP位点的的两条特异性正向引物及一条反向引物序列如下所示:C等位基因正向引物:GAAGGTGACCAAGTTCATGCTGGAAGAGGAGCATTGAGGACC;T等位基因正向引物:GAAGGTCGGAGTCAACGGATTGGGAAGAGGAGCATTGAGGACT;反向引物:AGGCAGCGGGCTTCCTCTTGAA;检测基因CYP2C9*3(c.1075A>C)SNP位点的的两条特异性正向引物及一条反向引物序列如下所示:A等位基因正向引物:GAAGGTGACCAAGTTCATGCTGTGCACGAGGTCCAGAGATACA;C等位基因正向引物:GAAGGTCGGAGTCAACGGATTGCACGAGGTCCAGAGATACC;反向引物:AGGCTGGTGGGGAGAAGGTCAA;检测基因VKORC1(-1639G/A)SNP位点的的两条特异性正向引物及一条反向引物序列如下所示:G等位基因正向引物:GAAGGTGACCAAGTTCATGCTGCGTGAGCCACCGCACCC;A等位基因型正向引物:GAAGGTCGGAGTCAACGGATTGCGTGAGCCACCGCACCT;反向引物:GGAAGTCAAGCAAGAGAAGACCTGAA;所述正向引物均由两部分序列结合而成:野生型正向引物的5’端为通用序列GAAGGTGACCAAGTTCATGCT,3’端为识别相应位点的特异序列;突变型正向引物的5’端为通用序列GAAGGTCGGAGTCAACGGATT,3’端为识别相应位点的特异序列。实施例2一种用于指导华法林个体化用药相关基因SNP检测的试剂盒采用的PCR扩增方法包括以下步骤:第一步:待测样本基因组DNA提取(1)从患者抽取血液样本。(2)从血液中获取DNA,采用天根生化(北京)有限公司生产的TGuide血液基因组DNA提取试剂盒(OSR-M102)在其配套的TGuideM16核酸自动提取仪上进行提取。提取过程如下:a.往样品管中加入200μl/400μl的哺乳动物全血样本,并加入10μl/20μl蛋白酶K混匀。b.放置样品管于T型架的孔4位置。运行编号102程序(全血基因组DNA提取程序),选择相应的样本量体积和最终洗脱体积。第二步:对DNA进行扩增采用10ng/10ul反应体系,具体操作为:1、将上述一系列引物分别与血液基因组DNA、2XPCR混合反应液、去离子水按照一定比例混合构成单独的反应体系,具体见下表:试剂名称体积(ul)基因组DNA(10ng)2ul引物mix1ul2XPCR混合反应液5ul去离子水2ul2、对上述反应体系进行PCR循环,PCR循环条件见下表:第三步:观测结果表1为采用试剂盒中的检测基因CYP2C9*2位点的两条特异性正向引物和一条反向引物对四个样品的基因型结果。表1如图1所示,在CYP2C9*2(430C>T)位点的荧光定量PCR扩增体系中,检测C等位基因的特异性正向引物5’端序列与2*qPCR反应混合液中FAM荧光标记的引物序列一致,检测T等位基因特异性正向引物5’端序列与2*qPCR反应混合液中HEX荧光标记的引物序列一致。图1中X轴代表了FAM荧光的强度,Y轴代表了HEX荧光的强度,1-1、1-2、1-3、1-4四个样本检测结果均靠近X轴,说明仅有FAM荧光被检出,因此基因型均为CC纯合。如图2所示,1-1、1-2、1-3、1-4四个样本在CYP2C9*2(430C>T)位点处仅检测到C等位基因,说明四个样本在CYP2C9*2(430C>T)位点的基因型全部为CC纯合。一代测序结果与试剂盒检测结果一致。表2为采用试剂盒中的检测基因CYP2C9*3(c.1075A>C)位点的两条特异性正向引物和一条反向引物对四个样品的基因型结果。表2如图3所示,在CYP2C9*3(c.1075A>C)位点的荧光定量PCR扩增体系中,检测A等位基因的特异性正向引物5’端序列与2*qPCR反应混合液中FAM荧光标记的引物序列一致,检测C等位基因特异性正向引物5’端序列与2*qPCR反应混合液中HEX荧光标记的引物序列一致。附图3中X轴代表了FAM荧光的强度,Y轴代表了HEX荧光的强度,2-1和2-2两个样本检测结果靠近对角线的位置,说明FAM和HEX两种荧光均被检出,因此基因型为AC杂合;2-3和2-4两个样本检测结果靠近X轴,说明只有FAM荧光被检出,因此基因型为AA纯合。如图4所示,2-1和2-2两个样本在CYP2C9*3(c.1075A>C)位点处同时检测到A和C两种等位基因,所以2-1和2-2两个样本在CYP2C9*3(c.1075A>C)位点的基因型为AC杂合;2-3和2-4两个样本在CYP2C9*3(c.1075A>C)位点处只检测到A等位基因,所以2-3和2-4两个样本在CYP2C9*3(c.1075A>C)位点的基因型为AA纯合。一代测序结果与试剂盒检测结果一致。表3为采用试剂盒中的检测基因VKORC1(-1639G/A)位点的两条特异性正向引物和一条反向引物对四个样品的基因型结果。表3如图5所示,VKORC1(-1639G/A)位点检测结果解释:在VKORC1(-1639G/A)位点的荧光定量PCR扩增体系中,检测C等位基因的特异性正向引物5’端序列与2*qPCR反应混合液中FAM荧光标记的引物序列一致,检测T等位基因特异性正向引物5’端序列与2*qPCR反应混合液中HEX荧光标记的引物序列一致。附图5中X轴代表了FAM荧光的强度,Y轴代表了HEX荧光的强度,3-1和3-2两个样本的检测结果靠近Y轴,说明只有HEX荧光被检出,因此基因型为TT纯合;图中3-3和3-4两个样本的检测结果靠近对角线,说明FAM荧光和HEX荧光均被检出,因此基因型为CT杂合。测序结果显示3-1、3-2两例样本在VKORC1(-1639G/A)位点的等位基因只有T,即3-1、3-2两例样本在VKORC1(-1639G/A)位点的基因型全部为TT;3-3、3-4两例样本在VKORC1(-1639G/A)位点的等位基因为T和C两种,即3-3、3-4两例样本在VKORC1(-1639G/A)位点的基因型为CT。一代测序结果与试剂盒检测结果一致。综上所述,本发明的内容并不局限在上述的实施例中,相同领域内的有识之士可以在本发明的技术指导思想之内可以轻易提出其他的实施例,但这种实施例都包括在本发明的范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1